Candida auris es una levadura multirresistente emergente que causa infecciones invasivas graves y brotes con una alta mortalidad. El control de C. auris es un reto. Laboratorios, clínicos e instituciones sanitarias deben trabajar conjuntamente para mejorar la identificación y el tratamiento de la infección, así como el control de la transmisión. Esta revisión describe los aspectos generales de la biología, diagnóstico y tratamiento de C. auris, al igual que las recomendaciones publicadas recientemente por un grupo de expertos. También se presenta la experiencia de un brote de C. auris en el Consorcio Hospital General Universitario de Valencia desde septiembre de 2017 hasta agosto de 2019. Se detectaron un total de 203 pacientes infectados y/o colonizados por C. auris. Se diagnosticaron 30 infecciones invasivas (29 candidemias y 1 meningitis). El 32% de las candidemias del año 2018 fueron por C. auris. Todas las cepas fueron resistentes a fluconazol.
Candida auris is an emerging multidrug-resistant yeast that causes serious invasive infections and outbreaks with high mortality. Controlling C. auris is a challenge in which laboratories, clinicians and public health agencies are needed to identify and treat infections and prevent transmission. This review describes the general aspects of the biology, diagnosis and treatment of C. auris infection, as well as the main recommendations recently published by expert groups. We also present our experience of the C. auris outbreak at the Consorcio Hospital General Universitario de Valencia from September 2017 to August 2019. A total of 203 patients were colonised and/or infected by C. auris. Thirty invasive infections (29 blood cultures and one case of meningitis) were diagnosed. In all, 32% cases of candidemia were caused by C. auris in 2018. All strains were resistant to fluconazole.
Candida auris es una levadura emergente con un importante impacto sanitario y mediático a nivel mundial. Más del 90% de las cepas de C. auris son resistentes a fluconazol y, además, esta especie puede llegar a ser resistente a otras clases de antifúngicos. Se ha relacionado con infecciones invasivas (p. ej., candidemias), se asocia con una elevada mortalidad y se disemina con facilidad en el ambiente hospitalario. Se describió por primera vez en el año 2009 en Japón y desde entonces se ha detectado en más de 35 países en todos los continentes, excepto en la Antártida. C. auris se considera una amenaza para la salud mundial por varias razones:
- •
La resistencia a antifúngicos limita drásticamente las opciones terapéuticas.
- •
La dificultad que supone/ha supuesto la identificación en el laboratorio.
- •
La facilidad de transmisión entre pacientes en el entorno hospitalario, principalmente en unidades de alto riesgo y, por ende, la posibilidad de causar brotes. C. auris coloniza a los pacientes, especialmente la piel, y además persiste durante semanas en el ambiente. La falta de métodos de descolonización y la eficacia subóptima de algunos desinfectantes ambientales hospitalarios de uso común agravan el desafío de controlar su propagación.
El género Candida comprende una serie de levaduras fenotípicamente similares pero genéticamente alejadas. C. auris difiere notablemente de las especies de Candida patógenas comunes como Candida albicans y Candida glabrata1. En el ambiente hospitalario, C. auris se comporta más como Staphylococcus aureus resistente a meticilina y enterobacterias resistentes a carbapenémicos. A diferencia de otras infecciones por Candida, que habitualmente son el resultado de la autoinfección de la microbiota del hospedador, C. auris puede transmitirse entre pacientes y por ello requiere la implementación de medidas de control y de prevención. El control de C. auris requiere un mejor conocimiento del microorganismo, vigilancia activa, identificación rápida, tratamiento apropiado e implementación de medidas de control y programas educativos y, por supuesto, la participación e implicación de un equipo multidisciplinar.
2Descubrimiento y expansiónC. auris se aisló por primera vez en Japón en el año 2006 de una cepa procedente del conducto auditivo externo de un paciente hospitalizado en un hospital geriátrico de Tokio2. Sin embargo, no se identificó como C. auris hasta el año 2009 (número de acceso de GenBank NG055302). El estudio de secuenciación del dominio D1/D2 del ADN recombinante (ADNr) 26S y la región espaciadora transcrita interna (ITS) del ADNr reveló que el aislado estaba estrechamente relacionado con Candida haemulonii, Candida pseudohaemulonii, Candida ruelliae y Candida heveicola, pero se diferenciaba de estas especies por su capacidad de crecimiento a 42°C y los patrones de asimilación de carbono. Finalmente, se propuso una nueva especie, Candida auris (del latín, oreja).
En el año 2011, se publicaron 15 casos de C. auris en pacientes de Corea del Sur3. Las cepas se aislaron de muestras de oído recogidas en 2006 procedentes de 3 hospitales como parte de un estudio de vigilancia multicéntrico3,4. En un primer momento, estos aislamientos recibieron la denominación de una especie nueva estrechamente relacionada con C. haemulonii. Tras el descubrimiento de C. auris, se confirmó que estos 15 aislados pertenecían a la especie C. auris al realizar con posterioridad el estudio de secuenciación ITS y D1/D2. Todos los pacientes tenían otitis media crónica y 7 de ellos tenían cultivos positivos persistentes, incluidos 3 que habían recibido antifúngicos sistémicos4. Sobre la base de los resultados de la secuencia y la agrupación en 3 hospitales, se propuso que se había producido una transmisión clonal intra e interhospitalaria4. Poco después, se publicaron las primeras infecciones invasivas por C. auris: se identificaron retrospectivamente mediante secuenciación ITS y D1/D2 3 casos de candidemia en Corea del Sur, al revisar los aislamientos de Candida cuya especie no se había identificado5. La primera de ellas en el año 1996 y las 2 restantes en el año 2009. Este descubrimiento alertó que C. auris no solo afectaba a los oídos, sino que podía causar infecciones invasivas graves, incluso mortales.
Para determinar si C. auris realmente estaba emergiendo como causa de infecciones en humanos, se realizó una revisión de la base de datos SENTRY Antimicrobial Surveillance Program, en la que se incluyeron más de 15.000 cepas de Candida aisladas durante 2004-2015 procedentes de Asia, Europa, América Latina y América del Norte. Se identificaron como C. auris 4 aislamientos entre 2004 y 2009 que inicialmente se identificaron como C. haemulonii6. Estos datos sugieren que C. auris apareció como agente causal de infecciones en humanos principalmente durante la última década.
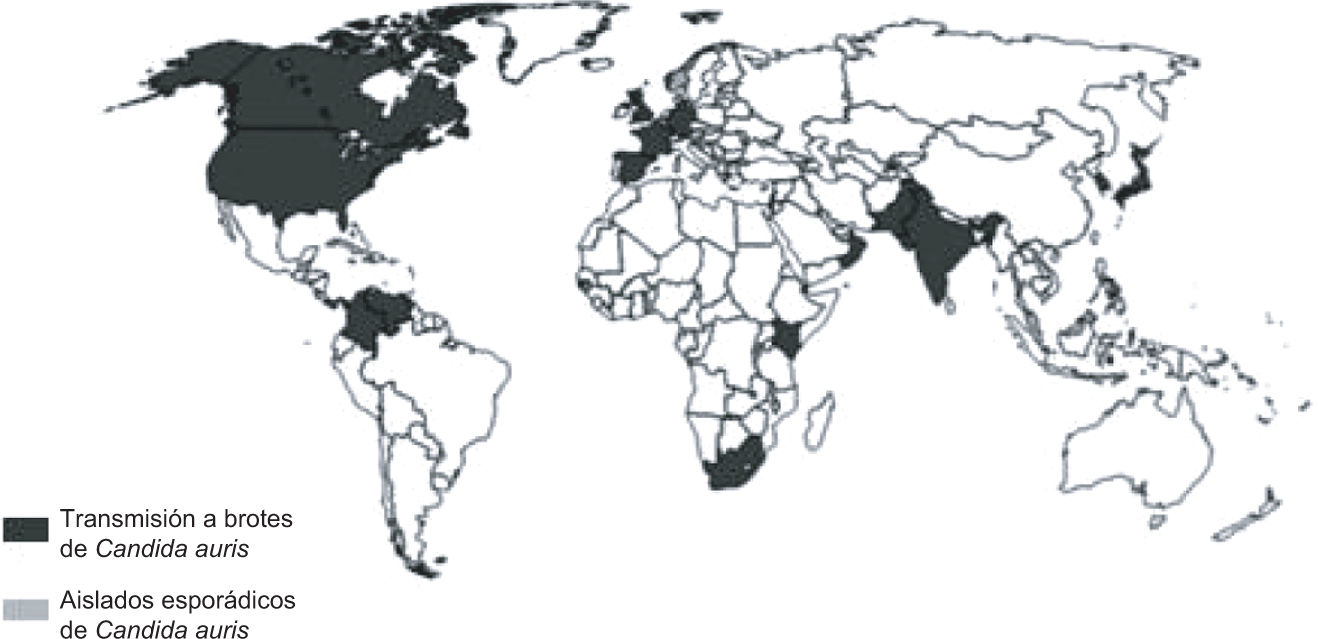
Desde su descripción en 2009, se ha detectado C. auris en 35 países (fig. 1). Debido a que la identificación de C. auris en algunos laboratorios no es fácil, por la falta de métodos adecuados disponibles, puede estar presente en otros países, pero no se ha detectado o aún no se ha declarado.
Países con casos informados de Candida auris (hasta marzo de 2018)1.
Se han descrito brotes (n>15 casos) por C. auris en España, Reino Unido, Colombia, India, Pakistán, Panamá, Rusia, Corea del Sur, Kenia, Sudáfrica, Israel, Estados Unidos y Venezuela7–11. Además de la producción de brotes, cabe destacar que se ha convertido en una de las principales especies de Candida implicadas en las candidemias, según indican algunas series recientes12,13.
Llama la atención la aparición simultánea de C. auris en regiones geográficas distantes. Según los estudios de la secuenciación del genoma completo (WGS) de los aislamientos de C. auris, las secuencias genéticas se agrupan en 4 poblaciones o clados geográficamente distintos: Asia meridional, Sudáfrica, Sudamérica y Asia oriental6. Recientemente, se ha descubierto una quinta población o clado.
Los clados difieren en decenas de miles de polimorfismos de un solo nucleótido (SNP), mientras que los aislamientos dentro de un mismo clado están altamente relacionados y difieren en solo unos pocos cientos de SNP6,14. El genoma completo de C. auris consta de aproximadamente 12,5 millones de pares de bases, por lo tanto, una diferencia de unos pocos cientos de SNP dentro de un mismo clado indica que los aislamientos son casi clonales6. Este hecho sugiere que C. auris apareció de forma independiente y casi simultánea en al menos 4 ubicaciones geográficas distintas y alejadas (fig. 1).
3Características biológicas y morfológicas de Candida aurisLas especies más cercanas a C. auris son C. ruelliae,C. pseudohaemulonii,Candida duobushaemulonii,Candida vulturna,C. heveicola, Candida konsanensis, Candida chanthaburiensis, C. haemulonii y Candida haemulonis var. vulnera15.
C. auris se caracteriza por ser una levadura ovalada que rara vez forma seudohifas16. Habitualmente se presenta como colonias rosadas, moradas, blancas en el medio cromogénico CHROMagar Candida17. Su capacidad para crecer a temperaturas de hasta 42°C18 y con altas concentraciones de sal son características que pueden ayudar a distinguir C. auris de otras especies de Candida19; sin embargo, se necesitan otros métodos de identificación para diferenciarla con precisión de otras especies (v. apartado Diagnóstico).
Se ha observado que algunas cepas de C. auris forman agregaciones en cultivo. Esto puede explicar que el organismo sea resistente a detergentes, a la luz ultravioleta y a otros métodos de limpieza. C. auris también forma biopelículas, lo que favorece su adherencia a las superficies. No obstante, estas biopelículas son significativamente más delgadas y menos complejas que las de C. albicans16,20. Según estudios realizados recientemente en modelos animales para conocer la virulencia de C. auris, se ha observado que exhibe una virulencia similar o ligeramente menor que C. albicans y Candida tropicalis y mayor que C. haemulonii18,21,22. Su capacidad para formar biopelículas, producir fosfolipasa y proteinasa, y secretar las proteasas aspárticas, así como la presencia de transportadores de oligopéptidos y manosil transferasas pueden explicar parte de su virulencia.
A pesar de los avances en el conocimiento de C. auris en los últimos años, aún no se conoce mucho acerca de sus características de biología celular y virulencia.
4Control de Candida auris en el ambiente hospitalarioCon frecuencia, C. auris se detecta varios días o semanas después del ingreso hospitalario; durante este tiempo se puede propagar rápidamente de paciente a paciente incluso antes de la aparición del “caso índice”7,23. C. auris puede permanecer viable durante varios meses en superficies y dispositivos, probablemente por la capacidad para formar biopelículas24,25. La descolonización de pacientes y la descontaminación ambiental presenta serias dificultades10,16,19,26–29.
Recientemente, los Centers for Disease Control and Prevention (CDC), Public Health England (PHE), así como el grupo de trabajo Infection Prevention and Control (IPC) de la International Society for Antimicrobial Chemotherapy (ISAC) han publicado recomendaciones para el diagnóstico, abordaje de pacientes, prevención y control30–32. Algunas de ellas se comentan a continuación.
4.1DiagnósticoIdentificar e informar correctamente C. auris es crucial para proporcionar una atención óptima al paciente, adecuar el tratamiento e iniciar las medidas adecuadas para la prevención y control de este microorganismo. El estudio de sensibilidad a antifúngicos se debe realizar en todos los aislamientos independientemente de cuál sea su origen, debido a los diferentes perfiles de resistencia que presenta la levadura.
Como se ha comentado anteriormente, C. auris forma colonias blancas, rosadas o moradas en CHROMagar Candida y puede ser difícil de distinguir de C. glabrata. A diferencia de la mayoría de las especies del género Candida, C. auris crece a temperaturas elevadas (40-42°C) y puede tolerar concentraciones de sal en el medio de cultivo de hasta del 10%. Esto se puede utilizar para preparar medios selectivos incluyendo SDA-A enriquecido con el 10% de sal durante el cribado19,33.
Hasta 2017, la mayoría de los sistemas de identificación comercial como VITEK (bioMérieux, Marcy l’Etoile, Francia), API-20C AUX (bioMérieux), Phoenix (BD-Diagnostics, Sparks, MD), MicroScan (Beckman Coulter, Pasadena, CA) y RapID Yeast Plus (diagnóstico innovador Systems, Norcross, Ga)34–37 han confundido a C. auris con C. haemulonii, Rhodotorula glutinis, Candida sake, Candida catenulate, Candida famata, Candida guilliermondii, Candida lusitaniae y Candida parapsilosis.
Una investigación de 102 aislamientos clínicos, previamente identificados como C. haemulonii o C. famata con el sistema VITEK, mostró que el 88,2% de los aislamientos fueron C. auris cuando se confirmaron mediante secuenciación ITS17. La identificación de C. auris en los laboratorios de microbiología ha sido un problema, porque los sistemas comerciales de identificación bioquímica carecían de C. auris en su base de datos. Actualmente, VITEK 2 (bioMérieux), así como MALDI Biotyper (Bruker-Daltonics, Bremen, Alemania) y VITEK MS (bioMérieux) con la versión de software 8.01, la incluyen en su base de datos, aunque es posible que no se puedan identificar todos los clados filogenéticos.
La secuenciación del dominio D1/D2 de la subunidad ribosómica grande (LSU) del gen 26S rRNA y las ITS del operón del gen rRNA nuclear, pueden diferenciar con exactitud C. auris de otras especies de Candida.
4.2Cribado del paciente al ingresoEl cribado de C. auris todavía no es una práctica rutinaria en la mayoría de los hospitales, porque se considera endémica de determinadas áreas, por los métodos de detección inadecuados o por la falta de percepción de la gravedad del problema.
En la actualidad, los pacientes ingresados en unidades de cuidados intensivos procedentes de áreas endémicas y los pacientes procedentes de centros donde se conoce que hay casos de C. auris, se deben considerar como grupo de riesgo y por tanto se debería realizar un cribado.
Las muestras más apropiadas para realizar el cribado de C. auris son muestras de axila e ingle (datos no publicados de Schelenz et al.). Sin embargo, el Hospital Universitario la Fe determina que son muestras del recto y la orina las más colonizadas por C. auris (datos no publicados de Pemán et al.). Otras muestras para el cribado, aunque menos sensibles son: nariz, boca, canales del oído externo, orina con catéter y heridas31. Si un paciente tiene heridas abiertas y/o catéteres intravasculares, estas muestras deben incluirse también en el estudio de cribado.
Si las instituciones sanitarias tienen un protocolo de vigilancia activa para microorganismos resistentes a múltiples fármacos, podría ser fácil y útil añadir el cribado de C. auris a las pruebas existentes.
4.3Prevención y control de infeccionesLas infecciones causadas por C. auris están aumentado8,10,38,39, así como las comorbilidades asociadas. Es importante que los centros donde no se ha detectado C. auris estén preparados para un primer caso siguiendo un protocolo de cribado e implementado las medidas de control y prevención adecuadas. Cualquier aislamiento de C. auris debe ser informado inmediatamente para realizar un aislamiento de contacto hasta el alta y se debe seguir hasta al menos 1 año después del primer cultivo negativo. Cuando los pacientes se trasladan dentro de la misma institución o a otra institución sanitaria, se debe de comunicar que el paciente está colonizado por C. auris.
Tras la detección de un caso se debe iniciar el estudio de los contactos, incluso en los pacientes a los que se les ha dado el alta. Si se detecta transmisión de C. auris, se debe seguir al paciente durante el tiempo del ingreso.
La higiene de manos es la clave para prevenir la transmisión de cualquier microorganismo, incluyendo C. auris. Al tratar con pacientes que están en aislamiento, la higiene de manos se debe realizar con alcohol (ABHR) cumpliendo con la norma europea EN 150040 para la higiene de manos en el punto de atención al paciente. A pesar que ABHR es la mejor opción, la higiene de manos con agua y jabón se debe de realizar cuando las manos estén visiblemente sucias.
Los pacientes colonizados o infectados con C. auris deben estar bajo aislamiento de contacto en una habitación individual, con presión negativa si se dispone y preferiblemente con una exclusa (para garantizar las medidas de aislamiento) y baño propio en la misma habitación o, en su defecto, usar un producto de lavado sin agua. El aislamiento de contacto se debe señalizar de forma visible en la entrada de la habitación. El material y los equipos biomédicos deben ser desechables o de uso individual para el paciente hasta el alta y posterior desinfección, prestando especial atención a los colchones y almohadas10.
El uso de bata de manga larga y guantes son medidas de contacto suficientes para tratar con pacientes colonizados/infectados por C. auris. No obstante, el uso de mascarilla quirúrgica se podría considerar para prevenir la colonización del personal sanitario que, de forma inconsciente, se pueda tocar la cara y así colonizarse con facilidad10.
La desinfección diaria y al alta del paciente es crucial para controlar la diseminación de C. auris. La limpieza y desinfección se deben realizar al menos 2 veces al día y la desinfección de las habitaciones después del alta del paciente debe realizarse con especial diligencia. Varios estudios han demostrado que el hipoclorito de sodio a concentraciones de 1.000ppm o superiores es efectivo para erradicar C. auris; estos productos se utilizan para la limpieza diaria8,10,26. Sin embargo, productos con hipoclorito de sodio a concentraciones de 5.000ppm se deberían utilizar para la limpieza tras el alta, aunque estos productos pueden ser altamente tóxicos para el personal. Otros productos que han demostrado ser eficaces son ácido peracético, peróxido de hidrógeno < 1% y vapor de peróxido de hidrógeno (VPH)25,41,42. El alcohol al 70% puede ser adecuado para la limpieza de superficies pequeñas. Algunos productos con amonios cuaternarios pueden ser eficaces, pero depende de su formulación específica24,42,43.
Nuevas tecnologías como la desinfección por luz ultravioleta (UV)-C y VPH se pueden utilizar para realizar la limpieza final tras el alta del paciente previa limpieza con otros productos eficaces frente a C. auris. Si se utiliza el método de UV-C, el ciclo que se debe de seleccionar para C. auris es el mismo que para Clostridium difficile.
Hasta la fecha, no existe ninguna recomendación específica acerca de la ropa del paciente.
Si el paciente necesita salir de la habitación para realizar alguna prueba específica, este debe de ser el último del día, con la posterior desinfección ambiental.
4.4Reingreso de pacientes con cultivos de Candida auris positivos anterioresLos pacientes con cultivos positivos de C. auris en ingresos previos deben ingresar con aislamiento de contacto y se realiza el cribado durante 3 días consecutivos. Si los 3 cribados son negativos se levanta el aislamiento de contacto. No obstante, se recomienda un cribado semanal.
4.5Abordaje de brotes- •
Los pacientes colonizados/infectados se deben aislar en habitaciones individuales y aplicar las medidas de aislamiento de contacto.
- •
Se debe clasificar a los pacientes en 3 cohortes “colonizado comprobado”, “posiblemente colonizado” y “sin riesgo”.
- •
Los contactos directos deben estar también en aislamiento de cohorte con aislamiento de contacto y sin entrada de ningún paciente nuevo.
- •
Cuando sea necesario y posible, el personal sanitario también debería clasificarse en las 3 cohortes anteriores y trabajar siempre en esa cohorte de pacientes en vez de en la unidad completa44.
- •
Si el brote es grande, la creación de una unidad separada donde se encuentren todos los pacientes afectados podría ser aconsejable.
- •
Es suficiente un contacto de 4h con un paciente o ambiente contaminado para adquirir C. auris10.
- •
Para confirmar que un paciente es negativo son necesarios 3 cultivos consecutivos de cribado negativos. Se recomienda realizar los estudios en los días 3-5-7.
- •
Se recomienda el cribado semanal de los pacientes negativos hasta el alta10.
- •
En situación de brote, se puede considerar el estudio del personal realizando un cribado de nariz, ingle y axila, así como un cultivo de manos y establecer un programa educacional33.
- •
La limpieza diaria se implementará y se llevará a cabo 3 veces al día.
- •
Utilizar si es posible UV-C o VPH después de la limpieza antes del alta y comprobar la eficacia de la desinfección mediante marcadores fluorescentes.
- •
Notificación de las infecciones y brotes por C. auris a las autoridades autonómicas y nacionales pertinentes.
En la actualidad, la evidencia sobre el uso de agentes tópicos para la descolonización de la piel es limitada.
6TratamientoC. auris es resistente al fluconazol (más del 90% de las cepas son resistentes), que se usa comúnmente en el tratamiento de las infecciones invasivas incluida la candidemia45. La elección del tratamiento para la infección por C. auris depende de la sensibilidad antifúngica. La resistencia a equinocandinas y anfotericina B varía según la región. Caspofungina, micafungina o anidulafungina son la primera elección de tratamiento empírico con anfotericina B liposomal (3 mg/kg) como alternativa. El 4% de los casos de candidemia por C. auris son resistentes a la gran mayoría de antifúngcos in vitro, aunque hay pocos datos sobre flucitosina. Voriconazol puede ser una alternativa oral si la cepa es sensible32.
7Experiencia en el Consorcio Hospital General Universitario de ValenciaEl Consorcio Hospital General Universitario de Valencia (CHGUV) es un hospital terciario de 503 camas. La unidad de críticos tiene 40 camas divididas en 2 unidades.
En septiembre de 2017 se detectó por primera vez C. auris en el CHGUV en el cultivo de orina de una paciente trasladada de otro hospital. Un mes después, el 14 de octubre de 2017, se diagnosticó el segundo caso de C. auris, siendo el primer caso de candidemia. Desde este momento, la vigilancia activa de C. auris en las unidades de críticos forma parte de la política de control de la infección del hospital. El cribado se realiza en el momento de admisión y una vez a la semana hasta el alta. Se recoge una muestra axilar-rectal y otra faríngea con medio Amies y se siembran en placas CROMagar Candida medium (Becton Dickinson). Se incuban a 37°C durante 48h, y se realiza una primera lectura a las 24h y una segunda a las 48h. Cualquier colonia de morfología compatible con C. auris (coloración blanca, rosa o morada) se identifica mediante MALDI-TOF (Bruker). El estudio de sensibilidad se realiza mediante Vitek®2 (bioMérieux) con las tarjetas AST-YS08 en el caso de muestras de colonización y mediante Sensititre YeastOne YO10 (Thermo Scientific) cuando se trata de muestras clínicas.
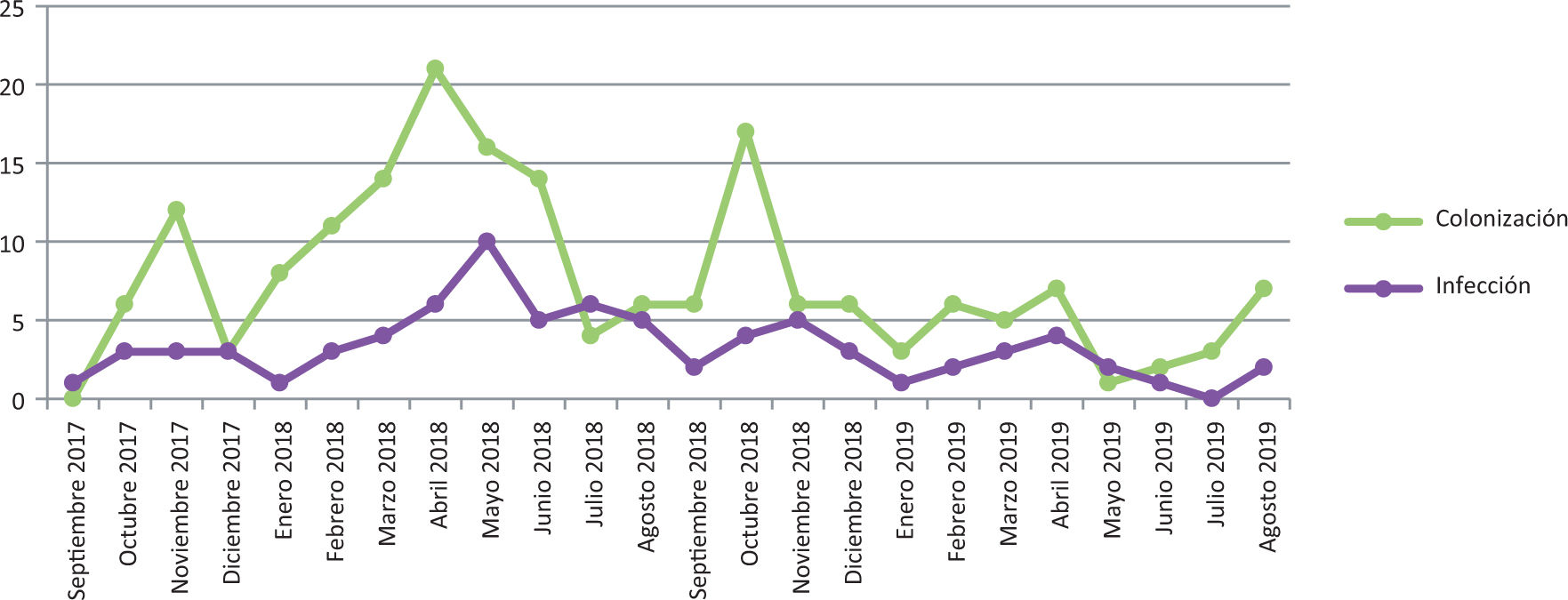
Se han detectado un total de 203 pacientes infectados y/o colonizados por C. auris durante un período de 2 años (septiembre de 2017-agosto de 2019) (fig. 2). El 70,4% de los pacientes fueron varones. La mediana de edad fue de 63 años (20-87 años).
El estudio de cribado se realizó a un total de 11.710 muestras de vigilancia activa (5.869 exudados faríngeos y 5.841 exudados axilares-rectales) procedentes de 3.261 pacientes. El 8,3% de las muestras estudiadas fueron positivas (976/11.710), con un 4,2% (245/5.869) y un 12,5% (731/5.841) de los exudados faríngeos y axilares-rectales, respectivamente.
El cultivo para el estudio de cribado de C. auris fue positivo en 184 pacientes, lo que supone el 5,6% (184/3.261) del total de pacientes analizados (fig. 2). Se diagnosticaron 30 infecciones invasivas: 29 candidemias y 1 meningitis. De ellas, 4 se detectaron antes de que los cultivos de vigilancia activa fueran positivos (en estos 4 casos se incluye el primer caso de candidemia). En nuestro hospital, también se observó una variación en la etiología de las candidemias: C. albicans ha pasado de ser el agente causal del 67% de las candidemias en el año 2014, a un 35% en el año 2018. Cabe destacar que C. auris es el segunda especie causal de las candidemias en el año 2018, con un 32%, solo 1 año después de detectar los primeros casos. En el estudio de sensibilidad antifúngica de los aislados de C. auris procedentes de hemocultivos, se observó que el 100% de las cepas fueron resistentes a fluconazol. El 3,5% de las cepas (1/29) fueron resistentes a anidulafungina y micafungina y el 6,9% (2/29) de las cepas fueron resistentes a caspofungina. No se observaron resistencias a anfotericina B.
Se siguen detectando casos esporádicos, tanto de colonización como de infección, incluso después de haber instaurado medidas de prevención y control de la infección. Esto, junto con la experiencia de otros hospitales con situaciones similares, da una idea del difícil abordaje que presenta C. auris. Este patógeno es otro más que se une a la lista de los microorganismos multirresistentes. Aunque se están empezando a realizar trabajos sobre C. auris, los datos todavía son escasos, con pocos estudios y pocas cepas, y se debería dedicarle suficientes medios y esfuerzos a este microorganismo emergente, ya que supone un grave problema de salud pública debido a su multirresistencia, la alta mortalidad, la facilidad de transmisión y la permanencia en los centros hospitalarios, así como por causar infecciones potencialmente graves.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.