Candida auris es una levadura emergente descrita por primera vez en el año 2009 en Japón1. Desde entonces su diseminación ha sido alarmante: se han reportado casos en más de 30 países de los 5 continentes2. Una de las características que la distinguen de otras levaduras es su multirresistencia, lo que limita las opciones terapéuticas. Destaca su elevada resistencia a fluconazol, en torno al 90%, y también se ha descrito resistencia a todos los antifúngicos en mayor o menor medida. Según estudios recientes, esta resistencia se sitúa en el 12% para anfotericina B y caspofungina, y en alrededor del 1% para micafungina y anidulafungina2. También existe la posibilidad de adquirir resistencia durante el tratamiento con antifúngicos2. Además, el hecho de ser una especie relativamente reciente complica su detección en el laboratorio, ya que puede no ser detectada por muchos sistemas comerciales3.
Presentamos un caso de candidemia recurrente por Candida albicans, Candida parapsilosis y Candida auris. Además, C. auris desarrolló resistencia a equinocandinas durante el tratamiento con anidulafungina: es el primer caso de C. auris resistente a equinocandinas descrito en España.
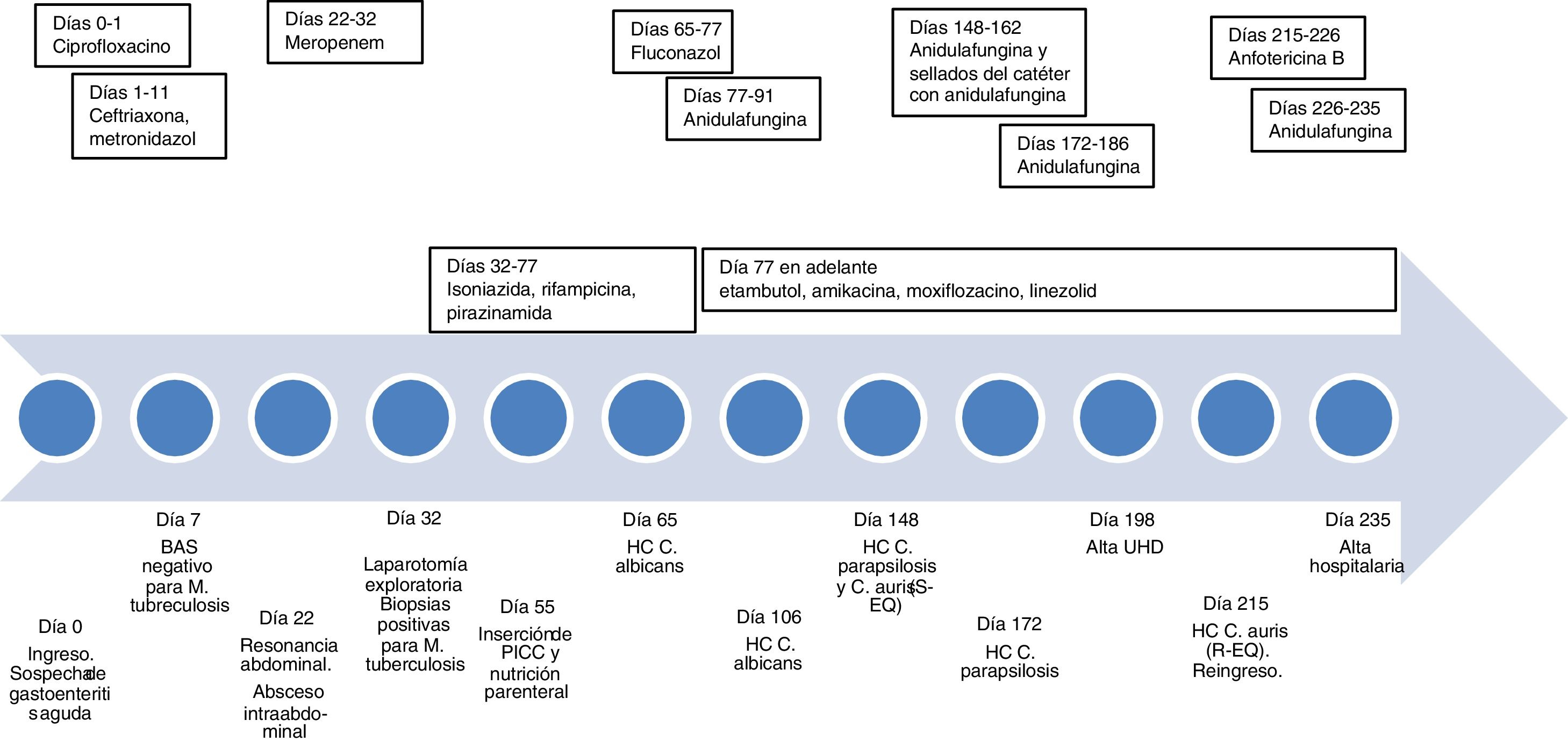
Se trataba de un varón de 21 años, natural de Bolivia, sin antecedentes de interés, que acudió a urgencias por dolor abdominal, diarrea y fiebre, con sospecha inicial de gastroenteritis aguda. Su madre tuvo una tuberculosis pulmonar tratada hacía 3 años. En las exploraciones destacaban infiltrados pulmonares que indicaban el diagnóstico de tuberculosis, por lo que ingresó en el Servicio de Enfermedades Infecciosas. La PCR de Mycobacterium tuberculosis (Xpert® MTB/RIF Ultra, Cepheid) en broncoaspirado y cepillado bronquial y la prueba IGRA (QFT-Plus, Qiagen) fueron negativas, por lo que se descartó tuberculosis pulmonar. El día 22 de ingreso, tras no mejorar la fiebre ni la clínica abdominal, se realizó una resonancia abdominal, que mostró un absceso intraabdominal. La clínica no mejoró a pesar del tratamiento antibiótico de amplio espectro, por lo que el día 32 se hizo una laparotomía exploratoria y se tomaron muestras, que fueron positivas para M. tuberculosis, por lo que se diagnosticó de tuberculosis miliar intestinal. El paciente requirió un ingreso prolongado debido a una fístula enterocutánea como complicación de la cirugía y a un déficit nutricional que requirió la colocación de un catéter venoso central con acceso periférico (PICC) para administrar nutrición parenteral (día 55).
El día 65 se aisló C. albicans en hemocultivos, por lo que se cambió el PICC y se administró fluconazol. El día 77 el paciente presentó una alteración del perfil hepático, por lo que se cambió el tratamiento antituberculoso (rifampicina e isoniazida) por uno de segunda línea (etambutol, amikacina, moxifloxacino y linezolid). También se cambió el fluconazol por anidulafungina, que terminó el día 91. El día 106 se produjo otro episodio de candidemia por C. albicans, que se trató de nuevo con anidulafungina durante 14 días y se cambió el PICC por un acceso venoso central de larga duración, por previsión de alta a la unidad de hospitalización domiciliaria. Sin embargo, el día 148 el paciente presentó fiebre y los hemocultivos volvieron a ser positivos. Tras realizar el subcultivo del hemocultivo positivo al medio cromogénico CHROMagar® Candida (Becton Dickinson), se observaron en este caso 2morfologías de colonias, ambas blancas/rosadas a las 48 h de incubación, que se identificaron como C. parapsilosis y C. auris mediante espectrometría de masas (Bruker). Se instauró tratamiento con anidulafungina durante 14 días y se hicieron sellados con el mismo antifúngico, pero el día 172 la colonización del catéter por C. parapsilosis persistía, por lo que se administró de nuevo anidulafungina durante 14 días y se cambió el reservorio. El día 198 fue dado de alta a la unidad de hospitalización domiciliaria.
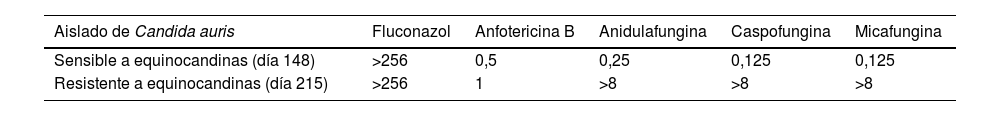
El día 215 volvió a ingresar por fiebre. Se aisló de nuevo C. auris en el hemocultivo a través del catéter. Dadas las complicaciones previas, se retiró el catéter y se suspendió la nutrición parenteral. Se inició anidulafungina, pero a los 2días se obtuvo el antifungigrama, donde se observó una resistencia de alto nivel a equinocandinas, por lo que se cambió el tratamiento antifúngico por anfotericina B. La sensibilidad de todos los aislamientos se determinó mediante microdilución con el sistema Sensititre® YeastOne® Y09 (ThermoFisher). Para la cepa resistente a equinocandinas, se determinó por duplicado y también se determinó por duplicado mediante el sistema Vitek 2® ASTYS07 (BioMérieux), que confirmó la resistencia. Los valores de concentraciones mínimas inhibitorias obtenidos se muestran en la tabla 1. El día 226, debido a un episodio de vómitos y nefrotoxicidad que se asoció a la anfotericina B, se volvió a administrar anidulafungina. El día 227, dada la pérdida de peso, se decidió reintroducir la nutrición parenteral, en este caso sin complicaciones, y el día 235 fue dado de alta. En la figura 1 (ver material adicional) se muestra la secuencia temporal del caso.
Sensibilidad a antifúngicos determinada mediante Sensititre® YeastOne® Y09 (valores de CMI en mg/L) de las cepas de C. auris aisladas
| Aislado de Candida auris | Fluconazol | Anfotericina B | Anidulafungina | Caspofungina | Micafungina |
|---|---|---|---|---|---|
| Sensible a equinocandinas (día 148) | >256 | 0,5 | 0,25 | 0,125 | 0,125 |
| Resistente a equinocandinas (día 215) | >256 | 1 | >8 | >8 | >8 |
El paciente presentaba varios factores de riesgo conocidos para el desarrollo de candidemia: cirugía abdominal, nutrición parenteral, presencia de catéteres y tratamiento antibiótico y antifúngico de amplio espectro durante un periodo prolongado de tiempo4. Además, el tratamiento prolongado con anidulafungina pudo favorecer, en primer lugar, la selección de especies resistentes como C. parapsilosis y C. auris y, en segundo lugar, el aislamiento de una cepa de C. auris resistente a equinocandinas, como se ha descrito en otros casos5,6. Aunque el mecanismo de resistencia en esta cepa está en estudio, la resistencia a equinocandinas suele deberse a mutaciones en la diana fks17. A pesar de que el paciente fue tratado con anidulafungina, la evolución fue favorable, lo que podría deberse a la retirada del catéter, medida que se recomienda siempre ante una candidemia8.
Dada la rápida transmisión de C. auris entre pacientes, para evitar un brote de C. auris es necesario instaurar medidas de control de infecciones, que incluyen: aislamiento de los pacientes infectados/colonizados, cultivos de vigilancia para detectar colonizaciones (al menos en axila e ingle), limpieza de la habitación al alta de un paciente colonizado/infectado y cultivos ambientales tras la limpieza8. El cumplimiento de las medidas básicas de higiene por parte del personal sanitario también es esencial, especialmente al manipular vías. La utilidad de la descolonización de los pacientes con antisépticos es controvertida, aunque habitualmente se hace con clorhexidina9. La identificación en el laboratorio se puede realizar mediante espectrometría de masas (MALDI-TOF) o métodos moleculares. Cuando estas técnicas no estén disponibles, se recomienda enviar a un laboratorio de referencia las levaduras sospechosas de ser C. auris, como aquellas que las pruebas bioquímicas identifiquen como ciertas especies filogenéticamente relacionadas (por ejemplo: Candida haemulonii o Candida lusitaniae) o aquellas que presenten resistencia a fluconazol10. Por su capacidad para adquirir resistencia, los pacientes en tratamiento por infecciones por C. auris se deberían monitorizar, así como hacer cultivos de seguimiento de diferentes muestras clínicas y estudios de sensibilidad en todos los aislamientos.
Candida auris es un patógeno multirresistente emergente que se debería añadir a los protocolos de vigilancia activa. Destaca sobre todo por su alta transmisibilidad, multirresistencia, la dificultad en la identificación en el laboratorio y su mal pronóstico, al afectar habitualmente a pacientes graves en unidades de críticos. La utilización prolongada de equinocandinas, tratamiento de elección en la actualidad, puede dar lugar a la aparición de cepas resistentes, lo que podría limitar todavía más las opciones terapéuticas y complicar el manejo de infecciones producidas por este microorganismo. Una vez más, cabe resaltar que el control del foco y el cambio de los catéteres son medidas imprescindibles para conseguir el éxito clínico en este contexto. Asimismo, hay que recalcar la importancia de controlar la diseminación de C. auris en el entorno hospitalario.