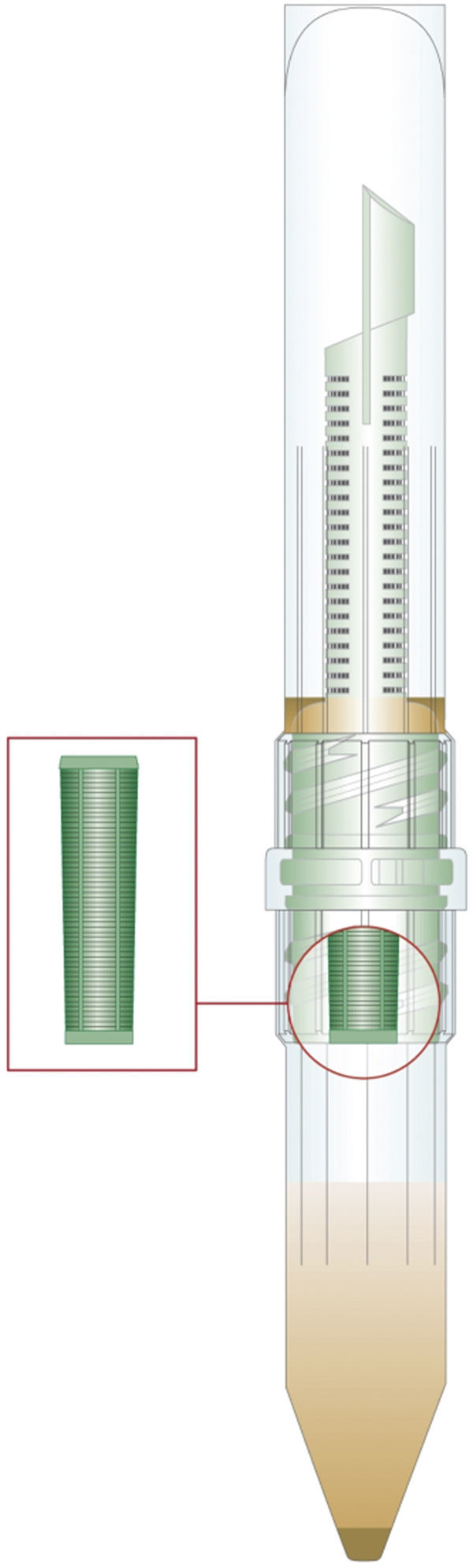
Tradicionalmente, el examen de parásitos en heces se ha realizado con técnicas de concentración que utilizan disolventes orgánicos tóxicos, como el acetato de etilo y el éter1–3, con el consecuente riesgo de exposición del personal que procesa las muestras. Además, se trata de técnicas que requieren varios pasos de centrifugación-decantación4,5, con un consumo medio de tiempo de 45 min en su procesamiento. Actualmente se están comercializando kits de concentración de parásitos de sencilla manipulación y que no requieren adición de solventes, como es el caso del Mini Parasep® Solvent Free. Se trata de un simple sistema cerrado de plástico (fig. 1) que contiene un líquido conservante y un filtro adaptado. De forma sencilla, el paciente puede inocular directamente en el dispositivo, con ayuda del dosificador incorporado, la cantidad de heces requerida. Con este kit la muestra llega directamente al laboratorio para centrifugar sin la necesidad de adicionar nuevos reactivos, eliminándose así la clásica fase de separación de grasas, como sí ocurre en el método tradicional de Ritchie modificado.
El objetivo del presente trabajo fue realizar un estudio piloto para estimar la concordancia entre un kit tradicional de concentración de parásitos en heces fundamentado en la técnica de sedimentación de Ritchie (Copropack SAF®, F. Soria Melguizo, Madrid, España, técnica 1) y el kit comercial Mini Parasep® SF (DiaSys Ltd, Berkshire, Inglaterra, técnica 2).
Paralelamente, se procesaron y examinaron mediante estas 2 técnicas una serie de muestras para estudio parasitológico en heces. La técnica 1 consistió en la concentración de parásitos mediante los siguientes pasos: mezcla de una porción de aproximadamente 5 g de heces con 10ml de formalina, centrifugación durante 10 min a 3.000r.p.m. y decantación del sobrenadante, resuspensión del sedimento en 5ml de éter, centrifugación durante 10 min a 3.000r.p.m. y decantación del sobrenadante, resuspensión del sedimento en unml de suero salino fisiológico y observación al microscopio. La técnica 2 consistió en la concentración de parásitos con el kit comercial Mini Parasep® SF mediante los siguientes pasos: introducción de una cantidad estándar de heces (tamaño de un guisante), en un dispositivo con un líquido conservante y un filtro con tamaño de poro de 425μm, centrifugación a 3.000 r.p.m. durante 3 min, decantación y resuspensión del sedimento en unml de solución salina y observación al microscopio. Los concentrados de cada técnica fueron examinados en el microscopio en el mismo día por personal altamente experimentado.
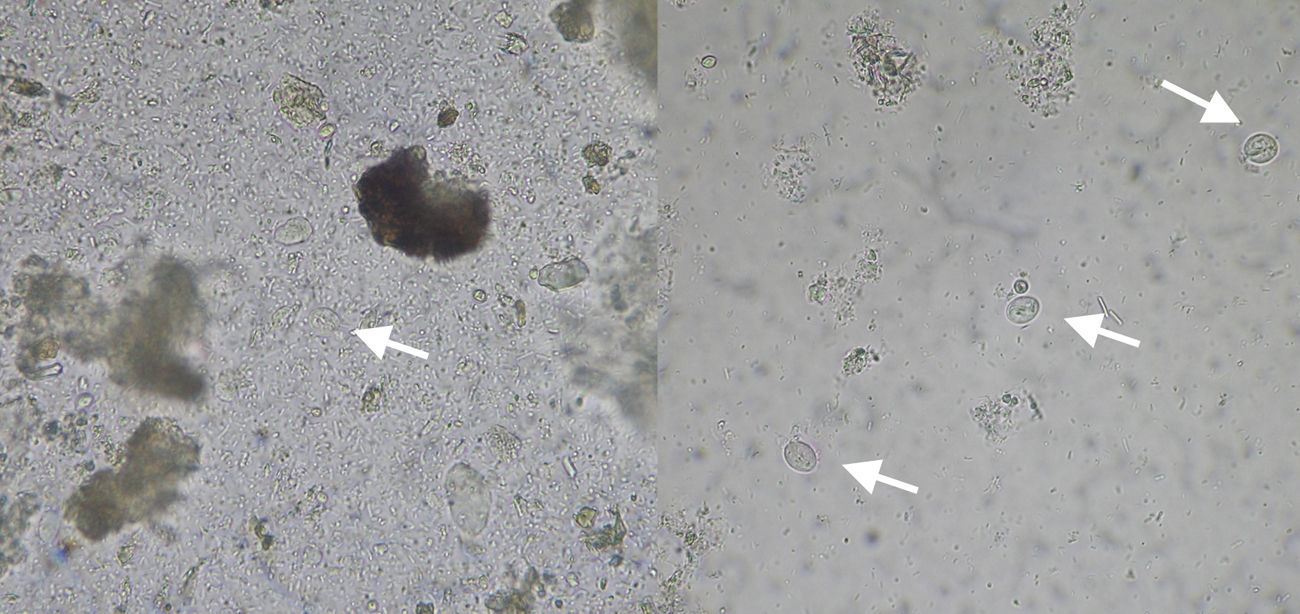
Se analizaron un total de 59 muestras seleccionadas a partir de los datos existentes en la historia clínica compatibles con diarrea crónica y eosinofilia. La concordancia entre ambas técnicas fue del 100% con un índice kappa=1. Se detectaron 6 muestras con quistes de Giardia lamblia, 2 con larvas de Strongyloides stercolaris, uno con quistes de Blastocystis hominis, uno con ooquistes de Cryptosporidium spp. y uno con quistes de Entamoeba coli y Blastocystis hominis. Para la detección de ooquistes de Cryptosporidium se realizó una confirmación mediante la tinción acid-fast de Kinyoun. Con la técnica 2 se observó mayor nitidez en la observación (fig. 2). El coste económico fue similar en ambas técnicas, aproximadamente de un euro, variando ligeramente según la oferta por volumen de consumo.
El sistema concentrador Mini Parasep® SF con su tamiz de pequeño tamaño de poro (425μm) permite separar partículas fecales grandes que, de otro modo, podrían sedimentarse en el cono durante la centrifugación6. Además, presenta una cámara de dispersión de grasas, consistente en un filtro secundario de 220μm de poro que retiene los restos fecales más pequeños y separa el contenido graso del sedimento resultante sin necesidad de añadir más disolventes. Por lo tanto, dicho dispositivo eliminaría artefactos y aumentaría la nitidez en la observación al microscopio, mejorando el rendimiento en la recuperación de parásitos. Así se demuestra en un estudio pakistaní7, en el que se estudiaron en paralelo 125 muestras mediante examen directo sin concentrar y con el sistema Mini Parasep® SF, donde se detectaron 25 y 38 muestras positivas respectivamente. En dicho estudio, se recuperó casi un 50% más con el nuevo sistema concentrador, además de detectar el total de las 25 muestras diagnosticadas mediante examen directo. Sin embargo, en nuestra serie, no aumentamos el rendimiento en recuperación y la concordancia entre ambas técnicas fue plena. Este idéntico rendimiento obtenido por ambas técnicas podría explicarse por que en nuestro estudio no se comparó con examen directo sin concentrar sino con otra técnica de concentración.
Por otra parte, la presentación del kit como un sistema cerrado de mínima manipulación y la no necesidad de adicionar disolventes tóxicos parecen claras ventajas en seguridad. No es tan evidente la superioridad de la técnica en la recuperación de parásitos, como lo demuestra un estudio inglés8, en el que se comparan 34 muestras de forma cuantitativa con huevos y quistes mediante el mismo sistema con y sin acetato de etilo (Midi Parasep® con acetato de etilo y Mini Parasep® SF). En el estudio se concluye que, en muestras con bajo recuento de parásitos, podrían no detectarse con el sistema libre de disolventes.
En conclusión, el kit comercial Mini Parasep® SF ha mostrado un rendimiento diagnóstico al menos igual al del método tradicional en la presente serie. Por tanto, se podría aconsejar su uso en la práctica clínica por sus ventajas de mínima manipulación, menor tiempo de procesamiento de las muestras y coste económico competitivo. Además, presenta la ventaja de una visión más nítida al microscopio con un menor contenido en artefactos, al ser eliminados por el filtro incorporado en el dispositivo. No obstante, serían deseables cohortes más amplias para confirmar estos resultados.