Varón de 48 años que acude a su médico de atención primaria por presentar un cuadro compatible con prostatitis. Como antecedentes personales de interés el paciente presenta hipertensión arterial con hipertrofia del ventrículo izquierdo en tratamiento con lisinopril/hidrocloritiazida 20/12,5mg desde el año 2007, insuficiencia renal leve desde 2010, apendicectomía por laparoscopia en el mismo año y colonoscopia con polipectomía a 15cm del margen anal en septiembre de 2011.
Al inicio de los síntomas, en mayo de 2011, se realizó un primer cultivo del líquido seminal que resultó positivo a Enterococcus faecalis. El paciente fue tratado con cefuroxima durante un mes y medio, sin remisión de los síntomas. Transcurrido este tiempo, se le realizó un cultivo de control, en el que se evidenció el fracaso terapéutico y se decidió cambiar la pauta antimicrobiana a levofloxacino 500mg/24h más nitrofurantoína 50mg/12h. Tras 4 meses de tratamiento continuado con quinolonas el paciente seguía con síntomas de prostatitis, por lo que se decidió repetir el cultivo del líquido seminal junto con un cultivo de orina.
La analítica realizada en octubre, paralelamente a los cultivos, mostró como alteraciones significativas urea de 54mg/dl, creatinina de 1,38mg/dl, filtrado glomerular de 58.45ml/min y ácido úrico de 7,20mg/dl, sin elevación del marcador tumoral PSA ni de la proteína C reactiva (PCR).
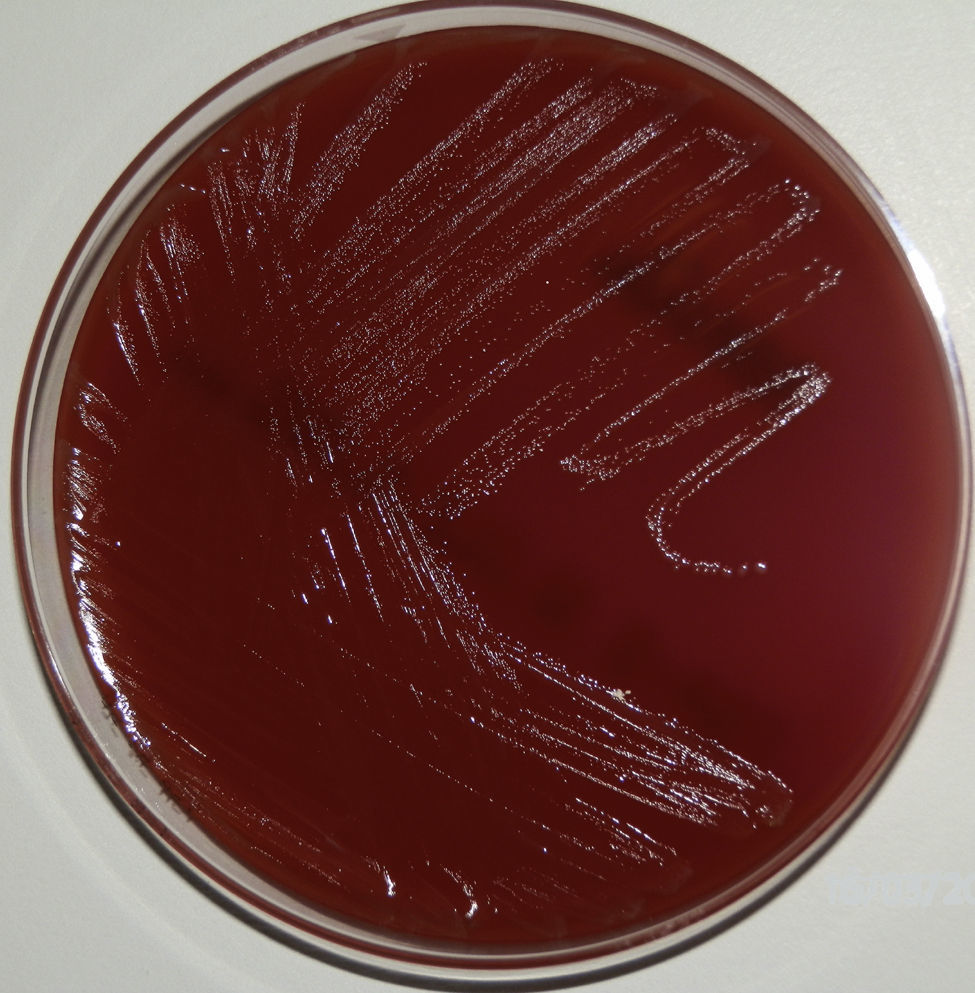
En la muestra de orina no se aislaron microorganismos, mientras que en el líquido seminal se aislaron >100.000UFC/ml de un bacilo grampositivo, oxidasa negativo, catalasa negativo, de crecimiento lento, no hemolítico (fig. 1). Para confirmación del diagnóstico de prostatitis bacteriana y descartar una probable contaminación o colonización, se solicitó una nueva muestra de orina y líquido seminal, que fueron remitidas al Servicio de Microbiología antes de instaurar una pauta antimicrobiana adecuada.
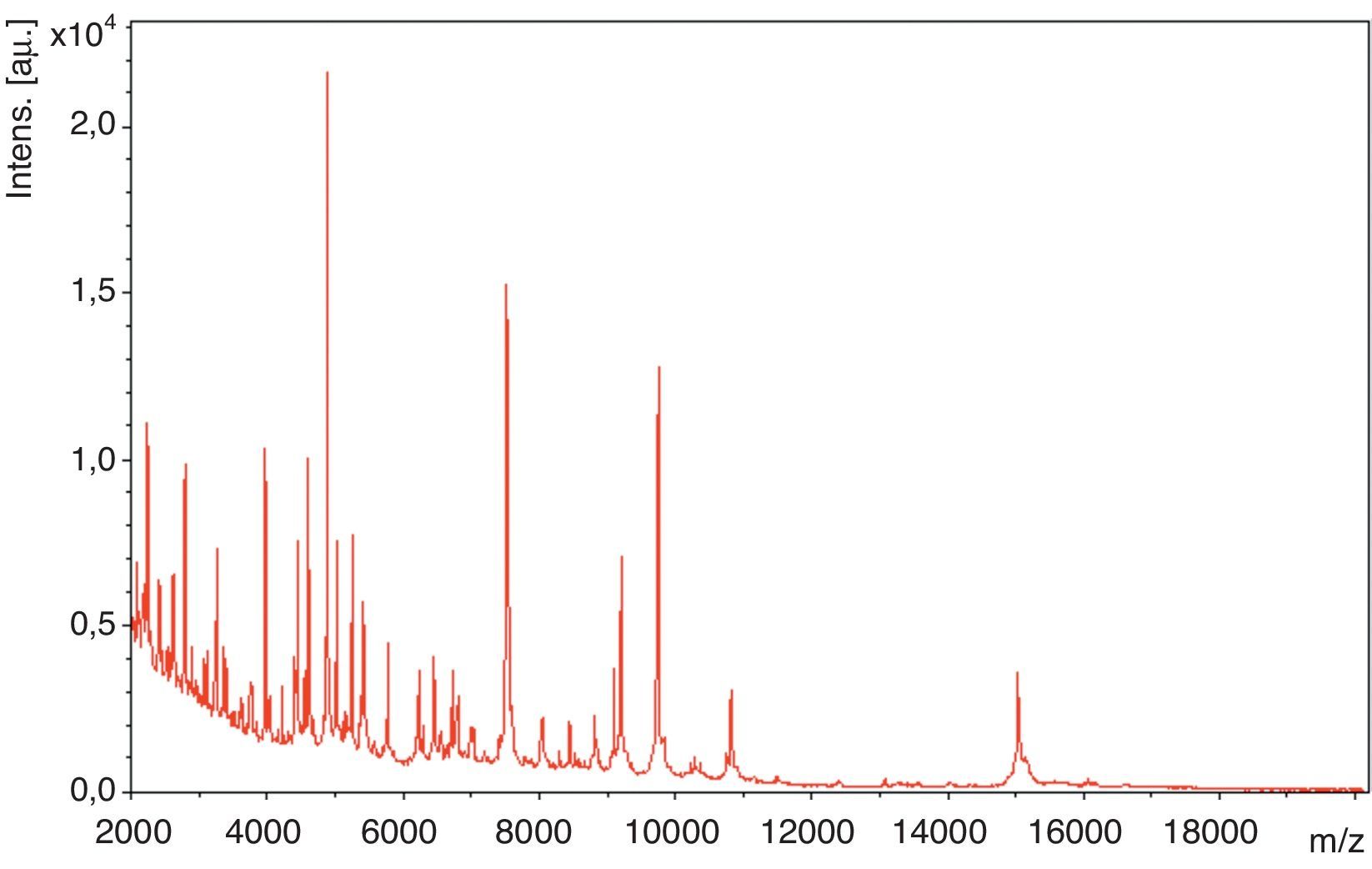
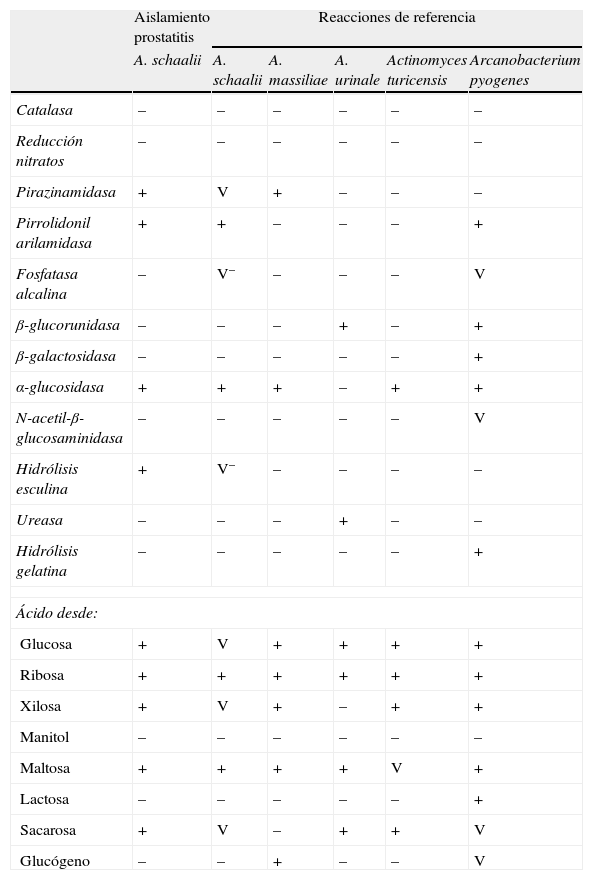
EvoluciónLa orina fue incubada durante 48h en anaerobiosis, resultando el cultivo negativo, mientras que en el líquido seminal se volvían a aislar >100.000UFC/ml de un bacilo grampositivo, que por espectrometría de masas (EM-MALDI-TOF) (Bruker; Bruker Daltonics Inc.) se identificó en ambos casos, con un score de 2,07, como Actinobaculum schaalii (fig. 2). La identificación por EM-MALDI-TOF fue confirmada mediante secuenciación de la subunidad 16S rRNA, obteniéndose una homología de ≥98% (datos no mostrados). En la identificación bioquímica realizada mediante API Coryne, API 32Strept y API 32A (BioMérieux, Craponne, Francia) se obtuvieron, respectivamente, los códigos e identificaciones siguientes: 6450731 Cellulomonas spp./Microbacterium spp. (99,9% perfil dudoso), 00102110000 Streptococcus acidominimus (99,9%, muy buena identificación), 0430077705 Actinomyces meyeri (perfil inaceptable); la comparación de las diferentes pruebas bioquímicas contrastadas se recoge en la tabla 1. El antibiograma se realizó mediante difusión en agar Schaedler suplementado con incubación en anaerobiosis a 35°C, 48h. A. sachaalii fue sensible a la penicilina, la ampicilina, la cefotaxima, la eritromicina, la clindamicina, la vancomicina, la telitromicina, el synercid, el linezolid, el cloranfenicol y la tigeciclina, pero resistente al ciprofloxacino, al levofloxacino y al cotrimoxazol. Para la interpretación de los halos de inhibición se siguieron los criterios de EUCAST para Enterobacteriaceae y Staphylococcus spp. (www.eucast.org).
Características bioquímicas de Actinobaculum schaalii por el API Coryne Sistem
| Aislamiento prostatitis | Reacciones de referencia | |||||
| A. schaalii | A. schaalii | A. massiliae | A. urinale | Actinomyces turicensis | Arcanobacterium pyogenes | |
| Catalasa | – | – | – | – | – | – |
| Reducción nitratos | – | – | – | – | – | – |
| Pirazinamidasa | + | V | + | – | – | – |
| Pirrolidonil arilamidasa | + | + | – | – | – | + |
| Fosfatasa alcalina | – | V– | – | – | – | V |
| β-glucorunidasa | – | – | – | + | – | + |
| β-galactosidasa | – | – | – | – | – | + |
| α-glucosidasa | + | + | + | – | + | + |
| N-acetil-β-glucosaminidasa | – | – | – | – | – | V |
| Hidrólisis esculina | + | V– | – | – | – | – |
| Ureasa | – | – | – | + | – | – |
| Hidrólisis gelatina | – | – | – | – | – | + |
| Ácido desde: | ||||||
| Glucosa | + | V | + | + | + | + |
| Ribosa | + | + | + | + | + | + |
| Xilosa | + | V | + | – | + | + |
| Manitol | – | – | – | – | – | – |
| Maltosa | + | + | + | + | V | + |
| Lactosa | – | – | – | – | – | + |
| Sacarosa | + | V | – | + | + | V |
| Glucógeno | – | – | + | – | – | V |
El paciente fue tratado con amoxicilina/ácido clavulánico 200/125mg/12h más un AINE cada 8h durante 4 meses, período tras el cual los síntomas remitieron y el cultivo del líquido seminal se negativizó.
ComentarioA. schaalii es un cocobacilo curvado pequeño grampositivo, anaerobio facultativo, no móvil, no esporulado, que muestra una ligera beta-hemólisis en agar sangre a los 3-5 días de incubación. Las colonias son grisáceas, de <1mm de diámetro a los 2días de incubación, y algunas veces presentan colonias dimórficas. Es negativo para catalasa, oxidasa y ureasa, no reduce los nitratos a nitritos, hidroliza el hipurato y es resistente al cotrimoxazol y al ciprofloxacino1-4. Su hábitat todavía es incierto, pero es probable que forme parte de la flora comensal del tracto genitourinario (TGU) y, por ello, potencial patógeno oportunista del mismo, principalmente en personas de edad avanzada, niños y pacientes con enfermedades de base del TGU1,2.
A. schaalii fue descrito por primera vez como causa de infección del tracto urinario (ITU) en humanos en 1997, y desde entonces se ha asociado a infecciones invasivas como urosepticemia, osteomielitis, abscesos y sepsis, principalmente en pacientes ancianos y en pacientes predispuestos1-8. A. schaalii también ha sido causa de sepsis en pacientes con cálculos renales y pielonefritis en un niño3,4,9. Recientemente se ha descrito un caso de endocarditis y otro de gangrena de Fournier por A. sachaalii, en pacientes sin antecedentes de ITU10,11. En algunos casos los pacientes tienen una historia de ITU de repetición, con leucocitos positivos y nitratos negativos en orina, durante meses o años antes de poder aislarse A. schaalii e instaurar un tratamiento adecuado2-4,8,12. Existe muy poca información sobre la sensibilidad in vitro y el adecuado tratamiento antimicrobiano. A. schaalii parece ser intrínsecamente resistente al metronidazol como anaerobio facultativo, al ciprofloxacino por mutaciones en la ADN girasa (gyrA) y en la topoisomeras iv (parC) y a trimetoprim, con una susceptibilidad variable al levofloxacino y a las sulfonamidas, y susceptible a beta-lactámicos, clindamicina, claritromicina, rifampicina, vancomicina, linezolid, tetraciclinas y nitrofurantoína13.
A. schaalii es un uropatógeno emergente que en pacientes predispuestos puede desencadenar infecciones graves en algunos casos. Debido a su difícil identificación mediante los sistemas comerciales convencionales disponibles en la mayoría de laboratorios, la espectrometría de masas (EM-MALDI-TOF) aparece como una alternativa diagnóstica rápida y eficaz, sin tener que recurrir a la secuenciación de la subunidad 16S rRNA14,15.
Hemos descrito aquí el primer caso de prostatitis por A. schaalii identificado por EM-MALDI-TOF, en un paciente con insuficiencia renal leve pero sin antecedentes de ITU, remitiendo los síntomas y negativizándose el cultivo del liquido seminal tras un tratamiento adecuado con amoxicilina/ácido clavulánico 200/125mg.