En España, la infección por Trypanosoma cruzi constituye una importante parasitosis importada debido al incremento de población procedente de área endémica. Como el diagnóstico de laboratorio de la fase crónica de la enfermedad se basa en la detección de anticuerpos IgG anti-T. cruzi, nuestros objetivos fueron los siguientes: i) comparar 10 técnicas de determinación de anticuerpos anti-T. cruzi; ii) evaluar su reactividad cruzada frente a enfermedades relacionadas, y iii) valorar el enzimoinmunoanálisis (ELISA)-rk39 y la inmunofluorescencia indirecta (IFI)-Leishmania para el diagnóstico diferencial de la leishmaniasis por Leishmania infantum.
Material y MétodosSe analizaron 223 sueros: 40 caracterizados por la empresa Qpanel y 183 procedentes de la seroteca del Servicio de Parasitología, Centro Nacional de Microbiología (chagásicos=66, sanos=97, leishmaniasis visceral=30 y malaria=30). La pruebas utilizadas fueron IFI y ELISA in house, 5 ELISA comerciales (Certest/Abbot Laboratories, BiosChile; Ortho® Clinical Diagnostics; BLK Diagnostic; bioMérieux, y Biokit), la prueba de aglutinación en gel y 2 pruebas inmunocromatográficas (Operon y CTK Biotech). Los últimos 4 ensayos utilizaban antígenos recombinantes (pruebas no convencionales).
ResultadosLa IFI y los ensayos de ELISA presentaron una sensibilidad entre el 97 y el 100%. Las pruebas inmunocromatográficas presentaron menor sensibilidad (92–96%). Todas las pruebas no convencionales presentaron menor número de reacciones cruzadas. El ELISA-rk39-Leishmania no presentó reactividad cruzada con los sueros chagásicos.
ConclusionesEn general, nuestros resultados confirman los datos obtenidos por otros autores. La sensibilidad de los ELISA es superior con respecto al resto de las pruebas, por lo que estas técnicas serían las más adecuadas para realizar el cribado serológico de la infección por T. cruzi. Una aproximación adecuada es la combinación de una prueba que utilice antígeno total con otra basada en antígenos recombinantes o péptidos sintéticos.
Trypanosoma cruzi infection is a major imported parasitic disease in Spain, because of the increase of immigrants from endemic areas. Since the laboratory diagnosis during the chronic phase is based on detection of anti-T. cruzi IgG antibodies, our aims were to compare 10 tests for determining anti-T. cruzi antibodies, to assess their cross-reactivity with related diseases, and to evaluate the rk39-ELISA and IFAT-Leishmania tests as tools for the differential diagnosis of leishmaniasis due to Leishmania infantum.
Material and MethodsA total of 223 sera were tested: 40 had been previously characterized by Qpanel, and 183 were obtained from the serum library of the Parasitology Department, Centro Nacional de Microbiología (66 chagasic, 97 healthy, 30 visceral leishmaniasis, and 30 malaria). Samples were examined using in-house IFAT and ELISA, 5 commercial ELISAs (Certest/Abbot Laboratories/BiosChile; Ortho® Clinical Diagnostics; BLK Diagnostic; bioMérieux; and Biokit), particle gel agglutination (ID-PaGIA), and two immunochromatographic assays (Operon and CTK Biotech). The last 4 tests are based in recombinant antigens (non-conventional tests).
ResultsThe IFAT and ELISAs showed a sensitivity of 97% to 100%. The immunochromatographic tests had somewhat lower sensitivity (92%–96%). All non-conventional tests presented a smaller number of cross-reactions. Leishmania-Rk39-ELISA did not show cross-reactivity with chagasic sera.
ConclusionsIn general, our results confirm the data obtained by other authors. The sensitivity of ELISA is higher than other tests; therefore, these techniques would be the most appropriate for screening of T. cruzi infection. A suitable approach is the combination of a test using total antigen with another based on either recombinant antigens or synthetic peptides.
La enfermedad de Chagas es uno de los principales problemas de salud que afecta a la población latinoamericana. Sin embargo, los actuales cambios demográficos están ampliando los límites geográficos de su distribución.
En la década de 1980 la Organización Mundial de la Salud estimaba que entre 16 y 18 millones de personas se encontraban infectadas por Trypanosoma cruzi, agente etiológico de esta enfermedad1. En el año 2006 la Organización Panamericana de la Salud (OPS) publicó una nueva estimación, según la que el número de individuos afectados estaría alrededor de 7,6 millones2.
El T. cruzi se transmite por contacto con las heces contaminadas de los insectos vectores (triatóminos), por transfusión sanguínea, de forma congénita, por transplantes de órganos y últimamente se está describiendo un mayor número de casos por transmisión oral3. Tras un corto período de tiempo conocido como fase aguda, los individuos que no reciben tratamiento específico evolucionan a la fase crónica de la infección. En esta fase, del 50 al 70% de las personas infectadas no desarrollará sintomatología alguna, y pueden permanecer en este estado durante el resto de sus vidas (forma indeterminada de la infección). Sin embargo, transcurridos 20–30 años o más, el 30–50% de los individuos presentará alteraciones cardíacas, digestivas y, en menor medida, del sistema nervioso1. Sólo del 1 al 2% de los casos se detecta en la fase aguda, pues la mayoría se diagnostica en la fase crónica.
Actualmente no existe una técnica de referencia para el diagnóstico de la enfermedad de Chagas. En la fase aguda, los métodos parasitológicos son los más idóneos; mientras que en la fase crónica, la parasitemia suele ser baja y en ocasiones indetectable, por lo que el diagnóstico la infección se realiza mediante la detección de anticuerpos IgG anti-T. cruzi. Existen 2 grupos de pruebas para la detección de anticuerpos anti-T. cruzi: 1) las pruebas convencionales, en las que el antígeno puede ser el parásito completo o extractos solubles o purificados cuya composición es una mezcla compleja de antígenos, y 2) las pruebas no convencionales que utilizan antígenos recombinantes o péptidos sintéticos1.
En España la enfermedad de Chagas es una parasitosis emergente e importada, debido al incremento en la migración de población procedente de zonas endémicas. Según el Instituto Nacional de Estadística, los inmigrantes latinoamericanos representan el 34% del total de la población extranjera4 (1,8 millones) y desde el año 2005 los centros de transfusión sanguínea están obligados a realizar una prueba validada para descartar la infección por T. cruzi en individuos con riesgo epidemiológico (Real Decreto 1088/2005)5. Según estudios preliminares en centros de transfusión sanguínea, la seroprevalencia de la infección por T. cruzi en donantes de sangre con antecedentes de riesgo está alrededor del 1%6. En España, hasta la fecha, se han descrito 2 casos fatales de Chagas transfusional7,8 y 4 casos de evolución favorable. Asimismo, la seroprevalencia en mujeres embarazadas latinoamericanas fluctúa entre el 1 y el 4,8%9–11, con una tasa de transmisión del 7,3%10.
Antes del año 2005 en el mercado español existía un número limitado de pruebas para la detección de anticuerpos anti-T. cruzi. Actualmente, el número de kits comerciales es cada vez mayor. Sin embargo, no se conoce la eficacia de éstos en el contexto epidemiológico español, donde la leishmaniasis causada por el tripanosomátido Leishmania infantum es una enfermedad endémica, y donde la elección de viajes a zonas tropicales incrementa el riesgo de exposición a otras parasitosis, como la malaria (MAL)12. Ambas protozoosis pueden ocasionar reactividad cruzada.
Por esto, los objetivos de este trabajo fueron los siguientes: i) comparar, mediante la utilización de sueros previamente caracterizados, los índices diagnósticos de una inmunofluorescencia indirecta (IFI) in house, un enzimoinmunoanálisis (ELISA) in house y 8 pruebas comerciales (5 ELISA, una prueba de aglutinación de partículas en gel con dos y tres antígenos recombinantes, y 2 inmunocromatografías) (tabla 1); ii) evaluar la reactividad cruzada con sueros de pacientes con evidencia serológica de leishmaniasis visceral (LEISH) y MAL, y iii) valorar la utilidad del antígeno recombinante rk39 e IFI-Leishmania, para discriminar la reactividad cruzada causada por L. infantum.
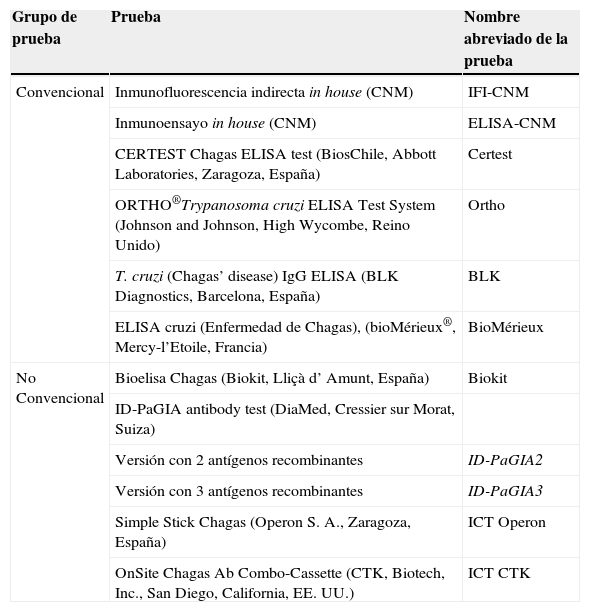
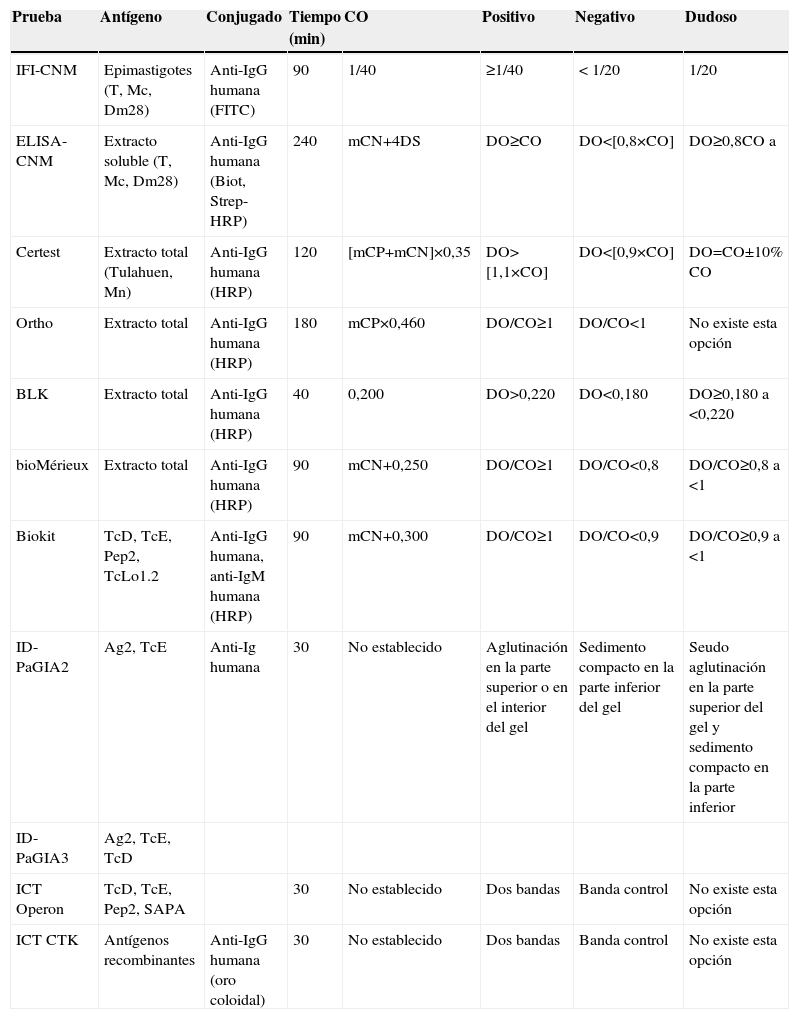
Pruebas para la determinación de anticuerpos anti-Trypanosoma cruzi
| Grupo de prueba | Prueba | Nombre abreviado de la prueba |
| Convencional | Inmunofluorescencia indirecta in house (CNM) | IFI-CNM |
| Inmunoensayo in house (CNM) | ELISA-CNM | |
| CERTEST Chagas ELISA test (BiosChile, Abbott Laboratories, Zaragoza, España) | Certest | |
| ORTHO®Trypanosoma cruzi ELISA Test System (Johnson and Johnson, High Wycombe, Reino Unido) | Ortho | |
| T. cruzi (Chagas’ disease) IgG ELISA (BLK Diagnostics, Barcelona, España) | BLK | |
| ELISA cruzi (Enfermedad de Chagas), (bioMérieux®, Mercy-l’Etoile, Francia) | BioMérieux | |
| No Convencional | Bioelisa Chagas (Biokit, Lliçà d’ Amunt, España) | Biokit |
| ID-PaGIA antibody test (DiaMed, Cressier sur Morat, Suiza) | ||
| Versión con 2 antígenos recombinantes | ID-PaGIA2 | |
| Versión con 3 antígenos recombinantes | ID-PaGIA3 | |
| Simple Stick Chagas (Operon S. A., Zaragoza, España) | ICT Operon | |
| OnSite Chagas Ab Combo-Cassette (CTK, Biotech, Inc., San Diego, California, EE. UU.) | ICT CTK |
CNM: Centro Nacional de Microbiología; ELISA: enzimoinmunoanálisis; ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IFI: inmunofluorescencia indirecta.
Se emplearon 3 paneles de sueros.
Primer panel: elaborado por la empresa QPanel (www.qpanel.com.br) y proporcionado por la OPS. Este panel constaba de 40 muestras de suero, 38 sueros reactivos (chagásicos diagnosticados en zona endémica) y 2 controles no reactivos.
Segundo panel: estaba constituido por 123 sueros, 28 sueros de pacientes latinoamericanos chagásicos crónicos diagnosticados en España, de los cuales 10 correspondían a individuos con parasitemia indetectable por la reacción en cadena de la polimerasa (PCR) (seropositivos PCR negativos) y 18 con parasitemia detectable mediante PCR (seropositivos PCR positivos); 73 sueros de individuos sanos procedentes de Sudamérica y 22 sueros de individuos sanos españoles. Estas muestras se seleccionaron y se consideraron los resultados concordantes entre IFI-Centro Nacional de Microbiología (CNM) y ELISA-CNM in house y la información clínico-epidemiológica.
Tercer panel: incluyó 60 sueros de individuos con evidencia serológica o parasitológica de LEISH (n=30) o MAL (n=30), con títulos de anticuerpos anti-Leishmania entre 1/80 y 1/1.280 (IFI-Leishmania in house13), o anti-Plasmodium entre 1/1.280 y 1/5.120 (Falciparum-Spot IF™, bioMérieux®, Mercy-l’Etoile, Francia). Estos sueros procedían de casos activos y pasados de leishmaniasis (pacientes españoles) y MAL (pacientes africanos). Ninguno de los pacientes tenía antecedentes de viajes a Latinoamérica.
Los 2 últimos paneles se prepararon con muestras de la seroteca del Servicio de Parasitología, CNM, Instituto de Salud Carlos III. Todos los sueros estuvieron conservados a −20°C hasta su uso.
Pruebas serológicas para la detección de anticuerpos anti-Trypanosoma cruziIFI in house (IFI-CNM): se realizó de acuerdo al protocolo descrito por Camargo (1966)14, con algunas modificaciones. El antígeno se preparó a partir de la mezcla proporcional de epimastigotes de cultivo en fase estacionaria de 2 cepas de T. cruzi II (Mc y T) y una de T. cruzi I (Dm28). En cada pocillo se depositaron 10 μl de una suspensión de 5×106parásitos/ml. Como conjugado se utilizó anti-IgG humana marcada con fluoresceína (bioMérieux®). El umbral de positividad se estableció en la dilución 1/40. La reactividad a la dilución 1/20 y la observación de campos con parásitos fluorescentes y no fluorescentes a la dilución 1/40 se consideraron como resultados dudosos.
ELISA in house (ELISA-CNM): el antígeno fue un extracto soluble preparado a partir de cultivos de epimastigotes en fase estacionaria de las mismas cepas de T. cruzi empleadas en IFI, según el procedimiento descrito por Scott et al (1987)15, con algunas modificaciones. En resumen, por cada gramo de sedimento de parásitos se añadieron 8ml de solución de lisis (20mM Tris-clorídrico [Tris-HCl], 10mM etilendiamino tetraacético [EDTA] pH 8) e inhibidores de proteasas (1mM EDTA, 1mM etilenglicol tetraacético [EGTA], 1mM N-etilmaleinimida [NEM], 1 μM Pepstatin, 1mM fluoruro de fenil metil sulfónico [PMSF], 100μM N-tosil-L-fenil alanil clorometill cetona [TCPK]). Esta mezcla se sometió a descompresión de nitrógeno en una bomba de cavitación para favorecer la rotura de los parásitos (120–140libra por pulgada cuadrada [PSI, pounds per square inch], 30min). El extracto soluble se obtuvo tras centrifugación diferencial, primero a 27.000×g durante 20min, y luego a 100.000×g durante 4 h. El sobrenadante se dializó en tampón fosfato salino (PBS) pH 7,4 y se conservó a −70°C hasta su uso. La concentración de proteínas se determinó mediante el método del ácido bicinconínico (BCA, Pierce, Rockford, Illinois, EE. UU.), según las instrucciones del fabricante.
Para realizar la prueba ELISA-CNM se sensibilizaron placas Nunc® Maxisorp con 1,5μg/pocillo del antígeno soluble de T. cruzi diluido en tampón carbonato de 0,05M pH 9,6 (0,5μg de cada cepa de T. cruzi T, Mc y Dm28). Tras bloquear con PBS suplementado con albúmina sérica bovina al 3% y Tween-20 al 0,1%, la placa se lavó 5 veces con PBS Tween-20 al 0,1%. Se añadieron los sueros problema y controles diluidos al 1/100 en PBS Tween-20 con albúmina sérica bovina al 0,1%. Para revelar los complejos antígeno-anticuerpo se utilizó el sistema Biotina-Streptavidina (Southern Biotechnology Associates, Icn., Birmingham, Alabama, EE. UU.). Como sustrato se empleó 2.2’-Azino-bis (3-ethylbennzthiazoline-6-sulfonic acid) (Sigma, St. Louis, Missouri, EE. UU.), diluido en tampón fosfato-citrato de 0,05M pH 5 con el 0,03% de perborato de sodio (Sigma). La reacción se frenó con solución de Dodecil sulfato sódico (SDS, sodium dodecyl sulfate) al 5% (Sigma). Las absorbancias se midieron en un lector de ELISA (Mios Microplate Reader, DYNATECH, Tarpon Springs, Florida, EE. UU.) a 405nm de longitud de onda. La línea de corte se definió como el promedio de los controles negativos más 4 desviaciones estándares (cut-off [CO, ‘umbral de reactividad’]).
Pruebas comerciales: todos los ensayos se realizaron de acuerdo a las instrucciones establecidas por los fabricantes de cada kit. La reactividad de cada una de las muestras se determinó según las especificaciones técnicas de cada ensayo. En la tabla 2 se describen las características de las pruebas utilizadas en este trabajo. La comparación de la reactividad entre los diferentes ensayos de ELISA se realizó mediante el cálculo del índice densidad óptica/CO.
Características e interpretación de las lecturas de las pruebas de detección de anticuerpos anti- Trypanosoma cruzi
| Prueba | Antígeno | Conjugado | Tiempo (min) | CO | Positivo | Negativo | Dudoso |
| IFI-CNM | Epimastigotes (T, Mc, Dm28) | Anti-IgG humana (FITC) | 90 | 1/40 | ≥1/40 | < 1/20 | 1/20 |
| ELISA-CNM | Extracto soluble (T, Mc, Dm28) | Anti-IgG humana (Biot, Strep-HRP) | 240 | mCN+4DS | DO≥CO | DO<[0,8×CO] | DO≥0,8CO a |
| Certest | Extracto total (Tulahuen, Mn) | Anti-IgG humana (HRP) | 120 | [mCP+mCN]×0,35 | DO>[1,1×CO] | DO<[0,9×CO] | DO=CO±10% CO |
| Ortho | Extracto total | Anti-IgG humana (HRP) | 180 | mCP×0,460 | DO/CO≥1 | DO/CO<1 | No existe esta opción |
| BLK | Extracto total | Anti-IgG humana (HRP) | 40 | 0,200 | DO>0,220 | DO<0,180 | DO≥0,180 a <0,220 |
| bioMérieux | Extracto total | Anti-IgG humana (HRP) | 90 | mCN+0,250 | DO/CO≥1 | DO/CO<0,8 | DO/CO≥0,8 a <1 |
| Biokit | TcD, TcE, Pep2, TcLo1.2 | Anti-IgG humana, anti-IgM humana (HRP) | 90 | mCN+0,300 | DO/CO≥1 | DO/CO<0,9 | DO/CO≥0,9 a <1 |
| ID-PaGIA2 | Ag2, TcE | Anti-Ig humana | 30 | No establecido | Aglutinación en la parte superior o en el interior del gel | Sedimento compacto en la parte inferior del gel | Seudo aglutinación en la parte superior del gel y sedimento compacto en la parte inferior |
| ID-PaGIA3 | Ag2, TcE, TcD | ||||||
| ICT Operon | TcD, TcE, Pep2, SAPA | 30 | No establecido | Dos bandas | Banda control | No existe esta opción | |
| ICT CTK | Antígenos recombinantes | Anti-IgG humana (oro coloidal) | 30 | No establecido | Dos bandas | Banda control | No existe esta opción |
Biot: anti-IgG humana marcada con biotina; CN: control negativo; CNM: Centro Nacional de Microbiología; CO: cut-off ‘umbral de reactividad’ CP: control positivo; DO: densidad óptica; DS: desviación estándar; FITC: Isotiocianato de fluoresceina (fluorescein isothiocyanate); HRP: peroxidasa de rábano (horseradish peroxidase); ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IFI: inmunofluorescencia indirecta; m: media aritmética; Strep-HRP: estreptavidina marcada con peroxidada.
ELISA-rk39 e IFI-Leishmania: para determinar la presencia de anticuerpos anti-Leishmania mediante el antígeno rk39 se siguió el protocolo descrito por Burns et al16. La IFI-Leishmania se llevó a cabo según el procedimiento descrito por Deniau et al13. En este último caso, el antígeno se preparó a partir de cultivos de promastigotes de la cepa de L. infantum MHOM/FR/78/LEM-75 (zimodema MON-1). El umbral de positividad se estableció en la dilución 1/80.
Análisis de datosCon el apoyo del programa SPSS 15, se construyeron tablas de contingencia 2×2. Se calcularon los índices diagnósticos de sensibilidad y especificidad mediante el programa EPIDAT 3.1, se analizaron en primer lugar los resultados de los paneles 1 y 2, y se los combinó posteriormente con los del panel 3. De la misma forma, se valoró la concordancia mediante el análisis del índice kappa (κ). La clasificación de los sueros del panel 1 en las categorías chagásico y no chagásico se estableció según la descripción de la empresa QPanel. En el panel 2, la categorización se definió mediante la combinación de los resultados de IFI-CNM, ELISA-CNM y los datos clinicoepidemiológicos: IFI-CNM positivo+ELISA-CNM positivo+procedencia de zona endémica o clínica compatible o diagnóstico parasitológico positivo por PCR=chagásico; ausencia de signos y síntomas de la enfermedad de Chagas u otra enfermedad+IFI-CNM negativo+ELISA-CNM negativo=no chagásico o control sano. Los resultados de los sueros del panel 3 se utilizaron para evaluar el grado de reactividad cruzada de cada prueba y su impacto en los índices diagnósticos. En este último análisis, todos los resultados obtenidos con el panel 3 se agruparon a los de los no chagásicos o controles sanos.
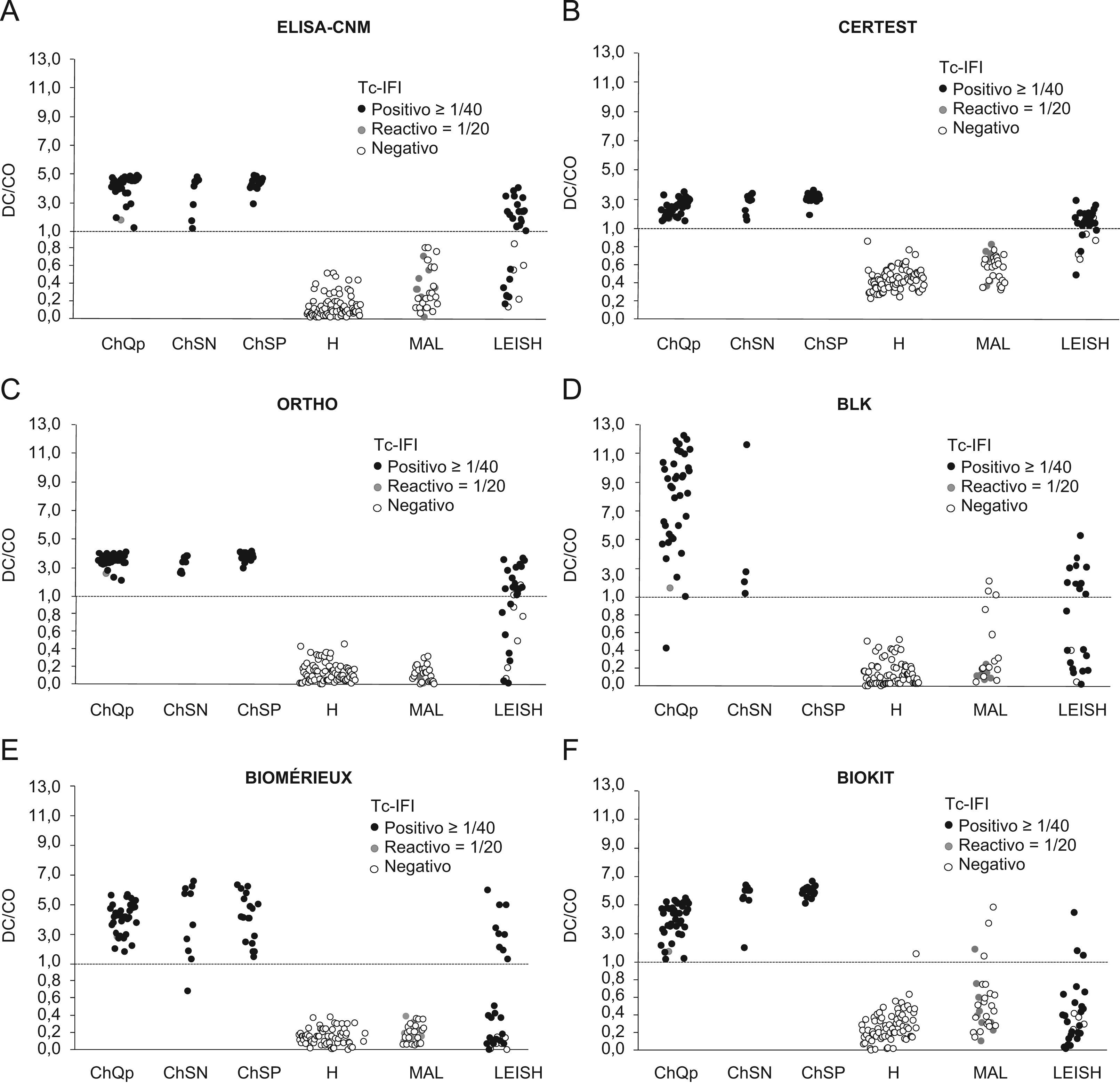
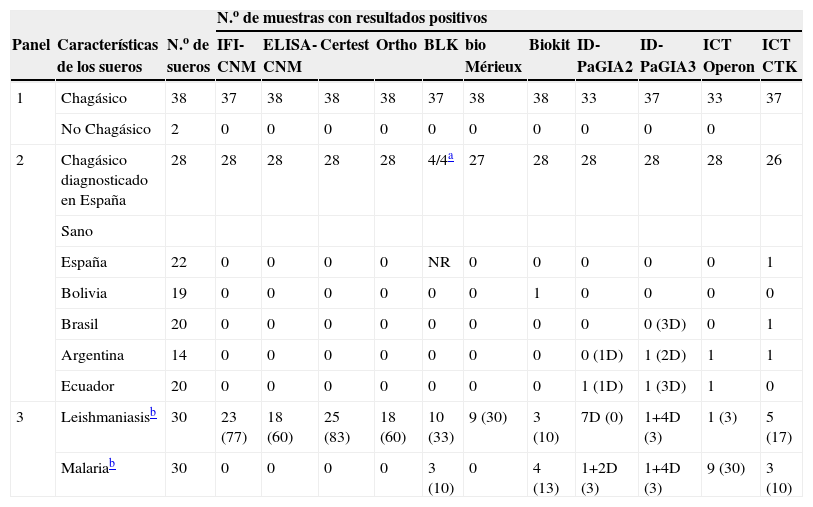
ResultadosComparación de la reactividadEl 92% (61/66) de los sueros de individuos chagásicos fueron reactivos en todas las pruebas (tabla 3), los resultados falsamente negativos correspondieron a sueros del panel elaborado por la empresa QPanel, a sueros con niveles de anticuerpos próximos al CO en algunos ensayos de ELISA o a sueros de individuos con parasitemia indetectable (tabla 4, figs. 1 y 2). Por otra parte, el 97% (94/97) de los sueros de los controles sanos presentaron resultados negativos en todas las pruebas. Sólo las pruebas no convencionales presentaron resultados falsamente positivos, estos resultados no fueron concordantes entre sí (tabla 4).
Reactividad de los sueros en las diferentes pruebas de detección de anticuerpos anti- Trypanosoma cruzi
| N.o de muestras con resultados positivos | |||||||||||||
| Panel | Características de los sueros | N.o de sueros | IFI-CNM | ELISA-CNM | Certest | Ortho | BLK | bio Mérieux | Biokit | ID-PaGIA2 | ID-PaGIA3 | ICT Operon | ICT CTK |
| 1 | Chagásico | 38 | 37 | 38 | 38 | 38 | 37 | 38 | 38 | 33 | 37 | 33 | 37 |
| No Chagásico | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| 2 | Chagásico diagnosticado en España | 28 | 28 | 28 | 28 | 28 | 4/4a | 27 | 28 | 28 | 28 | 28 | 26 |
| Sano | |||||||||||||
| España | 22 | 0 | 0 | 0 | 0 | NR | 0 | 0 | 0 | 0 | 0 | 1 | |
| Bolivia | 19 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | |
| Brasil | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 (3D) | 0 | 1 | |
| Argentina | 14 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 (1D) | 1 (2D) | 1 | 1 | |
| Ecuador | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 (1D) | 1 (3D) | 1 | 0 | |
| 3 | Leishmaniasisb | 30 | 23 (77) | 18 (60) | 25 (83) | 18 (60) | 10 (33) | 9 (30) | 3 (10) | 7D (0) | 1+4D (3) | 1 (3) | 5 (17) |
| Malariab | 30 | 0 | 0 | 0 | 0 | 3 (10) | 0 | 4 (13) | 1+2D (3) | 1+4D (3) | 9 (30) | 3 (10) | |
CNM: Centro Nacional de Microbiología; D: dudoso; ELISA: enzimoinmunoanálisis; ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IFI: inmunofluorescencia indirecta; NR: no realizado.
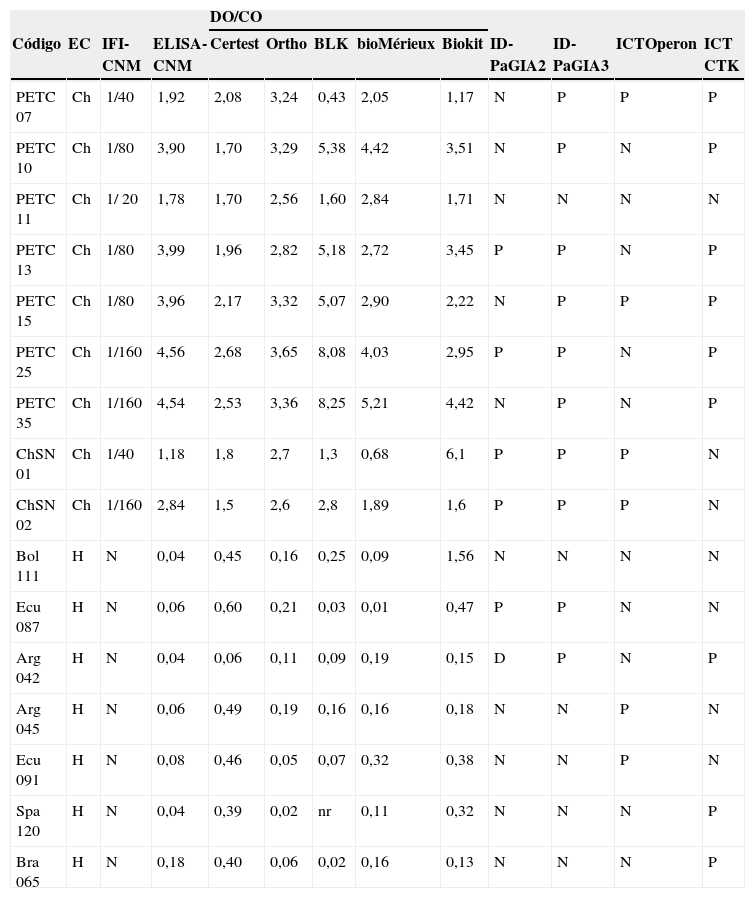
Comparación de las muestras con resultados discrepantes
| DO/CO | ||||||||||||
| Código | EC | IFI- CNM | ELISA-CNM | Certest | Ortho | BLK | bioMérieux | Biokit | ID-PaGIA2 | ID-PaGIA3 | ICTOperon | ICT CTK |
| PETC 07 | Ch | 1/40 | 1,92 | 2,08 | 3,24 | 0,43 | 2,05 | 1,17 | N | P | P | P |
| PETC 10 | Ch | 1/80 | 3,90 | 1,70 | 3,29 | 5,38 | 4,42 | 3,51 | N | P | N | P |
| PETC 11 | Ch | 1/ 20 | 1,78 | 1,70 | 2,56 | 1,60 | 2,84 | 1,71 | N | N | N | N |
| PETC 13 | Ch | 1/80 | 3,99 | 1,96 | 2,82 | 5,18 | 2,72 | 3,45 | P | P | N | P |
| PETC 15 | Ch | 1/80 | 3,96 | 2,17 | 3,32 | 5,07 | 2,90 | 2,22 | N | P | P | P |
| PETC 25 | Ch | 1/160 | 4,56 | 2,68 | 3,65 | 8,08 | 4,03 | 2,95 | P | P | N | P |
| PETC 35 | Ch | 1/160 | 4,54 | 2,53 | 3,36 | 8,25 | 5,21 | 4,42 | N | P | N | P |
| ChSN 01 | Ch | 1/40 | 1,18 | 1,8 | 2,7 | 1,3 | 0,68 | 6,1 | P | P | P | N |
| ChSN 02 | Ch | 1/160 | 2,84 | 1,5 | 2,6 | 2,8 | 1,89 | 1,6 | P | P | P | N |
| Bol 111 | H | N | 0,04 | 0,45 | 0,16 | 0,25 | 0,09 | 1,56 | N | N | N | N |
| Ecu 087 | H | N | 0,06 | 0,60 | 0,21 | 0,03 | 0,01 | 0,47 | P | P | N | N |
| Arg 042 | H | N | 0,04 | 0,06 | 0,11 | 0,09 | 0,19 | 0,15 | D | P | N | P |
| Arg 045 | H | N | 0,06 | 0,49 | 0,19 | 0,16 | 0,16 | 0,18 | N | N | P | N |
| Ecu 091 | H | N | 0,08 | 0,46 | 0,05 | 0,07 | 0,32 | 0,38 | N | N | P | N |
| Spa 120 | H | N | 0,04 | 0,39 | 0,02 | nr | 0,11 | 0,32 | N | N | N | P |
| Bra 065 | H | N | 0,18 | 0,40 | 0,06 | 0,02 | 0,16 | 0,13 | N | N | N | P |
CNM: Centro Nacional de Microbiología; CO: cut-off ‘umbral de reactividad’; Ch: individuo infectado por Trypanosoma cruzi; D: dudoso; DO: densidad óptica; EC: clasificación del estatus clínico; ELISA: enzimoinmunoanálisis; H: individuo control sano; ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IFI: inmunofluorescencia indirecta; N: negativo; P: positivo.
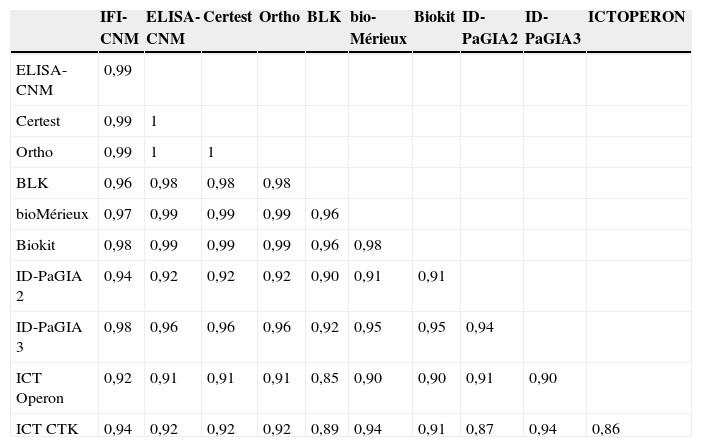
Comparación de los niveles de anticuerpos observados en los diferentes ensayos de enzimoinmunoanálisis con respecto a la inmunofluorescencia indirecta. Línea discontinua: CO. (ChQP: chagásicos diagnosticados en zona endémica; ChSN: seropositivos con PCR negativa, ChSP: seropositivos con PCR positiva; CO: cut-off ‘umbral de reactividad’; DO: densidad óptica; H: controles sanos; LEISH: pacientes con leishmaniasis visceral; MAL: pacientes con malaria).
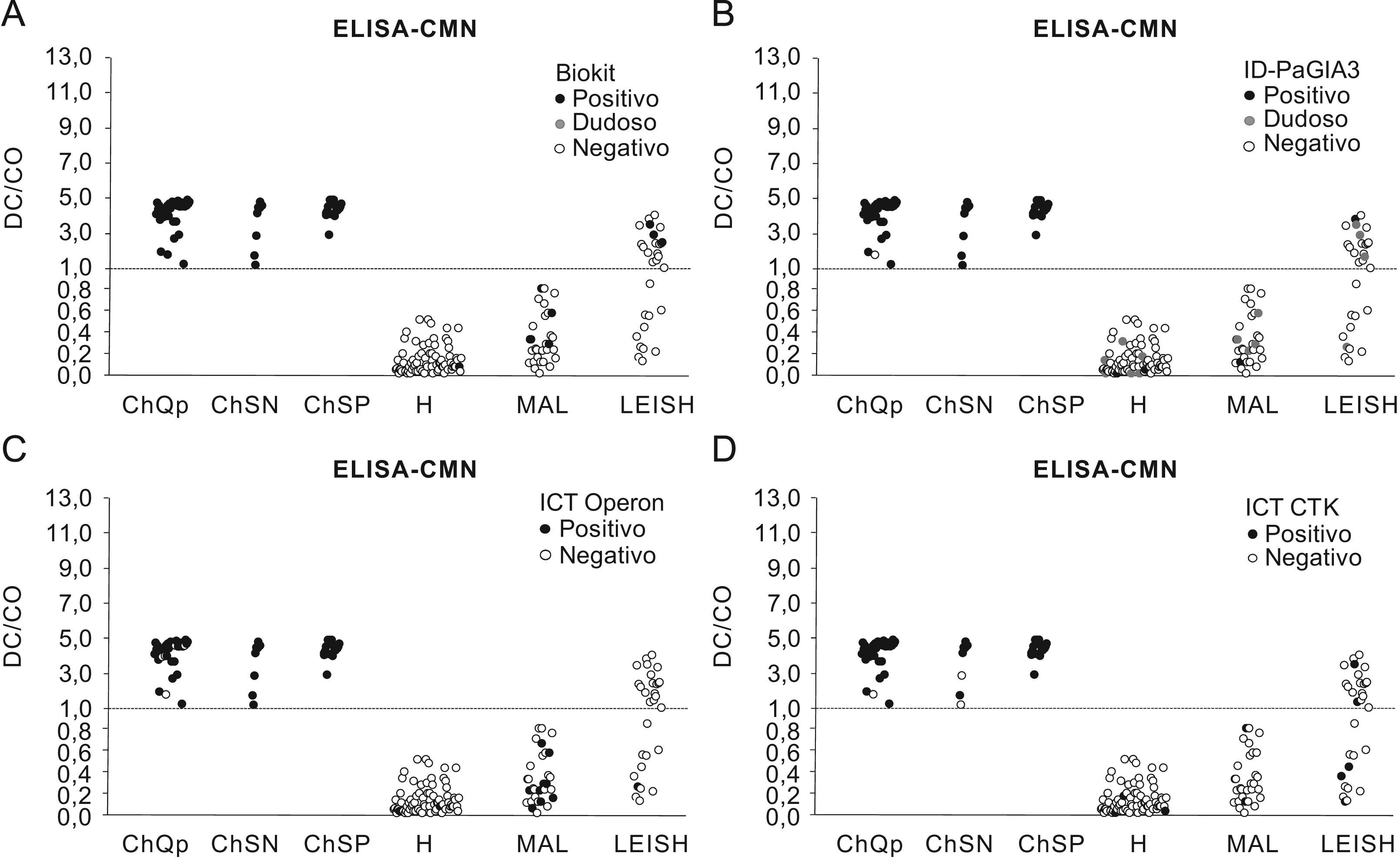
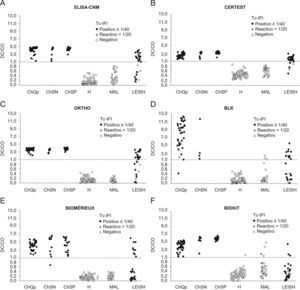
Comparación de los niveles de anticuerpos observados en el enzimoinmunoanálisis-Centro Nacional de Microbiología con respecto a las pruebas no convencionales. Línea discontinua: CO. (ChQP: chagásicos diagnosticados en zona endémica; ChSN: seropositivos con PCR negativa; ChSP: seropositivos con PCR positiva; CO: cut-off ‘umbral de reactividad’; DO: densidad óptica; H: controles sanos; LEISH: pacientes con leishmaniasis visceral; MAL: pacientes con malaria).
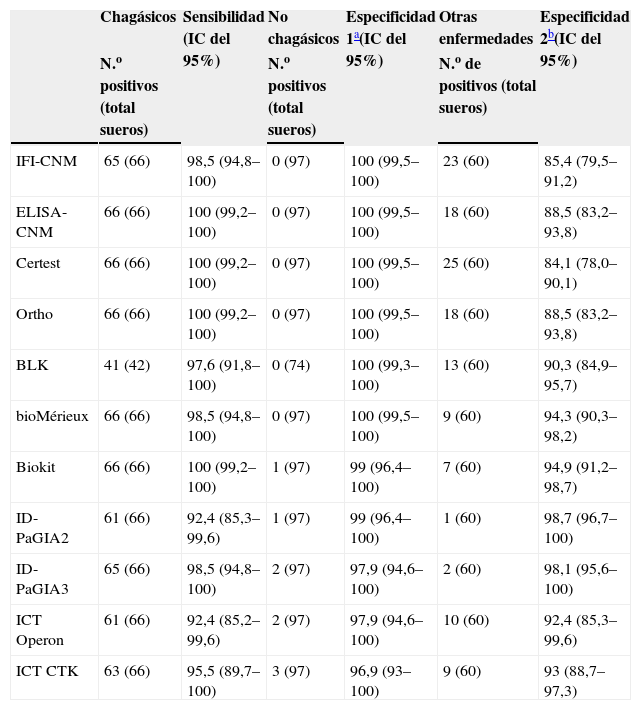
Todas las pruebas mostraron sensibilidad elevada (tabla 5). Las pruebas convencionales presentaron una sensibilidad desde el 98 al 100% y las no convencionales desde el 92 al 100%. Las pruebas rápidas fueron las que exhibieron menor sensibilidad. La especificidad en general fue elevada en todos los ensayos y fluctuaban los valores calculados entre el 97 y el 100%.
Sensibilidad y especificidad de las pruebas de detección de anticuerpos anti-Trypanosoma cruzi
| Chagásicos | Sensibilidad (IC del 95%) | No chagásicos | Especificidad 1a(IC del 95%) | Otras enfermedades | Especificidad 2b(IC del 95%) | |
| N.o positivos (total sueros) | N.o positivos (total sueros) | N.o de positivos (total sueros) | ||||
| IFI-CNM | 65 (66) | 98,5 (94,8–100) | 0 (97) | 100 (99,5–100) | 23 (60) | 85,4 (79,5–91,2) |
| ELISA-CNM | 66 (66) | 100 (99,2–100) | 0 (97) | 100 (99,5–100) | 18 (60) | 88,5 (83,2–93,8) |
| Certest | 66 (66) | 100 (99,2–100) | 0 (97) | 100 (99,5–100) | 25 (60) | 84,1 (78,0–90,1) |
| Ortho | 66 (66) | 100 (99,2–100) | 0 (97) | 100 (99,5–100) | 18 (60) | 88,5 (83,2–93,8) |
| BLK | 41 (42) | 97,6 (91,8–100) | 0 (74) | 100 (99,3–100) | 13 (60) | 90,3 (84,9–95,7) |
| bioMérieux | 66 (66) | 98,5 (94,8–100) | 0 (97) | 100 (99,5–100) | 9 (60) | 94,3 (90,3–98,2) |
| Biokit | 66 (66) | 100 (99,2–100) | 1 (97) | 99 (96,4–100) | 7 (60) | 94,9 (91,2–98,7) |
| ID-PaGIA2 | 61 (66) | 92,4 (85,3–99,6) | 1 (97) | 99 (96,4–100) | 1 (60) | 98,7 (96,7–100) |
| ID-PaGIA3 | 65 (66) | 98,5 (94,8–100) | 2 (97) | 97,9 (94,6–100) | 2 (60) | 98,1 (95,6–100) |
| ICT Operon | 61 (66) | 92,4 (85,2–99,6) | 2 (97) | 97,9 (94,6–100) | 10 (60) | 92,4 (85,3–99,6) |
| ICT CTK | 63 (66) | 95,5 (89,7–100) | 3 (97) | 96,9 (93–100) | 9 (60) | 93 (88,7–97,3) |
CNM: Centro Nacional de Microbiología; ELISA: enzimoinmunoanálisis; ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IC: intervalo de confianza; IFI: inmunofluorescencia indirecta.
Todos los ensayos convencionales presentaron reactividad cruzada con los sueros de leishmaniasis, que variaba entre el 30 y el 83%, y que fue considerablemente menor en los ensayos no convencionales (0 a 17%) (tabla 3). Sin embargo, todas las pruebas que mostraron menor reactividad cruzada con los sueros de leishmaniasis exhibieron reactividad cruzada con los sueros de MAL (3 al 30%) (tabla 3). El grado de reactividad fue bastante amplio, en especial en las muestras de los individuos con leishmaniasis, y presentaba títulos de IFI y valores de densidad óptica elevados (fig. 1). Otros sueros presentaron resultados dudosos tanto por IFI como por prueba de aglutinación en gel (tabla 3, figs. 1 y 2). Al calcular nuevamente los índices diagnósticos, incluidos los datos obtenidos con los sueros de leishmaniasis y MAL, las pruebas convencionales presentaron menor especificidad, en un rango entre el 84 y el 94%. En cambio, las pruebas no convencionales presentaron valores próximos a los obtenidos en el anterior análisis, del 92 al 99% (tabla 5), y superiores a las convencionales.
Análisis de la concordanciaLa concordancia entre los ensayos convencionales y no convencionales fue elevada cuando se analizó el conjunto de resultados obtenidos con los sueros correspondientes a individuos chagásicos y no chagásicos. Los índices κ variaron entre 0,86 y 0,99 (tabla 6). Cuando se incluyeron los resultados obtenidos con los sueros de leishmaniasis y MAL, los índices κ se situaron entre 0,62 y 0,98 (datos no mostrados). Mediante el análisis de la concordancia se pudo descartar el problema de reactividad cruzada con malaria. Este mismo análisis no fue suficiente para discriminar las reacciones cruzadas con leishmaniasis (fig. 1). Se observó una mejor discriminación cuando se combinaron Biokit con la IFI (fig. 1) o los ELISA convencionales con las pruebas no convencionales (fig. 2).
Evaluación de la concordancia mediante el estadístico kappa
| IFI-CNM | ELISA-CNM | Certest | Ortho | BLK | bio-Mérieux | Biokit | ID-PaGIA2 | ID-PaGIA3 | ICTOPERON | |
| ELISA-CNM | 0,99 | |||||||||
| Certest | 0,99 | 1 | ||||||||
| Ortho | 0,99 | 1 | 1 | |||||||
| BLK | 0,96 | 0,98 | 0,98 | 0,98 | ||||||
| bioMérieux | 0,97 | 0,99 | 0,99 | 0,99 | 0,96 | |||||
| Biokit | 0,98 | 0,99 | 0,99 | 0,99 | 0,96 | 0,98 | ||||
| ID-PaGIA 2 | 0,94 | 0,92 | 0,92 | 0,92 | 0,90 | 0,91 | 0,91 | |||
| ID-PaGIA 3 | 0,98 | 0,96 | 0,96 | 0,96 | 0,92 | 0,95 | 0,95 | 0,94 | ||
| ICT Operon | 0,92 | 0,91 | 0,91 | 0,91 | 0,85 | 0,90 | 0,90 | 0,91 | 0,90 | |
| ICT CTK | 0,94 | 0,92 | 0,92 | 0,92 | 0,89 | 0,94 | 0,91 | 0,87 | 0,94 | 0,86 |
CNM: Centro Nacional de Microbiología; ICT: prueba inmunocromatográfica (immunochromatographic test); ID-PaGIA2: prueba de aglutinación en gel, versión con 2 péptidos; ID-PaGIA3: prueba de aglutinación en gel, versión con 3 péptidos; IFI: inmunofluorescencia indirecta.
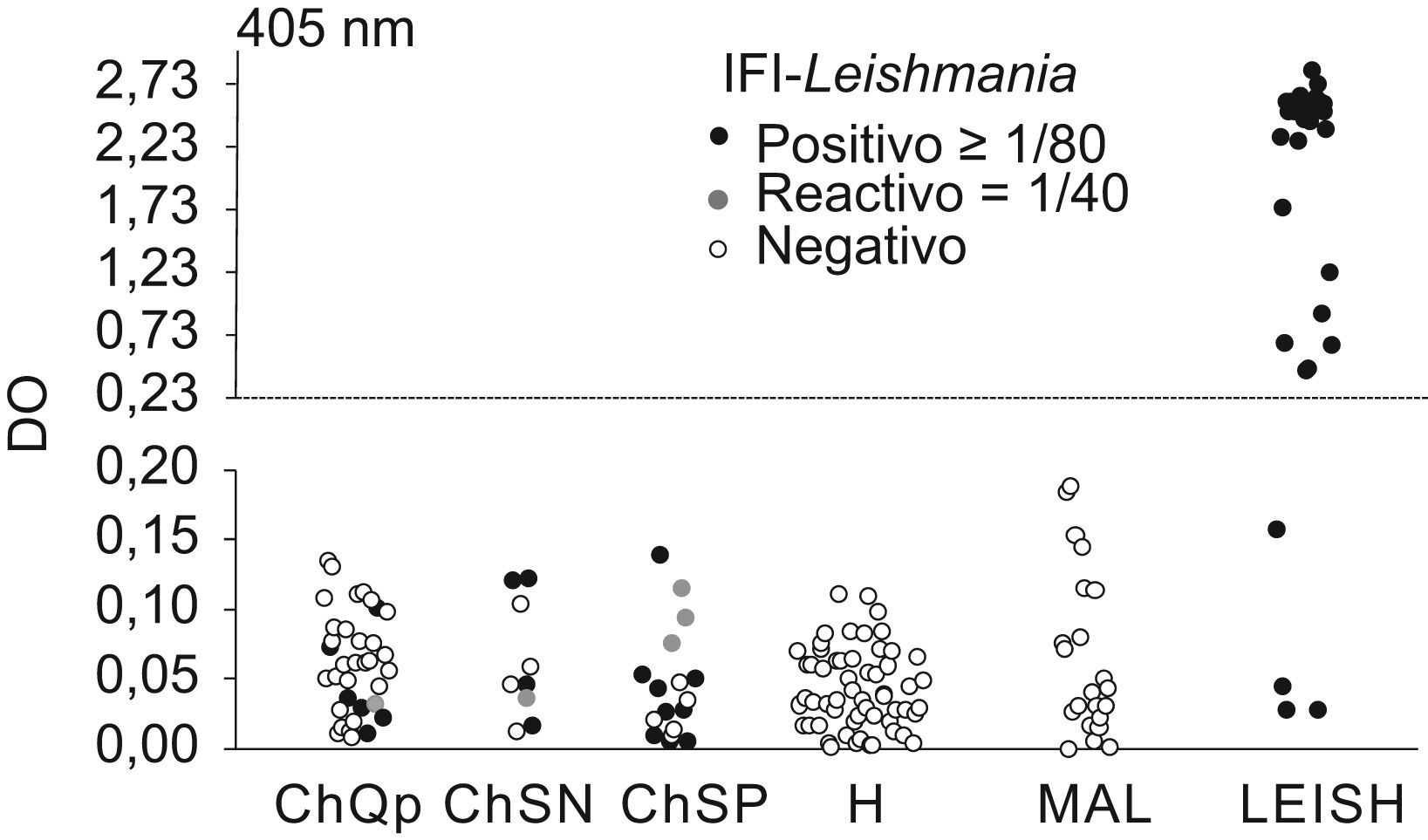
Como el problema principal de todos los ensayos convencionales de detección de anticuerpos anti-T. cruzi es la reactividad cruzada con los sueros de pacientes con leishmaniasis, se decidió valorar la utilidad de los ensayos IFI-Leishmania y ELISA-rk39 en el diagnóstico diferencial con esta enfermedad. Con el primer ensayo fueron positivos 21 (32%) de los 66 sueros de individuos chagásicos. No obstante, más del 50% de los sueros (12/21) presentaron títulos en el límite de positividad (1/80). En cambio, con el ensayo ELISA-rk39 todos los individuos chagásicos fueron negativos (fig. 3). Es importante mencionar que los 4 sueros de individuos con LEISH, que presentaron resultados negativos en el ELISA-rk39, correspondían a muestras con títulos bajos de IFI-Leishmania. Estos pacientes tenían un diagnóstico parasitológico positivo y se encontraban inmunodeprimidos (3 eran VIH positivos y uno había recibido un tratamiento con inmunosupresores).
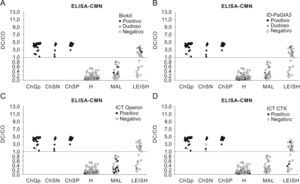
Comparación de los niveles de anticuerpos mediante enzimoinmunoanálisis-rk39 e inmunofluorescencia indirecta-Leishmania. Línea discontinua: CO (ChQP: chagásicos diagnosticados en zona endémica; ChSN: seropositivos con PCR negativa; ChSP: seropositivos con PCR positiva; CO: cut-off ‘umbral de reactividad’; DO: densidad óptica; H: controles sanos; LEISH: pacientes con leishmaniasis visceral; MAL: pacientes con malaria).
Desde el punto de vista del diagnóstico de laboratorio, la infección por T. cruzi es una entidad compleja, en la que su evolución natural marca la eficacia del diagnóstico parasitológico y serológico. La demostración del parásito es efectiva principalmente en la fase aguda. Desafortunadamente, el 98% de los afectados se diagnostica en la fase crónica. En esta fase, la herramienta que permite demostrar la infección por este protozoo es, principalmente, la determinación de los anticuerpos IgG anti-T. cruzi específicos.
Aunque se han realizado numerosos estudios para evaluar las distintas pruebas de detección de anticuerpos específicos anti-T. cruzi17–19, no existe consenso en la elección de una técnica de referencia. Los estudios realizados en el Cono Sur de Sudamérica reportan una eficacia elevada de los kits comerciales fabricados en esta región18,20. En cambio, los trabajos llevados a cabo en el norte de Sudamérica y Centroamérica muestran que la utilización de antígenos preparados a partir de las cepas de T. cruzi que se aíslan en estas zonas incrementa la sensibilidad de los ensayos de detección de anticuerpos21,22. Este hecho se basa en el predominio del genotipo T. cruzi I en estas regiones23,24 y la amplia extensión del genotipo T. cruzi II en los países del Cono Sur25. Otros autores postulan que esta diferencia en la distribución geográfica de los genotipos de T. cruzi a su vez influye en la variabilidad de la respuesta inmunitaria de los individuos infectados26. Por esto, algunos investigadores de Brasil y Estados Unidos plantearon la posibilidad de que las pruebas antígeno de excreción secreción de tripomatigotes (TESA, trypomatigotes excreted-secreted antigen)-blot27 o prueba de radioinmunoprecipitación (RIPA, radioimmunoprecipitation assay)28 pudieran considerarse como pruebas de referencia. Sin embargo, otros autores han demostrado que estas técnicas también presentan resultados falsos negativos y problemas de reactividad cruzada29–31. Además, debido a las limitaciones técnicas para su comercialización, la utilización de estas herramientas está restringida a los centros en los que se desarrollaron.
Teniendo en cuenta estos antecedentes, la confirmación de laboratorio de una sospecha clínica de enfermedad de Chagas sigue basándose en los resultados concordantes de al menos 2 técnicas inmunológicas de principios y antígenos distintos1.
En España el origen de la población extranjera latinoamericana es muy variado. Según el Instituto Nacional de Estadística, en diciembre de 2008 los extranjeros latinoamericanos procedían principalmente de Ecuador (23%), Colombia (16%), Bolivia (13%) y Argentina (10%)4. Por otra parte, como el resto de la población española, la población extranjera residente en España está expuesta a las infecciones autóctonas. Una de éstas es la LEISH causada por L. infantum, un tripanosomátido que genera una respuesta humoral con una importante activación policlonal, origen de la reactividad cruzada en numerosas técnicas de detección de anticuerpos de enfermedades relacionadas e incluso no relacionadas con esta parasitosis32. A este hecho se suma el aumento de los viajes a zonas tropicales y, por lo tanto, el riesgo de infección por otros agentes que producen activación policlonal. Este fenómeno podría interferir con el inmunodiagnóstico de T. cruzi, en especial en aquellas técnicas en las que intervienen los anticuerpos IgM. Por estas razones es necesario, en el contexto epidemiológico español, conocer la eficacia de las herramientas comerciales disponibles para la detección de anticuerpos anti-T. cruzi.
En general, nuestros resultados confirman los datos obtenidos por otros autores. La sensibilidad de los ELISA es superior con respecto al resto de las pruebas, por lo que estas técnicas serían las más adecuadas para realizar el cribado serológico de la infección por T. cruzi.
Aunque actualmente en el mercado español existen kits para realizar la prueba de IFI, en este estudio sólo se incluyó una preparada en nuestro laboratorio, que presentó una alta sensibilidad. Sin embargo, una limitación de las pruebas de IFI a la hora de aplicarse como ensayos de rutina, es que dependen de la experiencia técnica del operador en la lectura de la señal. Por esto, su uso como prueba de confirmación se restringe a centros de referencia. Por otra parte, existe controversia en la interpretación de los resultados reactivos a la dilución 1/20, unos consideran que este título debería ser el CO de esta prueba. Sin embargo, hay otros autores para los que este título significa reacción cruzada19, como nosotros comprobamos en este estudio.
Debido a la complejidad de la interacción de T. cruzi con su hospedador, ningún antígeno recombinante por sí solo ha alcanzado la eficacia de los extractos totales en el inmunodiagnóstico de este protozoo. Generalmente, la composición antigénica de los ensayos basados en antígenos recombinantes incluye una combinación de varios epítopos, que incluso suelen ser los mismos33. La influencia de este factor se aprecia en el caso de la prueba de aglutinación en gel: 4 de las 5 muestras con resultados negativos en la versión elaborada con 2 péptidos fueron positivas cuando se realizó la misma prueba con las partículas recubiertas con 3 péptidos (tabla 3). Por otra parte, estos 3 epítopos antigénicos también están incluidos en las pruebas Biokit e ICT: prueba inmunocromatográfica (immunochromatographic test); Operon (tabla 2), por lo que otro factor que también influye en la sensibilidad es el formato de fabricación.
Con respecto a las pruebas inmunocromatográficas, existen pocos ensayos en este formato y sólo el Chagas Stat-Pak se validó en Honduras para utilizarse como herramienta de cribado serológico en bancos de sangre34, aunque los mismos autores prefieren aplicarlo principalmente en estudios de campo (comunicación personal). Según los resultados obtenidos, las pruebas inmunocromatográficas incluidas en este estudio no alcanzan índices diagnósticos que avalen su incorporación en bancos de sangre. Sin embargo, la facilidad de su uso en la rutina diaria es indiscutible, puesto que estas pruebas no requieren infraestructura sofisticada ni personal especializado. Es decir, en circunstancias en las que es necesaria una actuación inmediata, como son el momento del parto de una gestante de áreas endémicas o el transplante de órganos de donantes con factores de riesgo para la infección por T. cruzi, estas pruebas permitirían la identificación rápida de los portadores infectados de alto riesgo. No obstante, tras el uso de esta prueba, todos los resultados (tanto positivos como negativos) deberían confirmarse con una segunda prueba de mayor sensibilidad, como por ejemplo un ELISA convencional; de esta manera se realizarían 2 ensayos de principios y antígenos distintos.
Es importante mencionar que con la técnica rápida ELISA BLK se analizó un menor número de sueros de individuos infectados por T. cruzi, por lo que el resultado falsamente negativo obtenido con esta prueba redundó en una menor sensibilidad comparada con los demás ensayos de ELISA.
En relación con la especificidad, es necesario mencionar que si bien sólo las pruebas no convencionales presentaron resultados discordantes en la población sana, en la rutina diaria este tipo de resultados también se observan en las pruebas convencionales. Una posible explicación técnica de la presencia de resultados falsamente positivos en el ELISA Bioelisa Chagas Biokit, podría deberse a la composición del conjugado, éste contiene anti-IgM además de anti-IgG humana. Si bien, algunos autores defienden la utilidad diagnóstica de la evaluación de los anticuerpos IgM35, éstos pueden generar resultados discordantes por su amplia reactividad36. Si bien en España no se puede descartar una posible infección aguda o reciente (período de ventana), el número de individuos en este período es reducido con respecto a lo que se observa en zonas endémicas, por lo que esta sospecha estaría asociada a un recién nacido hijo de una mujer seropositiva, a un viaje reciente (menos de 3 meses) a zona endémica, a cuadros febriles o signos de malestar general tras una transfusión de derivados sanguíneos o al transplante de órganos infectados. En todas estas situaciones, las herramientas de diagnóstico más adecuadas son las que permiten la detección del parásito8,37,38. Por otra parte, gracias a los estudios de seguimiento de casos agudos por accidentes de laboratorio, se conoce que la seroconversión de anticuerpos IgG en individuos inmunocompetentes, se produce a partir del primer mes después de haber estado en contacto con el parásito39. Asimismo, el seguimiento de individuos en la fase crónica ha demostrado que el nivel de anticuerpos, por lo general, se mantiene constante si no han recibido tratamiento tripanocida. Por el contrario, los que se han tratado son los que presentan, después de algunos años, resultados discordantes40. Como en áreas endémicas los individuos tratados no reciben certificación de esta práctica, es probable que algunos individuos inmigrantes se encuentren en estas circunstancias.
Por otra parte, una de las principales desventajas de los ensayos de detección de anticuerpos es la reactividad cruzada. Muchos autores han reportado este problema con sueros de pacientes con leishmaniasis, MAL y enfermedades autoinmunitarias, entre otras31. Por esto, para el estudio de los índices diagnósticos, algunos especialistas recomiendan la inclusión de muestras con evidencia serológica a otras enfermedades18. Según estas recomendaciones, incluimos sueros de individuos con leishmaniasis y MAL. Se eligieron estas parasitosis debido a que en evaluaciones previas realizadas en nuestro laboratorio estas enfermedades fueron las que generaron un mayor número de reacciones falsamente positivas. En efecto, todas las técnicas convencionales tienen una disminución importante en la especificidad con respecto a las no convencionales (tabla 5). Sin el análisis de la información clinicoepidemiológica muchos pacientes con leishmaniasis podrían diagnosticarse erróneamente como infectados por T. cruzi o se incluirían en la población de individuos con serología discrepante (tabla 3, fig. 1). Por esto es fundamental que además de la valoración de los datos clinicoepidemiológicos se realice un estudio parasitológico y el seguimiento del individuo a largo plazo.
Desde el punto de vista de un banco de sangre, cualquier problema de reactividad cruzada supone el descarte de la donación y, por lo tanto, la interrupción del riesgo de transmisión de cualquier patógeno. Sin embargo, si se trata de confirmar una sospecha clínica, sólo el seguimiento del individuo permitiría definir el significado de este tipo de resultados.
Dado que en España la población inmigrante puede contraer leishmaniasis, es importante tener en cuenta que la fiebre es un marcador clínico que caracteriza a la infección por L. infantum, signo que los portadores crónicos de T. cruzi no suelen manifestar. En estos casos, el diagnóstico serológico y diferencial deberá establecerse mediante la detección de anticuerpos anti-rk39, ya que la prueba de IFI-Leishmania presenta reactividad cruzada con los sueros de los individuos chagásicos (fig. 3). En situaciones de inmunodepresión, la detección del parásito será siempre la mejor elección.
En conclusión, y teniendo en cuenta nuestros resultados, los ensayos comerciales Ortho® Clinical Diagnostics, Certest/Abbot Laboratories/BiosChile, Biokit y bioMérieux cumplen las expectativas para realizar el cribado serológico de la infección por T. cruzi. Como todas las técnicas rápidas examinadas permitieron la confirmación de la sospecha clínica del 92% de los infectados y del 100% de los que presentaban parásitos en sangre periférica, estos ensayos podrían ser de gran utilidad en el cribado serológico de las situaciones particulares ya mencionadas; no obstante, para alcanzar resultados más adecuados deberían combinarse con un ELISA convencional. Por otra parte, como ninguna prueba ni convencional ni no convencional por sí sola puede establecer el diagnóstico o confirmación de la sospecha clínica, ni descarta el problema de la reactividad cruzada, la combinación de un ELISA convencional con uno no convencional puede ser la mejor alternativa para el diagnóstico de rutina. La combinación de pruebas siempre generará resultados discrepantes, por lo general, en un número reducido de casos. Por esto, la estrategia más adecuada para definir el significado de estas discrepancias sería el seguimiento serológico a largo plazo, apoyado de un buen diagnóstico diferencial en centros especializados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste estudio ha recibido el apoyo del Ministerio de Ciencia e Innovación y el Instituto de Salud Carlos III, en el marco de la Red de Investigación de Enfermedades Tropicales (RETIC-RICET, RD06/0021/0009 y RD06/0021/0019).
Los autores agradecen a la OPS la donación de los sueros caracterizados por la empresa QPanel, Brasil.