Los estudios farmacológicos realizados demuestran una relación entre la concentración plasmática de antirretrovirales (ARV) y su toxicidad y actividad antiviral. Sin embargo, en niños con infección por el virus de la inmunodeficiencia humana (VIH), los datos farmacocinéticos y farmacodinámicos son heterogéneos y limitados. Pretendemos analizar los niveles de fármacos ARV en la práctica clínica, en niños infectados por VIH y su influencia en la efectividad terapéutica.
MétodosEstudio observacional, prospectivo y multicéntrico, que incluye niños con infeccion por VIH, controlados en 5 hospitales terciarios entre marzo de 2006 y junio de 2008. Se determinó la concentración plasmática de ARV en el momento predosis y se analizó la relación con diferentes variables clínicas y analíticas.
ResultadosSe incluyó un total de 129 pacientes. El 41,3% presentaba niveles plasmáticos fuera del rango establecido. No se hallaron diferencias analíticas en función del género. Los menores de un año presentaban concentraciones infraterapéuticas y carga viral elevada, de modo más frecuente que el resto de los niños.
ConclusiónLas concentraciones plasmáticas de ARV son infraterapéuticas con mayor frecuencia en los menores de un año. Este hallazgo se relaciona con mayor fallo viral y supone un reto importante en esta población, que requiere un tratamiento a muy largo plazo.
Pharmacologic studies have shown a relationship between plasma antiretroviral levels and toxicity/viral activity. Nevertheless, pharmacokinetic and pharmacodynamic data are inconsistent and limited in HIV-infected children. An analysis was performed of plasma antiretroviral concentrations in clinical practice and their influence on therapy efficacy in HIV-infected children.
MethodsObservational, prospective, multicenter study, including HIV-infected children followed up at 5 reference hospitals between March 2006 and June 2008. Pre-dose plasma antiretroviral levels were determined and the relationships with various clinical and analytical variables were investigated.
ResultsA total of 129 patients were included, and 41.3% had antiretroviral plasma levels outside the established range. No differences were found between sexes. Children younger than 1 year had a higher rate of suboptimal levels and higher viral load than the remaining children.
ConclusionAntiretroviral plasma concentrations are more frequently suboptimal in children younger than 1 year. This finding is related with greater viral failure and implies a considerable challenge in this population, which requires very long-term treatment.
Desde la introducción del tratamiento antirretroviral (ARV) de gran actividad (TARGA) en el tratamiento de la infección por el virus de la inmunodeficiencia humana (VIH), se ha conseguido una disminución significativa de la morbimortalidad en estos pacientes y esta infección se ha convertido en una enfermedad crónica1. Esto cobra mayor importancia cuando se trata de pacientes pediátricos, que van a vivir más años de enfermedad y de tratamiento ARV.
Una de las estrategias propuestas para optimizar la efectividad del TARGA es la monitorización terapéutica de las concentraciones plasmáticas de estos fármacos. Consiste en modificar las dosis de ARV en función de su concentración plasmática, para mantenerla dentro de unos límites terapéuticos previamente definidos, con el objetivo de mejorar la eficacia terapéutica y evitar la toxicidad2.
Se han realizado múltiples estudios que indican la utilidad de la monitorización terapéutica de inhibidores de la proteasa (IP) y de inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITNAN) en la práctica clínica, la mayoría realizados en adultos.
Pretendemos analizar los niveles de fármacos ARV en la práctica clínica en niños infectados por VIH y su influencia en la efectividad terapéutica.
MétodosDiseño y población de estudioSe trata de un estudio observacional, prospectivo y multicéntrico, que incluye pacientes controlados en 5 hospitales terciarios de Madrid, con consulta especializada en el tratamiento de infección pediátrica por VIH.
Se presentó el proyecto del trabajo de investigación ante la Comisión de Investigación y el Comité de Ética e Investigación Clínica, que aprobaron su realización.
Se incluyeron niños y niñas con infección por VIH de transmisión vertical, controlados en los hospitales participantes entre el 1 de marzo de 2006 y el 30 de junio de 2008. Los pacientes incluidos debían estar recibiendo tratamiento que incluyera IP o ITNAN, durante un mínimo de 4 semanas, en las dosis establecidas por las guías para el uso de ARV en infección pediátrica por VIH. Se seleccionaron los pacientes con independencia de la raza, la carga viral y el estadio inmunológico.
Se excluyeron del estudio los niños con infección por virus de la hepatitis C o B y con insuficiencia renal.
Obtención y procesamiento de las muestrasLas extracciones se realizaron en el laboratorio de cada hospital participante, en ayunas y antes de la toma de la siguiente dosis de medicación. Para evitar modificaciones en la adherencia habitual, no se informó a los niños y ni a los padres/tutores en qué extracción iban a determinarse las concentraciones de ARV.
Las muestras se procesaron en un laboratorio centralizado y se analizó la concentración plasmática de ARV en el momento predosis o concentración valle, salvo para efavirenz en que se determinó la concentración a las 12h de la dosis anterior. La determinación de niveles de fármacos se realizó mediante una técnica de cromatografía líquida de alta eficacia, de fase líquida y detector ultravioleta, validada en el Laboratorio de Farmacocinética del Hospital Clínico de Barcelona3.
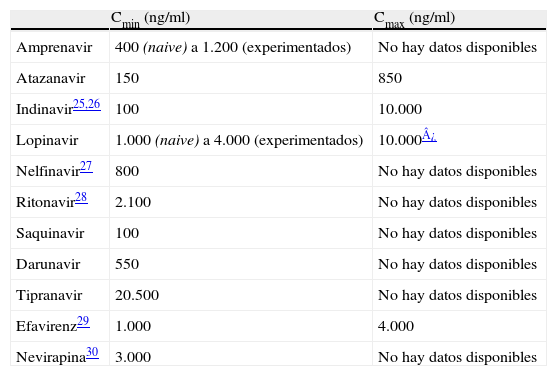
Para el estudio de los niveles plasmáticos, se tomaron como referencia los rangos establecidos como normales para adultos en distintos estudios4–6 y recogidos en www.hivpharmacology.com (tabla 1). Conforme a estos niveles de referencia, los resultados se clasificaron en 3 grupos: infraterapéuticos, normales y supraterapéuticos. No se incluyó en el análisis la concentración de ritonavir cuando éste era administrado en dosis no terapéutica (100 o 200mg), como potenciador de otros IP.
Rangos terapéuticos establecidos para inhibidores de la proteasa y para inhibidores de la transcriptasa inversa no análogos de los nucleósidos
| Cmin (ng/ml) | Cmax (ng/ml) | |
| Amprenavir | 400 (naive) a 1.200 (experimentados) | No hay datos disponibles |
| Atazanavir | 150 | 850 |
| Indinavir25,26 | 100 | 10.000 |
| Lopinavir | 1.000 (naive) a 4.000 (experimentados) | 10.000¿ |
| Nelfinavir27 | 800 | No hay datos disponibles |
| Ritonavir28 | 2.100 | No hay datos disponibles |
| Saquinavir | 100 | No hay datos disponibles |
| Darunavir | 550 | No hay datos disponibles |
| Tipranavir | 20.500 | No hay datos disponibles |
| Efavirenz29 | 1.000 | 4.000 |
| Nevirapina30 | 3.000 | No hay datos disponibles |
Cmax: concentración plasmática máxima; Cmin: concentración plasmática mínima.
Los niños se controlaron cada 3 meses en cada hospital, mediante entrevista clínica, exploración física y control analítico. El control de la adherencia al tratamiento se realizó, en cada visita, mediante cuestionario al paciente/tutor legal7 y recuento de comprimidos. El cumplimiento terapéutico se clasificó como bueno (toma de más del 90% de las dosis), regular (entre el 70 y el 90%) y malo (menos del 70%).
Análisis estadísticoSe controló la calidad de la información recibida, mediante la realización de un análisis exploratorio orientado a la detección de valores discrepantes, fuera de rango o ausentes.
Las variables se describieron mediante media, mediana y desviación típica (DT), en el caso de variables continuas, y frecuencia y porcentajes, en el caso de variables categóricas.
Para normalizar la distribución de la carga viral, se transformó en logaritmo decimal.
Se utilizaron análisis paramétricos como el test de la t de Student y ANOVA para comparar grupos. Asimismo, se aplicaron según el tamaño y condición de los grupos formados, análisis no paramétricos de rangos como el test de la U de Mann-Whitney o el análisis de variancia de Kruskall-Wallis.
Las curvas de supervivencia se realizaron con el método Kaplan-Meier y la comparación de éstas se realizó por el análisis de Log-rank (Mantel-Haenzel).
Todas las pruebas estadísticas se consideraron como bilaterales y se tomaron como valores significativos aquellos valores de p<0,05.
El análisis estadístico de los datos se realizó con el programa SPSS versión 15.0.
ResultadosCaracterísticas clínicas, analíticas y de tratamiento a la entrada en el estudioDurante el período de estudio se incluyó un total de 129 pacientes, con edades comprendidas entre los 4 meses y los 18 años. Setenta y un pacientes eran niñas (55%) y 58 eran niños (45%). La edad media a la entrada en el estudio fue de 134,7 meses (DT de 54,3 meses) y el tiempo medio de seguimiento fue de 19,5 meses (DT de 6,1 meses). No se produjo ningún fallecimiento ni ninguna pérdida en el seguimiento.
Las características clinicoanalíticas a la entrada en el estudio se detallan en la tabla 2.
Características basales clínicas, analíticas e inmunológicas de los pacientes incluidos en el estudio¿
| Niños | 58 (45%) |
| Niñas | 71 (55%) |
| Edad media (meses) | 134,7 (DT: 54,3) |
| IMC medio(kg/m2) | 18,3 (DT: 3,5) |
| Estadio Tanner | |
| 1 | 51 (39,5%) |
| 2 | 20 (15,5%) |
| 3 | 11 (8,5%) |
| 4 | 8 (6,2%) |
| 5 | 39 (30,2%) |
| Estadio inmunológico | |
| 1 | 31 (24%) |
| 2 | 36 (27,9%) |
| 3 | 62 (48,1%) |
| Estadio clínico | |
| A | 53 (41,1%) |
| B | 37 (28,7%) |
| C | 39 (30,2%) |
| Adherencia | |
| Buena | 88 (68,2%) |
| Regular | 29 (22,5) |
| Mala | 12 (9,3%) |
| Hemoglobina (g/dl)¿¿ | 13,3 (1,2) |
| Hematocrito (%)¿ | 39,6 (3,6) |
| VCM (μm3)¿ | 87 (7) |
| Leucocitos (/mm3)¿¿ | 7.139 (2.239) |
| Linfocitos (/mm3)¿¿ | 3.005 (1.330) |
| Plaquetas (/mm3)¿¿ | 288.966 (84.750) |
| Creatinina (mg/dl)¿¿ | 0,5 (0,15) |
| GOT (UI/l)¿¿ | 28 (10) |
| GPT (UI/l)¿¿ | 22 (13) |
| Colesterol (mg/dl)¿¿ | 182 (42) |
| Col-HDL (mg/dl)¿¿ | 56 (32) |
| Col-LDL (mg/dl)¿¿ | 104 (35) |
| Triglicéridos (mg/dl)¿¿ | 139 (97) |
| CD4 (mm3)¿¿ | 941 (552) |
| CD4 (%)¿¿ | 30,7 (9,1) |
| CD8 (mm3)¿¿ | 1132 (571) |
| CD8 (%)¿¿ | 38,6 (12,1) |
| Log10CV¿ | 2,34 (1,12) |
Col-HDL: colesterol unido a lipoproteínas de alta densidad; Col-LDL: colesterol unido a lipoproteínas de baja densidad; DT: desviación típica; GOT: aminotransferasa glutámico oxalacética; GPT: aminotransferasa glutámica pirúvica; IMC: índice de masa corporal; Log10CV: logaritmo decimal de la carga viral; VCM: volumen corpuscular medio.
En lo referente al régimen del TARGA que estaban recibiendo los pacientes a su entrada en el estudio, el tratamiento múltiple incluía, al menos, un IP en el 76,7% de los niños y, al menos, un ITNAN en el 47,3%. El tiempo medio del tratamiento ARV previo de los pacientes era de 39,2 meses (DT de 35,5 meses). El tiempo medio con ITAN previo era de 40 meses (DT de 34,5 meses), con ITNAN era de 42,9 meses (DT de 36,9 meses), con IP era de 35,5 meses (DT de 29,7 meses) y con inhibidores de la fusión era de 23,5 meses (DT de 17,7 meses). Las muestras se obtuvieron una media de 12h tras la última toma del fármaco (DT de 1,3h), con un rango que oscilaba entre 9 y 16h. No se hallaron diferencias en las concentraciones plasmáticas en función del momento de recogida de la muestra.
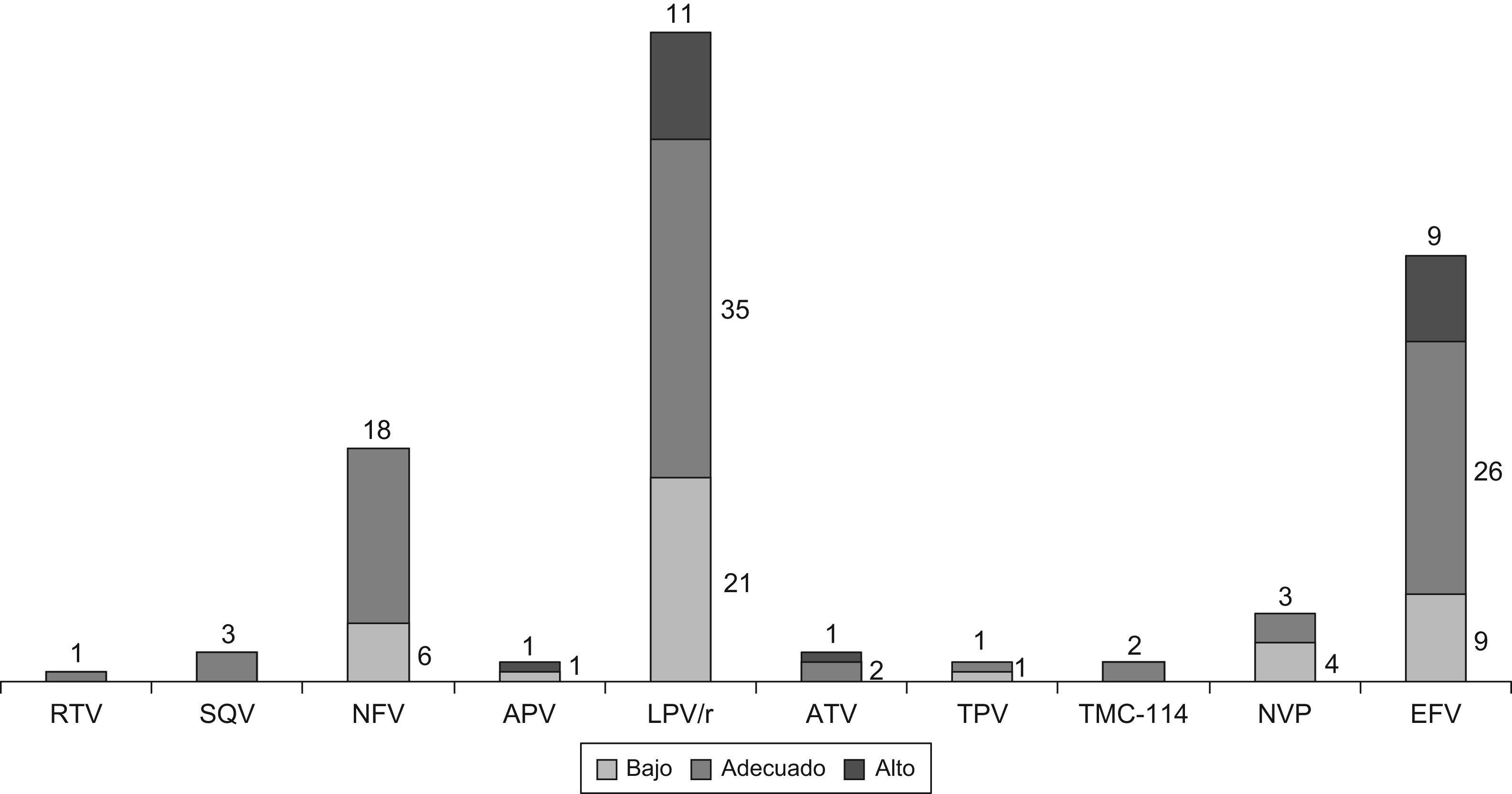
En las 129 muestras obtenidas al inicio del estudio se determinaron un total de 155 niveles plasmáticos de ARV, 51 de ITNAN y 104 de IP. A su entrada en el estudio, 42 pacientes (27,1%) tenían niveles de ARV infraterapéuticos y 22 pacientes (14,2%) tenían niveles plasmáticos en rango supraterapéutico. Sólo el 58,7% de los niños tenía concentraciones plasmáticas adecuadas. El tipo de nivel plasmático de cada fármaco se detalla en la figura 1.
Distribución de las concentraciones plasmáticas de los distintos antirretrovirales, expresado como número de pacientes. APV: amprenavir; ATV: atazanavir; EFV: efavirenz; LPV/r: lopinavir/ritonavir; NFV: nelfinavir; NVP: nevirapina; RTV: ritonavir; SQV: saquinavir; TMC-114: darunavir; TPV: tipranavir.
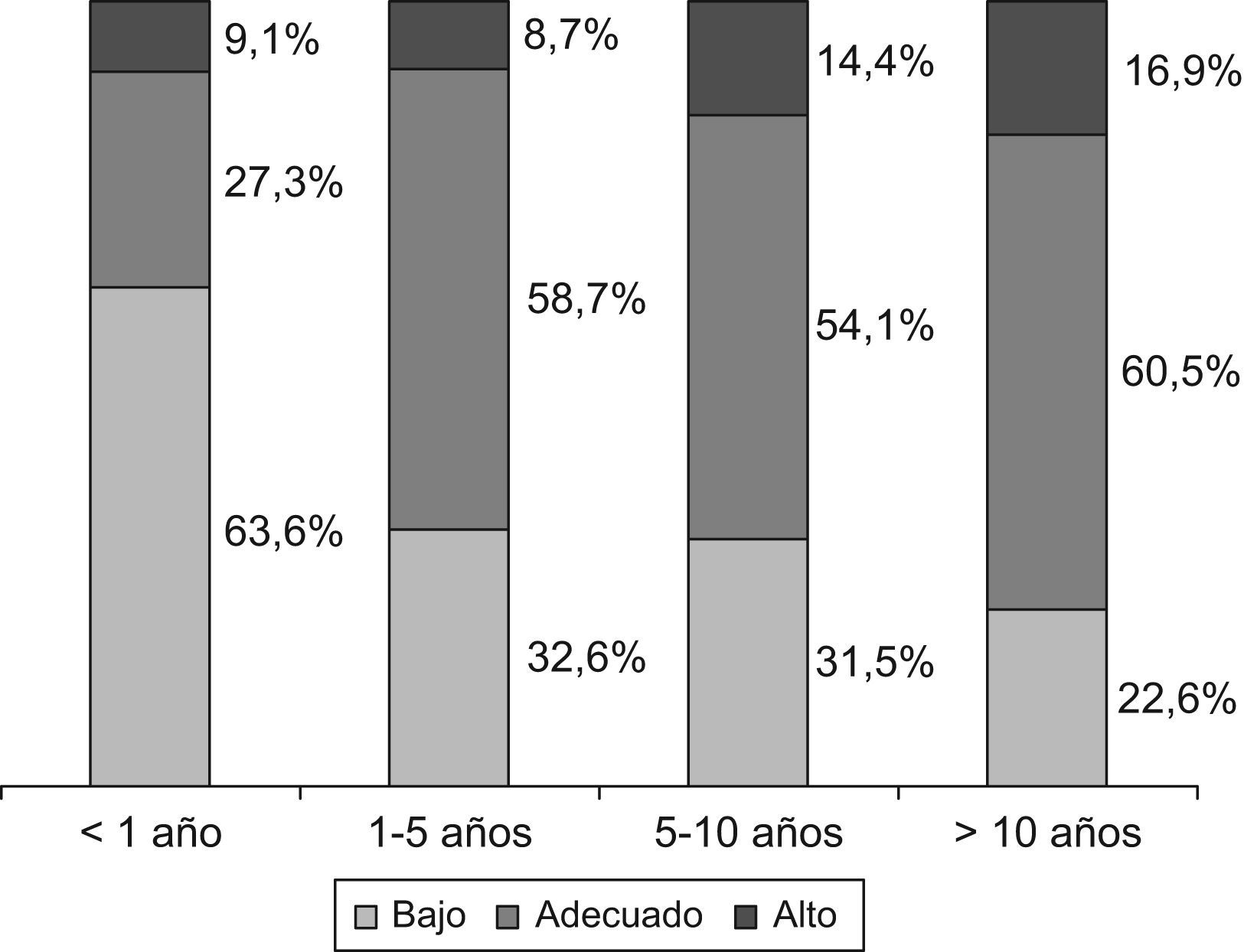
No se hallaron diferencias estadísticamente significativas en las concentraciones plasmáticas de ARV en función del sexo (p=0,32). En cuanto a la edad, se evaluaron las concentraciones plasmáticas de los ARV según el grupo de edad (menor de 1 año, 1–5 años, 5–10 años y mayor de 10 años) y se encontró que el grupo de pacientes menores de un año presentaba una prevalencia significativamente mayor que la esperada, de niveles infraterapéuticos (p=0,02) (fig. 2). Del mismo modo, los niños con estadio Tanner 1 presentaban mayor número de concentraciones plasmáticas bajas de ARV que el resto (p<0,001). Paralelamente, el grupo de niños menores de un año tenía una carga viral mayor que el resto y las diferencias resultaron estadísticamente significativas al compararlos con los demás grupos de edad: 1–5 años (p=0,008), 5–10 años (p=0,003) y más de 10 años (p=0,003).
Características evolutivas de la cohorteDurante los 28 meses de duración del estudio se realizó un total de 641 determinaciones de niveles plasmáticos de ARV, 421 concentraciones de IP y 220 concentraciones de ITNAN.
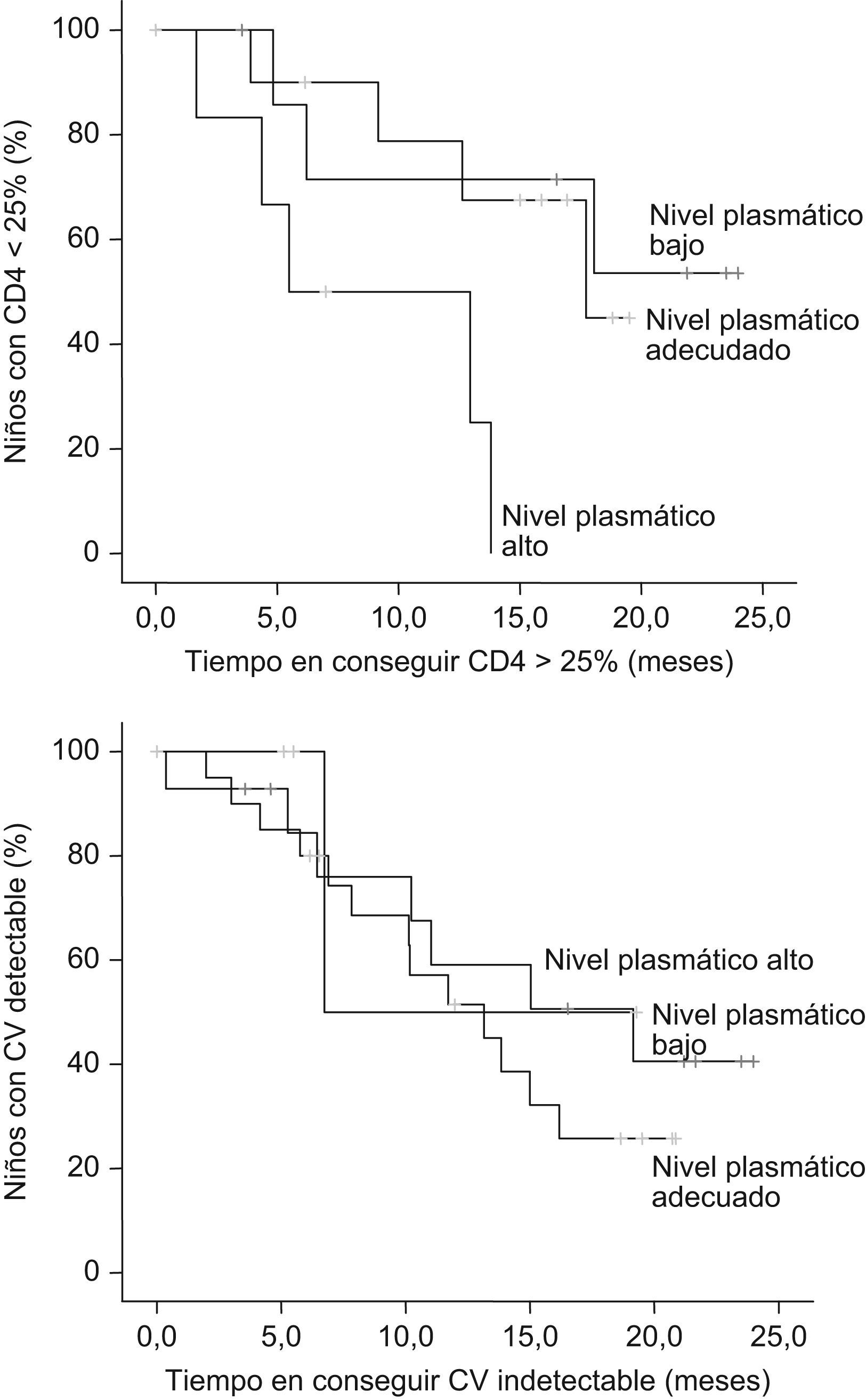
Los niños con niveles plasmáticos elevados consiguieron una carga viral indetectable en una mediana de 6,7 meses, frente a los 13,1 meses en el grupo de niveles adecuados y los 19,1 meses en el grupo de niveles bajos. Las diferencias no resultaron estadísticamente significativas (p=0,354) (fig. 3).
Se encontraron diferencias estadísticamente significativas entre los grupos de concentraciones plasmáticas bajas y altas (p=0,035) y adecuadas y altas (p=0,024), en cuanto al tiempo en alcanzar un recuento de linfocitos CD4 superior o igual al 25%. De manera que el tiempo medio en alcanzar linfocitos CD4 superiores o iguales al 25% fue de 8,6 meses en niños con niveles plasmáticos altos, de 15,6 meses en niños con niveles adecuados y de 17,6 meses en pacientes con niveles bajos (fig. 3).
La carga viral se mantuvo durante todo el seguimiento más elevada en los niños con niveles plasmáticos bajos. El porcentaje de linfocitos CD4 era óptimo en el grupo de pacientes con concentraciones plasmáticas adecuadas.
El grupo de pacientes con mala adherencia presentaba niveles infraterapéuticos con mayor frecuencia y niveles adecuados con menor frecuencia que el resto de los grupos, de forma estadísticamente significativa (p<0,001). Sin embargo, en el análisis de la evolución de niveles plasmáticos de ARV en función del tipo de adherencia al tratamiento no se encontraron diferencias estadísticamente significativas.
Los signos de lipodistrofia resultaron ligeramente superiores en el grupo de pacientes con niveles plasmáticos supraterapéuticos (22,8%) que en el grupo con niveles infraterapéuticos (16,9%) y adecuados (20,5%) (p=0,46). Entre los pacientes con signos de lipodistrofia, los que tenían niveles supraterapéuticos de IP presentaban mayor porcentaje de lipodistrofia grave (38,1%) que los que tenían niveles adecuados (13,9%) o bajos (11,1%) (p=0,039).
De los pacientes tratados con atazanavir, la mediana de bilirrubina total fue de 1,2mg/dl en los niños con concentración plasmática adecuada o infraterapéutica y de 2,5mg/dl en los niños con concentración plasmática supraterapéutica (p=0,037).
DiscusiónEn el programa conjunto de las Naciones Unidas y la Organización Mundial de la Salud sobre el VIH/sida8 se estima que durante el año 2007 vivían en el mundo 2,5 millones de niños con sida.
Los niños con infección por VIH constituyen una categoría extremadamente heterogénea y los datos farmacocinéticos y farmacodinámicos son limitados9. Todos los procesos farmacológicos sufren cambios a medida que el niño crece6 y la variabilidad es alta en la farmacocinética de IP y de ITNAN en la población pediátrica10. Los estudios farmacológicos realizados en niños demuestran, al igual que en adultos, una relación entre la concentración plasmática y la toxicidad y actividad antiviral11,12.
En nuestra muestra hemos observado que los niños con niveles plasmáticos adecuados de ARV son los que mantienen mejores cifras inmunológicas. Asimismo, hemos encontrado que los niños con concentraciones plasmáticas infraterapéuticas tardan más tiempo en alcanzar una carga viral indetectable y un porcentaje adecuado de linfocitos CD4 durante la evolución de la enfermedad. Precisamente estos datos analíticos se han descrito con anterioridad como los marcadores más precisos del pronóstico de la enfermedad13,14.
Por otro lado, hemos hallado relación entre concentraciones supraterapéuticas de ARV y toxicidad clínica y analítica.
La mayoría de los investigadores coinciden en que los niños con VIH podrían ser objeto de una monitorización terapéutica de fármacos, debido a la impredictibilidad de las concentraciones plasmáticas basadas en la dosis administrada15. Sin embargo, existen muy pocos datos de estudios concretos16–18. Los resultados obtenidos de nuestro estudio ilustran la necesidad de conseguir concentraciones plasmáticas de ARV por encima de un umbral, para suprimir la replicación viral en los niños.
En cuanto a la influencia de otros factores en las concentraciones plasmáticas de estos fármacos y, por tanto, en el éxito del TARGA, no hemos encontrado una influencia del género, aunque sí de la edad. Los niños menores de un año presentaban con mayor frecuencia niveles plasmáticos infraterapéuticos, así como mayor carga viral. Esta relación fue descrita también por parte del estudio de Capparelli et al, que demostraron que las concentraciones plasmáticas de ARV eran menores y más variables en los niños menores de 2 años que en los niños mayores y en los adultos19. Del mismo modo, hemos encontrado una mayor frecuencia de niveles infraterapéuticos en los niños en estadio prepuberal. Probablemente, la maduración enzimática hepática, polimorfismos enzimáticos, cambios en la absorción intestinal y otros factores del desarrollo podrían justificar estos hallazgos.
A pesar de que no hemos encontrado diferencias estadísticamente significativas, una mala adherencia al tratamiento se asocia, en nuestro estudio, con mayor frecuencia de concentraciones plasmáticas infraterapéuticas.
En España se han realizado algunos estudios sobre la utilidad de la monitorización terapéutica de ARV para el tratamiento de pacientes con infección por VIH: el estudio de Rodríguez-Novoa con 56 pacientes20, los realizados por Molto con 8521 y 117 pacientes22, y el de Casado con 59 pacientes23. Todos ellos indican que la monitorización es útil. Sin embargo, ninguno de éstos se ha realizado en la población pediátrica. La actitud tomada por los facultativos encargados ante los distintos resultados analíticos fue distinta e individualizada en cada paciente, ya que no existen recomendaciones estandarizadas a este respecto.
Hasta donde podemos saber, nuestro trabajo es de los pocos, si no el único, realizado en la población infantil de forma multicéntrica en España. Este estudio tiene algunas limitaciones, como el escaso número de pacientes y la recogida de parte de los datos de forma retrospectiva. La falta de rangos terapéuticos de referencia para la edad pediátrica es otra limitación, común al resto de estudios de las mismas características. No obstante, la medición de concentraciones plasmáticas de ARV en niños podría resultar útil en casos con sospecha de toxicidad, fallo viral o problemas en el cumplimiento terapéutico.
La prevalencia encontrada en nuestro trabajo de niveles plasmáticos de ARV inadecuados es del 41,3% en niños. Podría existir, por tanto, un alto riesgo de supresión viral incompleta, especialmente en los niños pequeños, y esto podría conducir al desarrollo temprano de resistencias en este grupo de edad24.
En conclusión, las concentraciones plasmáticas de ARV son infraterapéuticas con mayor frecuencia en los niños menores de un año o en estadio prepuberal de nuestro estudio. Este hallazgo se relaciona con mayor fallo viral y supone un reto importante en esta población, que requiere un tratamiento a muy largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste trabajo ha sido financiado por fondos de la Fundación para la Investigación y Prevención del Sida en España, fondos de Investigación Sanitaria (FIS PI061479), Red RIS RD06-0006-0035, Fundación Caja Navarra y Comunidad de Madrid (S-SAL-0159-2006).