Acinetobacter baumannii es un patógeno oportunista considerado de baja virulencia que se caracteriza por su gran capacidad de diseminación en el ambiente hospitalario y por su facilidad para adquirir resistencia a los antimicrobianos usados en clínica, incluidos los de amplio espectro, como los carbapenemes1. La resistencia a carbapenemes en A. baumannii suele estar mediada por la producción de betalactamasas (fundamentalmente oxacilinasas y, en menor medida, metalo-betalactamasas)1,2, aunque no se pueden descartar otros mecanismos de resistencia, como la hiperproducción de AMPc en cepas deficientes en porinas, la sobreexpresión de bombas de flujo o alteraciones en las proteínas fijadoras de penicilina3.
El fenómeno de heterorresistencia a los antimicrobianos consiste en la presencia de subpoblaciones resistentes minoritarias en una población sensible. La heterorresistencia en A. baumannii se ha descrito con colistina4 y los carbapenemes5 y puede detectarse fenotípicamente por la presencia de colonias en el interior del halo de inhibición de discos o tiras de E-test. No existen datos en la literatura médica sobre la utilidad de los métodos de microdilución en caldo para detectar cepas de A. baumannii heterorresistente a carbapenemes. Además, se desconoce cuál es la causa o los mecanismos de resistencia a carbapenemes implicados en estas cepas y no existe experiencia sobre la utilidad clínica de carbapenemes en infecciones causadas por cepas de A. baumannii heterorresistente a carbapenemes.
El objetivo de este estudio fue determinar si existe concordancia entre tres métodos para determinar la sensibili-dad/resistencia a carbapenemes de A. baumannii con fenotipo heterorresistente a carbapenemes.
MétodosSe incluyen 30 aislados clínicos de A. baumannii obtenidos desde febrero de 2006 hasta enero de 2007 de muestras de orina (n = 14), aspirado traqueal/bronquial (n = 10), exudado de herida (n = 4), sangre (n = 1), y líquido ascítico (n = 1) de pacientes ingresados en el Hospital Universitario Virgen Macarena de Sevilla. Los aislados se seleccionaron en función de las cantidades inhibitorias mínimas (CIM) de imipenem o meropenem determinadas con el sistema Wider I (Francisco Soria Melguizo, S.A., Madrid, España): 1 mg/l (4 aislados); 2, 4 u 8 mg/l (24 aislados); y 8 mg/l (2 aislados). La identificación bacteriana se realizó usando los sistemas Wider I y Api 20 NE (bioMérieux API, Marcy l’Étoile, Francia) y el crecimiento a 44 °C en caldo común. La relación clonal de los aislados se determinó mediante amplificación por reacción en cadena de la polimerasa de elementos palindrómicos extragénicos repetitivos (REP-PCR)6. El medio utilizado para determinar la heterorresistencia fue agar Mueller-Hinton (Difco, España). La heterorresistencia a carbapenemes se definió por la presencia de colonias de A. baumannii en el interior de los halos de inhibición de tiras de E-test (AB Biodisk, Suecia) y discos (Oxoid, España) con imipenem y/o meropenem.
Las CIM de imipenem y meropenem se determinaron mediante Wider I, microdilución en caldo Mueller-Hinton (recomendaciones del Clinical and Laboratory Standards Institute [CLSI])7 y E-test. Las lecturas fueron realizadas por tres observadores. Los resultados de CIM determinados por dos métodos se consideraron concordantes si existía una diferencia de ± 1log2. Los errores de categoría clínica se determinaron comparando los resultados obtenidos con Wider I, E-test y discos con los determinados por microdilución (método de referencia).
Con el objeto de determinar la frecuencia de las subpoblaciones heterorresistentes se utilizó un aislado (Acinetobacter baumannii 98.06 [Ab 98.06]) representativo del clon más prevalente. Se prepararon placas de agar con concentraciones de imipenem y meropenem equivalentes a 2, 4, 8 y 16 veces su respectivo valor de CIM (8 mg/l para imipenem y 4 mg/l para meropenem) y se inocularon con 0,1 ml de una suspensión bacteriana del aislado Ab 98.06 preparada en solución salina a una concentración equivalente a un 0,5 de Mc-Farland.
El aislado Ab 98.06 y una de las colonias que crecen dentro del halo de inhibición con meropenem se subcultivaron 10 veces en agar sin meropenem y en agar con meropenem en una concentración de 2 mg/l. Posteriormente se determinó si el fenómeno de heterorresistencia se reproducía usando tiras de E-test y discos de meropenem.
ResultadosSe obtuvieron seis patrones diferentes de REP-PCR o genotipos (2, 3, 4, 6, 9A y 9B). El 67% de los aislados pertenecían al mismo clon y el 83% de los 30 aislados fueron heterorresistentes a carbapenemes (fig. 1). La relación entre genotipo y CIM de imipenem fue: genotipo 9A (dos aislados; CIM de 0,5 y 2 mg/l, respectivamente), genotipo 9B (un aislado; CIM de 0,5 mg/l), genotipo 4 (uno aislado; CIM de 4 mg/l), genotipo 3 (un aislado; CIM de 64 mg/l), genotipo 2 (cuatro aislados; CIM de 0,5, 2, 4 y 8 mg/l, respectivamente) y genotipo 6 (21 aislados; CIM de 0,5 mg/l para un aislado, 2 mg/l para un aislado, 4 mg/l para nueve aislados, 8 mg/l para nueve aislados y 16 mg/l para un aislado).
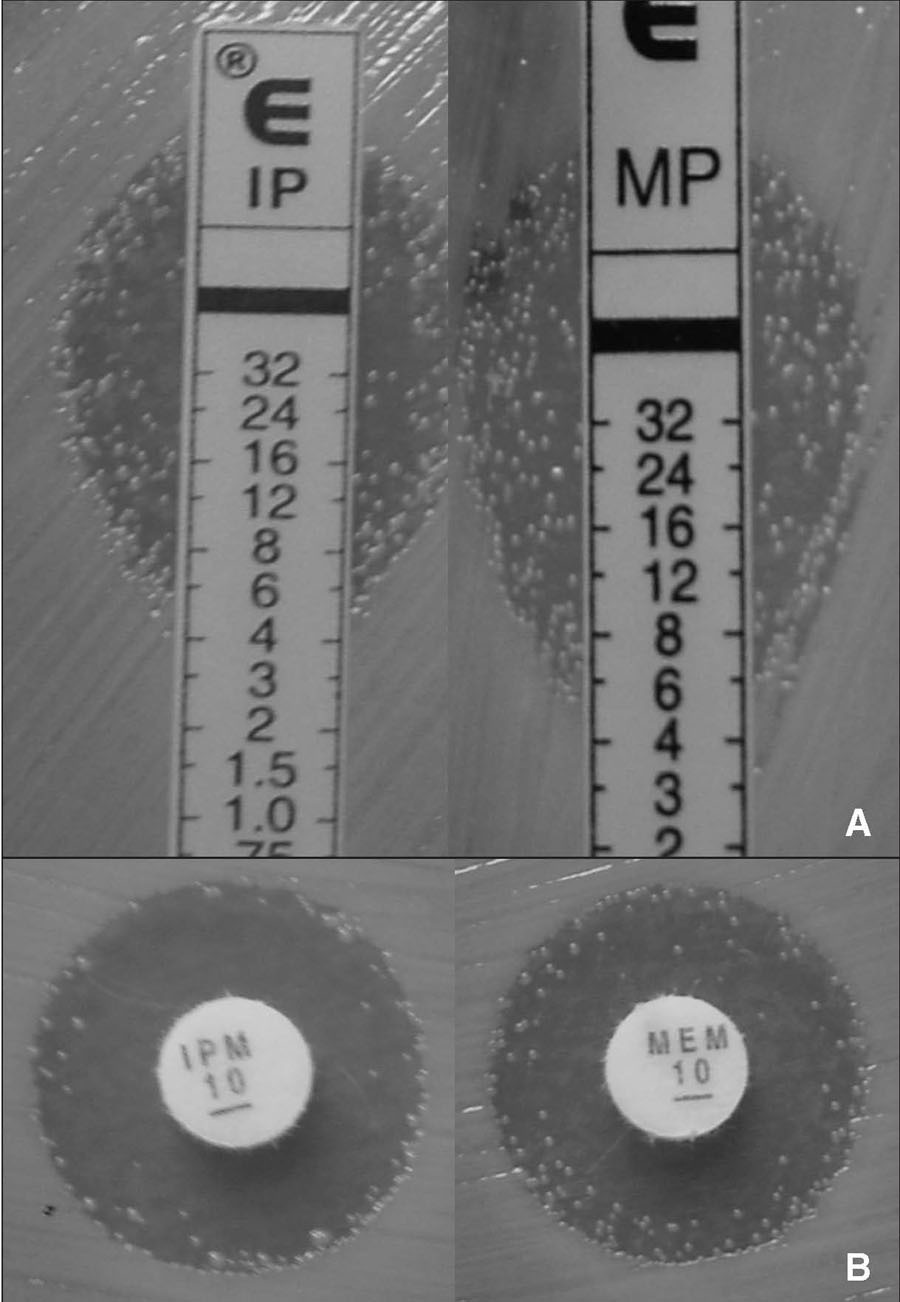
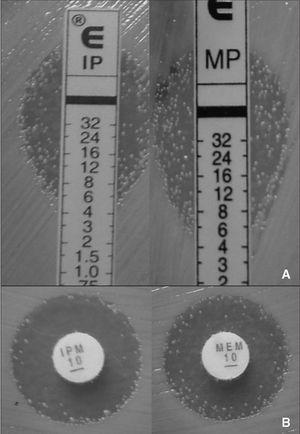
Figura 1. Detección de heterorresistencia a imipenem y meropenem en Acinetobacter baumannii mediante E-test (panel A) y difusión con discos (panel B).
El análisis de los resultados se realizó de dos maneras, una sin considerar las colonias resistentes que crecen en el interior de los halos de inhibición de las tiras de E-test y los discos de imipenem y/o meropenem, y otra considerando dichas colonias. En los aislados heterorresistentes, la concordancia en las CIM de imipenem y meropenem sin considerar las colonias resistentes fue la siguiente: el 96% para imipenem y el 100% para meropenem al comparar Wider I y la microdilución, el 50% para imipenem y el 64% para meropenem al comparar Wider I y E-test, y el 64% para imipenem y el 60% para meropenem al comparar la microdilución y E-test. Los resultados discrepantes obtenidos al comparar los tres métodos (Wider I y microdilución, Wider I y E-test, microdilución y E-test) se debieron a que las CIM obtenidas con el primer método fueron cuatro o más veces más bajas que las determinadas por el segundo método.
La concordancia en las CIM de imipenem y meropenem teniendo en cuenta las colonias resistentes de los aislados heterorresistentes fue: el 8% para imipenem y el 12% para meropenem al comparar Wider I y E-test, y el 8% para imipenem y meropenem al comparar la microdilución y E-test.
Al comparar las categorías clínicas para imipenem y meropenem no se observaron errores máximos (aislado sensible por Wider I, E-test o discos y resistente por microdilución). Como puede verse en la tabla 1, los errores menores y los errores mayores (aislado resistente por Wider I, E-test o discos y sensible por microdilución) fueron muy elevados, especialmente cuando se compara la microdilución frente a los métodos de difusión en agar (E-test y discos) y se consideran las colonias que crecen en el interior de los halos de inhibición.
TABLA 1. Errores en las categorías clínicas para imipenem y meropenem en los aislados de A. baumannii heterorresistentes a carbapenemes
En los aislados no heterorresistentes la concordancia en las CIM de imipenem y meropenem fue del 100% para imipenem y meropenem al comparar Wider I y la microdilución, y del 100% para imipenem y el 75% para meropenem al comparar Wider I y la microdilución frente a E-test.
Las frecuencias de las subpoblaciones resistentes a carbapenemes en presencia de concentraciones de meropenem de 8 y 16 mg/l fueron superiores (8-2 × 10–7 ufc/ml) a las obtenidas en presencia de 8 mg/l de imipenem (3 × 10–8 ufc/ml). En ninguna de las demás concentraciones evaluadas (32-128 mg/l para meropenem y 16-128 mg/l para imipenem) se observó crecimiento de colonias.
Después de subcultivar 10 veces el aislado Ac 98.06 y una colonia resistente a carbapenemes en un medio con carbapenemes las CIM de imipenem y meropenem se incrementaron hasta valores mayores o iguales a 32 mg/l (E-test) y presentaron heterorresistencia a carbapenemes (difusión con discos). La colonia resistente a carbapenemes subcultivada en medio sin carbapenemes reprodujo la heterorresistencia a imipenem y meropenem de igual modo que el aislado Ac 98.06.
DiscusiónLa heterorresistencia a carbapenemes en A. baumannii fue descrita por primera vez en 2005 por Pournaras et al5. Éste es el único estudio relacionado con la heterorresistencia a carbapenemes que se ha publicado hasta el momento, lo que explica que aún se desconozcan aspectos básicos como la prevalencia de las cepas de A. baumannii heterorresistente a carbapenemes y los mecanismos de resistencia implicados. Además, dado que no hay estudios que valoren la eficacia de los carbapenemes en infecciones causadas por A. baumannii heterorresistente a carbapenemes, este fenotipo de resistencia debe ser detectado en el laboratorio, puesto que es probable que dichas sub-poblaciones resistentes se seleccionen en presencia de imipenem o meropenem produciendo o condicionando el fracaso terapéutico.
Los resultados obtenidos en este estudio demuestran que existe una buena concordancia cuando se comparan entre sí los dos métodos basados en la microdilución (Wider I y microdilución). En cambio, la correlación entre los métodos basados en la microdilución y los métodos basados en la difusión en agar (E-test y discos) es muy baja, sobre todo cuando la lectura e interpretación de los resultados se realiza teniendo en cuenta las colonias resistentes que crecen en el interior de los halos de inhibición de las tiras de E-test. Las discrepancias en las CIM de imipenem y meropenem obtenidas mediante E-test se debieron a que con este método los valores de CIM fueron cuatro veces o más superiores a las determinadas con el sistema Wider I o la microdilución. Estas discrepancias se tradujeron en un elevado porcentaje de errores menores y errores mayores, que fue particularmente más evidente en los aislados en los que las CIM fueron iguales al punto de corte de 4 mg/l establecido por el CLSI para imipenem y meropenem.
Entre las posibles causas o factores que podrían explicar las discrepancias observadas en este estudio habría que considerar la composición o el tipo de medio con agar usado para detectar la heterorresistencia. Sin embargo, aún no hay datos disponibles para A. baumannii heterorresistente que apoyen esta hipótesis.
Posiblemente, las diferencias observadas con los métodos de microdilución y difusión en agar se deban a que la concentración de inóculo usada en los métodos de microdilución (2,5 × 104 ufc/pocillo; método de referencia) es unas 200 veces inferior a la usada en los métodos de difusión en agar (0,5 × 107 ufc/placa). La frecuencia con la que aparecían subpoblaciones resistentes a imipenem y meropenem fue relativamente baja (3 × 10–8 ufc/ml para imipenem y 2-8 × 10–7 ufc/ml para meropenem), lo que podría explicar en parte por qué no se detectan estas subpoblaciones cuando se utilizan métodos para determinar la sensibilidad a carbapenemes basados en la microdilución. La frecuencia de las subpoblaciones heterorresistentes a meropenem fue unas 10 veces más elevada que la de las sub-poblaciones resistentes a imipenem. Esta observación puede explicar por qué en los aislados de A. baumannii heterorresistentes estudiados el número de colonias resistentes que crecen en el interior de los halos de inhibición es siempre mayor con meropenem que con imipenem.
Después de varios subcultivos en ausencia de carbapenemes la subpoblación resistente derivada del aislado Ab 98.06 se comportó igual que la población heterorresistente. Este fenómeno es idéntico al descrito por Pournaras et al5 con aislados de A. baumannii heterorresistentes a carbapenemes procedentes de Grecia, y sugiere que la heterorresistencia podría estar más relacionada con la inducción de resistencia en la población heterorresistente en presencia de carbapenemes que con la selección de subpoblaciones resistentes estables.
A diferencia de los resultados obtenidos por Pournaras et al5 con los subcultivos de las subpoblaciones resistentes y del aislado heterorresistente de nuestro estudio determinadas tras varios subcultivos con imipenem o meropenem, se incrementó al menos dos diluciones, lo que sugiere que pueden existir diferencias en los mecanismos implicados en la heterorresistencia de las cepas de A. baumannii usadas en el estudio de Pournaras et al5 y las cepas de A. baumannii de nuestro estudio.
Finalmente, cabe destacar que los dos clones mayoritarios de nuestro estudio (clones 6 y 2) estuvieron representados por aislados heterorresistentes, y por uno o varios aislados no heterorresistentes, lo que indicaría que en A. baumannii la clonalidad no está relacionada con la heterorresistencia a carbapenemes.
En conclusión, los métodos de determinación de la sensibilidad a carbapenemes basados en la microdilución en caldo no son útiles para detectar A. baumannii con fenotipo heterorresistente a carbapenemes.
AgradecimientosFinanciado por el Ministerio de Sanidad y Consumo, el Instituto de Salud Carlos III-FEDER y la Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Correspondencia: Dr. F. Fernández-Cuenca. Servicio de Microbiología. Hospital Universitario Virgen Macarena. Avda. Doctor Fedriani, 3. 41009 Sevilla. España. Correo electrónico: felipefc@us.es
Manuscrito recibido el 5-9-2007; aceptado el 24-1-2008.