gracias a los avances en la técnica quirúrgica y en el manejo clínico de los receptores de trasplante renal (TR), las infecciones han disminuido su incidencia. Sin embargo, continúan siendo frecuentes y cambiantes en función, en parte, de la profilaxis y la etiología local.
Métodoestudio prospectivo y observacional de las infecciones en pacientes con TR realizado entre julio de 2003 y diciembre de 2005, durante los 2 primeros años postrasplante. Se ha realizado un análisis univariado y multivariado de los factores de riesgo asociados al desarrollo de infecciones.
Resultadosla incidencia de infección fue de 1,1 episodios/paciente durante 510±234 días. Los síndromes más frecuentes fueron: infección del tracto urinario (46,6%), infección por citomegalovirus (CMV) (22,7%) e infección de la herida quirúrgica (8%). La etiología fue: bacteriana (50,4%), viral (45,9%) y fúngica (3,6%). Los microorganismos más frecuentes fueron: CMV (36%), Escherichia coli (28%) —el 26% era productora de betalactamasas de espectro extendido (BLEE)—, y Staphylococcus coagulasa negativo (6,3%). El 79% de los episodios sucedieron en los 4 primeros meses postrasplante. Un paciente falleció a los 30 días del episodio de infección. La supervivencia del paciente y del injerto con infección al final del seguimiento fue del 98 y 89%, respectivamente.
Conclusioneslos síndromes más frecuentes son la infección del tracto urinario, la infección por CMV y la infección de la herida quirúrgica. Las infecciones bacterianas son mayoritarias, predominando los bacilos gramnegativos con una elevada tasa de E. coli productor de BLEE.
The incidence of infections has decreased in kidney transplant (KT) recipients owing to advances in the surgical techniques and clinical management of this population. Nevertheless, these complications continue to occur and the causes seem to be changing, in part because of the prophylactic strategies used.
MethodProspective, observational study investigating infections occurring during the first 2 years post-transplantation in KT recipients who underwent surgery between July 2003 and December 2005 at Hospital Universitario Virgen del Rocío. Univariate and multivariate regression analysis was performed to determine risk factors associated with the development of infection.
ResultsThe incidence of infection was 1.11 episodes per patient over 510±234 days. The most common infections were urinary tract infection (UTI) (46.6%), cytomegalovirus (CMV) infection (22.7%), and surgical site infection (8%). The causes were bacterial (50.4%), viral (45.9%), and fungal (3.6%) agents. The most frequent pathogens were CMV (36%), Escherichia coli (28%), extended-spectrum β-lactamase (ESBL)-producers (26%), and coagulase-negative staphylococci (6.3%). Seventy-nine percent of infection episodes occurred in the 4 months following KT. One recipient died 30 days after the infection episode. In the infection group, patient and graft survival at the end of follow-up was 98% and 89%, respectively.
ConclusionsThe most frequent syndromes were UTI, CMV infection and surgical site infection. The infections were mainly produced by bacteria, in particular gram-negative rods, and there was a high rate of ESBL E. coli.
Antes de 1980, el 60% de los receptores de trasplante renal (TR) tenía al menos un episodio infeccioso grave durante el primer año postrasplante (post-TR) con una mortalidad aproximada del 50%1. Dicha tasa ha disminuido significativamente en los últimos años, y actualmente es<5%2,3 gracias a los importantes avances en las técnicas quirúrgicas y de preservación de los órganos, en la inmunosupresión y en las pautas de profilaxis antimicrobiana utilizadas en estos pacientes4–6. Sin embargo, las complicaciones infecciosas continúan siendo una importante amenaza en la buena evolución del injerto6–8. Los microorganismos responsables de estos episodios pueden ser endógenos del receptor, procedentes del injerto o procedentes del medio externo o comunitario9.
El objetivo de este estudio es conocer la incidencia, la etiología, los factores de riesgo y el pronóstico de las complicaciones infecciosas durante los 2 primeros años post-TR.
MétodoSe incluyeron todos los pacientes adultos que recibieron un TR entre julio de 2003 y diciembre de 2005 en el Hospital Universitario Virgen del Rocío de Sevilla. Todos los pacientes se siguieron durante los 2 primeros años postrasplante, hasta la muerte o el final del estudio (30 de junio de 2006).
Criterios de infecciónLos criterios de infección utilizados son los correspondientes a las citas bibliográficas de los siguientes síndromes: infección del tracto urinario (ITU)10, pielonefritis11, infección por citomegalovirus (CMV)12, infección de herida quirúrgica13, neumonía bacteriana14, infección cutánea15 e infección de catéter16,17.
Criterio de rechazoSe ha utilizado la escala de clasificación del rechazo de Banff18.
Manejo clínico de los pacientesSe empleó amoxicilina-clavulánico como profilaxis antibiótica. Todos los pacientes recibieron profilaxis frente a Pneumocytis jirovecii y Toxoplasma gondii con cotrimoxazol.
Se consideraron pacientes de alto riesgo de infección por CMV los que presentaron una serología frente al virus de receptor negativo/donante positivo. En estos pacientes se estableció como pauta de prevención la profilaxis con valganciclovir durante 3 meses. El procedimiento utilizado para la detección de la replicación de CMV es la detección de antigenemia de CMV en leucocitos de sangre periférica. Como punto de corte para iniciar tratamiento se ha considerado cualquier valor de replicación viral en pacientes de alto riesgo y más de 25 leucocitos infectados/100.000 en pacientes de bajo riesgo.
EstadísticaLos datos descritos de variables continuas se expresan como media±desviación estándar o como mediana y rango. Las variables cualitativas se expresan como porcentaje. Se realizó un análisis univariado de los factores de riesgo de infección mediante χ2 para variables cualitativas y mediante la t de Student o no paramétricos para las variables cuantitativas. Se realizó posteriormente un análisis multivariado mediante un modelo de regresión logística múltiple, para ajustar los posibles factores de confusión. Los factores incluidos en dicho análisis fueron los relacionados con el desarrollo de infección en el análisis univariado y los que, a pesar de tener p⩾0,05, fueron considerados de relevancia clínica.
ResultadosEn el período de estudio se incluyeron 159 pacientes, de los cuales 87 (54,7%) fueron varones, con una edad media de 46±12 años. El tiempo de seguimiento medio fue de 510±234 días.
Ciento treinta y tres receptores (83,6%) recibieron tratamiento inmunosupresor con triple terapia (esteroides, antagonistas de la calcineurina y mofetil micofenolato) y 26 (16,4%) con doble terapia (esteroides y antagonistas de la calcineurina). Ochenta y seis pacientes (54%) recibieron tratamiento de inducción con daclizumab.
Ochenta y cinco pacientes (53,5%) presentaron al menos una complicación infecciosa durante el período de seguimiento. El número total de episodios de infección fue 176 (1,1 episodios/paciente), siendo la densidad de incidencia 0,24 episodios por 100 pacientes/día y la incidencia 79,2 episodios por 100 pacientes/año.
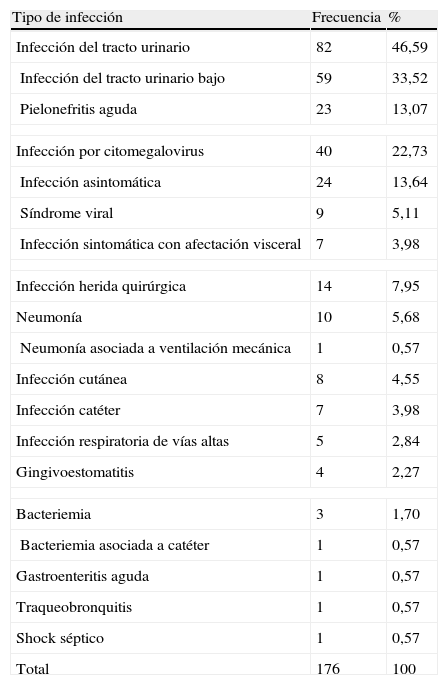
Los síndromes infecciosos más frecuentes fueron: 82 casos (46,6%) de ITU, 40 (22,7%) infecciones por CMV y 14 (8%) infecciones de la herida quirúrgica. El resto de los síndromes se detallan en la tabla 1.
Tipos de infección
| Tipo de infección | Frecuencia | % |
| Infección del tracto urinario | 82 | 46,59 |
| Infección del tracto urinario bajo | 59 | 33,52 |
| Pielonefritis aguda | 23 | 13,07 |
| Infección por citomegalovirus | 40 | 22,73 |
| Infección asintomática | 24 | 13,64 |
| Síndrome viral | 9 | 5,11 |
| Infección sintomática con afectación visceral | 7 | 3,98 |
| Infección herida quirúrgica | 14 | 7,95 |
| Neumonía | 10 | 5,68 |
| Neumonía asociada a ventilación mecánica | 1 | 0,57 |
| Infección cutánea | 8 | 4,55 |
| Infección catéter | 7 | 3,98 |
| Infección respiratoria de vías altas | 5 | 2,84 |
| Gingivoestomatitis | 4 | 2,27 |
| Bacteriemia | 3 | 1,70 |
| Bacteriemia asociada a catéter | 1 | 0,57 |
| Gastroenteritis aguda | 1 | 0,57 |
| Traqueobronquitis | 1 | 0,57 |
| Shock séptico | 1 | 0,57 |
| Total | 176 | 100 |
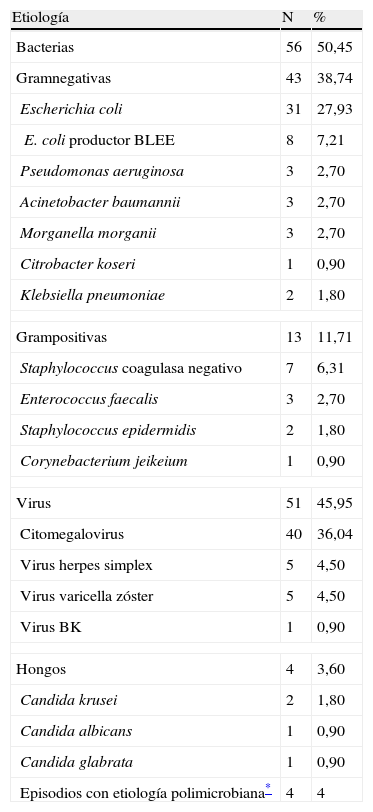
Se estableció el diagnóstico etiológico de 107 episodios de infección (61%), 4 (4%) de los cuales tuvieron una etiología polimicrobiana. La etiología agrupada de estos episodio fue: en 56 casos (50,4%) bacteriana, en 51 (45,9%) viral y en 4 (3,6%) fúngica. Los microorganismos más frecuentes fueron: CMV (36,04%), Escherichia coli (27,93%) y Staphylococcus coagulasa negativo (6,31%). Con respecto a E. coli, cabe destacar que 8 (25,8%) eran productores de betalactamasas de espectro extendido (BLEE) (el 7,21% del global de las etiologías). Este microorganismo fue aislado en 8 pacientes (5,03%), y no se produjo ningún caso de recidiva por él. La etiología de las complicaciones infecciosas se muestra en la tabla 2.
Etiología de las infecciones
| Etiología | N | % |
| Bacterias | 56 | 50,45 |
| Gramnegativas | 43 | 38,74 |
| Escherichia coli | 31 | 27,93 |
| E. coli productor BLEE | 8 | 7,21 |
| Pseudomonas aeruginosa | 3 | 2,70 |
| Acinetobacter baumannii | 3 | 2,70 |
| Morganella morganii | 3 | 2,70 |
| Citrobacter koseri | 1 | 0,90 |
| Klebsiella pneumoniae | 2 | 1,80 |
| Grampositivas | 13 | 11,71 |
| Staphylococcus coagulasa negativo | 7 | 6,31 |
| Enterococcus faecalis | 3 | 2,70 |
| Staphylococcus epidermidis | 2 | 1,80 |
| Corynebacterium jeikeium | 1 | 0,90 |
| Virus | 51 | 45,95 |
| Citomegalovirus | 40 | 36,04 |
| Virus herpes simplex | 5 | 4,50 |
| Virus varicella zóster | 5 | 4,50 |
| Virus BK | 1 | 0,90 |
| Hongos | 4 | 3,60 |
| Candida krusei | 2 | 1,80 |
| Candida albicans | 1 | 0,90 |
| Candida glabrata | 1 | 0,90 |
| Episodios con etiología polimicrobiana* | 4 | 4 |
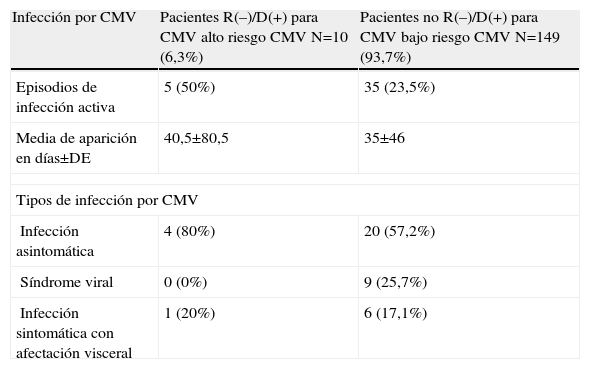
En 33 pacientes se diagnosticaron 40 episodios de infección por CMV (20,75%), que en 24 casos (60%) se manifestaron como infección asintomática, en 9 (22,5%) como síndrome viral y en 7 (17,5%) como infección sintomática con afectación visceral (gastritis 5, esofagitis 1 y pielonefritis 1). De los 10 pacientes con serología de alto riesgo para CMV, 5 (50%) tuvieron la infección: en 4 fue asintomática (días 26, 39, 92, 123), en 1 fue una infección sintomática con afectación visceral (gastrointestinal) a los 60 días, y no se produjo ningún caso de recidiva. La media de aparición de la enfermedad por CMV en pacientes de alto y bajo riesgo fue de 40,5 y 35 días, respectivamente (p>0,05) (tabla 3).
Episodios de infección por citomegalovirus (CMV)
| Infección por CMV | Pacientes R(–)/D(+) para CMV alto riesgo CMV N=10 (6,3%) | Pacientes no R(–)/D(+) para CMV bajo riesgo CMV N=149 (93,7%) |
| Episodios de infección activa | 5 (50%) | 35 (23,5%) |
| Media de aparición en días±DE | 40,5±80,5 | 35±46 |
| Tipos de infección por CMV | ||
| Infección asintomática | 4 (80%) | 20 (57,2%) |
| Síndrome viral | 0 (0%) | 9 (25,7%) |
| Infección sintomática con afectación visceral | 1 (20%) | 6 (17,1%) |
DE: desviación estándar.
Cuatro pacientes (2,51%) tuvieron algún episodio de infección fúngica, 2 fueron casos de cistitis en pacientes portadores de sonda y 2 de infección de la herida quirúrgica por Candida spp.
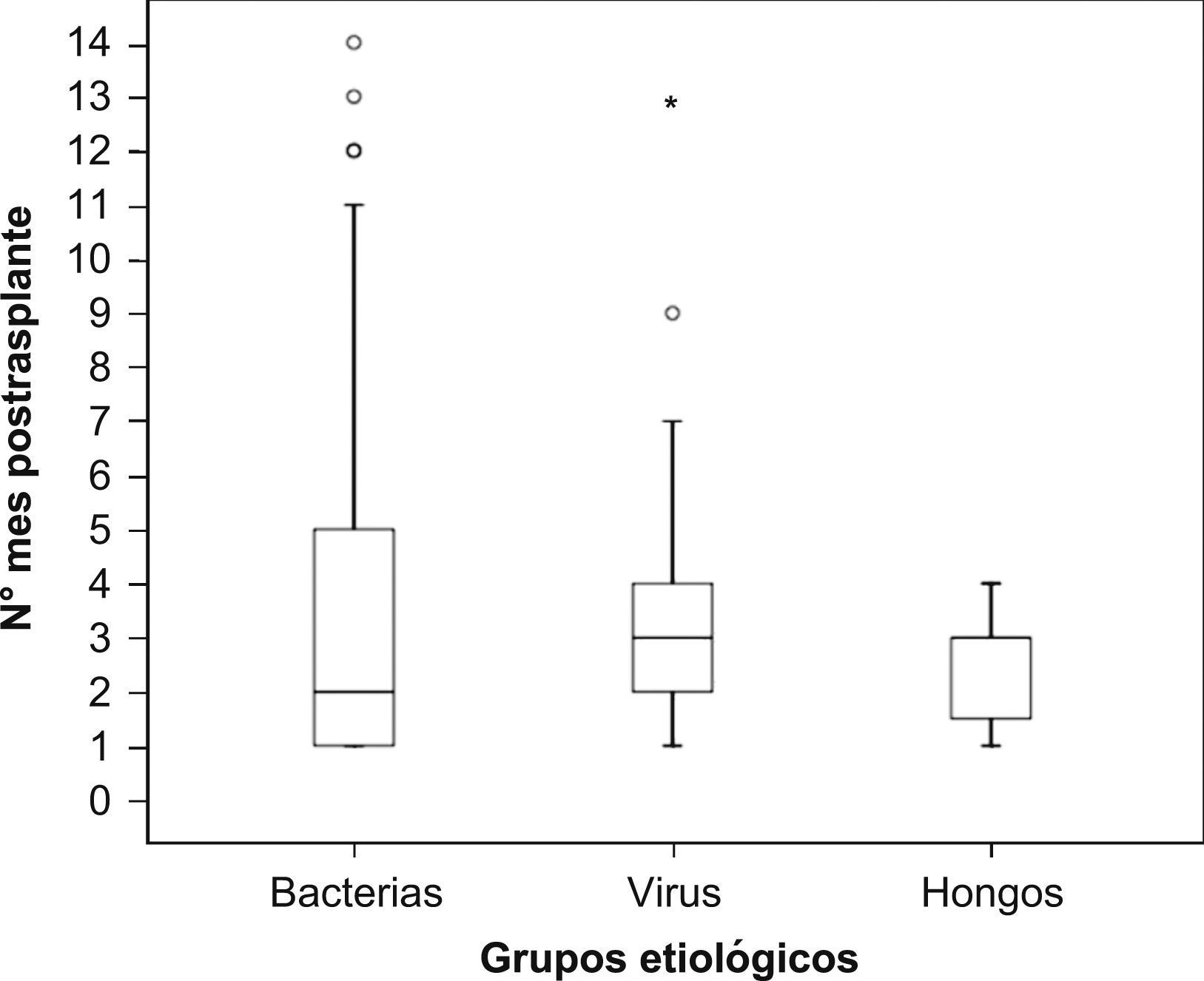
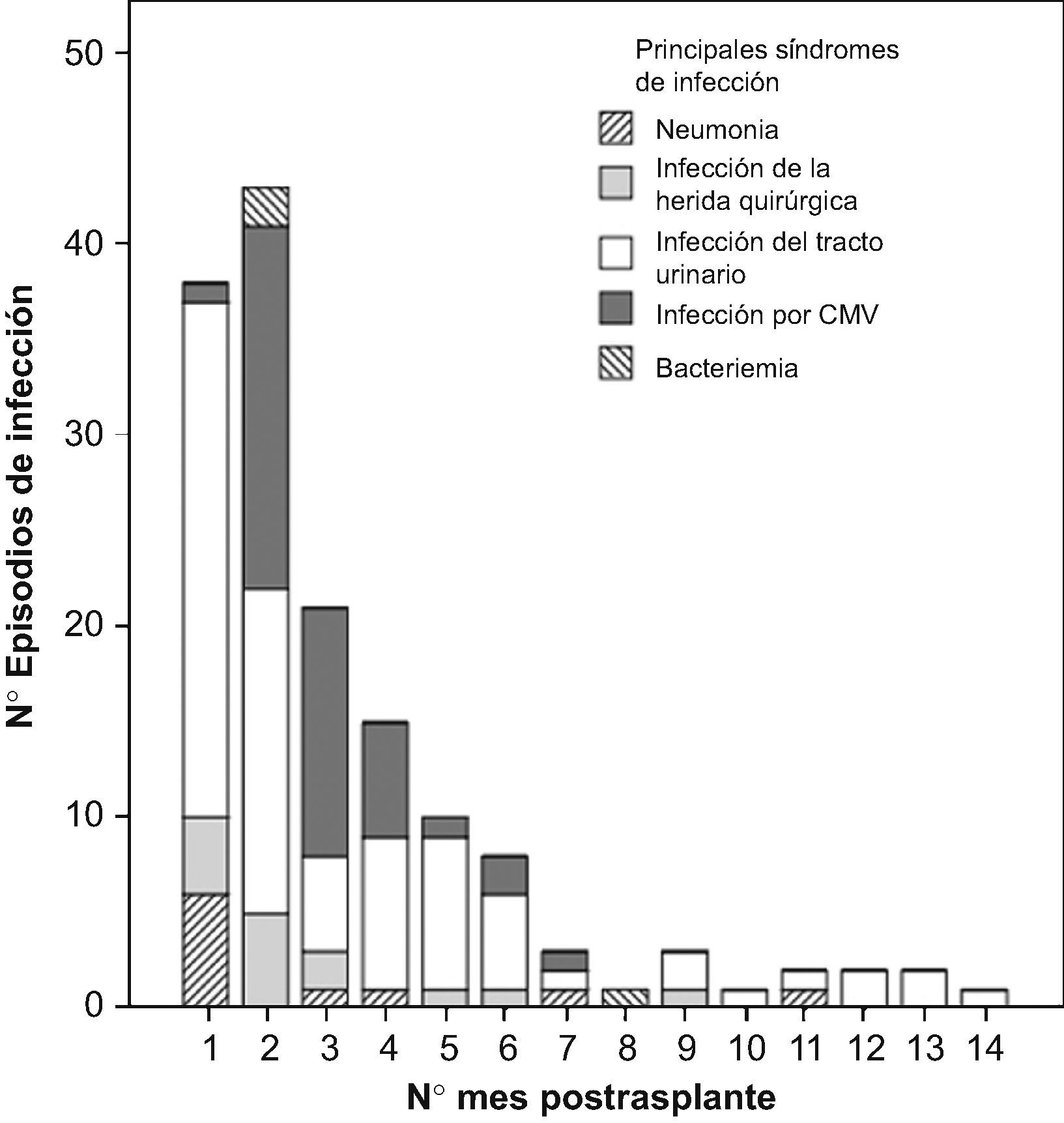
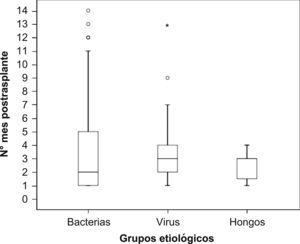
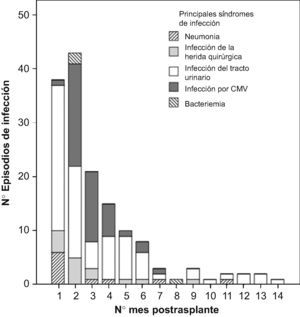
Durante los 4 primeros meses post-TR se produjeron 139 episodios de infección (79%). Las infecciones bacterianas fueron más precoces que las virales (figura 1). La incidencia mensual de los principales síndromes de infección se recoge en la figura 2.
De los 176 casos de infección, 42 (24%) eran graves (0,26 episodios/paciente), de ellos 35 (20%) cursaron con insuficiencia renal, 6 (3,4%) con fracaso multiorgánico y 1 (0,5%) con shock séptico. Trece de los 23 casos de pielonefritis (56,1%) cursaron con insuficiencia renal.
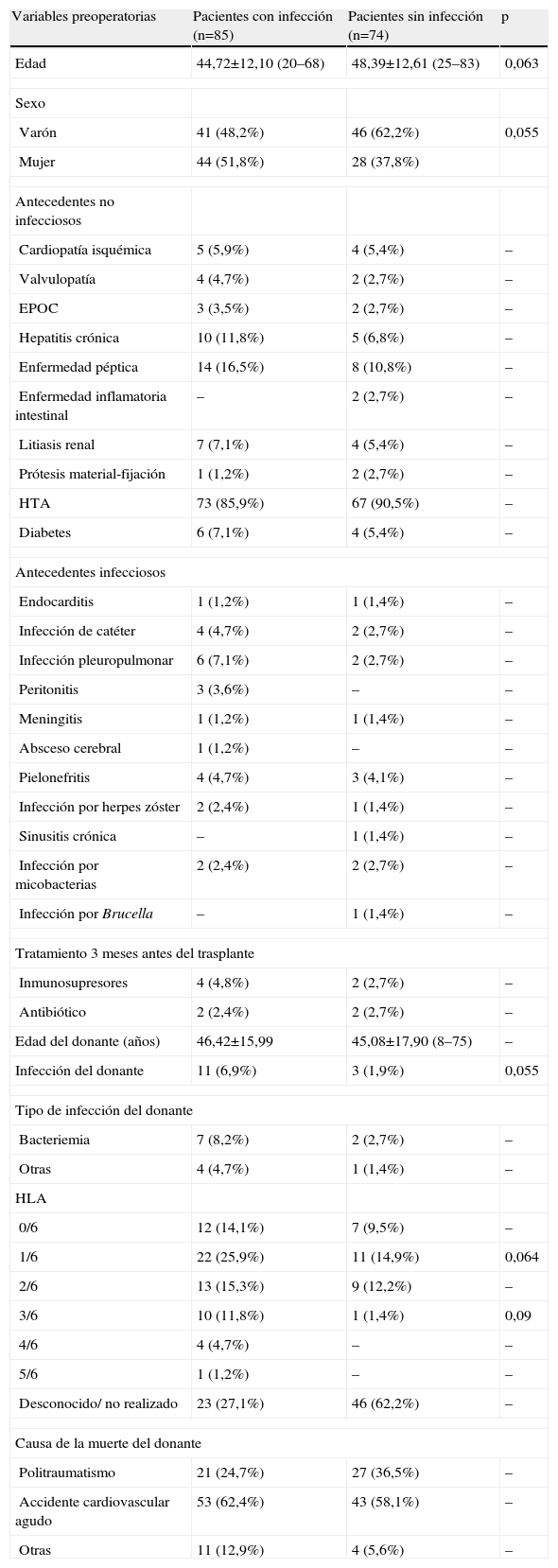
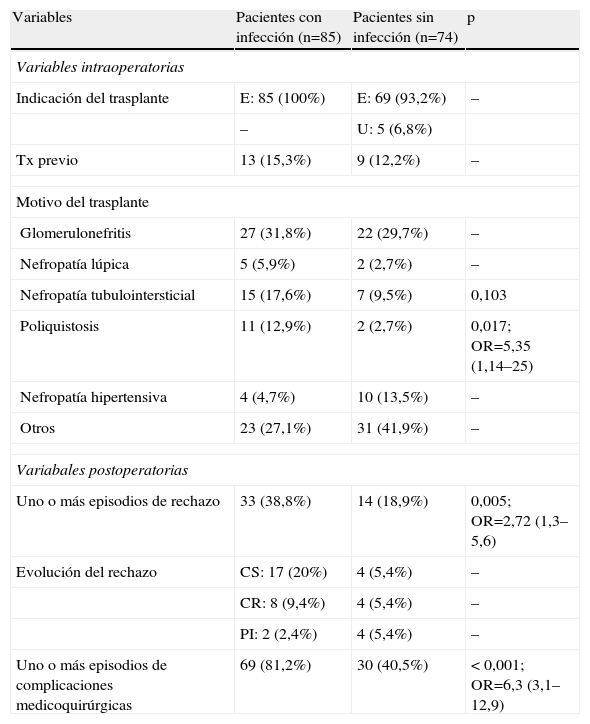
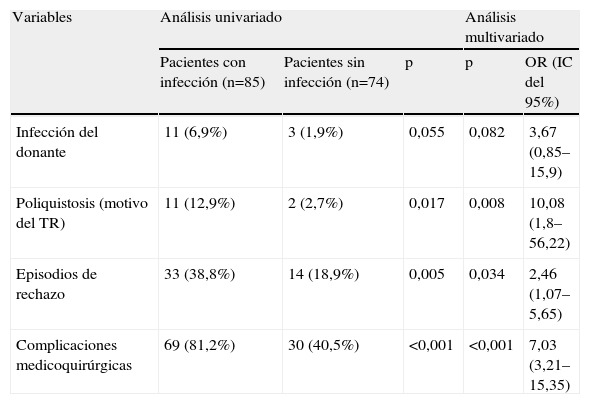
Las variables relacionadas con el desarrollo de infección, tanto en el análisis univariado como en el multivariado, fueron: la poliquistosis como motivo del trasplante, la evidencia de complicaciones medicoquirúrgicas y el rechazo (tablas 4 a 6).
Análisis univariado de factores de riesgo de infección. Variables preoperatorias
| Variables preoperatorias | Pacientes con infección (n=85) | Pacientes sin infección (n=74) | p |
| Edad | 44,72±12,10 (20–68) | 48,39±12,61 (25–83) | 0,063 |
| Sexo | |||
| Varón | 41 (48,2%) | 46 (62,2%) | 0,055 |
| Mujer | 44 (51,8%) | 28 (37,8%) | |
| Antecedentes no infecciosos | |||
| Cardiopatía isquémica | 5 (5,9%) | 4 (5,4%) | – |
| Valvulopatía | 4 (4,7%) | 2 (2,7%) | – |
| EPOC | 3 (3,5%) | 2 (2,7%) | – |
| Hepatitis crónica | 10 (11,8%) | 5 (6,8%) | – |
| Enfermedad péptica | 14 (16,5%) | 8 (10,8%) | – |
| Enfermedad inflamatoria intestinal | – | 2 (2,7%) | – |
| Litiasis renal | 7 (7,1%) | 4 (5,4%) | – |
| Prótesis material-fijación | 1 (1,2%) | 2 (2,7%) | – |
| HTA | 73 (85,9%) | 67 (90,5%) | – |
| Diabetes | 6 (7,1%) | 4 (5,4%) | – |
| Antecedentes infecciosos | |||
| Endocarditis | 1 (1,2%) | 1 (1,4%) | – |
| Infección de catéter | 4 (4,7%) | 2 (2,7%) | – |
| Infección pleuropulmonar | 6 (7,1%) | 2 (2,7%) | – |
| Peritonitis | 3 (3,6%) | – | – |
| Meningitis | 1 (1,2%) | 1 (1,4%) | – |
| Absceso cerebral | 1 (1,2%) | – | – |
| Pielonefritis | 4 (4,7%) | 3 (4,1%) | – |
| Infección por herpes zóster | 2 (2,4%) | 1 (1,4%) | – |
| Sinusitis crónica | – | 1 (1,4%) | – |
| Infección por micobacterias | 2 (2,4%) | 2 (2,7%) | – |
| Infección por Brucella | – | 1 (1,4%) | – |
| Tratamiento 3 meses antes del trasplante | |||
| Inmunosupresores | 4 (4,8%) | 2 (2,7%) | – |
| Antibiótico | 2 (2,4%) | 2 (2,7%) | – |
| Edad del donante (años) | 46,42±15,99 | 45,08±17,90 (8–75) | – |
| Infección del donante | 11 (6,9%) | 3 (1,9%) | 0,055 |
| Tipo de infección del donante | |||
| Bacteriemia | 7 (8,2%) | 2 (2,7%) | – |
| Otras | 4 (4,7%) | 1 (1,4%) | – |
| HLA | |||
| 0/6 | 12 (14,1%) | 7 (9,5%) | – |
| 1/6 | 22 (25,9%) | 11 (14,9%) | 0,064 |
| 2/6 | 13 (15,3%) | 9 (12,2%) | – |
| 3/6 | 10 (11,8%) | 1 (1,4%) | 0,09 |
| 4/6 | 4 (4,7%) | – | – |
| 5/6 | 1 (1,2%) | – | – |
| Desconocido/ no realizado | 23 (27,1%) | 46 (62,2%) | – |
| Causa de la muerte del donante | |||
| Politraumatismo | 21 (24,7%) | 27 (36,5%) | – |
| Accidente cardiovascular agudo | 53 (62,4%) | 43 (58,1%) | – |
| Otras | 11 (12,9%) | 4 (5,6%) | – |
EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial.
Análisis univariado de factores de riesgo de infección. Variables intra y postoperatorias
| Variables | Pacientes con infección (n=85) | Pacientes sin infección (n=74) | p |
| Variables intraoperatorias | |||
| Indicación del trasplante | E: 85 (100%) | E: 69 (93,2%) | – |
| – | U: 5 (6,8%) | ||
| Tx previo | 13 (15,3%) | 9 (12,2%) | – |
| Motivo del trasplante | |||
| Glomerulonefritis | 27 (31,8%) | 22 (29,7%) | – |
| Nefropatía lúpica | 5 (5,9%) | 2 (2,7%) | – |
| Nefropatía tubulointersticial | 15 (17,6%) | 7 (9,5%) | 0,103 |
| Poliquistosis | 11 (12,9%) | 2 (2,7%) | 0,017; OR=5,35 (1,14–25) |
| Nefropatía hipertensiva | 4 (4,7%) | 10 (13,5%) | – |
| Otros | 23 (27,1%) | 31 (41,9%) | – |
| Variabales postoperatorias | |||
| Uno o más episodios de rechazo | 33 (38,8%) | 14 (18,9%) | 0,005; OR=2,72 (1,3–5,6) |
| Evolución del rechazo | CS: 17 (20%) | 4 (5,4%) | – |
| CR: 8 (9,4%) | 4 (5,4%) | – | |
| PI: 2 (2,4%) | 4 (5,4%) | – | |
| Uno o más episodios de complicaciones medicoquirúrgicas | 69 (81,2%) | 30 (40,5%) | < 0,001; OR=6,3 (3,1–12,9) |
CR: corticorresistente; CS: corticosensible; E: electivo; PI: pérdida del injerto; OR: odds ratio; U: urgente.
Análisis estadístico univariante y multivariante de factores de riesgo de infección
| Variables | Análisis univariado | Análisis multivariado | |||
| Pacientes con infección (n=85) | Pacientes sin infección (n=74) | p | p | OR (IC del 95%) | |
| Infección del donante | 11 (6,9%) | 3 (1,9%) | 0,055 | 0,082 | 3,67 (0,85–15,9) |
| Poliquistosis (motivo del TR) | 11 (12,9%) | 2 (2,7%) | 0,017 | 0,008 | 10,08 (1,8–56,22) |
| Episodios de rechazo | 33 (38,8%) | 14 (18,9%) | 0,005 | 0,034 | 2,46 (1,07–5,65) |
| Complicaciones medicoquirúrgicas | 69 (81,2%) | 30 (40,5%) | <0,001 | <0,001 | 7,03 (3,21–15,35) |
IC: intervalo de confianza; OR: odds ratio; TR: trasplante renal.
La supervivencia de los pacientes con infección tras 30 días del episodio y tras 1 año fue del 99,37 y del 97,65%, respectivamente. En total 4 pacientes fallecieron al final del seguimiento, en 3 casos se conoció la causa, que en cada caso fue: neumonía, infarto agudo de miocardio y metástasis pulmonares. Al final del seguimiento, la supervivencia fue del 96,47% en los pacientes con infección y del 98,65% en los pacientes sin infección. No hubo diferencia significativa con respecto a la supervivencia del injerto entre pacientes con y sin infección (el 94,1 frente al 87,8%).
DiscusiónEl TR es una sólida opción terapéutica en pacientes con nefropatía crónica terminal6. Coincidiendo con otros estudios previos, las principales causas que motivaron el trasplante en nuestra serie fueron la glomerulonefritis, la nefropatía tubulointersticial, la nefropatía hipertensiva y la poliquistosis5,19,20.
Analizando la secuencia de aparición de las infecciones tras el trasplante, se distinguen 3 períodos bien definidos6,9,20. Durante el primer mes postrasplante, al igual que en estudios anteriores, las infecciones bacterianas fueron mayoritarias (91,5%)13,14,19 y las infecciones relacionadas con la cirugía fueron las más frecuentes6, en especial las infecciones del tracto urinario bajo (44,7%)20,21. Entre el segundo y sexto mes postrasplante, se produjo una alta incidencia de infección por CMV, donde este patógeno oportunista suele ser mayoritario6,22. A partir del sexto mes, donde las infecciones que aparecen son las mismas que afectan a la población general6, la incidencia fue muy inferior. Al igual que en los demás períodos, predominaron las cistitis.
Coincidiendo con otras cohortes publicadas, las infecciones bacterianas son las más frecuentes en los pacientes con TR, seguidas de las virales y, finalmente, de las fúngicas2,23,24, mientras que si se consideran los síndromes clínicos, las infecciones descritas como más frecuentes son: la ITU, la infección por CMV, la infección de la herida quirúrgica y las infecciones del tracto respiratorio2,3,5,7,9,14,19–21. En el presente estudio, la distribución por síndromes es similar.
Las infecciones urinarias fueron con mayor frecuencia cistitis. La pielonefritis en el TR tiene importancia, no sólo por su frecuencia sino por las consecuencias que pueden tener a corto y largo plazo, ya que está relacionada con el deterioro de la función del injerto23–25. En la presente serie, las pielonefritis supusieron aproximadamente un tercio de las infecciones urinarias. Esta proporción es menor que en otras series24,26, donde la incidencia oscila entre un 16 y un 40%. Ninguno de estos pacientes falleció pero, en más de la mitad de los casos, cursaron con un deterioro de la función renal.
E. coli es la causa más frecuente de ITU en la población general27. A pesar de que el paciente con TR tiene un contexto nosocomial que favorece la aparición de bacterias multirresistentes diferentes a E. coli, ésta es la primera causa de etiología bacteriana en este grupo de enfermos, de lo cual se deriva el tratamiento empírico de pielonefritis con ceftriaxona2,14,19–21,26. Aunque esto continúa siendo así, merece la pena subrayar la aparición de cepas productoras de BLEE. Por ello, previo al diseño de tratamiento antimicrobiano empírico, es importante el conocimiento de la epidemiología local de las infecciones presumiblemente bacterianas del paciente con TR, sobre todo en situaciones graves.
La profilaxis frente a CMV en pacientes de alto riesgo ha supuesto un importante descenso de la incidencia de infección en los últimos años28. Ésta es la infección oportunista más frecuente, a pesar de la profilaxis con valganciclovir, en pacientes de alto riesgo. Cabe destacar la elevada tasa de infecciones asintomáticas en pacientes durante la profilaxis con valganciclovir. No obstante, la mayoría de estos episodios correspondieron a viremias bajas (< 10 células infectadas/100.000) que se controlaron con aumento de la dosis de valganciclovir. Sin embargo, se diagnosticó un episodio de enfermedad de órgano, poniendo de manifiesto un fracaso de la profilaxis antiviral. Este fracaso podría explicarse por resistencia a ganciclovir29 o por dosis insuficientes de valganciclovir. Pensamos que probablemente sea por lo segundo, puesto que ambos casos se curaron con ganciclovir intravenoso. Otro aspecto que apoya esta hipótesis es que no hubo ningún caso de infección tardía por CMV en pacientes con profilaxis antiviral.
Los receptores de TR son susceptibles de tener infecciones fúngicas oportunistas30, con una incidencia que oscila entre el 3 y el 11%, dependiendo del estudio1,4,5,18,20,31. La incidencia de infección fúngica en nuestra cohorte es muy baja, siempre correspondió a infecciones por Candida spp. y no hubo ningún caso de infección invasiva por Aspergillus spp.
La mortalidad global de la serie fue del 2%, esta tasa fue inferior a la publicada en otras series recientes, donde oscila entre un 3 y un 15%3–5,14,19,26. En un caso, el fallecimiento del paciente estuvo relacionado con un episodio de infección, concretamente con una neumonía asociada a ventilación mecánica por Acinetobacter baumannii.
En resumen, las infecciones en el TR, a pesar de tener un buen pronóstico, siguen suponiendo un problema importante. Cabe destacar los cambios en lo que respecta a la epidemiología de las infecciones en estos pacientes, como el aumento creciente de las infecciones por enterobacterias productoras de BLEE, y que la estrategia preventiva de otras infecciones clásicamente involucradas en el paciente trasplantado (como la infección por CMV) aún no está resuelta.
FinanciaciónFinanciado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, Red de Estudio de Infección en el Trasplante (RESITRA G03/075) y Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).