El objetivo de este estudio es analizar la incidencia de infección en los niños tratados con ECMO, el tratamiento y su evolución.
MétodosSe realizó un estudio retrospectivo basado en una base de datos prospectiva en el que se incluyeron los niños menores de 18 años asistidos con ECMO entre septiembre de 2006 y noviembre de 2015. Se recogieron las características de los pacientes, la ECMO, los cultivos y el tratamiento de la infección.
ResultadosSe estudiaron 100 pacientes de 11 meses de edad mediana. El diagnóstico fue de cardiopatía en 94 pacientes. Se sospechó una infección y se inició antibioterapia en 51 pacientes, aunque solo se confirmó microbiológicamente en 22. Las infecciones más frecuentes fueron la sepsis (49%), neumonía (35,3%) e infección urinaria (9,8%). No existieron diferencias en los parámetros hematológicos y reactantes de fase aguda entre los niños con infección y el resto. Los niños que fallecieron presentaron mayor incidencia, no estadísticamente significativa, de infección durante la ECMO (60,4%) que los supervivientes (40,3%) (p=0,07). La duración de ingreso en la UCIP fue mayor, sin significación estadística, en los pacientes con infección que en el resto: 57 frente a 37 días (p=0,067).
ConclusionesLa frecuencia de infección en niños con ECMO es elevada, pero menos de la mitad son confirmadas microbiológicamente, sin existir parámetros específicos de infección. No se ha encontrado relación estadísticamente significativa de la infección con la mortalidad y la duración de ingreso en la UCIP.
The aim of this study was to analyse the incidence, treatment and evolution of infections in children treated with ECMO.
MethodsA retrospective study based on a prospective database was performed. Children under the age of 18 years treated with ECMO from September 2006 to November 2015 were included. The patients’ clinical characteristics were collected, together with ECMO technique, cultures and treatment of infection.
ResultsOne hundred patients with a median age of 11 months were analysed. Heart disease was diagnosed in 94 patients. An infection was suspected and antibiotic treatment was initiated in 51 patients, although only 22 of them were microbiologically confirmed. The most common infection was sepsis (49%), followed by pneumonia (35.3%) and urinary tract infection (9.8%). There were no differences in haematological parameters and acute phase reactants between children with infection and those without. Children who died had a higher incidence of infection during ECMO (60.4%) than the survivors (40.3%), but the difference did not reach statistical significance (P=.07). The duration of admission in the PICU was 57 days in patients with infection vs 37 days in patients without infection but the difference was not statistically significant (P=.067).
ConclusionsInfection in children with ECMO is common. There are no specific infection parameters and less than half of the clinical infections are confirmed microbiologically. There was no statistically significant correlation between infection and mortality or duration of PICU stay.
La oxigenación por membrana extracorpórea (ECMO) es una técnica de soporte vital indicada para pacientes con fallo cardiaco y/o pulmonar refractarios al tratamiento convencional1,2.
Los pacientes tratados con ECMO tienen un riesgo elevado de complicaciones debido a la invasividad de la técnica y la gravedad del estado clínico3,4. En los pacientes tratados con ECMO confluyen una serie de factores que aumentan el riesgo de infección. La canulación de grandes vasos para la ECMO irrumpe la barrera de protección corporal y proporciona una vía de entrada a patógenos. Además, estos pacientes tienen otros dispositivos invasivos como catéteres venosos centrales y arteriales, tubo endotraqueal y sonda urinaria, que aumentan el riesgo de infección nosocomial1,5. Por otra parte, un porcentaje importante de los pacientes están inmunocomprometidos por su propia enfermedad, por la cirugía y por los tratamientos que requieren.
El diagnóstico de las infecciones en los pacientes sometidos a ECMO resulta complicado debido a la falta de síntomas y signos precoces específicos. La propia técnica y las enfermedades subyacentes producen una elevación de los biomarcadores de respuesta inflamatoria tisular, lo que disminuye su utilidad en el diagnóstico de la infección6,7. Además, muchos pacientes reciben tratamiento antibiótico de amplio espectro, lo que complica el diagnóstico de infección y predispone a infecciones por gérmenes multirresistentes. Todos estos factores dificultan el diagnóstico y tratamiento de la infección en los niños con ECMO, y puede aumentar su morbimortalidad.
El objetivo principal de este estudio ha sido estudiar la incidencia, los factores de riesgo y el tipo de infecciones en los niños tratados con ECMO y su relación con la mortalidad y la duración de ingreso en la unidad de cuidados intensivos pediátricos (UCIP). El objetivo secundario ha sido valorar la utilidad del hemograma y los reactantes de fase aguda en el diagnóstico precoz de infección en los niños con ECMO.
Pacientes y métodosSe realizó un estudio observacional mediante un análisis retrospectivo de una base de datos prospectiva de los niños ingresados en la UCIP del Hospital General Universitario Gregorio Marañón tratados con ECMO. El estudio fue aprobado por el comité de ética local y se siguieron las normas para el acceso a los datos de las historias clínicas.
El criterio de inclusión fue haber recibido asistencia circulatoria con ECMO entre septiembre de 2006 y noviembre del 2015 en la UCIP.
Se recogieron las siguientes variables: datos clínicos (fecha de nacimiento, sexo, peso, talla, superficie corporal, diagnóstico), datos sobre la ECMO (fecha de inicio y fin, tipo de ECMO, tipo de canulación, cirugía previa y características de la misma, momento de colocación de ECMO, número de cambios del circuito), datos relacionados con la infección (sospecha de infección clínica, leucocitos, PCR, y PCT basales, a las 24, 48, 72h, a los 5 y 7 días, cultivos durante y tras la finalización de la ECMO, antibioterapia, evolución de la infección), y datos de la evolución del paciente (supervivencia y duración del ingreso en la UCIP).
No existieron unos criterios previamente establecidos de infección. La sospecha de infección clínica fue realizada por el médico responsable del paciente de acuerdo a síntomas clínicos generales (fiebre, empeoramiento del estado general) o localizados (por ejemplo, empeoramiento del estado respiratorio acompañado de nuevos infiltrados en la radiografía de tórax) y aumento de leucocitosis y reactantes de fase aguda.
Se recogieron hemocultivo, broncoaspirado y urocultivo cada 72h y también ante la sospecha de infección antes del inicio del tratamiento antibiótico.
Los pacientes en ECMO con canulación cervical recibieron profilaxis quirúrgica si se encontraban en el postoperatorio de cirugía cardiaca con cefazolina a dosis de 30mg/kg/8h durante 48h. Los pacientes en ECMO con canulación transtorácica y tórax abierto recibieron tratamiento con piperacilina-tazobactam y teicoplanina. Se realizó estudio estadístico con el programa IBM SPSS versión 21.0. En el estudio descriptivo las variables cuantitativas con distribución normal se presentan con medias y desviaciones estándar (DE), y aquellas que no cumplen los supuestos de normalidad (test de Kolmogorov-Smirnov y Shapiro-Wilks) como mediana y rango intercuartílico (RIC) (p25-p75). Las variables cualitativas se presentan como porcentajes. Para la comparación de variables cualitativas se utilizaron el test χ 2 y el test exacto de Fisher. Para la comparación de medias en variables cuantitativas se empleó la prueba t de Student. Para las variables que no tuvieron una distribución normal se utilizó la prueba de los rangos con signo de Wilcoxon (Wicoxon signed rank test). Se consideró significativo un valor de p<0,05.
ResultadosSe estudiaron 100 niños tratados ECMO. La mediana de edad fue de 11 meses (RIC: 4-66 meses) y el peso de 7,4kg (RIC: 4,8-16,8kg). El 67% eran varones. El 94% presentaba cardiopatía al ingreso, el 5% fallo respiratorio y un 1% shock séptico. En el 64% de los casos, la ECMO se instauró en el postoperatorio de cirugía cardiaca. La ECMO fue realizada en 55 pacientes a través de cánulas cervicales, en 30 con cánulas transtorácicas y en 15 pacientes se utilizaron ambos tipos de canulación. La duración mediana de la ECMO fue de 5,5 días (RIC: 3-9 días).
InfeccionesDurante la ECMO se sospechó una infección en 51 pacientes (51%). La infección más frecuente fue la sepsis (49%), seguida de la infección respiratoria (35,3%), la infección urinaria (9,8%), la infección intraabdominal (3,9%) y la infección de la herida quirúrgica (2%). Solamente en 22 de los casos (43,1%) se confirmó la infección microbiológicamente.
Las tasas de infección confirmada por 1.000 días de asistencia en ECMO fueron sepsis 40, infección respiratoria 34, infección urinaria 10, infección de la herida quirúrgica 4,5 e infección intraabdominal 3.
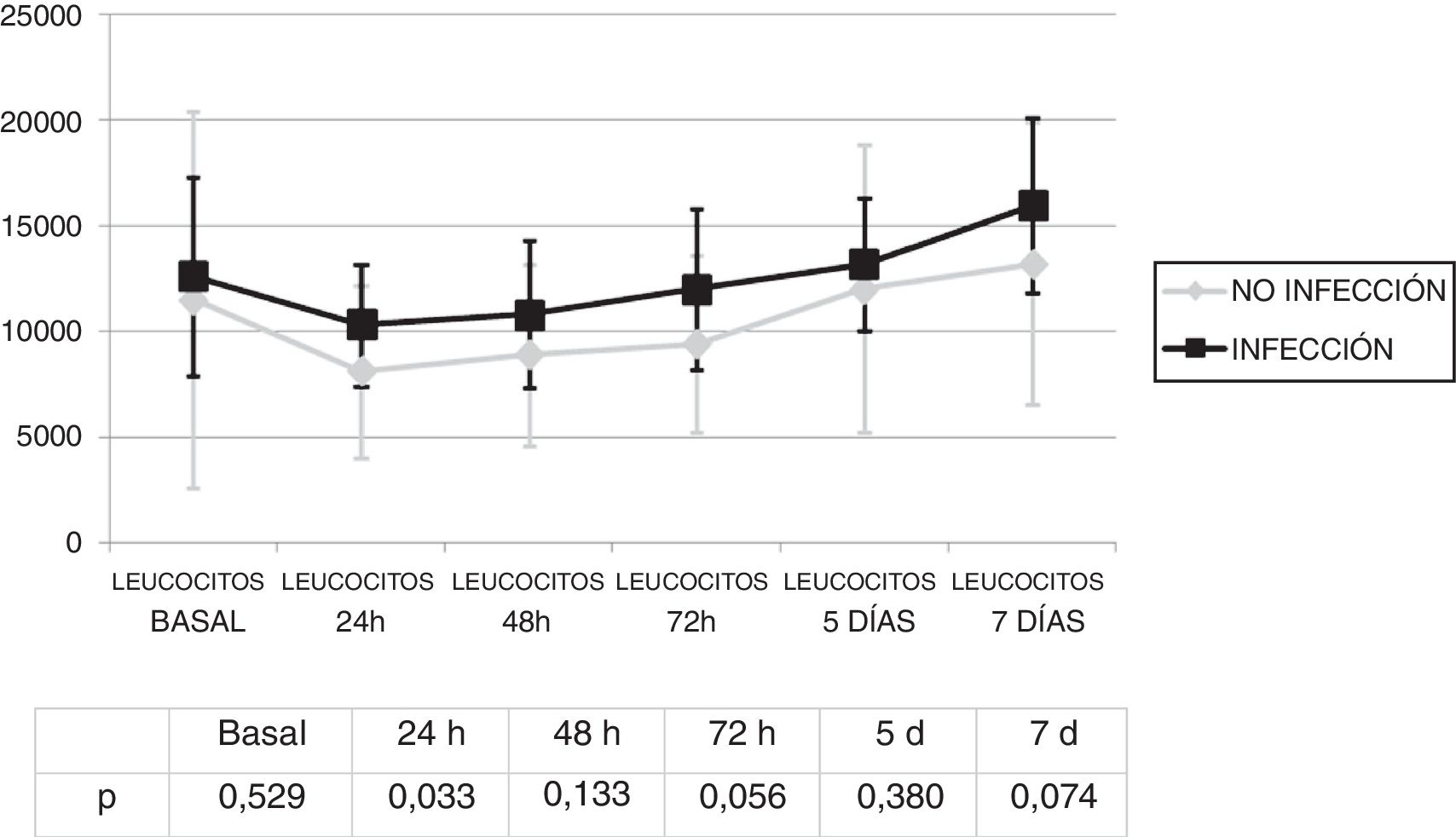
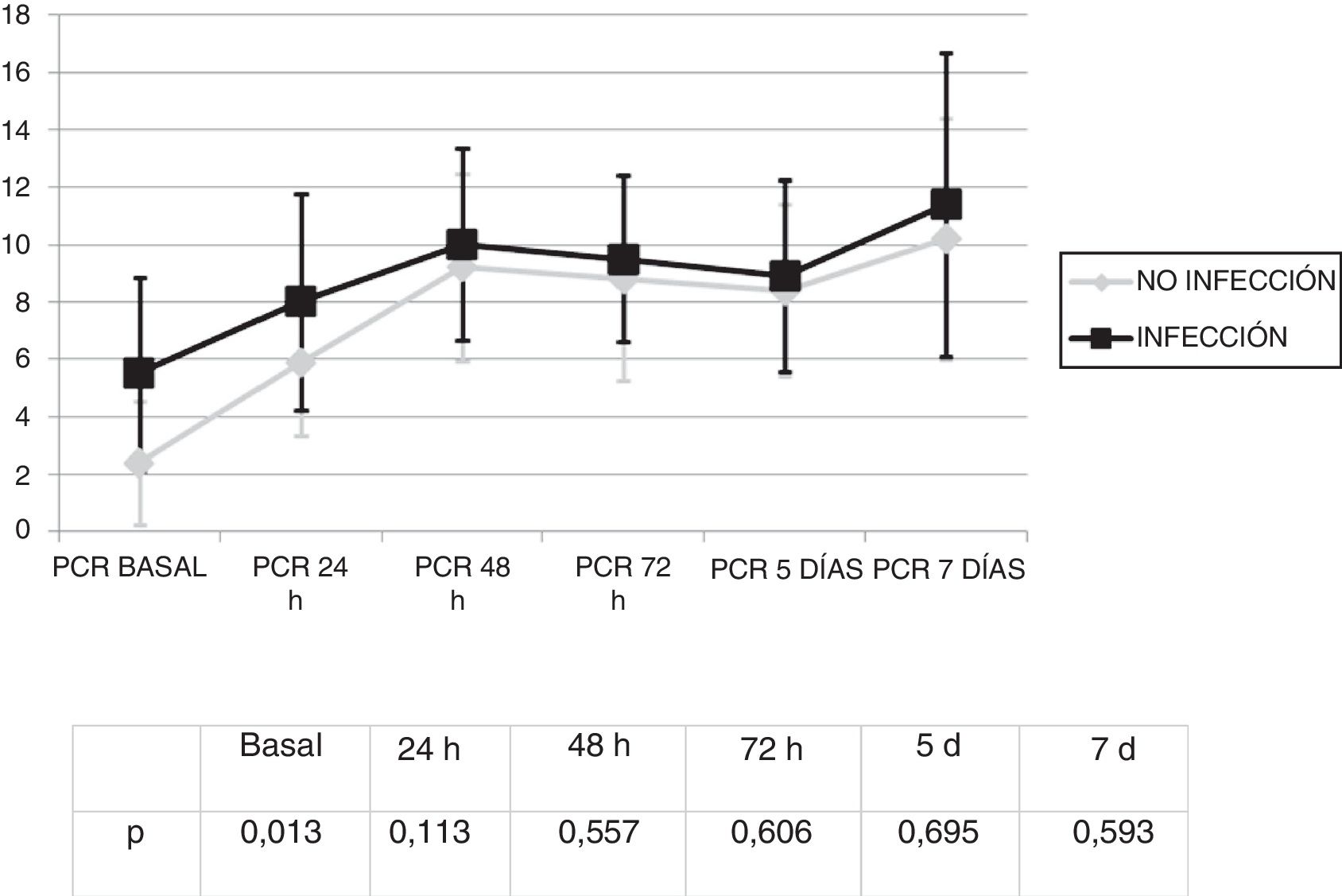
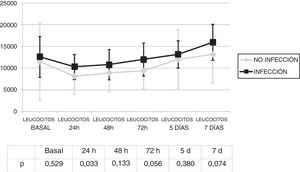
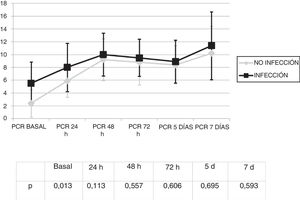
Se analizó la evolución de los leucocitos y la PCR durante los primeros 7 días tras el inicio de la ECMO. No existieron diferencias significativas en la cifra de leucocitos (fig. 1) y los valores de PCR (fig. 2) entre los pacientes infectados y los no infectados, salvo en los leucocitos a las 24h y en la PCR basal.
La infección se diagnosticó los 4,8 (DE: 4) días del inicio de la ECMO. No existió una diferencia estadísticamente significativa en los leucocitos el día del diagnóstico de la infección 12.805,7 (DE: 7367,6) con respecto a los del inicio de la ECMO 1.934,2 (DE: 9.883,4) (p=0,945).
Por el contrario sí se observó una elevación significativa en los valores de la PCR de 3,3 (DE: 4,7) mg/dL a 10,6 (DE: 8,6) mg/dL (p<0,01).
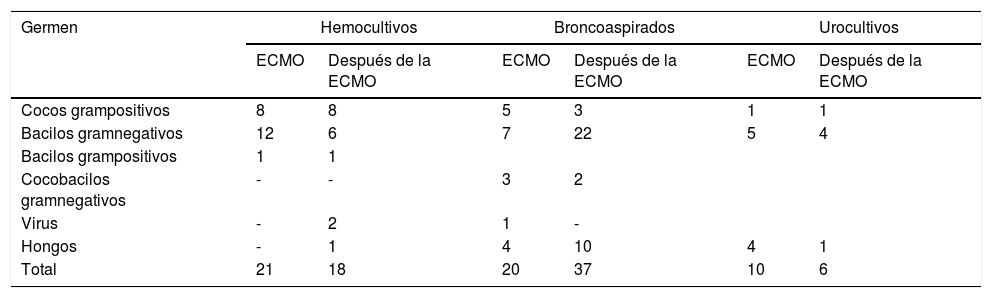
La tabla 1 recoge los resultados de los cultivos microbiológicos. Un 15,1% (21 de los 139) hemocultivos realizados durante la ECMO fueron positivos y un 11,5% (21 de los 182) realizados en los 15 días después de la ECMO. Un 25,9% (20 de 77) de los broncoaspirados realizados durante la asistencia con ECMO fueron positivos y un 22,6% (37 de 163) de los realizados tras finalizar la ECMO. Un 10,4% (10 de 96) de los 96 urocultivos realizados durante la ECMO fueron positivos y un 6,4% (6 de 94) de los urocultivos realizados posteriormente. Tan solo se aisló una Klebsiella pneumoniae productora de betalactamasas de espectro extendido.
Gérmenes encontrados en los cultivos
| Germen | Hemocultivos | Broncoaspirados | Urocultivos | |||
|---|---|---|---|---|---|---|
| ECMO | Después de la ECMO | ECMO | Después de la ECMO | ECMO | Después de la ECMO | |
| Cocos grampositivos | 8 | 8 | 5 | 3 | 1 | 1 |
| Bacilos gramnegativos | 12 | 6 | 7 | 22 | 5 | 4 |
| Bacilos grampositivos | 1 | 1 | ||||
| Cocobacilos gramnegativos | - | - | 3 | 2 | ||
| Virus | - | 2 | 1 | - | ||
| Hongos | - | 1 | 4 | 10 | 4 | 1 |
| Total | 21 | 18 | 20 | 37 | 10 | 6 |
ECMO: oxigenación por membrana extracorpórea
Hongos:
Hemocultivo: Candida 1.
Broncoaspirados: Candida 13, Aspergillus 1.
Urocultivo: Candida 5.
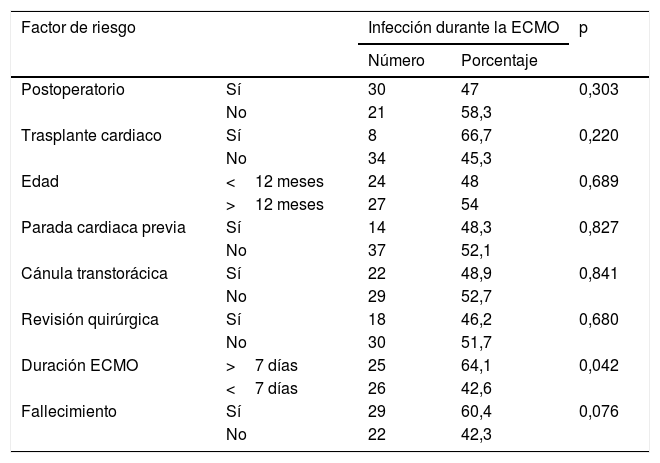
La tabla 2 recoge los factores relacionados con la infección durante la ECMO. De las variables estudiadas solamente la duración de la ECMO mayor de 7 días se asoció a una mayor frecuencia de infección clínica (p=0,042). Los pacientes que fallecieron presentaron una mayor frecuencia de infección clínica que los supervivientes aunque las diferencias no fueron estadísticamente significativas (p=0,076).
Factores asociados con infección durante la ECMO
| Factor de riesgo | Infección durante la ECMO | p | ||
|---|---|---|---|---|
| Número | Porcentaje | |||
| Postoperatorio | Sí | 30 | 47 | 0,303 |
| No | 21 | 58,3 | ||
| Trasplante cardiaco | Sí | 8 | 66,7 | 0,220 |
| No | 34 | 45,3 | ||
| Edad | <12 meses | 24 | 48 | 0,689 |
| >12 meses | 27 | 54 | ||
| Parada cardiaca previa | Sí | 14 | 48,3 | 0,827 |
| No | 37 | 52,1 | ||
| Cánula transtorácica | Sí | 22 | 48,9 | 0,841 |
| No | 29 | 52,7 | ||
| Revisión quirúrgica | Sí | 18 | 46,2 | 0,680 |
| No | 30 | 51,7 | ||
| Duración ECMO | >7 días | 25 | 64,1 | 0,042 |
| <7 días | 26 | 42,6 | ||
| Fallecimiento | Sí | 29 | 60,4 | 0,076 |
| No | 22 | 42,3 | ||
ECMO: oxigenación por membrana extracorpórea.
Se administró antibioterapia profiláctica quirúrgica previa a la ECMO en un 97,4% de los pacientes con cefazolina 60mg/kg/día con una duración mediana de 2 días (RIC: 2-6).
Solo un 8% de los pacientes no recibió antibioterapia durante la ECMO. El 18% de los pacientes recibió un antibiótico, el 21% recibió 2, 3 antibióticos el 30% y el 23% recibió 4. El antibiótico más empleado como antibioterapia inicial fue el meropenem (38%), seguido por la piperacilina-tazobactam (19,6%) y la teicoplanina (17,4%). La mediana de tiempo de duración de la antibioterapia fue de 10 días (RIC: 6-15).
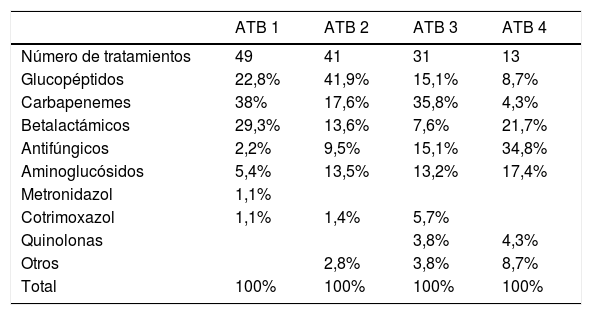
Muchos pacientes recibieron antibioterapia de forma secuencial por sospecha de infección. Se consideró un ciclo de antibioterapia cuando se inició uno o más antibióticos por sospecha de una nueva infección o por no resolución de la infección con la antibioterapia previa. Los antibióticos utilizados en cada ciclo de antibioterapia se muestran en la tabla 3.
Antibioterapia utilizada durante el tratamiento. Primer a cuarto ciclo de antibióticos
| ATB 1 | ATB 2 | ATB 3 | ATB 4 | |
|---|---|---|---|---|
| Número de tratamientos | 49 | 41 | 31 | 13 |
| Glucopéptidos | 22,8% | 41,9% | 15,1% | 8,7% |
| Carbapenemes | 38% | 17,6% | 35,8% | 4,3% |
| Betalactámicos | 29,3% | 13,6% | 7,6% | 21,7% |
| Antifúngicos | 2,2% | 9,5% | 15,1% | 34,8% |
| Aminoglucósidos | 5,4% | 13,5% | 13,2% | 17,4% |
| Metronidazol | 1,1% | |||
| Cotrimoxazol | 1,1% | 1,4% | 5,7% | |
| Quinolonas | 3,8% | 4,3% | ||
| Otros | 2,8% | 3,8% | 8,7% | |
| Total | 100% | 100% | 100% | 100% |
ATB: antibiótico.
Veinticinco pacientes presentaron infecciones en los 15 días posteriores a la retirada de la ECMO.
La neumonía asociada a ventilación mecánica fue la infección más frecuente (40%), seguida de la sepsis (32%), infección de herida quirúrgica (16%) e infección del tracto urinario (12%).
Evolución clínicaEn 76 pacientes se pudo retirar la asistencia de la ECMO: en 62 por mejoría de la situación clínica, en 7 pacientes se pasó a un sistema de asistencia ventricular y en 7 se realizó un trasplante cardiaco.
Cincuenta y dos pacientes sobrevivieron al alta del hospital. La mortalidad de los niños con sospecha de infección durante la ECMO fue del 60,4% y la de los niños sin infección del 42,3% (p=0,076). La mortalidad de los pacientes con sospecha de infección durante la ECMO fue mayor (60,4%) de la que presentaron infección posterior a la ECMO (24%) (p=0,017).
No existieron diferencias estadísticamente significativas en cada tipo de infección entre los supervivientes y los fallecidos; sepsis (un 39,5% frente a un 48,6%), infección respiratoria (un 39,5% frente a un 31,4%), infección urinaria (un 7% frente a un 14,3%), infección herida quirúrgica (un 7% frente a un 5%) e infección intraabdominal (un 4,7% frente a un 0%) (p=0,520).
La principal causa de muerte en los pacientes con sospecha de infección fue el fallo multiorgánico (57,1%), seguida de las complicaciones neurológicas (20%). En los pacientes sin sospecha de infección las causas más frecuentes de fallecimiento fueron las complicaciones neurológicas (30,8%), seguidas por el fallo multiorgánico (23,1%). No existieron diferencias estadísticamente significativas en la causa de fallecimiento entre los pacientes con y sin infección (p=0,158).
La duración media del ingreso en la UCIP fue de 45,7 días (DE: 37,3). La duración del ingreso de los pacientes con sospecha de infección fue mayor (50,1 días) (DE: 39,6) que la de los pacientes sin infección (24,9) días (DE: 9,4 días), aunque la diferencia no alcanzó significación estadística (p=0,06). No existieron diferencias en la duración de ingreso en la UCIP entre los niños con infección microbiológicamente confirmada (52,2 días) (DE: 43,7) y sin ella (48,3 días) (DE: 36,4) (p=0,176).
Los pacientes que presentaron infecciones durante la ECMO tuvieron una mayor duración media de ingreso en la UCIP (57) días (DE: 46), que los que tuvieron infección posterior a la ECMO (39,2) días (DE: 25,9), pero las diferencias tampoco fueron estadísticamente significativas (p=0,161).
DiscusiónIncidencia y diagnóstico de infecciónLa incidencia de infección en nuestro estudio (un 51% de sospecha de infección y un 22% de infección confirmada microbiológicamente) es más elevada que la descrita en el registro ELSO (18,7%)3. Estas diferencias pueden deberse en parte a que el registro ELSO, a diferencia de nuestro estudio, solo incluye las infecciones confirmadas microbiológicamente y aquellas que ocurrieron durante la ECMO3. Nosotros hemos preferido considerar infección cuando existió sospecha clínica (aunque en los pacientes en ECMO es muy complicado diferenciar la infección de otras complicaciones clínicas) y los pacientes fueron tratados con antibióticos. Este hecho probablemente haga que sobreestimemos algo la incidencia de infección.
Las infecciones más frecuentes en nuestros pacientes fueron la sepsis (49%) y la neumonía asociada a la ventilación mecánica (35,3%), coincidiendo con lo descrito en el registro ELSO3,5.
El mayor problema para hacer un diagnóstico precoz de infección es que tanto la PCR como la PCT son marcadores inflamatorios que aumentan por la enfermedad subyacente, la cirugía e incluso la ECMO6. Por ello es necesario utilizar también otros signos clínicos, aunque tampoco son específicos y pueden estar alterados también por otras causas, como la taquicardia y la hipotensión, y el aumento de la necesidad de fármacos vasoactivos8.
No todos los cultivos positivos deben ser considerados infección porque un porcentaje significativo de pacientes críticos puede estar colonizado y no infectado (por ejemplo, la mayoría de los broncoaspirados positivos para Cándida). Solo debe considerarse infección cuando el cultivo positivo se acompaña de clínica y analítica compatible2. Por otra parte, la antibioterapia de amplio espectro instaurada de manera precoz en los pacientes con sospecha clínica puede hacer que algunos cultivos no lleguen a positivizarse9.
Factores de riesgo de infecciónEn otros estudios se ha relacionado la infección con la duración de la ECMO2,4,8,10 la urgencia con la que se implanta el dispositivo8, el mayor estado de gravedad de los pacientes, las cánulas transtorácicas, la ventilación mecánica, la nutrición parenteral prolongada y la mayor edad de los niños2,11. En nuestro estudio solamente la duración mayor de 7 días se asoció con la infección durante la ECMO. Sin embargo, hay que tener en cuenta que la infección también podría influir en la necesidad de prolongación de la ECMO. La incidencia de infección en los niños con ECMO tras cirugía no fue mayor que en los pacientes no quirúrgicos, ni existieron diferencias con respecto a la edad.
AntibioterapiaEn nuestro estudio se administró antibioterapia previa a la ECMO en un 97,4% de los pacientes, pero como profilaxis de la cirugía cardiaca y no por haber entrado en ECMO. El uso de antibioterapia profiláctica en niños con ECMO es un tema muy controvertido. O’Horo et al. en una revisión sistemática no encontraron que la profilaxis antibiótica en niños y adultos con ECMO redujera la incidencia de infección12. Los únicos pacientes en los que según el registro ELSO se ha encontrado beneficio de una profilaxis antibiótica son los que tienen el tórax abierto, ya que tienen un mayor riesgo de mediastinitis y este hecho se relaciona con una mayor mortalidad4,5,12.
En cualquier caso, es importante no usar una profilaxis antibiótica de amplio espectro ni que esta sea de duración prolongada, pues dificulta el diagnóstico precoz de la infección y predispone a infecciones por gérmenes multirresistentes13.
Los antibióticos empíricos más utilizados en nuestro estudio fueron el meropenem y la piperacilina-tazobactan, de acuerdo a nuestro protocolo de infección nosocomial en el niño críticamente enfermo. Sin embargo, a lo largo del estudio cambió nuestra política antibiótica, y en el momento actual se usa piperacilina-tazobactam y teicoplanina como antibióticos iniciales1, reservando el meropenem para las infecciones por gérmenes productores de betalactamasas de espectro extendido o resistentes a los otros fármacos.
EvoluciónVarios estudios han encontrado una mayor tasa de mortalidad en los pacientes con ECMO con infección confirmada3,14. En cambio, en nuestro estudio no existieron diferencias en la mortalidad de los niños con infección, confirmada o no confirmada microbiológicamente, y los niños sin infección. Sin embargo, encontramos que la infección durante la ECMO se asocia a mayor mortalidad que la infección después de la ECMO, siendo un hallazgo que no se había analizado en estudios previos.
LimitacionesNuestro estudio presenta varias limitaciones. En primer lugar, se trata de un análisis retrospectivo, por lo que existieron limitaciones en la recogida de algunos datos y en la interpretación del diagnóstico de infección y las indicaciones de antibioterapia. La sospecha de infección clínica se realizó a criterio del médico responsable del paciente de acuerdo a los hallazgos clínicos y analíticos. Este hecho, aunque refleja la práctica clínica, puede haber creado sesgos en los resultados. Por otra parte, el estudio es unicéntrico y ha sido realizado en una UCIP que es referente en cirugía cardiaca, por lo que nuestros datos pueden no ser completamente extrapolables a otros centros con otro tipo de pacientes. La comparación de los datos analíticos se ha realizado en unos periodos de tiempo fijos tras el inicio de la ECMO pero el tiempo de desarrollo de la infección ha sido variable. Por último, el número de pacientes es relativamente pequeño para el análisis de algunas variables.
ConclusionesLa frecuencia de infección en niños con ECMO es elevada. Menos de la mitad de las infecciones clínicas son confirmadas microbiológicamente y no existen parámetros específicos que ayuden al diagnóstico precoz de la infección. No hemos encontrado relación estadísticamente significativa de la infección con la mortalidad y la duración de ingreso en la UCIP.
FinanciaciónInstituto de Salud Carlos III (PI15/00743). Red de Salud Maternoinfantil y del Desarrollo (Red SAMID). RETICS funded by the PN I+D+I 2008-2011 (Spain), ISCIIISub-Directorate General for Research Assessment and Promotion and the European Regional Development Fund (ERDF), ref. RD16/0022/0007.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.