Introducción
El término fiebre hemorrágica viral (FHV) describe un síndrome caracterizado por la presencia de fiebre y hemorragias en humanos, causado por virus pertenecientes a distintas familias (Filoviridae, Arenaviridae, Bunyaviridae y Flaviviridae), transmitidos al hombre por artrópodos (mosquitos y garrapatas), reservorios vertebrados, e incluso por transmisión directa. En un primer momento estos virus causan una infección aguda con una sintomatología inespecífica, que se vuelve más característica en las fases tardías de la enfermedad cuando se produce el fallo orgánico que puede llevar a la muerte.
Excepto en muy pocos casos, no existe un tratamiento específico ni eficaz para las FHV, e incluso cuando se dispone de los cuidados médicos adecuados, cursan con una alta mortalidad.
Debido al potencial de transmisión persona-persona que poseen algunos de los virus responsables de este tipo de enfermedades, pueden originar brotes epidémicos e infecciones nosocomiales si no se aplican las medidas de contención adecuadas, y por tanto, han de ser identificados o excluidos eficientemente ante la sospecha de una fiebre hemorrágica.
El aumento de los viajes a países tropicales y la implicación internacional en situaciones de conflicto y desastres naturales, hace posible la importación de FHV a zonas no endémicas. Recientemente se han comunicado casos importados de fiebre amarilla, virus Lassa o virus Crimea-Congo en Europa, lo que ha originado situaciones de alarma y ha puesto de manifiesto la necesidad de establecer pautas de control y cuidado de los pacientes con sospecha de padecer fiebre hemorrágica viral 1.
Etiología
Flaviviridae:dengue y fiebre amarilla
Los flavivirus son virus icosahédricos, envueltos, de pequeño tamaño (30-40 nm), que contienen un ARN monocatenario de polaridad positiva que codifica tres proteínas estructurales (C, preM/M, E) y 8 proteínas no estructurales (NS1, NS2A, NS2B, NS3, NS4A, 2K, NS4B y NS5) 2. Desde el punto de vista biológico la glucoproteína E es la más importante, puesto que participa en los procesos de adhesión y entrada en la célula y contiene en su superficie dominios antigénicos capaces de estimular la producción de anticuerpos neutralizantes.
El virus de la fiebre amarilla es el prototipo de la familia Flaviviridae, siendo esta enfermedad la primera fiebre hemorrágica descrita. A su vez las infecciones por dengue (VDEN) están causadas por cuatro serotipos diferentes de VDEN antigénicamente relacionados (VDEN-1, VDEN-2, VDEN-3, VDEN-4). Otros flavivirus como la fiebre hemorrágica de Omsk, la fiebre del bosque de Kyasanur, o el virus Alkhurma son también causa de fiebres hemorrágicas en el hombre 3.
Filoviridae:Marburg y Ébola
Los virus Marburg y Ébola son virus poco conocidos que comparten ciertas similitudes con los rhabdovirus, aunque han sido propuestos y aceptados como miembros de la nueva familia Filoviridae.
Los Filovirus comprenden dos géneros: el Marburgvirus que contiene una especie (el virus Marburg del lago Victoria, del que hay numerosas cepas), y el género Ébolavirus que contiene 4 especies (Ébola Costa de Marfil, Sudán, Zaire y Reston) 4.
Son virus pleomórficos de longitud variable siendo la media de longitud de 790 nm para Marburg y 920 nm para Ébola. El diámetro del virión ronda los 80 nm. Están compuestos por una nucleocápside helicoidal rodeada por una envuelta lipídica donde se insertan hacia el exterior glucoproteínas. Dentro de la nucleocápside se encuentra una única hebra de ARN de polaridad negativa, no infecciosa, que codifica 7 proteínas diferentes (NP, VP35, VP40, GP, VP30, VP24 y L) 2.
Arenaviridae:Lassa y fiebres hemorrágicas americanas
La familia Arenaviridae incluye 23 especies virales, y dentro del género Arenavirus se encuentran aquellos causantes fiebres hemorrágicas en el hombre (virus Lassa, Junín, Machupo, Guanarito y Sabia).
Los arenavirus se clasifican en dos grupos antigénicos diferentes: los arenavirus del Viejo Mundo, que incluye virus endémicos en África (Lassa) y el virus de la Linfocoriomeningitis (LCMV) de distribución mundial, y los arenavirus del Nuevo Mundo (o grupo Tacaribe) que incluye virus endémicos en las Américas (Junín, Machupo, Guanarito, Sabia, Whitewater Arroyo, etc.).
Los arenavirus son virus pequeños, de entre 100-130 nm de diámetro, con una envuelta lipídica que contiene proyecciones glucoproteicas en su superficie. Dentro del virión hay ribosomas que tienen la apariencia de granos de arena cuando se observan al microscopio electrónico, característica que les da nombre.
El genoma viral está formado por dos segmentos lineales de ARN monocatenario: el segmento largo (L) que codifica la polimerasa viral, y una proteína de unión a cinc, y el fragmento corto (S) que codifica la nucleoproteína (NP), y dos glucoproteínas (GP-1 y GP-2). La mayor parte del genoma es de polaridad negativa, pero una pequeña parte es de polaridad positiva por lo que son virus "ambisense" 5.
Bunyaviridae:Crimea-Congo y Valle del Rift
Los Bunyavirus son virus esféricos de entre 85-100 nm de diámetro, con una membrana de la que emergen proyecciones de manera uniforme. Contienen un ARN monocatenario no infeccioso de polaridad negativa formado por tres segmentos, y se diferencian unos de otros precisamente por el diferente tamaño de los mismos. El segmento pequeño (S) codifica la proteína de la nucleocápside, el fragmento mediano (M) codifica el precursor de la glucoproteína del que se generan las dos glucoproteínas virales, y el fragmento largo (L) codifica la ARN polimerasa viral.
Dentro de esta familia (excluyendo los hantavirus, previamente descritos en esta serie), dos virus se asocian con hemorragias: el virus de la fiebre hemorrágica de Crimea-Congo (FHCC), el cual pertenece al género Nairovirus al que pertenecen otros 32 virus transmitidos por garrapatas, y el virus de la fiebre del valle del Rift (FHVR) que a su vez pertenece al género Phlebovirus 3.
Epidemiología de las fiebres hemorrágicas virales
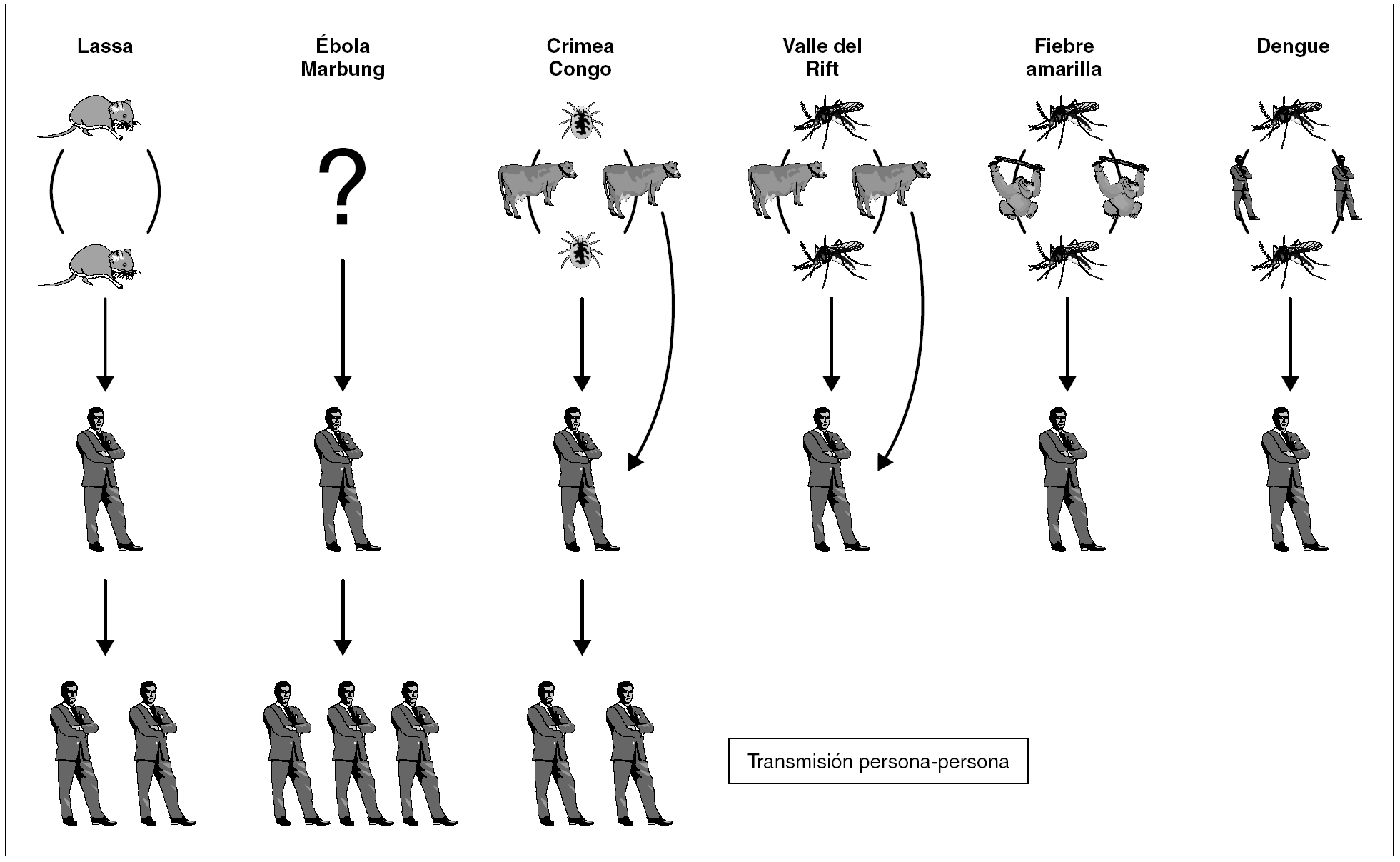
En general los virus causantes de fiebres hemorrágicas se mantienen en un ciclo zoonótico y pasan al hombre bien a través de un vector, un reservorio, o bien por contacto directo con un hospedador infectado. Algunos de ellos tienen gran facilidad para la transmisión persona-persona y son por tanto capaces de generar brotes nosocomiales (fig. 1).
Figura 1. Ciclos de transmisión de las fiebres hemorrágicas virales donde se refleja la transmisión a través de sus vectores y/o reservorios así como su posible transmisión directa en humanos.
Flaviviridae
Los virus dengue se transmiten de persona a persona (sin hospedador vertebrado intermedio) a través de mosquitos, siendo el hombre el principal reservorio del virus. De todos los vectores capaces de transmitir el virus, la hembra del mosquito Aedes aegypti es el vector más eficiente, permaneciendo infectivo el resto de su vida. Otros mosquitos del mismo género son capaces de transmitir la enfermedad como A. albopictus, A. polynesiensis y A. scutellaris.
El dengue se distribuye globalmente entre los paralelos 30° N y 40° S, siendo una enfermedad endémica en el Sudeste Asiático, el Pacífico, África, el Caribe y las Américas. La transmisión se produce durante todo el año en las áreas endémicas tropicales, sin embargo en la mayoría de los países existe un patrón estacional con una mayor incidencia en la época de lluvias 6.
El dengue es la enfermedad por arbovirus más importante en humanos, tanto por su morbilidad como por su mortalidad. Se estima que se producen 50.000.000 de infecciones por VDEN anualmente, con 500.000 hospitalizaciones debidas a fiebre hemorrágica por dengue (FHD) o síndrome de shock por dengue (DSS) con un total de 21.000 muertes 7. Desde hace 20 años el dengue no cesa de extenderse geográficamente, así como el mosquito vector, lo que contribuye a un incremento tanto en la frecuencia de aparición de epidemias como en la presencia de las formas más graves de la enfermedad, incluso en nuevas áreas 6. En los últimos años el dengue junto con la malaria constituye una de las enfermedades importadas más frecuentes a través de viajeros 8.
La fiebre amarilla es endémica y epidémica en 33 países del África Subsahariana y en áreas selváticas y rurales de América Latina. En Asia no se ha descrito la presencia del virus pero está presente el vector, lo que la convierte en zona de riesgo de aparición de la enfermedad 3.
La fiebre amarilla tiene dos ciclos de transmisión básicos que mantienen el virus en un ciclo selvático y en un ciclo urbano. En África tanto el ciclo selvático como el urbano se mantienen a través de mosquitos del género Aedes, mientras que en América los vectores selváticos son mosquitos del género Haemagogus y Sabethes. En el ciclo salvaje el hospedador vertebrado es el mono. El hombre se infecta cuando entra en contacto con mosquitos infectados en la selva, y cuando vuelve al entorno urbano el virus se asienta en las poblaciones urbanas de mosquitos, siendo su vector más importante Aedes aegypti. Los brotes parecen tener un pico de incidencia estacional que coincide con la estación lluviosa, siendo la población con mayor riesgo de adquirir la enfermedad aquella que vive cerca de la selva o que entra en ella para trabajar. Se estima que se producen aproximadamente 200.000 casos anuales con 30.000 muertes 9.
El virus del bosque de Kyasanur se transmite por garrapatas de la especie Haemaphysalis spinigera, que se ha encontrado sólo en ciertas zonas del oeste de India. El virus se transmite muy eficazmente por aerosoles, y se han descrito varios casos de infección adquirida en el laboratorio. En la actualidad el virus tiene importancia regional solamente, y no hay evidencia de transmisión fuera del área endémica 10.
La fiebre hemorrágica de Omsk es transmitida por garrapatas (Dermacentor sp.), aunque también se ha sugerido la transmisión a través del agua. El virus puede transmitirse a través de aerosoles y se consideran personas con riesgo de padecer la enfermedad los tramperos de ratón almizclero y los esquiladores. No se han descrito casos desde hace mucho tiempo 10.
Filoviridae
Los virus Ébola se distribuyen en las zonas húmedas de África Central y del Oeste, mientras que Marburg puede encontrarse en áreas más secas de África Central y del Oeste 11.
Los Filovirus causan zoonosis, aunque por el momento se desconoce su hospedador natural. Son altamente patógenos para los primates, incluyendo a los humanos, sin embargo, el virus Ébola Reston no ha demostrado patogenicidad en humanos aunque sí en primates. La infección en humanos siempre se da en áreas rurales tras contacto con primates no humanos.
La introducción de estos virus en comunidades humanas puede causar epidemias cuando no se utilizan las medidas de control de transmisión adecuadas, ya que se ha descrito la transmisión entre personas a través de fomites o gotas, y se ha descrito la infección por contacto con la piel de personas fallecidas debido a la presencia de virus en la piel y en las glándulas sudoríparas. La puerta de entrada del virus en los casos secundarios se supone que son las pequeñas heridas en la piel, y la conjuntiva 3. Por su parte el virus Marburg ha sido aislado en semen, habiéndose demostrado la transmisión sexual de la enfermedad. En el contexto de laboratorio estos virus son altamente infecciosos a través de aerosoles 10.
Arenaviridae
Los arenavirus se transmiten entre los roedores a través de la orina causando en ellos infección crónica. El hombre se infecta cuando entra en contacto con el virus excretado por estos roedores, y por ello su distribución geográfica coincide con la distribución del roedor específico (tabla 1). El modo de transmisión del virus desde el roedor al humano no se conoce exactamente, aunque probablemente se produzca a través de aerosoles, o bien mediante el contacto directo de cortes y arañazos en manos y pies con superficies contaminadas por el virus. Es frecuente la transmisión nosocomial cuando no se tienen en cuenta las medidas preventivas adecuadas, y se asocia el riesgo de infección persona-persona con la fase aguda de la enfermedad cuando el virus está presente en la garganta, o en el caso del virus Lassa por contacto sexual durante las fases de incubación o convalecencia 5.
La fiebre de Lassa es endémica en Nigeria, Sierra Leona, Liberia y Guinea, y se estima que produce aproximadamente unas 5.000 muertes al año. La fiebre de Lassa ha originado ocasionalmente casos importados en Europa, Estados Unidos, Japón y Canadá 12-17.
El único reservorio conocido para el virus Lassa es Mastomys sp., uno de los roedores semidomésticos más frecuentes en África. La enfermedad sigue un patrón estacional con los mayores picos de incidencia durante la estación seca (enero a marzo), aunque en zona endémica se presentan casos durante todo el año 18.
El virus Junín (fiebre hemorrágica argentina) se localiza en las zonas húmedas de Argentina, donde ocasiona epidemias anuales desde enero hasta agosto. Las personas con mayor riesgo de sufrir la infección son los granjeros, y aquellas que viven en áreas rurales, siendo la transmisión por aerosoles el mecanismo más probable de transmisión 19.
El virus Machupo (fiebre hemorrágica boliviana) se ha encontrado exclusivamente en Bolivia donde se mantiene a través de la infección crónica de roedores, y como los demás arenavirus se transmite a través de aerosoles de excretas de animales infectados, habiéndose descrito la transmisión persona-persona 20.
El virus Guanarito (fiebre hemorrágica venezolana) tiene una distribución muy localizada al sur del estado de Portuguesa en Venezuela, y aunque se dan casos durante todo el año, parece que existe un pico estacional entre noviembre y enero. Los agricultores son las personas con mayor riesgo de infección 20.
Por el momento no se ha descrito la presencia de otro arenavirus que no sea el virus de la Linfocoriomeningitis en Europa, Asia u Oceanía.
Bunyaviridae
El virus FHCC se mantiene en la naturaleza en garrapatas de la especie Hyalomma, transmitiéndose a otros hospedadores vertebrados (oveja, cabra, vaca, avestruces) cuando la garrapata realiza su ingesta de sangre. La amplia distribución de la enfermedad en Europa del Este, Asia, África, ciertas regiones de Rusia y China coincide con la distribución del vector. El hombre se infecta cuando es picado por una garrapata infectada, o por contacto con sangre del ganado infectado o de pacientes enfermos, siendo la transmisión nosocomial especialmente importante. La transmisión directa parece ocurrir a través del contacto de heridas en la piel con sangre u otros fluidos en el período de viremia. La mayoría de los pacientes son granjeros, veterinarios o trabajadores de matadero 21.
La enfermedad suele ocurrir de forma esporádica en los países endémicos, aunque parece seguir un patrón estacional en el que la mayor parte de los casos se dan en primavera u otoño.
La fiebre hemorrágica del valle del Rift es una zoonosis del ganado. El virus, inicialmente descrito en Kenia, se distribuye por África Subsahariana, Egipto, Arabia Saudita y Yemen. El hombre se infecta bien por la picadura de flebotomos o mosquitos (Aedes sp.), o por contacto con sangre u otros productos animales. No se ha demostrado transmisión directa persona-persona 22.
Patogenia
El modo por el que estos virus provocan patología en el hombre varía de unos a otros siendo cuatro los mecanismos principales de patogenicidad:
1. Daño vascular originado bien por la invasión directa de las células endoteliales por el virus, bien por la acción del complemento y determinadas citocinas, así como por el depósito de inmunocomplejos.
2. Desregulación de la coagulación caracterizada por la presencia de trombocitopenia, función plaquetaria anormal, desajustes en la producción hepática de factores de coagulación, y la presencia de coagulación intravascular diseminada (CID).
3. Desajuste inmunológico que provoca la inhibición de la respuesta inmunitaria permitiendo así una replicación viral incontrolada.
4. Daño celular directo en determinados órganos debido bien a la acción del virus o a la respuesta inflamatoria del huésped.
Dengue y fiebre amarilla
En una segunda infección por VDEN por un serotipo diferente al que causó la primoinfección, la existencia de una respuesta inmunitaria heteróloga frente al nuevo serotipo se ha asociado con la aparición de FHD 23 debido a la presencia de una respuesta inmunitaria de memoria. La presencia de anticuerpos no neutralizantes podría favorecer la opsonización de la partícula viral, favoreciendo su entrada y replicación en macrófagos y células dendríticas (un fenómeno denominado potenciación mediada por anticuerpos), induciendo una mayor carga viral y una fuerte activación de células T de memoria, además de la liberación de un gran número de citocinas y mediadores químicos, lo que llevaría al aumento de la permeabilidad vascular, característica principal del dengue hemorrágico. Dado que sólo un 3% de las personas con reinfección por VDEN desarrolla FHD parece que otros factores relacionados con el hospedador podrían estar implicados en el progreso de la enfermedad, tales como la edad, raza, o la presencia de enfermedades crónicas 24, así como determinados defectos en la coagulación y fibrinólisis 25. También se ha identificado la presencia de cuadros hemorrágicos en primoinfecciones, lo que implica que determinadas cepas virales pueden tener una mayor virulencia 26.
En las infecciones por fiebre amarilla, la patogenicidad se debe a la acción directa del virus sobre determinadas células epiteliales (hígado, riñón, etc.) o miocárdicas. La muerte suele acontecer como resultado de fallo renal y/o hepático, aunque el daño cardíaco contribuye a un peor pronóstico 27.
Ébola y Marburg
La patogénesis de los filovirus parece ser debida a la combinación del daño directo del virus sobre los tejidos, y la permeabilidad vascular mediada por la liberación de citocinas, y por el desajuste de la respuesta inmunitaria del huésped que impide la eliminación del virus debido a la infección de macrófagos y monocitos 28.
El aumento de la permeabilidad vascular se debe a la acción directa de la infección viral, y a la elevación de citocinas como el factor de necrosis tumoral a (TNF-α), y varias interleucinas (IL-2, IL-10), así como el interferón α y γ (IFN-α, IFN-γ). La desregulación de la cascada de coagulación también lleva a la aparición de CID.
Lassa y fiebres hemorrágicas americanas
Probablemente los arenavirus son capaces de ocasionar inmunosupresión en el organismo infectado, lo que facilita su cronificación en los roedores, y contribuye a su patogenicidad en humanos. El mecanismo exacto por el que se produce la hemorragia y el aumento en la permeabilidad vascular no es del todo conocido, pero se han observado cambios histopatológicos mínimos en los tejidos del hospedador, y no existe evidencia de la implicación de células inflamatorias. Por otro lado se ha demostrado la invasión directa del endotelio vascular por el virus y la secreción de citocinas por parte de los macrófagos puede ser en parte responsable de algunos de los cambios circulatorios que se producen y se han asociado a un peor pronóstico. Al contrario que en otras FHV la activación de la cascada del complemento, o de la cascada de coagulación, no parece tener relevancia en la patogénesis de la enfermedad 5.
Crimea-Congo y Valle del Rift
En las infecciones causadas por el virus de FHCC es frecuente la presencia de fragilidad capilar, lo que sugiere que se produce la infección del endotelio vascular, y contribuye al fallo hemostático al estimular la agregación/desagregación plaquetaria con la consiguiente activación de la cascada del complemento. En paralelo se observa una marcada trombocitopenia y un recuento plaquetario extremadamente bajo en la fase temprana de la enfermedad en aquellos casos con peor pronóstico. También la presencia de CID es una característica del proceso de la enfermedad 21.
El virus de la FHVR es muy hepatotropo, siendo el hígado donde se encuentra la mayor parte de las lesiones debido a la acción directa del virus, aunque también se ha descrito la degeneración del tejido miocárdico, y la presencia de neumonitis intersticial 29.
Sintomatología
La presentación clínica de las fiebres hemorrágicas es muy variada. Además, el potencial de provocar una fiebre hemorrágica varía de un virus otro siendo para algunos de ellos muy bajo (FHVR < 1%). Con la mayoría de virus, un porcentaje de personas infectadas, no enferma o tiene cuadros clínicos leves, tal como se desprende de estudios seroepidemiológicos en áreas endémicas, que muestran que hay un porcentaje de la población que ha sido infectada por virus con potencial de provocar fiebre hemorrágica, pero que sin embargo no han desarrollado la enfermedad o ésta ha sido tan leve que no ha merecido consulta o tratamiento30,31.
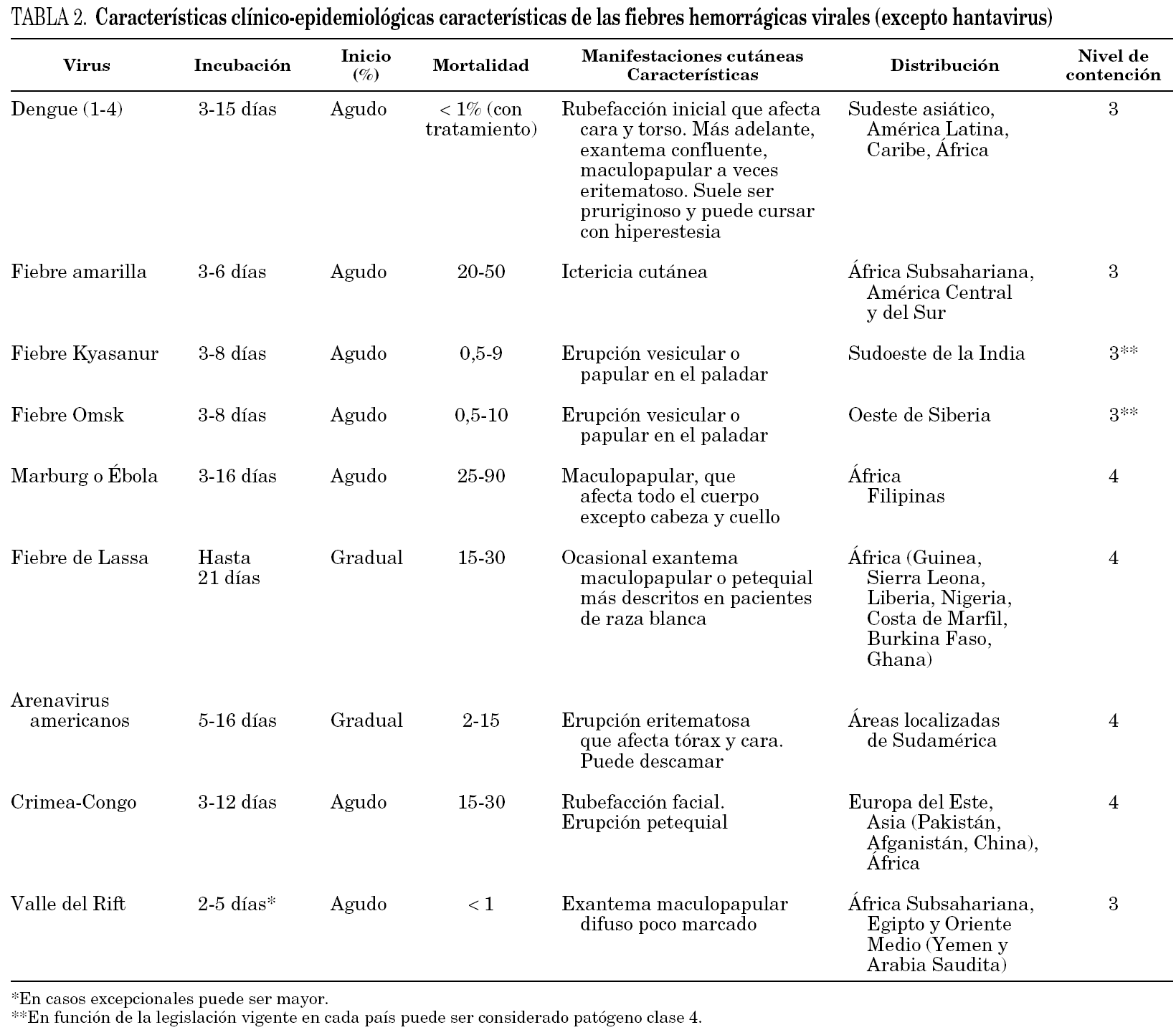
El período de incubación oscila entre un mínimo de 2 días y un máximo de 21 días (tabla 2).
El cuadro clínico de los FHV puede incluir un corto período prodrómico con fiebre, artromialgias, cefalea, fatiga y debilidad, náuseas, vómitos y diarreas, tos, dolor torácico y abdominal. Son síntomas totalmente inespecíficos que por sí solos no hacen pensar en una fiebre hemorrágica. La fiebre no suele tener ningún patrón especial, puede alcanzar temperaturas de hasta 41 °C y en ocasiones es bifásica.
Más adelante suele haber una bradicardia, junto a faringitis, conjuntivitis, taquipnea, disnea, dificultad para tragar, y en algunos casos una erupción maculopapular (tabla 2). Los pacientes que una vez infectados desarrollan una enfermedad hemorrágica pueden mostrar síntomas y signos clínicos alguno de los cuales son más característicos de unos u otros virus (tabla 3). Las manifestaciones hemorrágicas son muy diversas e incluyen: petequias, gingivorragias, epistaxis, hemoptisis, hematuria, hematemesis, melenas o sangrado excesivo en los lugares de punción.
Las hemorragias que caracterizan a estas enfermedades no suelen ser el motivo de la alta mortalidad. Sólo el 20% de los afectados por el virus Ébola tienen manifestaciones hemorrágicas 32. Además de las hemorragias estas enfermedades causan disfunciones o afectan a otros órganos, sobre todo al sistema nervioso central, riñones o hígado. La alta mortalidad está provocada más por el shock y el fallo multiorgánico que por las pérdidas sanguíneas.
Mortalidad
Generalmente la muerte ocurre durante la segunda semana de enfermedad, a los 9-10 días después del inicio del proceso 33. La mortalidad difiere de unos virus a otros, y en algunos de ellos, ha variado sustancialmente debido al tratamiento 34,35 (tabla 2).
Sospecha de diagnóstico
La aparición de los síntomas descritos anteriormente en una persona que ha efectuado un viaje reciente con historia epidemiológica de exposición rural en un área endémica o con historia de contacto con un enfermo afectado por un brote epidémico, debe considerarse como un caso de sospecha de fiebre hemorrágica viral. El diagnóstico diferencial de las FHV incluye muchas causas de fiebre en los trópicos, siendo importante la exclusión de malaria como principal causa mediante la realización de sucesivas extensiones de sangre. Otros patógenos que deben considerarse en el diagnóstico diferencial de una fiebre hemorrágica viral incluyen desde la hepatitis o el sarampión como agentes virales, a infecciones por algunas Rickettsias, Salmonella typhi, y principalmente Leptospira (tabla 4).
Datos de laboratorio
Generalmente hay una leucopenia (excepto en la fiebre de Lassa), aumento del hematócrito, trombocitopenia, anemia y aumento de transaminasas. Suele haber trastornos de la coagulación y el análisis de orina puede revelar una proteinuria y hematuria.
Convalecencia y secuelas
El período de convalecencia puede ser largo y complicado 36. En la fiebre de Lassa ocurre sordera en el 25-33% de casos con recuperación a veces parcial en la mitad de ellos al cabo de unos meses 33.
Se ha descrito también pérdida del cabello y dificultad en la coordinación en la convalecencia de muchas de las enfermedades causadas por los virus hemorrágicos. Otras secuelas documentadas son: mielitis transversa, pericarditis, orquitis 37.
Diagnóstico microbiológico de las fiebres hemorrágicas virales
En el caso de las FHV es crítica la rapidez con la que se realiza el diagnóstico, tanto para poder proporcionar el tratamiento adecuado como para aplicar cuanto antes las medidas de protección adecuadas para el personal sanitario y los contactos.
Las fiebres hemorrágicas se pueden diagnosticar en la fase más temprana de la enfermedad mediante aislamiento viral, detección del genoma viral por reacción en cadena de la polimerasa-transcripción inversa (RT-PCR), y detección de antígeno, o bien posteriormente mediante la detección de la presencia de anticuerpos.
La muestra clínica utilizada para el diagnóstico molecular es preferentemente el suero o el plasma. El uso de líquido cefalorraquídeo es útil cuando existe evidencia de manifestaciones neurológicas en el caso de presentaciones atípicas de dengue 38 o virus Lassa 39. El exudado nasofaríngeo y la orina son también muestras adecuadas para detectar la presencia de virus Lassa incluso después de la recuperación 40. También se ha detectado virus Ébola en semen después del restablecimiento 3.
Ha de tenerse especial cuidado en la obtención de las muestras para análisis, y deben etiquetarse adecuadamente para que sea evidente su infectividad y evitar de este modo infecciones en el personal de laboratorio. Las muestras con sospecha de contener el virus viable deben ser enviadas para su inactivación y procesamiento a laboratorios con instalaciones de contención adecuadas al nivel de bioseguridad correspondiente al virus causante de la infección (tabla 2) 3,41,42.
Diagnóstico molecular de las fiebres hemorrágicas virales
Puesto que todas las FHV están causadas por virus ARN, para su detección por PCR es necesario un paso previo de retrotranscripción para llevar a cabo la amplificación. Existen versiones de está metodología en uno (RT-PCR) o dos pasos (RT + PCR) y la utilización de una segunda ronda de PCR (PCR nested o anidada) incrementa la sensibilidad y especificidad del diagnóstico molecular aunque este abordaje retrasa la obtención de resultados y aumenta el riesgo de contaminación debido a la manipulación adicional de las muestras 43.
Los flavivirus (VFA y VDEN) pueden ser eficazmente diagnosticados por métodos moleculares en la fase aguda de la enfermedad, aunque es siempre aconsejable realizar en paralelo aislamiento viral y serología. En cuanto al diagnóstico molecular de VDEN, encontramos como limitación la brevedad del período de viremia que no permite la detección del virus a partir del quinto día tras la aparición de los síntomas 44,45.
Se han descrito distintos métodos para la detección específica de Filovirus que han demostrado muy buena sensibilidad 43,46.
En el caso de los Arenavirus, la fiebre de Lassa puede detectarse en todos los pacientes a partir del tercer día de enfermedad, mientras que el uso de técnicas de inmunofluorescencia tan sólo detecta la infección en un 52% de los pacientes 5. La reciente identificación de cepas de este virus en Liberia, Sierra Leona y Guinea demuestran que la variabilidad natural de este virus hacen que algunos métodos anteriormente descritos no sean de utilidad en el diagnóstico de las infecciones causadas por este virus, y alertan de la necesidad de precaución en la utilización de métodos moleculares como método diagnóstico 43. A su vez, en las infecciones causadas por el virus Junín se ha descrito el uso de dos protocolos de RT-PCR que utilizadas conjuntamente aportan una gran fiabilidad al diagnóstico molecular de la infección 47.
Los virus FHCC y FVR pueden ser detectados mediante RT-PCR o PCR en tiempo real. Sin embargo, estos métodos han demostrado poca sensibilidad y actualmente su uso es experimental por lo que deben siempre deben ser complementados con el aislamiento viral y la serología 43.
Debido a que varios virus pueden ser compatibles en la presentación de una fiebre hemorrágica viral, el uso de PCR multiplex capaces de detectar distintos patógenos al mismo tiempo, podrían ser útiles en el diagnóstico de las FHV, sin embargo por el momento son escasos los métodos descritos con este fin 43,48,49.
Las técnicas de PCR en tiempo real obtienen una notable sensibilidad y especificidad, a la vez que permiten la obtención de resultados en un breve período de tiempo. El uso de esta tecnología aporta una ventaja adicional como es la posibilidad de cuantificar la carga viral presente en muestra clínica lo que permite su uso como parámetro pronóstico de la enfermedad, en la monitorización del tratamiento, y en la evaluación del riesgo de transmisión del virus a los contactos. En este momento se han descrito el uso de esta metodología para la detección de todos los géneros virales causantes de fiebres hemorrágicas 50.
Entre las desventajas que supone el uso de métodos moleculares en el diagnóstico de las FHV encontramos los comúnmente asociados a este tipo de metodologías. Entre ellas encontramos los problemas de inhibición, con la posibilidad de generar falsos negativos que, debido a la gravedad y facilidad de transmisión de estas patologías, reviste especial preocupación.
Diagnóstico serológico de las fiebres hemorrágicas virales
En la actualidad existe una gran carencia de test comerciales disponibles para el diagnóstico serológico de este tipo de infecciones por lo que generalmente se realizan en laboratorios de referencia.
La detección de antígeno viral mediante ensayos de ELISA es uno de los mejores test para la identificación de los pacientes con fiebre hemorrágica viral debido a su rapidez y eficacia diagnóstica, siendo generalmente positivo en aquellos enfermos más graves, que a su vez son los que necesitan mayor soporte y constituyen un mayor riesgo de diseminación de la enfermedad.
La detección de inmunoglobulina M (IgM) o la determinación de un aumento de cuatro veces en el título de IgG son considerados criterios diagnósticos de infección aguda. Los ensayos de captura para la detección de IgM constituyen una de las herramientas más sensibles para la identificación de la infección aguda, y son los que presentan una mayor especificidad 3.
Existe una gran variedad de equipos comerciales para el diagnóstico serológico de flavivirus51, sin embargo, la serología de flavivirus presenta algunas limitaciones, siendo la más importante la existencia de reacciones cruzadas entre ellos que se ven adicionalmente complicadas en las infecciones repetidas por diferentes virus del mismo grupo, así como en individuos vacunados frente a los virus de la fiebre amarilla, encefalitis japonesa o encefalitis transmitida por garrapatas. En la actualidad existen reactivos de inmunofluorescencia indirecta disponibles comercialmente que permiten analizar simultáneamente la presencia de anticuerpos frente a diferentes flavivirus, lo que facilita la caracterización de las infecciones producidas por estos agentes 51.
En el caso de los filovirus la mayor parte de los pacientes muere antes de desarrollar una respuesta serológica específica, sin embargo en aquellos que sobreviven el tiempo necesario puede detectarse la presencia de IgM e IgG.
En el caso de la fiebre de Lassa un gran número de pacientes ya presenta anticuerpos frente al virus (53% IgG y 67% IgM) en su ingreso en el hospital 18. El uso de test de ELISA tanto para la detección de IgM como de antígeno viral tienen un alto grado de especificidad y sensibilidad para el diagnóstico de la infección aguda 52 por arenavirus, aunque por el momento no existen disponibles reactivos comerciales, y los reactivos deben ser proporcionados por laboratorios especializados capaces de producirlos en condiciones de bioseguridad de nivel 4.
En el caso de los virus FHCC y FHVR se ha observado que aquellos casos negativos por PCR pero positivos por cultivo viral presentan valores positivos de IgM por lo que la combinación de métodos moleculares y detección de IgM es una buena alternativa al cultivo viral como aproximación diagnóstica 43.
En el caso de los flavivirus y arenavirus, la seroneutralización permite la identificación y caracterización serológica inequívoca de las infecciones, sin embargo, a su laboriosidad y al tiempo necesario para obtener un resultado, se suma el gran inconveniente de la necesidad del uso de instalaciones de bioseguridad adecuados para el cultivo y manipulación de los distintos virus, lo que convierte la neutralización en un ensayo confirmatorio que se realiza sólo en laboratorios de referencia.
Cultivo viral
Aunque el cultivo viral constituye un diagnóstico definitivo, hay que tener en cuenta ciertas limitaciones en su uso:
1. La toma de muestra debe realizarse en la fase aguda de la enfermedad coincidiendo con el período de viremia.
2. La presencia de anticuerpos frente al virus puede interferir con el cultivo del mismo.
3. Las muestras obtenidas deben ser manejadas teniendo en cuenta ciertas condiciones necesarias en su transporte y conservación.
4. Es necesario el uso de laboratorios de nivel de bioseguridad 3 o 4 dependiendo del virus a cultivar.
Las líneas celulares más adecuadas para el aislamiento de VDEN y VFA son aquellas derivadas de mosquito (C6/36, AP61, TRA-284), aunque pueden utilizarse otras líneas como las células Vero-E6 para su cultivo, o la inoculación intratorácica de mosquitos 44,45. El resto de los virus pueden ser cultivados eficientemente en células Vero, o mediante inoculación en animales de laboratorio (cobayas o ratones lactantes).
Tratamiento
La ribavirina tiene actividad contra Arenavirus 34,35 y Bunyavirus pero no contra Filovirus o Flavivirus. Para estos últimos el único tratamiento posible hasta el momento es el de soporte (balance hidroelectrolitico, oxigenación, antibióticos para las sobreinfecciones, transfusiones, etc.).
El tratamiento con ribavirina está justificado ante la sospecha de una fiebre hemorrágica por Arenavirus o Bunyavirus. Hay que continuar durante 10 días si se confirma el diagnóstico o discontinuarla en caso contrario.
En la fiebre de Junín, el tratamiento con plasma de sujetos convalecientes de la enfermedad ha dado buenos resultados35, aunque es difícil de aplicar. El desarrollo de anticuerpos monoclonales quizá dará nuevas herramientas de tratamiento en el futuro.
Profilaxis
Son limitadas las vacunas disponibles frente a los virus causantes de fiebres hemorrágicas.
Existe una vacuna viva atenuada frente a la fiebre amarilla (cepa 17D) que ha demostrado su eficacia y seguridad, siendo recomendable la vacunación de la población rural mayor de 9 meses en áreas endémicas, así como de los trabajadores que deban entrar en la selva. Aunque la aplicación de la vacuna aún no es uniforme se ha observado que las campañas masivas de vacunación empiezan a tener efecto en la presencia de la enfermedad en áreas endémicas 9.
La vacunación frente a VFA está regulada como medida de protección para viajeros internacionales. Sin embargo, los niños menores de 6 meses, mujeres embarazadas e inmunocomprometidos, así como las personas que presenten alergia a las proteínas del huevo o la gelatina, pueden ser excluidos de la obligatoriedad de vacunación siempre que vayan acompañados de un certificado médico especificando las razones por las cuales no fue inmunizado. Sin embargo, cuando el riesgo de infección es elevado, la vacunación debe valorarse. La vacuna debe ser administrada al menos 10 días antes del viaje y tiene una validez de 10 años. Es de señalar que se han descrito casos de reacciones adversas debidas a la vacunación, tratándose generalmente de reacciones leves, aunque se han descrito casos de reacciones graves a la vacunación presentándose bien como enfermedad neurotrópica, o como enfermedad viscerotrópica.
Se dispone de una vacuna viva atenuada frente al virus Junín (Candid#1) que ha sido estudiada en voluntarios, y sometida a ensayos clínicos en la población de las áreas afectadas por la enfermedad con resultados prometedores 53.
Se han desarrollado vacunas inactivadas en Europa del Este para el control de las infecciones por el virus FHCC, así como existe una vacuna frente al virus FVR, pero por el momento no se aplican masivamente a la población ni son de uso recomendado en viajeros, estando su uso restringido a personal de alto riesgo (veterinarios, virólogos, etc.). En el caso del virus de la FHVR, la vacunación del ganado con la vacuna disponible para ello puede evitar la aparición de epidemias, aunque no la transmisión esporádica 29.
En ausencia de vacunas, la única medida profiláctica frente a las infecciones en las que el virus se mantiene en un ciclo selvático o urbano gracias a la presencia de un artrópodo, es el control vectorial, aunque no siempre es posible contar con la infraestructura de salud pública, el apoyo económico suficiente ni las políticas sanitarias adecuadas. El uso de repelentes adecuados para evitar la picadura de mosquitos y garrapatas, y el uso de ropa protectora e insecticidas es recomendable tanto para viajeros como para residentes en áreas endémicas para protegerse de la infección. En el caso de las infecciones que tienen como reservorio roedores es necesaria la eliminación eficaz de los mismos en los núcleos urbanos, pero la transmisión rural esporádica o la transmisión persona-persona no se puede evitar.
Dado que la fuente primaria del virus Ébola, así como el mecanismo por el que el hombre se infecta es desconocido, la prevención primaria no es posible, aunque se debe controlar el contacto con enfermos o animales muertos o enfermos en áreas endémicas.
En las FHV en la que existe riesgo de transmisión persona-persona y por tanto existe un riesgo de infección nosocomial las medidas de control deben ser enfocadas a limitar la diseminación de la enfermedad en casos secundarios. Esto implica el aislamiento de los casos sospechosos así como del seguimiento de los contactos para identificar posibles casos asociados, así como una eficaz implementación de las prácticas de control de transmisión (tabla 5).
Consideraciones especiales
Los pacientes con sospecha de padecer FHV de transmisión directa deben ser inmediatamente aislados del resto de pacientes, y los cuidados de enfermería deben ejecutarse teniendo en cuenta un riguroso control de las barreras de protección (tabla 5). El personal de laboratorio que procese las muestras en ensayos rutinarios debe ser correctamente advertido del riesgo de infección de las muestras, y debe prestarse especial atención a la eliminación de desechos de laboratorio y elementos punzantes que hayan estado en contacto con material infectado. Los pacientes que mueran debido a una FHV deben ser inmediatamente enterrados o incinerados por equipos especializados para evitar el riesgo de contaminación y mayor dispersión de la enfermedad.
En el caso de este tipo de infecciones es muy importante una correcta identificación de los contactos, lo que requiere la identificación del personal hospitalario, familiares, y de todos aquellos que hayan tenido un contacto cercano con el paciente antes de haberse realizado el diagnóstico. Se consideran contactos de alto riesgo aquellos que en algún momento fueron expuestos a la sangre u otros fluidos biológicos del paciente durante las 3 semanas posteriores a la aparición de los síntomas, en este grupo se debe controlar la temperatura corporal dos veces al día durante al menos 3 semanas tras el último contacto. Si en alguno de ellos se produce un aumento de la temperatura debe ser inmediatamente hospitalizado, aislado y tratado con ribavirina si se considera adecuado.
Los contactos casuales tienen un riesgo bajo de contraer la enfermedad pero deben ser advertidos de ello y se les debe solicitar que informen de la aparición de fiebre 3.
Agradecimientos
C. Domingo está contratada mediante el Convenio establecido entre la Dirección General de Salud Pública del Ministerio de Sanidad y Consumo (DGSP-MSC) y el Instituto de Salud Carlos III (ISCIII) para el desarrollo del Plan Nacional de Vigilancia y Control de las Fiebres Hemorrágicas Virales. C. Domingo y J. Gascón son investigadores pertenecientes a la Red Investigación Cooperativa en Enfermedades Tropicales (RICET).
Los autores quieren agradecer al Dr. José María Eiros su participación en la revisión del manuscrito, y al Dr. Antonio Tenorio su esfuerzo en el desarrollo del Plan Nacional de Vigilancia y Control de las Fiebres Hemorrágicas Virales.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Avances en el tratamiento de la infección por el virus VIH"
Disponible en: http://www.doyma.es/eimc/formacion
1 junio / 31 diciembre 2005