Fundamento del tratamiento antifúngico empírico
El tratamiento antifúngico empírico (TAE) tiene como principal objetivo mejorar el mal pronóstico de los pacientes con infección fúngica invasora (IFI), mediante el tratamiento precoz de la misma. Los fundamentos en los que se sustenta el TAE son: a) en los pacientes con neutropenia posquimioterapia el riesgo de IFI, aunque no bien cuantificado es real; b) el diagnóstico de las IFI es difícil, y c) el tratamiento de las IFI confirmadas, en general y en estos pacientes en particular, es poco eficaz.
Las directrices de la Sociedad Americana de Enfermedades Infecciosas (IDSA) recomiendan iniciar el TAE en los pacientes que continúan con fiebre después de 5-7 días de tratamiento antibacteriano y en los que la resolución de la neutropenia no es inminente (B-II) 1. La base de esta recomendación son dos estudios realizados en la década de 1980 que comparan el TAE con un grupo control. El primero de ellos, incluyó 50 pacientes que fueron distribuidos de forma aleatoria en tres grupos después de 7 días de fiebre persistente. En el primer grupo se suspendió el tratamiento antibacteriano, en el segundo se mantuvo y en el tercero se añadió anfotericina deoxicolato. Aunque la frecuencia de IFI resultó inferior en los pacientes que recibieron anfotericina, las diferencias no eran significativas entre los grupos de tratamiento (6% frente a 19%; p = NS) 2. El segundo estudio, realizado por la European Organization for Research on Treatment of Cancer (EORTC), incluyó 132 pacientes aleatorizados a recibir anfotericina deoxicolato (0,6 mg/kg/día) o placebo tras 5 días de fiebre persistente. Los resultados globales mostraron una tendencia favorable hacia el uso empírico de anfotericina: menor persistencia de fiebre (69% frente a 53%; p = NS); menor frecuencia de IFI (1,5% frente a 9%; p = NS) y, menor mortalidad relacionada con las IFI (0% frente a 6%; p = 0,05). Los resultados fueron más concluyentes en el subgrupo de pacientes que no habían recibido profilaxis antifúngica (78% frente a 45% de apirexia; p = 0,04), y en el subgrupo de pacientes con diagnóstico documentado de infección (75% frente a 41% de apirexia; p = 0,03) 3. Analizados de forma estricta, estos datos, sólo permiten concluir que anfotericina utilizada de forma empírica en pacientes con neutropenia febril persistente es mejor antitérmico que el placebo. Sin embargo y pese a que hasta la fecha ningún estudio haya demostrado que el TAE sea más eficaz que el placebo en reducir la frecuencia de IFI o la mortalidad, su uso se ha generalizado hasta convertirse en el tratamiento estándar de este síndrome y constituir la primera indicación de uso de antifúngicos.
Eficacia, efectividad, eficiencia y seguridad del tratamiento antifúngico empírico
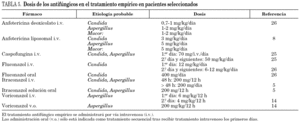
En esta situación se han realizando numerosos ensayos clínicos con el objetivo de definir el antifúngico de elección en el tratamiento del síndrome febril persistente en el paciente neutropénico. Sin embargo llama la atención que pese a la ausencia de evidencia anteriormente señalada, no se haya vuelto a realizar ningún estudio para conocer si el TAE es realmente eficaz. Los resultados de estos estudios en su mayoría han demostrado que los fármacos comparados (anfotericina deoxicolato, fluconazol, itraconazol, anfotericina de dispersión coloidal, anfotericina liposomal y caspofungina) son equivalentes (A-I) 4-8 y en sólo un estudio voriconazol resultó inferior a anfotericina liposomal (A-I) 9. En cuanto a seguridad, los ensayos clínicos realizados señalan que fluconazol, itraconazol y anfotericina liposomal son mejor tolerados y más seguros que anfotericina deoxicolato 4,5,7; anfotericina liposomal mejor tolerada que anfotericina complejo lipídico 10; y caspofungina y voriconazol mejor tolerados que anfotericina liposomal 8,9 (tabla 1). En todos estos estudios la anfotericina deoxicolato, se administró a dosis de 0,6-0,7 mg/kg/día en un intervalo de 4-6 h 4,5,7. Sin embargo se ha demostrado que la administración de anfotericina deoxicolato a dosis de 0,79 a 0,98 mg/kg/día en perfusión continua (24 h o, al menos a una velocidad de infusión < 0,08 mg/kg/día), reduce la frecuencia de efectos adversos relacionados con la infusión, la nefrotoxicidad y la mortalidad a los 3 meses, comparada con su administración en el tiempo de perfusión habitual (4 h), incluso en los receptores de TPH que reciben fármacos anticalcineurínicos (tabla 1) (A-I) 11,12. Con la anfotericina deoxicolato en perfusión continua se consiguen administrar dosis muy elevadas, dosis inicial 1 mg/kg/día con incremento escalonado hasta 2 mg/kg/día, y prolongadas, 16 días (7-72), con buena tolerancia renal (B-II) 13.
Como hemos señalado anteriormente ninguno de estos estudios han respondido a la pregunta principal: ¿cuál es la eficacia del TAE en los pacientes con neutropenia? La razón principal es que en el conjunto de variables usadas para la evaluación de la eficacia se incluyen dos que son inapropiadas: la desaparición de la fiebre durante la neutropenia y la suspensión prematura del tratamiento por ineficacia y/o por efectos adversos. La desaparición de la fiebre es una variable muy inespecífica de curación fúngica, más aún en estos pacientes en los que concurren múltiples causas de fiebre. Paradójicamente es la variable más influyente en el resultado final, porque constituye un criterio de inclusión imprescindible. En cuanto a la suspensión prematura del tratamiento, sorprende su inclusión como variable de eficacia cuando es una variable de seguridad y, evidentemente, de efectividad.
A pesar de estas limitaciones, estos estudios contienen importante información sobre la neutropenia febril y los nuevos antifúngicos. Los tres estudios liderados por T. Walsh 7-9, son los más apropiados para obtener esta información ya que son los que incluyen un mayor número de pacientes, en total 2.619 pacientes, los que describen con mayor detalle el método, y los más homogéneos (tabla 2). Para aproximarnos a la eficacia del TAE, podríamos considerar que todos los pacientes con fiebre tienen una IFI y que la desaparición de la fiebre indica la curación de la misma. En este supuesto la eficacia del TAE es del 44%. Ahora consideremos que la mejor variable para medir la eficacia del TAE es la respuesta de la IFI basal. En total hubo 95 episodios de IFI basal (3,6%) y de ellos curaron 48 con el TAE. En este supuesto la eficacia del TAE sería del 50,5%. A semejanza de los criterios diagnósticos de las IFI, podríamos decir que la eficacia posible (apirexia) del TAE sería del 44% y la eficacia probada (curación de la IFI basal) del 50,5%. La eficacia probada del TAE en estos estudios resulta similar a la mejor eficacia obtenida con el tratamiento antifúngico dirigido en pacientes neutropénicos con IFI establecida; 50% de curación para la candidiasis y 53% para la aspergilosis invasiva 14,15. Si a estos resultados añadimos que durante el TAE el 4,9% de los pacientes desarrollan una IFI de brecha (129 episodios/2.619 pacientes) 7-9 la eficacia del TAE se debilita aún más.
Analicemos ahora la efectividad del TAE. La efectividad posible del TAE es del 44% mientras que la efectividad probada cae al 1,8% (58 IFI basales curadas en 2.168 pacientes tratados). Por lo tanto sería necesario tratar 100 pacientes para curar 1,8 pacientes con IFI (NNT). O de otra manera, para curar 1,8 pacientes, 98,2 recibirían tratamiento sin ningún beneficio 16. Con estos datos podemos afirmar que el TAE es un tratamiento poco eficaz, y nada efectivo.
Otro aspecto debatible es la recomendación sobre el momento de inicio y duración del TAE. Se recomienda que el TAE se inicie a partir de las 96 h de fiebre persistente y neutropenia y que se mantenga durante al menos 14 días, y siempre que hayan pasado 7 desde la recuperación de la neutropenia 7-9. Estas recomendaciones son arbitrarias y prescinden de los principios clínicos básicos, al englobar síndromes tan diferentes como la fiebre sin focalidad, la fiebre con neumonía o la fiebre con dolor abdominal, y obligan a un manejo rígido de la duración del tratamiento que no tiene en cuenta la evolución del paciente, ni los resultados de las pruebas diagnósticas.
La seguridad que debe ser prioritaria en la evaluación de cualquier tratamiento, lo es más en el TAE, porque como acabamos de ver sólo una minoría de los pacientes que lo reciben tiene realmente una IFI. En los estudios de Walsh et al 7-9, el TAE no es un tratamiento inocuo, porque hasta en el 13% de los pacientes se indica la retirada prematura del mismo principalmente por efectos adversos.
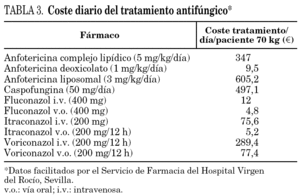
El coste económico es la diferencia más notable y objetiva entre los diferentes fármacos utilizados en el TAE como se muestra en la tabla 3. A la vista de las cifras de coste del tratamiento/día, se deduce que el TAE es una estrategia muy poco eficiente para la mayoría de los antifúngicos empleados.
En definitiva el TAE tradicional, no ha demostrado mayor eficacia que el placebo, no obtiene mejores resultados que el tratamiento antifúngico dirigido, tiene una efectividad mínima, no es inocuo y, con la mayoría de los antifúngicos, es muy poco eficiente. Por todas estas razones consideramos que el TAE universal no está justificado (D-I).
Tratamiento antifúngico empírico en pacientes seleccionados
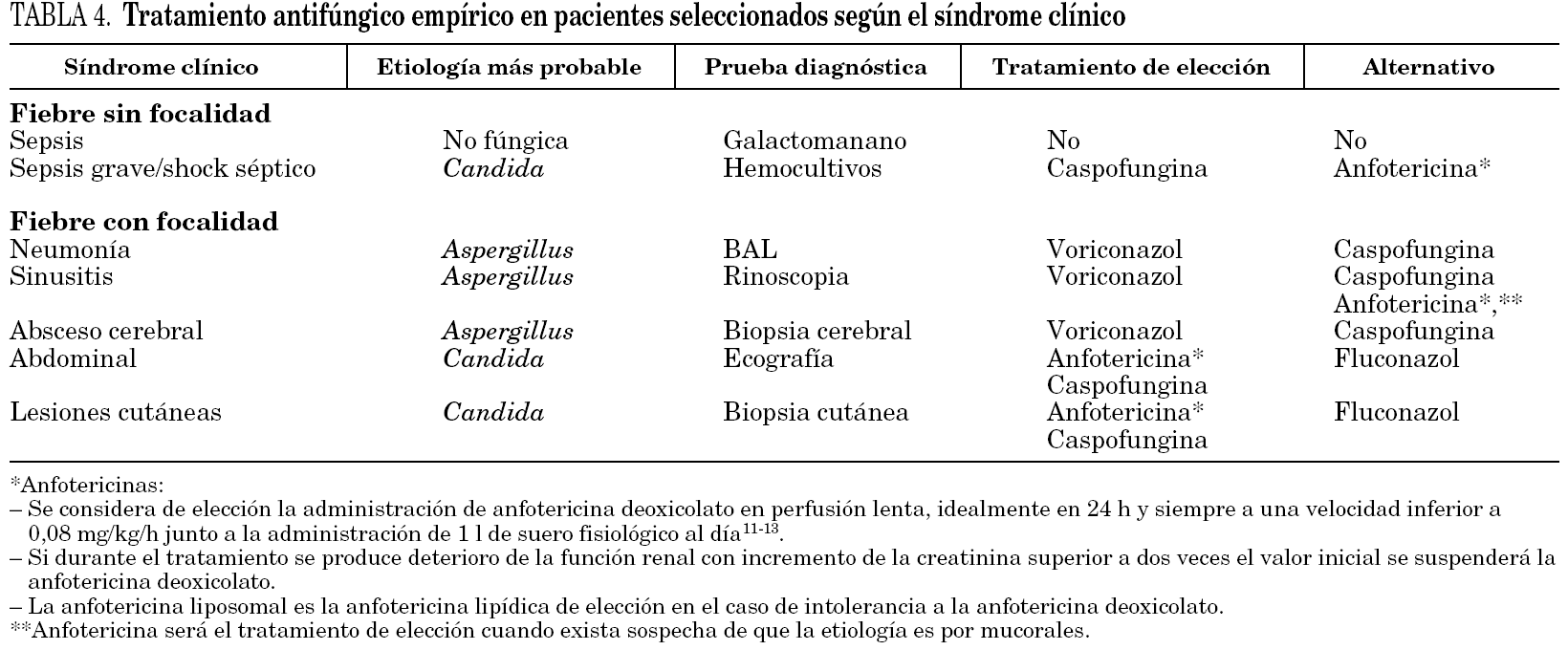
Frente al TAE universal proponemos el TAE en pacientes seleccionados por factores de riesgo y dirigido por criterios clínicos, como se recoge en la tabla 4. Para ello es necesario tener en cuenta los siguientes conceptos generales.
1. La etiología de la fiebre persistente en los pacientes con neutropenia es muy diversa, e incluye las infecciones por bacterias, hongos, virus y protozoos, los fármacos, las reacciones a los hemoderivados, y la propia neoplasia.
2. La etiología principal de las IFI en estos pacientes es Candida spp. (51%) y Aspergillus spp. (40%) 8.
3. El principal factor de riesgo para que la etiología de la candidemia sea Candida no albicans es la profilaxis antifúngica 17.
4. Las manifestaciones clínicas de las infecciones por Candida spp. y Aspergillus spp. son muy diferentes. La neumonía es la manifestación más común de la aspergilosis invasiva (79%) seguida de la sinusitis (19%), mientras que la candidemia (53%) y la candidiasis crónica diseminada (17%) lo son de la candidiasis invasora 9.
El primer paso en la evaluación clínica de los pacientes con neutropenia febril persistente sin diagnóstico tras la anamnesis, la exploración física y la radiografía de tórax, es establecer si existen o no síntomas y/o signos de infección, es decir si existe focalidad.
Pacientes con neutropenia febril persistente con focalidad
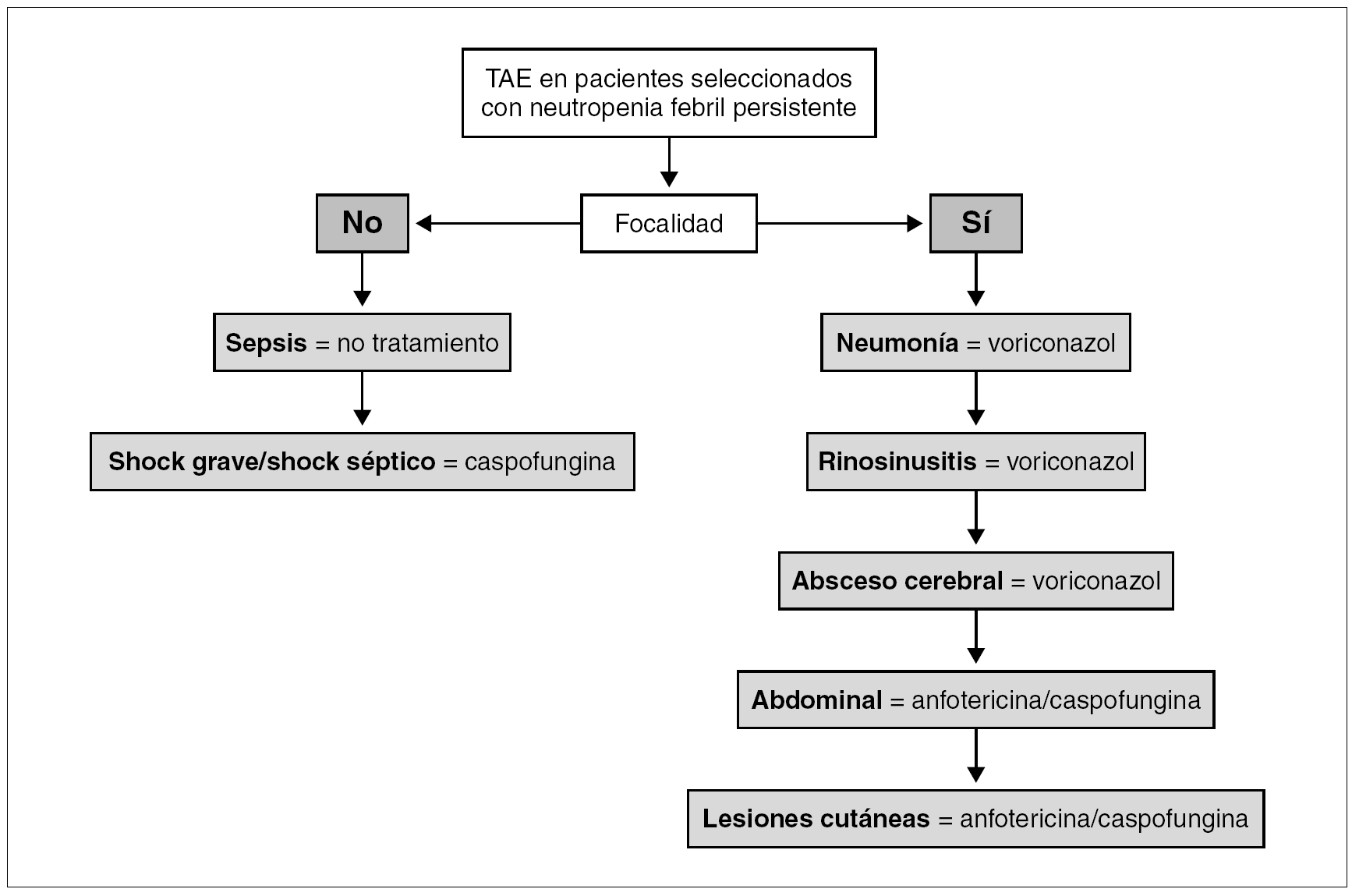
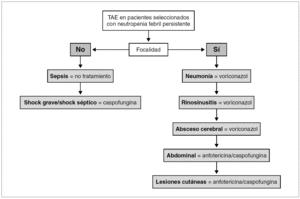
Si la fiebre tiene focalidad se iniciará el TAE con el antifúngico seleccionado según el síndrome clínico que presente el paciente, como se detalla a continuación y se expone en la tabla 5 y en la figura 1.
Figura 1. Algoritmo del tratamiento antifúngico empírico (TAE) en pacientes seleccionados.
Neumonía. En los pacientes con neumonía el TAE de elección es voriconazol (B-III). Los hongos, particularmente Aspergillus spp., son la principal etiología (43%) de la neumonía en los pacientes con neutropenia 18. Voriconazol es el tratamiento antifúngico de elección de la aspergilosis invasora (A-I) 14. El lavado broncoalveolar mediante broncoscopia es la técnica de elección para la toma de muestras sobre las que se realizarán las tinciones y cultivos para bacterias, hongos y virus; y el test del antígeno del galactomanano (B-II) 19. La tomografía computarizada (TC) de alta resolución (TCAR) está indicada sin demora (B-II) porque es útil para el diagnóstico de la aspergilosis invasora por imagen 19,20, ayuda a dirigir la toma de muestras de la broncoscopia 21, e identifica lesiones tributarias de tratamiento quirúrgico 22.
Rinosinusitis. En los pacientes con rinosinusitis el TAE de elección es voriconazol (B-III), porque la etiología fúngica es frecuente, y Aspergillus spp. es el agente más común 23. La rinoscopia anterior y la TC de senos y de órbitas son las pruebas diagnósticas inmediatas. La rinoscopia permite ver las lesiones necróticas características de la mucosa nasal y la toma de muestras para la confirmación diagnóstica. La TC determina la extensión de la infección, información fundamental para el tratamiento quirúrgico urgente.
Absceso cerebral. En los pacientes con absceso cerebral el TAE de elección es voriconazol (B-III). Los hongos (18-92%) son la principal etiología de los abscesos cerebrales en los receptores de TPH, junto a Toxoplasma gondii. Aspergillus spp. (58%) y Candida spp. (33%) son los más comunes 24,25.
La biopsia estereotáxica guiada por TC o la resección por craneotomía son las pruebas diagnóstico-terapéuticas de elección.
Abdominal/candidiasis hepatosplénica. En los pacientes con candidiasis hepatosplénica el TAE de elección es la anfotericina o la caspofungina (B-III) 26. La candidiasis hepatosplénica representa el 17% de los casos de candidiasis invasora en los pacientes con neutropenia, y se manifiesta por fiebre y dolor abdominal acompañados de elevación de la fosfatasa alcalina. La ecografía abdominal o la TC abdominal son las pruebas para identificar los microabscesos múltiples en hígado y/o bazo que constituyen la marca de esta enfermedad 27.
Lesiones cutáneas diseminadas. En los pacientes con lesiones cutáneas diseminadas, pápulas y/o nódulos, y sin neumonía el TAE de elección es la anfotericina o la caspofungina (B-III). En este síndrome la etiología fúngica es frecuente, especialmente Candida spp. Con mucha menor frecuencia, Criptococcus neoformans, Aspergillus spp. Fusarium spp., y Scedosporium spp. entre otros, pueden causar lesiones cutáneas similares 28. La biopsia cutánea urgente es la prueba diagnóstica de elección.
Pacientes con neutropenia febril persistente sin focalidad
En estos pacientes el primer paso es determinar con la evaluación clínica la gravedad del paciente de acuerdo a los criterios de sepsis, sepsis grave y shock séptico 29.
Pacientes con sepsis grave o shock séptico. Si la fiebre cursa sin focalidad y se acompaña de signos de sepsis grave o de shock séptico, el TAE de elección será caspofungina (B-III). La candidemia es la principal forma de presentación clínica de la candidiasis invasora en los pacientes con cáncer y neutropenia (53%) 9. La candidemia se manifiesta con fiebre sin focalidad en la mayoría de los casos (88%) y en un 10% de los casos como shock séptico 17. Además del TAE están indicadas las medidas terapéuticas recomendadas en el cuidado de los pacientes con sepsis grave o shock séptico 30.
Pacientes con sepsis. Finalmente si la fiebre cursa sin focalidad y sin signos de gravedad, que es la situación más frecuente, no está indicado el TAE (B-III) y sí una evaluación diagnóstica datallada incluyendo las siguientes exploraciones.
El test del antígeno del galactomanano se realizará inicialmente y dos veces por semana mientras persista la neutropenia y la fiebre sin diagnóstico. Si fuese positivo se indicará tratamiento con voriconazol y se repetirá para confirmar el diagnóstico (B-II). Si fuese negativo se continuará sin TAE y seguirá la evaluación diagnóstica (B-II). La especificidad y la sensibilidad de este test para el diagnóstico de la aspergilosis invasora es superior al 90% cuando se consideran dos determinaciones consecutivas positivas, y precede al diagnóstico convencional en 17 días (2-110) 19,31.
La TCAR se realizará inicialmente y siempre que aparezcan síntomas y/o signos de afectación pulmonar (B-II). La TCAR es la técnica diagnóstica de elección para identificar la presencia de lesiones pulmonares en los pacientes con neutropenia y radiografía de tórax normal, en los que revela infiltrados pulmonares en el 60% de los casos 20. Si la TCAR es positiva proceder como en el apartado de neumonía.
La ecografía abdominal se realizará si tras las exploraciones anteriores no se ha conseguido el diagnóstico. Buscará la presencia de microabscesos característicos de la candidiasis hepatosplénica 27. Si la ecografía es positiva proceder como en el apartado de la candidiasis hepatosplénica.
Si todo lo anterior es negativo, el paciente continúa con neutropenia y fiebre sin focalidad (8-10 días) actuar en función de la profilaxis antifúngica realizada y el tipo de enfermedad subyacente.
Si el paciente no recibe profilaxis con fluconazol o con itraconazol, iniciar tratamiento empírico con fluconazol (B-III). Fluconazol es muy eficaz en la prevención de la candidiasis invasora en los receptores de TPH alogénicos (A-I) 32,33. Itraconazol es tan eficaz como fluconazol pero peor tolerado (B-I) 34. En los pacientes con leucemia aguda la eficacia de estos azoles en la prevención de las IFI es menos consistente (C-I) 35-37.
Si el paciente recibe profilaxis con fluconazol o con itraconazol mantener sin TAE y continuar realizando el test del galactomanano (B-III) o bien iniciar TAE con caspofungina si se trata de un paciente de alto riesgo (C-III). Los pacientes con leucemia aguda en recaída y los receptores de TPH alogénico se consideran de alto riesgo de IFI 7-9.
Evaluación del TAE en pacientes seleccionados
Se reevaluará a las 48-72 h a la luz de los resultados de las pruebas diagnósticas y de la evolución del paciente. Si se ha establecido el diagnóstico de IFI, se deberá indicar el tratamiento antifúngico recomendado para la IFI. Si se ha establecido otro diagnóstico (p. ej., bacteriemia por P. aeruginosa) que justifica la clínica, indicar el tratamiento específico y suspender el TAE. Si continúa sin diagnóstico etiológico y el paciente continúa estable o con mejoría, se deberá mantener el TAE considerando su simplificación a fluconazol, itraconazol o voriconazol oral en función de la profilaxis previa y de los resultados del galactomanano, y realizar una nueva evaluación del paciente en 48-72 h. Por último si el paciente continúa sin diagnóstico etiológico y muestra signos o síntomas de progresión clínica, se deberá adoptar una decisión individualizada.