En los últimos años se han desarrollado varios métodos alternativos a las técnicas convencionales para la detección precoz de la enfermedad fúngica invasora (EFI). En este texto se revisa la utilidad de estos métodos en la práctica clínica y se analiza si pueden considerarse alternativas reales al examen microscópico y al cultivo microbiológico, si solo deben considerarse técnicas complementarias o si deben ser tomadas como técnicas en desarrollo alejadas del laboratorio clínico, disponibles únicamente en centros de referencia. El texto se divide en 3 secciones, ya que analiza por separado las infecciones por Candida, la aspergilosis y las micosis por especies emergentes y poco frecuentes.
A number of newer diagnostic procedures have been developed over the last few years as alternatives to conventional microbiological methods to detect invasive fungal diseases (IFD). This text reviews the performance of alternative methods in clinical settings, and their accuracy compared with that of microscopical examination and microbiological cultures. Some newer techniques considered as complementary and experimental procedures are also reviewed. The text is divided into three sections, including Candida infections, aspergillosis and infections due to rare and emerging fungal species.
Las enfermedades fúngicas invasoras (EFI) tienen elevados porcentajes de mortalidad, ya que son complicaciones que aparecen en pacientes con mal estado general por su enfermedad de base y porque suelen detectarse cuando ya han causando lesiones macroscópicas extensas y cuadros invasores, por lo que es muy difícil que respondan al tratamiento antifúngico1–3.
Por ello, la estrategia terapéutica más aceptada es pautar tratamiento profiláctico en pacientes con riesgo de EFI e iniciar terapia empírica cuando aparecen signos clínicos compatibles con infección, como neutropenia febril prolongada o signos de sepsis en enfermos críticos. Sin embargo, esta estrategia siempre ha tenido muchos detractores, ya que conlleva un uso inadecuado y excesivo de antifúngicos, lo que se relaciona con la aparición de efectos tóxicos, el desarrollo de resistencias y un gasto farmacéutico elevado. En la última década han aparecido algunas innovaciones que están modificando esta estrategia. Estos cambios están relacionados con el diagnóstico y el tratamiento precoces de la EFI y reciben la denominación de terapia anticipada, término acuñado dentro de las infecciones por citomegalovirus en pacientes hematológicos. En el campo de las infecciones fúngicas el tratamiento anticipado hace referencia, en su mayor parte, a la detección precoz de la aspergilosis en enfermos hematológicos con inmunodepresión intensa gracias a la cuantificación de galactomanano4,5.
En los últimos años se han desarrollado otras técnicas microbiológicas para detectar precozmente las micosis invasoras. Suelen agruparse bajo el término de técnicas alternativas al cultivo, ya que están basadas en la detección de componentes fúngicos2. En este texto se revisa la utilidad de estos métodos en la práctica clínica y se analiza si pueden considerarse alternativas reales al examen microscópico y al cultivo microbiológico. El texto se divide en 3 secciones, ya que analiza por separado las infecciones por Candida, la aspergilosis y las micosis por especies emergentes y poco frecuentes.
Diagnóstico de laboratorio de la candidiasis invasoraLa candidiasis invasora es una infección profunda que suele afectar a varios órganos y que generalmente cursa con hemocultivos positivos, aunque los hemocultivos pueden ser negativos hasta en la mitad de los casos. La candidemia solo hace referencia a la presencia de levaduras del género Candida en hemocultivos, habitualmente en el curso de una candidiasis invasora, pero existen muchos casos en que la candidemia es el único signo de infección, particularmente en los enfermos en los que la candidemia se asocia a la presencia de un dispositivo intravenoso. La candidiasis crónica diseminada es un tipo de infección invasora descrita en enfermos neutropénicos que cursa con lesiones hepáticas y esplénicas y, frecuentemente, con hemocultivos negativos4.
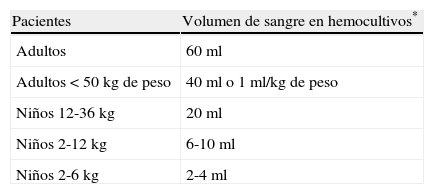
Diagnóstico microbiológico convencional de la candidiasis invasoraDiagnóstico por hemocultivosLa técnica de referencia para el diagnóstico de la candidiasis invasora sigue siendo la toma de hemocultivos. De acuerdo con las recomendaciones, la toma de hemocultivos debe realizarse una vez al día mientras exista sospecha de infección. En adultos, debe obtenerse un volumen total diario de 60ml de sangre, realizando 3 venopunciones de 20ml en diferentes zonas anatómicas en un periodo de 30min. Se deben inocular 3 frascos aerobios y 3 anaerobios e incubar al menos durante 7 días en sistemas automatizados validados para el diagnóstico clínico. Puede reducirse el volumen de las tomas en pacientes con condiciones especiales, como bajo peso o anemia. En niños, los volúmenes recomendados son menores y se presentan en la tabla 1. Algunos expertos recomiendan 2 únicas venopunciones y otras 4 por conjunto de hemocultivos, sin que existan evidencias sobre una menor o mayor rentabilidad6.
Volumen de sangre recomendado en la toma de hemocultivos según la edad y el peso del paciente
| Pacientes | Volumen de sangre en hemocultivos* |
| Adultos | 60ml |
| Adultos <50kg de peso | 40ml o 1ml/kg de peso |
| Niños 12-36kg | 20ml |
| Niños 2-12kg | 6-10ml |
| Niños 2-6kg | 2-4ml |
*Hemocultivos: 3 venopunciones diferentes realizadas en 30min y divididas en 6 alícuotas, 3 para botellas aerobias y 3 para anaerobias.
La sensibilidad de la técnica siguiendo estrictamente las recomendaciones del párrafo anterior es solo del 50-75%. En muchas ocasiones no es posible extraer los volúmenes recomendados, lo que tiene un efecto significativo en la fiabilidad diagnóstica de los hemocultivos. Esta técnica no debe considerarse de detección precoz, ya que se necesita que la infección esté avanzada para que los hemocultivos sean positivos, y además debe contarse el tiempo de incubación necesario para que se detecte crecimiento, que puede ser de varios días en algunas especies de Candida, como C. glabrata7. Por ello se están desarrollando métodos diagnósticos alternativos que se analizarán en próximos apartados.
Otro aspecto destacable es que no todas las levaduras que crecen en los hemocultivos deben considerarse como Candida spp. Según los últimos datos epidemiológicos, hasta el 5% de las levaduras obtenidas de hemocultivos pertenecen a otras especies, como Cryptococcus, Trichosporon, Rhodotorula o Saccharomyces8-10.
Todas las levaduras aisladas en hemocultivos deben ser identificadas al nivel de especie, ya que existen diferencias probadas en cuanto al perfil de sensibilidad de las diferentes especies. Se deben utilizar medios de cultivo habituales para hongos y pueden emplearse medios diferenciales que ayudan a identificar presuntivamente y distinguir entre las diferentes especies de Candida, por lo que se puede recomendar un tratamiento u otro hasta la identificación definitiva del patógeno. La identificación definitiva debe basarse en la morfología microscópica y en la realización de pruebas bioquímicas complementarias. Actualmente, algunos centros realizan la amplificación y/o secuenciación de ácidos nucleicos como técnicas de identificación definitiva o emplean metodologías novedosas como la basada en espectrofotometría de masas MALDI-TOF (matrix-assisted laser desorption/ionization/time-of-flight mass spectrometer). Estas técnicas no son necesarias para la identificación de las especies más habituales, pero sí pueden ayudar en el caso de los organismos poco frecuentes11,12. Tienen la ventaja adicional de poder ser utilizadas directamente sobre los hemocultivos, sin necesidad de realizar subcultivos intermedios, lo que agiliza el diagnóstico4,13.
Otro aspecto destacable son los estudios de sensibilidad a los antifúngicos. Existe un consenso mayoritario por el que se recomienda realizar el estudio de sensibilidad a los antifúngicos en todas las cepas de Candida aisladas en infecciones profundas. Para ello pueden emplearse técnicas comerciales que hayan sido validadas clínicamente o los métodos de referencia del European Committee on Antimicrobial Susceptibility Testing (EUCAST) o del Clinical Laboratory Standards Institute (CLSI). El estudio de sensibilidad es de especial utilidad en casos de enfermos expuestos con anterioridad a fármacos antifúngicos, en fracasos terapéuticos o en cepas pertenecientes a especies poco habituales de las que no existen muchos datos sobre perfil de resistencias14,15.
Diagnóstico en otras muestras clínicasEn cuanto a los métodos de diagnóstico convencionales en otras muestras clínicas, como biopsias y exudados de líquidos estériles, deben hacerse las siguientes recomendaciones. La toma y el transporte de la muestra no requieren medidas específicas y se deben seguir los procedimientos habituales. Debe tomarse la mayor cantidad de muestra posible, ya que la sensibilidad de los exámenes microscópicos y de los cultivos disminuye cuando se procesan muestras pequeñas o de poco volumen. Las muestras tienen que ser enviadas al laboratorio con rapidez o han de conservarse refrigeradas si no son procesadas en menos de 1h. Las que van a ser procesadas para citología o exámenes histopatológicos deben ser incluidas en los fijadores lo antes posible. Las muestras remitidas para examen en fresco y cultivo microbiológico deben ser procesadas asépticamente y nunca ser incluidas en fijadores. La visualización de levaduras en muestras estériles es indicativa de infección profunda. La utilización de contrastes (tinta china, tinta Parker o azul de lactofenol) y de tinciones con colorantes como las técnicas argénticas, la hematoxilina-eosina, el Giemsa, el azul de metileno y el PAS, aumentan la rentabilidad de la microscopia. También puede emplearse el microscopio de fluorescencia aplicando como contraste fluorescente el blanco de calcoflúor. Las biopsias tienen que deshacerse cuidadosamente y se debe utilizar un 10% de hidróxido de potasio, que ayuda a realizar este examen4,16.
No obstante, la visión de estructuras fúngicas solo es posible cuando estas son muy abundantes en la muestra a analizar, lo que suele producirse cuando la infección está muy avanzada. Además, salvo excepciones, los exámenes microscópicos no sirven para identificar la especie causante de la infección, lo que se considera fundamental desde que existen diferentes alternativas terapéuticas y se conocen los distintos perfiles de sensibilidad de las especies fúngicas.
En cuanto a los estudios histopatológicos, tanto la citología como el examen de cortes histológicos ayudan a detectar la infección fúngica. En ocasiones puede ser el único método capaz de detectar la infección. Los cortes histológicos también pueden emplearse para realizar técnicas inmunohistoquímicas que permiten identificar las especies presentes en el tejido mediante la utilización de un anticuerpo específico fluorescente que se liga a los tejidos infectados. Asimismo, también pueden utilizarse procedimientos de amplificación de ácidos nucleicos, tras su extracción previa de los tejidos. Las técnicas moleculares podrían convertirse en las técnicas de referencia para la identificación de las especies en muestras tisulares. No obstante, no existen métodos estandarizados, y todos los trabajos publicados hasta la fecha incluyen pequeños estudios de casos, que no tenían un tamaño muestral representativo17-19.
Los cultivos deben realizarse en medios habituales y para hongos. En las muestras en las que pueda existir una infección polimicrobiana o flora bacteriana comensal deben emplearse medios selectivos, como el agar Sabouraud con antibióticos como cloranfenicol y gentamicina. También se recomienda la utilización de medios de cultivo diferenciales, sobre todo en muestras donde puedan existir varias especies de levaduras. Los medios diferenciales cromógenos permiten reconocer varias especies de levaduras por el color de la colonia. Estos medios son de gran utilidad para distinguir las infecciones mixtas, que según algunos estudios podrían alcanzar hasta el 30% de todas las micosis4.
Diagnóstico alternativo de la candidiasis invasoraEn el caso de la candidiasis invasora, el desarrollo de técnicas alternativas al cultivo y a la microscopia se encuentra algo retrasado si lo comparamos con la aspergilosis o la criptococosis. A diferencia de la aspergilosis y otras infecciones por hongos filamentosos, la radiología tiene un papel muy reducido en el diagnóstico de la candidiasis, y las técnicas de detección de componentes fúngicos no tienen la misma aceptación que la cuantificación de galactomanano.
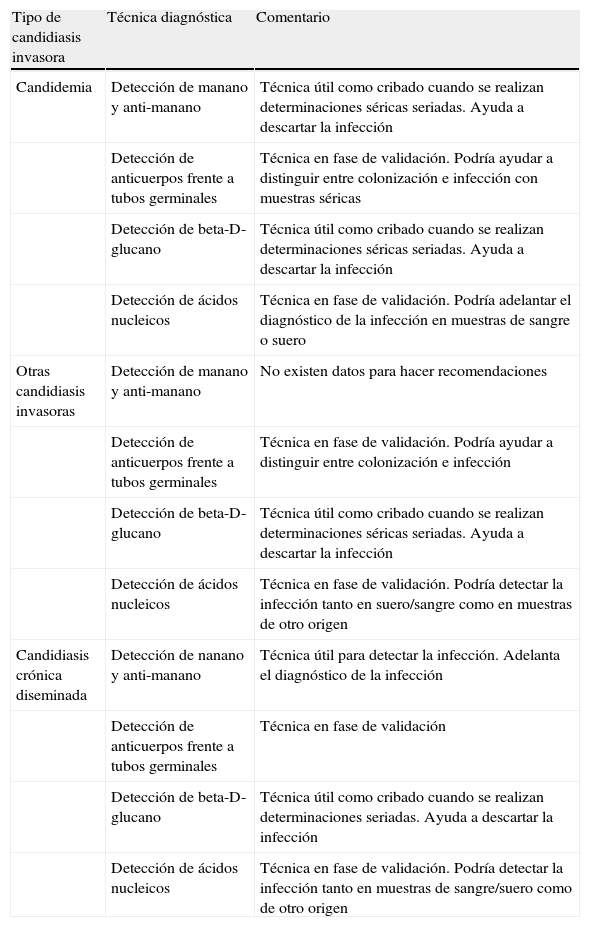
Sin embargo, en los últimos años se ha observado que es necesario disponer de técnicas de diagnóstico precoz de la candidiasis invasora, sobre todo en el enfermo crítico (tabla 2). En estos enfermos y ante la poca fiabilidad de los hemocultivos, la evaluación precoz del riesgo de candidiasis se hace mediante escalas o índices (scores), que incluyen la presencia de signos de infección en pacientes con riesgo de candidiasis más la colonización por levaduras. Cuando este índice está por encima de un valor, se inicia tratamiento empírico con antifúngicos. El valor predictivo positivo de estas escalas no supera el 20%. Por tanto, parece que se están tratando un gran número de enfermos que no lo necesitarían si se dispusiera de un método diagnóstico más preciso1.
Resumen de las recomendaciones actuales sobre el diagnóstico alternativo al cultivo en las candidiasis invasoras
| Tipo de candidiasis invasora | Técnica diagnóstica | Comentario |
| Candidemia | Detección de manano y anti-manano | Técnica útil como cribado cuando se realizan determinaciones séricas seriadas. Ayuda a descartar la infección |
| Detección de anticuerpos frente a tubos germinales | Técnica en fase de validación. Podría ayudar a distinguir entre colonización e infección con muestras séricas | |
| Detección de beta-D-glucano | Técnica útil como cribado cuando se realizan determinaciones séricas seriadas. Ayuda a descartar la infección | |
| Detección de ácidos nucleicos | Técnica en fase de validación. Podría adelantar el diagnóstico de la infección en muestras de sangre o suero | |
| Otras candidiasis invasoras | Detección de manano y anti-manano | No existen datos para hacer recomendaciones |
| Detección de anticuerpos frente a tubos germinales | Técnica en fase de validación. Podría ayudar a distinguir entre colonización e infección | |
| Detección de beta-D-glucano | Técnica útil como cribado cuando se realizan determinaciones séricas seriadas. Ayuda a descartar la infección | |
| Detección de ácidos nucleicos | Técnica en fase de validación. Podría detectar la infección tanto en suero/sangre como en muestras de otro origen | |
| Candidiasis crónica diseminada | Detección de nanano y anti-manano | Técnica útil para detectar la infección. Adelanta el diagnóstico de la infección |
| Detección de anticuerpos frente a tubos germinales | Técnica en fase de validación | |
| Detección de beta-D-glucano | Técnica útil como cribado cuando se realizan determinaciones seriadas. Ayuda a descartar la infección | |
| Detección de ácidos nucleicos | Técnica en fase de validación. Podría detectar la infección tanto en muestras de sangre/suero como de otro origen |
La detección combinada de manano y de anticuerpo anti-manano ha sido desarrollada como técnica específica para la detección de Candida spp. en suero. Hay un kit comercial disponible (Platelia Candida Antigen Plus y Antibody Plus, Bio-Rad Laboratories). Se han realizado trabajos retrospectivos multicéntricos y varios estudios de cohortes, así como de casos y controles. En todos ellos, la técnica ha demostrado una gran fiabilidad para la detección de la candidemia, con una sensibilidad del 80% y una especificidad del 85%. Se recomiendan hacer determinaciones seriadas (2 a la semana) en pacientes con riesgo, y de esta forma se adelanta la detección de la infección unos 6 días. La técnica tiene un 85% como valor predictivo negativo, por lo que puede ser muy útil para descartar la infección y ahorrar tratamientos innecesarios20. Por todo ello, la European Society of Clinical Microbiology and Infectious Diseases (ESCMID) recomienda en su guía sobre el diagnóstico y tratamiento de la candidiasis (en fase de publicación definitiva)21 la utilización de esta técnica diagnóstica en los laboratorios asistenciales para la detección de la candidemia. No existen datos sobre otras candidiasis invasoras, a excepción de la candidiasis crónica diseminada, donde un metaanálisis reciente indica que en este subgrupo de pacientes la sensibilidad de la técnica es del 86% y que detecta la infección 16 días antes que los hemocultivos20.
Detección de anticuerpos antimicelio o anti tubos germinalesOtra técnica específica para la detección de Candida es la cuantificación de anticuerpos antimicelio o anti tubos germinales de C. albicans (CAGTA) en suero, que pese a su nombre es capaz de detectar anticuerpos frente a otras especies de Candida. Este método ha sido desarrollado en España y comercializado como Candida albicans IFA IgG® (Vircell). Los estudios preliminares realizados indican que tiene una sensibilidad del 84,4%, con un valor predictivo positivo del 96% y una especificidad del 94,7%. Recientemente se ha utilizado la técnica en un estudio piloto con enfermos críticos no neutropénicos de varios hospitales españoles, y ha demostrado que el aumento en los títulos de este anticuerpo se relaciona con la infección por Candida. Se está realizando un estudio multicéntrico con mayor número de enfermos que, muy probablemente, aportará datos definitivos sobre la utilidad de esta técnica22.
Detección de beta-D-glucanoOtras técnicas se basan en la detección del beta-D-glucano, componente de la pared fúngica que no es específico de especie. Puede emplearse en el diagnóstico de la candidiasis, de la aspergilosis y de otras EFI, por lo que se incluyó como criterio diagnóstico de la European Organization for Research and Treatment of Cancer/Mycosis Study Group (EORTC/MSG)23. En Cryptococcus spp., otros basidiomicetos y zigomicetos, este glucano parece que podría existir en cantidades muy bajas, lo que disminuiría la sensibilidad de la técnica.
Existen varias técnicas comercializadas para la detección de glucano en suero. En Europa y en América la más utilizada es el Fungitell (Associated of Cape Cod Incorporated). Se han publicado varios metaanálisis, que incluían estudios transversales, de cohortes y de casos y controles24-26. En todos ellos la sensibilidad media de la técnica supera el 70%, con una especificidad > 80% y valores predictivos negativos > 85%. La utilización de albúmina, gasas, inmunoglobulinas y hemodiálisis se asocia a falsos positivos, y la neutropenia a falsos negativos. Por ello, se ha impuesto la idea de que esta técnica puede ser de utilidad en el enfermo crítico, ayudando a descartar la infección. Los datos disponibles en los estudios antes mencionados muestran que la sensibilidad de la cuantificación de beta-D-glucano en el caso concreto de la candidemia y otras candidiasis invasoras puede ser superior al 80%, con un valor predictivo negativo > 90% cuando se realizan determinaciones seriadas, adelantando en 7 días la detección por hemocultivos. De ahí que su uso asistencial ya esté recomendado en la guía de la ESCMID antes mencionada21. Este test no ha sido validado en población pediátrica.
Detección de ácidos nucleicosAnte las limitaciones de las técnicas convencionales en el diagnóstico de las micosis profundas, la detección de ácidos nucleicos de los hongos en muestras clínicas siempre se ha considerado como una alternativa de gran potencial, sobre todo las técnicas basadas en la reacción en cadena de la polimerasa (PCR), que permite la amplificación de cantidades muy pequeñas de ADN. Sin embargo, la elevada sensibilidad teórica de las técnicas basadas en la PCR no se ha visto confirmada hasta la fecha en la práctica clínica, aunque cada vez existen más datos que parecen apoyar la utilización de estas técnicas en el diagnóstico de las micosis2,4. Existe una técnica comercializada, SeptiFast (Roche Diagnostica), que permite detectar ADN de bacterias y de algunas especies fúngicas de Candida y de Aspergillus. Recientemente han visto la luz algunos estudios que indican que esta técnica podría ser eficaz en la detección de la candidemia27,28. Por otra parte, existen decenas de trabajos sobre la utilidad de las técnicas diagnósticas basadas en la PCR para detectar las candidiasis invasoras. Por las características de esta metodología, su principal limitación es la falta de estandarización y las distintas metodologías empleadas. No obstante, un metaanálisis publicado en 2011 incluyó datos de 54 estudios diferentes con un total de 4.700 enfermos29. La sensibilidad y la especificidad medias de estas técnicas en el diagnóstico de la candidemia fueron del 92 y del 95%. En el caso de enfermos críticos con sospecha de candidiasis invasora la sensibilidad de estas técnicas superó el 70%, mientras que los hemocultivos fueron positivos solo en el 38% de los casos. Además, otros trabajos han demostrado la precocidad diagnóstica de las técnicas moleculares frente a los cultivos tradicionales, ya que son capaces de detectar la infección 48h antes (intervalo 12h-8 días), lo que puede ser trascendental para instaurar un tratamiento precoz y aumentar la supervivencia de los enfermos30.
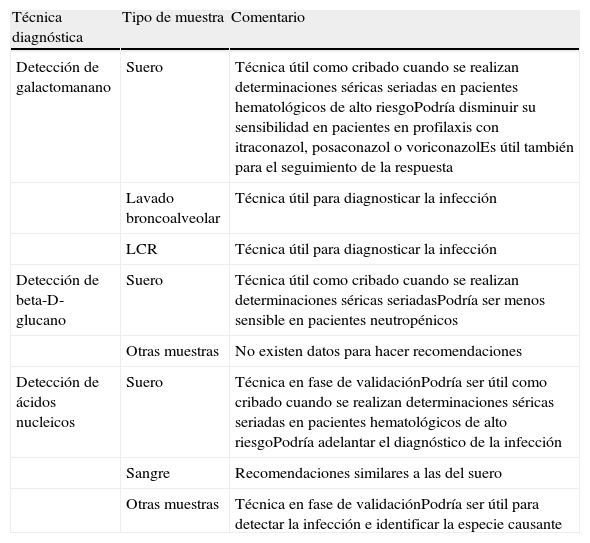
Diagnóstico de laboratorio de la aspergilosis invasoraLa aspergilosis invasora es una enfermedad que suele afectar principalmente a personas con graves enfermedades hematológicas sometidas a tratamientos inmunosupresores intensos y prolongados. La infección se produce por inhalación de conidias, por lo que la gran mayoría de los casos se inicia con una aspergilosis pulmonar que evoluciona hacia una infección diseminada fatal si no se recibe el tratamiento adecuado3. La detección precoz de la aspergilosis ha sido siempre una de las principales demandas diagnósticas. Por ello, se han desarrollado técnicas alternativas que se emplean rutinariamente en la actualidad, como se expondrá en los apartados siguientes (tabla 3).
Resumen de las recomendaciones actuales sobre el diagnóstico alternativo al cultivo en la aspergilosis invasora
| Técnica diagnóstica | Tipo de muestra | Comentario |
| Detección de galactomanano | Suero | Técnica útil como cribado cuando se realizan determinaciones séricas seriadas en pacientes hematológicos de alto riesgoPodría disminuir su sensibilidad en pacientes en profilaxis con itraconazol, posaconazol o voriconazolEs útil también para el seguimiento de la respuesta |
| Lavado broncoalveolar | Técnica útil para diagnosticar la infección | |
| LCR | Técnica útil para diagnosticar la infección | |
| Detección de beta-D-glucano | Suero | Técnica útil como cribado cuando se realizan determinaciones séricas seriadasPodría ser menos sensible en pacientes neutropénicos |
| Otras muestras | No existen datos para hacer recomendaciones | |
| Detección de ácidos nucleicos | Suero | Técnica en fase de validaciónPodría ser útil como cribado cuando se realizan determinaciones séricas seriadas en pacientes hematológicos de alto riesgoPodría adelantar el diagnóstico de la infección |
| Sangre | Recomendaciones similares a las del suero | |
| Otras muestras | Técnica en fase de validaciónPodría ser útil para detectar la infección e identificar la especie causante |
Las técnicas de diagnóstico convencional tienen una utilidad discreta en la detección de la aspergilosis invasora. Aspergillus spp. es un saprofito habitual del tracto respiratorio, por lo que su visualización y aislamiento en muestras respiratorias tienen un valor limitado. Por ello, en los últimos años se ha desarrollado la estrategia de la terapia anticipada basada en el diagnóstico radiológico y en la detección de componentes fúngicos2,23.
Como ya se indicó anteriormente, el examen microscópico presenta una sensibilidad baja y no es una técnica de diagnóstico precoz. Su valor aumenta cuando se toman muestras de tejidos, que en el caso de la aspergilosis es una biopsia pulmonar. Las tinciones y técnicas microscópicas recomendadas en el apartado de la candidiasis son las que deben emplearse en la aspergilosis. En ocasiones, los estudios histopatológicos son los únicos que permiten detectar una infección invasora, ya que es necesario ver que los filamentos y estructuras fúngicas están invadiendo los tejidos. Debe indicarse que los exámenes microscópicos no pueden identificar la especie causante ya que solo indican si la infección está causada por levaduras o por hongos miceliales. Además, dentro de estas últimas se pueden distinguir entre la hialohifomicosis, la feohifomicosis y la zigomicosis. Las hialohifomicosis, como la aspergilosis, muestran hifas finas, hialinas, septadas y con ramificaciones en ángulo agudo. Las feohifomicosis tienen filamentos de paredes gruesas con pigmentos de color oscuro. Los zigomicetos se caracterizan por presentar hifas anchas, irregulares, hialinas, sin septos y con ramificaciones en ángulo abierto (45-90°)31,32.
Las consideraciones sobre toma y transporte de muestras, así como sobre los medios de cultivo, son muy similares a las expuestas anteriormente. Es muy importante evaluar con detenimiento la presencia de Aspergillus u otros hongos en cultivos, incluso en el caso de muestras consideradas no estériles. Los hongos miceliales son contaminantes habituales de laboratorio y forman parte de la flora saprofita del ser humano, lo que disminuye la especificidad de los cultivos. Las levaduras no se consideran contaminantes de laboratorio, aunque sí forman parte de la flora de la piel y las mucosas. No obstante, antes de descartar un hongo como contaminante o flora saprofita se debería tomar en consideración si el enfermo tiene factores de riesgo de micosis y si se han cultivado hongos en varias muestras del paciente.
Diagnóstico alternativo de la aspergilosisDetección de galactomananoLa cuantificación de galactomanano se ha convertido en la principal innovación diagnóstica de la última década dentro del campo de la micología médica. El galactomanano es un componente de la pared celular de Aspergillus spp., aunque está presente en otras especies fúngicas en pequeñas cantidades. La detección de galactomanano se ha comercializado mediante un test de ELISA (Platelia Aspergillus, Bio-Rad) cuya principal aportación es su utilidad en el diagnóstico precoz de esta infección en pacientes oncohematológicos en riesgo de aspergilosis, en conjunción con la tomografía de alta resolución. La cuantificación de galactomanano es un criterio EORTC/MSG para el diagnóstico de aspergilosis probable5,23.
La cuantificación de galactomanano como técnica de diagnóstico precoz se considera un método de cribado. Por eso, se deben realizar determinaciones seriadas en suero en enfermos con riesgo de infección. Se aconsejan 2 a la semana, ya que así se incrementan su sensibilidad y su valor predictivo negativo. Los puntos de corte para considerar un resultado positivo son un índice por encima de 0,7 en una única muestra o por encima de 0,5 en 2 muestras consecutivas33.
En los últimos años se han publicado varios metaanálisis que recogen la experiencia publicada con esta técnica. Los porcentajes medios de sensibilidad y especificidad son > 70 y > 85%, respectivamente. La sensibilidad supera el 80% si se analizan solo los enfermos sometidos a trasplante de precursores hematopoyéticos, siendo aún mayor en trasplantes alogénicos (> 85%). Sin embargo, la sensibilidad desciende significativamente en enfermos no neutropénicos, por lo que no se recomienda como técnica de cribado en otros grupos de enfermos. En pacientes pediátricos existen menos estudios, aunque también es útil en enfermos de alto riesgo, si bien varios trabajos han destacado que esta técnica tiene muchos falsos positivos cuando se realiza en niños5,34.
No obstante, otros autores han puesto en duda la fiabilidad de la detección sérica de este antígeno incluso en enfermos hematológicos. En primer lugar, la administración previa de antifúngicos, particularmente la profilaxis con itraconazol, posaconazol o voriconazol, parece disminuir la sensibilidad de la prueba en más de un 30%. Debe recordarse que la profilaxis antifúngica es una práctica muy extendida y recomendada en todas las guía terapéuticas, especialmente en pacientes con alto riesgo de aspergilosis, que es donde la cuantificación de galactomanano ha demostrado su mayor utilidad. Por tanto, la fiabilidad diagnóstica de las determinaciones seriadas ha sido puesta en duda en caso de utilizar profilaxis antifúngica. El descenso en la sensibilidad reduce la eficacia de la técnica como cribado2,5.
Existen también muchas comunicaciones sobre falsos positivos asociadas al uso de betalactámicos, particularmente piperacilina/tazobactam35, fármaco que se utiliza con frecuencia en los enfermos hematológicos. Otra posible causa de falsos positivos es la contaminación con conidias de Aspergillus, en la extracción o en la manipulación de la muestra, y la reactividad cruzada con otras especies fúngicas, inmunoglobulinas, hemoderivados e inmunosupresores como la ciclofosfamida34.
Ante las dudas expuestas sobre la capacidad de esta técnica como medio de cribado en enfermos con profilaxis, algunos expertos creen que no debería emplearse de este modo, sino como un test diagnóstico en enfermos con signos de infección y, si es posible, no en suero sino en el lavado broncoalveolar. Esto ya ha demostrado su utilidad en otros grupos de enfermos. En pacientes no hematológicos con aspergilosis, como los pacientes críticos corticodependientes, la sensibilidad de la detección de galactomanano en suero es < 50%, pero en el lavado puede superar el 90%36. Recientemente se han publicado datos sobre la utilización de la cuantificación de galactomanano en lavados broncoalveolares en enfermos hematológicos37. Con un cut-off de 1, la sensibilidad de la técnica supera el 90%, con un valor predictivo positivo del 95%. La cuantificación de galactomanano en esta muestra respiratoria se está convirtiendo en una prueba de gran utilidad diagnóstica. Desafortunadamente, no tiene la misma fiabilidad cuando se realiza en otras secreciones respiratorias más accesibles, como esputo, secreciones bronquiales o lavados nasofaríngeos.
En cuanto a su utilización para realizar el seguimiento de la respuesta al tratamiento, no se han publicado estudios sólidos, aunque existen algunas evidencias. En enfermos hematológicos diagnosticados de aspergilosis invasora y en tratamiento antifúngico, un índice de galactomanano por encima de 1 en 2 muestras consecutivas se considera un indicio de fracaso terapéutico y los expertos recomiendan pautar un tratamiento de rescate38.
En 2009, la 3th European Conference on Infections in Leukemia (ECIL3) elaboró un consenso sobre el tratamiento y el diagnóstico de la aspergilosis en pacientes hematológicos. Sus recomendaciones finales sobre la utilización de galactomanano indican que esta técnica debe emplearse de forma rutinaria como cribado, en conjunción con la tomografía de alta resolución, en pacientes neutropénicos adultos en quimioterapia intensiva por leucemia o que han recibido un trasplante alogénico de precursores hematopoyéticos. Se deben realizar determinaciones séricas seriadas cada 3 o 4 días. Las publicadas por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) en 2011 incluyen recomendaciones similares. Ambos consensos comentan el efecto negativo de la profilaxis sobre la capacidad de diagnóstico precoz de la técnica. Los expertos también recomiendan, aunque con menor grado de evidencia, realizar cuantificaciones de galactomanano en el lavado broncoalveolar y el líquido cefalorraquídeo (LCR) cuando estas muestras estén disponibles, tanto en enfermos neutropénicos como no neutropénicos2,4.
Detección de beta-D-glucanoEn cuanto a otras técnicas alternativas para el diagnóstico de la aspergilosis, también se han visto progresos en los últimos años. Como se comentó en secciones anteriores, la cuantificación de beta-D-glucano se considera un criterio diagnóstico de EFI. Es un método de detección panfúngico que, en el caso de la aspergilosis, ha mostrado cifras de sensibilidad por encina del 60%. Hay algunas dudas sobre su utilidad como técnica de diagnóstico precoz en pacientes neutropénicos. Estas dudas, unidas a su poca implantación en los laboratorios asistenciales, han hecho que haya poca experiencia sobre esta técnica. Actualmente se considera un método que ayudaría a descartar infecciones por Candida en pacientes críticos, y es en el que se están realizando los principales estudios24,39.
Detección de ácidos nucleicosEn cuanto a la detección de ácidos nucleicos, la mayor parte de los métodos basados en la PCR para intentar diagnosticar EFI se han desarrollado para el diagnóstico de la aspergilosis. Un metaanálisis analizó un total de 16 estudios y 1.620 pacientes, publicados hasta el año 2008, en los que se utilizaron diferentes técnicas de PCR para detectar ADN de Aspergillus en muestras de sangre, suero y plasma40. Los autores resaltaron la falta de estandarización, las contaminaciones frecuentes y la escasa cantidad de ADN de Aspergillus que puede encontrarse en las muestras hematológicas. No obstante, el metaanálisis demostró que la detección de ADN puede ser de utilidad. Los resultados finales indicaron que un resultado positivo con la técnica de PCR tuvo un 88% de sensibilidad y un 75% de especificidad en el diagnóstico de la aspergilosis. Además, cuando se hicieron determinaciones seriadas, 2 o más PCR positivas consecutivas se relacionaban con un riesgo de aspergilosis 6 veces superior.
En los últimos años se están llevando a cabo diferentes estudios para acercar estas técnicas al diagnóstico clínico. La falta de reproducibilidad se está intentando superar mediante la estandarización y el control de calidad de los procedimientos. Uno de los principales avances ha sido la aparición de los métodos cuantitativos, entre los que destacan las técnicas de PCR cuantitativa o PCR en tiempo real, que están permitiendo automatizar los procesos de extracción y establecer unos requisitos mínimos para realizar estas técnicas41. Además, la International Society of Human and Animal Mycology (ISHAM) patrocina un ensayo multicéntrico mundial para estandarizar la detección de ADN de Aspergillus mediante técnicas basadas en la PCR. Hasta la fecha se han estandarizado procedimientos para la detección de ADN en sangre y suero mediante PCR en tiempo real, como la recomendación de que las técnicas incluyan un control interno para descartar la inhibición42. También se ha observado que la rentabilidad en suero es similar a la de la sangre, por lo que se ha indicado que estas técnicas pueden hacerse en suero, lo que resulta más conveniente para los laboratorios clínicos43.
Muchos expertos creen que lo que debe realizarse son determinaciones seriadas de ADN de Aspergillus en muestras de suero. Esta estrategia es similar a la que se sigue con el galactomanano y el beta-D-glucano, y pretende aumentar la sensibilidad y la capacidad de detectar precozmente la infección, convirtiéndose en una técnica de cribado. En los últimos años se han publicado algunos trabajos que demuestran la eficacia diagnóstica de las determinaciones seriadas. En estos, la sensibilidad de las determinaciones seriadas supera el 75% y los valores predictivos negativos se acercan al 100%, lo que permitiría descartar la infección con fiabilidad44,45. Otros autores han comunicado resultados desfavorables sobre estas técnicas, pero debe indicarse que en estos trabajos se incluyeron enfermos en profilaxis y con terapia empírica, lo que probablemente influyó en la sensibilidad de la técnica46,47. Otros trabajos han analizado retrospectivamente muestras que tenían conservadas extraídas de enfermos hematológicos con alto riesgo de aspergilosis y han comunicado que la mortalidad de los enfermos con PCR positivas fue significativamente superior a la de los pacientes con PCR negativas48.
Un aspecto relacionado con la utilización de la PCR como técnica de cribado es su impacto sobre el consumo excesivo de antifúngicos al reducir su utilización empírica. Algún estudio ya ha mostrado este efecto positivo en este sentido, y se están realizando ensayos clínicos. Uno de ellos ya ha sido publicado, y en él se evaluaron 2 estrategias en el manejo del enfermo hematológico: la empírica y la terapia anticipada basada en las determinaciones seriadas de ADN mediante PCR49. No se encontraron claras diferencias entre ambas estrategias, aunque en el grupo de la PCR la mortalidad al día 30 de seguimiento fue significativamente menor que en el grupo del tratamiento empírico (1,5% vs. 6,3%). En este estudio, el consumo de antifúngico fue superior en el grupo de la PCR (57% vs. 37%), lo que contradice el paradigma de la estrategia basada en el diagnóstico y que rechaza el empirismo.
Otro planteamiento es la utilización de las técnicas de PCR como tests diagnósticos en muestras como secreciones respiratorias y en biopsias de pulmón o de otros tejidos. Algunos trabajos han demostrado que la PCR puede ser muy útil para detectar Aspergillus en tejidos y en los lavados broncoalveolares, e incluso existe un método comercial, MycassayTN (Myconostica), que ha mostrado una sensibilidad apreciable en lavados broncoalveolares50,51.
Otro aspecto a tener en cuenta sobre la rentabilidad de las técnicas de PCR es su utilización combinada con la cuantificación de otros componentes fúngicos o con la tomografía de alta resolución. Los estudios que han analizado la utilización combinada del galactomanano y de la PCR han demostrado que se detecta el 100% de los casos de aspergilosis, tanto en muestras hematológicas como en lavado broncoalveolar50,52.
En cuanto a la precocidad diagnóstica de la determinaciones seriadas de ADN, no existen datos definitivos, pero podrían adelantar el diagnóstico de la infección varias semanas, al detectar enfermos en estadios iniciales de la infección o con el tracto respiratorio muy colonizado53,54. Esto podría conllevar un aumento del consumo de antifúngicos, lo que debe tomarse en consideración si las estrategias basadas en el diagnóstico no consiguen aumentar la supervivencia de los enfermos.
Los últimos consensos de la EORTC/MSG, de la ECIL y de la SEIMC no han incluido las técnicas basadas en la PCR como criterio diagnóstico de la infección. Debe considerarse como una técnica complementaria, útil en casos seleccionados, que se utiliza en algunos laboratorios de referencia, y esperar a la publicación de los estudios que están en marcha.
Diagnóstico de laboratorio de otras micosis invasorasUno de los aspectos que despierta mayor interés en el campo de la micología médica son las micosis invasoras por especies poco habituales y que reciben el nombre de especies emergentes. Es difícil estimar su frecuencia, pero existen algunos datos. El 5% de las fungemias están causadas por especies que no son Candida, y hasta el 20% de las infecciones pulmonares por hongos no están causadas por Aspergillus. Por ello, ante la disponibilidad de diferentes antifúngicos es necesario que los hongos se identifiquen al nivel de especie. A este respecto puede ser fundamental la aplicación de procedimientos basados en la detección molecular de ADN fúngico, especialmente en muestras de tejidos donde se observa invasión por estructuras fúngicas2,55.
Las micosis emergentes en España tienen 2 vertientes. Por un lado, la aparición de nuevas especies fúngicas oportunistas, y por otro, el aumento de las micosis endémicas primarias, asociado a la inmigración y a los viajes a zonas endémicas56. Se remite al lector a las recomendaciones de la SEIMC recientemente publicadas sobre estas infecciones, ya que en este texto no puede incluirse una revisión en profundidad sobre ellas1,3,4.
En cuanto al diagnóstico convencional, pueden hacerse recomendaciones similares a las recogidas en los apartados de Candida y Aspergillus. Muchas de estas especies son de crecimiento lento y difíciles de cultivar, por lo que se aconseja la utilización de medios de cultivo dispensados en tubo en vez de en placa, ya que se evita la contaminación y la desecación del agar. Además, deben sembrarse en tubo las muestras procedentes de enfermos en los que se sospeche la presencia de Histoplasma o de otro patógeno endémico, ya que el cultivo en tubo disminuye el riesgo de inhalación accidental en el laboratorio. Es importante recordar que los cultivos sospechosos de contener un hongo patógeno primario deben manejarse en instalaciones que cumplan las condiciones de bioseguridad GR-356.
En cuanto a las técnicas alternativas, en este apartado debe incluirse el método de diagnóstico que quizá sea el más fiable en la detección de una infección oportunista: la detección del antígeno capsular de Cryptococcus. Desarrollado hace 50 años, se emplea en muestras de LCR, hematológicas, secreciones respiratorias y orina. En enfermos VIH+ con criptococosis, la sensibilidad de estas técnicas es cercana al 100% en LCR y alrededor del 95% en sangre. La técnica también puede emplearse para evaluar la evolución de los enfermos. En enfermos inmunodeprimidos no VIH+, la sensibilidad de la detección antigénica desciende al 75%16.
En el caso de otras infecciones fúngicas, no se ha conseguido desarrollar métodos de detección tan eficaces como el de la criptococosis. La detección de beta-D-glucano, al ser panfúngica, podría emplearse para detectar algunas de estas infecciones, pero no existen datos publicados, a excepción de la neumonía por Pneumocystis jiroveci. En estas, la sensibilidad de la técnicas se sitúa por encima del 95%, con concentraciones antigénicas séricas muy por encima de las observadas en otras micosis (>200pg/ml)26.
Como se indicó anteriormente, las técnicas moleculares podrían ayudar a detectar las micosis poco frecuentes. Se han realizado trabajos con técnicas de PCR para especies de zigomicetos, Scedosporium, Pneumocystis jiroveci y hongos endémicos2,56-60. Se han utilizado tanto en muestras de sangre y suero como en tejidos. Los resultados son prometedores, pero deben realizarse estudios más amplios con métodos estandarizados. En cuanto a las micosis endémicas, se han publicado 128 casos de histoplasmosis y 21 de paracoccidioidomicosis en España en las últimas décadas. En algunos casos se han utilizado técnicas moleculares de diagnóstico. Su eficacia es muy buena en muestras respiratorias y biopsias, y algo inferior (70-80%) en muestras hematológicas, sobre todo en pacientes con infecciones localizadas.
En el caso de la neumocistosis, se han publicado estudios en los que es posible distinguir la colonización de la infección mediante técnicas de PCR cuantitativa61. En pacientes VIH+, la sensibilidad y la especificidad de estas pruebas superan el 95%. En enfermos no VIH, la sensibilidad es algo inferior, con valores predictivos positivos del 50% y negativos del 98%.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion