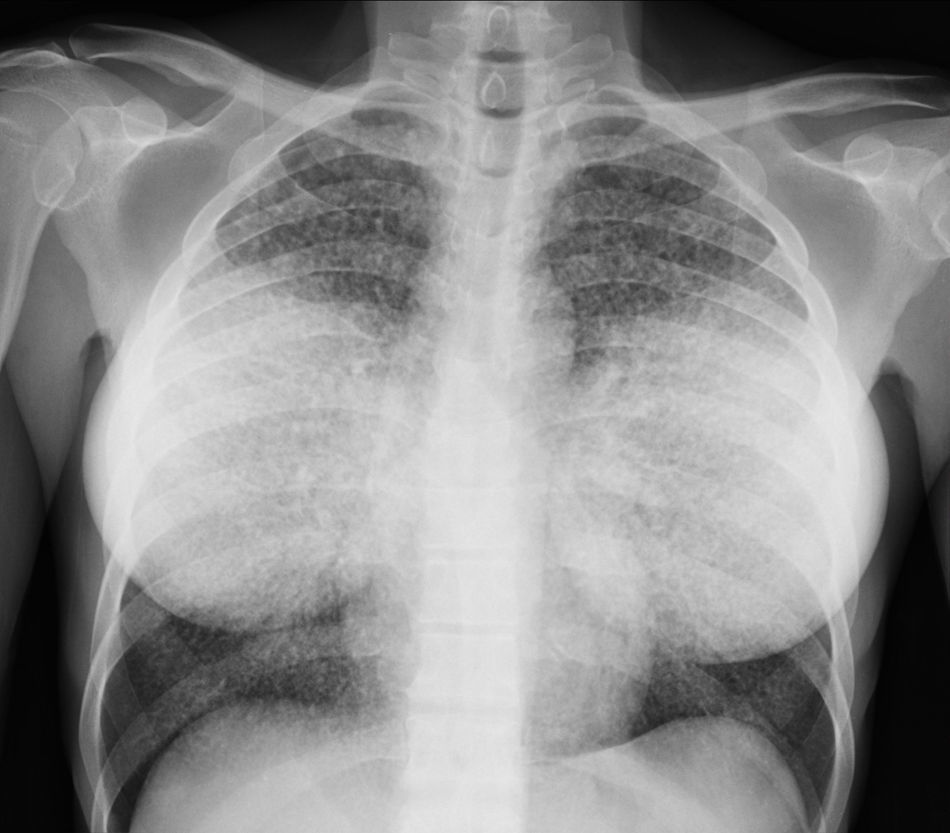
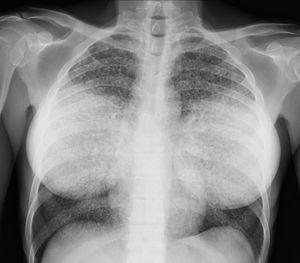
Varón de 35 años, transexual, originario de Colombia. Vive en España desde 2009. Antecedentes de cirugía estética mamaria y glútea en 2005. Consulta en agosto de 2011 por fiebre asociada a astenia, pérdida de peso y sudoración nocturna desde hace 2 meses, así como signos de deshidratación y desnutrición. Analíticamente destaca una hiponatremia (124 mEq/l), aumento de LDH (1.053 UI/l), colestasis (bilirrubina directa 1,3mg/dl, FA 1.410 U/l, GGT 211 UI/l), linfopenia (300/ml), y aumento de marcadores inflamatorios (VSG 73mm/h, PCR 7mg/dl). Una radiografía de tórax evidencia un patrón miliar bilateral (fig. 1) y en una ecografía abdominal destaca una hepatomegalia homogénea. Se solicita serología urgente combinada para VIH (antígeno p24 y anticuerpos para VIH 1 y 2 por ELISA), virus hepatotropos, VDRL, antígeno para Cryptococcus neoformans, reacción intraepidérmica de Mantoux y ELI-SPOT TBC. Se toman muestras de hemocultivos para microorganismos comunes y micobacterias, urinocultivo, y se realiza fibrobroncoscopía con lavado broncoalveolar (LBA) de lóbulo medio para la detección de microorganismos comunes, micobacterias, hongos, virus y Pneumocystis jirovecii, así como muestra de esputo post-LBA. Con la orientación de tuberculosis miliar y posible sobreinfección bacteriana, se inicia tratamiento empírico con tuberculostáticos (isoniazida 75mg-rifampicina 150mg-pirazinamida 400mg-etambutol 275mg) y ceftriaxona 1g ev c/24h.
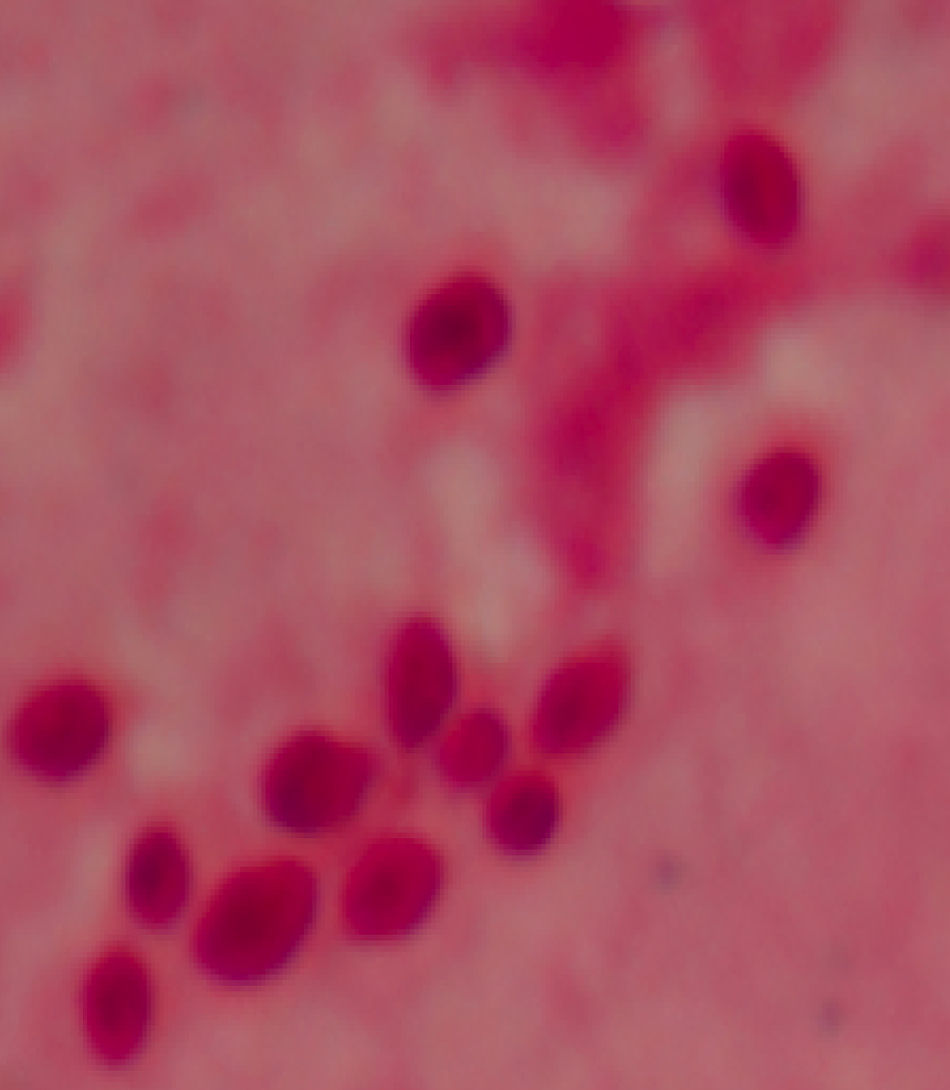
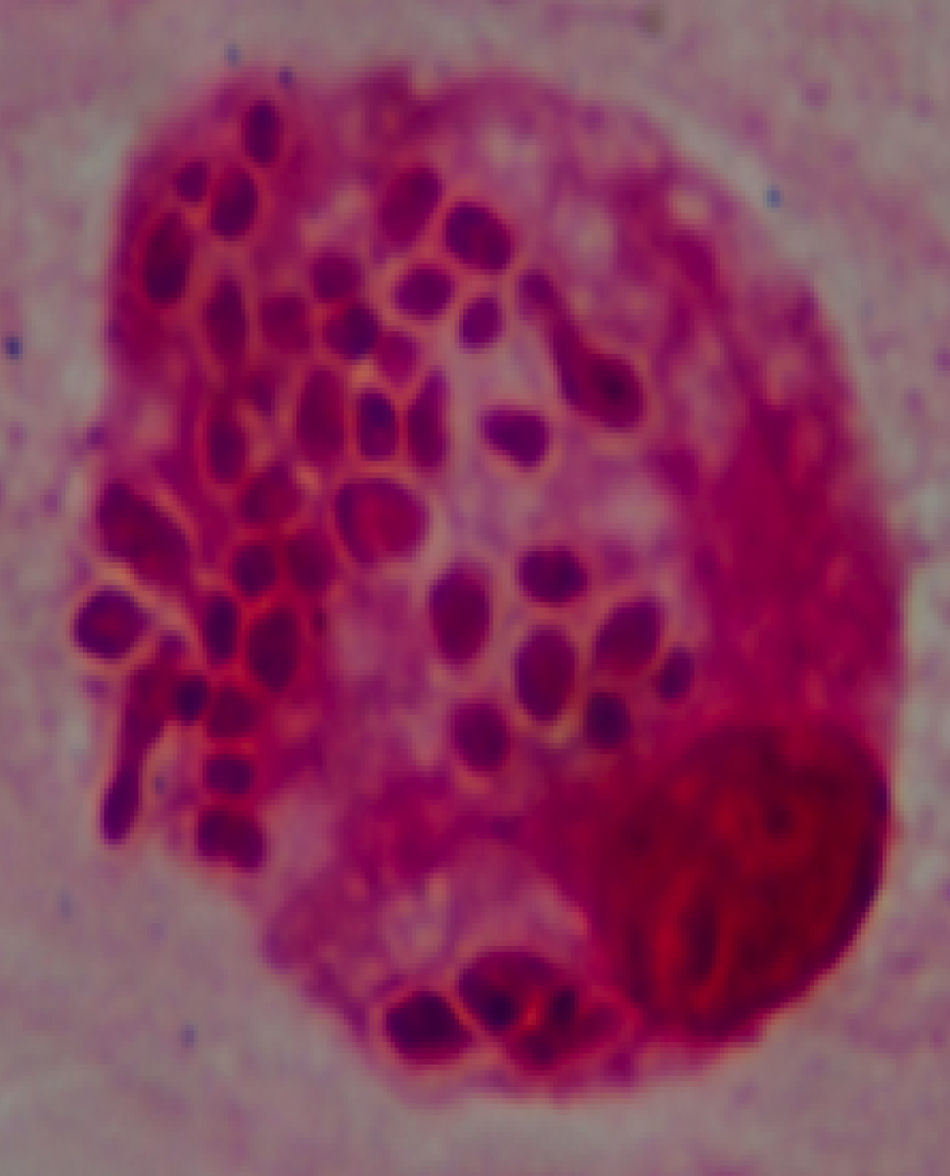
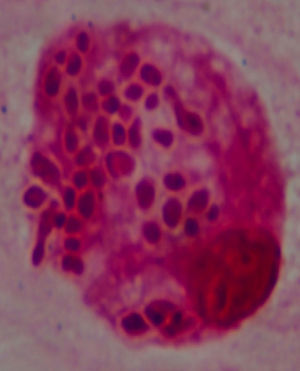
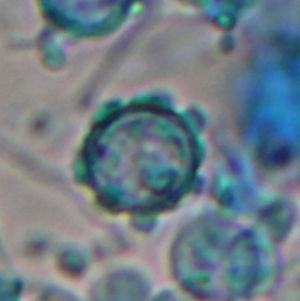
Diagnóstico y evoluciónLa serología para VIH resulta positiva, con carga viral por PCR de 107.000 copias ARN/ml y recuento de CD4 total de 11 cels/μL. Los hemocultivos para microorganismos comunes y micobacterias resultan negativos, cultivos en heces y orina para micobacterias negativos, ELI-SPOT (antígenos ESAT-6 y CFP-10) y Mantoux negativos, VDRL y antígeno de C. neoformans negativos. Del lavado broncoalveolar resultan negativos los cultivos para microorganismos comunes, PCR para micobacterias, antígenos y PCR para CMV, VEB, VHS-1 y 2 y virus respiratorios. En el examen directo con tinción de Gram de la muestra de esputo se observan abundantes levaduras (fig. 2). El LBA se prepara por citocentrifugación y se realiza tinción de plata, que descarta la presencia de P. jirovecii, tinción Giemsa para recuento celular y tinción de Gram. En todos los casos se observa la presencia de levaduras intracelulares, en algunos casos con gemación, que presentan un halo de exclusión (fig. 3). La morfología de la levadura sugiere la posibilidad de histoplasmosis, microorganismo clasificado en el nivel de peligrosidad 3, por lo que se procedió según las recomendaciones de la Sociedad Española de Microbiología Clínica1. El personal del laboratorio que pudiera entrar en contacto con muestras y cultivos de este paciente fue advertido e informado de las medidas de precaución adicionales que se tomaban. Todos los procedimientos posteriores, excepto los de biología molecular a partir de la extracción de ADN, fueron realizados en un laboratorio de nivel de contención 3. Al completar el estudio los cultivos fueron destruidos. Se inicia la identificación de esta levadura por métodos moleculares.
Ante la sospecha de enfermedad micótica invasora se inicia tratamiento con anfotericina B lipídica 300mg ev c/24h. La respuesta terapéutica inicial es desfavorable, desarrollando el paciente un distrés respiratorio y empeoramiento de la función hepática con importante plaquetopenia, que requieren de monitorización en unidad de cuidados intensivos durante 72 horas. De forma intercurrente se detecta carga viral alta de citomegalovirus, con buena respuesta a ganciclovir 250mg/kg/12h. Tras ese período (a las dos semanas de ingreso) se inició tratamiento antirretroviral, suspendiéndose los tuberculostáticos y pasando la anfotericina a itraconazol 400mg c/24h durante 5 días y posteriormente 200mg c/24h de forma indefinida. Tras un nuevo empeoramiento clínico que se abordó reintroduciendo la anfotericina y corticoides a dosis altas durante dos semanas más, el paciente experimentó una completa resolución del cuadro clínico y de las alteraciones analíticas.
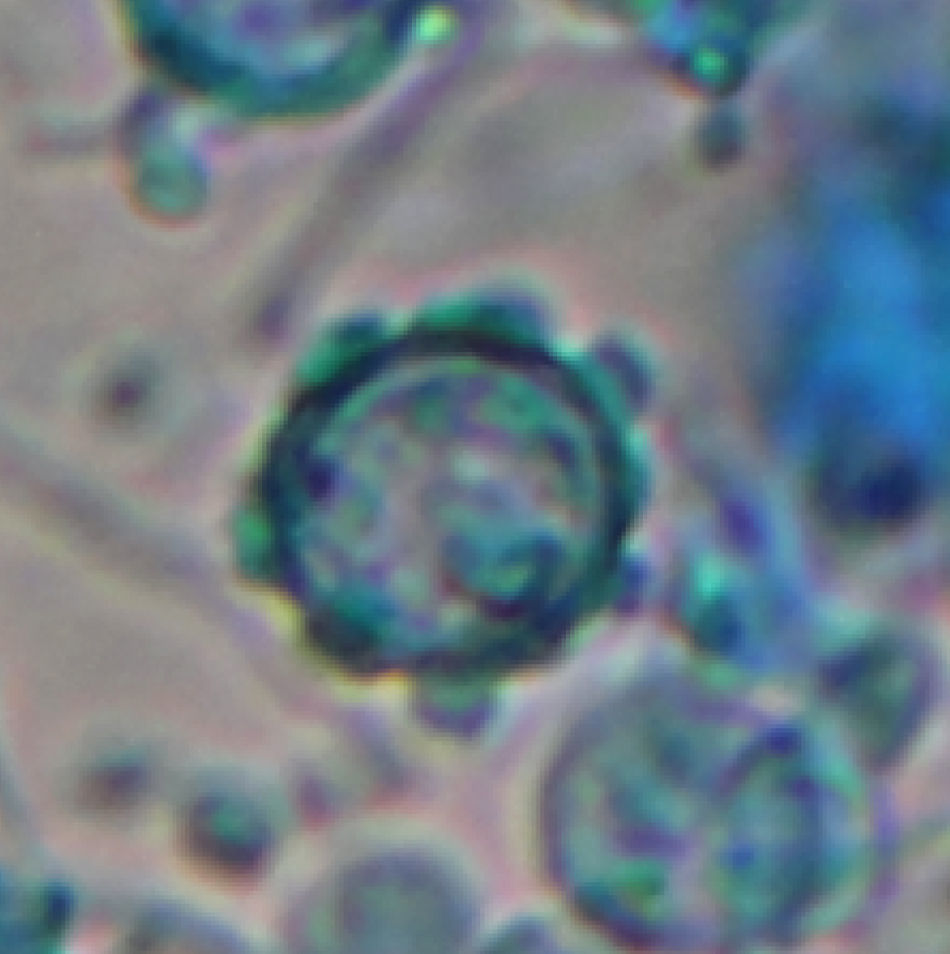
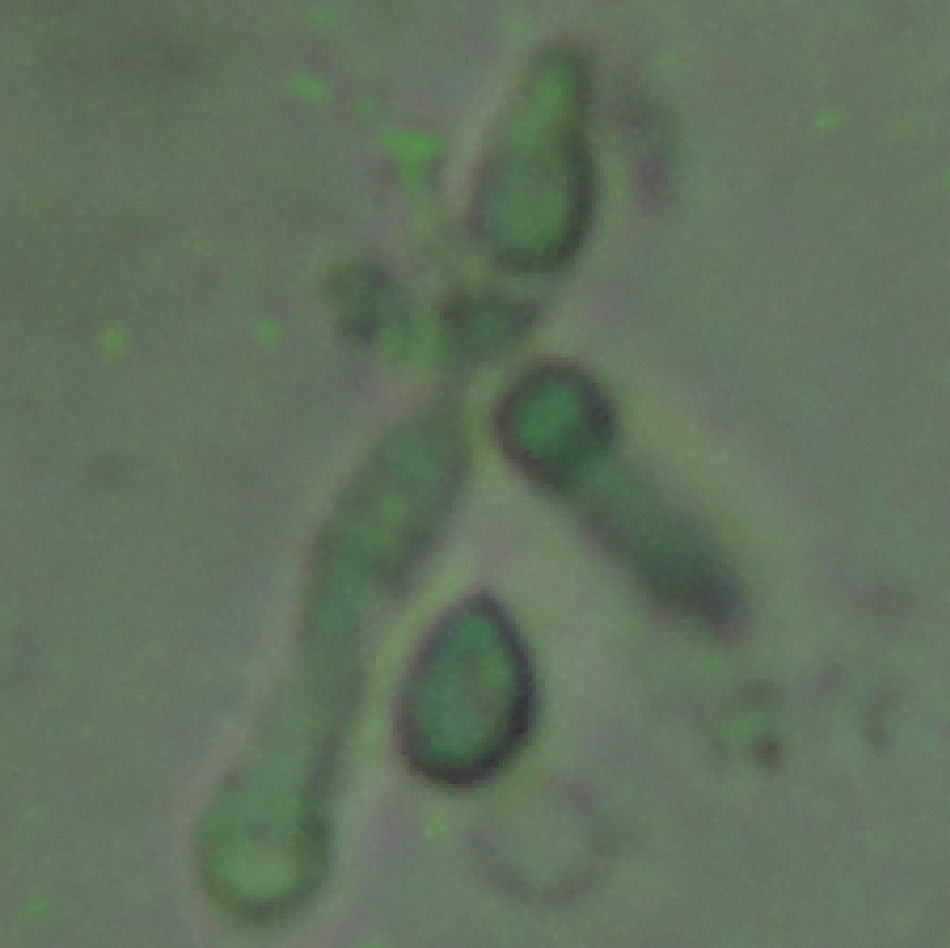
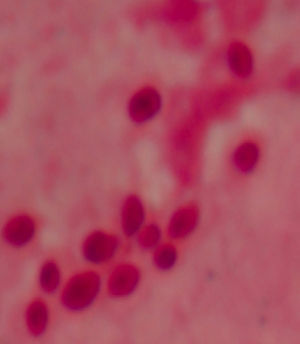
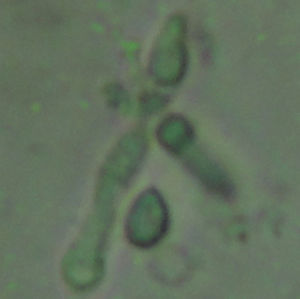
La detección de ADN por reacción en cadena de la polimerasa (PCR) a partir del LBA fue positiva. Se concentró una alícuota de 1ml del BAL mediante centrifugación a 16.000g. Se retiró el sobrenadante dejando 400μl y se añadió 100mg de arena de vidrio. Se agitó enérgicamente durante 10 minutos y se centrifugó para separar la arena de vidrio y los restos celulares. Se realizó la extracción del ADN total (EZ1 Virus Minikit V2.0, Qiagen). Para la amplificación (PCR) se utilizaron los cebadores universales ITS1/ITS42. El resultado de la amplificación se visualizó por electroforesis en gel de agarosa. El amplicón obtenido se purificó y se secuenció por ambos extremos. Se identificó Histoplasma capsulatum por comparación con la base de datos pública GenBank. A los siete días de la realización de los cultivos del esputo y del lavado broncoalveolar en Agar Sangre y Agar Dextrosa Saboureaud se observó el crecimiento de colonias levaduriformes en las placas incubadas a 37°C y el crecimiento de un hongo filamentoso en las placas incubadas a 25°C. El examen en fresco de la forma filamentosa a los 15 días de cultivo mostró la presencia de hifas hialinas septadas con macroconidias esféricas con proyecciones digitiformes, características de H. capsulatum (fig. 4) corroborando la identificación molecular realizada a las 72h de ingreso del paciente. Los hemocultivos fueron negativos por el sistema de detección automático (Sistema Bactec 9240 fluorimétrico; Becton Dickinson). A los diez días de incubación se extrajo 1ml de cada hemocultivo y se realizó el examen en fresco del precipitado, observándose la presencia de levaduras de pequeño tamaño (fig. 5). Se realizaron resiembras en Agar sangre y las placas se cultivaron a 37°C o 25°C obteniéndose colonias de hongo levaduriforme y filamentoso, respectivamente. Se interpretó el cuadro como histoplasmosis diseminada en paciente con infección por VIH no conocida.
H. capsulatum forma parte del denominado grupo de micosis endémicas, caracterizado por afectar a pacientes inmunocompetentes e inmunosuprimidos (sobre todo con deficiencia celular), que se localiza en las zonas templadas alrededor del mundo. En pacientes con sida suele ser una enfermedad de alta morbi-mortalidad, sobre todo en zonas endémicas y con escasos recursos, siendo incluso la enfermedad marcadora de sida en hasta el 50% de los pacientes3. Si bien la histoplasmosis puede tener diferentes cursos clínicos (desde asintomático a formas pulmonares agudas y crónicas) en pacientes inmunosuprimidos suele manifestarse como enfermedad diseminada, con fiebre, pérdida de peso, astenia, hepatoesplenomegalia, y compromiso pulmonar (siendo lo más frecuente la presencia de infiltrados retículo-nodulillares bilaterales), digestivo, neurológico y cutáneo, entre otros4,5. En este caso parece tratarse de una reactivación de una infección latente adquirida posiblemente en su país de origen, que se ha reactivado al infectarse por el virus VIH. El diagnóstico requiere un elevado índice de sospecha. En pacientes con sida la detección de antígeno de histoplasma en suero y orina puede ser negativa en pacientes con recuentos bajos de CD46. La observación directa de las muestras respiratorias, que muestran la presencia de levaduras intracelulares de aspecto atípico, junto con los datos de la anamnesis, deben hacer sospechar de la presencia de un H. capsulatum, en cuyo caso se debe seguir la normativa de seguridad que afecta a agentes infecciosos de nivel 3. Por tratarse de un paciente VIH es necesario realizar el diagnóstico diferencial con P. jirovecii y Leishmania. La utilización de métodos moleculares para la identificación de este hongo de crecimiento lento permite adelantar el diagnóstico microbiológico y, por lo tanto, adecuar el tratamiento antifúngico. El tratamiento se basa en el uso de anfotericina B liposomal (en formas moderadas a graves) por lo menos durante 2 semanas, y posteriormente terapia prolongada con itraconazol7,8.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.