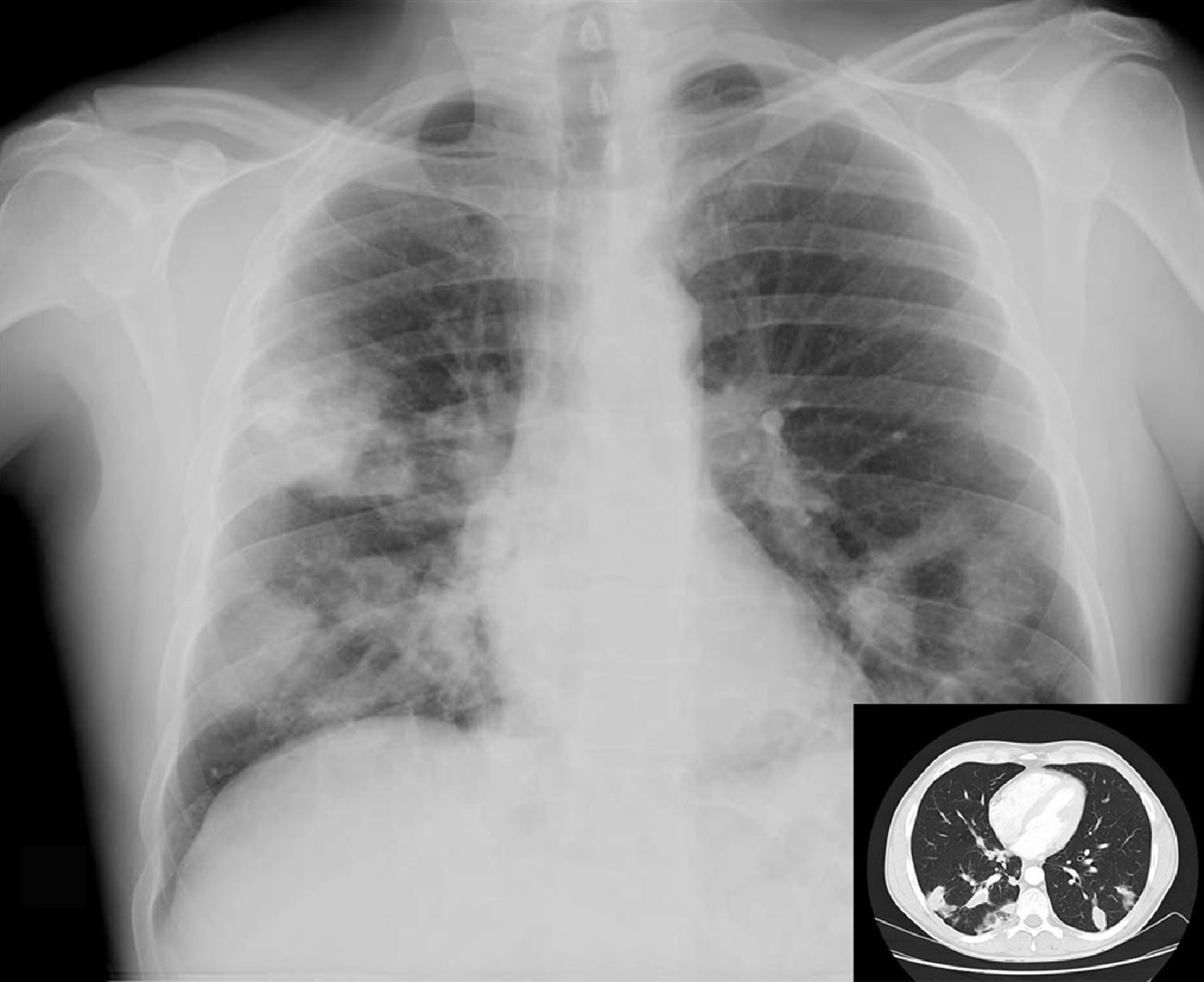
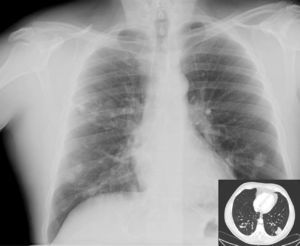
Varón de 43 años nacido en España con infección VIH conocida desde 1992 adquirida vía parenteral e infección crónica por VHC. En estadio C desde 1994 en que presentó TBC ganglionar que fue tratada correctamente. Fue seguido en otro centro entre 1997 y 2003 siendo el nadir de CD4 de 170cel/μl en febrero de 1998. Realizó tres líneas de tratamiento antirretroviral de alta eficacia (TARGA) basadas en 3TC-d4T-IDV-NFV. En revisión en nuestro centro desde 2003 fecha en la que realizaba tratamiento con 300mg de lamivudina/24h/v.o., estavudina 40mg/12h/v.o. y nevirapina 200mg/12h/v.o., siendo el recuento de CD4 en ese momento de 490cel/μl y la carga viral plasmática (CVP) de 1,69log10 copias/ml. En diciembre de 2005 se sustituye la estavudina por 245mg de tenofovir/24h/v.o. ante la presencia de lipoatrofia y en marzo de 2006 se suspende el tratamiento antirretroviral ante la sospecha de hepatotoxicidad por nevirapina. Una analítica realizada 4 semanas después muestra normalización de las transaminasas siendo la situación inmunovirológica de 449 CD4cel/μl y la CVP de 5,68log10 copias/ml. El paciente abandona el seguimiento permaneciendo sin tratamiento antirretroviral durante 14 meses. Acude en mayo de 2007 a consultas refiriendo episodios repetidos de muguet con buena respuesta a nistatina v.o. y pérdida de 5kg de peso. Se inicia TARGA basado en 300mg de tenofovir coformulado con 200mg de emtricitabina/v.o. cada 24 horas y fosamprenavir 400mg/12h/v.o. potenciado con ritonavir 100mg/12h/v.o. Acude a urgencias 3 semanas después de iniciado el TARGA por fiebre de 5 días de evolución, sudoración y tos escasamente productiva. A su llegada a urgencias, TA 130/80mmHg, temperatura 39,2° C, saturación de oxígeno (aire ambiente) del 95%. Buen estado general. Eupneico. Lipoatrofia facial y crepitantes en ambos campos pulmonares, siendo el resto de la exploración física normal. Se realizó hemograma y estudio de coagulación que resultaron normales y bioquímica con ALT 77U/l, AST 88U/l, GGT 128U/l, LDH 363U/l, siendo la urea, creatinina e iones normales. La situación inmunovirológica fue de 356 CD4cel/μl y CVP 2,82log10. La Rx de tórax mostró infiltrados pseudonodulares bilaterales (fig. 1). El diagnóstico diferencial de pacientes VIH con lesiones pulmonares nodulares de causa infecciosa se establece según exista o no cavitación en ellas y el recuento de CD4 (mayor o menor de 200 CD4 diagnostico cel/μl), lo que implicaría incluir o no etiologías como Legionella, Nocardia o Rhodococcus. Independientemente del recuento de CD4 habría que considerar infecciones oportunistas por hongos y micobacterias, las neoplasias pulmonares (linfoma, carcinoma broncogénico o sarcoma de Kaposi) o la endocarditis derecha. Se decidió ingreso hospitalario solicitándose hemocultivos convencionales y para micobacterias, baciloscopia y cultivo de esputo, antígeno criptocócico sérico, ecocardiografía, TAC de tórax y fibrobroncoscopia.
Rx de tórax: infiltrado alveolar parcheado en ambos campos pulmonares, alguno de ellos de morfología nodular. TAC de tórax c/c: opacidades nodulares bilaterales peribroncovasculares y perilinfática sin cavitación con infiltrados alveolares pseudonodulares con broncograma y tendencia a la confluencia en regiones declives de ambos lóbulos inferiores.
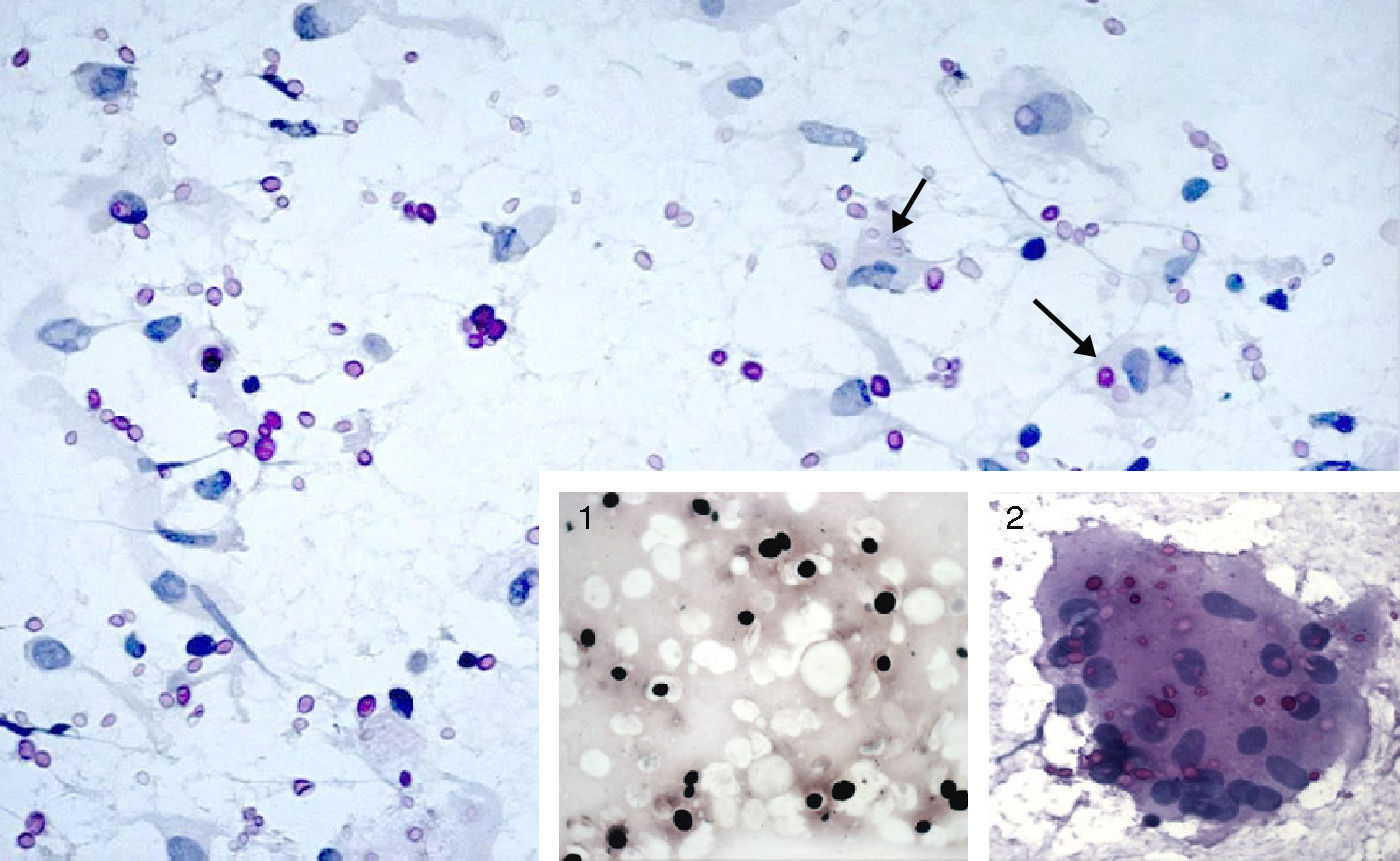
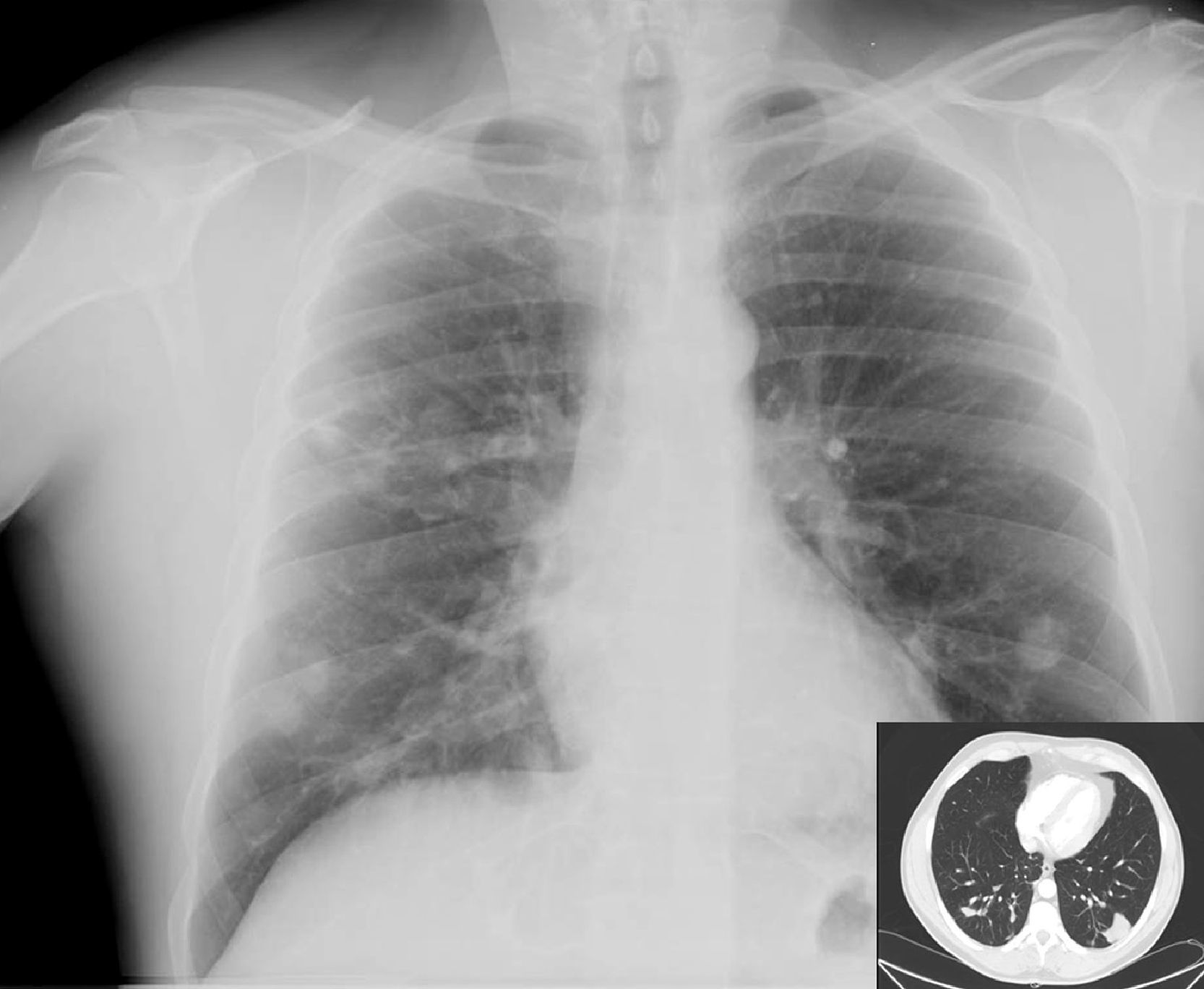
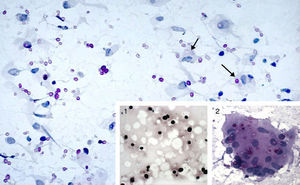
Se inició tratamiento antitérmico con desaparición de la fiebre a las 72 horas. El resultado de los hemocultivos extraídos en urgencias fue negativo. La proteína C reactiva fue de 3mg/dl y la VSG de 39mm/hora. La ecocardiografía no evidenció imágenes sugestivas de endocarditis derecha. Se realizó TAC de tórax (fig. 1) con opacidades nodulares múltiples e infiltrados alveolares pseudonodulares. La fibrobroncoscopia resultó normal siendo el cultivo convencional, de micobacterias y hongos en muestras del lavado broncoalveolar (BAL) y broncoaspirado (BAS), negativo. La inmunofluorescencia directa para Pneumocystis jirovecii en el BAL fue negativa. No se observaron gérmenes ni se evidenciaron células neoplásicas en la citología de muestras de cepillado bronquial, BAS o BAL. Se realizó antígeno criptocócico en sangre positivo con un título de 1/256. El estudio de líquido cefalorraquídeo mostró 4leucocitos/mm3, 67mg/dl de proteínas, 59mg/dl de glucosa, siendo la tinta china, el cultivo y el antígeno criptocócico negativos. Se realizó punción aspirado con aguja fina (PAAF) de uno de los nódulos basales izquierdos, cuyo cultivo en medio aerobio, anaerobio y micobacterias resultó negativo, observándose levaduras que fueron enviadas al Servicio de Micología del Centro Nacional de Microbiología (Instituto de Salud Carlos III, Madrid) para su identificación. El estudio anatomopatológico, incluyendo tinciones de PAS y Grocott, demostró macrófagos (mono y multinucleados) con un componente menor de linfocitos y neutrófilos y gran cantidad de esporas elípticas sin hifas intra y extracitoplasmáticas (fig. 2). Durante dos semanas realizó tratamiento con anfotericina B (7mg/Kg/día/i.v.) y flucitosina (100μg/Kg/día/v.o.), seguidos de seis semanas de fluconazol 400mg/día/v.o. La levadura aislada, mediante métodos convencionales no genotípicos, fue C. neoformans var grubii (serotipo A). Se mantuvo el TARGA en todo momento no requiriendo esteroides. Completó un año con 200mg/día/v.o. de fluconazol. En radiografía y TAC torácico (fig. 3) al año de seguimiento se evidenciaba la reducción manifiesta del número y tamaño de los nódulos pulmonares. Los CD4 eran de 492cel/μl y la CVP 1,69log10 copias/ml. Tres años después se encontraba asintomático siendo el recuento de CD4 de 903cel/ml y la CVP<1,3log10 copias/ml.
PAAF de pulmón. MO (magnificación original) 640×. Tinción de PAS. Abundantes estructuras de tamaño variable (4-15μm), centro retráctil y coloración rosada, generalmente sueltas y ocasionalmente en el interior de macrófagos (flechas). 1: Tinción de Gomori-Grocott, tinción a base de metenamina de plata. Se observa un halo claro alrededor de los microorganismos. MO 640×. 2: Célula multinucleada gigante con abundantes criptococos en su interior. Tinción de PAS. MO 640×.
La criptococosis es una enfermedad infecciosa causada por levaduras encapsuladas pertenecientes al género Cryptococcus spp. siendo las especies C. neoformans y C. gatti los principales patógenos humanos. C. neoformans es un hongo cosmopolita que se aísla en el suelo contaminado con excrementos de palomas y otras aves, mientras que C. gatti se aísla en áreas tropicales y subtropicales relacionándose con eucaliptos y alcornoques. C. neoformans no suele causar infecciones en personas inmunocompetentes a diferencia de C. gatti. C. neoformans variedad grubii causa la gran mayoría de la criptococosis relacionada con el sida1,2. La población susceptible está constituida por pacientes inmunodeprimidos, siendo el factor de riesgo más importante para su adquisición la infección por el virus de la inmunodeficiencia humana tipo 11. Otros factores de riesgo conocidos son: trasplante de órganos sólidos, enfermedades onco-hematológicas, enfermedades del tejido conectivo, disminución idiopática de linfocitos CD4, cirrosis hepática, diabetes y el tratamiento con esteroides o anticuerpos monoclonales (etanercept, infliximab, alemtuzumab)2. La prevalencia de la criptococosis en pacientes con sida al comienzo de la epidemia fue del 2-10% en Europa Occidental y Estados Unidos1. Tras la introducción del TARGA y en aquellos países con acceso al mismo, se produce un dramático descenso en su incidencia. La infección se adquiere tras inhalar levaduras pobremente encapsuladas (<3μm) de la naturaleza, que se depositan en los alvéolos pulmonares3. Una vez que el hongo penetra en el huésped susceptible puede causar infección latente o enfermedad aguda, dependiendo de tres factores patogénicos: situación inmune del huésped, virulencia de la cepa, o tamaño del inóculo2,4. Los órganos afectados con más frecuencia son el sistema nervioso central y el tracto respiratorio, siendo menos común la afectación de la piel, próstata, ojos, hueso, tracto urinario y sangre2. Las manifestaciones clínicas, radiológicas e histológicas de la criptococosis pulmonar varían en función del estado inmune del paciente 1,4–6. En pacientes inmunocompetentes la infección aguda puede ser asintomática en hasta un tercio de los casos, o bien presentar síntomas inespecíficos como fiebre, dolor torácico, tos con expectoración mucosa o pérdida de peso2. No suele diseminarse, siendo los cultivos en sangre, orina y LCR, así como el antígeno criptocócico (sérico y en LCR) negativos4. La manifestación radiológica más frecuente consiste en nódulos pulmonares únicos o múltiples bien delimitados, infiltrados simulando masas, adenopatías (hiliares y mediastínicas), ocasionalmente derrame pleural y raramente cavitación4. Entre los hallazgos histológicos destaca la formación de granulomas junto con infiltrados de monocitos y células gigantes multinucleadas acompañadas de abundantes hifas4–6. Por otro lado, los pacientes VIH con inmunodepresión severa (antes del TARGA) presentaban en su mayoría síntomas como fiebre (81%) y tos (63%), disnea (50%), pérdida de peso (47%), cefalea (41%), y ocasionalmente dolor pleurítico y hemoptisis4. La diseminación del germen a sangre o meninges era la norma en más del 90% de los pacientes2, condicionando tanto la clínica como un pésimo pronóstico7. En la radiología de tórax se observaban con más frecuencia infiltrados intersticiales (focales o difusos), y adenopatías, siendo infrecuentes los infiltrados nodulares y alveolares así como las masas y el derrame pleural6,7. Los hallazgos histológicos se caracterizan por una escasa respuesta inflamatoria con abundantes hifas en el parénquima pulmonar4–6. La restauración del sistema inmune en pacientes VIH inducida por el TARGA puede acompañarse de una respuesta inflamatoria exagerada y empeoramiento de las manifestaciones clínicas de infecciones oportunistas, conocido como síndrome de reconstitución inmunológica (SIR)8. Se distinguen dos tipos de SIR conocidos como SIR «paradójico» y SIR «desenmascarado». El primero se define como el deterioro clínico de la infección oportunista conocida y diagnosticada tras una respuesta inicial de esta al tratamiento antimicrobiano. El SIR «desenmascarado» consiste en la presentación acelerada de la infección oportunista, que se encontraba latente, durmiente o subclínica cuando comenzó el TARGA9. La manifestación clínica más frecuente del SIR asociado a la criptococosis es la afectación neuromeníngea, seguida de la ganglionar, pulmonar y cutaneomucosa10.
La infección latente por C. neoformans en el tejido linfático pulmonar puede reactivarse tras un periodo prolongado (con una fisiopatología similar a la tuberculosis) ocasionando enfermedad5, con formas clínicas atípicas como el caso que aquí presentamos. En todo paciente gravemente inmunodeprimido hay que considerar la aparición de un SRI ante la presentación de cuadros clínicos coincidiendo con la elevación de linfocitos CD4 y la caída de la viremia plasmática.