La enfermedad de Chagas o tripanosomiasis americana es una parasitosis originaria del continente americano. En la naturaleza, Trypanosoma cruzi se transmite vectorialmente a través de diversas especies de chinches triatominos. No obstante, se han descrito otros mecanismos de transmission no vectorial, como la transmisión a través de productos sanguíneos o mediante el trasplante de órganos infectados, y la transmisión vertical. Actualmente, la enfermedad de Chagas afecta a unos 10-12 millones de personas en el mundo y el proceso de urbanización en América Latina y los movimientos migratorios desde los países endémicos han posibilitado que la enfermedad de Chagas sea diagnosticada en zonas donde la infección no es endémica. Se considera que un 20-30% de las personas infectadas por T. cruzi desarrollarán a lo largo de su vida alteraciones cardíacas. Las características diferenciales de la cardiopatía chagásica, el escaso conocimiento que se tiene de ella en nuestro medio y la elevada frecuencia de arritmias y muerte súbita como primeras manifestaciones potenciales de esta enfermedad hacen prioritarias la elaboración y divulgación de protocolos diagnósticos y terapéuticos para la atención de estos pacientes a fin de mejorar el conocimiento de esta patología por los profesionales sanitarios potencialmente implicados en su detección y manejo.
Chagas’ disease, or American trypanosomiasis, is a parasitic zoonosis found only in the Americas. Under natural conditions, Trypanosoma cruzi is transmitted by insects belonging to different species of Triatoma. However, several routes of transmission that do not involve insect vectors have also been described, such as transmission via blood products or transplantation of infected organs, and vertical transmission. At present, the number of people infected with Chagas’ disease worldwide is estimated to be about 10-12 million. The process of urbanization in Latin America and migratory population movements from endemic countries have led to the disease being diagnosed in non-endemic areas. It is estimated that 20-30% of individuals infected with T. cruzi will develop symptomatic heart disease at some point during their lives. The specific differential characteristics of chronic chagasic cardiopathy, lack of knowledge of the disease among many healthcare workers, and the fact that arrhythmia or sudden death is frequently the first manifestation of disease all make it essential that diagnostic and therapeutic protocols for the disease are developed and disseminated. The aim should be to improve patient care by increasing understanding of the condition by physicians and other healthcare professionals who may be involved in its detection and treatment.
La enfermedad de Chagas o tripanosomiasis americana es una parasitosis originaria del continente americano. Carlos Chagas la describió a principios del siglo XX, y ha sido –y es– uno de los retos de salud pública más importantes de América Latina.
Las tendencias epidemiológicas en las últimas dos décadas muestran claramente una reducción de la transmisión vectorial debido a los programas de control y mejora de la vivienda rural, así como su interrupción en Chile, Uruguay y recientemente Brasil, lo que ha contribuido a la disminución de la incidencia anual de la enfermedad en todo el continente1–3.
En la naturaleza, Trypanosoma cruzi se transmite vectorialmente a través de diversas especies de chinches triatominos. No obstante, se han descrito otros mecanismos de transmisión no vectorial a través de productos sanguíneos, el trasplante de órganos y la transmisión vertical. En las zonas donde la infección es endémica, también se ha descrito la transmisión oral por la ingestión de alimentos contaminados con heces de los chinches infectados4,5.
Actualmente, la enfermedad de Chagas afecta a unos 10-12 millones de personas en el mundo6. Su distribución geográfica se extiende desde el paralelo 40 de latitud norte, en el sur de Estados Unidos en América del Norte, al paralelo 45 de latitud sur de Argentina y Chile7. El proceso de urbanización en América Latina, intensificado en la segunda mitad del siglo XX, ha modificado el perfil epidemiológico de esta enfermedad, y los movimientos migratorios desde los países endémicos han posibilitado que la enfermedad de Chagas sea diagnosticada en zonas donde la infección no es endémica8,9.
España se ha convertido en uno de los países europeos que recibe más inmigrantes procedentes de América Latina. El 31 de diciembre de 2005 constaban en el registro de extranjeros con tarjeta de residencia en España cerca de un millón de personas originarias de América Latina10, aunque la revisión del padrón municipal del año 2005 arrojaba unas cifras superiores (1.445.796 personas). En las unidades y servicios especializados en medicina tropical y salud internacional de nuestro país ya se está diagnosticando y tratando a personas con esta enfermedad11.
La reciente reunión de la OPS en Montevideo se hizo eco de esta realidad, y en su informe final hace alusión a las necesidades que tienen los países receptores de inmigrantes originarios de áreas endémicas para hacer frente a la enfermedad de Chagas y poder atender adecuadamente a las personas afectadas, así como para evitar la transmisión de T. cruzi por las vías vertical y sanguínea12.
Patogénesis e historia natural de la cardiopatía en la enfermedad de ChagasDespués de la fase aguda de la infección, la enfermedad de Chagas no tratada entra en una fase crónica, inicialmente con una forma asintomática o indeterminada. Posteriormente, el 20-30% de los pacientes desarrolla alteraciones cardíacas (forma cardíaca), un 10% alteraciones digestivas (forma digestiva) o ambas (forma mixta) y menos del 5%, una forma neurológica. El resto permanecerá en la forma indeterminada, sin ningún tipo de manifestaciones clínicas durante toda su vida13.
Debido a la potencial gravedad de las complicaciones cardíacas de la enfermedad y a la frecuencia de éstas, el II Taller sobre la enfermedad de Chagas importada se ha centrado en las características clínicas de la cardiopatía chagásica crónica (CCC) y en los requerimientos para un correcto diagnóstico, manejo y tratamiento. La patogenia de la enfermedad es controvertida, aunque los conocimientos actuales orientan hacia una etiología mixta, en la que participaría directamente el parásito produciendo daño miocárdico14,15 y un fenómeno autoinmune asociado16,17. Otros mecanismos patogénicos descritos incluyen alteraciones microvasculares y denervación autonómica18–21.
La cardiopatía chagásica presenta algunas características diferenciales con otras cardiopatías más comunes en nuestra área:
- –
Se trata de una cardiopatía fibrosante, que generalmente se localiza en la región posteroinferior y apical del ventrículo izquierdo, el nódulo sinusal y el sistema de conducción por debajo del haz de His y cursa con afectación predominantemente segmentaria de la contractilidad.
- –
Es una miocardiopatía dilatada con tendencia a la formación de aneurismas, sobre todo apicales.
- –
Gran potencial arritmogénico, siendo frecuentes las arritmias ventriculares, muchas veces asociadas a bradiarritmias (de origen sinusal y/o auriculoventricular).
- –
Elevada frecuencia de fenómenos tromboembólicos.
- –
Puede presentarse como dolor precordial, generalmente atípico, aunque eventualmente puede simular una cardiopatía isquémica.
En la evolución natural de la enfermedad, las alteraciones cardíacas aparecen de forma progresiva a los 20-30 años de la infección22. No obstante, un 5-10% de los pacientes presentan durante la fase aguda una miocarditis de evolución rápida hacia una forma grave de cardiopatía de Chagas23,24. Más raramente, pacientes que se encuentran en la fase crónica de la enfermedad, con afectación cardíaca leve, pueden presentar una agudización súbita con intensa parasitemia y clínica de insuficiencia cardíaca aguda; los tratamientos inmunosupresores favorecen también estas reagudizaciones25.
Estudio del paciente con sospecha de enfermedad de Chagas y cardiopatía chagásicaDiagnóstico de la infección por T. cruziEl diagnóstico de la enfermedad de Chagas en nuestro medio se abordó en el documento de consenso del primer Taller sobre la enfermedad de Chagas importada26. En síntesis se basa en la coexistencia de dos criterios:
- –
Antecedente epidemiológico compatible: el paciente debe tener por lo menos un antecedente epidemiológico (personas originarias o hijos de madres originarias de zonas endémicas; viajeros con estancias en área endémica y estilo de vida de riesgo de infección) que haya hecho posible la transmisión de T. cruzi a través de cualquiera de las vías de infección descritas.
- –
Diagnóstico microbiológico. Se considera infectadas a todas las personas con un resultado parasitológico positivo o si tienen dos resultados positivos con dos técnicas serológicas que utilicen diferentes antígenos. En caso de resultados dudosos o de discordancia entre los mismos, debe realizarse una tercera técnica. Existen diversas pruebas serológicas para el diagnóstico de la enfermedad de Chagas que utilizan técnicas distintas (ELISA, ELISA modificado o con antigenos recombinantes, inmunofluorescencia, hemaglutinación indirecta, inmunocromatografía). La reacción en cadena de la polimerasa (PCR) es posiblemente la técnica parasitológica más sensible en el Chagas crónico, pero su práctica no exime de utilizar las pruebas serológicas.
Para descartar que un paciente con infección por T. cruzi tenga afectación cardíaca, se debe practicar una anamnesis y una exploración física completas, un electrocardiograma, una radiografía de tórax y un ecocardiograma. Los síntomas y signos de exploración física en la cardiopatía chagásica son los propios de las miocardiopatías en general y ninguno de ellos es patognomónico de esta enfermedad.
AnamnesisEl principal objetivo de la anamnesis es detectar síntomas de una posible cardiopatía subyacente. En la tabla 1 se describen los signos y síntomas más frecuentemente asociados a la afectación cardíaca por T. cruzi. Es importante recoger asimismo la existencia de alteraciones digestivas (disfagia, estreñimiento…), ya que ocasionalmente pueden coexistir ambas formas.
Signos y síntomas más frecuentemente relacionados con la afección cardíaca por T. cruzi
|
Al efectuar la anamnesis, es importante recordar que existen diferencias lingüísticas y culturales que pueden dificultar la comunicación médico-paciente. Ocasionalmente los pacientes no comparten los mismos significados para palabras idénticas (por ejemplo, "ahogo", "mareo" o "palpitaciones") y puede ser necesario definir a qué se refiere en cada caso. Además, con frecuencia los inmigrantes padecen trastornos adaptativos, duelos de separación y trastornos distímicos en relación con su situación social y familiar27 que pueden dificultar la identificación del síntoma-guía o motivo de consulta con precisión. Por último, es necesario tener en cuenta las condiciones laborables desfavorables (horarios intensivos, miedo a perder el contrato, contratos no regularizados…), que suponen una traba adicional para acudir a las citas programadas. Puesto que la enfermedad es conocida por estos pacientes y genera preocupación, la notificación del resultado positivo de infección/enfermedad de Chagas al paciente requiere un correcto proceso de comunicación que genere confianza12. En este sentido, los mediadores culturales desempeñan un papel importante.
Exploración físicaDebe realizarse una exploración física detallada, prestando especial atención a la exploración cardiovascular. Los soplos cardíacos de disfunción valvular pueden aparecer como consecuencia de la dilatación de las cavidades. En fases más avanzadas se detectan los signos habituales de congestión e hipoperfusión periférica. La caquexia cardíaca es también una manifestación de estados más avanzados de la cardiopatía chagásica y tiene un valor pronóstico importante.
ElectrocardiogramaA todo paciente con infección por T. cruzi debe practicársele un electrocardiograma (ECG) convencional de 12 derivaciones, con un registro largo, de 30 segundos, en DII. En la fase crónica de la infección las alteraciones electrocardiográficas preceden en años a la aparición de los síntomas y de cardiomegalia (tabla 2). Aunque no existe un patrón electrocardiográfico patognomónico, estas alteraciones, especialmente el bloqueo de rama derecha, aislado o asociado a hemibloqueo anterior izquierdo en pacientes con serología positivar, pueden considerarse indicativas de cardiopatía chagásica crónica28–30. No obstante, dada su falta de especificidad, el diagnóstico requiere confirmación, ya que su presencia no significa necesariamente la etiología chagásica.
Alteraciones electrocardiográficas más frecuentes en la cardiopatía chagásica
|
Un ECG normal excluye la presencia de disfunción moderada o grave del VI, con un valor predictivo negativo (VPN) cercano al 100%. Por otro lado, a mayor número de alteraciones presentes en el ECG, peor función ventricular31.
Las alteraciones de la conducción intraventricular y el ensanchamiento del QRS aparecen precozmente en la CCC, cuando todavía no existen alteraciones de la contractilidad miocárdica, por lo que carecen del valor pronóstico que tienen en otras cardiopatías32.
Radiografía de tóraxEs una exploración de baja sensibilidad para la detección de la cardiopatía chagásica, ya que puede existir disfunción ventricular con radiografía normal. Sin embargo, la evidencia de cardiomegalia podría ser un factor predictivo de riesgo de muerte súbita en pacientes con Chagas crónico33. Se debe realizar con el paciente en situación clínicamente compensada, valorando como positivos los signos de hipertensión venocapilar, crecimiento de cavidades o un índice cardiotorácico superior a 0,60.
EcocardiografíaPuesto que la ecocardiografía es una técnica incruenta de amplia difusión, y muy útil para valorar la función ventricular, todo paciente con enfermedad de Chagas es candidato a la realización de un ecocardiograma basal.
Las alteraciones ecocardiográficas más frecuentes se resumen en la tabla 334,35. Para la realización del ecocardiograma son útiles las siguientes recomendaciones:
- a)
Se aconseja realizar un estudio ecocardiográfico transtorácico convencional, siguiendo un sistema específico:
- 1.
Utilizar un transductor de alta frecuencia.
- 2.
Realizar un corte transversal (para el análisis segmentario de la región inferoposterior), otro apical de dos cámaras y cortes intermedios entre dos y cuatro cámaras, para detectar la posible existencia de aneurismas apicales.
- 3.
Se debe valorar con especial atención la región posteroinferior del ventrículo izquierdo (VI), incluyendo el ápex cardíaco, en busca de hipocinesias o acinesias segmentarias y de aneurismas apicales. Es frecuente observar además la presencia de hiperrefringencia y adelgazamiento parietal, semejante a lo descrito en la cardiopatía isquémica, siendo éste un sustrato para el desarrollo de arritmias ventriculares por reentrada.
- 4.
Se recomienda prestar especial atención a la búsqueda de ecocontraste espontáneo y a la existencia de trombos intracavitarios.
- 5.
Valorar específicamente la función diastólica y la función del ventrículo derecho en todos los pacientes con sospecha de cardiopatía chagásica. La alteración de la función diastólica del VI ocurre de forma precoz en la enfermedad de Chagas, y su gravedad generalmente se correlaciona con el grado de disfunción sistólica36,37.
- 6.
El estudio transesofágico está indicado cuando la ventana transtorácica no permite valorar las cavidades izquierdas.
- 1.
Hallazgos ecocardiográficos más frecuentes en la cardiopatía chagásica
|
La reducción de la fracción de eyección del ventrículo izquierdo, el aumento del diámetro telesistólico y el patrón restrictivo del flujo mitral son los predictores ecocardiográficos pronósticos más importantes en los pacientes con cardiopatía chagásica38,39.
En las fases avanzadas, cuando existe insuficiencia cardíaca congestiva, el patrón ecocardiográfico predominante es el de una hipocinesia difusa biventricular con aumento de las cuatro cavidades.
Otras exploraciones cardiológicas en el paciente con sospecha de cardiopatía chagásicaAdemás de los estudios básicos comentados, otras exploraciones complementarias pueden ser útiles en determinados pacientes o circunstancias:
Estudio Holter (EH) de 24 horasSe recomienda su realización en pacientes con:
- –
Síntomas sugestivos de arritmia cardíaca (síncope, presíncope o palpitaciones).
- –
Presencia de determinadas arritmias cardíacas en el ECG, como bradiarritmias sinusales (con frecuencia cardíaca media inferior a 40 lpm y/o pausas sinusales prolongadas), bloqueos auriculoventriculares de segundo grado y extrasístoles ventriculares frecuentes y/o con formas repetitivas (salvas).
El Holter de 24 horas permitirá establecer la posible relación de los síntomas con una arritmia, identificar a los pacientes en riesgo de muerte súbita y evaluar la presencia de disfunción autonómica33,40. En aproximadamente el 90% de los pacientes con cardiopatía chagásica y disfunción ventricular o insuficiencia cardíaca se registran episodios de taquicardia ventricular no sostenida41.
Para la realización del EH se debe utilizar una técnica convencional preferiblemente con un sistema de 3 canales. La sensibilidad del Holter es baja cuando los episodios de arritmia son poco frecuentes, pudiéndose en estos casos utilizar otras técnicas como el Holter implantable.
Estudio electrofisiológico (EEF)El objetivo del EEF en estos pacientes es identificar alteraciones de la conducción auriculoventricular e intraventricular, así como analizar la posibilidad de inducir arritmias ventriculares malignas. Las indicaciones son las mismas que para el estudio de otras patologías con riesgo de muerte súbita:
- –
Pacientes con sintomatología sugestiva de arritmia (síncope o presíncope) no aclarada por los estudios previos.
- –
Taquicardia ventricular sostenida, con o sin sintomatología, independiente del grado de función ventricular.
- –
Paciente resucitado de muerte súbita.
- –
Pacientes que presentan en el ECG o Holter alteraciones asociadas a un mayor riesgo de muerte súbita: extrasístoles ventriculares repetidas o en parejas, episodios de taquicardia ventricular no sostenida y aumento de la dispersión del intervalo QT asociados a la presencia de disfunción ventricular42. En este subgrupo de pacientes, si el estudio electrofisiológico no es posible, puede administrarse amiodarona de forma empírica, si no existen contraindicaciones.
Estaría indicada básicamente en los siguientes casos:
- –
Valoración de capacidad funcional.
- –
Valoración de la respuesta cronotrópica.
En presencia de dolor torácico y cardiopatía chagásica, la prueba de esfuerzo es de escasa utilidad para conocer la etiología del dolor; en estos casos se debe realizar una coronariografía.
CoronariografíaSe indicará de acuerdo con los criterios de la Sociedad Española de Cardiología43, teniendo en cuenta lo reseñado en el punto anterior.
Biopsia miocárdicaNo se considera actualmente una técnica diagnóstica en la cardiopatía chagásica, debido a sus riesgos y escasa especificidad.
Manejo del paciente infectado por T. cruziPaciente asintomático con electrocardiograma y radiografía de tórax normalesEl riesgo de cardiopatía chagásica es mayor durante la segunda y tercera décadas después de la infección44. En los pacientes con evidencia de infección por T. cruzi y con un electrocardiograma normal, o con mínimas alteraciones no sugestivas de CCC, el riesgo anual de progresión hacia la cardiopatía es del 2 al 5%45,46. Por este motivo se recomienda un ecocardiograma basal.
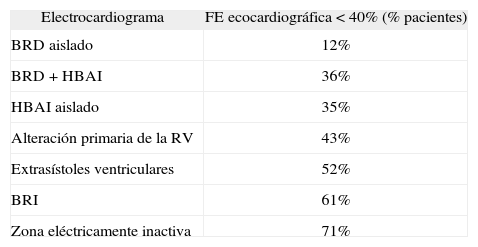
Paciente asintomático con ECG anormalEn este grupo de pacientes se recomienda realizar un estudio ecocardiográfico basal. Los hallazgos son muy variables, detectándose en aproximadamente el 30% de los casos disfunción ventricular izquierda (fracción de eyección, FE, inferior al 40%). En la tabla 4 se describe la prevalencia de ésta en los diferentes patrones electrocardiográficos47. En general, el pronóstico viene determinado por el grado de disfunción ventricular48.
Frecuencia de disfunción ventricular izquierda moderada o grave (FE < 40%), de acuerdo con el tipo de alteración electrocardiográfica
| Electrocardiograma | FE ecocardiográfica < 40% (% pacientes) |
| BRD aislado | 12% |
| BRD + HBAI | 36% |
| HBAI aislado | 35% |
| Alteración primaria de la RV | 43% |
| Extrasístoles ventriculares | 52% |
| BRI | 61% |
| Zona eléctricamente inactiva | 71% |
BRD: bloqueo rama derecha; BRI: bloqueo rama izquierda;
HBAI: hemibloqueo anterior izquierdo; RV: repolarización ventricular.
La frecuencia con que debe repetirse el ecocardiograma dependerá de la situación clínica del paciente. A pesar de que no existen estudios al respecto, la progresión de la enfermedad en los pacientes asintomáticos con ecocardiografía normal es lenta, por lo que, en este grupo, basta con repetirla dentro de los cinco años siguientes, siempre que no aparezcan síntomas. Cuando el estudio inicial muestra alteraciones se debe repetir, en un período de 1-3 años, debido al mayor riesgo de progresión49, especialmente si hay disfunción ventricular significativa (FE < 40). En cualquier paciente, la aparición de nuevos síntomas o alteraciones electrocardiográficas debe considerarse como indicación de un nuevo estudio ecocardiográfico.
El objetivo del seguimiento ecocardiográfico es identificar a los pacientes con disfunción moderada o grave, muchas veces todavía asintomáticos, pero que podrían beneficiarse precozmente de fármacos para el manejo de la cardiopatía50.
Paciente sintomáticoEl paciente con cardiopatía chagásica sintomática (tabla 1) debe considerarse como un paciente con un elevado riesgo de muerte súbita. Síntomas tan inespecíficos como la debilidad o la sensación de inestabilidad tienen, en este contexto, mucha importancia debido a que pueden ser premonitorios de un episodio de síncope. Es importante recordar que la muerte súbita puede ser, con frecuencia, la primera manifestación de la cardiopatía chagásica51,52. En la tabla 5 se resumen las principales indicaciones de las pruebas diagnósticas para el estudio de la cardiopatía chagásica.
Resumen de las principales indicaciones de las pruebas diagnósticas en la cardiopatía chagásica
| Electrocardiograma | En todo paciente con evidencia de infección por T. cruzi |
| Ecocardiografía | En todo paciente con evidencia de infección por T. cruzi |
| Holter 24 horas | Síntomas de bajo gasto (síncope, presíncope, palpitaciones, etc.) y/o alteraciones electrocardiográficas compatibles con taquiarritmia o bradiarritmia |
| Estudio electrofisiológico | Síncope no aclarado, taquicardia ventricular (TV) con disfunción ventricular o sintomática |
| Prueba de esfuerzo | Valoración de la respuesta funcional y/o de la capacidad cronotrópica |
| Cateterismo cardíaco | Dolor torácico de características anginosas |
En general, el manejo de estos pacientes tiene muchos puntos en común con el de otras cardiopatías. También hay que tener en cuenta que en muchas ocasiones se aplican a la cardiopatía chagásica estrategias generales no validadas específicamente para esta enfermedad. Los bloqueadores beta (con las precauciones que se mencionan en el párrafo siguiente) y los inhibidores de la enzima de conversión de la angiotensina (IECA) son los fármacos recomendados en los pacientes con disfunción ventricular moderada o grave (FE < 40%). A pesar de no haber evidencias científicas de su beneficio, la amiodarona se utiliza en estos pacientes debido a la presencia de arritmias complejas53.
Existen peculiaridades de la cardiopatía chagásica que son importantes de recordar a la hora de plantear el manejo terapéutico de los pacientes:
- –
La cardiopatía chagásica crónica presenta una elevada frecuencia de bradiarritmias (bloqueos auriculoventriculares, disfunción sinusal…). Por este motivo, fármacos como los digitálicos, los bloqueadores beta, algunos antagonistas de los canales de calcio y la amiodarona deben utilizarse con precaución, iniciando el tratamiento con dosis bajas y vigilando estrechamente la aparición de complicaciones.
- –
Los pacientes con insuficiencia cardíaca refractaria pueden valorarse como candidatos a trasplante cardíaco. A pesar de que se ha descrito algún caso de reactivación de la enfermedad de Chagas, las series publicadas muestran resultados satisfactorios y una mayor supervivencia en estos pacientes comparados con los pacientes con cardiopatía isquémica o miocardiopatía dilatada idiopática54.
- –
No existe indicación para la cardiomioplastia o la cirugía reconstructiva en esta patología.
- –
La utilidad de la terapia de resincronización en estos pacientes está aún en discusión y se debería utilizar criterios ecocardiográficos y electrocardiográficos para valorar su indicación.
- –
Existen experiencias preliminares, aún no publicadas, con células madre para mejorar la función miocárdica de pacientes con enfermedad de Chagas.
Se debe tener en cuenta la elevada frecuencia de fenómenos trombóticos y embólicos en los pacientes con enfermedad de Chagas. La mayoría de los eventos son accidentes isquémicos cerebrales, y muchos pacientes presentan causas cardiológicas que justifican el fenómeno, aunque hay otros factores implicados55,56.
En un estudio realizado en Brasil se identificaron cuatro predictores AVC embólico en pacientes con cardiopatía chagásica subyacente: edad > 48 años, alteración primaria de la repolarización ventricular, aneurisma apical y FEVI < 50%57. La presencia de estos cuatro predictores implicaba una incidencia anual de AVC de 4%. De todas formas y en ausencia de evidencias más definitivas, la prevención del tromboembolismo en el paciente con CCC mediante anticoagulantes debe guiarse con las recomendaciones clínicas habituales: pacientes con fibrilación auricular, episodios embólicos previos y/o existencia de trombos murales. No se ha definido aún el papel de los antiplaquetarios en la prevención de los accidentes tromboembólicos.
Manejo de las bradiarritmiasLas bradiarritmias sintomáticas son, en ocasiones, candidatas a la implantación de marcapasos. Las guías internacionales para la implantación de marcapasos son útiles en los pacientes con cardiopatía chagásica.
Manejo de las arritmias ventricularesLos pacientes con cardiopatía chagásica presentan frecuentemente extrasístoles y taquicardias ventriculares, la mayoría de veces en relación con daño miocárdico localizado que origina fenómenos de reentrada. La mayoría de las taquiarritmias ventriculares sostenidas en los pacientes con cardiopatía chagásica no se originan en el aneurisma apical del ventrículo izquierdo, sino en la porción inferolateral58,59.
Por tratarse de una afección progresiva con múltiples focos arritmogénicos, la ablación por radiofrecuencia no debe considerarse una técnica de primera elección.
Por el contrario, y a pesar de no existir estudios específicos en la cardiopatia chagásica crónica, se recomienda la implantación de un desfibrilador automático implantable (DAI) para reducir la posibilidad de muerte súbita en las siguientes situaciones:
- –
Taquicardia ventricular sostenida (TVS). Además, en estos pacientes y de forma empírica se aconseja administrar amiodarona con el objetivo de disminuir la frecuencia de descargas y reducir la posibilidad de una tormenta eléctrica. Si a pesar de estas medidas el paciente recibe demasiadas descargas, se debe valorar la ablación por radiofrecuencia60,61.
- –
TVS monomórfica inducida durante el estudio electrofisiológico.
En pacientes con taquicardia ventricular no sostenida (TVNS) y estudio electrofisiológico normal (no inducibles), existe la posibilidad de administrar amiodarona.
Manejo del dolor anginoideOcasionalmente el dolor torácico constituye una manifestación clínica de la cardiopatía chagásica, e incluso de la esofagopatía chagásica. Fisiopatológicamente se postula la alteración de la microvasculatura miocárdica como causa de este síntoma.
En el caso de que el dolor torácico sea el síntoma inicial o predominante de la cardiopatía chagásica, se debe realizar el diagnóstico diferencial con una cardiopatía isquémica asociada mediante un cateterismo cardíaco. Las técnicas de perfusión miocárdica con isótopos radiactivos se pueden utilizar, aunque su valor para el diagnóstico diferencial del dolor anginoide está limitado por la presencia de áreas de fibrosis miocárdica en los pacientes con cardiopatía chagásica. No existe tratamiento específico para estos casos.
Tratamiento etiológico en el Chagas crónicoClásicamente se sabe que en la fase crónica de la enfermedad la tasa de curación en personas adultas oscila entre el 8 y el 25%62. La disminución de los títulos de anticuerpos séricos se utiliza como marcador de curación, pero la lentitud de los cambios serológicos, las posibles reinfecciones en las áreas endémicas y la falta de marcadores clínicos han dificultado el conocimiento real de la eficacia del tratamiento. Por ello y los potenciales efectos adversos de la medicación, no hay un consenso internacional para el tratamiento etiológico en esta fase de la enfermedad. Sin embargo, un estudio reciente demuestra una reducción de la progresión de la enfermedad de Chagas en pacientes tratados con benznidazol63. Siguiendo el documento de consenso del año 200526, los pacientes con pruebas parasitológicas positivas sí deben recibir tratamiento etiológico y debe considerarse para el resto, estableciendo un acuerdo entre médico y paciente, informando adecuadamente de los potenciales efectos adversos del fármaco.
Consideraciones adicionalesLa enfermedad de Chagas debe sospecharse en todo paciente con antecedente epidemiológico compatible y sintomatología de afectación cardíaca. Las características diferenciales de la cardiopatía chagásica, el escaso conocimiento que se tiene de ella en nuestro medio y la elevada frecuencia de arritmias y muerte súbita como primeras manifestaciones potenciales de esta enfermedad hacen prioritarias la elaboración y divulgación de protocolos diagnósticos y terapéuticos para la atención de estos pacientes a fin de mejorar el conocimiento de esta patología por los profesionales sanitarios implicados en su detección y manejo.
En algunos contextos puede que no se disponga de las técnicas necesarias para el correcto diagnóstico y tratamiento de los pacientes con sospecha de enfermedad de Chagas o de cardiopatía chagásica. Si un paciente con antecedentes epidemiológicos compatibles presenta signos y síntomas de patología cardíaca, se recomienda su derivación a un especialista en cardiología y a un centro especializado en enfermedades importadas. En cualquiera de los dos casos, la derivación del paciente no debe excluir que el médico de atención primaria, que es quien valorará inicialmente al paciente, realice una buena anamnesis y exploración clínica, así como un electrocardiograma convencional y una radiografía de tórax antes de derivar al paciente.
Como es obvio, el manejo de la CCC es y ha sido motivo de discusión científica en los países endémicos. Referimos por su interés los consensos de la Sociedad Argentina de Cardiología y la del Brasil, que pueden ser consultadas en internet64,65.
De acuerdo con los autores y los editores, este artículo se publicó de forma íntegra en Rev Esp Cardiol. 2007;60(3):285-93.
El Taller sobre la enfermedad de Chagas importada tuvo lugar los días 6 y 7 de marzo de 2006 y fue financiado por la Agència de Gestió d’Ajuts Universitaris i de Recerca (AGAUR; 2005/ARCS2/00040) de la Generalitat de Catalunya; por el Ministerio de Educación y Ciencia MEC (SAF-2005-24601-E); por la Red de Medicina Tropical del FIS (RICET). Diversos miembros que han participado en la elaboración del documento de consenso participan en la RICET y la RIVEMTI (Red Catalana de Vigilancia Epidemiológica de Enfermedades Tropicales e Importadas).