Introducción
Durante el año 2006 se han cumplido los 25 años de la primera descripción de lo que posteriormente constituiría el llamado síndrome de inmunodeficiencia adquirida o sida. Pocos meses después se descubría el virus de la inmunodeficiencia humana (VIH) y se abría la puerta para el diagnóstico microbiológico. Durante este tiempo, los laboratorios de microbiología han tenido que hacer un gran esfuerzo para adaptarse a las demandas clínicas que estos enfermos requieren. Así, durante los últimos años se han generalizado la determinación de la carga vírica plasmática y la detección y el análisis de las mutaciones que confieren resistencias a los fármacos antirretrovirales. El presente procedimiento constituye la tercera edición del Diagnóstico microbiológico de la infección por VIH y en él se ha intentado reflejar y actualizar las principales tareas y cometidos que un laboratorio de microbiología debería tener para realizar la atención íntegra al paciente infectado por VIH. Su objetivo ha sido orientar de forma conceptual y aplicada la metodología empleada en el diagnóstico y seguimiento de la infección por VIH. A efectos prácticos se ha dividido en tres apartados claramente diferenciados: el diagnóstico serológico, la determinación de la carga vírica plasmática y el análisis de las posibles resistencias a los distintos retrovirales.
Diagnóstico serológico
La detección de anticuerpos VIH responde básicamente a cuatro apartados: seguridad biológica (cribado de donantes de sangre, órganos, semen, óvulos, etc.), diagnóstico de la infección por VIH, vigilancia epidemiológica e investigación. El diferente objetivo que se persigue con cada uno de estos apartados influye en la elección de la técnica apropiada, en la actitud del profesional de laboratorio ante un resultado y en la estrategia o algoritmo de confirmación. De forma conceptual se denominan pruebas diagnósticas las que se emplean de forma individualizada en el suero de una persona bajo los principios clínicos de consentimiento informado y sirven para la identificación clínica de un paciente como infectado o no por el VIH. Cuando las pruebas se aplican en virtud de criterios de seguridad biológica, vigilancia epidemiológica o investigación y el objetivo principal no es el diagnóstico clínico de infección VIH, las denominamos pruebas de detección de anticuerpos VIH en sentido estricto. En estos casos, se pueden emplear con éxito muestras alternativas al suero. Esta distinción, aparentemente semántica, condiciona la utilización de las pruebas de detección de anticuerpos VIH de forma coordinada y secuencial.
Condiciones del laboratorio y precauciones con las muestras
Los laboratorios que realicen diagnóstico de anticuerpos VIH en suero deben observar las normas de seguridad de nivel 2. Los sueros se deben recoger de la forma habitual y evitar mantenerlos más de 24 h a temperatura ambiente. Para minimizar las contaminaciones microbianas se recomienda usar tubos estériles y no conservarlos a más de 4 °C más allá de 72 h. Para períodos de conservación más prolongados, utilizar temperaturas de 20° y 70 °C, sobre todo si se prevé la necesidad de detectar antígeno (Ag) p24 u otros componentes estructurales del VIH, ya que estos últimos se desnaturalizan paulatinamente a temperaturas superiores a 70 °C, por lo que los sueros no debieran ser inactivados por calor. Dadas las connotaciones clínicas y sociales que puede tener el diagnóstico de infección por VIH, hay que señalar la importancia de una correcta y cuidadosa identificación de los pacientes y su correspondiente suero cuando el objetivo sea el diagnóstico VIH.
Pruebas de cribado
Las pruebas de detección habituales de anticuerpos VIH han experimentado un considerable desarrollo y mejoras desde su aparición. Básicamente, las mejoras han afectado, en especial, al antígeno o los antígenos utilizados en el ensayo y al principio técnico en el que se fundamentan dichas reacciones. Mientras que en los enzimoinmunoanálisis (EIA) de primera generación se utilizaban lisados virales de VIH-1, en la actualidad (EIA/ELFA [enzyme-linked fluorescent assay] de cuarta generación) se utilizan péptidos recombinantes/sintéticos de VIH-1 y VIH-2 y VIH-1 "O" y Ac (anticuerpos) para detectar el antígeno p241. La evolución de estos antígenos ha permitido, por una parte, incrementar la sensibilidad sin merma de la especificidad y, por otra, ha hecho posible la detección de anticuerpos frente a tipos y subtipos del VIH que escapaban a los equipos de diagnóstico habituales. A pesar de las mejoras introducidas en los equipos actuales, debe tenerse en cuenta la posibilidad real de encontrar sueros de infectados por subtipos inusuales del VIH, sobre todo en pacientes de África o en personas con estancias prolongadas en este continente.
Respecto al principio técnico que emplean, cabe mencionar que la gran mayoría están basados en el EIA: indirecto, en sandwich y de captura. Existen EIA competitivos que tienen una gran especificidad aunque adolecen de cierta falta de sensibilidad en algunos momentos de la infección por el VIH, como al inicio de la seroconversión y en los pacientes en estadios terminales. Sin embargo, combinadas con otras pruebas de mayor sensibilidad en forma secuencial, pueden proporcionar excelentes resultados en la estrategia diagnóstica. Estos tipos de pruebas han sufrido también variaciones tecnológicas, como la utilización de sustratos fluorescentes, que han dado lugar a las pruebas denominadas ELFA. La última aportación a las pruebas inmunoenzimáticas ha sido la detección simultánea del antígeno p24 y anticuerpos VIH, lo que acorta el período ventana.
Entre las pruebas de cribado de anticuerpos VIH, las denominadas pruebas rápidas han experimentado un desarrollo importante; los antígenos que emplean son similares a los EIA y ELFA y el tiempo en el que se puede obtener un resultado oscila entre 5 y 20 min. Aunque las características operacionales son inferiores a los EIA y ELFA, deben tenerse en cuenta para situaciones de urgencia. Combinadas con otras pruebas de detección de anticuerpos, constituyen una estrategia que mejora la especificidad de los resultados de forma asequible en términos de costes laborales y de tiempo. Su mayor inconveniente reside en la lectura, que siempre es subjetiva, y con algunos sueros pueden producirse reactividades que generen dudas de interpretación. Asimismo, han aparecido pruebas rápidas basadas en el principio de la inmunocromatografía capilar que han mejorado de forma importante la sensibilidad y la especificidad respecto a las previas.
Pruebas de confirmación
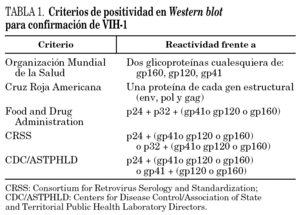
La trascendencia de la infección por el VIH hace necesaria la confirmación de los resultados positivos obtenidos en las pruebas de detección primaria de anticuerpos; este paso es inexcusable cuando el objetivo de las pruebas sea el diagnóstico, y puede ser obviado cuando aquéllas se realicen para seguridad biológica. Existen diferentes pruebas de confirmación; entre ellas cabe citar las basadas en los principios de inmunoelectrotransferencia o Western blot (WB), de inmunofluorescencia indirecta (IFI), de radioinmunoprecipitación (RIPA) y de inmunoblot con antígenos recombinantes (LIA). Las técnicas de IFI y RIPA, por razones distintas (subjetividad de la lectura, requerimientos de laboratorio, etc.), se emplean cada vez menos, de tal forma que los resultados de confirmación por WB son considerados el patrón para confirmar anticuerpos frente al VIH. Existen distintos criterios de positividad emitidos o recomendados por organismos o sociedades involucrados en el diagnóstico del VIH (tabla 1); de ellos, el de la Organización Mundial de la Salud (OMS) es el más específico cuando se trabaja con sueros de procedencia poblacional muy diversa2.
El WB contiene los antígenos del propio VIH, algunas de sus proteínas precursoras y antígenos de origen celular. Existen modalidades que incorporan en un extremo diferenciado de la tira un péptido sintético específico del VIH-2 (gp36), que facilita la sospecha de infección por VIH-2 en coinfecciones y en WB indeterminados para el VIH-1. Debido a que las tiras de nitrocelulosa en las que se depositan los antígenos del VIH contienen, en mayor o menor cantidad, proteínas de la célula huésped en la que se ha cultivado el virus, a menudo se observan bandas de reactividad contra dichas proteínas. De ahí la necesidad de adiestramiento en la lectura e interpretación de las bandas de origen viral. Es conveniente adoptar una disciplina metodológica en la lectura e interpretación de bandas de reactividad del WB, que deberá ser uniforme y sistematizada para cada laboratorio.
Los resultados indeterminados de la prueba WB constituyen una fuente de ansiedad en pacientes y pueden llegar a generar desconcierto en los responsables del diagnóstico. Las causas de reactividades anormales en WB son muy variadas y no están totalmente explicadas. Se han descrito resultados indeterminados en personas con factor reumatoide en el suero, lupus eritematoso, hiperbilirrubinemias, infección por otros retrovirus, parasitosis y por otras causas. En la membrana de envoltura del VIH pueden estar presentes antígenos leucocitarios humanos (HLA) que produzcan reactividades en el WB hasta en el 30% de los individuos multitransfundidos, y con ello den lugar a falsas reactividades.
Problemas en el cribado y confirmación
Los problemas que se presentan en el cribado y confirmación de anticuerpos del VIH son similares a los de otras pruebas de diagnóstico serológico, aunque en este caso adquieren una importancia mayor por las posibles consecuencias y la trascendencia clínica de la infección3.
Desde el punto de vista serológico, en la infección por el VIH ocurren cambios en la dinámica de producción de anticuerpos desde el momento de la seroconversión. El período ventana de dos a cuatro semanas de duración se caracteriza por la ausencia de anticuerpos y la presencia de Ag p24, proteína mayoritaria del core del VIH, y ARN viral. En estadios finales de la infección pueden desaparecer los anticuerpos contra algunas de las proteínas estructurales internas del virus (p24, p17, p55, etc.), y en algunos individuos se ha comunicado la ausencia de criterios diagnósticos de positividad por WB en los meses finales de la enfermedad, como consecuencia del intenso deterioro inmunitario4. La posibilidad de falsos negativos puede ocasionar cierta alarma cuando el objetivo perseguido en la determinación de anticuerpos VIH es la seguridad biológica (bancos de sangre, hemoderivados, donaciones)5. Por ello, la adopción de técnicas de EIA/ELFA de cuarta generación se utiliza para minimizar al máximo el período ventana. Por otra parte, se debe descartar el diagnóstico de infección por el VIH mediante otras pruebas complementarias, cuando la anamnesis revele prácticas de riesgo o síntomas o signos clínicos sugestivos de infección causada por el VIH.
En el laboratorio de virología tienden a preocupar más los resultados falsos positivos, tanto en las pruebas de cribado como en las de confirmación, sobre todo cuando éstos se producen en personas sin ninguna práctica de riesgo. La evolución de las técnicas y los antígenos usados ha reducido la aparición de falsos positivos, que en las primeras pruebas podía llegar en algunas situaciones particulares hasta el 5% y que en la actualidad es inferior al 1%. Las posibles causas de falsos positivos son muy variadas y se salen del objetivo de este documento; pero dependen básicamente de dos elementos: la técnica utilizada y las condiciones derivadas del paciente. Entre las causas debidas a condiciones del paciente se apunta repetidamente en la literatura médica a las reactividades por autoanticuerpos; a este respecto cabe señalar la presencia en la envoltura del VIH de antígenos del sistema HLA procedentes de la célula huésped, que explican, en parte, las falsas reactividades observadas en sueros de individuos trasplantados, multitransfundidos y otros con enfermedades autoinmunes.
En el momento actual pueden producirse situaciones clínicas que den lugar a la necesidad de seguimiento serológico del paciente al menos durante dos o tres semanas y a la utilización de otros marcadores serológicos de infección del VIH (Ag p24 o detección de ARN viral). A pesar de la sensibilidad de estas pruebas, el diagnóstico definitivo deberá confirmarse con el suero cuando tenga lugar la seroconversión. Es muy recomendable la adopción de pruebas EIA/ELFA para detección simultánea de anticuerpos y Ag p24 del VIH cuando se trabaje en situaciones clínicas que prevean un alto riesgo de detectar seroconversiones (clínicas de desintoxicación, centros de metadona, etc.) o en aquellos casos en los que exista riesgo de donar un órgano de un paciente en el período de seroconversión.
Finalmente, cuando el objetivo de las pruebas sea el diagnóstico, se debe tener en cuenta que los pacientes, y en ocasiones los propios clínicos, rara vez entienden expresiones tales como "falso positivo", "indeterminado", "positivo dudoso", etc. En consecuencia, es preciso tener el máximo cuidado al emitir los informes del laboratorio, estableciendo informes claros y concluyentes, o bien formulando recomendaciones precisas para el seguimiento y el diagnóstico definitivo del paciente.
Determinación de la viremia plasmática de VIH
La determinación de la carga viral plasmática (CVP) del VIH constituye una de las técnicas que más se han desarrollado en los últimos años6. Su utilización más frecuente es como monitorización del tratamiento antirretroviral (TAR). De esta forma, una vez instaurado el TAR, la CVP disminuye con rapidez en las primeras semanas y algo más lentamente a partir del primer mes de tratamiento. En general, se recomienda una determinación basal y, al menos, una evaluación en las semanas 4, 12 y 24 de tratamiento, para seguir con posterioridad el seguimiento cada 3-4 meses. Debería esperarse una reducción de 1 log10 en la primera semana, 2 log10 en la semana 4 y debería ser indetectable entre las semanas 16-24 tras el inicio del tratamiento. Los cambios mayores de 0,3 log10 entre dos determinaciones se consideran significativos. Aunque el nivel de CD4 es el parámetro fundamental para decidir el inicio del TAR, en algunas situaciones la CVP puede considerarse en la toma de decisión; por ejemplo, en pacientes con CD4 entre 200 y 350/μl se recomienda en general iniciar el TAR, aunque en aquellos con cifras más cercanas a 350 y CVP bajas (< 20.000 copias/ml) podría diferirse su iniciación. Por el contrario, algunos expertos recomiendan el inicio del TAR por encima de 350 CD4/μl si la CVP es > 100.000 copias/ml. Otras posibles utilidades de la CVP serían en la valoración del riesgo de transmisión, puesto que se ha demostrado que cuanto mayor es la CVP mayor es el riesgo de transmisión, o como método diagnóstico de infección por el VIH durante el período ventana en la primoinfección, cuando todavía los anticuerpos específicos anti-VIH pueden no ser detectables7.
En la actualidad hay varias técnicas disponibles comercialmente en España que permiten la detección de hasta un nivel de 50 copias de ARN de VIH por mililitro de plasma. Las diferencias técnicas fundamentales radican en los formatos, tiempos y capacidad de procesamiento. Las nuevas técnicas de transcripción reversa-reacción en cadena de la polimerasa (RT-PCR) en tiempo real basadas en sondas fluorescentes son, en general, más rápidas y permiten rangos dinámicos más amplios (40-107 copias/ml). Todas las técnicas detectan y cuantifican el subtipo B, que es el más prevalente en nuestro medio, así como los subtipos circulantes más frecuentes (A, C, D, F, G). El procedimiento comercializado por Abbott es el que tiene el rango más amplio de detección de subtipos y es el único que cuantifica el grupo O. Ninguna de las técnicas licenciadas detecta el VIH-2.
Obtención y tratamiento de las muestras
Sangre
La muestra necesaria para la determinación de CVP es un tubo de sangre anticoagulada con ácido etilendinitrilotetraacetático (EDTA) o citrato (ACD) de 5-10 ml. No son aceptables los tubos con heparina, pues ésta interfiere con algunas técnicas moleculares, ni el suero, porque los resultados son menos consistentes. Los tubos con EDTA son los más ampliamente recomendados y, aunque ACD es también aceptable, presenta el inconveniente de contener un mayor volumen de sustancia en el tubo, de tal forma que puede ser un factor de dilución en tubos sólo parcialmente llenos. El plasma se separa por centrifugación a 1.000-1.500 g (2.000-2.500 rpm en las centrífugas más habituales) durante 10 min a temperatura ambiente. Es importante considerar la estabilidad de la sangre total y el plasma separado para las determinaciones de CVP de VIH. En la tabla 2 se muestra la estabilidad del VIH-1 para la determinación de la CVP según su forma de almacenamiento.
Líquido cefalorraquídeo, semen y otros fluidos
Aunque la determinación de la CVP de VIH en estos especímenes no esta estandarizada, en ocasiones es necesaria su realización en el contexto de estudios de investigación o por petición expresa y específica del clínico responsable8. El líquido cefalorraquídeo (LCR) se puede procesar por la mayoría de los procedimientos de manera similar al plasma, y conviene centrifugarlo en las mismas condiciones que la sangre total para separar células inflamatorias y hematíes. Respecto al semen y otros fluidos, es posible adaptar las técnicas para la determinación de CVP tanto en el propio semen como en muestras cervicovaginales e incluso tejidos.
Interpretación de los resultados
En virología es tradicional utilizar escalas logarítmicas para expresar información cuantitativa, tal como concentraciones de virus o potencia infectiva de inóculos. La mayoría de las técnicas de CVP expresan los datos en escala lineal y logarítmica. La variabilidad de dichas técnicas es menor de 0,3 log10, y por lo tanto, cualquier resultado con una diferencia mayor se considera significativo9. La mayoría de los pacientes infectados que no reciben tratamiento tienen una CPV detectable en rango muy amplio que puede llegar a más de 10 millones de copias/ml. Por el contrario, los pacientes en TAR y después de las primeras 16-24 semanas, se espera que tengan una CVP < 50 copias/ml. Si la CVP es detectable durante el seguimiento obliga a considerar falta de adherencia al tratamiento o desarrollo de mutaciones de resistencias a los fármacos antirretrovirales. Además de la progresión natural de la infección, la CVP puede aumentar rápidamente en situaciones en las que se produce un estímulo inmunológico que incrementa la producción de partículas víricas por los linfocitos infectados. Estos episodios se han descrito en infecciones activas (tales como tuberculosis, neumonía por Pneumocystis jirovecii, etc.) y tras la administración de vacunas.
Hasta un 10-15% de pacientes con TAR que mantienen CVP indetectable por períodos prolongados de tiempo pueden presentar ocasionalmente viremia detectable de bajo nivel10. Estos episodios, conocidos como blips, aparecen en determinaciones aisladas y parecen limitarse sin cambios en el tratamiento. Los blips no parecen relacionados con falta de cumplimiento ni peor pronóstico a largo plazo. La opinión más aceptada es que se trata de pequeñas fluctuaciones de la viremia e incluso de errores en el procesamiento de las muestras que resultan en CVP de bajo nivel. Esta consideración está apoyada por el hecho de que muchos de estos blips no son reproducibles en laboratorios diferentes. Para que un incremento no esperado de la CVP pueda ser considerado como blip debería ser inferior a 500-1.000 copias/ml y en la siguiente determinación debería producirse de nuevo la indetectabilidad.
Un porcentaje pequeño (5-7%) de pacientes infectados, después del pico de viremia intensa correspondiente a la infección aguda, puede mantener la replicación del virus controlada durante períodos prolongados en ausencia de tratamiento antirretroviral. En estos casos, la CVP puede ser indetectable durante meses. Esta situación, aunque poco frecuente, es normal y suele ocurrir en pacientes con diagnóstico de certeza de infección, que se encuentren asintomáticos y con cifras de linfocitos CD4 normales. No obstante, una CVP indetectable en un paciente con infección por el VIH diagnosticada por ELISA, que está sintomático o tiene las cifras de linfocitos CD4 disminuidas sin recibir TAR, nos debe hacer sospechar una variante no detectada, generalmente VIH-1 grupo O o VIH-2.
Pruebas para la detección de resistencias
Sin lugar a dudas, las pruebas de detección de resistencias a los fármacos retrovirales son de las que más se han desarrollado en los últimos años en los laboratorios de microbiología11. Las pruebas para la detección de resistencias a antirretrovirales pueden clasificarse en dos tipos: genotípicas y fenotípicas. Las resistencias genotípicas determinan las mutaciones en la secuencia primaria de nucleótidos de la transcriptasa inversa (TI) y de la proteasa (PR) y, recientemente, de la envoltura, comparándola con la secuencia de una cepa patrón o cepa salvaje. La resistencia fenotípica se expresa en términos de concentración de droga necesaria para inhibir la replicación vírica en cultivo celular. Por lo general, se expresa en términos de CI50, que indica la concentración de fármaco requerida para reducir al 50% la producción viral in vitro. La interpretación de estos valores es diferente en función del fármaco implicado. En la tabla 3 se recogen los inconvenientes y ventajas principales de los métodos genotípicos y fenotípicos.
Técnicas genotípicas
El estudio genotípico de las mutaciones de resistencia puede hacerse de varias formas12. El más extendido de ellos consiste en la amplificación mediante PCR del fragmento del genoma viral que se quiere estudiar (normalmente el gen de la transcriptasa inversa o de la proteasa), para, a continuación, secuenciar y analizar la posible presencia de mutaciones asociadas con resistencia a los distintos antirretrovirales. En la actualidad hay varios kits comerciales que facilitan su realización. De ellos, los más utilizados son TRUGENE® HIV-1 Genotyping Test (Siemens) y ViroSeq® HIV genotyping system (Abbott Diagnostics). El primero utiliza la secuenciación bidireccional y la electroforesis en gel, mientras que el segundo emplea el método unidireccional y la electroforesis capilar. Ambos sistemas ofrecen un software para la edición de las secuencias y un algoritmo propio de interpretación.
Como consecuencia de que sólo una parte minoritaria de los codones que se amplifican por PCR son posiciones de resistencia y que la gran mayoría son polimorfismos, se han diseñado una serie de alternativas a la secuenciación en las que se buscan mutaciones específicas. Dentro de estas técnicas las que más se han empleado son: VERSANT® HIV-1 RT Resistance Assay y VERSANT® HIV-1 Protease Resistance Assay (LIPA), que se basan en la hibridación de productos amplificados mediante PCR con sondas específicas distribuidas a lo largo de una tira de nitrocelulosa.
Interpretación del genotipo
Debido a que es difícil tener un profundo conocimiento de la significación clínica de todas las mutaciones, los ensayos genotípicos se suelen acompañar de una interpretación de las mutaciones encontradas: para ellos, existen varios sistemas de interpretación clínica de las mutaciones obtenidas. Dos de los más utilizados están disponibles en Internet; son la página de la Sociedad Internacional de Sida (http://www.iasusa.org/) y la base de datos para secuencias de proteasa y transcriptasa inversa de la Universidad de Stanford (http://hivdb.stanford.edu/). Todos son fácilmente accesibles y presentan sistemas de interpretación sencillos para todos los fármacos disponibles. Sin embargo, en ninguno de los documentos de consenso o paneles de expertos se emiten normas sobre cuál debe ser la forma de interpretar los resultados de las pruebas genotípicas, y en ocasiones existen serias discrepancias entre ellos, en especial en el caso de algunos análogos de nucleósidos como estavudina, abacavir, tenofovir y didanosina13. Hay que destacar que es importante interpretar el resultado de las pruebas de resistencia teniendo en cuenta la historia previa de tratamiento antirretroviral y, en su caso, estudios previos de resistencias que se hayan realizado al mismo paciente.
Técnicas fenotípicas
Los estudios fenotípicos tienen la ventaja de evaluar con mayor fidelidad la sensibilidad del virus frente a cada fármaco, y según este grado de sensibilidad se podría valorar en un futuro la posibilidad de sobrepasar la resistencia aumentando las concentraciones plasmáticas del fármaco. Sin embargo, los estudios fenotípicos deben considerarse por el momento poco viables, principalmente por la complejidad, laboriosidad de la técnica y el tiempo necesario para la emisión de resultados. La sensibilidad fenotípica puede realizarse de dos maneras:
Método de sensibilidad del virus en células mononucleares de sangre periférica
En este caso, el análisis se realiza a partir del aislamiento del virus del paciente procedente de células mononucleares de sangre periférica (CMSP). Para ello se estimulan las CMSP del paciente con fitohemaglutinina (PHA) y se cocultivan con CMSP de donantes no infectados también estimuladas con PHA y en presencia de dosis crecientes del antirretroviral en estudio. Semanalmente se renuevan las CMSP de los donantes y en un tiempo aproximado de cuatro semanas se evalúa la producción de nuevos virus.
Técnicas con virus recombinantes
Esta técnica consiste en la amplificación mediante PCR de la transcriptasa inversa y la proteasa directamente de muestras de plasma del enfermo. A continuación, se transfectan en células huésped conjuntamente con un plásmido linearizado que codifica para una cepa del VIH de laboratorio en la que se ha eliminado esta secuencia. En la célula huésped tiene lugar un proceso de recombinación homóloga cuyo resultado es un VIH recombinante que porta las secuencias de pol del paciente y que, además, se puede cultivar con facilidad en el laboratorio. Esta técnica, que se caracteriza por una mayor rapidez y reproducibilidad en los resultados que el cultivo de CMSP, ha sido comercializada en la actualidad por tres casas diferentes.
En el método Antivirogram® (Virco) los virus recombinantes se preparan mediante transfección de células MT-4 con el producto amplificado de la proteasa y la trancriptasa inversa y con un plásmido que contiene el genoma completo del VIH salvo la región gag-pro-RT. La CI50 del virus recombinante se determina en cultivos, midiendo la viabilidad de células MT4 infectadas con el virus recombinante en presencia de diluciones de cada antirretroviral. El método Phenosense® (ViroLogic) es un ensayo de un solo ciclo de replicación viral, lo cual reduce el tiempo para los resultados. Utiliza un proceso de ligación, más que de recombinación homóloga, para introducir el fragmento amplificado mediante RT-PCR en el genoma de una partícula de VIH en la que el gen env ha sido sustituido por un gen productor de luciferasa. En un ciclo de replicación, este virus es capaz de producir todas las proteínas de VIH a excepción de las de envoltura y, en su lugar, se expresa el gen de la luciferasa. La CI50 del virus recombinante se determina cuantificando la expresión del gen de la luciferasa en cultivos de célula infectadas con el virus recombinante en presencia de antirretrovirales. Finalmente, el método Phenoscript® (Viralliance) combina aspectos de los dos anteriores: un proceso de recombinación homóloga con un solo ciclo de replicación viral. Las células diana (P4) contienen el gen de la β-galactosidasa, de manera que en el momento en que se acumulan suficientes productos del gen TAT en la célula infectada, se expresa el gen de la β-galactosidasa y su producto se puede medir por medio de colorimetría o fluorimetría.
Interpretación del fenotipo
Las técnicas fenotípicas se basan en la capacidad de los virus aislados del paciente de infectar células frescas en presencia de varias diluciones del antirretroviral que ensayar. De esta forma se puede calcular la cantidad de fármaco necesaria para que el crecimiento de virus se inhiba en un 50% o en un 90% (CI50 y CI90, respectivamente). El mismo procedimiento realizado en cepas sin mutaciones de resistencia (cepas de referencia o cepas salvajes) permitirá conocer el número de veces que la CI50 de la cepa en estudio está aumentada con respecto a la de referencia, para así poder estimar la sensibilidad o resistencia a ese fármaco. De esta manera, se pueden definir puntos de corte (cutoff), que serán distintos para cada antirretroviral. Existen distintos puntos de corte: técnico, biológico y clínico.
El punto de corte técnico se establece en función de la reproducibilidad del ensayo: sólo informa de si la CI50 de la cepa en estudio difiere significativamente de la cepa patrón; por lo tanto, no proporciona información sobre la relación existente, con la posibilidad o no de una respuesta clínica al antirretroviral en estudio. El punto de corte biológico se basa en la media de la CI50 de cepas aisladas de pacientes noveles, y para cada antirretroviral, este punto de corte se establece en dos desviaciones estándar por encima de la media de CI50 de dichas cepas. Este cutoff, aun siendo una buena medida de la sensibilidad a los antivirales, tampoco proporciona ninguna medida acerca de si un tratamiento será efectivo o no. Para esto último se define el punto de corte clínico, que establece una correlación entre la CI50 a un antirretroviral con la respuesta clínica medida en términos de descenso de la carga viral en un determinado período de tiempo.
Predicción del fenotipo a partir del genotipo: fenotipo virtual
El fenotipo virtual es, quizá, la principal herramienta clínica en este campo. Ha sido diseñado por Virco y desarrollado a partir de la información procedente de alrededor de 100.000 genotipos con sus fenotipos correspondientes. De esta manera, cuando se obtiene el genotipo de la muestra de un paciente, éste es analizado por el software del propio sistema, que identifica todas las mutaciones de resistencia y busca en la base de datos genotipos de muestras previas que presentan el mismo patrón de mutaciones. Posteriormente, el software recupera los fenotipos de esas muestras y produce lo que se denomina fenotipo virtual, con los cambios en la CI50 para cada fármaco. Esta técnica ha sufrido diversas modificaciones/actualizaciones, la última de ella en 2005, y recibió entonces el nombre de vircoType HIV-1®. Su mayor novedad es que incorpora nuevos puntos de corte, que en esta versión son clínicos, y, además, define la resistencia a un fármaco de un modo continuo, en vez de hacer una interpretación dual.
Indicaciones de las pruebas de resistencia
Es difícil establecer unas claras indicaciones para la realización de las pruebas de resistencias. Existen guías de recomendación específicas en este sentido, tanto nacionales (GESIDA) como internacionales (DHHS), efectuadas por grupos de expertos14,15. Sin embargo, se acepta su realización en los siguientes escenarios:
1.Pacientes sin tratamiento previo:
a)Infección aguda por el VIH: ambas guías recomiendan su empleo si se decide iniciar tratamiento, con el objeto de detectar la posible transmisión de cepas resistentes. Las guías de las DHHS americanas recomiendan extender este período hasta 1-3 años después de la seroconversión.
b)Infección crónica VIH: debe considerarse su empleo en todos los pacientes que van a iniciar tratamiento, en los que no se disponga de una prueba realizada durante la infección aguda.
c)Embarazo: la guía nacional de GESIDA recomienda su realización en todas las mujeres embarazadas.
d)Profilaxis posexposición (PPE) ocupacional: la guía de GESIDA recomienda considerar su utilización en el caso fuente.
2.Paciente con tratamiento antirretroviral: recomendar en todo fracaso al TAR para determinar el papel de la resistencia en el fracaso y diseñar un nuevo régimen con el mayor número de fármacos activos.
Limitaciones de las pruebas de resistencia
En la actualidad, la mayoría de las pruebas genotípicas o fenotípicas incluyen durante su realización la extracción del ARN viral y su posterior retrotranscripción en ADN. De este ADN se amplifica la región genómica que se desea investigar mediante PCR. Los procedimientos de extracción y amplificación son cruciales para el posterior análisis del amplificado, y la calidad de los resultados dependerá directamente de la calidad de estas dos etapas del proceso. En todos los ensayos descritos hasta la fecha se amplifican el gen de la proteasa y parte de la TI del VIH, y en algunos se amplifica también un fragmento del gen gag. Las técnicas de las que disponemos aseguran el 98-100% de éxito en la amplificación en muestras con una carga viral superior a 500-1.000 copias/ml. No obstante, con las modificaciones adecuadas es posible amplificar prácticamente cualquier muestra con carga viral detectable, es decir, con más de 50 copias/ml. La mayoría de las técnicas sólo detectan una variante si ésta representa más del 20% del total de la población. Para asegurar la detección de las variantes que representan menos del 20%, también llamadas variantes minoritarias, es necesario recurrir a técnicas especiales (clonación de los productos de amplificación, PCR mediante diluciones al límite o PCR a tiempo real) que no son aplicables hoy por hoy al proceder habitual del laboratorio de secuenciación del VIH.
Correspondencia: Dr. J.C. López.
Servicio de Microbiología Clínica.
Unidad de Enfermedades Infecciosas-VIH.
Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 46. 28007 Madrid. España.
Correo electrónico: juanclopezbq@wanadoo.es
Manuscrito recibido el 2-3-2007; aceptado el 6-3-2007.