Actualizar las recomendaciones sobre el tratamiento antirretroviral (TARV) para los adultos infectados por el virus de la inmunodeficiencia humana (VIH).
MétodosUn panel de expertos del Grupo de Estudio de Sida y del Plan Nacional sobre el Sida han consensuado estas recomendaciones. Para esto, han revisado los avances en la fisiopatología del VIH, los resultados de eficacia y seguridad de ensayos clínicos, y los estudios de cohortes y de farmacocinética publicados en revistas biomédicas o presentados en congresos. Se han definido 3 niveles de evidencia según la procedencia de los datos: estudios aleatorizados (nivel A), de cohortes o de caso-control (nivel B) u opinión de expertos (nivel C). En cada una de las situaciones se ha establecido recomendar, considerar o no recomendar el TARV.
ResultadosEl TARV con combinaciones de 3 fármacos constituye el tratamiento de inicio de elección de la infección crónica por el VIH. Estas pautas deben incluir 2 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido y un inhibidor de la transcriptasa inversa no análogo de nucleósido, o bien 2 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido y un inhibidor de la proteasa potenciado con ritonavir, aunque son posibles otras combinaciones. Se recomienda iniciar el TARV en los pacientes con infección por el VIH sintomática. En los pacientes asintomáticos, el inicio del TARV se basará en los resultados de determinación de linfocitos CD4 (CD4/μl), en la carga viral plasmática (CVP) y en las comorbilidades del paciente: 1) si la cifra de linfocitos CD4 es inferior a 350células/μl, se recomienda iniciar el TARV; 2) en caso de que la cifra de linfocitos CD4 se encuentre entre 350–500células/μl, se recomienda el tratamiento en los pacientes con cirrosis hepática, hepatitis crónica por el virus C, riesgo cardiovascular elevado, nefropatía asociada al VIH, CVP superior a 100.000copias/ml, proporción de linfocitos CD4 inferior al 14% o en pacientes mayores de 55 años, y 3) si la cifra de linfocitos CD4 es superior a 500células/μl, en general se puede diferir el tratamiento, pero puede considerarse si se da cualquiera de las circunstancias citadas antes. Se recomienda iniciar el tratamiento en caso de hepatitis B con criterios de tratamiento y se puede considerar en caso de riesgo de transmisión sexual. El objetivo del TARV es lograr una CVP indetectable. La adherencia al TARV desempeña un papel fundamental en la duración de la respuesta antiviral. Las opciones terapéuticas tras los fracasos del TARV son limitadas, pero los nuevos fármacos posibilitan la consecución de una CVP indetectable en pacientes multitratados. Los estudios genotípicos son de utilidad. La toxicidad es un factor cada vez menos limitante del TARV, cuyos beneficios superan los posibles perjuicios. También se comentan los criterios del TARV en la infección aguda, el embarazo y la profilaxis postexposición, así como el protocolo terapéutico en la coinfección por el VIH y los virus de la hepatitis C y B.
ConclusionesLa cifra de linfocitos CD4, la CVP y las comorbilidades del paciente son los factores de referencia más importantes para iniciar el TARV en pacientes asintomáticos. Por otra parte, el número considerable de fármacos disponibles, los métodos más sensibles de monitorización de la CVP y la posibilidad de determinar las resistencias hacen que las estrategias terapéuticas deban ser mucho más individualizadas para conseguir en cualquier circunstancia el objetivo de una CVP indetectable.
This consensus document is an update of antiretroviral therapy recommendations for adult patients with human immunodeficiency virus infection.
MethodsTo formulate these recommendations a panel made up of members of the Grupo de Estudio de Sida (Gesida, AIDS Study Group) and the Plan Nacional sobre el Sida (PNS, Spanish AIDS Plan) reviewed the advances in the current understanding of the pathophysiology of human immunodeficiency virus (HIV) infection, the efficacy and safety of clinical trials, and cohort and pharmacokinetic studies published in biomedical journals or presented at scientific meetings. Three levels of evidence were defined according to the data source: randomized studies (level A), cohort or case-control studies (level B), and expert opinion (level C). The decision to recommend, consider or not to recommend ART was established in each situation.
ResultsCurrently, the treatment of choice for chronic HIV infection is the combination of three drugs of two different classes, including 2 nucleosides or nucleotide analogs (NRTI) plus 1 non-nucleoside (NNRTI) or 1 boosted protease inhibitor (PI/r), but other combinations are possible. Initiation of ART is recommended in patients with symptomatic HIV infection. In asymptomatic patients, initiation of ART is recommended on the basis of CD4 lymphocyte counts, plasma viral load and patient co-morbidities, as follows: 1) therapy should be started in patients with CD4 counts below 350cells/μl; 2) When CD4 counts are between 350 and 500cells/μl, therapy should be started in case of cirrhosis, chronic hepatitis C, high cardiovascular risk, HIV nephropathy, HIV viral load above 100000copies/ml, proportion of CD4 cells under 14%, and in people aged over 55; 3) Therapy should be deferred when CD4 are above 500cells/μl, but could be considered if any of previous considerations concurs. Treatment should be initiated in case of hepatitis B requiring treatment and should be considered for reduce sexual transmission. The objective of ART is to achieve an undetectable viral load. Adherence to therapy plays an essential role in maintaining antiviral response. Therapeutic options are limited after ART failures but undetectable viral loads maybe possible with the new drugs even in highly drug experienced patients. Genotype studies are useful in these situations. Drug toxicity of ART therapy is losing importance as benefits exceed adverse effects. Criteria for antiretroviral treatment in acute infection, pregnancy and post-exposure prophylaxis are mentioned as well as the management of HIV co-infection with hepatitis B or C.
ConclusionsCD4 cells counts, viral load and patient co-morbidities are the most important reference factors to consider when initiating ART in asymptomatic patients. The large number of available drugs, the increased sensitivity of tests to monitor viral load, and the ability to determine viral resistance is leading to a more individualized therapy approach in order to achieve undetectable viral load under any circumstances.
El tratamiento antirretroviral (TARV) evoluciona con tal rapidez que exige una frecuente actualización de sus recomendaciones. Desde que en 1995 el Plan Nacional sobre el Sida (PNS) y su Consejo Asesor Clínico editaran las primeras «Recomendaciones de tratamiento antirretroviral en el adulto»1, este organismo junto con el Grupo de Estudio de Sida (Gesida) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica han actualizado estas recomendaciones con periodicidad anual, y las han publicado en la revista Enfermedades Infecciosas y Microbiología Clínica o en sus respectivas páginas web. Otras instituciones y sociedades científicas elaboran y actualizan sus propias recomendaciones sobre el empleo de los fármacos antirretrovirales (FAR)2,3.
El objetivo de este documento es dar a conocer a la comunidad científica y a los profesionales que tratan a pacientes infectados por el virus de la inmunodeficiencia humana (VIH) el estado del arte del TARV en el momento de su actualización. Se incluyen algunos aspectos del tratamiento que tanto el Gesida como el PNS, en colaboración con otras sociedades científicas, han elaborado in extenso, a los que se remite al lector interesado en el tema.
MetodologíaEl panel está formado por un grupo de clínicos expertos en el tratamiento de pacientes infectados por el VIH y en el uso de los FAR. La Junta Directiva del Gesida y la Secretaría del PNS designaron a estos profesionales y ellos aceptaron voluntariamente. Los miembros se han dividido en grupos formados por un redactor y varios consultores para actualizar cada capítulo de las recomendaciones. Tres miembros del panel actúan como coordinadores y uno como redactor general.
Para la actualización de estas guías se han revisado los datos más relevantes de las publicaciones científicas o las comunicaciones a congresos. Con esta recopilación, el redactor de cada grupo actualiza su capítulo, somete sus aportaciones a los consultores que, a su vez, sugieren cambios en este. Cada capítulo se remite a los coordinadores y finalmente se ensamblan en el documento final, en el que se resaltan las novedades. Con posterioridad, el documento se discute y se consensúa en una reunión presencial de los coordinadores y redactores, finalmente, si queda algún aspecto pendiente, se concluye en la Red. Tras esto se expone durante un período de tiempo en la web de las entidades promotoras para que los profesionales a los que va dirigido y quien esté interesado pueda sugerir matices o cambios que el panel puede aceptar a posteriori.
El grado de evidencia científica aportado por un estudio de investigación es esencial si sus resultados van a matizar una recomendación de práctica clínica. La jerarquización de la evidencia está ligada a la solidez del diseño de cada estudio y es un concepto epidemiológico y bioestadístico incorporado en este tipo de documentos y a la medicina basada en la evidencia4,5.
Para la elaboración de estas recomendaciones es fundamental el análisis de ensayos clínicos controlados que demuestren de modo claro los resultados de cada intervención terapéutica, pero aprovechamos la información procedente de otro tipo de estudios como los de cohortes y los de caso-control. Por esto se han seguido los niveles de recomendación utilizados en versiones anteriores que, según la procedencia de los datos, son de nivel A: estudios aleatorizados y controlados, de nivel B: estudios de cohortes o de caso-control, y de nivel C: estudios descriptivos u opinión de expertos.
Se debe recordar que los datos sobre los TARV cambian frecuentemente, por lo que los lectores deben consultar con regularidad otras fuentes de información.
Principios generalesTras más de 20 años de estudios clínicos con FAR efectuados en todos los estadios evolutivos de la infección por el VIH y mediante la utilización de los fármacos en distintas combinaciones, pueden establecerse los siguientes principios:
- 1.
El TARV se basa en combinaciones de al menos 3 fármacos, lo que retrasa la progresión clínica (morbilidad e ingresos hospitalarios), reduce los costes y aumenta la supervivencia6,7. Se han establecido pautas eficaces con menos número de fármacos en esquemas de simplificación y rescate, algunas de las cuales no están autorizadas por las autoridades sanitarias.
- 2.
La adherencia al TARV desempeña un papel primordial en el grado y la duración de la respuesta antiviral8. Por esto es imprescindible que cada centro hospitalario tenga una estrategia para mejorar el cumplimiento del TARV mediante una estrecha colaboración entre todos los profesionales implicados.
- 3.
La situación clínica, la cifra de linfocitos CD4 y la carga viral plasmática (CVP) son los elementos básicos para establecer las decisiones terapéuticas y monitorizar la efectividad del TARV. Los linfocitos CD4 y la CVP son los parámetros imprescindibles para la toma de decisiones. Ambos son factores predictivos independientes de la progresión de la enfermedad. Además, el primero indica el riesgo de presentar episodios oportunistas (EO) y señala el momento de iniciar las profilaxis de las infecciones oportunistas. Existe una buena correlación entre las respuestas virológica, inmunológica y clínica (restauración de la inmunidad celular, retraso en la progresión y aumento de la supervivencia)9,10.
- 4.
El objetivo del tratamiento es reducir la CVP por debajo de los límites de detección (<50copias/ml) y mantenerla suprimida el mayor tiempo posible.
- 5.
La aparición de resistencias es un fenómeno inevitable cuando el VIH se expone a la presión selectiva de los fármacos y continúa su replicación. La detección de resistencias por métodos genotípicos es muy útil en el fracaso virológico. Asimismo, puede ser útil medir los niveles plasmáticos de fármacos en determinadas situaciones clínicas.
- 6.
Con las pautas actuales de TARV es posible la restauración del sistema inmunitario cuantitativa y cualitativamente, independientemente de la inmunodepresión de partida11,12. La recuperación es lenta y constante mientras el TARV sea efectivo y es más difícil a partir de un determinado grado de deterioro y en la edad avanzada.
- 7.
En diciembre de 2009 disponemos de 23 FAR comercializados que pertenecen a 6 familias, lo que posibilita estrategias terapéuticas individualizadas.
- 8.
La toxicidad de los FAR a medio y largo plazo es un factor limitante que obliga a buscar nuevas opciones terapéuticas manteniendo la potencia antiviral13.
- 9.
Hay diversas pautas de TARV que son similares en cuanto a potencia antirretroviral. La elección dependerá de las preferencias del médico o del paciente, de los efectos secundarios, de la adherencia, de tratamientos previos y de resistencias cruzadas, de interacciones farmacológicas, de la disponibilidad y de los costes.
- 10.
La recomendación de iniciar el TARV sólo cuando las cifras de linfocitos CD4 son inferiores a 350células/μl se debe fundamentalmente al temor a los efectos secundarios14, a las dificultades de adherencia8 y al riesgo de desarrollo de resistencias15. También ha influido en esta actitud la imposibilidad de erradicar el VIH16 y de restaurar la respuesta inmunoespecífica frente a este11,17. Sin embargo, la mejoría gradual de las pautas de inicio en cuanto a tolerancia y simplicidad, la evidencia de un efecto negativo directo del VIH per se sobre la salud así como el incremento de opciones de rescate tras un fracaso virológico han reabierto el debate sobre este tema y algunos expertos abogan por recomendaciones menos restrictivas para iniciar el tratamiento.
- 11.
La complejidad creciente del TARV implica que el cuidado de los pacientes debe efectuarse por parte de personal especializado que tenga los conocimientos y los medios adecuados18.
- 12.
La prevención de la infección por el VIH es un aspecto fundamental que no debe olvidarse nunca en la práctica clínica diaria y que debe introducirse de forma sistemática en la educación sanitaria de los pacientes y las personas de su entorno.
El recuento de linfocitos CD4 y la CVP son los parámetros que se utilizan para indicar el TARV, monitorizar su eficacia y tomar decisiones respecto a cambios.
Existen otros parámetros que, aunque no intervienen directamente en el inicio del TARV, se deben realizar igualmente en la evaluación inicial o en el seguimiento, ya que pueden matizar las decisiones terapéuticas (tabla 1).
Exploraciones complementarias en la valoración y el seguimiento de los pacientes con infección por el virus de la inmunodeficiencia humana
|
CMV: citomegalovirus; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana; TARV: tratamiento antirretroviral.
El número de linfocitos CD4 es el marcador principal de riesgo de progresión clínica de la infección por el VIH y de necesidad de TARV. Un objetivo del TARV es la restauración inmunológica y la forma más práctica de valorarlo es medir el incremento de los linfocitos CD4, que es evidente en las primeras semanas de tratamiento11,12,19–21. Además del número de linfocitos CD4, se restaura la respuesta proliferativa frente a mitógenos y antígenos memoria, y se puede retirar las profilaxis de infecciones oportunistas19–22. Paralelamente al aumento de los linfocitos CD4, hay una disminución de los linfocitos CD8 y de otros marcadores de activación del sistema inmunitario19,20.
El aumento de la cifra de linfocitos CD4 es lento pero constante en el tiempo. No hay datos que definan cuál es la respuesta inmunológica adecuada. Se admite, según estudios de cinética celular, que durante el primer año debería existir un aumento mínimo de las cifras de linfocitos CD4 de 50–100células/μl23. No es raro observar una discordancia entre la respuesta virológica y la inmunológica: pacientes que mantienen una cifra de linfocitos CD4 estable o que disminuye a pesar de tener una CVP no detectable24–27. En esta situación puede existir una carga viral detectable en el tejido linfático por un TARV subóptimo26. Sin embargo, esta linfopenia puede deberse a otras causas como hipertensión portal, toxicidad farmacológica, etc. En este sentido, se ha indicado que en cirróticos se puede usar el porcentaje de linfocitos CD4 para la toma de decisiones28,29, aunque también en estos pacientes el número de linfocitos CD4 ha demostrado ser el mejor predictor de riesgo30. Por otra parte, se ha comunicado la posibilidad de suspender la profilaxis frente a Pneumocystis jirovecii en pacientes con con cifras de linfocitos CD4 inferiores a 200células/μl si la CVP está suprimida, lo que orienta a que la supresión viral continuada debe ser necesaria para la reconstitución de la función inmunitaria31.
En los pacientes asintomáticos deben medirse los linfocitos CD4 cada 3–6 meses y, ante un hallazgo que oriente a tomar una decisión terapéutica, debe repetirse en 3–4 semanas32,33. Se aconseja la repetición del recuento de linfocitos CD4 antes de tomar la decisión de iniciar el TARV.
Carga viral plasmática del virus de la inmunodeficiencia humanaEl objetivo del TARV es suprimir la replicación viral de modo rápido y duradero. La CVP desciende rápidamente (1–2log10) al inicio del TARV y el nadir, que se alcanza a las 4–8 semanas, se correlaciona con la duración de la respuesta34–37. Los pacientes con CVP muy elevadas pueden tardar hasta 24 semanas en conseguir niveles inferiores a 50copias/ml38.
El objetivo de supresión de la CVP es llegar a una cifra inferior a 50copias/ml, cifra con la que se ha comprobado que no se seleccionan mutaciones39,40 y la duración de la respuesta virológica es mucho mayor (frente a los que mantienen CVP de entre 50–500copias/ml)35. En los pacientes con CVP controlada se ha observado ocasionalmente brotes transitorios de viremia de bajo nivel (blips)41, que vuelve espontáneamente a ser indetectable sin ningún cambio en el tratamiento. La patogenia de los blips no está clara y se ha indicado que la activación inmunitaria por infecciones intercurrentes estimularía las células crónicamente infectadas (reservorios) con aparición transitoria de CVP42. La mayoría de los estudios no relacionan los blips con el fracaso virológico43–46, aunque un pequeño porcentaje puede desarrollar fracaso virológico con aparición de mutaciones de resistencia47,48.
Los criterios de respuesta y fracaso virológicos son los siguientes:
Respuesta virológica: Un descenso de la CVP superior a 1log a las 4 semanas del TARV, y CVP inferior a 50copias/ml a las 16–24 semanas.
Fracaso virológico: Cualquiera de las siguientes situaciones: a) CVP detectable a las 24 semanas del TARV, o b) si tras alcanzar una CVP indetectable (<50copias/ml), esta vuelve a ser detectable en 2 determinaciones consecutivas.
Es conveniente medir la CVP a las 4 semanas de inicio del TARV para comprobar la respuesta virológica y como medida indirecta de adherencia. Posteriormente, la determinación se hará cada 3–6 meses. Si la medida de la CVP se efectúa tras un proceso viral intercurrente o tras vacunación, puede haber brotes transitorios de la CVP49.
Recomendaciones
- •
Se debe conocer la CVP, ya que es un criterio secundario para el inicio del TARV, complementario al número de linfocitos CD4 (nivel A).
- •
Se debe controlar la eficacia del TARV mediante la CVP, que es el parámetro principal para evaluarla, definir su fracaso y tomar decisiones de cambio (nivel B).
- •
Debe utilizarse una técnica de determinación de CVP cuyo dintel de detección sea inferior a 50copias/ml y usar siempre la misma técnica (nivel B).
- •
Si se van a tomar decisiones terapéuticas en función de un resultado, se debe confirmar la CVP con una segunda determinación (nivel B).
Las concentraciones plasmáticas de algunos FAR se correlacionan con su eficacia o su toxicidad, por lo que se ha sugerido que la determinación de los niveles plasmáticos podría ser útil para optimizar su uso50.
Se conocen determinadas situaciones clínicas o factores que pueden inducir variaciones importantes en los niveles plasmáticos de los FAR, lo que justificaría su determinación51. Entre ellos se encuentran el sexo, la edad, el peso y la superficie corporal, los niveles de α-1-glucoproteína y las variaciones en las isoformas del citocromo P450 (CYP), las interacciones medicamentosas, el embarazo, la insuficiencia hepática o renal.
La monitorización de los niveles plasmáticos se limita a inhibidores de la transcriptasa inversa no análogos de nucleósido (NN) y a inhibidores de la proteasa (IP), ya que la determinación de la forma activa de los inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido (AN) (intracelular) presenta una variabilidad interpaciente e intrapaciente tan amplia que dificulta su uso clínico.
El valor de los niveles de IP con respecto a su eficacia ha perdido vigencia desde que se utilizan potenciados, aunque ha aumentado su valor para reducir toxicidad. Los datos que relacionaban niveles plasmáticos de IP y eficacia se obtuvieron en los estudios de desarrollo donde se utilizaron en monoterapia52. Los estudios en regímenes de combinación han mostrado resultados dispares: han variado según la línea de tratamiento (sin tratamiento previo frente a pretratados), los fármacos acompañantes (otros IP o NN) o la potenciación con ritonavir (RTV)53–59. En cuanto a la toxicidad, se ha demostrado una relación entre niveles plasmáticos y algunos efectos secundarios como alteraciones gastrointestinales, hipertrigliceridemia y parestesias (con RTV), alteraciones renales (con indinavir [IDV]), hepatotoxicidad (con nevirapina [NVP]), colesterol total y triglicéridos (con lopinavir [LPV] potenciado con RTV [LPV/r])60–64. Igualmente, hay datos que indican que los pacientes que alcanzan concentraciones más elevadas de efavirenz (EFV) tienen mayor riesgo de síntomas neuropsiquiátricos65,66.
Las limitaciones del uso sistemático de niveles plasmáticos en la clínica diaria son múltiples: por una parte, no existen estudios prospectivos que demuestren su utilidad en mejorar la eficacia y, por otra parte, la ausencia de rangos terapéuticos asociados a respuesta terapéutica o la posibilidad de reducir reacciones adversas. Otra limitación es la falta de disponibilidad de la técnica en la mayoría de los laboratorios.
Resistencia del virus de la inmunodeficiencia humana a fármacos antirretroviralesLa tasa de mutación espontánea de los retrovirus se estima en un nucleótido por cada 104 o 105 nucleótidos y copia de la cadena del ARN67–69. Por otro lado, la vida media de los linfocitos CD4 infectados que replican activamente es de un día y se estima que la vida media del virus en plasma es de 6h70–73. La conjunción de esta alta tasa de error de la transcriptasa inversa y de la rápida renovación de la población viral produce un acúmulo de gran cantidad de variantes virales, que reciben el nombre de cuasi especies. El número de variantes genéticas distintas presentes en un momento dado en un individuo infectado se estima entre 5×105–5×1010.
Las mutaciones que confieren resistencia pueden existir en estas cuasi especies, pero representan una proporción mínima de la población viral hasta que se ve sometida a la presión selectiva del TARV72. Así pues, el tratamiento conllevará que las variantes resistentes se conviertan en población dominante al cabo de semanas o meses si no se suprime la replicación viral74–76.
No todas las mutaciones tienen la misma importancia. Para cada FAR existen unas llamadas «principales», cuya presencia está estrechamente ligada a la aparición de resistencia y que reducen la eficiencia biológica del virus (fitness), y otras llamadas «secundarias» que, en menor medida, también contribuyen a la resistencia y que, en general, actúan modificando la capacidad replicativa viral.
Detección de resistencias del virus de la inmunodeficiencia humana a fármacos antirretroviralesLas variantes resistentes pueden detectarse mediante técnicas genotípicas o fenotípicas15. Las técnicas genotípicas detectan cambios específicos en los genomas de las enzimas diana de los fármacos (transcriptasa inversa, proteasa, integrasa, envuelta), mientras que las técnicas fenotípicas determinan la respuesta de la población viral mayoritaria a concentraciones crecientes de los distintos fármacos. Ambas comparten limitaciones como la dificultad de detección cuando la población mutada es inferior al 20% de la población viral o la CVP es inferior a 1.000copias/ml15, aunque técnicas recientes van reduciendo ambas limitaciones. Las pruebas de resistencias deben realizarse durante el TARV77 activo, ya que a la población viral resistente la sustituirá otra población sensible a las pocas semanas de retirar los fármacos. Los resultados de estas pruebas se deben interpretar teniendo presentes los estudios previos de resistencia, la historia terapéutica y la adherencia.
Las técnicas genotípicas y fenotípicas tienen ventajas y desventajas que las hacen complementarias entre sí15. Las técnicas genotípicas son más sencillas, rápidas y accesibles para la mayor parte de los laboratorios y permiten la detección de mutaciones centinela antes de que se detecten cambios de susceptibilidad en las pruebas fenotípicas. Su mayor limitación estriba en la dificultad de establecer una correlación genotípica-fenotípica y, sobre todo, en las dificultades de interpretación para algunos fármacos. Además, su aplicación en la práctica diaria requiere el conocimiento previo por parte del clínico de la influencia que tiene cada mutación detectada en la eficacia de cada fármaco. Las técnicas fenotípicas tienen la ventaja de informar del efecto neto de las distintas concentraciones sobre la sensibilidad real de la cepa predominante a los FAR, se hayan utilizado o no. Existe una buena correlación entre las 2 técnicas existentes en la actualidad: Virologic Phenosense® y Virco Antivirogram®78. Sus mayores desventajas son el coste, la disponibilidad limitada y la demora en la obtención de resultados. Para superar estas desventajas se ha desarrollado el fenotipo virtual79, obtenido a partir de una base de datos que tiene miles de muestras analizadas mediante ambas técnicas. Ante un determinado genotipo, el sistema busca todos los genotipos coincidentes en la base de datos y calcula el fenotipo medio de estos pacientes. En una modificación reciente (VircoType®) se añade información de predicción de la respuesta: proporción de pacientes con respuesta máxima o reducida y ausencia de respuesta (puntos de corte clínicos). Se ha demostrado que existe una buena correlación entre ambos métodos78,79, sobre todo con los NN y menos con los AN. La correlación es bastante más deficiente en pacientes multitratados.
Numerosos trabajos han estudiado en países desarrollados la prevalencia de resistencias primarias en pacientes con infección aguda o crónica. Se sabe que la mayoría de las mutaciones puede detectarse durante años y que su prevalencia ha aumentado y ha llegado a superar el 10%80–82. En España, en un estudio multicéntrico de pacientes con infección reciente, se encontró que el 14% de las cepas tenía mutaciones primarias83, pero datos más recientes muestran una reducción de la prevalencia en los diagnósticos nuevos al 10%84,85. Por eso se debe realizar una prueba genotípica en el momento del diagnóstico. Un estudio de coste-eficacia relativo a la ventaja de efectuar la prueba genotípica a todos los pacientes con infección crónica antes de iniciar el TARV ha demostrado que esta es coste-eficaz a la hora de preservar fármacos y que, por tanto, debería incluirse en la práctica habitual86,87. Se debería considerar repetir el genotipado antes de iniciar el TARV en caso de diferir este por la posibilidad de haber sufrido una reinfección.
En España se está llevando a cabo una recogida de información sobre mutaciones de resistencia en pacientes en fracaso virológico atendidos en diferentes centros hospitalarios españoles integrados en la Plataforma de Resistencias de la Red Española de Investigación en Sida (RIS). Próximamente estará disponible a través de su portal electrónicoa y permitirá el acceso a un sistema de interpretación en tiempo real de los genotipos de resistencia según los criterios de la RIS.
No se conoce la utilidad de la detección de poblaciones minoritarias que se escapan al estudio genotípico convencional88–95.
Significado clínico de las resistencias del virus de la inmunodeficiencia humana a fármacos antirretroviralesCon el uso de la CVP en el seguimiento de los pacientes con infección por el VIH se ha evidenciado la relación entre aparición de mutaciones de resistencias y fracaso virológico. Sin embargo, este fenómeno no es homogéneo para todos los fármacos, ya que es muy claro en los AN y los NN pero existen datos contradictorios con los IP, con los que se ha constatado fracaso virológico sin evidencia de resistencias96. En este sentido se ha definido el fenómeno de resistencia celular, ya que se ha detectado la existencia de bombas de expulsión de los FAR en la membrana de los linfocitos y otras células. Se han descrito la MDRP-1 (glicoproteína-P [P-gp]) para los IP y la MDRP-4 para los AN97. Se desconoce la relevancia clínica de estos hallazgos.
En los estudios prospectivos y aleatorizados que han utilizado las pruebas de resistencias para el manejo del fracaso virológico se compara la eficacia del cambio de TARV cuando se realiza según las distintas pruebas de resistencia (genotipo, fenotipo o fenotipo virtual), con o sin consejo de expertos o en función de la historia terapéutica previa o la experiencia clínica de los médicos98–106. Un metaanálisis de los primeros estudios comunicados puso de manifiesto que el uso del genotipo para diseñar el TARV de rescate frente al estándar (historia terapéutica y experiencia del médico) se asociaba con un control virológico significativamente mayor a los 3 y los 6 meses107. Estas diferencias no se observaron en los estudios en los que se compararon los métodos fenotípicos frente al tratamiento estándar107. Por otro lado, no se han detectado diferencias cuando se han comparado el fenotipo virtual y el fenotipo real105,106. Se requieren, pues, más datos para aclarar el papel de las pruebas fenotípicas para guiar el TARV.
Recomendaciones
- •
Se deben estudiar las mutaciones de resistencia, ya que su conocimiento permite un mejor uso de los fármacos (nivel A).
- •
Se considera indicada la realización de las técnicas genotípicas de detección de resistencias en la práctica asistencial en las situaciones expuestas en la tabla 2 (nivel B).
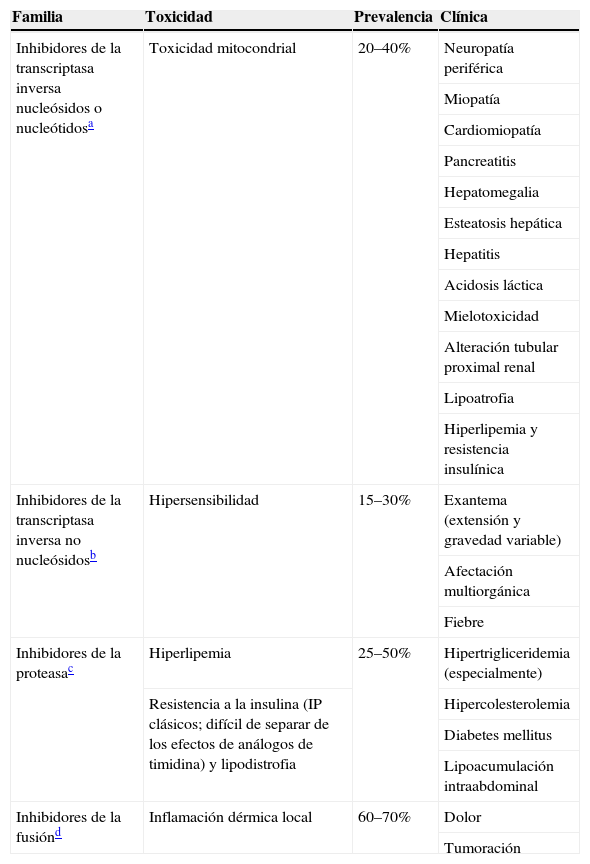
La reacción de hipersensibilidad (RHS) a abacavir (ABC) es un síndrome multiorgánico que se manifiesta con una combinación variable de fiebre, mialgias, síntomas respiratorios y gastrointestinales y un exantema de intensidad creciente, y puede llegar a ser fatal en caso de continuar con el fármaco o reintroducirlo. Suele aparecer durante las primeras 6 semanas de tratamiento, se presenta en el 5–8% de los pacientes que toman ABC y es la causa más frecuente de sus discontinuación108. Se sabe que la RHS es más frecuente en la población blanca y se dispone de una prueba cutánea (parche) para su confirmación.
Estudios farmacogenéticos han identificado que la RHS ocurre en las personas portadoras del alelo HLA B*5701. En el ensayo PREDICT, en el que se aleatorizó a los pacientes para comenzar TARV con ABC o para comenzarlo sólo si el alelo HLA B*5701 era negativo, se valoró la RHS por datos clínicos que se confirmaron con una prueba cutánea (confirmación inmunológica). La prevalencia del alelo HLA B*5701 en esta cohorte era del 5,6%. La genotipificación del alelo HLA B*5701 redujo la incidencia de sospecha clínica de RHS (el 3,4 frente al 7,8%) y la inmunológica (el 0 frente al 2,7%), el valor predictivo negativo de esta prueba fue del 100%109. Se ha validado esta prueba en población negra y se han confirmado los resultados110.
El ABC no debe utilizarse en personas portadoras del alelo HLA B*5701. Si el alelo HLA B*5701 es negativo, no se descarta la posibilidad de RHS y debe informarse y controlar a estos pacientes respecto a la RHS cuando se inicia tratamiento con ABC.
Recomendaciones
- •
Se debe determinar el alelo HLA B*5701 a todos los pacientes en el momento del diagnóstico o cuando vayan a comenzar el TARV con ABC (nivel A).
- •
Si el alelo HLA B*5701 es positivo, no se debe prescribir ABC (nivel A).
- •
Si se prescribe ABC sin conocer el HLA B*5701, debe informarse al paciente y estar alerta para detectar síntomas de RHS (nivel C).
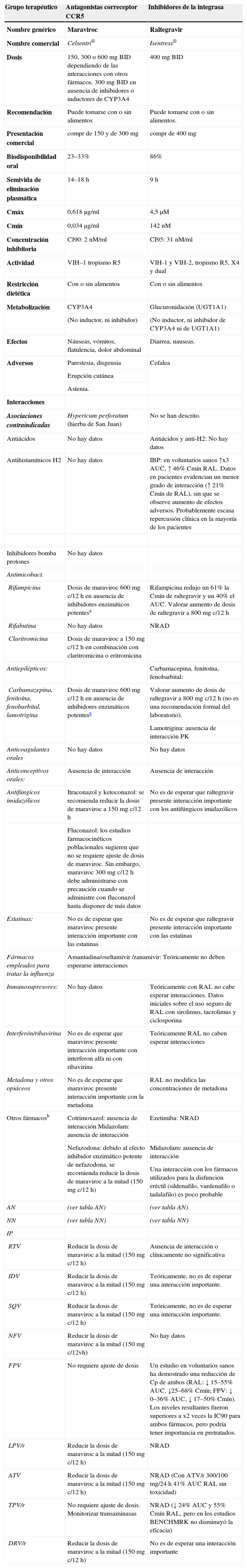
El VIH entra en la célula diana por un mecanismo que incluye el reconocimiento del receptor CD4, seguido de la unión a uno de los correceptores CCR5 o CXCR4 y, a continuación, se produce la fusión de las membranas con paso del ARN del VIH a la célula invadida. Los antagonistas del CCR5 (maraviroc [MVC], vicriviroc [VCV]) son fármacos que bloquean este receptor impidiendo la entrada del VIH en la célula111.
Tras la infección por el VIH, la mayoría de los pacientes albergan virus que usan el correceptor CCR5 (R5). En caso de no llevar tratamiento, el virus evoluciona a cepas que, en mayor o menor proporción, utilizan el correceptor CXCR4 (X4), y pueden encontrarse igualmente cepas duales o mixtas (D/M) que pueden usar ambos correceptores. Este cambio se relaciona con un descenso de CD4 y un aumento de la inmunodepresión ya que se consideran más patogénicas112. En los pacientes multitratados con CVP detectable, las cepas X4 o D/M son más prevalentes, y pueden llegar a superar el 50% en caso de cifras de linfocitos CD4 inferiores a 100células/μl113,114.
Actualmente, existe una técnica fenotípica para la detección del tropismo (Trofile®, Monogram Biosciences, EE. UU.) que se realiza en un solo centro (California, EE. UU.) y que llega a detectar la población X4 o D/M cuya proporción supere el 0,3% en una CVP de 1.000copias/ml o más (prueba ultrasensible)115,116. Existen técnicas genotípicas de detección de tropismo (actualmente no comercializadas) en las que se efectúa la secuenciación de la región V3 de la gp120 (semejante a la realización de un test de resistencias genotípico), posteriormente se le aplica al resultado alguna de las reglas de interpretación disponibles en la Webb. En España, en la misma página web de resistencias de la RIS se podrá interpretar el resultado de esta secuenciación.
Infección aguda por el virus de la inmunodeficiencia humanaLa primoinfección por el VIH es sintomática en más de la mitad de los casos, pero puede pasar desapercibida ya que sus síntomas son los de una virosis común117–121. El cuadro clínico es similar a la mononucleosis o a una meningoencefalitis viral121. Los síntomas y los signos más comunes son fiebre, adenopatías, mialgias, exantema, sudoración nocturna y artralgias122. Debe sospecharse en toda persona con conducta de riesgo y síntomas compatibles. Las determinaciones necesarias para el diagnóstico difieren de la infección crónica. Como en esta fase todavía no hay anticuerpos (período ventana), debe determinarse la CVP123 que se detecta a partir de la primera semana, precede a los síntomas y tiene una sensibilidad y una especificidad del 100 y del 97%, respectivamente. La CVP suele estar muy elevada (>6log10) en la infección aguda y se relaciona con la intensidad de las manifestaciones clínicas. La seroconversión se detecta 1–2 semanas más tarde122. La técnica de western blot con la que se confirma el diagnóstico puede ser negativa o indeterminada y deberá repetirse unas semanas después del comienzo de los síntomas para confirmar su positivización. El término infección aguda (diagnóstico antes de la seroconversión) no debe confundirse con infección reciente, que es la que tiene menos de 6 meses de evolución121.
Desde la descripción de los primeros casos de infección aguda se sabe que la progresión a sida es más rápida en los pacientes sintomáticos. En estudios de cohortes que han analizado la historia natural de la infección por el VIH se ha evidenciado que la progresión a sida o muerte se asociaba a factores iniciales de la infección como la gravedad de la sintomatología en la infección aguda124 (mayor riesgo a mayor número de síntomas), el descenso inicial de las cifras de linfocitos CD4 (mayor riesgo si era inferior a 500células/μl)125 y el nivel de la CVP a partir del 4.° mes (mayor progresión si el setpoint era superior a 100.000copias/ml)124, así como al ADN proviral inicial (mayor progresión si era superior a 3,4log10 copias/millón de células mononucleares en sangre periférica)125.
El TARV en la infección aguda puede tener ventajas e inconvenientes121,126. Las ventajas teóricas serían acortar la duración de los síntomas, suprimir la replicación viral, reducir el riesgo de transmisión del VIH (muy elevado en la infección aguda)118, reducir la diversidad viral y el número de células infectadas (reservorio) y preservar o restaurar el sistema inmunitario y la inmunidad específica frente al VIH, tanto proliferativa (mediada por los linfocitos CD4) como citotóxica (mediada por los linfocitos CD8+)117,127–131, lo que podría permitir el control inmunológico de la replicación viral, modificar la historia natural, disminuir el riesgo de progresión y mejorar el pronóstico de la infección por el VIH. Por el contrario, las principales desventajas del TARV en la fase aguda son su duración indefinida (ya que con las pautas de TARV que hasta ahora se han utilizado no se erradica la infección117 ni se restaura el tejido linfático asociado a mucosas132) y el riesgo de efectos secundarios o desarrollo de resistencias, así como el tratamiento innecesario de los posibles no progresores.
En la actualidad el inicio del TARV durante la infección aguda es controvertido133,134. La información disponible se ha obtenido de series pequeñas, generalmente sin grupo control, en países desarrollados, con pacientes infectados por el subtipo B y con pautas de TARV similares a las utilizadas en la infección crónica. No hay estudios publicados que hayan evaluado si otras pautas (TARV con inhibidores de la entrada o de la integrasa) pueden ser más efectivas en este escenario. Hasta ahora no se ha demostrado un beneficio clínico en términos de reducir la progresión a sida o muerte133, aunque en algún estudio se ha visto una mejor evolución inmunológica y virológica en los pacientes tratados135–137.
En cualquier caso, si se decide iniciar TARV, las pautas recomendadas son las mismas que en la infección crónica y la respuesta virológica a IP o a NN es similar136,138–140. Como en la infección crónica, siempre debe efectuarse un test de resistencias, se vaya a iniciar TARV o no, por la posibilidad de transmisión de cepas resistentes. En pacientes con multirresistencia se debe realizar un tropismo viral porque se han descrito cepas con fenotipo dual (R5 y X4) y una rápida progresión a sida141–143. Dado que la prevalencia de cepas con resistencia a NN es mayor que a IP en pacientes con infección aguda o reciente83,144, si se decide iniciar TARV y todavía no está disponible el resultado del estudio de resistencias, es preferible comenzar con una pauta basada en IP. Se ha observado que la prevalencia de lipodistrofia y dislipidemia asociadas al TARV es similar a la de los pacientes con infección crónica145–147.
Para evitar el TARV indefinido y conseguir los objetivos mencionados previamente, se han planteado diversas estrategias121,126: 1) administrar el TARV durante un período limitado de tiempo; 2) administrarlo de forma intermitente a fin de potenciar la respuesta específica al VIH y controlar la replicación viral sin FAR; 3) combinar el TARV con inmunosupresores (hidroxiurea, ciclosporina A, ácido micofenólico) o citoquinas (interleucina [IL]-2), y 4) asociar TARV y vacunas terapéuticas. Sin embargo, ninguna de estas estrategias ha conseguido que el sistema inmunitario controle la replicación viral de forma sostenida en ausencia de TARV, por lo que en la actualidad si se inicia el tratamiento durante la infección aguda, probablemente se deba mantener de forma indefinida.
La eficacia del TARV durante un período variable se ha evaluado en estudios de cohortes en los que se han comparado pacientes con infección aguda o reciente tratados frente a no tratados. Los resultados de la mayoría de estos estudios no han conseguido demostrar un beneficio clínico, virológico ni inmunológico a las 48–144 semanas de interrumpir el tratamiento, mientras que en otros, solo una pequeña proporción de los pacientes tratados mostraban un setpoint de CVP más bajo, mejores cifras de CD4 o mantenían la respuesta inmunoespecífica frente al VIH138,148–160. Habrá que esperar los resultados de ensayos clínicos aleatorizados que están en marcha (estudio SPARTAC) para poder valorar adecuadamente los potenciales beneficios de esta estrategia terapéutica.
La administración de TARV intermitente con el fin de potenciar la respuesta inmunoespecífica al VIH para controlar la replicación viral no ha conseguido buenos resultados, y es testimonial la proporción de pacientes que mantenía la respuesta inmunitaria y el control de la replicación viral sin TARV a las 96 semanas131,161,162. Además, esta estrategia de interrupción estructurada no está exenta de la aparición de resistencias163,164.
La estrategia de asociar al TARV citoquinas como interferón pegilado o IL-2 a fin de disminuir el reservorio viral y mejorar la respuesta inmunitaria165–167 tampoco ha conseguido sus objetivos. Se han efectuado estudios con interferón pegilado168 o inmunosupresores (hidroxiurea, ciclosporina, ácido micofenólico) para reducir la activación del sistema inmunitario y controlar la replicación viral164,169–172. Algunos de estos estudios solamente han podido demostrar mayor toxicidad164.
Finalmente, las vacunas terapéuticas asociadas o no al TARV con el fin de restaurar o potenciar la respuesta inmunoespecífica frente al VIH tampoco han mostrado mejores resultados173. Se sabía que en modelos animales algunas vacunas habían sido satisfactorias174,175, pero los resultados de 2 ensayos clínicos doble ciego en humanos han sido desalentadores176,177. Tanto en el estudio QUEST176 (TARV frente a TARV más vacuna ALVAC-HIV, y TARV frente a TARV más vacuna ALVAC-HIV más Remune®) como en el ensayo clínico178 que comparó diferentes dosis de una vacuna que usaba el virus de la viruela aviar (Avipox) con los genes gag/pol del VIH insertados, la respuesta virológica e inmunoespecífica fue similar al grupo placebo.
Recomendaciones
- •
En general, no se recomienda iniciar TARV en los pacientes con infección aguda (nivel B)121,126. Solamente se recomienda el TARV cuando existen manifestaciones clínicas graves o una duración prolongada de los síntomas y tras explicar al paciente sus ventajas e inconvenientes (nivel C).
- •
Se debe efectuar siempre una prueba de resistencias al diagnóstico de la infección aguda, se vaya a iniciar el TARV o no (nivel B)83,141,142.
- •
Si se decide iniciar el TARV, las pautas recomendadas son las mismas que en la infección crónica (nivel C)136,138–140. Si no se dispone del resultado del estudio de resistencias es preferible comenzar con una pauta basada en un IP potenciado con RTV (IP/r) (nivel C)83,144.
- •
En los pacientes no tratados se recomienda evaluar los criterios del TARV a partir de los 6 meses, cuando ya la infección es crónica (nivel A).
En los pacientes sin tratamiento previo, se debe valorar individualmente cuándo iniciar el TARV y qué combinación de fármacos utilizar, sopesando siempre las ventajas y los inconvenientes de cada opción. La disposición y la motivación del paciente para iniciarlo es un factor crítico a la hora de tomar la decisión de empezar.
Cuándo iniciar el tratamiento antirretroviralSe dispone de combinaciones de FAR que bloquean de forma duradera la replicación viral en plasma y tejido linfático, lo que permite la restauración, al menos parcial, del sistema inmunológico6,11,179. En ediciones previas de estas guías se hacía énfasis en la influencia en el equilibrio riesgo-beneficio del TARV de la toxicidad a medio y largo plazo de los FAR, los problemas de adherencia, la aparición de resistencias, las interacciones medicamentosas y el impacto en la calidad de vida8. Aunque todos estos factores siguen siendo muy importantes, es justo reconocer que el número de opciones terapéuticas, la eficacia, la seguridad y la simplicidad de las combinaciones de antirretrovirales han aumentado marcadamente durante los últimos 5 años180. Además, debido fundamentalmente al uso del IP/r, el riesgo de desarrollo de multirresistencia ha disminuido considerablemente.
Gracias al TARV se ha reducido drásticamente el riesgo de progresión y muerte de los pacientes con infección por el VIH. A pesar de todos estos avances, la esperanza de vida del paciente infectado por el VIH que recibe TARV está acortada con respecto a la de la población general181,182. Se ha comunicado que solo los pacientes que han recibido TARV durante al menos 6 años y han alcanzado una cifra de CD4 superior a 500células/μl tienen una mortalidad similar a la población general183.
El aumento de la eficacia, la seguridad y la simplicidad del TARV junto con el reconocimiento de que aún existe margen de mejora en el aumento de la esperanza de vida del paciente infectado por el VIH han vuelto a plantear el debate sobre un inicio más temprano del TARV.
Evaluación del riesgo de progresiónLa CVP y la cifra de linfocitos CD4 son marcadores independientes de progresión de la infección por el VIH184,185.
Existe evidencia, basada en ensayos clínicos y estudios observacionales, que apoya el inicio del TARV en pacientes con cifras de linfocitos CD4 inferiores a 200células/μl, pero no hay ensayos en pacientes con cifras de linfocitos CD4 superiores a 200células/μl que indiquen cuál es el momento óptimo para iniciarlo. Sin embargo, y a pesar de sus limitaciones, existen estudios de cohortes observacionales, de pacientes tratados o no, que pueden ayudar a la hora de decidir el inicio del TARV en personas con infección por el VIH asintomáticas.
El debate actual se centra en torno a si es necesario iniciar TARV con cifras de linfocitos CD4 cercanas o incluso superiores a 350células/μl. Los datos que sustentan este debate provienen de cohortes de pacientes en las que se ha evaluado la mortalidad, la progresión a sida, la incidencia de enfermedades no definitorias de sida, la recuperación inmunológica y la toxicidad del tratamiento en función de la cifra de linfocitos CD4 previa al inicio del TARV. Los estudios de cohortes tienen importantes problemas metodológicos, como el sesgo de prescripción, que hacen que la calidad de la evidencia sea menor que la proveniente de ensayos clínicos aleatorizados.
Respuesta clínica (progresión a sida o muerte)Hay datos muy limitados sobre la comparación de la mortalidad o la progresión a sida en pacientes que empiezan el TARV con cifras de linfocitos CD4 por encima o por debajo de 350células/μl.
En un análisis de 10.855 pacientes de varias cohortes, la progresión a sida o muerte fue significativamente mayor en los que iniciaban el TARV con cifras de linfocitos CD4 inferiores a 200células/μl (hazard ratio [HR]: 2,93) que en los que lo empezaron con cifras de linfocitos CD4 de entre 201–350células/μl, pero no hubo diferencia (HR: 1,26) cuando se comparó los que iniciaron con cifras de linfocitos CD4 de entre 201–350células/μl frente a los que empezaron con cifras de linfocitos CD4 superiores a 350células/μl. Sin embargo, se observó un aumento significativo del riesgo de sida (no de sida o muerte) en los que empezaron con cifras de linfocitos CD4 de entre 201–350células/μl frente a los que empezaron con cifras de linfocitos CD4 superiores a 350células/μl (HR: 1,52; intervalo de confianza del 95% [IC95%]: 1,10–2,10)9.
En la cohorte PISCIS de Cataluña y Baleares, el riesgo de progresión a sida o muerte tras el inicio del TARV fue significativamente menor en los pacientes que lo iniciaron con cifras de linfocitos CD4 de 350células/μl o más que en los que lo empezaron con cifras de linfocitos CD4 de entre 200–350células/μl (HR: 1,85; IC95%: 1,03–3,33) o inferiores a 200células/μl (HR: 2,97; IC95%: 1,91–4,63)10.
En un subanálisis de los pacientes con cifras de linfocitos CD4 superiores a 350células/μl del ensayo SMART que no estaban recibiendo TARV al inicio del estudio, los aleatorizados para demorar el TARV hasta alcanzar la cifra de linfocitos CD4 de 250células/μl tuvieron mayor riesgo de enfermedades oportunistas o muerte por causas no directamente relacionadas con sida que quienes iniciaron el TARV inmediatamente con cifras de linfocitos CD4 de 350células/μl o más186.
Por último, en un análisis paralelo de 17.517 pacientes con infección por el VIH asintomática en EE. UU. y Canadá (estudio NA-ACCORD), se estratificaron dichos pacientes en función del recuento de linfocitos CD4 (de 351 a 500células/μl o más de 500células/μl) en el momento de iniciar el TARV. En cada grupo se comparó el riesgo relativo (RR) de muerte de los pacientes que iniciaron tratamiento cuando el recuento de linfocitos CD4 era superior a cualquiera de los 2 puntos de corte (tratamiento precoz) con el de los pacientes que difirieron el tratamiento hasta que el recuento de linfocitos CD4 cayó por debajo de dichos puntos de corte (tratamiento diferido). El primer análisis incluyó a 8.362 pacientes, 2.084 (25%) que inciaron tratamiento con cifras de linfocitos CD4 de entre 351–500células/μl y 6.278 (75%) que difirieron el tratamiento. Tras ajuste por año de tratamiento, cohorte y características clínicas y demográficas se halló un incremento del riesgo de muerte del 69% al comparar el grupo de tratamiento precoz con el de tratamiento diferido (RR en el grupo de TARV diferido: 1,69; IC95%: 1,26–2,26; p<0,001). En un segundo análisis con 9.155 pacientes, 2.220 (24%) iniciaron TARV precozmente (con más de 500células/μl) y 6.935 (76%) difirieron el TARV. Se halló un incremento del RR de muerte en el grupo de TARV diferido del 94% (RR: 1,94; IC95%: 1,37–2,79; p<0,001)187.
Por último, en un ensayo clínico, controlado, aleatorizado, abierto, llevado a cabo en Haití (CIPRA HT 001), se aleatorizó a 816 pacientes mayores de 18 años con cifras de linfocitos CD4 de entre 200–350 células/μl para iniciar TARV (zidovudina [ZDV]+ lamivudina [3TC]+EFV) o diferirlo hasta 2 semanas después del diagnóstico clínico de sida o que su recuento de CD4 descendiera por debajo de las 200células/μl. El estudio fue interrumpido prematuramente tras un análisis interino planeado que mostró 6 muertes en el grupo de 200–350células/μl frente a 23 en el grupo de pacientes que difirieron el TARV. Además, en el grupo de TARV diferido se diagnosticó el doble de casos de tuberculosis que en el grupo de inicio inmediato188.
En resumen, los estudios de cohorte sugieren que existe una relación progresiva entre la inmunodeficiencia y el riesgo de muerte o progresión a sida. Comparado con los pacientes que empiezan el TARV las cifras de linfocitos CD4 de entre 200–350células/μl, el riesgo de progresión está claramente aumentado en los pacientes que empiezan TARV con cifras de linfocitos CD4 por debajo de 200células/μl. La evidencia más reciente indica que el riesgo de muerte o progresión a sida podría ser aun menor en los pacientes que empiezan el TARV con cifras de linfocitos CD4 por encima de 350células/μl.
Incidencia de enfermedades no relacionadas con el virus de la inmunodeficiencia humanaRecientemente, los estudios de cohortes han puesto énfasis en el riesgo de aparición de enfermedades que hasta el momento no se habían considerado relacionadas con la inmunosupresión y, por tanto, no eran prevenibles con el empleo del TARV. Estas enfermedades son de tipo cardiovascular (infarto de miocardio, ictus), afectación de órganos (insuficiencia renal, hepatopatía descompensada) y aparición de cánceres no definitorios de sida (todo tipo excepto sarcoma de Kaposi, linfoma no hodgkiniano y carcinoma cervical invasor).
Hay que resaltar que, para los pacientes que empiezan el TARV con cifras de linfocitos CD4 superiores a 200células/μl, la incidencia de enfermedades no relacionadas con el VIH es tan frecuente como la de las definitorias de sida189. Por tanto, es muy relevante investigar estrategias encaminadas a disminuir la incidencia de los 2 tipos de complicaciones y no solo de las relacionadas clásicamente con la inmunosupresión. El TARV podría ejercer un efecto beneficioso sobre las complicaciones no relativas a sida mediante el control del estado proinflamatorio y la activación inmunitaria asociados a la replicación viral persistente.
En la cohorte D:A:D190 y en la cohorte CASCADE191 se ha comunicado que existe una disminución progresiva del riesgo de enfermedades no relacionadas con el VIH a medida que aumenta la cifra de linfocitos CD4. Los pacientes que presentan el menor riesgo de desarrollar enfermedades no definitorias de sida son los que mantienen una cifra de linfocitos CD4 superior a 350células/μl.
En el ensayo clínico SMART192, la incidencia de enfermedades no relacionadas con el VIH aumentó significativamente en el grupo de pacientes que suspendieron el TARV cuando la cifra de linfocitos CD4 era inferior a 350células/μl. En el ensayo clínico FIRST189 también se ha puesto de manifiesto una relación entre la cifra de linfocitos CD4 y el riesgo de desarrollar enfermedades no definitorias de sida: el riesgo es menor en aquellos pacientes que mantuvieron la cifra de linfocitos CD4 por encima de 350células/μl.
Subgrupos de mayor riesgo de progresiónVarios estudios10,193,194 han demostrado que diversos subgrupos de pacientes tienen un mayor riesgo de mortalidad o progresión a sida independientemente de su cifra de linfocitos CD4 antes de iniciar el TARV. El uso de drogas por vía parenteral, la coinfección por el virus de la hepatitis C (VHC), el sexo masculino y la edad avanzada se asocian a un mayor riesgo de progresión. Aunque no se ha establecido claramente un corte de edad a partir del cual sea más beneficioso iniciar el TARV, los estudios de cohorte sugieren que el riesgo de progresión está aumentado por encima de los 55–60 años de edad195.
Se ha estudiado la relación de la proporción de linfocitos CD4 al inicio del TARV con la supervivencia en un grupo de pacientes cuyos cifras de linfocitos CD4 estaban entre 200–350células/μl. La supervivencia era más corta si la proporción era menor del 5% (HR: 4,46) o de entre el 5–14% (HR: 2,43) que si era mayor o igual al 15% (p<0,01)196. Sin embargo, en la cohorte PISCIS, la proporción de linfocitos CD4 no fue un factor independiente asociado con el riesgo de progresión10.
Respuesta inmunológicaHay datos contradictorios sobre si existe un límite en la reconstitución inmunológica de los pacientes que reciben TARV. La cohorte del Hospital Johns Hopkins y la cohorte ATHENA196,197, con un seguimiento de hasta 7 años después del inicio del TARV, indican que la posibilidad de alcanzar recuentos de linfocitos CD4 normales depende del número inicial. En estas 2 cohortes solo los pacientes que iniciaron el TARV con cifras de linfocitos CD4 superiores a 350 células/μl se aproximaron a la normalización cuantitativa; sin embargo, los datos de Eurosida198 indican que se puede normalizar el número de linfocitos CD4, independientemente del nadir alcanzado, si la replicación viral persiste suprimida por debajo de 50copias/ml de forma prolongada.
Toxicidad del tratamiento antirretroviralUn argumento para diferir el TARV es evitar la toxicidad asociada al empleo de antirretrovirales. Hay pocos estudios actuales que hayan evaluado la incidencia de efectos adversos en función de la cifra de linfocitos CD4 antes del inicio del TARV. Un estudio reciente indica que la incidencia de neuropatía periférica, anemia e insuficiencia renal no está aumentada en los pacientes que inician el TARV con cifras de linfocitos CD4 superiores a 350células/μl199. De hecho, la incidencia de neuropatía periférica y de anemia fue menor en los pacientes que iniciaron el TARV con cifras de linfocitos CD4 por encima de 350células/μl que en quienes lo empezaron con cifras de entre 200–350células/μl.
Tratamiento antirretroviral para evitar la transmisión del virus de la inmunodeficiencia humana (parejas serodiscordantes)Algunos expertos han indicado que en parejas serodiscordantes que mantienen relaciones sexuales no protegidas, el tratamiento del miembro infectado a fin de controlar la replicación viral (carga viral indetectable) puede constituir una indicación de TARV. En un metaanálisis reciente que incluyó a 5.021 parejas heterosexuales y 461 episodios de transmisión, la tasa global de transmisión para pacientes en TARV fue de 0,46 (IC95%: 0,19–1,09) por 100 pacientes/año. La tasa de transmisión desde un sujeto en TARV con CVP inferior a 400copias/ml fue nula (no hubo transmisiones), con un límite superior de confianza al 97,5% de 1,27 por 100 personas/año. Si el sujeto no recibía TARV, la tasa de transmisión era de 0,16 (IC95%: 0,02–1,13) por 100 personas/año. No había suficientes datos para estratificar el riesgo de transmisión en función de la presencia de enfermedad de transmisión sexual, uso de condón o coito vaginal o anal200.
Recomendaciones
- •
El inicio del TARV debe basarse en 3 elementos: los síntomas, el número de linfocitos CD4 y la CVP.
- •
En caso de infección sintomática (episodios B o C) se recomienda iniciar el TARV en todos los casos (nivel A).
- •
Si la infección es asintomática, el inicio del TARV se basa en el número de linfocitos CD4, la CVP o en determinadas comorbilidades o características del paciente (tabla 3):
- ○
Si el número de linfocitos CD4 es inferior a 350células/μl, se recomienda el TARV (nivel B).
- ○
Si el número de linfocitos CD4 está entre 350–500células/μl, se recomienda el TARV en los pacientes con ciertas comorbilidades (cirrosis hepática, hepatitis crónica por virus C, hepatitis B con indicación de tratamiento, CVP superior a 105copias/ml, proporción de linfocitos CD4 inferior al 14%, edad superior a 55 años, riesgo cardiovascular elevado y nefropatía asociada al VIH) (nivel B).
- ○
Si el número de linfocitos CD4 es superior a 500células/μl, se recomienda diferir el TARV en general. Sin embargo, debe ser considerado en los pacientes con comorbilidades (cirrosis hepática, hepatitis crónica por virus C, hepatitis B con indicación de tratamiento, CVP superior a 105copias/ml, proporción de linfocitos CD4 inferior al 14%, edad superior a 55 años, riesgo cardiovascular elevado y nefropatía asociada al VIH) (nivel B).
- ○
En parejas serodiscordantes, debe valorarse cuidadosamente el inicio del TARV para disminuir la transmisión por vía sexual (nivel B). En ningún caso esto debe suponer la abstención de otras medidas para impedir la transmisión del VIH.
- ○
- •
A pesar de las consideraciones previas, el inicio del TARV debe valorarse siempre individualmente. Antes de tomar la decisión de iniciarlo, deben confirmarse las cifras de CD4 y de CVP. Además, debe prepararse al paciente, ofrecerle las distintas opciones, adaptar el esquema terapéutico al estilo de vida, las comorbilidades, las posibles interacciones y valorar el riesgo de una mala adherencia.
El tratamiento de elección de la infección por el VIH en el momento actual consiste en una combinación de al menos 3 fármacos que incluyan 2 AN y un IP/r o un NN (tabla 4). Con la mayoría de estas combinaciones se puede conseguir CVP inferiores a 50copias/ml en más del 70% de los casos a las 48 semanas201.
Indicaciones de tratamiento antirretroviral en pacientes asintomáticos con infección crónica por el virus de la inmunodeficiencia humana
| Linfocitos CD4 | Pacientes asintomáticos | Nivel de evidencia |
| ≤350 | Recomendar | Aa, Bb |
| 350–500 | Recomendar en determinadas ocasionesc | B |
| >500 | Diferir en general. Considerar en determinadas ocasionesd | B |
Cirrosis hepática, hepatitis crónica por el virus de la hepatitis C; CVP superior a 105copias/ml; proporción de linfocitos CD4 inferior al 14%; edad superior a 55 años; riesgo cardiovascular elevado; nefropatía asociada al virus de la inmunodeficiencia humana. Si la hepatitis B requiere tratamiento, se recomienda iniciar el tratamiento antirretroviral.
Combinaciones de tratamiento antirretroviral en pacientes sin tratamiento previo
| Pautas | Combinaciones | ||
| Pautas preferentes | Un fármaco de columna A+uno de columna B+uno de columna C | ||
| Columna Aa | Columna Ba | Columna Cb | |
| TDF | FTC | EFV | |
| ABCc | 3TC | NVPd | |
| ATV/r en QD | |||
| DRV/r en QD | |||
| FPV/r en BID | |||
| LPV/r en QD o BID | |||
| SQV/r BID | |||
| RALe | |||
| Pautas alternativas | ZDV | ATV | |
| ddI | FPV en BID | ||
| FPV/r en QD | |||
| MVCf | |||
| Pauta en caso de no poder usar las previas | ZDV+3TC+ABC C/s TDF | ||
| Pautas contraindicadas | Combinaciones de AN: ZDV+d4T, 3TC+FTC | ||
| ABC+3TC+TDF | |||
| ddI+3TC+TDF | |||
| d4T+ddI+ABC | |||
Nota: Para una mejor interpretación de la tabla, se recomienda consultar el texto.
/r: potenciado con ritonavir; 3TC: lamivudina; ABC: abacavir; AN: inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido; ATV: atazanavir; BID: pauta de tratamiento administrada 2 veces al día; d4T: estavudina; ddI: didanosina; DRV: darunavir; EFV: efavirenz; EMEA: Agencia Europea del Medicamento; FPV: fosamprenavir; FTC: emtricitabina; IP: inhibidor de la proteasa; LPV: lopinavir; NN: inhibidores de la transcriptasa inversa no análogos de nucleósido; NVP: nevirapina; QD: pauta de tratamiento administrada una vez al día; RAL: raltegravir; SQV: saquinavir; TDF: tenofovir; ZDV: zidovudina.
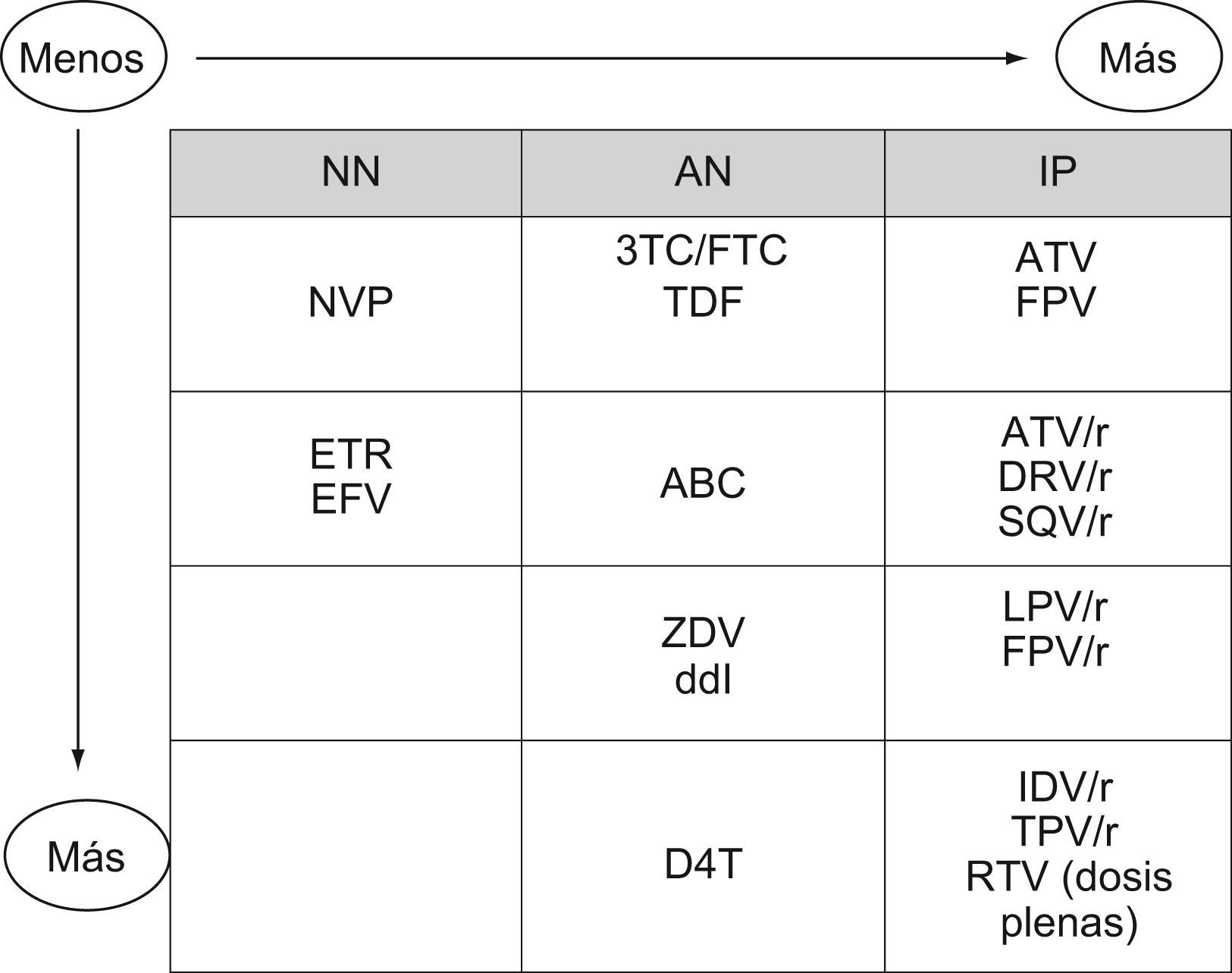
Las combinaciones de AN de elección en los regímenes triples de inicio son TDF+FTC (o 3TC) y ABC+3TC (o FTC). La elección de una de ellas dependerá del tercer fármaco elegido y del perfil de seguridad. Aunque 3TC y FTC son fármacos que se pueden utilizar indistintamente, se recomienda utilizar las coformulaciones ABC/3TC y TDF/FTC (nivel C). Antes de iniciar el tratamiento con ABC, se debe realizar una prueba de genotipificación del alelo HLA B*5701 y, si el resultado es positivo, el ABC está contraindicado (nivel A). Según el tercer fármaco, no hay experiencia con algunas combinaciones de AN de elección como ABC+3TC+NVP. No hay experiencia de TDF+3TC con un IP como tratamiento inicial, pero sí de TDF+FTC (con LPV/r, DRV/r y SQV/r). Las combinaciones ZDV+3TC o DDI+3TC causan más lipoatrofia que TDF+FTC o ABC+3TC.
En las pautas preferentes de la columna C se incluyen fármacos de 3 familias. Se considera que entre los NN el balance global de riesgo/beneficio favorece a EFV frente a NVP (Nivel C). EFV ha demostrado mayor eficacia virológica que LPV/r (nivel A). Ningún otro IP se ha comparado con EFV. Los IP están en orden alfabético. DRV/r y ATV/r han demostrado mayor eficacia y menor toxicidad que LPV/r, mientras que FPV/r y SQV/r han demostrado no ser inferiores a LPV/r.
Los estudios que demuestran la eficacia similar entre ABC y TDF en pacientes sin tratamiento previo se han generado con un IP/r como tercer fármaco. La pauta ABC-3TC ha presentado un mayor riesgo de fracaso virológico que TDF/FTC en pacientes con cargas virales altas (>100.000copias/ml). Con respecto a la asociación entre ABC y riesgo cardiovascular, no hay datos suficientes para tomar decisiones clínicas, pero se debería usar con precaución en pacientes con riesgo cardiovascular elevado.
NVP ha demostrado no presentar inferioridad con respecto a ATV/r (ambos en combinación con TDF+FTC). NVP no debe administrarse (como tratamiento de inicio) a mujeres con cifras de linfocitos CD4>250células/μl o a varones con >400células/μl.
Se consideran «pautas preferentes» las combinaciones avaladas por el mayor número de ensayos clínicos con eficacia y durabilidad óptimas, tolerancias aceptables y fáciles de usar. Otras pautas que han demostrado eficacia, pero con menor número de pacientes, menor duración de los estudios, mayor toxicidad o complejidad en su posología se han considerado «pautas alternativas». Se dispone de múltiples pautas antirretrovirales de eficacia similar. En este contexto, este comité quiere destacar la importancia creciente del costo de los FAR para establecer las pautas preferentes.
Consideraciones generales sobre las combinaciones de fármacos antirretroviralesRespecto de las distintas combinaciones de TARV, este comité quiere hacer varias puntualizaciones: 1) resaltar que las combinaciones de 2 AN con LPV/r o EFV son las más experimentadas en caso de inmunodepresión avanzada (cifras de linfocitos CD4 inferiores a 100células/μl)202–208; 2) las pautas de 3 AN son menos eficaces que las pautas de 2 AN+ un NN209 o 2 AN+ un IP210,211; 3) el tratamiento con fármacos de las 3 familias (AN, NN e IP) puede ser muy potente, pero no se recomienda de inicio por su complejidad, toxicidad y limitación de futuras opciones terapéuticas en caso de fracaso2,3,212,213. Otro tanto ocurre con las pautas que incluyen solamente 2 IP; 4) la combinación de un NN y un IP ha demostrado una eficacia similar al tratamiento triple con IP202, pero produce mayor dislipidemia214,215; 5) los inhibidores de la fusión no se utilizan en el tratamiento de inicio y deben reservarse para el fracaso, y 6) el TARV de inicio con más de 3 fármacos no mejora la pauta estándar con 3216–219.
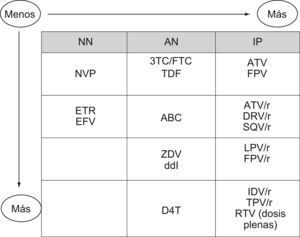
Consideraciones sobre la elección de un inhibidor de la transcriptasa inversa no análogo de nucleósido o un inhibidor de la proteasa potenciado con ritonavirLas pautas basadas en NN ofrecen ciertas ventajas sobre las que incluyen un IP/r: 1) presentan menos interacciones farmacocinéticas; 2) tienen un perfil metabólico más favorable; 3) tienen menor coste, y 4) el número de comprimidos es menor. Además, dada la baja barrera genética de los NN, el momento idóneo de su uso es el primer tratamiento. En pautas de rescate, los NN de primera generación tienen menos actividad que otros componentes del régimen.
La ventaja principal de los IP/r es su alta barrera genética para el desarrollo de resistencias.
Recomendación
- •
Puede utilizarse la combinación de 2 AN+ un NN o 2 AN+ un IP/r como tratamiento de inicio (los fármacos preferentes se detallan más adelante). Una alternativa válida cuando no se pueden tomar IP o NN es combinar 3 AN (ZDV+3TC+ABC) o 2 AN+MVC (nivel A) (tabla 4).
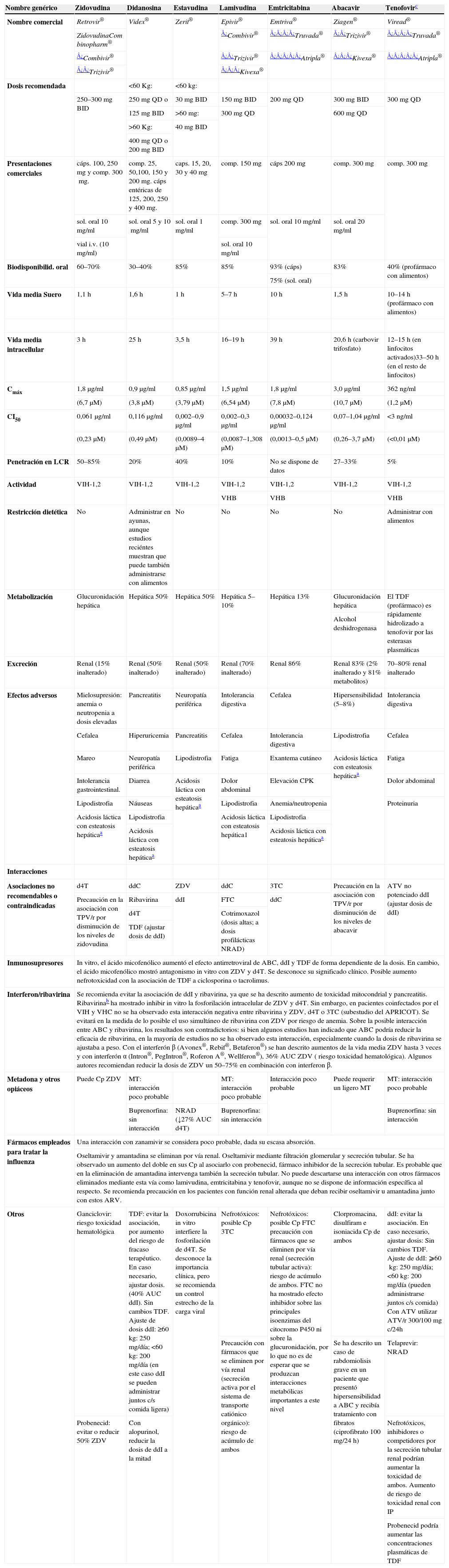
En España están comercializados 6 AN: ZDV, didanosina (ddI), estavudina (d4T), 3TC, emtricitabina (FTC) y ABC. También se dispone de un análogo de nucleótido, tenofovir (TDF). A efectos prácticos, la sigla AN incluye también al TDF en esta guía. Las principales características de los AN se describen en la tabla 5. Las combinaciones TDF+FTC (o 3TC), ABC+3TC (o FTC) y ddI+3TC (o FTC) pueden administrarse una vez al día; de ellas, TDF+FTC y ABC+3TC se presentan en un solo comprimido.
Inhibidores de la transcriptasa inversa análogos de nucleósido y de nucleótido
| Nombre genérico | Zidovudina | Didanosina | Estavudina | Lamivudina | Emtricitabina | Abacavir | Tenofovirc |
| Nombre comercial | Retrovir® | Videx® | Zerit® | Epivir® | Emtriva® | Ziagen® | Viread® |
| ZidovudinaCom binopharm® | ¿Combivir® | ¿¿¿¿Truvada® | ¿¿Trizivir® | ¿¿¿¿Truvada® | |||
| ¿Combivir® | ¿¿Trizivir® | ¿¿¿¿¿Atripla® | ¿¿¿Kivexa® | ¿¿¿¿¿Atripla® | |||
| ¿¿Trizivir® | ¿¿¿Kivexa® | ||||||
| Dosis recomendada | <60Kg: | <60kg: | |||||
| 250–300mg BID | 250mg QD o | 30mg BID | 150mg BID | 200mg QD | 300mg BID | 300mg QD | |
| 125mg BID | >60mg: | 300mg QD | 600mg QD | ||||
| >60Kg: | 40mg BID | ||||||
| 400mg QD o 200mg BID | |||||||
| Presentaciones comerciales | cáps. 100, 250mg y comp. 300mg. | comp. 25, 50,100, 150 y 200mg. cáps entéricas de 125, 200, 250 y 400mg. | caps. 15, 20, 30 y 40mg | comp. 150mg | cáps 200mg | comp. 300mg | comp. 300mg |
| sol. oral 10mg/ml | sol. oral 5 y 10mg/ml | sol. oral 1mg/ml | comp. 300mg | sol. oral 10mg/ml | sol. oral 20mg/ml | ||
| vial i.v. (10mg/ml) | sol. oral 10mg/ml | ||||||
| Biodisponibilid. oral | 60–70% | 30–40% | 85% | 85% | 93% (cáps) | 83% | 40% (profármaco con alimentos) |
| 75% (sol. oral) | |||||||
| Vida media Suero | 1,1h | 1,6h | 1h | 5–7h | 10h | 1,5h | 10–14h (profármaco con alimentos) |
| Vida media intracellular | 3h | 25h | 3,5h | 16–19h | 39h | 20,6h (carbovir trifosfato) | 12–15h (en linfocitos activados)33–50h (en el resto de linfocitos) |
| Cmáx | 1,8μg/ml | 0,9μg/ml | 0,85μg/ml | 1,5μg/ml | 1,8μg/ml | 3,0μg/ml | 362ng/ml |
| (6,7μM) | (3,8μM) | (3,79μM) | (6,54μM) | (7,8μM) | (10,7μM) | (1,2μM) | |
| CI50 | 0,061μg/ml | 0,116μg/ml | 0,002–0,9μg/ml | 0,002–0,3μg/ml | 0,00032–0,124μg/ml | 0,07–1,04μg/ml | <3 ng/ml |
| (0,23μM) | (0,49μM) | (0,0089–4μM) | (0,0087–1,308μM) | (0,0013–0,5μM) | (0,26–3,7μM) | (<0,01μM) | |
| Penetración en LCR | 50–85% | 20% | 40% | 10% | No se dispone de datos | 27–33% | 5% |
| Actividad | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 |
| VHB | VHB | VHB | |||||
| Restricción dietética | No | Administrar en ayunas, aunque estudios reciéntes muestran que puede también administrarse con alimentos | No | No | No | No | Administrar con alimentos |
| Metabolización | Glucuronidación hepática | Hepática 50% | Hepática 50% | Hepática 5–10% | Hepática 13% | Glucuronidación hepática | El TDF (profármaco) es rápidamente hidrolizado a tenofovir por las esterasas plasmáticas |
| Alcohol deshidrogenasa | |||||||
| Excreción | Renal (15% inalterado) | Renal (50% inalterado) | Renal (50% inalterado) | Renal (70% inalterado) | Renal 86% | Renal 83% (2% inalterado y 81% metabolitos) | 70–80% renal inalterado |
| Efectos adversos | Mielosupresión: anemia o neutropenia a dosis elevadas | Pancreatitis | Neuropatía periférica | Intolerancia digestiva | Cefalea | Hipersensibilidad (5–8%) | Intolerancia digestiva |
| Cefalea | Hiperuricemia | Pancreatitis | Cefalea | Intolerancia digestiva | Lipodistrofia | Cefalea | |
| Mareo | Neuropatía periférica | Lipodistrofia | Fatiga | Exantema cutáneo | Acidosis láctica con esteatosis hepáticaa | Fatiga | |
| Intolerancia gastrointestinal. | Diarrea | Acidosis láctica con esteatosis hepáticaa | Dolor abdominal | Elevación CPK | Dolor abdominal | ||
| Lipodistrofia | Náuseas | Lipodistrofia | Anemia/neutropenia | Proteinuria | |||
| Acidosis láctica con esteatosis hepáticaa | Lipodistrofia | Acidosis láctica con esteatosis hepática1 | Lipodistrofia | ||||
| Acidosis láctica con esteatosis hepáticaa | Acidosis láctica con esteatosis hepáticaa | ||||||
| Interacciones | |||||||
| Asociaciones no recomendables o contraindicadas | d4T | ddC | ZDV | ddC | 3TC | Precaución en la asociación con TPV/r por disminución de los niveles de abacavir | ATV no potenciado ddI (ajustar dosis de ddI) |
| Precaución en la asociación con TPV/r por disminución de los niveles de zidovudina | Ribavirina | ddI | FTC | ddC | |||
| d4T | Cotrimoxazol (dosis altas; a dosis profilácticas NRAD) | ||||||
| TDF (ajustar dosis de ddI) | |||||||
| Inmunosupresores | In vitro, el ácido micofenólico aumentó el efecto antirretroviral de ABC, ddI y TDF de forma dependiente de la dosis. En cambio, el ácido micofenólico mostró antagonismo in vitro con ZDV y d4T. Se desconoce su significado clínico. Posible aumento nefrotoxicidad con la asociación de TDF a ciclosporina o tacrolimus. | ||||||
| Interferon/ribavirina | Se recomienda evitar la asociación de ddI y ribavirina, ya que se ha descrito aumento de toxicidad mitocondrial y pancreatitis. Ribavirinab ha mostrado inhibir in vitro la fosforilación intracelular de ZDV y d4T. Sin embargo, en pacientes coinfectados por el VIH y VHC no se ha observado esta interacción negativa entre ribavirina y ZDV, d4T o 3TC (subestudio del APRICOT). Se evitará en la medida de lo posible el uso simultáneo de ribavirina con ZDV por riesgo de anemia. Sobre la posible interacción entre ABC y ribavirina, los resultados son contradictorios: si bien algunos estudios han indicado que ABC podría reducir la eficacia de ribavirina, en la mayoría de estudios no se ha observado esta interacción, especialmente cuando la dosis de ribavirina se ajustaba a peso. Con el interferón β (Avonex®, Rebif®, Betaferon®) se han descrito aumentos de la vida media ZDV hasta 3 veces y con interferón α (Intron®, PegIntron®, Roferon A®, Wellferon®), 36% AUC ZDV ( riesgo toxicidad hematológica). Algunos autores recomiendan reducir la dosis de ZDV un 50–75% en combinación con interferon β. | ||||||
| Metadona y otros opiáceos | Puede Cp ZDV | MT: interacción poco probable | MT: interacción poco probable | Interacción poco probable | Puede requerir un ligero MT | MT: interacción poco probable | |
| Buprenorfina: sin interacción | NRAD (↓27% AUC d4T) | Buprenorfina: sin interacción | Buprenorfina: sin interacción | ||||
| Fármacos empleados para tratar la influenza | Una interacción con zanamivir se considera poco probable, dada su escasa absorción. | ||||||
| Oseltamivir y amantadina se eliminan por vía renal. Oseltamivir mediante filtración glomerular y secreción tubular. Se ha observado un aumento del doble en sus Cp al asociarlo con probenecid, fármaco inhibidor de la secreción tubular. Es probable que en la eliminación de amantadina intervenga también la secreción tubular. No puede descartarse una interacción con otros fármacos eliminados mediante esta vía como lamivudina, emtricitabina y tenofovir, aunque no se dispone de información específica al respecto. Se recomienda precaución en los pacientes con función renal alterada que deban recibir oseltamivir u amantadina junto con estos ARV. | |||||||
| Otros | Ganciclovir: riesgo toxicidad hematológica | TDF: evitar la asociación, por aumento del riesgo de fracaso terapéutico. En caso necesario, ajustar dosis. (40% AUC ddI). Sin cambios TDF. Ajuste de dosis ddI: ≥60kg: 250mg/día; <60kg: 200mg/día (en este caso ddI se pueden administrar juntos c/s comida ligera) | Doxorrubicina in vitro interfiere la fosforilación de d4T. Se desconoce la importancia clínica, pero se recomienda un control estrecho de la carga viral | Nefrotóxicos: posible Cp 3TC | Nefrotóxicos: posible Cp FTC precaución con fármacos que se eliminen por vía renal (secreción tubular activa): riesgo de acúmulo de ambos. FTC no ha mostrado efecto inhibidor sobre las principales isoenzimas del citocromo P450 ni sobre la glucuronidación, por lo que no es de esperar que se produzcan interacciones metabólicas importantes a este nivel | Clorpromacina, disulfiram e isoniacida Cp de ambos | ddI: evitar la asociación. En caso necesario, ajustar dosis: Sin cambios TDF. Ajuste de ddI: ⩾60kg: 250mg/día; <60kg: 200mg/día (pueden administrarse juntos c/s comida) Con ATV utilizar ATV/r 300/100mg c/24h |
| Precaución con fármacos que se eliminen por vía renal (secreción activa por el sistema de transporte catiónico orgánico): riesgo de acúmulo de ambos | Se ha descrito un caso de rabdomiolisis grave en un paciente que presentó hipersensibilidad a ABC y recibía tratamiento con fibratos (ciprofibrato 100mg/24h) | Telaprevir: NRAD | |||||
| Probenecid: evitar o reducir 50% ZDV | Con alopurinol, reducir la dosis de ddI a la mitad | Nefrotóxicos, inhibidores o competidores por la secreción tubular renal podrían aumentar la toxicidad de ambos. Aumento de riesgo de toxicidad renal con IP | |||||
| Probenecid podría aumentar las concentraciones plasmáticas de TDF | |||||||
Nota: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias./r: potenciado con ritonavir; 3TC: lamivudina; ABC: abacavir; ARV: antirretrovirales; ATV: atazanavir; AUC: área bajo la curva; BID: pauta de tratamiento administrada 2 veces al día; Cp: concentración plasmática; CPK: creatin-fosfoquinasa; ddC: zalcitabina; d4T: estavudina; FTC: emtricitabina; i.v.: intravenosa; LCR: líquido cefalorraquídeo; MT: metodona; NRAD: no requiere ajuste de dosis; QD: pauta de tratamiento administrada una vez al día; TDF: tenofovir; TPV: tipranavir; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana; ZDV: zidovudina.
El estudio Gilead 903 comparó la eficacia y la seguridad del TDF frente al d4T administrados en combinación con EFV y 3TC en pacientes sin TARV previo. Los 602 pacientes incluidos tenían una media de cifras de linfocitos CD4 de 276–283células/μl y de CVP de 4,91log10 copias/ml. En un análisis por intención de tratamiento (ITT), a las 144 semanas, la proporción de pacientes con CVP inferior a 50copias/ml era del 67,9% en el grupo de TDF y del 62,5% en el de d4T. Entre los tratados con TDF, fue menos frecuente tanto la toxicidad global relacionada con disfunción mitocondrial (el 6 frente al 28%) como la neuropatía periférica (el 3 frente al 10%) o la lipodistrofia (el 3 frente al 19%). Asimismo, este grupo tuvo un mejor perfil lipídico. Por tanto, este estudio apoyó el uso de TDF+3TC+EFV frente al d4T+3TC+EFV como tratamiento de inicio220.
Estudio Gilead 934El estudio aleatorizado Gilead 934 comparó TDF+FTC en pauta de tratamiento administrada una vez al día (QD) frente a ZDV+3TC en pauta de tratamiento administrada 2 veces al día (BID) combinados con EFV. Se incluyó a 517 pacientes sin TARV previo, con una CVP basal de 5log10 y una mediana de linfocitos CD4 de 233–241células/μl, según grupo de tratamiento. En el ITT, a las 48 semanas, se observó que la proporción de pacientes con CVP inferior a 400copias/ml fue del 81% en el grupo de TDF+FTC y del 70% en el grupo de ZDV+3TC (p=0,005). La proporción de pacientes con CVP inferior a 50copias/ml fue del 77 frente al 68%, respectivamente (p=0,034). Las cifras de linfocitos CD4 aumentaron a 190células/μl en el grupo de TDF+FTC frente a 158células/μl en el grupo de ZDV+3TC (p=0,002). Hubo menos efectos adversos en el grupo de TDF+FTC (el 4 frente al 9%; p=0,016) y menos suspensiones de tratamiento por reacciones adversas (el 4 frente al 9%; p=0,016). El 6% de los pacientes tratados con ZDV+3TC tuvo anemia frente al 0% de los tratados con TDF+FTC. El incremento del colesterol fue más bajo y el volumen de grasa en extremidades más alto en el grupo de TDF+FTC (diferencias significativas)221. A las 144 semanas de seguimiento, la proporción de pacientes con CVP inferior a 400copias/ml era del 75% en el grupo de TDF+FTC y del 58% en el grupo de ZDV+3TC (p=0,004), pero sin diferencias en la CVP inferior a 50copias/ml (p=0,08). En caso de fracaso virológico, la mutación M184V/I fue más frecuente en el grupo de ZDV+3TC222. La respuesta inmunológica fue algo mejor en los pacientes tratados con TDF+FTC (312 frente a 271células/μl; p=0,09). Por otra parte, la cantidad de grasa en las extremidades fue mayor en el grupo de TDF+FTC (7,9 frente a 5,4kg; p<0,001)223.
Estudio CNA30024El estudio CNA30024 es un ensayo aleatorizado, doble ciego, que comparó la eficacia y la tolerancia de la ZDV frente al ABC (ambos en BID) combinados con 3TC y EFV. Se incluyó a 649 pacientes sin TARV previo, con una CVP basal media de 4,76–4,81log10 copias/ml y una media de linfocitos CD4 de 256–267células/μl. A las 48 semanas, la eficacia virológica fue similar en ambos grupos. Alrededor del 70% alcanzaron una CVP inferior a 50copias/ml (ITT). Sin embargo, el incremento de linfocitos CD4 fue significativamente superior en el grupo tratado con ABC (mediana: 205 frente a 155células/μl). Un 8% de los pacientes que tomaron ABC desarrolló RHS. Sobre la base de los resultados de este estudio, se considera que el ABC es equivalente a la ZDV en eficacia antiviral, aunque debe tenerse en cuenta el riesgo de aparición de la RHS224.
Estudio CNA30021El estudio CNA30021 es un ensayo aleatorizado que comparó la eficacia del ABC en QD frente a BID. Incluyó a 770 pacientes sin TARV previo. Los pacientes recibieron ABC en dosis de 600mg en QD o ABC en dosis 300mg en BID, además de 3TC (300mg en QD)+EFV (600mg en QD). A las 48 semanas, el porcentaje de pacientes que alcanzó una CVP inferior a 50copias/ml (ITT) fue del 66% en la rama QD y del 68% en la rama BID. El estudio demostró la equivalencia de las 2 pautas de administración de ABC. Las RHS a ABC (grado 3–4) fueron más frecuentes en la rama QD que en la BID (el 5 frente al 2%)225.
Estudio ABCDEEl ABCDE es un ensayo clínico abierto que incluyó a 237 pacientes aleatorizados para recibir ABC o d4T en combinación con 3TC+EFV. A las 96 semanas, la proporción de pacientes con CVP inferior a 50copias/ml fue mayor en los tratados con ABC (el 60,9 frente al 47,5%; p=0,05). El grupo tratado con d4T presentaba lipoatrofia clínicamente aparente (para médico y paciente) en el 38,3% de los casos, significativamente superior al 4,8% de los que recibieron ABC226.
Estudio PREDICTEl ensayo clínico PREDICT ha demostrado que la incidencia de RHS a ABC puede disminuir drásticamente mediante la genotipificación del alelo HLA B*5701109. En este ensayo clínico, la prueba de genotipificación del alelo HLA B*5701 tuvo un valor predictivo negativo del 100% para descartar la RHS a ABC confirmada mediante prueba cutánea.
Estudio FTC 301-AEl FTC 301-A es un ensayo clínico aleatorizado y doble ciego que comparó la eficacia y la tolerancia de la FTC frente a la d4T, ambos en combinación con ddI+EFV. Se incluyó a 571 pacientes sin tratamiento previo, con una media de linfocitos CD4 de 312–324células/μl y una media de CVP de 4,8log10. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml para los grupos de FTC y d4T fue del 74 y del 58% (p<0,0001). El incremento de los linfocitos CD4 fue mayor en el grupo de FTC (168 frente a 134células/μl; p<0,05). La proporción de pacientes que discontinuaron por efectos adversos fue mayor en el grupo de d4T+ddI (el 16,6 frente al 7,4%; p=0,0028). Los pacientes tratados con d4T+ddI tuvieron mayor incidencia de neuropatía periférica, diarrea y náuseas227.
Estudio Gesida 3903El Gesida 3903 es un ensayo clínico aleatorizado y abierto que estudió la eficacia de la combinación ddI+3TC en QD. En este ensayo se compararon ddI (400mg en QD o 250mg si el peso del paciente era inferior a 60kg, tomados con o sin comida)+3TC (300mg en QD) frente a ZDV+3TC (coformulados, 300/150mg en BID) en 369 pacientes sin TARV previo. Todos los pacientes recibieron además EFV (600mg en QD). A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 70% en el grupo de ddI+3TC y del 63% en el grupo de ZDV+3TC (p=0,154; diferencia: 7,1%; IC95%: 2,39–16,59). El estudio demostró que la pauta ddI+3TC no presentaba inferioridad frente a ZDV+3TC. La discontinuación del tratamiento por efectos adversos fue menor en el grupo de ddI+3TC (el 14, 8 frente al 26%; p=0,046), así como la toxicidad hematológica y la anemia (el 1 y el 6%; p=0,003). No hubo diferencias en cuanto a la recuperación inmunológica, ni en la prevalencia de lipoatrofia o lipoacumulación, valorada por criterio del investigador228.
Estudio ACTG-384El ACTG-384 es un estudio que valoró la eficacia y la tolerancia de las distintas combinaciones de AN cuando se asocian a un tercer fármaco (NN o IP). Este ensayo clínico aleatorizado se planteó responder a 3 preguntas: 1) ¿es mejor empezar con ddI+d4T o ZDV+3TC como combinación de AN?; 2) ¿es mejor empezar con un IP (nelfinavir [NFV]) o un NN (EFV)?, y 3) ¿es mejor utilizar combinaciones secuenciales de 3 FAR o una combinación de 4? Se incluyó a 980 pacientes sin TARV previo, con una mediana de linfocitos CD4 de 278células/μl y una CVP basal de 4,9log10 copias/ml. Los grupos del estudio fueron: 1) d4T+ddI+EFV→ZDV+3TC+NFV; 2) d4T+ddI+NFV→ZDV+3TC+EFV; 3) ZDV+3TC+EFV→d4T+ddI+NFV; 4) ZDV+3TC+NFV→d4T+ddI+EFV; 5) d4T+ddI+EFV+NFV, y 6) ZDV +3TC+EFV+NFV. El punto de valoración final primario fue el tiempo hasta el fracaso de 2 regímenes secuenciales de 3 FAR o el primer fracaso de regímenes de 4. La mediana de seguimiento fue de 2,3 años. Desafortunadamente, el diseño factorial fue frustrado por el hecho de que las combinaciones de AN no fueron independientes del efecto del tercer fármaco. La actividad del EFV fue diferente cuando se combinó con ZDV+3TC que con ddI+d4T, y la actividad de la combinación de ZDV+3TC varió según si se combinaba inicialmente con EFV o NFV. Por estas razones el análisis factorial no se pudo realizar. Sin embargo, de los datos de este estudio se pueden hacer varias observaciones: 1) en relación con el tiempo hasta el primer fracaso virológico, es significativamente mejor iniciar el tratamiento con ZDV+3TC+EFV que con d4T+ddI+EFV o ZDV+3TC+NFV; 2) si el tratamiento se inicia con ZDV+3TC+EFV, no existe beneficio significativo al añadir NFV como cuarto fármaco, y 3) d4T+ddI producen más efectos tóxicos que ZDV+3TC. Los resultados de este estudio avalarían la combinación de ZDV+3TC+EFV como tratamiento de inicio217,229.
Estudio ACTG 5175En el ensayo clínico ACTG 5175 se comparó la combinación ZDV+ 3TC+EFV con TDF+FTC+EFV y con ddI+FTC+atazanavir (ATV) (sin potenciar con RTV) en 1.571 pacientes sin tratamiento previo230. Después de una mediana de seguimiento de 72 semanas, el comité de control y seguridad del estudio decidió suspender el grupo de tratamiento con ddI+FTC+ATV debido a una tasa significativamente mayor de fracaso terapéutico.
Estudio HEATEn el estudio HEAT se comparó la combinación ABC+3TC con la combinación TDF+FTC en 688 pacientes sin tratamiento previo. Todos los pacientes recibieron además LPV/r en cápsulas una vez al día. Los datos disponibles a las 48 y a las 96 semanas231,232 avalan que la pauta ABC+3TC no presenta inferioridad frente a TDF+FTC cuando se administran junto a LPV/r una vez al día. Tras 96 semanas de seguimiento, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 60% en el grupo de ABC+3TC y del 58% en el grupo de TDF+FTC. La tasa de fracaso virológico confirmado fue del 12% en el grupo de ABC y del 11% en el grupo de TDF. Tampoco hubo diferencias significativas en el subgrupo de pacientes que iniciaron tratamiento con más de 100.000copias/ml, aunque el estudio no tiene poder para demostrar que la pauta ABC+3TC no presenta inferioridad en pacientes con CVP elevadas.
Estudio ACTG 5202El estudio ACTG 5202 es un ensayo clínico factorial que comparó ABC+3TC y TDF+FTC en 1.858 pacientes sin tratamiento previo. Los pacientes fueron aleatorizados además para recibir ATV potenciado con RTV (ATV/r) o EFV. En el subgrupo de pacientes que iniciaron el TARV con una CVP superior a 100.000copias/ml, el tiempo hasta el fracaso virológico fue más corto en los que recibieron ABC+3TC y el número de efectos adversos grado 3–4 fue mayor. Después de una mediana de seguimiento de 60 semanas, el porcentaje de pacientes con fracaso virológico fue del 14% en el grupo de ABC+3TC y del 7% en el grupo de TDF+FTC (P=0,0003). Si el paciente había alcanzado una CVP inferior a 50copias/ml, entonces no hubo diferencias en cuanto a fracaso posterior independientemente de la pareja de nucleósidos recibida233.
Estudio ASSERTEl estudio ASSERT es un ensayo clínico abierto y multicéntrico que comparó las pautas ABC+3TC y TDF+3TC, ambos en combinación con EFV, en 385 pacientes sin tratamiento previo. El objetivo primario fue demostrar una seguridad renal superior para ABC+3TC frente a TDF+FTC. Los cambios en el filtrado glomerular estimado a las 48 semanas fueron similares en ambos grupos. No obstante, la proporción de pacientes que consiguieron una CVP indetectable (<400copias/ml) a las 48 semanas fue inferior en el grupo con ABC+3TC respecto al del grupo con TDF+FTC (el 67 y el 77%, respectivamente; p=0,049), al igual que para una CVP inferior a 50copias/ml (el 59 y el 71%, respectivamente; p=0,022)234.
Metaanálisis que compara la base de nucleósidos abacavir+lamivudina con tenofovir+emtricitabinaEn un reciente metaanálisis se analizaron datos de 12 ensayos clínicos en los que se utilizaron TDF+FTC (3.399) o ABC+3TC (1.769) en combinación con IP/r. En los ensayos que utilizaron LPV/r, ATV/r y fosamprenavir (FPV) potenciado con RTV (FPV/r) como tercer fármaco, la tasa de respuesta (por ITT, el tiempo hasta la pérdida de respuesta virológica [TLOVR], ITT-TLOVR) fue significativamente inferior para ABC+3TC que para TDF+FTC (el 68,8 frente al 76,1%; p=0,0015). En pacientes con carga viral basal inferior a 100.000copias/ml, la diferencia fue del 70,1% para ABC+3TC frente al 80,6% para TDF+FTC (p=0,0161), mientras que en los que tenían una carga basal superior a 100.000copias/ml, la diferencia rozó la significación estadística (el 67,5 frente al 71,5%; p=0,0523)235.
Cohortes que avalan las recomendaciones de uso de inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótidoEstudio D:A:DEn la cohorte del estudio D:A:D se ha comunicado que el uso reciente (pero no el acumulado) de ABC (definido como estar recibiéndolo en el momento actual o haberlo suspendido durante los últimos 6 meses) se asoció con un incremento de 1,9 veces del riesgo de tener un infarto de miocardio (comparado con los pacientes que no han utilizado recientemente ABC). Esta asociación persistía después del ajuste por otros factores de riesgo. El riesgo de infarto de miocardio no estaba aumentado en los pacientes que hacía más de 6 meses que habían comenzado el tratamiento con ABC o en los que se había suspendido más de 6 meses antes. El aumento del riesgo de infarto de miocardio fue más relevante desde el punto de vista clínico en aquellos pacientes que ya tenían un riesgo cardiovascular alto según la ecuación de Framingham. En este estudio también se encontró un incremento significativo del riesgo de infarto de miocardio asociado al uso reciente de ddI, si bien la magnitud de la asociación fue menor236.
Estudio SMARTEn el estudio SMART, que también ha evaluado la asociación entre el uso de ABC y el riesgo de enfermedad cardiovascular en el grupo de pacientes aleatorizados para continuar el TARV, se ha observado una asociación significativa entre estar recibiendo ABC y un incremento del riesgo de tener un infarto de miocardio (HR: 4,3), lo que es más evidente en los pacientes que ya tenían múltiples factores de riesgo o alteraciones electrocardiográficas en el momento basal237.
Otras cohortesEn una revisión de múltiples ensayos de ABC (9.639 pacientes,7.485 personas/año de seguimiento) no se ha encontrado una asociación entre el uso de este AN y el riesgo de tener un infarto de miocardio238.
Resumen de los datos de ensayos y cohortesLa pauta TDF+FTC es más eficaz y tiene menos riesgo de lipoatrofia que la combinación ZDV+3TC. La combinación ABC+3TC tiene una eficacia similar a la ZDV+3TC, con menor riesgo de lipoatrofia, y ha demostrado que no presenta inferioridad frente a la pauta TDF+3TC cuando ambas se administran con LPV/r. El riesgo de fracaso virológico es mayor con la pauta ABC+3TC que con la pauta TDF+3TC en pacientes con CVP elevadas cuando ABC+3TC se administra con EFV o ATV/r233. No se han realizado grandes estudios de la combinación TDF+3TC con un IP como tratamiento inicial, pero sí de TDF+FTC (con ATV/r, FPV/r, LPV/r, darunavir [DRV] potenciado con RTV [DRV/r] y saquinavir [SQV] potenciado con RTV [SQV/r]). No existe experiencia de ensayos clínicos de la combinación ABC+3TC con NVP, pero sí con ATV/r, LPV/r, FPV/r239–241.
La combinación ddI+3TC asociada a EFV no es inferior a ZDV+3TC+EFV228. No hay datos sobre el riesgo de lipoatrofia de la combinación ddI+3TC medida por DEXA. No existe experiencia de las combinaciones ddI+FTC con NVP ni con IP. La combinación d4T+3TC ha demostrado su eficacia en múltiples estudios, pero produce más alteraciones del metabolismo de los lípidos, lipodistrofia y neuropatía periférica que la combinación TDF+3TC.
Recomendaciones sobre inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido
Combinaciones preferentes
- •
Las combinaciones de AN de elección para regímenes de inicio son TDF+FTC (o 3TC) o ABC+3TC (o FTC). Siempre que sea posible se recomienda el uso de nucleósidos coformulados (nivel A).
- •
La combinación ABC+3TC debe ser empleada con precaución en pacientes con CVP elevadas (>100.000copias/ml) (nivel A).
- •
Aunque no hay datos para concluir que la combinación ABC+3TC incrementa el riesgo de tener un infarto de miocardio, se debe usar con precaución en pacientes con riesgo cardiovascular elevado (nivel B).
Combinaciones alternativas
- •
Combinaciones de AN alternativas son ddI+3TC (nivel A) y ddI+FTC, aunque de esta sólo existen datos de la combinación ddI+FTC de un ensayo clínico, por lo que su perfil de seguridad no está firmemente establecido.
- •
Otras combinaciones alternativas son ZDV+3TC (o FTC) y ZDV+ddI 221,223.
Combinaciones no recomendadas
- •
No se recomiendan las combinaciones d4T+ddI por toxicidad, TDF+ddI por toxicidad y menor eficacia242–246, ZDV+d4T por antagonismo, FTC+3TC por similar perfil de resistencias y pocos beneficios clínicos (tabla 4)2,3,212,247.
En resumen, la elección final de la combinación de AN deberá individualizarse teniendo en cuenta las características del fármaco, la situación clínica y las preferencias del paciente. Las pautas sencillas pueden facilitar la adherencia. Estas incluyen FAR que se administran una vez al día (ABC, ddI, FTC, 3TC y TDF) o coformulados en dosis fijas (TDF+FTC o ABC+3TC).
Combinaciones de tratamiento antirretroviral con 3 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótidoLas combinaciones de 3 AN han demostrado eficacia virológica e inmunológica en varios estudios, pero con resultados inferiores cuando se han comparado a combinaciones de 2 AN con un IP/r o NN.
Existe una coformulación con la asociación ZDV+3TC+ABC que permite su administración en forma de un comprimido en BID, pauta atractiva desde el punto de vista de la adherencia. Otros estudios comparan esta combinación con pautas que contienen IP o NN.
Ensayos que avalan las recomendaciones de uso de 3 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótidoEstudio ACTG A5095El ACTG A5095 es un estudio aleatorizado y controlado con placebo que evaluó la eficacia y la tolerancia de 3 regímenes: 1) ZDV+3TC+ABC (Trizivir®); 2) ZDV+3TC+EFV, y 3) ZDV+3TC+ABC+EFV en pacientes sin tratamiento previo. Se incluyó a 1.147 pacientes con una mediana de linfocitos CD4 de 238células/μl y una CVP de 71.434copias/ml. Tras una mediana de seguimiento de 32 semanas, los pacientes tratados con ZDV+3TC+ABC tuvieron mayor fracaso virológico (el 21 frente al 11% en los otros grupos) y en un tiempo más corto (p<0,001), independientemente del nivel de CVP. Dado que a las 48 semanas la proporción de pacientes con CVP inferior a 200copias/ml era del 74% en el grupo con 3 AN y del 89% en los otros 2 (ITT), el comité de seguridad recomendó que el grupo de ZDV+3TC+ABC se interrumpiese y que el estudio continuase de forma ciega con los pacientes de los grupos que contenían EFV209. Estos resultados han hecho que se replantee el papel de la pauta ZDV+3TC+ABC en el tratamiento de inicio y se considere una alternativa de otras opciones más eficaces.
A los 3 años de seguimiento, la pauta ZDV+3TC+ABC+EFV no demostró ser superior a la pauta ZDV+3TC+EFV. La proporción de pacientes con CVP inferior a 200 y a 50copias/ml en las 2 ramas del estudio fue del 90 y el 92% (p=0,59) y del 85 y el 88% (p=0,39), respectivamente. El ensayo A5095 demostró que la adición de un tercer AN a un régimen que incluya 2 AN y EFV no incrementa la respuesta virológica248.
Estudio CNA3005El CNA3005 es un estudio controlado con placebo, doble ciego y de equivalencia, que comparó ZDV+3TC+ABC frente a ZDV+3TC+IDV. La principal conclusión fue que ambos regímenes eran equivalentes para alcanzar una CVP inferior a 400copias/ml, pero en los pacientes con CVP superior a 100.000copias/ml, el régimen con ABC era inferior al de IDV para conseguir una CVP inferior a 50copias/ml211.
Estudio CLASSEl estudio CLASS comparó la eficacia virológica de una pauta basada en NN (EFV) frente a un IP/r (amprenavir potenciado con RTV [APV/r]) o una pauta con 3 AN (d4T), todos ellos combinados con ABC y 3TC. Los datos preliminares a las 48 semanas (ITT) mostraron la superioridad de la pauta de EFV frente a las otras (pacientes con CVP inferior a 50copias/ml: el 76, el 59 y el 62%, respectivamente)249.
Estudio ESS30009El estudio ESS30009 comparó la administración en QD de 3 AN (TDF+3TC+ABC) frente a la combinación de ABC+3TC+EFV. Se observó una falta de respuesta virológica temprana (descenso de CVP de 2log10 o más a las 8 semanas o incremento de 1log10 sobre el nadir alcanzado) en el grupo de pacientes con 3 AN. Entre los pacientes que llegaron a las 12 semanas, se consideraron no respondedores al 49% en el grupo de 3 AN y al 5% en el grupo de EFV (p<0,001). El análisis genotípico de los 14 aislados de los no respondedores (grupo con 3 AN) mostraron la mutación M184V, 8 de ellos tenían la K65R, que puede reducir la susceptibilidad a TDF y a ABC250.
Otros estudiosEn un estudio piloto con ddI+3TC+TDF, el 91% de los pacientes tuvo un fracaso virológico (descenso de la CVP de 2log10 o menos a las 12 semanas). La mutación M184I/V se detectó en el 95% de los pacientes y el 50% tenía también la K65R.
En otro estudio reciente, se comparó la eficacia y la tolerancia de la pauta d4T+ddI+ABC frente a SQV+RTV (400/400mg en BID)+ZDV+3TC frente a NFV+NVP+ZDV+3TC. Se incluyó a 180 pacientes, con una mediana de linfocitos CD4 de 161células/μl y una CVP de 5log10. A las 48 semanas, la proporción de pacientes con CVP inferior a 20copias/ml fue inferior en el grupo de 3 AN (el 43, el 62 y el 69%, respectivamente), los efectos secundarios fueron más frecuentes en este grupo251.
Además, en un estudio multicéntrico español no comparativo en el que se le inició TARV a pacientes con 4 AN (Trizivir®+TDF) a los que se los siguió hasta las 96 semanas, la proporción de pacientes con CVP inferior a 50copias/ml era del 63% (ITT) y del 87% (análisis «en tratamiento»). Los resultados fueron mejores si la CVP era inferior a 5log10 o la cifra de linfocitos CD4 era superior a 250células/μl252.
El estudio TIMS comparó la combinación de 4 AN (Trizivir®+TDF) frente a ZDV+3TC+EFV en 113 pacientes. Tras 48 semanas de seguimiento, la proporción de pacientes con CVP inferior a 50copias/ml era del 67% (ITT) en el grupo de 4 AN y del 67% en el grupo de ZDV+3TC+EFV253.
Recomendaciones sobre las combinaciones de 3 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido
- •
Un régimen con ZDV+3TC+ABC con o sin TDF debería usarse solamente cuando no pueda usarse otra pauta más potente (nivel A).
- •
No se recomienda utilizar d4T+ddI+ABC (nivel A). El comité recomienda no utilizar en ningún momento pautas con 3 AN con ABC+3TC+TDF o ddI+3TC+TDF (nivel A).
- •
No deben usarse otras combinaciones de 3 AN en una pauta de TARV porque no existe experiencia.
En España hay 3 NN comercializados: NVP, EFV y etravirina (ETR). Sus principales características se describen en la tabla 63,247. El EFV y la NVP son inductores del CYP y pueden interaccionar con otros fármacos. El EFV se administra en QD (1 comprimido de 600mg/día) y la NVP se puede administrar tanto en BID (200mg/12h) como en QD (400mg/día)254–256; durante los primeros 14 días se administra un comprimido al día. La ETR se administra en BID (200mg/12h).
Inhibidores de la transcriptasa inversa no nucleósidos
| Nombre genérico | Nevirapina | Efavirenz | Etravirina |
| Nombre comercial | Viramune® | Sustiva® | Intelence® |
| ¿Atripla® | |||
| Dosis recomendada | 200mg QD×14 días seguidas de 200mg BID | 600mg QD | 200mg BID (dispersable en agua) |
| Presentaciones comerciales | Comprimidos 200mg | Cápsulas 50, 100 y 200mg y 600mg | Comprimidos 100mg |
| Biodisponibilidad oral | > 90% | 66% (aumenta con comida con contenido graso) | |
| Cmáx | 200mg/24h: 3,6μg/ml (13,51μM) | 4,07μg/ml (12,9μM) | 4,51μg/ml |
| 400mg/24h: 4,5μg/ml (17μM) | |||
| Cmín | 1,9μg/ml (7,13μM) | 1,77μg/ml (5,6μM) | 1,85μg/ml |
| Concentración inhibitoria | CI50: 0,0026–0,026μg/ml (0,01–0,1μM) | CI 90–95: 0,00014–0,0021μg/ml (0,00046–0,0068μM) | (0,0014–0,0048μM) |
| Actividad | VIH-1 | VIH-1 | VIH-1 |
| Niveles de LCR | 45% | 69% | No disponible |
| Semivida de elimininacón plasmática | 25–30h | 40–50h | 35–40h |
| Restricción dietética | Con o sin alimentos | Con o sin alimentos | Con alimentos o bebida energética |
| Metabolización | Hepática CYP3A4 (Inducción) | Hepática CYP3A4 (inducción-inhibición) | Hepática: |
| |||
| Excreción | Renal 80% | Renal 34% | Renal:<1,2% |
| Heces 10% | Heces 16–61% | Excrección fundamentalmente por heces | |
| Efectos adversos | Exantema | Exantema | Exantema |
| Aumento de transaminasas y | Síntomas neuropsiquiátricos | Náuseas | |
| Hepatitis aguda | Aumento de las transaminasas | Diarrea | |
| Teratogenicidad en monos | |||
| Interacciones | |||
| Asociaciones contraindicadas | Anticonceptivos orales | Anticonceptivos orales | Carbamacepina |
| Etravirina | Astemizol | EFV | |
| Hypericum (hierba de San Juan) | Carbamacepina | Fenitoina | |
| Ketoconazol | Cisaprida | Fenobarbital | |
| Itraconazol | Claritromicina | Hypericum (hierba de San Juan) | |
| Rifampicina | Deriv. Ergotamina | NVP | |
| Saquinavira | Etravirina | Rifampicina | |
| Voriconazol | Hipericum (hierba de S. Juan) | TPV/r | |
| Itraconazol | IP no potenciado | ||
| Midazolam | |||
| Pimozida | |||
| Posaconazol | |||
| Saquinavir (como único IP) | |||
| Terfenadina | |||
| Triazolam | |||
| Voriconazol (evitar/ajustar dosis) | |||
| Antiácidos | No se ha observado interacción significativa | No se ha observado interacción significativa | Teóricamente no es de esperar una interacción significativa |
| Inhibidores de la bomba de protones | Teóricamente no es de esperar una interacción significativa | Ausencia de interacción | NRAD (↑41% AUC ETR) |
| Antihistamínicos H2 | Teóricamente no es de esperar una interacción significativa | Ausencia de interacción | NRAD (↓14% AUC ETR) |
| Antimicobacterianos: | ↓Cmín y AUC NVP del 35 a más del 50%. Resultados clínicos discordantes. No aumentar la dosis de NVP por mayor toxicidad. No emplear pautas de NVP QD con rifampicina | ||
| Rifampicina | Precaución-monitorizar estrechamente eficacia | NRAD (↓25% AUC EFV) | No hay datos. No se recomienda dado que se prevé una importante reducción de las concentraciones de ETR |
| Rifabutina | NRAD | 450–600mg/día rifabutina o 450–600mg 3veces /semana | NRAD (↓37% AUC ETR) |
| Claritromicina | NRAD | ↓39% AUC claritromicina | ↓39% AUC claritro, ↑42% AUC ETR |
| Buscar alternativa (azitromicina) para el tratamiento de MAC | Buscar alternativa (azitromicina) para el tratamiento de MAC | ||
| Antiepilépticos: | Precaución. Monitorizar niveles de ambos fármacos | Precaución. Monitorizar niveles de antiepiléptico | No hay datos |
| Carbamazepina | Carbamacepina: no recomendado (↓47% Cmín EFV con 400mg c/24h de CBZ; ↓35% Cmín CBZ). | ||
| fenitoína, fenobarbital | Fenitoína: algun caso descrito de fenitoína y ↓ EFV a niveles indetectables (evitar o monitorizar niveles de ambos) | ||
| Anticoagulantes orales | Teóricamente NVP podría aumentar o reducir el INR. Monitorizar estrechamente | Teóricamente NVP podría aumentar o reducir el INR (un caso descrito que requirió reducir dosis de warfarina). Monitorizar estrechamente | Teóricamente NVP podría aumentar o reducir el INR. Monitorizar estrechamente |
| Anticonceptivos orales: | ↓19% AUC etinilestradiol. Utilizar métodos alternativos | ↑37% AUC etinilestradiol (no hay datos con dosis múltiples). Utilizar métodos alternativos | Ausencia de interacción |
| Antifúngicos | Anfotericina B: NRAD | Anfotericina B: NRAD | Anfotericina B: NRAD |
| Caspofungina: considerar un aumento de la dosis de mantenimiento de caspofungina a 70mg/dFluconazol: No recomendable (↑100% AUC NVP con toxicidad)Itraconazol, ketoconazol y voriconazol: contraindicados | Caspofungina: considerar un aumento de la dosis de mantenimiento de caspofungina a 70mg/dFluconazol: NRAD | Los antifúngicos imidazólicos pueden aumentar las concentraciones plasmáticas de etravirina. Etravirina podría reducir las concentraciones plasmáticas de itraconazol y ketoconazol por aumento de su metabolismo a través del CYP3A4Fluconazol: NRAD (AUC de fluconazol sin cambios; 86% AUC ETR | |
| Itraconazol: No recomendable (sólo con monitorización de niveles de ambos fármacos; un caso de histoplasmosis tratada con éxito con TDM y ajuste a 800mg/d de itraconazol y 400mg/d de EFV) | Voriconazol: 36% AUC voriconazol; 14% AUC ETR | ||
| Posaconazol: contraindicado (↓ 50% AUC posacon) | |||
| Voriconazol: No recomendable (solo con monitori-zación de niveles de ambos fármacos)(aumentar dosis de voriconazol a 400mg/12 y posible disminución de EFV a 300mg/d) | |||
| Estatinas: | Con atorvastatina, lovastatina y simvastatina, monitorizar eficacia estatina. Con fluvastatina y pravastatina interacción poco probable | Se han descrito reducciones del 58% en el AUC de simvastatina, del 43% en el AUC de atorvastatina y del 40% en el AUC de pravastatina. No hay datos para lovastatina y fluvastatina. Algunos pacientes pueden requerir aumento de dosis, que debe realizarse de forma gradual | NRAD (↓37% AUC de atorvastatina, 27% AUC 2-OH-atorvastatina) |
| Fármacos empleados para tratar la influenza | Amantadina/oseltamivir/zanamivir: teóricamente no deben esperarse interacciones | ||
| Inmunosupresores: | Posible ↓Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/eficacia del inmunosupresor. La dosis de ciclosporina y tacrolimus, una vez ajustada, se mantiene más o menos constante a lo largo del tiempo. En pacientes con TOH, la dosis de tacrolimus requerida en pacientes tratados con NVP fue similar a la utilizada en VIH negativos | Con ciclosporina una vez ajustada la dosis, ésta se mantiene más o menos constante a lo largo del tiempo. Sin embargo, EFV redujo de forma importante los niveles de tacrolimus en pacientes con TOH. Con el resto, teóricamente posible ↓Cp (aunque también podría Cp) de prednisona y sirolimus. Monitorizar niveles/eficacia-toxicidad del inmunosupresor | No hay datos. ETR podría reducir la Cp de ciclosporina, tacrolimus y sirolimus (monitorizar) |
| Interferón/ribavirina | Ribavirina: no existe evidencia de interacción con los no nucleósidos. Interferón: su vía de eliminación no está claramente establecida así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado p. ej. Cp de teofilina y barbitúricos). No hay datos con respecto a posibles interacciones con los no nucleósidos. Se recomienda una monitorización más estrecha de los efectos secundarios a nivel de SNC con la combinación de efavirenz e interferón | No hay datos. Teóricamente no es de esperar una interacción significativa | |
| Metadona | Posible síndrome abstinencia | Posible síndrome abstinencia | Ausencia de interacción |
| Puede requerir dosis MT del 8°–10° día | Puede requerir dosis MT del 8°–10° día. Buprenorfina podría ser una alternativa con menor riesgo de sd. abstinencia (datos limitados) | ||
| Antirretrovirales IP | |||
| IDV | ↓30% AUC IDV. Valorar ↑ 1000mg c/8h IDV en función de sus Cp (elevada variabilidad interindividual) o usar IDV/r 800/100mg c/12h. NRAD NVP | ↓31% AUC IDV con 200mg/día de EFV. ↑ 1000mg c/8h IDV o usar IDV/r 800/100mg c/12h. NRAD EFV | Evitar el uso de IDV no potenciado con TMC125. No hay estudios con IDV/r |
| RTV | NRAD | NRAD (↑18% AUC RTV) | NRAD en dosis potenciación. |
| Contraindicado con RTV a dosis plenas (↓46% AUC ETR) | |||
| SQV | No recomendado con SQV no potenciado (↓27% AUC SQV)a | No recomendado con SQV no potenciado (↓62% AUC SQV)b | NRAD con SQV potenciado |
| NRAD NVP | |||
| NFV | NRAD | Si bien los estudios en voluntarios sanos no mostraron interacción, un estudio en pacientes naive mostró a las 32 semanas una tendencia no significativa a ↓Cmáx y AUC NFV y ↓Cmín NFV significativa | No hay datos. Asociación no recomendada |
| FPV | NRAD (FPV/r 700/100mg c/12h) | NRAD (FPV/r 700/100mg c/12h) | ETR sin cambios. 69% AUC FPV/r (700/100mg/12h)(contrariamente a lo esperado) Considerar reducción de dosis de FPV (no hay información suficiente para recomendar un ajuste de dosis) |
| Valorar aumento de dosis de RTV en QD (300mg) | Valorar aumento de dosis de RTV en QD (300mg) | ||
| LPV/r | ↓22% AUC/↓55% Cmín LPV. Valorar 600/150mg c/12h (variabilidad interindividual elevada. Si es posible, determinar niveles plasmáticos LPV). NRAD NVP | ↓20–25% AUC LPV. Valorar 600/150mg c/12h. (variabilidad interindividual elevada. Si es posible, determinar niveles plasmáticos LPV)NRAD NVP | Formulación meltrex de LPV/r: NRAD (LPV sin cambios, ↓35% AUC de ETR)NRAD EFV |
| ATV/r | ↓33% Cmín, ↓60% AUC ATV. No se recomienda en pacientes pretratados. Ajuste de dosis de ATV/r en pacientes naive a 400/100mg c/24h. Se recomienda monitorizar niveles de ATV | ↓42% Cmín ATV. No se recomienda en pacientes pretratados. Ajuste de dosis ATV/r en pacientes naive a 400/100mg /24h. Se recomienda monitorizar niveles de ATV | Utilizar ATV/r (↑30% AUC ETR y ↓17% AUC ATV |
| TPV/r | NRAD | NRAD | Asociación contraindicada (↓76% AUC ETR y ↑18% el AUC de TPV) |
| Darunavir/ritonavir | NRAD | NRAD (↑21% AUC EFV y ↓13% AUC DRV) | NRAD (↓37% AUC ETR y ↑6% AUC DRV) |
| Inhibidores de la integrasa | |||
| RTG | NRAD | NRAD (↓36% AUC RAL) | NRAD (↓10% AUC RAL, ↓ 34% Cmín de RAL). Debido a la amplia variabilidad de la PK de RAL se han descrito Cmín95 (14,6ng/ml) en algunos pacientes. Significado clínico incierto |
| Inhibidores del correceptor CCR5 | |||
| MVC | NRAD | En ausencia de inhibidores enzimáticos potentes debe aumentarse la dosis de MVC a 600mg c/12h. Si se coadministran inhibdores (ej. IP/r) la dosis de MVC será de 150mg/12hc | En ausencia de inhibidores enzimáticos potentes debe aumentarse la dosis de MVC a 600mg c/12h. Si se coadministran inhibdores (ej. IP/r) la dosis de MVC será de 150mg/12hc |
| Otros | Puede ↓ Cp de los fármacos metabolizados a través del CYP3A4d | Atovacuona/proguanilo:↓ 68% AUC atovacuona y ↓ 58% AUC de proguanilo. Valorar aumento de dosis (datos limitados procedentes de la comparación de datos de pacientes con datos históricos de voluntarios sanos sin TARV | Puede Cp de los fármacos metabolizados a través del CYP3A4d aunque es más probable que las ↓ |
| Sildenafilo: (↓41–57% AUC sildenafilo) (puede requerir aumento de dosis) | |||
| Puede Cp de los fármacos metabolizados a través del CYP3A4d aunque es más probable que las ↓ | |||
| Paroxetina: ausencia de interacción | |||
| Digoxina: ausencia de interacciones | |||
Nota: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias.
/r: potenciado con ritonavir; AUC: área bajo la curva de concentraciones plasmáticas frente al tiempo (exposición al fármaco); ATV: atazanavir; BID: pauta de tratamiento administrada 2 veces al día; CBZ: carbamacepina; Cp: concentración plasmática; EFV: efavirenz; ETR: etravirina; FPV: fosamprenavir; IDV: indinavir; INR: cociente internacional normalizado; IP: inhibidor de la proteasa; LCR: líquido cefalorraquídeo; LPV: lopinavir; MAC: micobacterium avium complex; MVC: maraviroc; NRAD: no requiere ajuste de dosis; NVP: nevirapina; PK: farmacocinética; QD: pauta de tratamiento administrada una vez al día; RAL: raltegravir; RTV: ritonavir; SQV: saquinavir; TARV: tratamiento antirretroviral; TDM: monitorización de niveles plasmáticos; TPV: tipranavir; VIH: virus de la inmunodeficiencia humana.
Categorías seguridad embarazo (FDA): A=ausencia de riesgos para el feto; B=no teratogenicidad en animales, falta de estudios en humanos; C=no datos de seguridad en embarazadas y los estudios en animales muestran toxicidad fetal o no se han realizado y no deben utilizarse dichos fármacos, a menos que el beneficio potencial supere el posible riesgo fetal.
Saquinavir en cápsulas duras (Invirase®) puede asociarse con nevirapina si se combina con ritonavir (SQV/RTV 1000/100mg c/12h), en cuyo caso datos preliminares han mostrado buenos resultados.
Saquinavir puede asociarse con la dosis habitual de efavirenz si se combina con ritonavir (1000/100–200mg c/12h).
En presencia de inhibidores enzimáticos potentes como los IP (excepto TPV/r y FPV/r), antifúngicos imidazólicos (ketoconazol, itraconazol), macrólidos (eritromicina, claritromicina), nefazodona o telitromicina el efecto inhibidor predomina sobre el efecto inductor enzimático y por lo tanto, se recomienda reducir la dosis de maraviroc a 150mg c/12h. Maraviroc no debe combinarse con dos inductores potentes, p. ej., rifampicina+efavrienz.
Principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, amprenavir, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dexametasona, diazepam, disopiramida, estazolam, etionamida, fentanilo, finasterida, fluracepam, glipizida, itraconazol, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, sertralina, sildenafilo (Viagra®), vardenafilo, tadalafilo, tacrolimus, vincristina y zolpidem.
En el ensayo Combine se comparó la eficacia de la NVP frente al NFV257. Es de destacar que el ensayo no tenía suficiente poder estadístico para evaluar la equivalencia entre ambas pautas. El número de pacientes incluidos con CVP elevada (>100.000copias/ml) fue bajo y no se observaron diferencias entre NVP y NFV. En una recopilación de diversos estudios con NVP en pacientes sin TARV previo, el 83% de los que tenían CVP superior a 100.000copias/ml tenían CVP indetectable a los 6 meses258.
Ensayo ARTENEn el ensayo ARTEN se comparó la eficacia y la seguridad de la NVP administrada una o 2 veces al día frente al ATV/r, ambos combinados con TDF/FTC. Se trata de un ensayo aleatorizado, abierto y multicéntrico, que incluyó a 569 pacientes (sin tratamiento previo; con cifras de linfocitos CD4 inferiores a 250células/μl en mujeres y a 400células/μl en varones). El fracaso virológico se definió por la presencia de CVP detectable (>50copias/ml) a las 24 semanas y en 2 determinaciones posteriores hasta las 48 semanas en las 2 ramas de NVP analizadas conjuntamente. El margen de no presentar inferioridad se estableció en el –12%. La proporción de pacientes con carga viral basal superior a 100.000copias/ml fue superior al 60% en los 3 grupos de tratamiento. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml fue del 67 y el 65% para NVP y ATV/r, respectivamente (IC95%: −5,9–9,8; p=0,63) en el análisis basado en el objetivo primario, mientras que en el análisis por TLVOR fue del 70 y el 74%, respectivamente (IC95%: −10,4–4,5%; p=0,44). En pacientes con CVP basal superior a 100.000copias/ml, la proporción de indetectabilidad para NVP y ATV/r fue del 60 y el 52%, respectivamente256. El incremento de linfocitos CD4 fue similar en ambas ramas, así como la tasa de fracaso virológico. Las discontinuaciones del tratamiento fueron más frecuentes en las ramas de NVP. En un análisis del inicio del tratamiento, la caída de la CVP durante las primeras 4 semanas y el tiempo hasta la respuesta al tratamiento fueron mejores con NVP que con ATV/r259.
Ensayos clínicos que avalan las recomendaciones de efavirenzPautas con efavirenz frente a pautas con inhibidores de la proteasaEstudio ACTG 5142El estudio ACTG 5142 es un ensayo clínico aleatorizado cuyo objetivo era valorar la eficacia y tolerancia de 3 regímenes de tratamiento: LPV/r+2 AN, EFV+2 AN y LPV/r+EFV. Se incluyó a 753 pacientes con una mediana de linfocitos CD4 de 182células/μl y CVP de 100.000copias/ml. Los puntos finales de valoración fueron: 1) fracaso virológico: a) fracaso temprano: imposibilidad de reducir la CVP más de 1log10 o rebrote antes de las 32 semanas, y b) fracaso tardío: imposibilidad de suprimir la CVP por debajo de 200copias/ml o rebrote después de las 32 semanas; 2) finalización del régimen: fracaso virológico o suspensión relacionada con la toxicidad. A las 96 semanas, la proporción de pacientes sin fracaso virológico fue del 67, el 76 y el 73% para los grupos de LPV/r+2 AN, EFV+2 AN y LPV/r+EFV, respectivamente. En este corte, la proporción de pacientes con CVP inferior a 200copias/ml (ITT) fue del 86, el 93 y el 92% para cada rama de tratamiento (p=0,041; LPV frente a EFV), y con CVP inferior a 50copias/ml fue del 77, el 89 y el 83%, respectivamente (p=0,003; LPV frente a EFV). El incremento de linfocitos CD4 fue mayor en los grupos que contenían LPV/r frente al grupo de EFV (p=0,01) frente a EFV+2 AN. Los datos de resistencias indican que, en caso de fracaso virológico, es más probable que aparezcan resistencias a 2 clases de fármacos en el grupo de EFV+2 AN que en los grupos de LPV/r, mientras que hipertrigliceridemia fue más frecuente en los pacientes con LPV/r+EFV. En resumen, el estudio ACTG 5142 demuestra que tanto la eficacia virológica como el tiempo hasta el fracaso virológico son mejores con la pauta de EFV+2 AN y el incremento de los linfocitos CD4 es mayor en los grupos con LPV/r202.
Estudio DMP-006En el estudio DMP-006 se demostró que el EFV combinado con ZDV y 3TC tiene una mayor eficacia virológica (48 y 144 semanas) que la combinación IDV+ZDV+3TC260.
Estudio ACTG 384En el estudio ACTG 384 se demostró que la combinación EFV+ZDV+3TC es más eficaz que un régimen con NFV+ZDV+3TC o NFV+ddI+d4T229.
Estudio FOCUSEn el ensayo FOCUS se comparó una pauta con EFV frente a SQV/r (1.600/100 en QD) en 152 pacientes sin tratamiento previo. La pauta con EFV fue más eficaz a las 48 semanas (CVP <50copias/ml; el 71 frente al 51%) y presentó menos toxicidad261.
Estudio CLASSEn el ensayo clínico CLASS se comparó una pauta con EFV frente a otra con APV/r con 1.200/200mg en QD. El EFV y el APV/r mostraron una eficacia similar en el objetivo primario (CVP <400copias/ml a las 96 semanas) y en la proporción de pacientes con CVP inferior a 50copias/ml (ITT), independientemente de la CVP alta. El EFV consiguió tasas de respuesta virológica superiores a las 24 y las 48 semanas, pero no a las 96 semanas, objetivo principal del estudio. Sin embargo, la dosis utilizada no se considera óptima y no está autorizada para el tratamiento inicial262.
Estudio BMS-034En el estudio BMS AI424-034 se demostró que la pauta ATV (400mg en QD)+ZDV+3TC fue tan eficaz como EFV+ZDV+3TC en pacientes sin tratamiento previo263. Sin embargo, los resultados de este estudio son difíciles de interpretar por un error en la determinación de la CVP relacionado con el procesamiento y el tipo de tubos empleados para el transporte de muestras.
Pautas con efavirenz frente a pautas con 3 inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótidoEstudio ACTG A5095Como ya se ha comentado previamente, el estudio ACTG-A5095 demostró que las combinaciones de fármacos de 2 familias (EFV+ZDV+3TC o EFV+ZDV+3TC+ABC) son más eficaces que la combinación de 3 AN (ZDV+3TC+ABC)209.
Pautas con efavirenz frente a pautas con nevirapinaEstudio 2NNEl estudio 2 NN254, ensayo clínico aleatorizado y abierto, comparó la eficacia y la tolerancia de 4 pautas con EFV, NVP (400mg en QD), NVP (200mg en BID) y EFV+NVP, combinados todos con d4T+3TC. Se incluyó a 1.216 pacientes con una mediana de linfocitos CD4 de 190células/μl y una CVP de 4,7log10 copias/ml. Se consideró fracaso de tratamiento el fracaso virológico (descenso de CVP inferior a 1log10 a las 12 semanas o 2 determinaciones de CVP superiores a 50copias/ml a partir de las 24 semanas o una CVP de 50copias/ml o más a las 48 semanas), la progresión clínica a estadio C o muerte y el cambio de tratamiento. A las 48 semanas, la proporción de pacientes con fracaso de tratamiento fue del 43,6% en el grupo de NVP en QD; del 43,7% en el de NVP en BID; del 37,8% en el de EFV, y del 53,1% en el de NVP+EFV. La diferencia del 5,9% (IC95%: −0,9–12,8) entre las ramas con NVP en BID y EFV no fue significativa, por lo que no pudo demostrarse la equivalencia dentro de los límites del 10%. No hubo diferencias entre los grupos con NVP (en QD o en BID). El fracaso de tratamiento fue más frecuente en la rama NVP+EFV que en la de EFV (15,3%; p=0,0003), pero no hubo diferencias significativas respecto al grupo de NVP en QD (9,5%; p=0,05). Tampoco hubo diferencias entre las distintas ramas con respecto a la proporción de pacientes con CVP inferior a 50copias/ml: el 70% con NVP en QD; el 65% con NVP en BID; el 70% con EFV, y el 62,7% con EFV+NVP (ITT). En el subgrupo con CVP alta (>100000copias/ml), el fracaso de tratamiento fue del 19,9% en la rama NVP en QD; el 15,8% en la de NVP en BID; el 8,2% en la de NVP+EFV, y el 5,9% en la de EFV (p=0,004). El incremento de linfocitos CD4 fue el mismo en las 4 ramas. Los efectos adversos fueron más frecuentes en el grupo de NVP+EFV y la toxicidad hepatobiliar fue más frecuente en el de NVP en QD que en los otros. Se registraron 25 muertes, de las que 2 se atribuyeron a la NVP. Como conclusión de este estudio se puede decir que la eficacia fue similar en los 3 grupos que contenían un NN. La eficacia de la combinación NVP+EFV es inferior a la que contiene solamente EFV.
A la hora de valorar los resultados de este estudio, debe tenerse en cuenta que en el diseño se especificó que sería clínicamente significativa una diferencia de fracaso terapéutico inferior al 10% entre las 2 pautas (48 semanas). Los resultados indicaron, sin embargo, que no podía descartarse una diferencia mayor ya que, según el IC95%, la eficacia del EFV sobre la NVP puede superar el 10%. En un análisis de sensibilidad en el que solo se incluyó a los pacientes que tomaron la medicación, la proporción de pacientes con éxito terapéutico fue significativamente mayor en el grupo de EFV que en el de NVP en BID.
Resumen sobre ensayos con inhibidores de la transcriptasa inversa no análogos de nucleósidoSe ha demostrado que pautas con EFV o NVP son más eficaces que pautas con 3 AN. Igualmente se ha demostrado que una pauta con EFV es más eficaz que con algunos IP (IDV, NFV, LPV/r202). El EFV ha demostrado resultados similares al APV/r y superiores al SQV/r con dosis de IP no aprobadas en Europa, el EFV no se ha comparado con DRV/r ni con ATV/r. Sin embargo, la NVP no ha demostrado en ningún ensayo clínico que sea más eficaz que un IP, pero sí no ha presentado inferioridad frente al ATV/r. Por último, la comparación entre los 2 NN no ha permitido obtener conclusiones definitivas.
Consideraciones sobre la elección de un régimen con nevirapina o efavirenz- 1)
El EFV ha demostrado su eficacia en pacientes con CVP superior a 100.000copias/ml o muy inmunodeprimidos (cifras de linfocitos CD4 de 50–100células/μl)204,208 y es capaz de suprimir la carga viral en tejido linfático de forma similar a regímenes con IP264.
- 2)
El EFV está contraindicado en embarazadas (riesgo de teratogenicidad) y debería evitarse en mujeres que quieran quedarse embarazadas o que no utilicen métodos anticonceptivos seguros. El EFV puede producir mareos, trastornos de la concentración y somnolencia, por lo que se deberá informar a los pacientes y recomendarles que, en presencia de estos síntomas, eviten tareas peligrosas como conducir o usar máquinas pesadas. Asimismo debería evitarse en pacientes con antecedentes psiquiátricos graves.
- 3)
El EFV está disponible para su uso en coformulación junto con TDF+FTC en un único comprimido de administración una vez al día.
- 4)
En pacientes que reciben metadona debe tenerse especial cuidado, ya que tanto el EFV como la NVP suelen inducir su metabolismo y producir síndrome de abstinencia.
- 5)
La NVP puede producir exantema cutáneo, con o sin fiebre, y síntomas pseudogripales. Se han descrito episodios hepáticos graves e incluso fatales durante las primeras semanas de tratamiento, por lo que la NVP debe administrarse con precaución en pacientes con hepatopatía crónica y aminotransferasas elevadas (contraindicada si las aminotransferasas están por encima de 5 veces el límite superior de la normalidad). Los episodios hepáticos son más frecuentes en el primer tratamiento de mujeres con cifras de linfocitos CD4 superiores a 250células/μl (el 11 frente al 0,9%) o de hombres con cifras de linfocitos CD4 superiores a 400células/μl (el 6,3 frente al 1,2%). Sin embargo, en pacientes con CVP indetectable que simplifican el tratamiento a NVP no se observan estas alteraciones.
- 6)
La NVP no ha demostrado inferioridad con respecto al ATV/r, incluso en pacientes con CVP superior a 100.000copias/ml.
- 7)
Existe muy escasa experiencia en cuanto a la eficacia y la tolerancia de la combinación ABC+3TC+NVP. Tanto el ABC como la NVP pueden presentar RHS.
Recomendaciones sobre inhibidores de la transcriptasa inversa no análogos de nucleósido
- •
En general se recomienda EFV frente a NVP por el mayor número de estudios y experiencia (nivel C).
- •
El EFV está contraindicado durante el primer trimestre de la gestación. Se recomienda considerar otras opciones en mujeres que no utilicen métodos anticonceptivos eficaces. Asimismo, se debe evitar en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos o trastornos de la concentración.
- •
Se desaconseja la NVP en el inicio del TARV en mujeres con recuento de linfocitos CD4 superior a 250células/μl y en varones con recuento de linfocitos CD4 superior a 400células/μl.
En España se han comercializado 9 IP: SQV, IDV, RTV, NFV, FPV, LPV, ATV, tipranavir (TPV) y DRV. El TPV potenciado con RTV (TPV/r) está aprobado por la Agencia Europea del Medicamento (EMEA) solamente en pacientes pretratados. Sus principales características se muestran en la tabla 7,8. Los IP son inductores e inhibidores del CYP y frecuentemente pueden originar interacciones farmacocinéticas. La elección final del IP se basará en datos de eficacia, tolerancia, interacciones, posología y farmacocinética. El LPV/r se administra en comprimidos coformulados que no precisan refrigeración. Para el resto de los IP/r se recomienda mantener las cápsulas de RTV refrigeradas (la ficha técnica informa que pueden permanecer hasta 30 días a temperatura no superior a 25°C).
Inhibidores de la proteasa (1a parte): indinavir, ritonavir, saquinavir, nelfinavir y fosamprenavir
| Nombre genérico | Indinavir | Ritonavir | Saquinavir | Nelfinavir | Fosamprenavir |
| Nombre comercial | Crixivan® | Norvir® | Viracept® | Telzir® | |
| Dosis | 800mg TID | Como potenciador de otros IP: 100 o 200mg con cada dosis de IP | SQV/r 1.000/100 BID | 750mg TID o | FPV/r 700/100mg c/12h |
| IDV/r 800/100 BID | Como IP (600mg BID) se desaconseja | Tomar con comida grasa | 1.250mg BID | Con o sin alimentos | |
| Recomendación | Restricción dietética | Tomar con comida grasa | |||
| Ingesta abundante de líquidos no carbónicos | |||||
| Presentación comercial | cáps. 200 y 400mg | sol. oral 80mg/ml | comp. 200mg | comp. 250mg | comp. 700mg |
| cáps. 100mg | comp. 500mg | polvo (1 cuch 1g =50mg de NFV) | |||
| Biodisponibilidad oral | 30–60% | 80% | 4–8% | 20–80% | No hay datos |
| Semivida de eliminación plasmática | 1,5–2h | 3–5h | 1–2h | 3,5–5h | 9h |
| Cmáx | 8μg/ml | 11,2μg/ml | 0,243μg/ml | 3μg/ml | FPV/r 700/100mg c/12h: 6,08μg/ml |
| (12,6μM) | (15,54μM) | (0,32μM) | 4,52μM) | FPV/r 1.400/200mg c/24h: 7,24μg/ml | |
| Cmín | 0,15μg/ml (0,25μM) | 3,7μg/ml (5,13μM) | 75ng/ml | 1,2μg/ml (1,81μM) | FPV/r 700/100mg c/12h: 2,12μg/ml |
| FPV/r 1.400/200mg c/24h: 1,45μg/ml | |||||
| Concentración inhibitoria | CI90: <0,07μg/ml | CI90: <0,1μg/ml | CI90: 0,1μg/ml | CI95: 0,0046–0,13μg/ml | CI50: 0,006μg/ml |
| (<0,098μM) | (<0,138μM) | (0,13μM) | (0,007–0,196μM) | (0,012μM) | |
| Actividad | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 | VIH-1,2 |
| Metabolización | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 |
| Efectos | Nefrolitiasis | (En dosis reducidas la prevalencia de los efectos adversos es muy baja) | Intolerancia G-I (diarrea) | Diarrea | Intolerancia G-I (diarrea) |
| Adversos | Intolerancia G-I. | Intolerancia G-I | Cefalea | Hiperglucemia | Exantema |
| Hiperbilirrubinemia | (vómitos, diarrea) | ↑ transaminasas | Dislipidemia | ||
| Hiperglucemia | Parestesias orales | Hiperglucemia | Lipodistrofia | Cefalea | |
| Dislipidemia | Hepatitis | Dislipidemia | Posible aumento del sangrado en hemofílicos | Hiperglucemia | |
| Lipodistrofia | Hiperglucemia | Dislipidemia | |||
| Posible aumento del sangrado en hemofílicos | Dislipidemia | Lipodistrofia | Lipodistrofia | ||
| Lipodistrofia | Posible aumento del sangrado en hemofílicos | Posible aumento del sangrado en hemofílicos | |||
| Posible aumento del sangrado en hemofílicos | |||||
| Interacciones | |||||
| Asociaciones contraindicadas | Amiodarona | Alfuzosina | Ajo, suplementos (utilizar SQV/r) | Anticonceptivos orales | Anticonceptivos orales |
| Astemizol | Amiodarona | Astemizol | Astemizol | Astemizol | |
| Atazanavir | Anticonceptivos orales | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Bupropion | Cisaprida | |
| Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Astemizol | Carbamacepina | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Deriv. ergotamina | |
| Cisaprida | Cisaprida | Cisaprida | Cisaprida | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | |
| Deriv. Ergotamina | Cloracepato | Dexametasona | Deriv. Ergotamina | Halofantrina | |
| Halofantrina | Clozapina | Deriv. ergotamina | Halofantrina | Hypericum (hierba de San Juan) | |
| Hypericum (hierba de San Juan) | Dextropropoxif. | Efavirenz | Hypericum (hierba de San Juan) | Lumefantrina | |
| Lumefantrina | Diacepam | Fenitoína | Lumefantrina | Lopinavir/ritonavir | |
| Midazolam oralk | Deriv. ergotamina | Fenobarbital | Midazolam oralk | Midazolam oralk | |
| Pimozida | Disulfiram | Fluticasona | Omeprazol y afines | Pimozida | |
| Rifampicina | Encainida | Halofantrina | Pimozida | Rifampicina | |
| Terfenadina | Estatinas (excepto pravastatina) | Hypericum (hierba de San Juan) | Rifampicina | Terfenadina | |
| Triazolam | Estazolam, | Lumefantrina | Terfenadina | Triazolam | |
| Éxtasis | Midazolam oralk | Triazolam | |||
| Flecainida | Nevirapina | ||||
| Fluracepam | Pimozida | ||||
| Fluticasona | Rifampicina | ||||
| Halofantrina | Terfenadina | ||||
| Hypericum (hierba de San Juan) | Triazolam | ||||
| Lumefantrina | |||||
| Meperidina | |||||
| Metanfetamina | |||||
| Midazolam oralk | |||||
| Pimozida | |||||
| Piroxicam | |||||
| Propafenona | |||||
| Quinidina | |||||
| Terfenadina | |||||
| Triazolam | |||||
| Voriconazol | |||||
| Zolpidem | |||||
| Antiácidos | Espaciarlos 1h | No hay datos | No hay datos | No hay datos | Ausencia de interacciones |
| Inhibidores de la bomba de protones | Utilizar IDV/r (↓47% AUC IDV) | No hay datos | NRAD (omeprazol 40mg/d 80% AUC SQV sin toxicidad) | Contraindicado (↓36% AUC NFV) | NRAD (↓Cmáx, pero AUC y Cmín FPV sin cambios). |
| Antihistamínicos H2 | No hay datos | No hay datos | NRAD | No hay datos | NRAD (↓30% AUC, pero Cmín sin cambios) |
| Antimicobact. | |||||
| Rifampicina | Contraindicado tanto con IDV como con IDV/r | ↓35% AUC RTV. NRAD (RTV a dosis plenas). Monitorizar toxicidad hepática | Contraindicadoj | Contraindicado | Contraindicado |
| Rifabutinaa | 1.000mg c/8h IDV. | RFB 150mg 3veces/semanaa | Contraindicado como único IPa,c | 1.000mg c/8h o 1.250mg c/12h NFV. | NRAD FPV/r RFB 150mg 3veces/semanaa |
| RFB 150mg c/24h o 300mg 3veces/semanaa | RFB 150mg c/24h o 300mg 3veces/semanaa | ||||
| Claritromicina | NRADConsiderar tratamientos alternativos para indicaciones diferentes de MACEn presencia de RTV, ajustar dosis de claritro si función renal alteradab | Considerar tratamientos alternativos para indicaciones diferentes de MAC (100% AUC 14-OH-claritromicina) | NRADDado que se administra con RTV, considerar tratamientos alternativos para indicaciones diferentes de MAC | NRAD | FPV no potenciado: NRADFPV/r: Considerar tratamientos alternativos para indicaciones diferentes de MACAjustar dosis claritro si func. renal alteradab. |
| Ajustar dosis claritro si func. renal alteradab | |||||
| Antiepilépticos: | Posible ↓Cp IDV. | Monitorizar Cp antiepiléptico y ARV. RTV puede ↓Cp de fenitoína y lamotrigina. Datos iniciales indican que también podría ↓Cp de valproico | Posible ↓Cp NFV. Monitorizar Cp antiepiléptico y ARV | Posible ↓Cp APV. Monitorizar Cp antiepiléptico y ARV | |
| Carbamacepina, fenitoína, fenobarbital | Monitorizar Cp antiepiléptico y ARV. Con carbamacepina ↓Cp IDV importantes. Evitar asociarlos | Varios casos descritos de toxicidad por carbamacepina | No hay datos. Evitar la combinación o monito-rizar estrechamente los niveles de ambos | Algún caso descrito de toxicidad por carbamacepina | |
| Anticoagulantes orales | Los IP pueden alterar las Cp de los anticoagulantes. Existen casos descritos de reducción del efecto anticoagulante con requerimiento de aumento de dosis de acenocumarol y warfarina al asociarlos a RTV o IDV. Monitorizar estrictamente el tiempo de protrombina | ||||
| Anticonceptivos orales: | NRAD | ↓40% AUC etinilestradiol. Usar métodos alternativos | No hay datos | ↓47% AUC etinilestradiol. Usar métodos alternativos | Usar métodos alternativos |
| Antifúngicos imidazólicos | Con fluconazol NRAD | Máx 200mg/día de ketoconazol e itraconazol | Fluconazol: NRAD | No se han descrito interacciones clínicamente importantes con fluconazol, itraconazol, ketoconazol o caspofungina | Con FPV/r no sobrepasar 200mg/día de ketoconazol e itraconazol |
| Con ketoconazol ↓IDV 600mg c/8h | Con fluconazol NRAD de ninguno | Voriconazol y SQV+/−RTV: no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir). Se recomienda monitorizar estrechamente | Con Voriconazol: no hay datos. Se recomienda monitorizar estrechamente (podría aumentar la toxicidad de ambos) | Con voriconazol y FPV+/− RTV no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir). Se recomienda monitorizar estrechamente | |
| Con itraconazol posible Cp IDV. | Voriconazol contraindicado (estudio con 400mg c/12h de RTV: ↓82% AUC voriconazol, AUC RTV sin cambios; estudio con 100mg c/12h de RTV: ↓39% AUC voriconazol, AUC RTV sin cambios importantes) | Ketoconazol e itraconazol máx 200mg/día | |||
| Con fluconazol NRAD de ninguno | |||||
| Con voriconazol+IDV 800mg c/8h: NRAD.Con IDV/r no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver RTV). Monitorizar estrechamente | |||||
| Estatinas: | Lovastatina y simvastatina contraindicadas. Con fluvastatina y pravastatina interacción poco probable. Atorvastatina: asociar con precaución (iniciar con dosis bajas máximo 10mg/día) | Atorvastatina, fluvastatina lovastatina y simvastatina contraindicadas. Con pravastatina interacción poco probable. SQV/RTV 400/400mg c/12h ↓50% pravastatina (probablemente NRAD) y x4,5 AUC atorvastatina (iniciar con dosis bajas máximo 10mg/día) | Lovastatina y simvastatina contraindicadas. Con fluvastatina interac poco probable. Atorvastatina: asociar con precaución (iniciar con dosis bajas máximo 10mg/día). Con SQV/RTV 400/400mg c/12h ↓50% pravastatina (probablem NRAD) y x4,5 AUC atorvastatina (iniciar con dosis bajas máximo 10mg/día) | Lovastatina y simvastatina contraindicadas. Con fluvastatina interacción poco probable. Pravastatina es segura pero probablemente requiera aumento de dosis (↓47% AUC). Atorvastatina: Asociar con precaución (iniciar con dosis bajas máximo 10mg/día) | Lovastatina y simvastatina |
| Contraindicadas. Con fluvastatina y pravastatina interacción poco probable. FPV aumentó 2,3 veces el AUC de atorvastatina (10mg/día): asociar con precaución (iniciar con dosis bajas máximo 10mg/día) | |||||
| Etanol: | El uso agudo o crónico de etanol alteró mínimamente la farmacocinética de los IP | ||||
| Antabus: algunos IP podrían dar lugar a una reacción de tipo disulfiram por su contenido en etanol: Norvir® solución oral (43% v/v); Norvir cápsulas (12% p/p); Kaletra® solución oral (42%); Aptivus cápsulas (7% p/p =100mg/cáps). Kaletra® en comprimidos no contiene alcohol. Agenerase® en solución tiene un elevado contenido de propilenglicol (550mg/ml), que se metaboliza a través de la alcohol deshidrogenasa, por lo que el consumo de etanol junto con estos IP podría producir toxicidad. Kaletra® en cápsulas y Agenerase® en cápsulas también contienen propilenglicol, pero en menor cantidad | |||||
| Fármacos empleados para tratar la influenza | Zanamivir/amantadina: una interacción con los IP se considera poco probable | ||||
| Oseltamivir se ha relacionado con efectos adversos neuropsiquiátricos, aunque no se puede descartar que éstos sean debidos, al menos en parte, a la propia enfermedad. Los IP al bloquear la glicoproteína-P podrían aumentar la penetración de oseltamivir en el SNC y empeorar sus efectos adversos. Se recomienda asociarlos con pecaución hasta que no se disponga de más datos | |||||
| Inmunosupresores: | Posible Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor | RTV puede aumentar hasta 3 veces Cp ciclosporina y tacrolimus | Posible Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor | Posible Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor Un paciente con trasplante de hígado requirió una reducción muy importante en la dosis de tacrolimus. Las Cp NFV no se alteraron. Micofenolato se glucuronida por lo que NFV podría ↓ sus Cp. Monitorizar niveles/eficacia | Posible Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor |
| ↑30% AUC de prednisolona tras la administración de prednisona. | |||||
| Posible Cp sirolimus. Monitorizar niveles/toxicidad inmunosupresor. Micofenolato se glucuronida por lo que RTV podría ↓ sus Cp. Monitorizar niveles/eficacia | |||||
| Inmunosupresores: | La dosis de ciclosporina inicial debe ser aprox 1/10 de la habitual y puede requerir reducciones progresivas a lo largo del tiempo. En algunos casos la dosis al cabo de 2 años es tan sólo un 25% de la inicial (probablemente por aumento de la absorción intestinal a lo largo del tiempo) | ||||
| Tacrolimus: se ha descrito una interacción muy importante con LPV/r (pueden ser necesarios menos de 1mg de tacrolimus a la semana y puede ser necesario esperar de 3 a 5 semanas (según función hepática) antes de administrar otra dosis de tacrolimus al iniciar LPV/r. También se ha descrito interacción con otros IP (p. ej . mayor con NFV que con IDV, requiriéndose en un estudio unos 0,6mg diarios de tacrolimus con estos IP. Tras el cambio de NFV por FPV no potenciado pueden requerirse aumentos de dosis (se han descrito reducciones del 50% de sus Cp) | |||||
| Interferón/ribavirina | Ribavirina: no existe evidencia de interacción con los IP. Interferón: su vía de eliminación no está claramente establecida así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado p. ej. Cp de teofilina y barbituratos). No hay datos con respecto a posibles interacciones con los IP | ||||
| Metadona | in vitro ↑ 30% AUC MTProbablemente NRAD | in vitro x2 AUC MT in vivo ↓36% AUC MT. dosis MT.Bupropión: RTV puede ↓Cp bupropion | NRAD | ↓40–50% Cp MT en algunos pacientes. | Algunos pacientes pueden requerir aumento de dosis de MT. |
| Solo requiere pequeños ↑dosis. | |||||
| Otros fármacos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Felodipino: un caso descrito de interacción (edema, mareo, hipotensión) en una mujer que recibía 50mg/día de metoprolol y 5mg/día de felodipino | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos |
| Algún caso descrito de reducción de eficacia de L-tiroxina | Fluoxetina: se han descrito 3 casos de síndrome serotoninérgico | Digoxina: ↑49%AUC de digoxina: Monitorizar digoxinemia | Posible aumento Cp sildenafilo (max 25mg en un periodo de 48h). Esta interacción también se produce con vardenafilo (máx 2,5mg c/24h) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | ||
| IDV puede aumentar 4,4 veces AUC sildenafilo (max 25mg en un periodo de 48h). Esta interacción también se produce con vardenafilo (máx 2,5mg c/72h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | Algún caso descrito de reducción de eficacia de L-tiroxina | SQV puede aumentar 3,1 veces AUC sildenafilo (max 25mg en un periodo de 48h). Esta interacción también se produce con vardenafilo (máx 2,5mg c/24h y 2,5mg c/72h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | Puede Cp de los fármacos que se metabolizan a través del CYP3A4d ↓ Cp de los que sufren glucuronidacióni | Posible aumento Cp sildenafilo (max 25mg en un periodo de 48h). Esta interacción también se produce con vardenafilo (máx 2,5mg c/24h y 2,5mg c/72h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | |
| Con omeprazol espaciar 1h (ausencia de interacción con IDV/r) | Quinina: x4 AUC quinina. Reducir dosis | El zumo de pomelo aumenta los niveles de saquinavir | Con FPV/r 700/100mg c/12h se redujo aprox un 50% el AUC de paroxetina (20mg/día) | ||
| Puede Cp de los fármacos que se metabolizan a través del CYP3A4d | RTV puede aumentar 11 veces AUC sildenafilo (max 25mg en un periodo de 48h). Esta interacción también se produce con vardenafilo (máx 2,5mg c/72h) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | Puede Cp de los fármacos que se metabolizan a través del CYP3A4d | Puede o ↓ Cp de los fármacos que se metabolizan a través del CYP3A4d, ya que es un inhibidor de este isoenzima pero los datos también sugieren que puede inducirlo | ||
| Puede Cp de los fármacos que se metabolizan a través de los CYP3A4e>2D6f, ó↓ Cp si 2C9g y ↓ Cp si CYP1A2h y glucuronidacióni | |||||
| NN | (ver la tabla NN) | ||||
| IP | |||||
| IDV | IDV/r: 800/100–200mg c/12h | ↑x4–8 AUC SQV. Sin cambios AUC IDV. No hay datos sobre ajuste de dosis (antagonismo in vitro y complicado de dosificar) | NFV/IDV: 1250/ 1200mg c/12h | No hay datos suficientes sobre ajuste de dosis | |
| En investigación pauta IDV/r: 1.200/200mg c/24h. No existen datos de eficacia y seguridad a largo plazo | (datos limitados) | ||||
| No existen datos de eficacia y seguridad a largo plazo | |||||
| RTV | SQV/r: 400mg/400mg BID | RTV 100 o 200mg c/12h: 30% AUC NFV | FPV/r 700/100mg c/12h | ||
| SQV/r: 1.000/100mg/12h | Se desaconseja esta asociación | (En pacientes naive puede administrarse una vez al día: FPV/r 1.400/100–200mg c/24h. No se recomienda en pacientes pretratados) | |||
| En investigación en pacientes naive SQV/r 1.500/100–200mg/24h (preferiblemente en el desayuno) | |||||
| SQV | Se desaconseja esta asociación | Datos iniciales sobre ajuste de dosis: SQV-SGC/FPV/RTV 1.000/700/200mg c/12h (Se recomienda monitorizar niveles plasmáticos) | |||
| No existen datos de eficacia y seguridad a largo plazo | |||||
| NFV | No hay datos | ||||
Nota: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias.
/r: potenciado con ritonavir; APV: amprenavir; ARV: antirretrovirales; ATV: atazanavir; AUC: área bajo la curva; BID: pauta de tratamiento administrada 2 veces al día; Cp: concentración plasmática; FPV: fosamprenavir; IDV: indinavir; IP: inhibidor de la proteasa; MAC: micobacterium avium complex; MT: metodona; NFV: nelfinavir; NN: inhibidores de la transcriptasa inversa no análogos de nucleósido; NRAD: no requiere ajuste de dosis; QD: pauta de tratamiento administrada una vez al día; RFB: rifabutina; RTV: ritonavir; SGC: soft gelatin capsule; SQV: saquinavir; TID: pauta de tratamiento administrada 3 veces al día; VIH: virus de la inmunodeficiencia humana.
En pacientes coinfectados con VIH y tuberculosis con inmunosupresión avanzada (CD4 <100cél/mm3) en tratamiento con rifampicina o rifabutina 2 veces por semana se ha descrito la aparición de resistencia a rifamicinas. También se han descrito fracasos de tratamiento antituberculosos con aparición de resistencias en pacientes con imnonosupresión avanzada tratados con IP/r y rifabutina 150mg c/48h o tres veces por semana. En estos casos valorar dosis mayores: rifabutina 300mg tres veces semana.
SQV junto con RTV (400/400mg c/12h o 1.000/100mg c/12h) pueden administrarse con dosis reducidas de rifabutina (150mg 3veces /semana)(experiencia limitada).
Principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dextropropoxifeno, diazepam, diltiazem, disopiramida, estazolam, etionamida, etosuximida, felodipino, fentanilo, finasterida, flunaricina, fluracepam, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, quinina, sertralina, sildenafilo (Viagra®), vardenafilo, tadalafilo, tacrolimus, verapamilo, vincristina y zolpidem.
RTV pueder aumentar hasta 3 veces el AUC de los siguiente fármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, docetaxel, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, tacrolimus, taxol y trazodona, entre otros.
Aumento de 1,5 a 3 veces en el AUC de los fármacos metabolizados a través del CYP2D6: amitriptilina, clomipramina, clorpromacina, desipramina, fluoxetina, haloperidol, imipramina, maprotilina, metoprolol, mexiletina, nortriptilina, paroxetina, perfenazina, pindolol, propranolol, risperidona, timolol, tioridacina, tramadol y venlafaxina.
Fármacos metabolizados a través del CYP2C9/19: diclofenac, ibuprofeno, indometacina, fenitoína, gliburida, glipizida, lansoprazol, losartan, omeprazol, proguanilo y tolbutamida.
atovaquona, clofibrato, codeína, difenoxilato, ketoprofeno, ketorolaco, lamotrigina, loracepam, metoclopramida, morfina, naproxeno, oxacepam, propofol, temacepam y valproico.
Inhibidores de la proteasa (2a parte): lopinavir, atazanavir, darunavir, tipranavir
| Nombre genérico | Lopinavir/r | Atazanavir | Darunavir/r | Tipranavir/r |
| Nombre comercial | Kaletra® | Reyataz® | Prezista® | Aptivus® |
| Dosis | 400/100mg c/12h | 300/100mg r/24h o 400mg c/24h | 600/100mg c/12h (en pacientes pretratados). | TPV/r 500/200mg c/12h |
| Recomendación | 800/200mg /24h | Nota: en un estudio se observó que tan solo un 38% de los pacientes tratados con ATV no potenciado alcanzaron una Cmin>150ng/ml | 800/100 QD (en pacientes sin tratamiento previo | Tomar con comida |
| Tomar con o sin comida | Tomar con comida | Tomar con comida | ||
| Presentación comercial | comp 200/100mg | cáps 100, 150, 200 y 300mg | Comp 300, 400 y 600mg | cáps 250mg |
| comp 100/25mg | ||||
| sol. oral 80/20mg/ml | ||||
| Biodisponibilidad oral | 70% | Los alimentos aumentan entre 35–70% los niveles plasmáticos | 82% en presencia de 100 mg de | Los alimentos aumentan 2 veces el AUC de TPV. |
| ritonavir administrados 2 veces al día | ||||
| Semivida de eliminación plasmática | 5-6 horas | 5-8 horas | 15 horas | 6 horas |
| Cmax | 10μg/ml ABT-378 | — | 6.890ng/ml | — |
| (15,9μM) | ||||
| Cmin | 5,16μg/ml ABT-378 (8,2μM) | — | 3.578ng/ml | 32μM (TPV/r 500/200mg c/12h) |
| 67μM (TPV/r 1200/200mg c/12h) | ||||
| Concentración inhibitoria | 50:0,062μg/ml | 50:0,002-0,004μg/ml | EC50 = 0,7–5,0ng/ml | 0,16-0,2μM (aunque, debido a su elevada unión a prot plasmáticas, debería alcanzar entre 0,5–1μM para mostrar actividad antiviral). |
| (0,1μM) | (2,6 – 5,3nM) | |||
| 90: 0,007-0,012μg/ml | ||||
| (9-15nM) | ||||
| Actividad | VIH-1,2 | VIH-1 | VIH-1,2 | VIH-1,2 |
| Metabolización | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 |
| Efectos | Intolerancia G-I | Hiperbilirrubinemia | Intolerancia G-I (vómitos, ÿortalsÿ) | Intolerancia GI (ÿortalsÿ) |
| adversos | (vómitos, ÿortalsÿ) | Intolerancia GI (ÿortalsÿ) | Cefalea | Alteraciones SNC (ÿortals, dificultad de concentración, enlentecimiento, cambios de humor) |
| Cefalea | Cefalea | Astenia | En combinación con RTV, aumento de triglicéridos y transaminasas | |
| Astenia | Los estudios disponibles a las 48 semanas no muestran alteraciones lipídicas relevantes | Dislipemia leve | Se han descrito 14 casos de hemorragia ÿortalsÿnial, 8 de los cuales fueron ÿortals, entre 6.840 pacientes incluidos en ensayos clínicos | |
| Hiperglicemia | ATV/r: dislipemia leve | Erupción cutánea, que suele ser moderada y autolimitada | La mayoría tenían factores de riesgo | |
| Dislipemia | Posible aumento del sangrado en hemofílicos | Posible aumento del sangrado en hemofílicos | ||
| Lipodistrofia | ||||
| Posible aumento del sangrado en hemofílicos | ||||
| Asociaciones contraindicadas | Anticonceptivos orales | Astemizol | Amiodarona | Astemizol |
| Astemizol | Estatinas (excepto fluvastatina y | Astemizol | Cisaprida | |
| Cisaprida | pravastatina) | Cisaprida | Deriv. ergotamina | |
| Deriv. ergotamina | Cisaprida | Deriv. Ergotamina | Encainida | |
| Encainida | Deriv. Ergotamina | Estatinas (simvastatina y lovastatina) | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | |
| Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Halofantrina | Extasis | Etravirina | |
| Éxtasis | Hypericum (Hierba de San Juan) | Fenobarbital | Éxtasis | |
| Fluticasona inh. | Lumefantrina | fenitoina | Flecainida | |
| Fosamprenavir | Indinavir | Fluticasona inh. | Fluticasona inh | |
| Flecainida | Irinotecan | Halofantrina | Halofantrina | |
| Halofantrina | Midazolam oral10 | Hypericum (Hierba de San Juan) | Hypericum (Hierba de San Juan) | |
| Omeprazol y afines9 | Lidocaína sistémica | |||
| Hypericum (Hierba de San Juan) | Pimozida | Metanfetamina | Lumefantrina | |
| Lumefantrina | Rifampicina | Midazolam oral10 | Metanfetamina | |
| Metanfetamina | Terfenadina | Pimozida | Midazolam oral10 | |
| Midazolam oral10 | Triazolam | Quinidina | Pimozida | |
| Pimozida | Rifampicina | Propafenona | ||
| Propafenona | Sertindol | Quinidina | ||
| Quinidina | Terfenadina | Rifampicina | ||
| Rifampicina | Triazolam | Saquinavir | ||
| Terfenadina | Terfenadina | |||
| Triazolam | Triazolam | |||
| Antiácidos | Ausencia de interacción | Espaciar 1-2h (primero ATV) | Espaciar 1-2h (↓25-29% AUC TPV) | |
| Inh. bomba protones | Ausencia de interacción | Contraindicado11 | Ausencia de interacción | Ausencia de interacción |
| Antihist. H2 | Ausencia de interacción | Ensayado con famotidina12 | Ausencia de interacción | No hay datos: probablemente ausencia de interacción |
| Antimicobact. | ||||
| - Rifampicina | Contraindicado | Contraindicado | Contraindicado | Contraindicado (no hay datos) |
| - Rifabutina (RFB) | RFB 150mg 3veces /semana0 | NRAD atazanavir | NRAD darunavir/ritonavir | RFB 150mg 3veces /semana0 |
| RFB 150mg 3veces /semana. | RFB 150mg 3veces /semana0 | |||
| - Claritromicina | Considerar tratamientos alternativos para indicaciones diferentes de MAC | Reducir 50% la dosis de claritro | Considerar tratamientos alternativos para indicaciones diferentes de MAC (niveles de 14-OH-claritromicina inferiores al límite de cuantificación) | Considerar tratamientos alternativos para indicaciones diferentes de MAC |
| Ajustar dosis claritro si func. renal alterada1 | Se reducen las concentraciones de su metabolito 5-hidroxi- | Ajustar dosis claritro si func. renal alterada1 | TPV:↑60% AUC, x2 Cmín; Claritro: ↑19% AUC, ↑68% Cmin, ↓>95% 14-OH-claritromicina | |
| Considerar tratamientos alternativos para indicaciones diferentes de MAC | ||||
| Antiepilépticos: | Un caso descrito de intoxicación con carbamacepina (tambien podrían ↓Cp LPV: monitorizar niveles de ambos) | Posible ↓Cp ATV. Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepiléptico | Carbamazepina (200 mg/12h): ↑45% AUC CBZ, DRV sin cambios. Valorar reduccion de dosis de carbamazepina del 25-50%. Se recomienda monitorizar niveles de carbamazepina | Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepiléptico |
| Carbamazepina, fenitoína, fenobarbital, lamotrigina | Con fenitoína, se han descrito ↓30% en el AUC de fenitoína, LPV y RTV y ↓ ≅ 50% Cmin LPV y RTV. Posible repercusión clínica Monitorizar Cp de ambos fármacos | Lamotrigina: con ATV no potenciado ↓12% AUC lamotrigina; con ATV/r ↓32% AUC lamotrigina | Fenobarbital y fenitoína: contraindicados por riesgo de reducción de las Cp de DRV | Un caso de reducción del 50% en las Cp de fenobarbital |
| Con lamotrigina: se recomienda duplicar la dosis de lamotrigina | ||||
| Con ác valproico: datos contradictorios (↓48% niveles valproico en un paciente versus sin cambios en otro estudio en que se comparó niv. de valproico con datos históricos) | ||||
| Precaución | ||||
| Anticoagulantes orales | Los IP pueden alterar las Cp de los anticoagulantes. Existen casos descritos de reducción del efecto anticoagulante con requerimiento de aumento de dosis de acenocumarol y warfarina al asociarlos a RTV, LPV/r ó IDV. Monitorizar estrictamente el tiempo de protrombina | |||
| Anticonceptivos orales: | ↓42% AUC etinilestradiol | Posible ↓Cp ATV. Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepiléptico | Carbamazepina (200mg/12h): ↑45% AUC CBZ, DRV sin cambios. Valorar reduccion de dosis de carbamazepina del 25-50%. Se recomienda monitorizar niveles de carbamazepina | Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepiléptico |
| Usar métodos alternativos | Lamotrigina: con ATV no potenciado ↓12% AUC lamotrigina; con ATV/r ↓32% AUC lamotrigina | Fenobarbital y fenitoína: contraindicados por riesgo de reducción de las Cp de DRV | Un caso de reducción del 50% en las Cp de fenobarbital | |
| Antifúngicos imidazólicos | No se han descrito interacciones clínicamente importantes con fluconazol. Máx 200mg/día de itraconazol y de ketoconazol. | Ausencia de interacción con fluconazol. | Ketoconazol: + 42% AUC darunavir; AUC de ketoconazol 2 veces mayor: dosis máxima de ketoconazol 200mg/día. | Con fluconazol (100mg c/24h), posible aumento de los niveles plasmáticos de TPV (datos limitados) |
| Con voriconazol y LPV/r no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir) | Puede administrarse atazanavir no potenciado con ketoconazol junto con una comida ligera sin que se requiera ajuste de dosis. Con ATV/r no exceder 200mg/d de ketoconazol | Itraconazol: dosis máxima de itraconazol 200mg/d | Monitorizar toxicidad | |
| Monitorizar estrechamente | Con voriconazol y ATV+/- RTV: no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir) | La coadministración de voriconazol y darunavir/ritonavir no ha sido estudiada (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir) | No se recomienda sobrepasar los 200mg/d de fluconazol, itraconazol y ketoconazol | |
| Monitorizar estrechamente | Monitorizar estrechamente | Con voriconazol y TPV+/- RTV: no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver Ritonavir) | ||
| Posaconazol (400mg/12h) en voluntarios sanos aumentó 3,7 veces el AUC de ATV no potenciado y 2,5 veces el AUC de ATV/r. Se observaron aumentos de los niveles plasmáticos de bilirrubina | Monitorizar estrechamente | |||
| Estatinas: | Lovastatina, simvastatina y fluvastatina contraindicadas | Lovastatina y simvastatina contraindicadas | Lovastatina, simvastatina y fluvastatina contraindicadas | Lovastatina, simvastatina y fluvastatina contraindicadas |
| Pravastatina: NRAD | Fuvastatina y pravastatina interacción poco probable | Atorvastatina (↑x4 AUC atorvastatina): se recomienda empezar con una dosis de atorvastatina de 10mg al día y aumentar progresivamente en función de la respuesta clínica. | TPV/r aumentó 9 veces el UC de atorvastatina | |
| Atorvastatina: asociar con precaución (iniciar con máximo 10mg/d) | Atorvastatina: asociar con precaución (iniciar con máximo 10mg/d) | Pravastatina: DRV/r no aumentó la exposición a una dosis única de pravastatina, en la mayoría de sujetos, aunque ésta se multiplicó 5 veces sólo en un subgrupo de sujetos. Se recomienda iniciar con dosis bajas de pravastatina e incrementarlas gradualmente hasta conseguir el efecto clínico deseado | Utilizar preferiblemente pravastatina (interacción poco probable) | |
| Etanol: | El uso agudo o crónico de etanol alteró mínimamente la farmacocinética de los IP | |||
| Antabus: algunos IP podrían dar lugar a una reacción de tipo disulfiram por su contenido en etanol: Norvir® solución oral (43% v/v); Norvir cápsulas (12% p/p); Kaletra® solución oral (42%); Aptivus cápsulas (7% p/p =100mg/cáps). Kaletra® en comprimidos no contiene alcohol. Agenerase® en solución tiene un elevado contenido de propilenglicol (550mg/ml), que se metaboliza a través de la alcohol deshidrogenasa, por lo que el consumo de etanol junto con estos IPs podría producir toxicidad. Kaletra® en cápsulas y Agenerase® en cápsulas también contienen propilenglicol, pero en menor cantidad | ||||
| Fármacos empleados para tratar la influenza | Zanamivir/amantadina: una interacción con los IPs se considera poco probable | Oseltamivir se ha relacionado con efectos adversos neuropsiquiátricos, aunque no se puede descartar que éstos sean debidos, al menos en parte, a la propia enfermedad. Los IPs al bloquear la glicoproteína-P podrían aumentar la penetración de oseltamivir en el SNC y empeorar sus efectos adversos. Se recomienda asociarlos con precaución hasta que no se disponga de más datos | ||
| Inmunosupresores: | Posible ↑Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor. Micofenolato se glucuronida por lo que RTV podría ↓ sus Cp. Monitorizar niveles/eficacia. En un paciente, las dosis de ciclosporina tuvo que reducirse a 1/20 parte al añadir LPV/r | Posible ↑Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor | Posible ↑Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor | No hay datos. Se recomienda monitorizar estrechamente los niveles plasmáticos de inmunosupresor |
| Tacrolimus: un caso descrito de ajuste hasta 0,5mg/semana | ||||
| La dosis de ciclosporina inicial debe ser aprox 1/10 de la habitual y puede requerir reducciones progresivas a lo largo del tiempo. En algunos casos la dosis al cabo de 2 años es tan sólo un 25% de la inicial (probablemente por aumento de la absorción intestinal a lo largo del tiempo) | ||||
| Tacrolimus: se ha descrito una interacción muy importante con LPV/r (pueden ser necesarios menos de 1mg de tacrolimus a la semana y puede ser necesario esperar de 3–5 semanas (según función hepática) antes de administrar otra dosis de tacrolimus al iniciar LPV/r. También se ha descrito interacción con otros IP (p. ej. mayor con NFV que con IDV, requiriéndose en un estudio unos 0,6 mg diarios de tacrolimus con estos IP | ||||
| Interferón/Ribavirina | Ribavirina: no existe evidencia de interacción con los IP | |||
| Interferón: su vía de eliminación no está claramente establecida así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado p. ej. ↑Cp de teofilina y barbituratos). No hay datos con respecto a posibles interacciones con IP | ||||
| En pacientes tratados con ATV se han descrito ↑x2 bilirrubina | ||||
| Metadona (MT) y otros opiáceos | ↓53% AUC MT. Habitualmente NRAD de metadona | Metadona: Probablemente NRAD. Ausencia de interacción farmacocinética con ATV 400mg/d. Según datos iniciales con ATV/r 300/100mg c/24h los ajustes de dosis de MT, si se requieren, son mínimos. | Metadona: no se requiere ajustes inicialmente. Monitorización clínica y ajustar dosis posteriormente en caso necesario, aunque habitualmente no se requiere | Metadona: ↓48% isómero activo R-metadona: puede requerir aumento de dosis |
| Algunos casos descritos de intoxicación opiácea en pacientes tratados con ATV/r y buprenorfina, resuelta tras reducir la dosis del opiáceo | Buprenorfina/naloxona: buprenorfina sin cambios, ↑46% AUC norbuprenorfina. Síntomas leves de exceso de opiáceos en algunos pacientes sin requerir ↓dosis | Loperamida: a pesar de que TPV/r actúa como inhibidor de la glicoproteína-P, no se observó aumento de los efectos en SNC de loperamida (16mg) | ||
| Otros fármacos | Artemeter/lumefantrina: | Atovaquona/proguanilo: | Digoxina: Darunavir/ritonavir aumenta las concentraciones plasmáticas de digoxina | Bupropión: se reducen las concentraciones a la mitad en presencia de TPV/r |
| ↑ x2-3 AUC lumefantrina, ↓35% %AUC artemeter, LPV sin cambios. NRAD monitorizar toxicidad | ↓33% AUC atovaquona, | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | |
| Atovaquona/proguanilo: | ↓74% AUC proguanilo (datos limitados procedentes de comparar niveles de pacientes con voluntarios sanos sin TARV) | |||
| ↓65% AUC atovaquona, | Con TDF: utilizar ATV/r 300/100mg c/24h. | Inhibidores de la recaptación de serotonina: las AUC sertralina (50mg/d) y de paroxetina (20mg/d) se redujeron aprox. un 50% y 40%, respectivamente, tras 7 días de coadministración con DRV/r | Tadalafilo: mínima dosis cuando se utiliza los primeros días del tratamiento con TPV/r. Después de 7-10 días de tratamiento con TPV/r, no es necesario ajustar la dosis de tadalafilo | |
| ↓68% AUC proguanilo (datos limitados procedentes de comparar niveles de pacientes con voluntarios sanos sin TARV) Valorar aumento de dosis | Reducir dosis de diltiazem a la mitad. | Sildenafilo: el AUC de sildenafilo se multiplica por 4. Dosis inicial: no exceder 25 mg en un periodo de 48h para sildenafilo, 2,5mg en 72h para vardenafilo y 10 mg en 72h para tadalafilo | Valaciclovir: ausencia de interacción | |
| Bupropión: LPV/r ↓57% AUCde bupropión | Posible aumento Cp sildenafilo (max 25mg en un periodo de 48h), vardenafilo (máx 2,5 mg c/72h si asociado a RTV) y tadalafilo (iniciar con 5mg y no exceder 10mg c/72h) | (sigue) | (sigue) | |
| Digoxina: ↑81%AUC (0-12h) de una dosis única de 0,5mg de digoxina, posiblemente por interacción con Pgp intestinal. Precaución con otros fármacos substrato de Pgp: verapamilo, doxorrubicina | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | |||
| Ezetimiba no modificó de forma significativa la farmacocinética de LPV/r (no se evaluó la posible interacción en el sentido contrario, aunque no parece probable una interacción importante) | Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 y UDP-glucuroniltransferasa 1A1 | |||
| Gemfibrozilo: ↓41% AUC de gemfibrozilo. | ||||
| (sigue) | ||||
| Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | En general DRV/r puede aumentar las concentraciones plasmáticas de los fármacos que se metabolizan a través del CYP3A43 | Aunque con TPV/r se ha visto que predomina el efecto inhibidor enzimático de RTV, se recomienda mucha precaución, ya que TPV ha reducido los niveles plasmáticos de varios IP aún en presencia de RTV | ||
| Algún caso descrito de reducción de eficacia de L-tiroxina | (↓68% AUC ATV, ↓70% AUC de SQV, ↓ 45% el AUC de APV, y ↓ 49% el AUC de LPV). Podría ocurrir también con otros fármacos | |||
| Posible aumento Cp sildenafilo (max 25mg en un periodo de 48h), vardenafilo (máx 2,5 mg c/72h) y tadalafilo (iniciar con 5 mg y no exceder 10 mg c/72h). | ||||
| Vinblastina: un caso de interacción grave con LPV/r: tras una dosis de 6mg/m2 de vinblastina el paciente desarrolló pancitopenia de grado 4. Se resolvió reduciendo la dosis a la mitad Productos naturales: ausencia de interacción PK con Ginkgo biloba y Echinacea purpurea | ||||
| Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 | ||||
| Podría también ↑Cp (aumento mucho menor) de los fármacos que se metabolizan a través del 2D65 | ||||
| Puede ↓Cp de los fármacos que se metabolizan a través del CYP2C9/196 o sufren glucuronidación8 | ||||
| AN | (ver tabla AN) | |||
| NN | (ver tabla NN) | |||
| IP | ||||
| - IDV | Datos farmacocinéticos iniciales: IDV 600-800mg c/12h | Al igual que atazanavir, indinavir se ha asociado a hiperbilirrubinemia (aumento de la Bi indirecta) por lo que no se recomienda asociar ambos IPs | DRV/r 600/100mg c/12h | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV |
| LPV/r NRAD | IDV: 800g c/12h (600 mg c/12h en caso de intolerancia) | |||
| No existen datos de eficacia y seguridad a largo plazo | ||||
| - RTV | LPV/r 400/100mg c/12h | ATV/r 300/100mg c/24h | ↑ 14 veces AUC DRV. DRV esta indicado solamente en combinación con RTV. Dosis de DRV/r 600/100mg c/12h en pacientes pretratados y 800/100 mg c/24h en pacientes naive. | TPV/r 500/200mg c/12h |
| Una dosis adicional de RTV 100mg c/12h: ↑46% AUC LPV y x2 Cmin LPV. Con LPV/r, las Cmin RTV son 3 veces menores que con 100mg RTV c/12h asociado a IDV ó SQV | ||||
| - SQV | SQV 1000mg c/12h + LPV/R dosis habitual | Con una dosificación de SQV/RTV/ATV 1500/100/300mg c/24h se ha observado que algunos pacientes no alcanzan una Cmin adecuada de SQV, por lo que se recomienda restringir su uso a pacientes naive a IP con CV baja a intermedia No existen datos de eficacia y seguridad a largo plazo | No recomendado (SQV sin cambios; ↓26% AUC de darunavir) | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓70% AUC SQV) |
| No existen datos de eficacia y seguridad a largo plazo | ||||
| - NFV | NFV: 1000-1250mg c/12h LPV/r: pacientes con susceptibilidad reducida o experiencia previa a IP pueden requerir aumento de dosis | No hay datos | No hay datos | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP |
| No existen datos de eficacia y seguridad a largo plazo | ||||
| -FPV | Si se requiere usar esta combinación, se recomienda monitorizar niveles plasmáticos (como dosis inicial puede emplearse 1400mg c/12h de FOS-APV con 600/150mg c/12h de LPV/r | ATV 300-400mg c/24h (o repartidos c/12h) + FPV/r 700/100mg c/12h ó 1400/100-200mg c/24h (datos farmacocinéticos iniciales) | No hay datos | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV |
| No existen datos de eficacia y seguridad a largo plazo | No existen datos de eficacia y seguridad a largo plazo | (Algunos autores han logrado niveles adecuados monitorizando y aumentando la dosis de FPV/r a 1400/200mg c/12h en combinación con TPV (500mg c/12h). Sin embargo, dada la elevada variabilidad interindividual, algunos pacientes podrían no alcanzar niveles adecuados. Experiencia limitada) | ||
| - LPV/r | Datos farmacocinéticos iniciales: ATV 300mg c/24h + LPV/r 400/100mg c/12h | Contraindicado (↓40% AUC DRV) | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓49% AUC LPV). | |
| No existen datos de eficacia y seguridad a largo plazo | (Algunos autores han logrado niveles adecuados monitorizando y aumentando la dosis de LPV/r a 400/300mg c/12h ó 533/233mg c/12h en combinación con TPV (500mg c/12h). Sin embargo, dada la elevada variabilidad interindividual, algunos pacientes podrían no alcanzar niveles adecuados Experiencia limitada) | |||
| - ATV | NRAD | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓68% AUC ATV) | ||
| - DRV/r | No hay datos2,4,7 | |||
AUC: área bajo la curva; BID: 2 veces al día; Cp: concentraciones plasmáticas; I: Invirase®; IT: interacción; NRAD: no requiere ajuste de dosis; NS: no significativa; QD: una vez al día.
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias.
En pacientes coinfectados con VIH y tuberculosis con inmunosupresión avanzada (CD4 <100 cél/mm3) en tratamiento con rifampicina o rifabutina 2 veces por semana se ha descrito la aparición de resistencia a rifamicinas. También se han descrito varios casos de fracaso del tratamiento antituberculoso con aparición de resistencias en pacientes con inmunosupresión avanzada tratados con IPs potenciados y rifabutina 150 mg c/48h o 3 veces por semana. En estos pacientes valorar dosis mayores: 300 mg rifabutina 3 veces por semana.
SQV (I o F) junto con RTV (400/400mg c/12h o 1.000/100mg c/12h) pueden administrarse con la dosis habitual de rifampicina o dosis reducidas de rifabutina (150mg 3veces /semana)(experiencia limitada).
Principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dextropropoxifeno, diazepam, diltiazem, disopiramida, estazolam, etionamida, etosuximida, felodipino, fentanilo, finasterida, flunaricina, fluracepam, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, quinina, sertralina, sildenafilo (Viagra®), vardenafilo, tadalafilo, tacrolimus, verapamilo, vincristina y zolpidem.
RTV pueder aumentar hasta 3 veces el AUC de los siguiente fármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, sildenafilo, tacrolimus, taxol y trazodona, entre otros.
Aumento de 1,5–3 veces en el AUC de los fármacos metabolizados a través del CYP2D6: amitriptilina, clomipramina, clorpromacina, desipramina, fluoxetina, haloperidol, imipramina, maprotilina, metoprolol, mexiletina, nortriptilina, paroxetina, perfenazina, pindolol, propranolol, risperidona, timolol, tioridacina, tramadol y venlafaxina.
Fármacos metabolizados a través del CYP2C9/19: diclofenac, ibuprofeno, indometacina, fenitoína, gliburida, glipizida, lansoprazol, losartan, omeprazol, proguanilo y tolbutamida.
atovaquona, clofibrato, codeína, difenoxilato, ketoprofeno, ketorolaco, lamotrigina, loracepam, metoclopramida, morfina, naproxeno, oxacepam, propofol, temacepam y valproico. a. La EMEA ha emitido la autorización de este fármaco solo para pacientes pretratados, a la dosis de 300mg ATV/100mg de ritonavir.
Atazanavir/ritonavir puede administrarse junto con antihistamínicos H2 (estudio realizado con famotidina) sin que se requiera espaciarlos. Si el atazanavir no se potencia con ritonavir, se recomienda administrarlo 2h antes del antihistamínico H2.
Según datos iniciales el midazolam intravenoso podría administrarse junto con los inhibidores de la proteasa reduciendo la dosis y bajo estrecha monitorización clínica (UCI o similar). Sin embargo, el midazolam oral está contraindicado.
ATV no potenciado nunca debe asociarse a IBP. ATV/r no debe asociarse a IBP en pacientes pretratados. En pacientes sin tratamiento previo podría emplearse un máximo de 20mg de omeprazol junto con ATV/r, espaciándolos 12 horas. En cualquier caso se evitará la administración de ATV en las primeras horas tras administrar un IBP.
Con ATV/r, puede emplearse una dosis máxima de famotidina de 40mg c/12h en pacientes sin tratamiento previo o de 20mg c/12h en pacientes pretratados (el ARV se administrará simultáneamente a fin de que el ATV/r se haya absorbido cuando actúe el anti-H2, o 10h después del anti-H2). Cuando deba emplearse un anti-H2 junto con TDF y ATV/r se aumentará la dosis de ATV/r a 400/100mg c/24h. En tratamiento inicial, si solo puede emplearse ATV no potenciado, se utilizará una dosis máxima de 20mg en una toma y 20mg c/12h en total de famotidina (ATV se administrará en este caso 2 horas antes, para asegurar su absorción en ausencia de RTV, o 10h después del anti-H2). En cualquier caso, se evitará la administración del ATV dentro de las primeras horas tras la administración de un anti-H2.
Se entiende por IP potenciado la coadministración de un IP con dosis reducidas de RTV. El RTV tiene un potente efecto inhibidor del CYP, que inhibe el metabolismo del segundo IP y mejora su perfil farmacocinético y el cociente Cmin/CI50, lo que reduce el riesgo de aparición de resistencias. Además, al potenciar un IP se reduce el número de comprimidos, la frecuencia de las dosis y las restricciones dietéticas, lo que favorece la adherencia. Un inconveniente de estas combinaciones es su potencial toxicidad. En la tabla 7,8 se muestran las combinaciones más importantes de IP y sus dosificaciones basadas en estudios farmacocinéticos.
Ensayos que avalan las recomendaciones de inhibidores de la proteasaComparaciones entre inhibidores de la proteasaEstudio M98-863El M98-863 es un ensayo aleatorizado, doble ciego, multicéntrico, que comparó LPV/r (400/100mg en BID; n=326) frente a NFV (750mg en pauta de tratamiento administrada 3 veces al día; n=327) junto con d4T+3TC. A las 60 semanas, se observó mejor respuesta virológica (ITT) en los pacientes tratados con LPV/r (CVP <50copias/ml; el 64 y el 52%, respectivamente; p=0,001)265 (tabla 10).
Inhibidores de la fusión
| Nombre genérico | Enfuvirtida (T-20) |
| Nombre comercial | Fuzeon® |
| Dosis recomendada | 90mg c/12h s.c. |
| Presentaciones comerciales | vial de 90mg |
| Cmáx | 4,59mcg/ml |
| Cmín | 2,6–3,4mcg/ml |
| CI 50 | 0,259mcg/ml |
| Actividad | VIH-1 |
| Biodisponibilidad | 80% (vía s.c.) |
| Vida media plasmática | 3,8h |
| Metabolización | Catabolismo en sus aminoácidos constituyentes |
| Excreción | No hay datos |
| Efectos adversos | Reacciones locales leve-moderadas en el punto de inyección, dolor de cabeza y fiebre |
| Interacciones | Escaso riesgo de interacción metabólica. Se ha observado in vitro un efecto sinégico intenso de enfuvirtide con elvitegravir, lopinavir y darunavir y un efecto sinérgico moderado con efavirenz. Estudios in vitro e in vivo con una amplia variedad de isoenzimas hepáticos no han mostrado efecto inhibitorio de T-20 sobre los mismos. Estudios en pacientes no se ha encontrado interacción de T-20 con rifampicina, ETR, RTV y SQV/r. Tampoco se ha observado interacción farmacocinética de T-20 con tacrolimus ni con DRV. En un estudio se observó un aumento de las concentraciones de TPV (↑50% Cmín) y de RTV (↑ volumen de distribución y semivida de eliminación de ambos) en presencia de enfuvurtida, aunque estos resultados no han podido corroborarse en otro estudio. Según un subanálisis del estudio RESIST, no parece que el aumento en las concentraciones plasmáticas de TPV se relacione con un aumento del riesgo de hepatotoxicidad |
Nota: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias.
/r: potenciado con ritonavir; DRV: darunavir; ETR: etravirina; RTV: ritonavir; SQV: saquinavir; s.c.: subcutáneo; TPV: tipranavir; VIH: virus de la inmunodeficiencia humana.
En el ensayo clínico M02-418 se evaluó la eficacia y la tolerancia del LPV/r en BID frente al LPV/r en QD combinados con TDF+FTC. Se incluyó a 190 pacientes con una mediana de linfocitos CD4 de 214–232células/μl y una de CVP de 4,6–4,8log10 en cada grupo. A las 48 semanas, la proporción de pacientes (ITT) con CVP inferior a 50copias/ml fue similar (el 70 y el 64% según pauta, LPV/r en QD o LPV/r en BID)266.
Estudio KLEANEl estudio KLEAN comparó el FPV/r (700/100mgen BID) con el LPV/r (300/100mg en BID, cápsulas), ambos con ABC+3TC coformulados, en 887 pacientes. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 66% en el grupo de FPV/r y del 65% en el de LPV/r, lo que demuestra que el FPV/r no presenta inferioridad frente a las cápsulas de LPV/r. No hubo diferencia significativa en cuanto a tolerancia digestiva (náuseas, vómitos, diarrea) ni alteraciones lipídicas239.
Estudio APV30001-NEATEn el estudio NEAT se evaluó la eficacia y la tolerancia del FPV (1.400mg en BID) frente al NFV, ambos en combinación con ABC+3TC. Se aleatorizó a 166 pacientes para FPV y a 83 para NFV. A las 48 semanas, la proporción de pacientes con CVP inferior a 400copias/ml fue mayor en el grupo de FPV que en el de NFV (el 66 y el 51%; ITT). En el grupo de CVP elevada (>100.000copias/ml), la proporción fue del 67 y el 35%, respectivamente (p<0,05)267.
Estudio APV30002-SOLOEl SOLO es un ensayo clínico aleatorizado en el que se comparó a 322 pacientes tratados con FPV/r en QD (1.400/200mg) con 327 pacientes tratados con NFV, ambos asociados a ABC+3TC. La mediana de linfocitos CD4 fue de 170células/μl y la CVP fue de 4,8log10. El 20% de los pacientes tenían cifras de linfocitos CD4 inferiores a 50células/μl. A las 48 semanas no hubo diferencias (ITT) en la proporción de pacientes con CVP inferior a 400copias/ml (el 69 con FPV/r frente al 68% con NFV) ni con CVP inferior a 50copias/ml (el 55 frente al 53%). Sin embargo, la proporción de pacientes que presentaron fallo virológico fue superior en la rama de NFV (17%) que en la de FPV/r (7%)268.
Estudio COL100758El estudio COL100758 comparó el FPV/r (1.400/100mg) y el FPV/r (1.400/200mg), ambos en QD junto con ABC+3TC coformulados. Se incluyó a 115 pacientes. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 79% (FPV/r, 100mg) y del 63% (FPV/r, 200mg); p=0,061. La adherencia fue mejor en el grupo de 100mg de RTV269. En voluntarios sanos se ha demostrado que los niveles plasmáticos de FPV (1400mg en QD) no difieren si se potencia con 100 o 200mg de RTV270.
Estudio ARTEMISEl estudio ARTEMIS comparó el DRV/r (800/100mg en QD) frente al LPV/r (en BID y en QD) en 689 pacientes que recibieron además TDF+FTC coformulados. La dosificación de LPV/r fue variable: el 77% recibió el LPV/r en BID, el 15% en QD y, además, el 7% cambió de BID a QD durante el estudio. El 15% recibió LPV/r en cápsulas, el 2% en comprimidos y el 83% cambió de cápsulas a comprimidos durante el estudio. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 84% en el grupo de DRV/r y del 78% en el de LPV/r (IC95%: –0,3–11,2; p=0,062), lo que demuestra que el DRV/r no presenta inferioridad frente al LPV/r. Los pacientes tratados con DRV/r presentaron menos diarrea grado 2–4 que los tratados con LPV/r (el 4 frente al 10%) y las elevaciones lipídicas fueron menores (triglicéridos y colesterol total)271. En una actualización a las 96 semanas272, alcanzaron una CVP inferior a 50copias/ml (ITT-TLOVR) el 79% de los pacientes del grupo de DRV/r y el 71% de los del grupo de LPV/r, por lo que se concluyó que no solo se consigue que no presente inferioridad (objetivo primario por protocolo; p<0,001; IC95%: 1,9–14,8), sino también que el DRV/r presente superioridad (objetivo secundario; p=0,012; por ITT). Esta diferencia a favor del DRV/r se demostró también en pacientes con CVP alta y en los muy inmunodeprimidos. En el grupo de DRV/r hubo menos fracasos virológicos y menos mutaciones (ninguna que condicionara resistencia a IP), así como menos efectos adversos.
Estudio GEMINIEl estudio GEMINI comparó el SQV/r (1.000/100mg en BID) frente al LPV/r (300/100mg en BID, cápsulas) en 337 pacientes. Todos recibieron además TDF+FTC coformulados. A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 64,7% en el grupo de SQV/r y del 63,5% en el grupo de LPV/r (IC95%: –9,6–11,9). El estudio demostró que el SQV/r no presenta inferioridad frente al LPV/r. Las elevaciones lipídicas fueron similares, con un incremento mayor de triglicéridos en el grupo de LPV/r y de cLDL en el de SQV/r273.
Estudio BMS-089El estudio BMS-089 comparó el ATV (400mg en QD) frente al ATV/r (300/100mg en QD). Se incluyó a 200 pacientes que recibieron además d4T de liberación retardada (100mg en QD) y 3TC (300mg en QD). A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 75% (ATV/r) y del 70% (ATV). En este estudio se demostró que el ATV/r no presenta inferioridad frente al ATV sin potenciar. Las causas de fracaso terapéutico fueron diferentes en los 2 grupos. Hubo más fracasos virológicos en la rama de ATV no potenciado (10 frente a 3; p=ns). Los que fracasaron en la rama de ATV/r no tuvieron mutaciones en el gen de la proteasa, mientras que se detectaron en 3 de los 10 que fracasaron con ATV sin potenciar. También hubo más mutaciones a 3TC en el grupo no potenciado (7 de 10, frente a una de 3). Las suspensiones de tratamiento por hiperbilirrubinemia fueron más frecuentes con ATV/r. El estudio pone de manifiesto la mayor eficacia virológica y barrera genética del ATV/r274.
Estudio 1182.33El estudio 1182.33 intentó comparar 2 dosis de TPV/r (500/100 en BID y 500/200 en BID) frente a LPV/r (400/100 en BID). El comité de vigilancia decidió parar el estudio por mayor tasa de elevación asintomática de enzimas hepáticas en la rama de TPV/r 500/200 en BID y por no alcanzar el criterio de no presentar inferioridad a las 60 semanas en la rama de TPV/r 500/100 en BID. Debido a estos resultados no se recomienda el uso de TPV/r en tratamientos de inicio.
Estudio M05-730La combinación TDF+FTC+ LPV/r (comprimidos en BID) se ha comparado con la combinación TDF+FTC+LPV/r (comprimidos en QD) en 664 pacientes que recibían el primer tratamiento. Este ensayo clínico demuestra que el LPV/r comprimidos administrado una vez al día no presenta inferioridad frente al LPV/r comprimidos administrados 2 veces al día. La proporción de pacientes con cargas virales inferiores a 50copias/ml (ITT) fue del 77% en el grupo en QD y del 76% en el grupo en BID. Durante las primeras 8 semanas del estudio, los pacientes de cada grupo fueron aleatorizados además para recibir las cápsulas o los comprimidos de LPV/r sin que se encontraran diferencias entre ambas presentaciones respecto a la incidencia de efectos adversos o a discontinuaciones por toxicidad275.
Estudio CASTLEEste ensayo compara la combinación TDF+FTC+ATV/r en QD con la combinación TDF+FTC+LPV/r (cápsulas) en BID en 883 pacientes sin tratamiento previo, demostrando que el ATV/r no presenta inferioridad frente al LPV/r en su forma de cápsulas. La proporción de pacientes con cargas virales inferiores a 50copias/ml (ITT) fue del 78% en el grupo de ATV/r y del 76% en el grupo de LPV/r. ATV/r mostró mejor perfil lipídico (colesterol total, triglicéridos y colesterol no-HDL). La ictericia y la hiperbilirrubinemia fueron más frecuentes en el grupo de ATV/r, mientras que la diarrea y las náuseas lo fueron en el grupo de LPV/r276. En una actualización a las 96 semanas se mantuvo la situación del ATV/r de no presentar inferioridad (CVP <50copias/ml; el 74 y el 68% según rama con ATV/r o LPV/r [ITT]). Discontinuaron el tratamiento el 16% (ATV/r) y el 21% (LPV/r). Tanto los efectos adversos como las alteraciones lipídicas fueron menores en la rama de ATV/r277.
Resumen sobre ensayos de inhibidores de la proteasa en pacientes sin tratamiento previoLos estudios han demostrado que la administración de un IP (LPV, SQV, FPV, ATV, DRV) potenciado tiene ventajas de eficacia y barrera genética respecto a los IP no potenciados. El principal inconveniente de la potenciación es el aumento de efectos adversos.
Recomendaciones sobre inhibidores de la proteasa
- •
Se recomienda el uso habitual de IP/r como primer TARV.
- •
Como IP de primera elección se recomiendan ATV/r en QD, DRV/r en QD, FPV/r en BID, LPV/r en BID o QD y SQV/r en BID (nivel A). Se han ordenado alfabéticamente, pero el DRV/r y el ATV/r han demostrado mayor eficacia y menor número de efectos adversos (nivel A).
- •
Se deben considerar como alternativas otras dosificaciones de IP/r o IP no potenciados: ATV (400mg en QD), FPV/r (1.400/200mg en QD) o FPV/r (1.400/100mg en QD). Estas dosificaciones carecen de ensayos clínicos con tamaño muestral adecuado que valoren su eficacia frente a un IP de primera elección y la EMEA no las ha aprobado.
- •
La combinación ddI+FTC+ATV (no potenciado) no debe utilizarse en pacientes sin TARV previo por alto riesgo de fracaso virológico (nivel A).
- •
El NFV, el IDV y el RTV a dosis plenas son 3 IP que, salvo excepciones, no deben utilizarse debido a su menor eficacia, mayor toxicidad y complejidad de uso.
- •
El TPV/r no debe utilizarse en pacientes sin TARV previo (nivel A).
Los antagonistas del correceptor CCR5 actúan bloqueando la entrada del VIH en la célula diana. Estos fármacos son activos solamente si el virus tiene tropismo R5.
El MVC es el antagonista del correceptor CCR5 que ha aprobado la EMEA para su uso en tratamientos en pacientes pretratados con VIH con tropismo R5 y resistente a otras familias de antirretrovirales. Sin embargo, ya se conocen los datos de un ensayo clínico de MVC en pacientes sin tratamiento previo.
Ensayo que avala la recomendación de antagonistas del CCR5Estudio MERITEl estudio MERIT es un ensayo que comparó el MVC (300mg en BID) con el MVC (600mg en QD) con el EFV (600mg en QD) en pacientes infectados por el VIH con el tropismo R5 y sin tratamiento previo. Los pacientes recibieron además ZDV+3TC. El grupo de MVC en QD fue interrumpido a las 16 semanas por no alcanzar el criterio virológico definido en el protocolo.
A las 48 semanas, la proporción de pacientes con CVP inferior a 50copias/ml (ITT) fue del 65,3 y del 69,3% en el grupo de MVC y de EFV, respectivamente (límite inferior del IC97,5%: –10,9). La proporción de pacientes con CVP inferior a 400copias/ml (ITT) fue del 70,6 y del 73,1% en el grupo de MVC y de EFV, respectivamente (límite inferior del IC97,5%≤9,5). El límite inferior del IC97,5%, de no presentar inferioridad, que se estableció para este ensayo clínico fue del –10%. Por tanto, el estudio demostró que el MVC no presenta inferioridad para el criterio de 400copias/ml pero no para el de 50copias/ml. La discontinuación del TARV por falta de eficacia fue más frecuente con MVC (11,9%) que con EFV (4,2%), pero por efectos adversos la discontinuación fue mayor con EFV (13,6%) que con MVC (4,2%). La recuperación inmunológica fue mayor con MVC (170 frente 144células/μl)278.
Recomendaciones
- •
Este comité considera que el MVC sólo debe emplearse como tratamiento de inicio en pacientes con virus con tropismo R5 y cuando no sea posible un tratamiento con NN o con un IP. El MVC no está aprobado por la EMEA para su uso en pacientes sin tratamiento previo; la recomendación se basa en resultados del estudio MERIT.
Los inhibidores de la integrasa (IInt) actúan alterando las moléculas de la integrasa viral y estas ya no pueden unir los extremos reactivos del ADN viral al ADN celular. La EMEA ha aprobado el raltegravir (RAL) para su uso en el tratamiento de pacientes con infección por el VIH, con o sin experiencia previa a antirretrovirales y resistencia a otras familias de antirretrovirales.
Ensayo que avala la recomendación de inhibidores de la integrasaEstudio STARTMRKEl estudio STARTMRK es un ensayo clínico, aleatorizado, doble ciego, multicéntrico e internacional, que comparó el EFV con el RAL, ambos combinados con TDF+FTC, en 566 pacientes sin TARV previo279. El objetivo primario de eficacia fue la consecución de una CVP inferior a 50copias/ml a las 48 semanas. El margen de no presentar inferioridad fue del 12%. El 53% de los pacientes tenía una carga viral basal superior a 100.000copias/ml y un 47% tenía un recuento de linfocitos CD4 inferior a 200células/μl. El objetivo primario se consiguió en un 86,1% de los pacientes del grupo de RAL y en un 81,9% del grupo de EFV (diferencia: 4,2%; IC95%: −1,9–10,3). El grupo de RAL tardó menos tiempo en alcanzar la indetectabilidad que el grupo de EFV (p<0,0001). Los efectos adversos relacionados con los fármacos fueron más frecuentes en el grupo de EFV que en el de RAL (p<0,0001)279.
Modificación del tratamiento antirretroviralFracaso del tratamiento antirretroviralEl fracaso del TARV se puede entender desde 3 puntos de vista: virológico, inmunológico y clínico.
La incidencia de fracaso virológico, sus causas y el perfil de mutaciones de resistencia han cambiado desde el inicio del TARV. Tras la introducción de los NN y los IP/r, la incidencia y las características del fracaso al primer TARV se han reducido sustancialmente180,280,281. La toxicidad fue la causa más frecuente de retirada del tratamiento y, en ese contexto, se documentó una mayor duración de la eficacia en pacientes tratados con NN que con IP280.
En la época moderna existe una preferencia a utilizar pautas sencillas y con escasa toxicidad que combinan AN no timidínicos y NN o IP/r.
Sucesivos fracasos terapéuticos con acumulación de mutaciones de resistencias frente a diferentes familias de FAR suponen menores posibilidades de éxito del TARV y mayor incidencia de sida y muerte282.
Factores que influyen en el fracaso terapéuticoLos factores que influyen en el fracaso del TARV pueden clasificarse en 3 grupos según dependan del paciente, de los fármacos o del virus.
Entre los primeros, el más importante es la adherencia al tratamiento, que es el mejor predictor de respuesta terapéutica283–285. Si se detecta un fracaso virológico sin mutaciones de resistencia debe valorarse la falta de adherencia como causa más probable. La ausencia de mutaciones en este escenario no excluye que puedan existir en poblaciones virales minoritarias no detectables por las pruebas de detección de resistencia genotípicas convencionales.
Entre los factores que dependen del fármaco, se considera en primer lugar la potencia del régimen terapéutico, la falta de niveles en sangre por malabsorción o interacciones medicamentosas y los errores de dosificación.
Entre los factores que dependen del VIH, el más importante es la resistencia a los FAR que resulta de la interacción de la capacidad replicativa y la diversidad del virus con la presión farmacológica. La resistencia a los FAR puede transmitirse a otras personas, es variable según el área o el colectivo de pacientes estudiados y el método empleado. Las cifras de infección reciente por virus resistentes varían entre en un 7,7–19,2%286,287. Se estima que en nuestro medio entre el 9–12% de las infecciones recientes por el VIH tienen mutaciones de resistencia83,288–290. Las mutaciones únicas con resistencia a NN o a AN comprometen la eficacia de los tratamientos de primera línea290. El uso de técnicas ultrasensibles que permiten detectar mutaciones de resistencia en variantes virales minoritarias no detectables con las técnicas convencionales (véase más adelante) podría explicar algunos de los fracasos virológicos en pacientes que inician un TARV potencialmente eficaz88–95. Dos estudios de cohortes han coincidido al describir que si se logra una CVP inferior a 50copias/ml en el primer TARV, el rebrote de la CVP suele asociarse a mal cumplimiento o toxicidad y en muy escasas ocasiones puede atribuirse a falta de potencia, interacciones medicamentosas o problemas de absorción44,291.
El fenómeno de la inmigración obliga a valorar el origen de los pacientes con infección por el VIH en situación de fracaso virológico. El uso de NVP en dosis única, el TARV poco potente, la escasa monitorización o los problemas de distribución y almacenaje de los fármacos explican el aumento de incidencia de fracaso virológico en la población infectada en los países desfavorecidos292–294. Una elevada proporción de estos pacientes son portadores de VIH diferentes al subtipo B y, por tanto, con distintos patrones de mutaciones de resistencia. Existe una mayor predisposición a seleccionar la mutación K65R en el subtipo C295 y se ha comunicado que los pacientes con subtipos no B (independientemente de exposición a FAR) presentan mayor proporción de resistencia al TPV que los infectados por los subtipos B296. Por otra parte, algunos pacientes de origen subsahariano padecen infección por el VIH-2 o infección dual por el VIH-1 y el VIH-2. EL VIH-2 desarrolla patrones diferentes de mutaciones tras exposición a AN297.
Criterios de cambio de tratamiento antirretroviral por fracaso virológicoLas definición de fracaso virológico se ha indicado previamente (véase apartado «Carga viral plasmática del virus de la inmunodeficiencia humana»). Ante un fracaso virológico es recomendable repetir la CVP para confirmarlo y cambiar el TARV lo antes posible para evitar el acúmulo de mutaciones y la elevación de la CVP, y de este modo facilitar la respuesta al nuevo tratamiento.
Los blips son rebrotes o elevaciones transitorias de la CVP cerca del umbral de detección en pacientes en TARV y con CVP suprimida. En la mayoría de los estudios no se asocian a mayor riesgo de fracaso43,45,46,298,299, aunque otros estudios sí que han relacionado los blips con riesgo de fracaso virológico41,48 e incluso se ha observado evolución genética y selección de resistencias en los blips45,298. En un paciente con blips frecuentes debe evaluarse la potencia del TARV y la adherencia al tratamiento.
El fracaso inmunológico suele ir precedido de un fracaso virológico. Algunos pacientes con CVP indetectable presentan permanentemente un número bajo de linfocitos CD4 con mayor riesgo de morbimortalidad secundaria a sida300 y otros procesos. En estos casos, se recomienda no cambiar el TARV, salvo las combinaciones que se asocian a descenso de linfocitos CD4 (p. ej., ZDV o TDF+ddI).
El fracaso clínico en un paciente en TARV, es decir la aparición de episodios clínicos B o C, no siempre se asocia a fracaso virológico. Puede aparecer en los primeros meses de instauración del TARV en pacientes muy inmunodeprimidos o relacionarse con fenómenos de restauración inmunológica, lo que puede obligar a modificar el TARV301.
Objetivo del tratamiento tras un fracaso virológicoEl objetivo terapéutico es conseguir de nuevo la máxima supresión viral (<50copias/ml). Para esto, se debe instaurar un nuevo régimen con 2 o 3 fármacos plenamente activos y se contará con otros que conserven actividad (estudio de resistencias) y sean bien tolerados.
No se debe retrasar el cambio de tratamiento. A partir de datos de los estudios TORO, que se comentarán más adelante, se han establecido 4 factores asociados a eficacia virológica del TARV de rescate: recuento de linfocitos CD4 de 100células/μl o más (OR: 2,1; IC95%: 1,5–3,1); CVP basal inferior a 5log10 (OR: 1,8; IC95%: 1,2–2,6); haber recibido 10 o menos FAR (OR: 2,4; IC95%: 1,6–3,4), y disponer de 2 o más fármacos activos en el nuevo TARV (OR: 2,3; IC95%: 1,6–3,3)302.
Para conseguir el objetivo de CVP indetectable pueden ser útiles algunas estrategias como las siguientes:
- •
Facilitar la adherencia al TARV. El TARV nuevo debe ser cómodo y bien tolerado; las pautas sencillas (p. ej., ZDV/3TC/ABC+TDF) pueden conseguir resultados inesperados303. En algunos colectivos con pobre adherencia al tratamiento puede intentarse un tratamiento directamente observado dado el número considerable de QD304,305.
- •
Pruebas de resistencia. La realización de una prueba de resistencia genotípica o fenotípica en cada fracaso optimiza el nuevo tratamiento, aumenta su eficacia y mejora el pronóstico de los pacientes306. Los resultados más útiles se obtienen si esta prueba se realiza mientras el paciente se encuentra con el tratamiento que ha fracasado. En pacientes multitratados puede establecerse el índice de susceptibilidad fenotípica/genotípica (número de fármacos activos según la prueba de resistencias genotípica o fenotípica) como predictor de respuesta al tratamiento307. Existen ciertas discordancias según el sistema en el que se realiza la interpretación de resistencias, lo que puede suponer una limitación en el uso del índice de susceptibilidad genotípica en la práctica clínica. La concordancia mayor se observa en los NN (93%) y en los IP (84%), en cambio en los AN sólo es del 76%308.
- •
Índice ponderado (score) de resistencia genotípica. La interpretación de las pruebas genotípicas a IP resulta difícil en pacientes con varios fracasos virológicos acumulados y depende del número de mutaciones seleccionadas, de su patrón y la combinación de ambos aspectos. En la actualidad se han desarrollado índices ponderados (scores) que definen la sensibilidad a determinados IP (ATV/r309, SQV/r310, LPV/r311, DRV/r312 y TPV/r313) y a la ETR (véase más adelante) basados en datos extraídos de estudios realizados en la vida real. Estos scores marcan el «peso» de cada una de las mutaciones según el grado de resistencia (valores negativos) o de susceptibilidad o hipersusceptibilidad (valores positivos). Los scores puntúan cada una de las mutaciones y finalmente se obtiene un resultado de mayor o menor susceptibilidad al fármaco.
- •
Cociente inhibitorio genotípico. El cociente inhibitorio genotípico es la razón entre las concentraciones plasmáticas del fármaco y el número de mutaciones relevantes en el gen de la proteasa. Se considera un marcador predictivo de respuesta a un IP314–316. Otra aproximación es el coeficiente inhibitorio normalizado que calcula la relación entre las concentraciones mínimas plasmáticas del fármaco y el número de veces por encima de la IC50 obtenido en el fenotipo viral317.
- •
Pruebas de resistencia con mayor sensibilidad: PCR específica del alelo, ensayo de ligación de oligonucleótidos, ultradeep-sequencing (pirosecuenciación o secuenciación masiva) y single genome sequencing (secuenciación clonal). Son metodologías actualmente en investigación que permiten conocer el papel que desempeñan en el fracaso virológico las variantes virales minoritarias con mutaciones de resistencia (especialmente en NN por su baja barrera genética) y que están presentes antes del inicio del tratamiento pero que no detectan las pruebas de resistencia convencionales90,92. Las técnicas basadas en la PCR en tiempo real tienen una gran sensibilidad para detectar variantes minoritarias puntuales, pero presentan bastantes limitaciones. Las técnicas ultrasensibles basadas en la secuenciación aumentan la sensibilidad de detección de mutaciones minoritarias y, al disponer de secuencias completas independientes, permite establecer nítidamente su asociación, realizar estudios filogenéticos más completos y estudiar la evolución en el tiempo de las diferentes poblaciones. Existen pocos estudios bien diseñados que evalúen el impacto clínico de variantes minoritarias en pacientes que inicien TARV con fármacos de barrera genética baja88–95,318 y sus resultados son inconsistentes debido principalmente a las diferencias en la metodología empleada y a las poblaciones estudiadas, por lo que no se ha establecido la utilidad clínica de su detección.
- •
Monitorización plasmática de fármacos. Poco útil por la variabilidad interindividual pero en ocasiones puede ayudar a optimizar el tratamiento y mejorar así su eficacia304,319,320.
Estas estrategias se han evaluado escasamente en estudios prospectivos y aleatorizados para poder recomendarlas en la práctica clínica diaria.
Cambio de tratamiento antirretroviral tras fracaso precozLos ensayos clínicos aleatorizados que han evaluado la eficacia de diferentes combinaciones de FAR en tratamientos de segunda línea son escasos. El objetivo terapéutico es la resupresión de la CVP (<50copias/ml). Los cambios precoces evitan el acúmulo de mutaciones y permiten secuenciar FAR incluso dentro de cada familia. Con los FAR actualmente disponibles resulta sencillo diseñar un TARV de rescate, aunque siempre se debe contar con una prueba de resistencias.
En el caso de pacientes que iniciaran el tratamiento con 3 AN, la mutación más frecuente es la M184V209, con o sin la K65R, si el TARV incluía AN no timidínicos321–323.
Si el fracaso es en un paciente que inició el TARV con 2AN y un NN, una única mutación (p. ej., 103N) es capaz de generar resistencia de alto nivel a EFV y NVP324. El fracaso virológico se acompaña de otras mutaciones a AN (M184V, L74V o K65R) con una incidencia superior a lo que ocurre cuando el primer régimen está compuesto por 2 AN y un IP/r325. Un cambio precoz evitaría la acumulación de mutaciones de resistencia que comprometiera la eficacia de los NN de nueva generación. En este escenario no se recomienda la utilización de ETR si existen 3 o más mutaciones frente a NN (véase más adelante)326.
El uso de IP/r en el primer TARV ha reducido significativamente el número de fracasos virológicos y la selección de mutaciones frente a los IP. El desarrollo de resistencias en los IP es un proceso gradual que requiere normalmente el acúmulo de varias mutaciones del gen de la proteasa75. Cada mutación reduce la susceptibilidad de las cepas virales a los IP. Existen mutaciones seleccionadas específicamente por un IP (no potenciado) y no presentan resistencias cruzadas: 30N (NFV)103, 47A y 76V (LPV)327,328, 48V (SQV)329, 50L (ATV)330 o 50V (FPV y DRV331), y alguna de ellas puede producir hipersusceptibilidad a otros IP: la 47A confiere elevada resistencia fenotípica a LPV (>100 veces), resistencia cruzada con FPV e hipersusceptibilidad a SQV327; la 50L causa hipersusceptibilidad a todos los IP excepto a ATV332, o la 50V causa resistencia a LPV e hipersusceptibilidad a TPV. La continua aparición de nuevas mutaciones obliga a consultar las bases de datos específicas con información actualizada sobre patrones de resistencia y su significado clínico (Los Álamosc, Universidad de Stanfordd o la Plataforma de Resistencias de la RISe3). El rescate de un tratamiento a 2 AN más un IP/r debe realizarse con 3 fármacos activos que pueden incluir NN, AN, IP/r y otros de las nuevas familias. Si se pretende utilizar un IP, el DRV/r resulta más eficaz que el LPV/r cuando existen mutaciones de resistencia frente a IP o no existen suficientes fármacos activos (ensayo TITAN, véase más adelante).
Con frecuencia, el fracaso virológico del primer TARV selecciona mutaciones de resistencia (M184V, K65R, L74V, etc.)321 que obliga a utilizar otros AN (ZDV o d4T) en los tratamientos de segunda línea que inducen toxicidad crónica y a menudo irreparable (toxicidad mitocondrial, lipoatrofia, resistencia insulínica y otras alteraciones metabólicas). Existe una tendencia entre los clínicos a evitar estos análogos y utilizar fármacos de las nuevas familias.
Cambio de tratamiento antirretroviral en el fracaso avanzado (tratamiento antirretroviral de rescate)El tratamiento tras el fracaso de al menos 2 líneas de TARV se ha denominado tratamiento de rescate. En esta situación la mayoría de los enfermos han experimentado fracaso con las 3 familias de FAR más utilizados: AN, NN e IP. Sin embargo, en los estudios genotípicos, todavía existen algunos FAR que conservan actividad moderada o elevada frente al VIH.
Existen numerosos ensayos clínicos que han comparado diferentes tratamientos de rescate. En todos ellos han utilizado IP/r o fármacos nuevos. Son estudios difícilmente comparables entre sí por la heterogeneidad de la población, los tratamientos previos, los criterios de eficacia, el tiempo de seguimiento y el tipo de tratamiento optimizado utilizado.
Inhibidores de la proteasa potenciadosLopinavir potenciado con ritonavirLa experiencia del LPV/r en el tratamiento de rescate se ha obtenido de los ensayos clínicos realizados por el resto de IP/r, que utilizan LPV/r como IP comparador (véase más adelante).
FosamprenavirEstudio CONTEXTEl CONTEXT es un ensayo clínico aleatorizado y abierto de fase iii que comparó la eficacia del FPV/r frente al LPV/r, ambos con 2 AN en pacientes tratados previamente con uno o 2 IP. Se incluyó a 300 pacientes que se asignaron para recibir FPV/r (1.400/200mg en QD), FPV/r (700/100mg en BID) o LPV/r (400/100mg en BID). Los resultados mostraron que el FPV/r en QD era inferior al LPV/r y no se pudo demostrar que el FPV/r en BID no presentara inferioridad frente al LPV/r. La proporción de pacientes con CVP inferior a 400 y a 50copias/ml a las 48 semanas fue del 50 y del 37% para FPV/r en QD, del 58 y del 46% para FPV/r en BID, y del 61 y del 50% para LPV/r333,334.
SaquinavirEstudio MaxCmin2El estudio MaxCmin2 evaluó la eficacia del SQV/r (1.000/100mg en BID) frente al LPV/r (400/100mg en BID) en un estudio abierto y aleatorizado que incluyó a 339 pacientes. A las 48 semanas (ITT, interrupción=fracaso), el 25% de los tratados con LPV/r y el 39% de los tratados con SQV/r presentaron fracaso terapéutico definido como CVP de 200copias/ml o más en cualquier momento del estudio (p=0,005). El tiempo hasta el fracaso fue similar con ambas pautas (p=0,27)335. En este estudio se utilizaron cápsulas duras con 200mg de SQV y la adherencia, los efectos adversos y el diseño abierto probablemente resultaron negativos para el grupo de SQV/r. Es posible que con la actual presentación de SQV en cápsulas duras de 500mg mejoraran estos resultados.
AtazanavirEstudio AI424 045El estudio AI424 045 comparó el ATV/r frente a la combinación ATV+SQV y frente al LPV/r en pacientes en fracaso virológico. Se requería una CVP superior a 1000copias/ml, que hubieran llevado al menos 2 regímenes previos y experiencia con algún fármaco de las 3 clases (AN, NN e IP). Todos los pacientes recibieron además TDF y otro AN. A las 24 semanas se demostró que la eficacia del grupo que combinaba ATV+SQV era inferior a la del grupo de LPV/r, por lo que se dio opción de cambiar el tratamiento. Tanto a las 24 como a las 48 semanas, el ATV/r resultó no ser inferior al LPV/r respecto al criterio de valoración primario (reducción de la CVP) y la consecución de CVP inferior a 50 o a 400copias/ml. Sin embargo, la proporción de pacientes con CVP inferior a 50 copias/ml fue del 38% en el grupo de ATV/r frente al 45% en el de LPV/r336. A las 96 semanas, el criterio de valoración primario demostró una eficacia similar del ATV/r (−2,29log10) frente al LPV/r (−2,08log10). En los pacientes en tratamiento, la proporción con CVP indetectable fue similar en ambos grupos, pero el estudio carece de poder estadístico para demostrar diferencias en este objetivo secundario. En un subestudio337 que analizó la respuesta virológica a las 48 semanas según la presencia de mutaciones en las posiciones D30, V32, M36, M46, I47, G48, I50, F53, I54, A71, G73, V77, V82, I84, N88 y L90, la respuesta fue similar si había 4 mutaciones o menos. Sin embargo, cuando el número era de 5 o más, ningún paciente (0/9) del grupo de ATV/r y el 28% (5/18) de los de LPV/r lograron indetectabilidad. Por otra parte, se identificaron mutaciones asociadas a resistencia a ambos fármacos. Las mutaciones en las posiciones M46, G73, I84 o L90 reducen la eficacia del ATV/r a menos de un 30%, al igual que las posiciones M46, I54 o I84 con el LPV/r.
El ATV/r no parece ser un buen fármaco en pacientes con experiencia a múltiples fármacos y mutaciones acumuladas a IP. Sin embargo, la cómoda posología, su bajo perfil de toxicidad y el patrón de mutaciones favorable pueden convertirlo en el IP de elección en algunos pacientes multitratados.
TipranavirEstudio RESIST 1 y 2Los estudios RESIST son estudios fase iii en los que se comparó el TPV/r con otro IP/r elegido por cada investigador. Los criterios de inclusión exigían llevar una pauta con IP, estar en fracaso virológico (CVP>1.000copias/ml) y en el estudio genotípico debía haber una o más mutaciones primarias en los codones 30, 46, 48, 50, 82, 84 o 90, y 2 o menos en los codones 33, 82, 84 o 90. Se aleatorizó a los pacientes para recibir TPV/r o un IP/r comparador (IP/rC). A todos los pacientes se les administró un tratamiento optimizado que podía incluir enfuvirtida (ENF). Los pacientes partían de CVP elevadas (mediana de 4,8log10copias/ml) y de cifras de linfocitos CD4 bajos (mediana <200células/μl). En el RESIST-1, la mayoría de los pacientes del IP/rC recibieron LPV/r (61%), mientras que en el RESIST-2 los más usados fueron APV/r (40%) y LPV/r (38%). La ENF se indicó en el 36% del RESIST-1 y en el 12% del RESIST-2 (había pacientes tratados previamente con este fármaco)338.
Los resultados conjuntos de ambos estudios a las 48 semanas mostraron una proporción de pacientes con una CVP inferior a 400copias/ml del 30,4 y del 13,8% con TPV/r y con IP/rC, respectivamente, y con una CVP inferior a 50copias/ml del 22,8 y del 10,2%, respectivamente. El uso de ENF mejoró los resultados en ambos grupos, y alcanzó el 52% (<400copias/ml) y el 35,8% (50copias/ml) en el grupo del TPV/r338.
El TPV/r tiene un perfil de interacciones específico que debe conocerse antes de usarlo en tratamientos de rescate.
Mutaciones de resistencia al tratamiento antirretroviralSe han identificado 19 mutaciones en 14 posiciones de aminoácidos (10V, 24I, 36I, 43T, 46L, 47V, 50L/V, 54A/L/M/V, 54L, 58E, 74P, 76V, 82L/T, 83D y 84V) asociadas a resistencia al TPV. Según el peso en la respuesta al tratamiento con TPV (favorezcan la respuesta, tengan impacto reducido o gran impacto en la resistencia) se les ha dado un valor en el score (10V: 1; 24I: −2; 33F: 1; 36I: 2; 43T: 2; 46L: 1; 47V: 4; 50L/V: −4; 54A/M/V: 2; 54L: −6; 58E: 3; 74P: 4; 76V: −2; 82L/T: 4; 83D: 4, y 84V: 3). En la elaboración de este score se ha tenido en cuenta la eficacia de la medicación que acompañaba al TPV. Cuando el score era de 3 o menos, la respuesta a las 8 y a las 48 semanas es máxima y mínima si el score es superior a 10. La proporción de pacientes que respondían aumentaba cuanto mayor era la eficacia de la medicación acompañante313.
DarunavirEste IP presenta una alta afinidad por la proteasa y es muy potente in vitro e in vivo frente a la cepa salvaje y a mutantes con resistencias a múltiples FAR, incluidos los IP339,340.
Estudio POWER 1 y 2Los ensayos POWER compararon la eficacia y la tolerancia de diferentes dosis de DRV/r (fase ii) frente a un IP/rC, asociados ambos a una selección optimizada de fármacos. Los pacientes incluidos tenían una CVP superior a 1.000copias/ml, habían sido tratados previamente con fármacos de las 3 familias y tenían una o más mutaciones primarias a IP. La aleatorización se estratificó por el número de mutaciones, la CVP y el uso de ENF. A las 24 semanas, la dosis de DRV/r se unificó a 600/100mg en BID. En el análisis combinado de ambos estudios, a las 48 semanas, se incluyó solamente a los pacientes que recibieron la dosis de DRV/r de 600/100mg en BID desde el principio (n=131) frente al grupo control (n=120). La variable principal de eficacia fue la respuesta virológica confirmada (reducción de la CVP ≥1log10copias/ml y TLOVR). En cuanto a la eficacia, la reducción de la CVP se alcanzó en el 61% de los pacientes del grupo de DRV/r y en el 15% del grupo comparador (diferencia: 46%; IC95%: 35–57; p<0,0001). La proporción con una CVP inferior a 50 copias/ml (ITT-TLOVR) fue del 45% en los tratados con DRV/r y del 10% en el grupo control. Esta eficacia del DRV/r se mantuvo independientemente del uso de ENF, de la CVP basal, de mutaciones primarias frente a IP o del número de FAR activos en el tratamiento optimizado. También la proporción de discontinuaciones (fracaso o abandono por cualquier motivo) fue menor en el grupo de DRV/r (el 21 frente al 81%)341. A las 96 semanas, el 39% de los pacientes tratados con DRV/r y el 9% del grupo comparador persistían con una CVP inferior a 50copias/ml (p<0,001; ITT-TLOVR)342.
El estudio POWER 3 se diseñó para incrementar los datos de eficacia, seguridad y tolerancia del DRV/r (dosis de 600/100mg en BID) y ratificar los resultados obtenidos en los estudios POWER 1 y 2343. A las 144 semanas, el 37 y el 9% de los pacientes, respectivamente, persistían con una CVP inferior a 50copias/ml344.
Estudio TITANEl TITAN es un ensayo fase iii, aleatorizado, que comparó la eficacia del DRV/r frente al LPV/r, ambos con un tratamiento optimizado, en pacientes en fracaso virológico pero con menor experiencia en tratamientos que en los estudios POWER. Los criterios de inclusión fueron CVP superior a 1.000copias/ml, duración de TARV de 12 semanas o más y que nunca hubieran recibido LPV/r. Los datos deberían analizarse con criterios de no presentar inferioridad. No obstante, con la finalidad de realizar una comparación entre ambas opciones terapéuticas, el diseño del estudio recogía, a priori, que se realizaría un estudio de superioridad por ITT en caso de cumplirse la situación de no presentar inferioridad. Se incluyó a 595 pacientes. A las 48 semanas se observó (ITT) que el 77% de los pacientes tratados con DRV/r y el 67% del grupo LPV/r alcanzaron la variable principal del estudio: CVP inferior a 400copias/ml (diferencia media estimada; 10%; IC95%: 2–17; p<0,001); el DRV/r cumplía por tanto criterios de superioridad frente al LPV/r. También se observaron diferencias con criterios de superioridad del DRV/r cuando se analizó la proporción con CVP inferior a 50copias/ml (el 71 frente al 60%; diferencia media estimada; 11%, IC95%: 3–19; p=0,005). En el análisis de subgrupos respecto a la CVP inferior a 50copias/ml, el DRV/r resultó también superior al LPV/r si los linfocitos CD4 basales eran bajos, la CVP era superior a 100.000copias/ml, había presencia de una o más mutaciones primarias a IP, el fold-change de LPV/r era superior a 10 o el fold-change de DRV era inferior a 10. El fracaso virológico fue del 10% en el grupo de DRV/r y del 22% en el de LPV/r. En el análisis de las mutaciones de resistencia, solo el 21% (6/28) de los pacientes que fracasaron con DRV/r desarrollaron mutaciones adicionales en el gen de la proteasa, mientras que sí lo hizo el 36% (20/56) del grupo LPV/r. Las mutaciones frente a AN fueron menos frecuentes en el grupo con DRV/r (el 14 frente al 27%). Los autores concluyen que en pacientes con experiencia limitada a TARV y en fracaso virológico, el DRV/r no es inferior al LPV/r respecto a la variable principal del estudio (CVP <400copias/ml) y es superior cuando se analiza la CVP inferior a 50copias/ml. La seguridad y la tolerancia del DRV/r fueron comparable a las del LPV/r, con menos diarrea de grado 2–4 y mejor perfil lipídico345.
Estudio GRACEEl estudio GRACE (Gender, race and clinical experience) es un estudio en fase iiib, multicéntrico y abierto, que incluyó a pacientes con experiencia previa a FAR y con una CVP de 1.000copias/ml o más. Todos los pacientes recibieron DRV/r (600/100mg en BID) con un tratamiento optimizado que incluía AN y NN, incluida la ETR. El objetivo principal fue evaluar si había diferencias según el sexo o la raza de los pacientes respecto a la eficacia (CVP <50copias/ml) del tratamiento a las 48 semanas. Se incluyó a 429 pacientes, de los cuales un 67% eran mujeres y un 84% eran de raza negra. Un 32,8% de las mujeres suspendió el TARV frente a un 23,2% de los hombres (p<0,05). A las 48 semanas, en el ITT-TLOVR, un 50,9% de las mujeres y un 58,5% de los hombres alcanzaron una CVP inferior a 50copias/ml. Las diferencias en la respuesta virológica ajustada por la CVP y el recuento de linfocitos CD4 basales fue de −9,6 (IC95%: −19,85–0,68). En el ITT-TLOVR en el que se censuraron los pacientes que fracasaron por causas diferentes al fracaso virológico, un 73 y un 73,5% de las mujeres y de los hombres alcanzaron una CVP inferior a 50copias/ml, diferencia de −3,9 (IC95%: −13,89–6,02. Los autores resaltan la eficacia y la seguridad del DRV/r en los tratamientos de rescate tanto en hombres como en mujeres, aunque una elevada proporción de mujeres abandonan el TARV por razones distintas al fracaso virológico346.
Mutaciones de resistencia a darunavirSe han identificado 11 mutaciones del gen de la proteasa (V11I, V32I, L33F, I47V, I50V, I54L o M, T74P, L76V, I84V, L89V) relacionadas con pérdida de sensibilidad al DRV. La presencia de 3 o más de estas mutaciones al inicio del tratamiento supuso una menor proporción de pacientes con CVP indetectable a las 24 semanas (aun siendo mayor que en el grupo control). Con solo una o 2 de estas mutaciones esa proporción fue del 53 y del 37%347.
Las interacciones farmacológicas del DRV son mínimas, sin embargo, ciertas combinaciones farmacológicas están contraindicadas (véase más adelante).
Inhibidores de la transcriptasa inversa no análogos de nucleósidoEtravirinaLa ETR es un NN de nueva generación activo en pacientes con infección por el VIH con mutaciones de resistencia frente a EFV y NVP.
Estudios DUET 1 y 2Los ensayos clínicos en fase iii DUET se diseñaron para analizar la eficacia y la seguridad de la ETR en pacientes con experiencia previa a FAR. Con un diseño similar, DUET 1 y 2, son ensayos multinacionales, paralelos, aleatorizados y doble ciego de ETR frente a placebo. Los criterios de inclusión eran CVP superior a 5.000copias/ml, TARV estable durante 8 semanas o más, presencia de una o más mutaciones frente a NN y de 3 o más mutaciones frente a IP. Todos los pacientes recibieron DRV/r y AN según tratamiento optimizado. El uso de ENF fue opcional. La variable principal del estudio era conseguir a las 24 semanas una CVP inferior a 50copias/ml (ITT-TLOVR). Se incluyó a 612 pacientes en el DUET-1 y a 591 en el DUET-2. Los resultados fueron CVP inferior a 50copias/ml en los tratados con ETR, el 56 y el 62% (DUET-1 y DUET-2) frente al 39 y el 44% (en grupos placebo), respectivamente, (p<0,01 y p<0,001). La CVP se redujo en 2,4 y 2,3log10 en los grupos con ETR y en 2,3 y 1,7log10 en los de placebo (diferencia no significativa). Entre los pacientes que recibieron ETR y ENF en el tratamiento optimizado, el 60 y el 73% alcanzaron una CVP inferior a 50copias/ml frente al 56 y el 68% de los del grupo placebo348,349. Los resultados conjuntos de ambos estudios a las 48 semanas confirman los datos previos con el 61% de los pacientes con ETR que alcanzaron una CVP inferior a 50copias/ml frente al 40% de los pacientes asignados al grupo placebo (p<0,0001); el descenso de la CVP era de −2,25log10 y –1,49log10, respectivamente350. A las 96 semanas, el análisis combinado de ambos estudios señala que la eficacia de la ETR más tratamiento optimizado fue superior al grupo comparador: el 57 frente al 36%, respectivamente (p<0,001). El 91% de los pacientes asignados a ETR que alcanzaron una CVP inferior a 50 copias a las 48 semanas persistía con la misma eficacia virológica a las 96 semanas351. Por otra parte, el número de episodios clínicos asociados a sida o muerte fue menor en el grupo que recibió ETR (p=0,06) y alcanzó diferencias estadísticamente significativas cuando se compararon los pacientes de ambos grupos que además utilizaban ENF (el 5,9% en el grupo de ETR frente al 10,1% en el grupo placebo; p=0,02)352.
La tolerancia a la ETR fue buena, su efecto secundario más frecuente fue un exantema leve o moderado (el 2% suspendió la ETR).
La ETR tiene muy pocas interacciones medicamentosas (véase más adelante).
Mutaciones de resistencia a etravirinaSe han identificado 17 mutaciones que pueden disminuir la respuesta a la ETR: V90I, A98G, L100I, K101E/H/P, V106I, E138A, V179D/F/T, Y181C/I/V, G190A/S y M230L353. Entre estas mutaciones, la presencia de la Y181I o la Y181V seguidas de la L100I, K101P, Y181C y M230L son las que generan una mayor resistencia a ETR. Estas mutaciones tienen una baja prevalencia en la población con VIH con fracaso virológico312.
Por otra parte, Monogram ha desarrollado un score que asigna a cada mutación un valor en función de su peso (valor 4: L100I, K101P, Y181C/I/V; valor 3: E138A/G, V179E, G190Q, K238T, K101P, V106A, E138K, 179L, Y188L, y valor 1: V90I, K101H, V106M, E138Q, V179D/F/M, Y181F, Y189I, G190E/T, H221Y, P225H, K238T). Si el resultado es inferior a 4, la ETR tiene un 90% de probabilidades de ser eficaz (fold-change<2,9)354. La plataforma de resistencias de RIS adjudica 2 puntos a las mutaciones Y181C/I/V, L100I, K101P, M230L y un punto al resto, y considera resistencia un score de 3 o más312.
Inhibidores de la uniónEnfuvirtidaLa ENF inhibe la fusión del VIH y evita su penetración y replicación. Se administra por vía subcutánea y su principal efecto adverso es la reacción en el punto de inyección.
Estudios TORO I y IILos estudios TORO son 2 ensayos fase iii en los que se comparó la actividad antiviral de la ENF en combinación con una pauta optimizada frente a una pauta optimizada en pacientes en fracaso viral con múltiples tratamientos previos. Se incluyó a alrededor de 1.000 pacientes, con una mediana de CVP basal superior a 100.000copias/ml y de linfocitos CD4 inferior a 100células/μl. A las 24 semanas, el descenso de la CVP fue mayor en los tratados con ENF que en los tratados con la pauta optimizada. La ENF produjo un descenso de la CVP de −0,93log10 (TORO I) y de −0,78log10 (TORO II) (p<0,0001)355,356. A las 48 semanas, en el análisis combinado de los 2 estudios, el descenso de la CVP fue de −1,48log10copias/ml (ENF) y de −0,63log10copias/ml en el tratamiento optimizado (p<0,0001)357. La probabilidad de alcanzar una respuesta virológica fue más del doble en el grupo de ENF (descenso de CVP superior a 1log10: el 37 frente al 17%; CVP inferior a 400copias/ml: el 30 frente al 12% y CVP inferior a 50copias/ml: el 18 frente al 8% [p<0,0001]). El tiempo hasta el fracaso del grupo con ENF triplicó al grupo control (32 y 11 semanas; p<0,0001)358. Es decir, tanto el análisis primario de eficacia como el resto de los análisis secundarios predefinidos demostraron que el tratamiento de rescate era más eficaz cuando se utilizaba ENF.
Se han identificado mutaciones en la región HR1 de la gp41 del virus que reducen la sensibilidad al ENF (G36D/S, I37V, V38A/M/E, Q39R, Q40H, N42T, N43D). Otras mutaciones o polimorfismos en otras regiones de la envoltura, como por ejemplo la región HR2, podrían disminuir la sensibilidad a ENF331. Por esto, secuenciar solo las mutaciones de la región HR1 podría ser inadecuado cuando se sospecha resistencia a ENF.
Un consenso español recomienda su uso en pacientes en los que no se pueda confeccionar un tratamiento óptimo con 3 fármacos359.
Antagonistas del correceptor CCR5MaravirocEl MVC es un inhibidor de la entrada que bloquea uno de los correceptores de quimioquinas (CCR5) utilizados por el VIH para entrar en la célula. El MVC es un antagonista del correceptor CCR5 e impide la entrada del virus con tropismo R5. Presenta una actividad potente frente a cepas con tropismo R5, tanto silvestres como con mutaciones para AN, NN o IP360.
Estudios MOTIVATE 1 y 2Los estudios MOTIVATE 1 y 2 son 2 ensayos clínicos en fase iii, paralelos y doble ciego, en los que se aleatorizó a los pacientes incluidos para recibir MVC (en QD o en BID) frente a placebo y se añadió a cada uno de los grupos un tratamiento optimizado. Los criterios de inclusión fueron una CVP superior a 5.000copias/ml, tropismo R5 y resistencia a uno o más FAR o a 2 o más IP. Los pacientes se estratificaron según el uso de ENF y la CVP. Se incluyó a más de 1.000 pacientes, de los que 209 recibieron placebo, 414 MVC en QD (150 o 300mg) y 426 MVC en BID (150 o 300mg). La variable principal del estudio fue la reducción de la CVP a las 48 semanas, y la proporción de pacientes con CVP inferior a 400 o 50copias/ml fue una variable secundaria.
Los resultados combinados de ambos estudios a las 48 semanas muestran que el descenso de CVP fue de −1,68log con MVC en QD, de −1,84log con MVC en BID y de −0,78log en el grupo placebo. La proporción de pacientes con CVP inferior a 400copias/ml fue del 51,7, el 56,1 y el 22,5%, respectivamente, (p<0,0001 frente a placebo) y con CVP inferior a 50copias/ml del 43,2, el 45,5 y el 16,7% (p<0,001 frente a placebo). El incremento de linfocitos CD4 fue también significativamente mayor en los grupos que recibieron MVC, independientemente de la dosificación361. Esta ventaja en la recuperación inmunológica puede tener trascendencia en el futuro, ya que también se la ha demostrado con independencia de la eficacia virológica362. La eficacia (CVP <50copias/ml) fue también superior cuando los pacientes recibieron ENF por primera vez: el 64 y el 61% en los grupos que recibieron MVC y el 27% en los grupos que recibieron placebo+ENF363. A las 96 semanas, el 41,3% de los pacientes que recibieron MVC en BID persistían con una CVP inferior a 50copias/ml frente al 7,2% de los pacientes del grupo placebo364.
Los efectos adversos producidos por el MVC no fueron superiores a los del grupo placebo. Los temores iniciales de mayor riesgo de hepatotoxicidad o de mayor incidencia de tumores no se han confirmado363,365,366.
Se analizó retrospectivamente la relación del fracaso virológico en los pacientes de los MOTIVATE con el tropismo viral. Dos tercios de los pacientes con MVC que fracasaron tenían un tropismo dual (R5/X4) o bien el tropismo varió entre la selección y el inicio del tratamiento. El cambio de tropismo del R5 a dual o a X4 se observó en el 7,5% de los pacientes que fracasaban con MVC y solo en el 1,9% del grupo placebo. No se observó cambio de tropismo en el 4% de los fracasados que recibían MVC. Tras la retirada del MVC, las cepas revertían rápidamente a R5. Todos los pacientes que recibían MVC presentaron un incremento significativo de los linfocitos CD4367.
Resistencia a maravirocLa eficacia del MVC exige la presencia de tropismo viral R5 y no es activo cuando las poblaciones virales presentan tropismo viral X4 o dual (R5/X4). Algunos casos de FV durante el tratamiento con MVC corresponden a un sobrecrecimiento de poblaciones virales con tropismo X4 preexistentes y no detectadas por la baja sensibilidad de la prueba (Trophile® detectaba virus X4 con una certeza del 100% solo cuando la proporción era del 10% o más de la población viral y la CVP era superior a 1.000copias/ml). La técnica de Trophile ultrasensible detecta poblaciones minoritarias con tropismo X4 hasta en una proporción inferior al 1%. Además, se han identificado mutaciones en la molécula gp120 que permite al virus unirse al receptor R5 en presencia de MVC sin cambiar de tropismo durante el tratamiento331. El perfil de mutaciones seleccionadas por el MVC es complejo y todavía no se conoce su importancia y su frecuencia de aparición.
El MVC es un sustrato de la P-gp y su metabolismo se realiza a través del CYP3A4, por lo que presenta un potencial importante de interacciones con fármacos que utilizan la misma vía metabólica (véase capítulo «Interacciones»).
Inhibidores de la integrasaRaltegravirLa integrasa es una de las 3 enzimas fundamentales del ciclo de replicación del VIH. Su función es catalizar la inserción del ADN proviral en el genoma de la célula huésped. El RAL es un fármaco capaz de inhibir la integrasa, es activo frente a cepas del VIH con mutaciones de resistencia a las 3 familias clásicas y frente a cepa silvestre368.
Estudios BENCHMRK 1 y 2Los ensayos clínicos en fase iii BENCHMRK 1 y 2 son estudios paralelos, aleatorizados y doble ciego diseñados para analizar la eficacia del RAL en rescate de pacientes expuestos a múltiples FAR y en fracaso virológico. Los criterios de inclusión fueron CVP superior a 1.000copias/ml y resistencia genotípica o fenotípica al menos a un fármaco de cada una de las 3 clases (AN, NN e IP). Se incluyó a 350 pacientes (BENCHMRK 1) y a 349 (BENCHMRK 2) en situación clínica muy avanzada (criterios de sida: 82%) y que habían recibido una mediana de 12 FAR durante 9,9 años. Los pacientes fueron aleatorizados (2:1) para recibir RAL o placebo, ambos con tratamiento optimizado. En los resultados combinados de ambos estudios a las 16 semanas, la proporción de CVP inferior a 400copias/ml fue del 77,5% en el grupo RAL y del 41,9% en el grupo placebo. La CVP inferior a 50copias/ml fue del 61,8% en el grupo RAL y del 32,9% en el grupo placebo (p<0,001). A las 48 semanas, el porcentaje de pacientes con CVP inferior a 50copias/ml fue del 62,1% para el grupo de pacientes que recibió RAL frente al 32,9% del grupo placebo (p<0,001)369. La eficacia del RAL fue independiente de la CVP, de los linfocitos CD4+ o del índice GSS/PSS de 2 o más.
Cuando en el tratamiento optimizado se asoció DRV/r y ENF, la proporción de CVP inferior a 400copias/ml fue del 98% (RAL) y del 87% (placebo); si solamente recibían ENF, el 90% (rama RAL) y el 63% (rama placebo) tenían una CVP inferior a 400copias/ml, mientras que si sólo recibían DRV/r, las proporciones fueron del 90 y el 55%370. La seguridad y la tolerabilidad de RAL resultaron comparables al placebo. Se observó una mayor incidencia de neoplasias en el grupo asignado a RAL (el 3,5 frente al 1,7%), aunque no se ha comunicado ninguna relación directa con el fármaco. En estudios posteriores que analizan la incidencia de las neoplasias en ensayos clínicos y programas de acceso expandido no se observa una mayor incidencia de cáncer en los pacientes que reciben RAL371.
El análisis combinado a las 96 semanas de los estudios BENCHMRK demostró la eficacia duradera de RAL. El 58% de los pacientes que recibieron RAL persistían con una CVP inferior a 50copias/ml frente al 26% de los pacientes del grupo placebo. Este porcentaje se incrementó al 79% cuando los pacientes recibían además otros fármacos activos372.
El RAL se metaboliza por glucuronización hepática; no es inductor o inhibidor de las isoenzimas del CYP, por lo que su potencial de interacciones farmacológicas es bajo (véase capítulo «Interacciones»).
Estudio TRIOEstudio abierto no comparativo que tuvo como objetivo evaluar la eficacia y la seguridad de un TARV de rescate que contenía RAL+DRV/r+ETR. Los criterios de inclusión fueron los siguientes: edad de 18 años o más, CVP superior a 1.000copias/ml, sin tratamiento previo con fármacos en investigación y con historia de fracaso virológico a NN. Los pacientes debían ser portadores de infección por el VIH multirresistente con el siguiente patrón de resistencias genotípicas: 3 o más mutaciones primarias de resistencia a IP (D30N, V32I, L33F, M46I/L, I47A/V, G48V, I50L/V, I54M, L76V, V82A/F/L/T/S, I84V, N88S y L90M); 3 o más mutaciones a AN; 3 o menos mutaciones a DRV (V11I, V32I, L33F, I47V, I50V, I54L/M, G73S,L76V, I84V y L89V), y 3 o menos mutaciones a NN (A98G, L100I, K101Q/P/E, K103H/N/S/T, V106A/M, V108I, E138G/K/Q, V179D/E/F/G/I, Y181C/I/V/C/H/L, Y188C/H/L, G190A/C/E/Q/S, P225H, F227C/L, M230I/L, P236L, K238N/T y Y318F). Ciento tres pacientes cumplieron los criterios de inclusión y recibieron el tratamiento. Los resultados del estudio son los siguientes: a las 24 semanas, 93 pacientes (90%; IC95%: 85–96) y, a las 48 semanas, 89 pacientes (86%, IC95%: 80–93) lograron una CVP inferior a50copias/ml. La mediana de descenso de la CVP a las 48 semanas respecto al valor basal fue de –2.4log (IQR: −2,9 a −1,9). La mediana de ascenso de los linfocitos CD4 respecto al valor basal fue de 108/μl (IQR: 58–169). Durante el período del estudio, sólo un paciente tuvo que suspender el tratamiento por toxicidad373.
Mutaciones de resistencia a raltegravirEn estudios in vitro se han identificado hasta 41 mutaciones del gen de la integrasa asociadas a resistencia. Un total de 105 pacientes de 462 que recibieron RAL en los estudios BENCHMRK desarrolló fracaso virológico a las 48 semanas, aunque solo en 94 se pudo realizar estudio de resistencias. En el 68% (64/94) se detectaron mutaciones de resistencia a RAL con 3 patrones de resistencia: 1) N155H+L74M, E92Q, T97A, V151I, G163R; 2) Q148K/R/H+G140S/A, E138K, y 3) Y143R/C+L74A/I, T97A, I203M, S230R. El RAL es un fármaco de barrera genética baja o intermedia, y son necesarias 2 mutaciones para la resistencia completa.
Opciones de tratamiento en pacientes con múltiples fracasos virológicos y sin opciones terapéuticasEn general, el fracaso virológico en el paciente multitratado rara vez conduce de forma rápida al fracaso inmunológico y a la progresión clínica24,374,375. De hecho, muchos pacientes continúan con recuentos de linfocitosCD4 estables y aproximadamente solo un tercio experimenta un descenso376. Este último hecho se observa cuando la CVP es elevada, habitualmente superior a 10.000–20.000copias/ml.
En un paciente en el que resulte imposible construir un TARV potencialmente eficaz con al menos 2 fármacos activos por problemas de resistencia, toxicidad, comorbilidad grave, falta de adherencia o tolerancia pueden plantearse otras opciones diferentes al tratamiento de rescate si la situación inmunitaria del paciente lo permite.
Suspensión del tratamiento antirretroviralLa interrupción del tratamiento en pacientes multirresistentes se planteó ante la hipótesis de que la reaparición de la cepa silvestre permitiría una mejor respuesta tras la reintroducción del tratamiento. Los ensayos clínicos realizados para evaluar esta estrategia han evidenciado un descenso importante del número de linfocitos CD4 durante la interrupción frente a los que continúan con el TARV377,378.
Tratamientos con pautas de tratamiento antirretroviral no supresorasDiversos estudios han demostrado los efectos beneficiosos de mantener un tratamiento no supresor en caso de infección avanzada multirresistente379. En una publicación reciente se comunicó que en pacientes con un recuento de linfocitos CD4 inferior a 50 células/μl, el riesgo de desarrollar una enfermedad oportunista tipo sida era un 22% inferior si el paciente continuaba con el TARV a pesar de presentar fracaso virológico respecto a los que lo suspendieron380.
El tratamiento de un paciente con escasas opciones terapéuticas puede ser un tratamiento no supresor. Deben ser tratamientos cómodos, poco tóxicos y que disminuyan la capacidad replicativa viral. No se recomienda continuar con pautas no supresoras que contengan IP, NN o IInt, ya que la acumulación de resistencias frente a estos fármacos dificultaría la eficacia de futuros fármacos de estas familias. Pautas con 2 o 3 AN que incluyan 3TC o FTC podrían resultar parcialmente eficaces en algunos pacientes, aunque obligaría a una monitorización frecuente del recuento de linfocitos CD4381.
La mutación M184V afecta la capacidad replicativa del VIH. Un ensayo que incluía pacientes multirresistentes con esta mutación, aleatorizados para continuar solo con 3TC o para suspender el tratamiento, mostró a las 48 semanas que el 69% (IC95%: 51–83) del grupo que interrumpió frente al 41% (IC95%: 26–59) de los que continuaron con 3TC presentó un episodio clínico o fracaso inmunológico. En los pacientes que recibían 3TC el fracaso fue más tardío (p=0,01) y el descenso de linfocitos CD4, el rebrote de la CVP y el aumento de la capacidad replicativa fueron menores382. En función de estos estudios se propone que el tratamiento de pacientes con múltiples fracasos contenga 3TC o FTC para mantener en la población viral la mutación M184V y reducir su capacidad replicativa383.
Replicación viral baja en pacientes multitratadosCon las recomendaciones actuales sobre el TARV, 2 determinaciones sucesivas de CVP superiores a 50copias/ml tras 6 meses de iniciado el TARV o tras haber conseguido previamente una CVP inferior a 50copias/ml se considera fracaso virológico. En los ensayos clínicos realizados en pacientes sin tratamiento previo como en los realizados en pacientes con fracasos virológicos, un número no desdeñable de pacientes consiguen un descenso significativo importante de la CVP (<400copias/ml), pero no alcanzan la máxima supresión viral. Esta proporción se incrementa en pacientes con fracasos previos y acumulación de mutaciones de resistencia frente a diferentes FAR. Con frecuencia, los pacientes con replicación viral baja (RVB) y persistente del VIH, y que podemos definir como una CVP de entre 50–500/1.000copias/ml, mantienen o incluso aumentan el número de linfocitos CD4. La ausencia de alternativas terapéuticas, la conservación de la inmunidad y la dificultad de realizar pruebas de resistencia genotípicas o determinación del tropismo viral por la baja viremia plasmática aconsejan mantener al paciente con el mismo tratamiento mientras la CVP no se eleve de determinado valor. En este escenario se han propuesto diferentes estrategias terapéuticas, aunque ninguna de ellas ha sido evaluada en estudios prospectivos longitudinales y comparativos. Algunos autores han demostrado que la intensificación del tratamiento podría conseguir de nuevo valores de CVP inferiores a 50copias/ml384, aunque la intensificación podría constituir un tratamiento subóptimo especialmente si se utilizan fármacos con barrera genética baja. Otra posibilidad consistiría en realizar una pruebas más sensibles de resistencias genotípicas que permiten detectar mutaciones a pesar de la CVP baja385,386. No se sabe cuál es la mejor actitud en pacientes con RVB, aunque se conoce que los pacientes con RVB pueden seleccionar nuevas mutaciones de resistencia, fracasos385,386 y contribuir a la diseminación de la infección a otras personas387. La tolerancia al tratamiento, la opinión del paciente, la posibilidad de realizar pruebas de resistencia o tropismo viral y sobretodo la posibilidad de cambiar el TARV incluyendo al menos 2 FAR plenamente activos condicionan la actitud del clínico en este escenario clínico.
Recomendaciones de cambio de tratamiento antirretroviral por fracaso virológico
- •
Se debe conseguir una CVP indetectable (<50copias/ml) en el TARV en segunda línea o posterior (nivel A).
- •
El TARV nuevo debe contener 3 FAR totalmente activos (nivel A).
- •
Se deben realizar un estudio de resistencias y una prueba de tropismo para confeccionar el mejor régimen alternativo (nivel B). La prueba de resistencias debe realizarse mientras el paciente está recibiendo el tratamiento fallido o lo más precozmente tras la suspensión.
- •
Si es imposible diseñar un TARV de rescate con 3 fármacos activos, la combinación de 2 plenamente activos y otros que conserven cierta actividad puede resultar eficaz en una elevada proporción de pacientes.
- •
El cambio del TARV por fracaso virológico debe efectuarse de modo precoz para evitar el acúmulo de mutaciones y facilitar la respuesta al nuevo tratamiento (nivel C).
- •
En la elección del nuevo TARV se deben analizar las causas que motivaron el fracaso (adherencia o interacciones medicamentosas), la historia farmacológica, las toxicidades que haya presentado y las mutaciones de resistencia previas (nivel C).
- •
El nuevo TARV debe ser cómodo, bien tolerado por el paciente y lo menos tóxico posible. Debe insistirse en la adherencia antes de iniciar un rescate (nivel C).
- •
Debe evitarse los análogos de timidina, especialmente d4T, si existen otras alternativas en cualquiera de las líneas del tratamiento de rescate (nivel C).
- •
No se deben realizar interrupciones estructuradas del TARV en situaciones de fracaso virológico con el objetivo de aumentar la eficacia del tratamiento de rescate (nivel A).
- •
No se recomienda suspender el TARV en pacientes en situación de fracaso virológico y sin opciones terapéuticas de rescate (nivel B). En esta situación debe buscarse un tratamiento basado en fármacos que disminuyan la capacidad replicativa viral (p. ej., 3TC, FTC o TDF) y debe vigilarse estrechamente su eficacia mediante determinaciones periódicas del recuento de linfocitos CD4 y de CVP (nivel C).
- •
Es recomendable, en determinas circunstancias, consultar con un clínico con experiencia en TARV de rescate o enviar al paciente a otro centro hospitalario que disponga de experiencia y fármacos suficientes para conseguir un TARV con las máximas posibilidades de éxito (nivel C).
Se entiende por simplificación del TARV el cambio de un esquema terapéutico que ha conseguido la supresión de la replicación viral por otro más sencillo que sigue manteniendo esta supresión. Sus objetivos son mejorar la calidad de vida, facilitar la adherencia y prevenir o revertir algunos efectos adversos.
Con la simplificación se consigue reducir el número de comprimidos o la frecuencia de tomas, aprovechar la comodidad de las coformulaciones, eliminar las restricciones alimentarias, mejorar los efectos secundarios y reducir o eliminar las interacciones.
Esta estrategia empezó a utilizarse con la aparición de los NN. La mayoría de los estudios de simplificación iniciales se efectuó a partir de pautas con IP no potenciados. La potenciación con RTV de los IP fue el primer paso para elaborar regímenes terapéuticos que no presentan los problemas de complejidad y tolerancia de los IP iniciales. Los IP de segunda generación y las nuevas formulaciones de los antiguos, así como las coformulaciones y los fármacos de nuevas clases, han contribuido también a construir tratamientos sencillos.
En la actualidad, la mayoría de los pacientes inician tratamiento con combinaciones sencillas y, con posterioridad, cuando estas fracasan, pasan a tratamientos más complejos. La simplificación ha sido una estrategia muy utilizada durante un período largo de tiempo, pero en la actualidad las pautas con tratamientos sencillos desde el principio son la práctica habitual y quedan pocos para simplificar.
Se puede simplificar el TARV al reducir el número de fármacos, el número de comprimidos o el número de tomas.
Reducción del número de fármacosLos primeros estudios de simplificación del TARV tuvieron como objetivo la reducción del número de fármacos, esto se denominó estrategia de inducción-mantenimiento consistente en una primera fase de inducción con 3 o 4 antirretrovirales seguida del mantenimiento con menos de 3 fármacos.
Esta estrategia se cuestionó por el fracaso de algunos ensayos iniciales. Algún estudio posterior no encontró diferencias en la proporción de pacientes con CVP inferior a 50copias/ml (el 79 frente al 77%) a las 48 semanas entre la rama de simplificación y la de mantenimiento del TARV inicial, las reacciones adversas fueron menos frecuentes en el grupo de simplificación (el 15 frente al 6%) y mejoraron el perfil lipídico y la adherencia216.
Se ha explorado la estrategia de simplificar a monoterapia con LPV/r tras un tiempo de inducción con tratamiento triple que incluye a este fármaco. En un estudio piloto español comparativo, aleatorizado y abierto, en el que se incluyó a 42 pacientes, 21 se simplificaron a monoterapia con LPV/r388. A las 72 semanas, la proporción de CVP indetectable en el grupo de monoterapia era la misma (81%) y había descendido al 90,5% en el grupo de tratamiento triple (p=0,38)389. En los pacientes que fracasaron no se observaron mutaciones genotípicas de resistencia y se reindujo la supresión viral al reintroducir los AN previamente retirados. Los datos a las 96 semanas confirman la durabilidad y la seguridad de esta estrategia390. Tras este estudio, se realizó el estudio OK04, que incluyó a 205 pacientes con CVP indetectable durante al menos 6 meses (mediana de 28) que estaban tomando un TARV que incluía LPV/r asociado a 2 AN. Es un estudio aleatorizado, abierto, de crierior de no presentar inferioridad, que comparaba la estrategia de continuación del tratamiento triple frente a la monoterapia con LPV/r, seguido de la reinducción con 2 AN si aparecía rebrote viral. A las 48 semanas, el porcentaje de pacientes sin fracaso virológico fue del 90 y el 94% respectivamente (diferencia: −4%; límite superior del IC95% para la diferencia: 3,4% al cumplir el criterio de no presentar inferioridad). El porcentaje de pacientes con CVP inferior a 50copias/ml a las 48 semanas (ITT), considerando las reinducciones como fallos, fue del 85% en el grupo de monoterapia y del 90% en el de continuación (p=0,31). Los episodios de viremia de bajo nivel, con CVP de entre 50–500copias/ml fueron más frecuentes en los pacientes tratados con monoterapia (4 frente a ninguno)391.
Con los pacientes de estos 2 estudios se efectuó un análisis multivariante de los factores predictores de pérdida de respuesta virológica del grupo tratado con LPV/r en monoterapia. El fracaso virológico se relacionó con la falta de adherencia, niveles bajos de hemoglobina y un nadir de linfocitos CD4 inferior a 100células/μl392.
En otro estudio de simplificación a monoterapia con LPV/r, la estrategia fue algo distinta. Se incluyó a 155 pacientes sin tratamiento previo a los que se aleatorizó (2:1) para iniciar tratamiento con ZDV+3TC junto con LPV/r (n=104) o con EFV (n=51). Entre las 24 y 48 semanas de tratamiento y tras al menos 3 controles con CVP inferior a 50copias/ml, los pacientes que tomaban LPV/r pasaron a mantenimiento con LPV/r en monoterapia. Se consideró fracaso a cualquier viremia positiva y a las 96 semanas de seguimiento, un 48% de los pacientes en tratamiento con LPV/r y un 61% con EFV presentaban una CVP inferior a 50copias/ml (p=0,17; IC95% para la diferencia: −29–4). En un nuevo análisis en el que se incluyeron como respondedores a los pacientes que tras reintroducir los mismos AN consiguieron de nuevo CVP inferior a 50copias/ml, el 60% de los pacientes en tratamiento con LPV/r y el 63% con EFV respondieron al tratamiento (p=0,73; IC95%: −19–13). Se observaron viremias de bajo nivel en los pacientes en monoterapia. En cuanto a la seguridad, se observó lipoatrofia en el 5% del grupo de monoterapia frente al 34% del grupo de EFV. No se observaron diferencias en cuanto a la lipohipertrofia. Las alteraciones lipídicas grado 3–4 fueron más frecuentes en el grupo de LPV/r393.
En estos 2 estudios se pone de manifiesto la importancia del período durante el cual la CVP permanece indetectable previamente al paso a monoterapia.
Esta misma estrategia se está explorando con ATV/r394 y DRV/r395,396.
Se han publicado los resultados a las 48 semanas de un estudio piloto, abierto, de un solo grupo, de simplificación a ATV/r: el ACTG 5201394. Se incluyó en este estudio a 34 pacientes que habían iniciado tratamiento con 2 AN e IP, que estaban con carga viral indetectable (<50copias/ml) durante al menos 48 semanas, que no se los había tratado con NN, no presentaban fallo virológico previo y eran HBsAg negativos. En el momento de entrar en el estudio se sustituía el IP que estaban tomando por ATV/r y 6 semanas después se suspendían los AN. El objetivo primario del estudio era medir el tiempo hasta el fallo virológico. A las 48 semanas, 30 pacientes (88%) seguían con carga viral indetectable. En los que presentaron fallo virológico no se detectaron mutaciones de resistencia. Además, en el análisis de la viremia residual se observó que no se modificaba en los pacientes en los que no hubo fallo virológico, pero aumentaba progresivamente en los que lo tuvieron; se detectó desde 4–12 semanas antes de que se confirmara el fracaso. Más recientemente se han comunicado datos del estudio OREY. Se trata de un estudio piloto, abierto, multicéntrico, de grupo único y 96 semanas de seguimiento, que evaluó la monoterapia con ATV/r. Se incluyó a 61 pacientes que estaban recibiendo TARV, que no habían tenido ningún fracaso previo (CVP <50copias/ml al menos 24 semanas) y en tratamiento con ATV/r y 2 AN al menos las 8 semanas antes de su inclusión. En el análisis a las 48 semanas, la mayoría de los pacientes mantuvó la supresión virológica (el 79% con CVP inferior a 400copias/ml) tras cambiar a monoterapia, la reintroducción del tratamiento triple fue generalmente satisfactoria (7 de 9 pacientes). El desarrollo de mutaciones primarias a IP fue raro397.
En cuanto al DRV/r, se han comunicado 2 ensayos clínicos que exploran 2 escenarios distintos en los que se estudian la eficacia y la seguridad de la administración de DRV/r en monoterapia. En el estudio MONET395 se incluyó a 256 pacientes en TARV con 2 AN y un NN o con un IP/r, sin experiencia previa a DRV/r ni historia de fallo virológico, con carga viral indetectable (<50copias/ml) durante al menos 6 meses. Se los aleatorizó para tomar DRV/r (800/100 en QD) (n=129) en monoterapia o con 2 AN optimizados (n=127). Se trata de un estudio de criterio de no presentar inferioridad en el que el objetivo primario es medir el TLOVR. Aunque el seguimiento programado es de 96 semanas, los datos comunicados corresponden a la semana 48; en ellos se confirma que la rama de DRV/r en monoterapia no presenta inferioridad. En el ITT, al considerar cambio de tratamiento como un fracaso, el 85,3% de los pacientes que tomaban DRV/r frente al 84,3% de los que tomaban además 2 AN presentaba una CVP indetectable (−1; límite del IC95%: −9,9). En cuanto a la aparición de resistencias, se ha detectado un paciente por rama con evidencia de resistencia genotípica, pero no fenotípica a DRV. En el estudio MONOI396 el diseño es distinto. Se trata de un ensayo clínico, aleatorizado, abierto, en el que se incluyó a pacientes que habían recibido TARV durante al menos 18 meses, que presentaban una CVP inferior a 400copias/ml durante los 18 meses previos y una CVP inferior a 50copias/ml en el momento de la inclusión, que no habían presentado fallo virológico a IP ni habían recibido nunca DRV/r. Consta de 2 fases, en la primera se introduce en el tratamiento DRV/r y 8 semanas más tarde (segunda fase) se aleatoriza (1:1) para recibir DRV/r (600/100mg en BID) o DRV/r (600/100mg en BID)+2 AN. Es un estudio de criterio de que la pauta de monoterapia no presente inferioridad frente al tratamiento triple y el objetivo primario es conocer el porcentaje de pacientes que mantienen respuesta virológica a las 48 semanas, aunque el seguimiento programado es más prolongado. En la fase inicial se incluyó a 242 pacientes, se aleatorizó a 226. Se comunicaron los datos a las 48 semanas (110 pacientes en tratamiento triple y 109 con DRV/r). En los resultados por protocolo, el DRV/r en monoterapia muestra que no presenta inferioridad frente a la tratamiento triple (el 94,1 frente al 99,0% de CVP inferior a 50copias/ml). En el análisis por ITT se obtienen resultados similares (el 87,5 frente al 92%). Se observaron 3 fracasos virológicos (>400copias/ml) en pacientes con DRV/r en monoterapia, sin detectarse mutaciones de resistencia para DRV, y con posterior resupresión viral tras la reintroducción de los AN. Se reseña que 2 pacientes en el grupo de monoterapia tuvieron clínica relacionada con falta de supresión del VIH en el sistema nervioso central (SNC).
Igualmente se han presentado datos de varios estudios en los que se explora la posibilidad de realizar otro tipo de inducción-mantenimiento que consiste en iniciar un tratamiento con ATV/r y posteriormente suspender el RTV. Esta estrategia se ha planteado dada la cantidad de problemas que produce el RTV incluso a dosis bajas. Los estudios más significativos son el INDUMA y el ARIES. El INDUMA398 es un estudio aleatorizado, abierto, multicéntrico, de criterio de no presentar inferioridad, en el que se incluyó a 252 pacientes sin tratamiento previo que iniciaron tratamiento de inducción con 2AN+ATV/r y que a las 26–30 semanas, los que tenían una CVP inferior a 50copias/ml y seguían con el tratamiento (172) se aleatorizan (1:1) para continuar con el mismo tratamiento o a tomar 2 AN+ATV (400mg en QD) con un seguimiento de 48 semanas. El objetivo primario es conocer la proporción de pacientes que mantienen una CVP inferior a 50copias/ml a las 48 semanas. Los objetivos secundarios son conocer el porcentaje de pacientes con CVP inferior a 400copias/ml, la cifra de linfocitos CD4 y los datos de seguridad. La mitad de los pacientes llevaba como pareja de AN ABC/3TC. A las 48 semanas, la rama de ATV demuestra que no presenta inferioridad con respecto a la de ATV/r (la proporción de pacientes con CVP inferior a 50copias/ml es del 75% en la rama de ATV/r [n=85] y del 78% en la rama de ATV [n=87]; diferencia de 2,9; IC95%: 69,8–15,5). En cuanto al perfil de seguridad, se produjeron menos casos de hiperbilirrubinemia y de dislipemia en la rama de ATV. Los autores concluyen que esta es una opción adecuada y segura en pacientes que no toman TDF. No se detectaron resistencias frente a IP en ninguno de los grupos entre los pacientes que presentaron fracaso virológico. El estudio ARIES399 es un estudio similar. Se trata de un ensayo clínico abierto, multicéntrico, de criterio de no presentar inferioridad, en el que se incluye a pacientes sin tratamiento previo a los que se pauta ABC/3TC+ATV/r y, posteriormente, a las 36 semanas, se aleatorizan (1:1) para seguir con el mismo tratamiento o para suspender el RTV durante 48 semanas si su CVP es inferior a 50copias/ml y no han presentado fallo virológico previo. Se aleatorizó a 419 pacientes y se incluyó en el análisis a los 379 (90%) que completaron las 84 semanas de seguimiento. El objetivo primario era conocer la proporción de pacientes con CVP inferior a 50copias/ml a las 84 semanas (TLOVR). Los autores observan que la eficacia de ambos tratamientos es similar y sostenida, independientemente de la CVP basal y que el fallo virológico es infrecuente (2%).
Reducción del número de comprimidos o de dosisLa reducción del número de comprimidos o de dosis se consigue sustituyendo el IP por un fármaco de otro grupo. En esta estrategia, ampliamente estudiada, se ha evaluado la sustitución del IP/r por EFV, NVP o ABC y también por otro IP/r que se pueda administrar en QD.
Simplificación con efavirenzSe han realizado múltiples estudios al respecto, pero pocos de ellos son comparativos.
En los estudios DMP-049 y DMP-027 se aleatorizó a pacientes que estaban tomando un TARV con IP para seguir con este o sustituirlo por EFV. En los 2, el fracaso virológico fue menor en el grupo de EFV400,401.
En otro estudio se comparó el cambio de IP por EFV (n=25), NVP (n=26) o la continuación con el IP (n=26) en pacientes en TARV con IP y cifras de linfocitos CD4 superiores a 300células/μl y CVP inferior a 80copias/ml mantenida más de 9 meses. A las 48 semanas (ITT) no hubo diferencia en la proporción de pacientes con CVP indetectable con EFV (80%) o IP (77%)402.
En un estudio con diseño combinado (caso-control y aleatorizado) se comparó la evolución de 167 pacientes (a los que tras suspender el IP se aleatorizó para recibir EFV o ABC) con otros 167 pacientes que continuaron con IP (control). A las 48 semanas (ITT), el 70% de los tratados con EFV y el 54% con IP presentaban una CVP inferior a 500copias/ml (p<0,05)403.
Simplificación con nevirapinaExisten varios estudios aleatorizados y un estudio con diseño caso-control en los que se compara seguir con un IP con cambiar a NVP.
En varios estudios aleatorizados para seguir con el mismo tratamiento o simplificar el IP, la eficacia terapéutica a las 24–48 semanas fue similar en las 2 ramas y se observó una mejoría del perfil lipídico404–406. En uno de los estudios se observó una mayor eficacia virológica en el grupo de simplificación407.
En un estudio caso-control de una cohorte de pacientes que recibieron un IP en su primer TARV y que lo sustituyeron por NVP (n=125) o por otro IP (nueva formulación de SQV o a IP/r; n=321), se encontró a las 48 semanas que el RR de fracasar por cambio de tratamiento fue 5 veces superior con el IP que con la NVP, sin que existieran diferencias en el riesgo de fracaso virológico408.
Con un diseño distinto, en otro estudio español (MULTINEKA) se aleatorizó a 67 pacientes en tratamiento estable y con CVP inferior a 50copias/ml durante al menos 6 meses para recibir LPV/r con NVP o con 2 AN. A las 48 semanas de tratamiento, no se detectó fracaso virológico en ninguno de los pacientes. Se describió un posible beneficio en la toxicidad mitocondrial en los pacientes con NVP409.
La NVP está contraindicada como tratamiento de inicio en mujeres con cifras de linfocitos CD4 superiores a 250células/μl y en varones con cifras superiores a 400 células/μl por riesgo de hepatotoxicidad grave. Sin embargo, varios estudios independientes410–415 coinciden en señalar que no se ha observado un incremento de la hepatotoxicidad o del exantema en pacientes en los que se introduce NVP como estrategia de simplificación o sustitución por toxicidad, independientemente del número de linfocitos CD4. Estos resultados son muy consistentes por el número de pacientes.
Simplificación con abacavirSe han realizado múltiples estudios aleatorizados y un estudio caso-control prospectivo que analizan esta estrategia. Los resultados son dispares.
En uno de ellos, la eficacia terapéutica fue superior en la rama del ABC416–418. En los otros, incluido el estudio TRIZAL y el COLA30305, la eficacia fue similar, pero se observó una mayor incidencia de fracasos en aquellos pacientes que habían pasado a tomar ABC y previamente habían tomado tratamientos subóptimos403.
En el estudio ya comentado de diseño combinado (caso-control y aleatorizado) que comparaba IP con EFV o ABC, el 65% de los pacientes tratados con ABC y el 54% de los que continuaron con IP presentaron una CVP inferior a 500copias/ml (p<0,05) a las 48 semanas419.
En otro estudio, se aleatorizó a 209 pacientes para recibir ZDV+3TC+ABC en combinación fija con EFV o LPV/r durante 24–36 semanas. Los pacientes que tuvieron una CVP inferior a 50 copias/ml en ambos grupos continuaron solo con ZDV+3TC+ABC. A las 72 semanas, un 31 y un 43% de los apcientes mantuvieron la CVP indetectable (ITT), pero el 34 y el 25% cambiaron la pauta por toxicidad420.
Otro estudio piloto incluye a 17 pacientes que, tras 12 meses de recibir un TARV estable que contenía un IP, pasaban a tomar ZDV+3TC+ABC coformulados y TDF. A los 24 meses, todos continuaban con una CVP indetectable, tenían una mejoría del perfil lipídico y hubo una reducción de los pacientes que precisaban hipolipidemiantes. Además, se observó un descenso significativo de los niveles de ADN proviral420.
En distintos estudios se ha puesto de manifiesto la existencia de un riesgo elevado de fracaso terapéutico y de desarrollo de mutaciones a AN cuando se utilizan pautas de simplificación con 3TC+ABC+TDF421 y 3TC+ddI+TDF, por lo que se desaconsejan como estrategia de simplificación pese a su sencillez.
Comparación directa de efavirenz, nevirapina y abacavir en simplificación del tratamiento antirretroviralEl NEFA es un estudio prospectivo en el que se aleatorizó a 460 pacientes en tratamiento con 2 AN más un IP y con una CVP inferior a 200copias/ml durante 6 meses o más422,423. Se sustituyó el IP por NVP (n=155), EFV (n=156) o ABC (n=149). El 50, el 58 y el 46% de los pacientes, respectivamente, habían recibido tratamientos previos subóptimos con uno o 2 AN. La eficacia terapéutica (ITT) a las 48 semanas (CVP<200copias/ml) fue similar en los 3 grupos (77, 72 y 77%; p=n.s.). El fracaso virológico fue superior en el grupo de ABC (6, 4 y 12%; p<0,05) y ocurría en los pacientes que habían recibido tratamiento subóptimo. Estos resultados se han confirmado a los 3 años424. El análisis genotípico de las cepas de los pacientes con fracaso virológico evidenció un número mayor de mutaciones de resistencias a AN en los que recibieron ABC425. El número de pacientes que suspendió el tratamiento por efectos adversos fue menor en el grupo de ABC (17, 17 y 6%; p<0,01). La simplificación a cualquiera de los NN, sobre todo a NVP, produjo beneficios en el perfil lipídico, con reducción de colesterol no-HDL con ABC. Los niveles de triglicéridos se redujeron en los 3 grupos. Los marcadores de resistencia a la insulina mostraron una tendencia a la mejoría. Sin embargo, no mejoraron las alteraciones en la distribución de la grasa426.
Un estudio de cohortes con los datos de la French Hospital Database on HIV trata de reproducir los datos del estudio NEFA pero en la vida real. Se incluyó a 2.462 pacientes seguidos durante 12 meses y en los que el primer tratamiento hubiera incluido un IP; se cambió el IP por EFV, NVP o ABC. Los factores predictivos de rebrote de la CVP fueron sexo femenino, menor edad, exposición subóptima previa a antirretrovirales, CPV elevada, uso de ddI/d4T tras el cambio y cambio a NVP o ABC (si se habían recibido tratamientos subóptimos). Las diferencias respecto al NEFA probablemente se deban a diferencias metodológicas427.
Al comparar la simplificación a 3 AN (ZDV+3TC+ABC coformulados) frente a la combinación de 2 AN (ZDV+3TC coformulados) más NVP, en el análisis (ITT) a las 48 semanas no hubo diferencias significativas en cuanto a CVP indetectable428.
Simplificación con atazanavirEl ATV es un IP de dosificación en QD, bien tolerado, con buen perfil metabólico y pocos comprimidos, que ha permitido una nueva estrategia de simplificación en la que un IP sustituye a otro.
El SWAN es un estudio abierto en fase iiib, en el que se aleatorizó (2:1) a 419 pacientes en tratamiento estable con IP (potenciado o no) y con CVP indetectable para recibir ATV (400mg en QD), en caso de tomar TDF se pautó ATV/r (300/100mg) (n=278) o para continuar con el IP (n=141). A las 48 semanas, el fracaso virológico fue menor en los que simplificaron (el 7 frente al 16%; p<0,01). La eficacia virológica fue superior en los pacientes que pasaron de tomar un IP no potenciado a ATV (el 22 frente al 5%; p<0,001); no hubo diferencias entre los que siguieron con IP/r y los que pasaron de IP/r a ATV (e 11 frente al 8%; p=n.s.)429. En cuanto a la seguridad, la suspensión del tratamiento fue mayor en los pacientes del grupo control (el 21 frente al 34%; p<0,01) y el perfil lipídico fue mejor en el grupo que simplificó a ATV. Los datos de los estudios ATAZIP y SIMPATAZ confirman la seguridad y la eficacia de esta estrategia de simplificación, en este caso cambiando LPV/r por ATV/r430,431.
El estudio REAL, del que se han presentado datos a las 48 semanas, es un ensayo clínico en el que se incluyó a pacientes en un TARV estable de al menos durante 12 semanas con un IP administrado en BID, con CVP indetectable y lipohipertrofia, a los que se aleatorizó para continuar con el mismo tratamiento o cambiar el IP a ATV/r (300/100mg). El control inmunovirológico se mantuvo, se observó una mejoría del perfil lipídico en la rama de ATV pero no se observaron diferencias en cuanto a la composición corporal432.
Otra estrategia es la desarrollada en el ensayo clínico AI424-067 a las 48 semanas433. Se trata de un estudio aleatorizado, abierto, prospectivo, en el que se incluyó a 246 pacientes en tratamiento con IP/r, hiperlipidemia y una CVP inferior a 50copias/ml. Se aleatorizó los pacientes para cambiar a ATV (400mg) en el día uno (cambio inmediato) o mantener su tratamiento y cambiar a ATV (400mg) a las 24 semanas (cambio retrasado). A las 12 semanas, ambos grupos mantenían un control virológico similar y aquellos pacientes que tomaban ATV presentaron una mejoría significativa de las cifras de cLDL (−15 y +1%; p<0,0001). Los autores concluyen que el cambio inmediato o diferido de un IP potenciado o no a ATV no potenciado en pacientes con hiperlipidemia se asocia con mejoría en los parámetros lipídicos sin pérdida de supresión virológica.
Simplificación a regímenes de administración en una vez al díaEl cambio a un régimen en QD es otra forma de simplificación en pacientes que están bien controlados. Varios ensayos han comprobado la validez de esta estrategia.
En un ensayo clínico se aleatorizó a 355 pacientes para seguir con su TARV o cambiar a un tratamiento en QD (ddI+FTC+EFV). A las 48 semanas seguían con CVP indetectable el 87% de la rama QD y el 79% de los que no habían cambiado (p<0,05)434. En otro estudio no aleatorizado en el que se incluyó a 169 pacientes, 84 siguieron su TARV y 85 se cambiaron a ddI +TDF+NVP en QD; la eficacia virológica fue buena (el 76 frente al 86%; ITT) pero los linfocitos CD4 disminuyeron en la rama en QD con un decremento medio de 95células/μl435.
La combinación ddI+TDF ha demostrado eficacia virológica pero pobre recuperación de linfocitos CD4 o incluso descenso de su número aunque la CVP esté suprimida. Este descenso era más patente cuando se administraban las dosis estándares (plenas) de ddI436. Los regímenes de administración en QD que contengan la combinación ddI+TDF deben evitarse. De hacerlo, se debe reducir la dosis de ddI a 250mg/día en pacientes con más de 60kg de peso y a 200mg/día en pacientes por debajo de este peso.
Con la aparición de las combinaciones a dosis fijas de AN administrados en QD se ha simplificado aun más la situación. Está cada vez más claro su papel en el tratamiento de inicio y ya se han puesto en marcha ensayos para valorar su uso en regímenes más sencillos. El SWEET es un ensayo clínico en el que se aleatorizó a 234 pacientes en tratamiento durante al menos 6 meses con ZDV+3TC (coformulados)+EFV y con una CVP inferior a 50copias/ml para recibir TDF+FTC (coformulados)+EFV o para seguir con el mismo tratamiento. A las 24 semanas se observó una mejoría en las cifras de hemoglobina y en el perfil lipídico en la rama TDF+FTC y se mantuvo la respuesta al tratamiento (CVP<50copias/ml; el 93 frente al 88%; p=0,26). Recientemente se han publicado los resultados a las 48 semanas437, a las que han llegado 206 pacientes. Un 5% de los pacientes que continuaron con el mismo tratamiento y un 3% de los que lo cambiaron discontinuaron el estudio por efectos adversos. No se observaron diferencias estadísticamente significativas entre las 2 ramas por intención de tratamiento (el 85% de los pacientes que continuaron el tratamiento frente al 88% de los que cambiaron tenían una CVP inferior a 50copias/ml). En el subestudio de 100 pacientes a los que se ha realizado DEXA del tejido graso, se observa que la grasa se mantiene o aumenta en los pacientes que cambian el tratamiento, pero disminuye en el grupo que continúa (diferencia media: 448g: IC95%: 57–839g; p=0,025). Al igual que en otros estudios, el incremento de grasa es menor en aquellos pacientes que tomaban ZDV y en los que presentaban menor cantidad de grasa periférica. No se observaron diferencias entre grupos en cuanto a toxicidad renal. Los investigadores concluyen que el cambio de ZDV/3TC a TDF/FTC en pacientes en tratamiento con EFV y respuesta virológica mantenida es seguro desde el punto de vista virológico y se asocia con un incremento de la cifra de hemoglobina y una mejoría de los parámetros lipídicos y de la distribución de la grasa corporal.
En otro ensayo clínico aleatorizado, abierto, que incluyó a 80 pacientes con CVP inferior a 50copias/ml y que estaban en tratamiento con ZDV/3TC (+ IP o NN), a los que se aleatorizó para seguir con ZDV/3TC o cambiar a TDF/FTC (RECOMB), a las 24 semanas, el 85% de los pacientes en tratamiento con TDF/FTC presentaba una CVP inferior a 50copias/ml frente a un 80% con ZDV/3TC (p=0,77)438. Se observó además un incremento significativo de grasa en las extremidades en los pacientes cuya masa grasa era inferior a 7,2kg basalmente. Por último, mejoraron las cifras de cLDL en la rama de TDF/FTC. En los datos a las 72 semanas439, no se ha observado ningún fallo virológico; el 90% de la rama de TDF/FTC frente a un 83% de la rama de ZDV/3TC presentan una CVP inferior a 50copias/ml (p=0,52); la mediana de incremento de la cifra de linfocitos CD4 fue similar. Además, en estos pacientes se observa una mejoría significativa, un incremento progresivo de grasa en las extremidades, sobre todo si el IMC basal es superior a 25kg/m2 y llevan más de 5 años con ZDV/3TC. El análisis se realiza según el IMC basal sea superior o no a 25kg/m2 y el número de años en tratamiento con ZDV/3TC, y en todos los escenarios la mejoría de grasa periférica es estadísticamente significativa en la rama de TDF/FTC. Los autores concluyen que esta es una estrategia segura desde el punto de vista inmunovirológico y de efectos adversos, que mejora la lipoatrofia y distintos parámetros bioquímicos (hemoglobina, hematocrito y cLDL). Otro ensayo similar es el TOTEM, en el que se incluyó a 91 pacientes con CVP inferior a 400copias/ml y dislipidemia, a los que se aleatorizó para seguir con el mismo tratamiento o cambiar a TDF/FTC. En los pacientes que cambiaron se observó una mejoría significativa en el perfil lipídico a las 12 semanas440. Se conoce igualmente los resultados del BICOMBO, estudio aleatorizado y abierto que incluyó a 335 pacientes que recibían tratamiento con un régimen que incluía 3TC, con supresión virológica durante 6 meses o más y a los que se aleatorizó para sustituir los AN por las combinaciones coformuladas ABC+3TC (n=167) o TDF+FTC (n=168)441. El estudio se diseñó para evaluar que ambas combinaciones no presentan inferioridad respecto al fracaso terapéutico o virológico. En el grupo de TDF+FTC, el fracaso terapéutico fue del 13,3 frente al 19,2% en el de ABC+3TC, lo que no demostró que la pauta ABC+3TC no presentara inferioridad frente a TDF+FTC (IC95%: −2–14). Sin embargo, la pauta ABC+3TC demostró que no presentaba inferioridad frente a TDF+FTC en el objetivo de fracaso virológico (el 2,4 frente al 0%; IC95%: 0,05–6). Las suspensiones por epsiodios adversos fueron del 10% del grupo de ABC+3TC frente al 5% del grupo TDF+FTC (p=0,004). En cuanto al perfil lipídico, las reducciones del colesterol total, HDL, LDL y triglicéridos fueron mayores en la rama del TDF+FTC. El incremento en la grasa periférica y las alteraciones en la función renal o la densidad mineral ósea fueron similares. La toxicidad hepática fue muy baja en ambos grupos. Por el contrario, la respuesta inmunológica fue mejor en el grupo de ABC+3TC. La determinación previa del alelo HLA B*5701 podría haber modificado estos resultados.
Se ha publicado recientemente un ensayo clínico prospectivo, aleatorizado, controlado, abierto, multicéntrico, que incluyó a pacientes en tratamiento con CVP indetectable a los que se aleatorizó para seguir con el mismo tratamiento o tomar TDF+FTC+EFV coformulados con un seguimiento a 48 semanas442; las 2 ramas demostraron la misma eficacia. Se incluyó a 300 pacientes que presentaban una CVP inferior a 200copias/ml durante 3 meses o más sin ningún cambio de tratamiento. Se estatificaron según estuvieran tomando NN o IP y se los aleatorizó (2:1) para simplificar el tratamiento (tomar la tableta única) o seguir con su mismo tratamiento. Se evaluó la eficacia y la seguridad en el momento basal y a las 4, 12, 24, 36 y 48 semanas. Además, a los pacientes se les realizó una valoración de la calidad de vida así como de sus preferencias en cuanto a los fármacos. De los 300 pacientes incluidos, 97 continuaron con el mismo tratamiento. A las 48 semanas, el 89% de los pacientes con TDF+FTC+EFV frente al 88% con el mismo tratamiento presentaba una CVP inferior a 200copias/ml (TLOVR; IC95%) con una diferencia entre ramas de 1,1% (−6,7–8,8), lo que indica que la rama de TDF+FTC+EFV no presenta inferioridad. El 87% de los pacientes que cambiaron a TDF+FTC+EFV frente al 85% de los que no cambiaron el tratamiento presentaba una CVP inferior a 50copias/ml analizados de la misma manera: diferencia entre las 2 ramas del 2.6% (IC95%: −5,9–11,1). Las tasas de discontinuación fueron similares, aunque la suspensión por efectos adversos fue superior en la rama de TDF+FTC+EFV (el 5 frente al 1%), sobre todo por sintomatología relacionada con el SNC. No se observaron diferencias en cuanto a la tasa de filtrado glomerular ni a la adherencia. Sí se observó una mejoría en la cifra de triglicéridos en la rama de TDF+FTC+EFV (−20 frente a −3mg/dl; p=0,035). En cuanto a los datos de calidad de vida443, los pacientes que simplificaron referían mejoría en muchos de los síntomas relacionados con el VIH, encontraban el nuevo tratamiento más fácil de tomar y seguir y lo preferían frente a los tratamientos previos.
Desde la publicación del estudio NODY255 disponemos de una nueva opción para simplificar a un tratamiento en QD, ya que ha demostrado la eficacia y la seguridad de la simplificación de NVP administrada 2 veces al día a una vez al día. Se trata de un estudio con una duración de 48 semanas, abierto, aleatorizado, multicéntrico en el que se incluyó a 298 pacientes estables que estaban tomando NVP 2 veces al día durante al menos 12–18 semanas y presentaban una CVP inferior a 50copias/ml. Se aleatorizó a estos pacientes para continuar con el mismo tratamiento o tomar NVP en QD. El objetivo primario del estudio era valorar la seguridad hepática del tratamiento en QD analizando la proporción de pacientes con ALT/AST grado 3–4; los objetivos secundarios eran conocer el desarrollo de hepatitis clínica y la eficacia inmunovirológica y clínica. El estudio demostró que no había inferioridad por protocolo frente a mantener la pauta inicial, se había predefinido la situación de no presentar inferioridad como un margen del 10% para hepatotoxicidad, que era el objetivo primario.
Una de las grandes cuestiones por resolver es si el impacto de no tomar una dosis de medicación por olvido o incumplimiento puede ser mayor en un régimen en QD que en un régimen de varias dosis diarias en cuanto a la aparición de mutaciones de resistencia444. En la actualidad disponemos de múltiples fármacos que se pueden administrar una vez al día, con una vida media suficientemente larga como para evitar este problema.
Otros tipos de simplificaciónCon la aparición de nuevos fármacos de nuevas familias se ha podido simplificar el tratamiento administrado a pacientes multitratados. Esta simplificación no radica en el número de comprimidos, sino en la forma de administración de los fármacos. Así se han presentado ya estudios en los que se sustituye el ENF por el RAL y se mantiene la eficacia del tratamiento445–450. Aunque la mayoría de trabajos son observacionales, ya se ha realizado un ensayo clínico447 en el que se incluyó a 170 pacientes con VIH resistente a los 3 grupos de fármacos y CVP inferior a 400copias/ml durante al menos 3 meses en tratamiento con ENF. Se los aleatorizó (1:1) para seguir con ENF o cambiar a RAL. El objetivo primario era la proporción acumulada de pacientes con fallo virológico definido como CVP de 400copias/ml o más hasta las 24 semanas. Se observó fallo virológico en un paciente por rama. La conclusión de los autores es que el cambio a RAL es eficaz y bien tolerado a las 24 semanas de este, que ofrece la ventaja de la simplicidad, un mismo perfil de seguridad y que se necesita un seguimiento más a largo plazo. No se podría utilizar MVC en el contexto de la simplificación, en estudios similares a los ya realizados, ya que en estas circunstancias no se puede realizar el test de tropismo.
Pero la simplificación a veces no es tan sencilla y no debe realizarse si puede comprometer la eficacia del tratamiento. Como ejemplo, destacan 2 ensayos clínicos presentados recientemente, SWITCHMRK 1 y 2451. Se trata de 2 ensayos clínicos paralelos, multicéntricos, doble ciego, aleatorizados, en los que se incluyó a pacientes virológicamente controlados en tratamiento del que formaba parte el LPV/r de forma estable, no se excluyó a pacientes que habían fracasado a otros regímenes terapéuticos, siempre que en el momento de inclusión presentaran una CVP inferior a 50copias/ml durante al menos 3 meses. Se aleatorizó a los pacientes (1:1) para mantener LPV/r o cambiar a RAL, con la misma base de análogos. Los objetivos primarios eran conocer el porcentaje de cambio en las cifras de lípidos a las 12 semanas, la proporción de pacientes con CVP inferior a 50copias/ml a las 24 semanas así como la eficacia y la seguridad a las 24 semanas. En el SWITCHMRK 2 se aleatorizó a 355 pacientes y se trató a 354 (176 con RAL y 178 con LPV/r). Tras el cambio, el RAL se confirmó como bien tolerado y se produjo una mejoría significativa de los parámetros lipídicos, pero no demostró no presentar inferioridad desde el punto de vista virológico a las 24 semanas: 154 de 175 pacientes (88%) frente a 167 de 178 (93,8%) tenían una CVP inferior a 50copias/ml en los grupos de RAL y LPV/r, respectivamente; la diferencia observada entre los 2 tratamientos es de −5,8% (IC95%: −12,2–0,22; ITT). Probablemente estos resultados se deben a los criterios de inclusión de los pacientes y más en concreto a permitir la entrada en el estudio de pacientes con fracaso virológico previo cuando se plantea sustituir el LPV/r por RAL, que tienen distinta barrera genética. La enseñanza de este estudio es que se debe elegir muy bien a los pacientes cuyo tratamiento se simplifica y la estrategia de simplificación por seguir.
Recomendaciones
- •
En pacientes sin historia de fracaso previo a IP, con CVP indetectable al menos 6 meses y signos o síntomas de toxicidad por los AN es posible la simplificación a DRV/r o LPV/r en monoterapia393,395,452 (nivel A).
- •
Si no ha existido fracaso previo a AN, se puede sustituir el IP por EFV, NVP. No se recomienda simplificar de un IP a ABC si el paciente ha recibido tratamientos subóptimos previos con AN (nivel A)423.
- •
Está contraindicada la simplificación a ABC asociado a TDF y 3TC o a TDF y ddI421,435,436,453 (nivel B).
- •
En pacientes con riesgo cardiovascular elevado la simplificación a ATV o ATV/r, NVP o RAL puede añadir ventajas metabólicas431,433,435,445 (nivel A).
- •
En pacientes que están en su primera pauta terapéutica con IP y con CVP indetectable se puede simplificar a una QD como EFV+TDF+FTC (o 3TC), EFV+ddI+3TC (o FTC), o ATV/r (o ATV)+TDF+FTC442,454 (nivel A).
- •
La sustitución de ENF por RAL en pacientes suprimidos virológicamente se ha demostrado como eficaz y segura450 (nivel A).
- •
Es importante seleccionar muy bien los pacientes a los que se debe simplificar y la estrategia por seguir. La simplificación no se puede realizar a costa de la pérdida de la eficacia virológica. Solo se puede plantear una simplificación si no ha existido fracaso previo o si se utilizan fármacos plenamente activos para mantener el éxito virológico451 (nivel A).
- •
Otras posibles simplificaciones deben realizarse en el seno de ensayos clínicos, no en la práctica clínica (nivel C).
Se entiende por adherencia al TARV la capacidad del paciente para implicarse correctamente en la elección, el inicio y el cumplimiento de este a fin de conseguir una adecuada supresión de la replicación viral.
El control virológico depende de múltiples factores, pero la adherencia incorrecta es la primera causa de fracaso terapéutico y se relaciona con mala respuesta virológica455, peor reconstitución inmune456 y mayor riesgo de mortalidad457,458. Por tanto, es muy importante que los pacientes sean conscientes de su enfermedad, entiendan claramente el objetivo del TARV, participen en la decisión de iniciarlo, se sientan capaces de cumplir este tratamiento y comprendan la enorme importancia que tiene una toma continuada y correcta de la medicación.
Durante los últimos años se ha intentado conocer los factores asociados a la mala adherencia. Las diferencias entre los estudios, muchos de ellos carentes del adecuado rigor metodológico, hacen difícil realizar generalizaciones con alto grado de evidencia459. Se han identificado varios factores asociados con la mala adherencia, entre los que destacan la mala relación médico-paciente, el consumo activo de drogas, la enfermedad mental, la edad más joven, el nivel educativo del paciente, el idioma, la falta de apoyo social, la complejidad del tratamiento, los efectos secundarios y, más recientemente, el temor acerca de la aparición de alteraciones metabólicas y morfológicas8,460,461. Un tema controvertido es la relación de la adherencia con la edad, su importancia va ser creciente dado el envejecimiento de la población infectada por el VIH. Ciertos autores encuentran mayor adherencia en los mayores de 50 años mientras que otros no. Trabajos recientes señalan que el uso concomitante de otras medicaciones, la mayor prevalencia de efectos adversos y de interacciones, la depresión y las alteraciones de la memoria generan una menor adherencia en los mayores462. Lo que parece claro es que los trastornos neurocognitivos, más frecuentes en la población de más edad, suponen un factor negativo para la adherencia463 y que este aspecto deberá estudiarse y atenderse en los próximos años. Por el contrario, el apoyo emocional y vital, la capacidad para incluir la medicación en las actividades de la vida diaria sin ocultarla y la comprensión de la relación entre adherencia y desarrollo de resistencias son factores que predicen una adherencia correcta. Corregir los primeros e incrementar los segundos forma parte de la optimización del TARV (tabla 11).
Causas de adherencia incorrecta y posibles estrategias de intervención
| Causas potenciales de incumplimiento | Posibles intervenciones | |
| Factores sociales, económicos, educativos | Falta de apoyo social o familiar. Escasos recursos. Bajo nivel educativo | Buscar alianza con familia y allegados. Conocer necesidades sociales. Reclutar organizaciones comunitarias. Educación intensiva, explicaciones claras y comprensibles y adaptadas |
| Factores del equipo asistencial | Falta de recursos. Atención masificada e impersonal. Ausencia de coordinación entre diferentes servicios de apoyo a la asistencia. Insuficiente formación en terapia antirretroviral. Falta de accesibilidad. Deficiente formación en relación personal sanitario-paciente | Accesibilidad y continuidad de la asistencia. Equipo multidisciplinar. Recursos materiales y humanos suficientes y coordinados |
| Formación sólida en terapia antirretroviral y en atención al paciente. | ||
| Plantear terapia directamente observada en determinados ámbitos asistenciales | ||
| Factores relacionados con el tratamiento | Efectos adversos, tamaño y palatabilidad de las unidades galénicas, número de dosis diarias. Intrusión en la vida del paciente. Falta de adaptación a las preferencias y necesidades del paciente | Simplificar el régimen terapéutico. Pautas convenientes en número y dosificación de comprimidos, emplear fármacos co-formulados |
| Individualizar tratamiento: Resistencias, comorbilidad, preferencias, interacciones | ||
| Técnicas especiales para la toma de la medicación. Ayudar a desarrollar mecanismos de reacción (p.e. anticipación y manejo de efectos adversos) | ||
| Factores relacionados con el paciente | No aceptación. Rechazo del diagnóstico. Rechazo del tratamiento (creencias y actitudes) | Negociar y consensuar el plan terapéutico. Fomentar la percepción de indicadores de la necesidad de tratamiento. Informar sobre riesgos y beneficios del tratamiento. Asociar cada toma con actividades cotidianas. Técnicas especiales y ayudas para el cumplimiento (diarios de medicación, alarmas, teléfonos, etc). Mejorar la comunicación paciente – profesional sanitario. Información referente a la enfermedad y el tratamiento, motivo de la dosificación, riesgo del incumplimiento. Información oral y escrita. Verificar comprensión. Derivar para intervención psicológica en áreas disfuncionales o intervención psiquiátrica si se detecta patología psiquiátrica |
| Olvidos y barreras. Insuficiente comprensión de la enfermedad y su tratamiento. Insuficiente entendimiento de la relación riesgo/beneficio | ||
| Motivos de dosificación y cumplimiento | ||
| Comorbilidad psiquiátrica | ||
| Uso y abuso de drogas |
El inicio del TARV no es urgente en los pacientes con infección crónica. Antes de iniciar el tratamiento conviene preparar al paciente, identificar las situaciones que puedan dificultar la adherencia correcta y corregirlas464. Es importante conocer los factores dependientes del paciente (laborales, restricciones dietéticas, etc.) para diseñar un TARV a la medida. Cuando se inicie el TARV es imprescindible que se ofrezca información detallada, soporte y accesibilidad en los aspectos relacionados con el tratamiento. En este sentido, el uso de un teléfono directo puede facilitar el contacto entre el paciente y los profesionales.
Durante el TARV es fundamental evaluar periódicamente la adherencia, que debe tenerse en cuenta en las decisiones terapéuticas. Dado que no existe un método fiable de evaluación, se recomienda utilizar varias técnicas, como la entrevista, pasar un cuestionario estructurado (existen cuestionarios disponibles validados en España465,466), el recuento de medicación sobrante y la recogida de esta así como la evolución clínica y virológica. Para esto es indispensable que exista una buena coordinación entre todos los estamentos implicados y en particular entre clínicos y farmacéuticos.
La entrevista y los cuestionarios estructurados son de fácil acceso en cualquier ámbito asistencial, sin embargo, no son muy precisos y, en determinadas circunstancias (por ejemplo, en UDVP), pueden arrojar resultados no válidos. Los métodos más sofisticados y caros para evaluar la adherencia como determinación de los niveles plasmáticos de fármacos467 o los dispositivos electrónicos que registran la toma de medicación (Medication Event Monitoring System) se circunscriben al campo de la investigación468.
Las características virológicas del VIH determinan que, cuando existen niveles subterapéuticos de los FAR, el virus pueda replicarse y desarrollar resistencias. Los datos obtenidos durante los primeros tratamientos combinados, basados en IP sin potenciar, constataron que la máxima eficacia requería una adherencia prácticamente perfecta, clásicamente superior al 95%283. Estudios recientes indican que con niveles menores se pueden alcanzar los objetivos terapéuticos en regímenes basados en NN o IP/r, especialmente en pacientes que consiguen viremias indetectables272,469,470. Debe destacarse que no sólo es importante el porcentaje de dosis omitidas, sino también los patrones de adhesión subóptima. Las interrupciones de tratamiento (más de 2 días sin tomar ningún fármaco) presentan mayor repercusión en la respuesta virológica que la omisión ocasional de la dosis471. En el tratamiento de inicio también se ha demostrado una relación lineal entre nivel de adherencia y la efectividad: en tratamientos basados en NN, por cada 10% de incremento en el cumplimiento se observó un 10% más de pacientes que consiguen viremias indetectables sostenidas472.
La relación entre adherencia y desarrollo de resistencias es más compleja que la idea establecida de que «la falta de adherencia aumenta el riesgo de resistencias». Se han encontrado diferencias en función de las familias de fármacos, así, en pautas basadas en IP no potenciados se comprobó la aparición de resistencias con niveles altos de cumplimiento, mientras que en pautas con NN las resistencias son inusuales en los pacientes muy cumplidores y se dan en los poco adherentes o en los pacientes con interrupciones prolongadas del tratamiento473; por el contrario, en el caso de los IP potenciados, la aparición de resistencias es más difícil en cualquier nivel de adherencia474,475.
Si se detecta una falta de adherencia debe se intervenir de forma activa para corregirla. La monitorización de la adherencia no debe utilizarse para explicar un fracaso o el desarrollo de resistencias, sino para prevenir que estos se produzcan mediante la detección precoz de los problemas e implementar rápidamente medidas correctoras476. A modo de ejemplo, cuando se analizó la adherencia no de forma global, sino fármaco por fármaco, se detectó que en un 30% de los pacientes tenía falta de adherencia diferencial, es decir a alguno de los componentes del tratamiento, y esta falta de adherencia se relacionó con fracaso virológico477. En estos pacientes, la coformulación de fármacos podría ser una alternativa.
Las estrategias son múltiples, algunas basadas en teorías psicológicas y la mayoría dirigidas a paliar los condicionantes sociales o individuales de los pacientes. Desde esta perspectiva, cabe analizar las intervenciones sobre adherencia mediante las denominadas «entrevistas motivacionales» 478, las visitas domiciliarias y la intervención específica sobre la pareja del paciente, todas ellas relativamente complejas, sin resultados definitivos y sin grandes diferencias frente al grupo control asesorado acorde con una buena práctica clínica. Las intervenciones dirigidas a ciertas poblaciones especiales (mujeres, latinos en EE. UU. y pacientes con historia previa de alcoholismo) no han logrado mejorar la adherencia al tratamiento459.
Han demostrado ser beneficiosas las intervenciones sencillas de educación y soporte en aspectos prácticos del tratamiento479. Probablemente la intervención que ha demostrado mayor eficacia ha sido el soporte interpersonal estructurado, en el que personal sanitario entrenado emplea estrategias individualizadas. Respecto al tratamiento directamente observado, los estudios controlados arrojan resultados contradictorios, en general han demostrado beneficio respecto al tratamiento autoadministrado en poblaciones especiales (usuarios de drogas o en prisiones) pero no han demostrado diferencias a largo plazo en la clínica convencional480,481.
Es importante recordar que la adherencia decae con el tiempo y, por tanto, las estrategias diseñadas para optimizarla deben dirigirse no solo a incrementarla sino a mantenerla constante482.
El Gesida y el PNS, conjuntamente con la Sociedad Española de Farmacia Hospitalaria8, han revisado los factores que influyen en la adherencia, los métodos de evaluación y las posibles estrategias de intervención y actuación de un equipo multidisciplinario que debe estar integrado por médicos, farmacéuticos, enfermeras, psicólogos y personal de soporte. Remitimos a ese documento para profundizar en el tema de la adherencia al TARV.
Recomendaciones
- •
Antes de iniciar el TARV se debe preparar al paciente, identificar y corregir las causas que pueden limitar su adherencia. Si el paciente no está preparado, en general es mejor retrasar el inicio del TARV.
- •
Una vez iniciado el TARV se recomienda efectuar un primer control a las 2–4 semanas para corregir los factores inherentes al tratamiento o del propio paciente que puedan limitar la adherencia.
- •
Debe facilitarse el contacto entre el paciente y los profesionales.
- •
Si la adherencia es correcta, debe monitorizarse y reforzarse, en coincidencia con las visitas clínicas (nivel C).
- •
El control de la adherencia debe realizarse por parte de un equipo multidisciplinario, y en él deben estar implicados no solo el médico sino también la enfermería, los profesionales de apoyo psicológico y la farmacia hospitalaria (nivel C).
- •
Cada unidad asistencial debería realizar un seguimiento periódico de la adherencia, no solo con vistas a detectar las faltas individuales de cumplimiento sino para conocer la magnitud del problema en su ámbito de trabajo; el análisis de los datos permitirá determinar las causas de los problemas detectados (abandonos, vacaciones terapéuticas, incumplimientos, etc.) y elaborar estrategias concretas de actuación, tanto con los enfermos como en la estructura y el funcionamiento del equipo asistencial (nivel C).
Los FAR pueden producir numerosos efectos secundarios que se presentan al inicio del tratamiento o a medio-largo plazo. En este último caso, suelen asociarse a procesos fisiológicos o a comorbilidades relacionados con el envejecimiento. Algunos de ellos son específicos de fármacos y otros de grupo. En las tablas 12–16 se muestra la toxicidad característica de cada familia y se resume la toxicidad por órganos y aparatos, la patogenia, la relación individual con cada fármaco, el diagnóstico y el tratamiento de estos483. A continuación se comentan los que, por su frecuencia o potencial gravedad, tienen mayor relevancia clínica.
Toxicidad de cada familia de fármacos antirretrovirales
| Familia | Toxicidad | Prevalencia | Clínica |
| Inhibidores de la transcriptasa inversa nucleósidos o nucleótidosa | Toxicidad mitocondrial | 20–40% | Neuropatía periférica |
| Miopatía | |||
| Cardiomiopatía | |||
| Pancreatitis | |||
| Hepatomegalia | |||
| Esteatosis hepática | |||
| Hepatitis | |||
| Acidosis láctica | |||
| Mielotoxicidad | |||
| Alteración tubular proximal renal | |||
| Lipoatrofia | |||
| Hiperlipemia y resistencia insulínica | |||
| Inhibidores de la transcriptasa inversa no nucleósidosb | Hipersensibilidad | 15–30% | Exantema (extensión y gravedad variable) |
| Afectación multiorgánica | |||
| Fiebre | |||
| Inhibidores de la proteasac | Hiperlipemia | 25–50% | Hipertrigliceridemia (especialmente) |
| Resistencia a la insulina (IP clásicos; difícil de separar de los efectos de análogos de timidina) y lipodistrofia | Hipercolesterolemia | ||
| Diabetes mellitus | |||
| Lipoacumulación intraabdominal | |||
| Inhibidores de la fusiónd | Inflamación dérmica local | 60–70% | Dolor |
| Tumoración |
Las distintas manifestaciones de la toxicidad se suelen presentar de forma aislada. Aparecen generalmente en los tres primeros meses de tratamiento, aunque algunas expresiones de la toxicidad mitocondrial (neuropatía, miopatía, acidosis láctica o lipoatrofia) suelen aparecer de forma tardía (meses o años).
IP: inhibidor de la proteasa; TDF: tenofovir.
ABC constituye una excepción, pues su toxicidad está mediada por hipersensibilidad. TDF puede inducir nefrotoxicidad.
Toxicidad de los antirretrovirales por órganos y aparatos
| Toxicidad | Fármaco/s | Diagnóstico | Patogenia | Actitud |
| Anemia | ZDV (dependiente de la dosis) | Síntomas clínicos de anemia | Inhibición de la proliferación de las células progenitoras eritroides | Suspensión de ZDV |
| Transfusión de hematíes (si hemoglobina <8g/dl ó hay síntomas de anemia) | ||||
| Miopatía | ZDV (dependiente de la dosis) | Después del primer semestre de tratamiento | Toxicidad mitocondrial | Suspensión de ZDV |
| Síntomas: mialgias o debilidad muscular proximal y elevación de enzimas musculares (CPK, LDH, aldolasa) | Si clínica importante, prednisona 1–2mg/kg/día | |||
| Neuropatía periférica | ddI (13–34%)d4T (15–20%)(dependiente de la dosis) | Hipoestesia, parestesia o dolor en zona distal de extremidades (especialmente pies) | Interacción entre citoquinas y factores de crecimiento neuronal | Evitar asociaciones de fármacos neurotóxicos |
| Diagnóstico diferencial con la neuropatía por el propio VIH (aparece en pacientes sin tratamiento e inmunodepresión grave) | Favorecida por neuropatía previa y factores predisponentes (enolismo, desnutrición, diabetes, etc.) | Valorar mantener fármacos potencialmente implicados si la clínica no es grave y no hay alternativas razonables | ||
| Suspender los fármacos implicados si clínica progresiva o invalidante. La recuperación es lenta (meses o años) | ||||
| Si dolor leve: analgésicos habituales | ||||
| Si dolor moderado-intenso: gabapentina, pregabalina o lamotrigina con o sin benzodiacepinas; si no eficacia, valorar carbamacepina o amitriptilina (producen efectos colinérgicos) | ||||
| Si dolor muy intenso o refractario: opiáceos | ||||
| Toxicidad neuropsíquica | EFV (20–50%) | Durante el primer mes de tratamiento, tras lo cual disminuye o desaparece | Desconocida | Evitar en pacientes con trastornos psiquiátricos mayores |
| (dependiente de la dosis; más prevalente si administración con alimentos) | Espectro clínico variado: mareo, ansiedad, somnolencia, trastornos del sueño, agravamiento de problemas psíquicos subyacentes, y alteraciones motoras | Valorar individualmente el estilo de vida y la actividad del paciente antes de prescribirlo | ||
| Generalmente no es necesaria la suspensión de efavirenz | ||||
| Suspender en casos de manifestaciones graves o invalidantes | ||||
| Administración por la noche, al menos 1–2h después de la cena | ||||
| Valorar benzodiacepinas o neurolépticos si alteraciones del sueño persistentes | ||||
| Puede intentarse ajuste de dosis si hay posibilidad de estudio farmacocinético, aunque no está definitivamente probado | ||||
| Exantema o hipersensibilidad | Fármaco/s | Diagnóstico | Patogenia | Actitud |
| No -nucleósidos (más frecuente NVP y ETR) (<20%) | Durante los primeros dos meses de tratamiento | Desconocida. | Comienzo escalonado de dosis de nevirapina. No dar corticoides profilácticos (no evitan el riesgo e incluso lo pueden aumentar) ni antihistamínicos | |
| Inhibidores de proteasa (más frecuente TPV (8–14%), DRV y FPV (3–5%) | Exantema maculo-papular (casos leves) | Se ha sugerido una reacción antígeno-anticuerpo similar a la enfermedad del suero o una toxicidad directa por metabolitos intermediarios | Si exantema leve sin clínica de hipersensibilidad acompañante, se puede mantener el tratamiento y realizar una vigilancia estrecha | |
| Nucleósidos (más frecuente ABC, 5–8%) | Fiebre, afectación mucosa, pulmonar, hepática o hematológica (casos graves) | Identificación de pacientes con riesgo genético elevado de hipersensibilidad a abacavir (HLA B*5701) | El exantema por ETR, aunque puede ser grave, raramente obliga a retirar el fármaco | |
| La hipersensibilidad se manifiesta por afectación multiórganica, a veces con escaso o nulo exantema, y puede haber eosinofilia | Si exantema grave o clínica de hipersensibilidad, interrupción permanente del fármaco | |||
| En los casos donde pueda estar implicado ABC y la clínica no sea clara, puede ser razonable mantener el tratamiento durante 24h más con una vigilancia estrecha y valorar evolución antes de retirar ABC | ||||
| Tratamiento sintomático con antihistamínicos o corticoides una vez interrumpido el fármaco sospechoso | ||||
| Tratamiento de soporte hemodinámico, o respiratorio en casos graves que lo requieran | ||||
| No reintroducir nunca un fármaco retirado por sospecha de hipersensibilidad | ||||
| Hepatitis | Nucleósidos (más frecuente ZDV, ddI y d4T). No nucleósidos (más frecuente NVP) | El 50% de los casos aparece en el primer semestre | Multifactorial: toxicidad mitocondrial (nucleósidos), efecto tóxico-inmunológico (no nucleósidos); si IP efecto mixto (toxicidad directa, recuperación inmune si VHB o VHC), rebrote de virus B tras suspender TARV con efecto anti-VHB | Considerar vigilancia estrecha y potencial suspensión si transaminasas >5 veces límite superior de normalidad |
| Inhibidores de proteasa (más frecuente RTV) | Aumento de transaminasas sin clínica (10–15% de pacientes) | Interrumpir si transaminasas >10 veces límite superior de normalidad, manifestaciones clínicas de hipersensibilidad (fiebre o exantema), de fallo hepático (ictericia, encefalopatía, o hemorragia) o acidosis láctica | ||
| Hepatitis clínica (<1%) | ||||
| Factores de riesgo: infección por virus de hepatitis B y C | ||||
| Gastrointestinal | Inhibidores de proteasa sobre todo RTV (a dosis plenas), 40%; IDV, 25%; NFV, 25%; LPV/r, 25%; SQV, 5% | Sabor desagradable (RTV suspensión) | Multifactorial | Raramente grave, pero por su frecuencia e incomodidad puede limitar la adherencia al TAR |
| Nucleósidos con menor frecuencia que IP (particularmente ZDV y TDF) | Molestias digestivas altas (IDV y APV) | Inhibición de enzimas pancreáticas (inhibidores de proteasa) | Para la diarrea, dietas rica en alimentos astringentes o fármacos inhibidores de la motilidad intestinal (loperamida) | |
| Diarrea (NFV y LPV/r) | Intolerancia a la lactosa que contienen como excipiente (todos los antirretrovirales) | Suspensión del fármaco si molestias persistentes o intensas | ||
| Pancreatitis | Nucleósidos (más frecuente ddI y d4T) | Generalmente, asintomática. | Toxicidad mitocondrial | Retirar el fármaco potencialmente implicado |
| Aumento de riesgo cuando se administra hidroxiurea, o TDF con ddI | Puede haber manifestaciones clínicas de dolor abdominal y diarrea | |||
| Insuficiencia renal y tubulopatía | TDFIDV | Elevación leve o moderada de la creatinina con/sin anomalías analíticas de disfunción tubular. | Alteración tubular proximal (TDF)Nefritis intersticial por cristales (IDV) | Evitar en pacientes con insuficiencia renal. Evitar en lo posible coadministración con otros fármacos potencialmente nefrotóxicos |
| No suele acompañarse de clínica | Hidratación adecuada para prevenir o mejorar la elevación de creatinina. | |||
| Suspensión del fármaco si el filtrado glomerular es <50ml/min | ||||
| Nefrolitiasis | IDVATV | Dolor cólico lumbar. Hematuria microscópica y ocasionalmente macroscópica. Ocasionalmente, fiebre (diagnóstico diferencial con pielonefritis) | Precipitación de indinavir en orina concentrada (densidad >1.020) y pH básico (>5) | Prevención mediante ingesta adecuada de líquido (1.500ml de agua al día o más si ambiente caluroso o pérdidas extraordinarias de líquidos). Evitar bebidas carbónicas |
| Más frecuente en ambientes calurosos | Antiinflamatorios no esteroideos para el dolor | |||
| Suspensión transitoria del fármaco responsable si dolor intenso | ||||
| Suspensión definitiva del fármaco responsable si episodios repetidos sin desencadenante evidente | ||||
| Ajuste de dosis si posibilidad de estudio farmacocinético |
/r: potenciado con ritonavir; ABC: abacavir; APV: amprenavir; CPK: creatin-fosfoquinasa; d4T: estavudina; ddI: didanosina; DRV: darunavir; EFV: efavirenz; FPV: fosamprenavir; IDV: indinavir; LPV: lopinavir; NVP: nevirapina; RTV: ritonavir; SQV: saquinavir; TPV: tipranavir; VHB: virus de la hepatitis B; VIH: virus de la inmunodeficiencia humana; ZDV: zidovudina.
Evaluación y tratamiento de la dislipidemia
| Evaluación | Tratamiento |
| Realizar analítica en ayunas | Objetivo del tratamiento: |
| Descartar otras causas de hiperlipemia secundaria |
|
| Tratamiento encaminado a prevenir la enfermedad aterosclerótica y a evitar las complicaciones inmediatas de la hipertrigliceridemia grave | Tratamiento: |
| En primer lugar, medidas generales: dieta (consulta a experto en nutrición), ejercicio físico, abstinencia de tabaco, y sobre todo valoración individualizada de la retirada de IP o de los análogos de la timidina | |
| Tratamiento farmacológico (si medidas previas no son eficaces): | |
| |
cLDL: colesterol ligado a lipoproteínas de baja densidad.
Evaluación y tratamiento de la diabetes mellitus
| Evaluación | Tratamiento |
| Realizar analítica en ayunas | Valorar individualizadamente la sustitución de análogos de la timidina y otros fármacos no antirretrovirales que pudieran estar implicados |
| Prueba de tolerancia oral a la glucosa (si glucosa basal alterada) | Objetivo terapéutico guiado por hemoglobina glicosilada (HbA1c) <7% |
| Tratamiento encaminado a evitar las complicaciones metabólicas a corto plazo (hipoglucemia, cetosis, cetoacidosis, y estado hiperosmolar) y las complicaciones micro y macro-vasculares a largo plazo | Consulta con endocrinólogo |
| Antidiabéticos orales. Metformina, si sobrepeso u obesidad abdominal, o sulfonilureas. Pioglitazona si lipoatrofia | |
| Insulina en los pacientes con diabetes de inicio e insulinopenia (cetosis o cetoacidosis), pérdida de peso y cuando no sea posible conseguir el objetivo de HbA1c<7% con antidiabéticos orales. | |
| Debería considerarse la administración de 75–150mg/día de AAS a todos los pacientes con diabetes |
AAS: ácido acetilsalicílico; HbA 1c: hemoglobina glucosilada
Evaluación y tratamiento de la alteración de la distribución de la grasa corporal¿
| Evaluación | Tratamiento |
| Diagnóstico clínico | No hay ninguna medida que haya demostrado resolver satisfactoriamente los cambios corporales. Las que a continuación se describen han mostrado, en el mejor de los casos, una eficacia parcial y algunas de ellas no están exentas de riesgos: |
| Sería deseable la realización periódica de alguna medida objetiva de la composición corporal (según disponibilidad y posibilidades económicas de cada centro) |
|
AN: inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido; FAR: fármacos antirretrovirales; IP: inhibidor de la proteasa; ZDV: zidovudina.
En la tabla 12 se exponen los posibles efectos adversos debidos al daño mitocondrial producido por la inhibición de la enzima ADN-polimerasa mitocondrial. Al más grave de ellos, una combinación de acidosis láctica y esteatosis hepática, lo induce la d4T y, en menor medida, la ZDV y la ddI. Su incidencia es baja, pero si no se diagnostica a tiempo puede ser mortal483. Las manifestaciones clínicas, subagudas e inespecíficas (astenia, disnea e insuficiencia hepática) o la acidosis aparecen cuando el lactato es superior a 5–10mmol/l. Debe tenerse un alto grado de sospecha y realizar el diagnóstico antes de que aparezca acidosis, pues en esta fase (hiperlactatemia asintomática) la mortalidad es muy inferior a la de la acidosis láctica y la esteatosis hepática. Su tratamiento consiste en retirar los AN causantes y monitorizar los niveles plasmáticos de lactato484.
La lipoatrofia108,485, aunque también es secundaria a toxicidad mitocondrial, se comenta en el apartado de anomalías de la distribución de la grasa corporal.
Reacciones de hipersensibilidadAunque todos los FAR pueden provocar RHS, son mucho más frecuentes con ABC y NN (la RHS a ABC se ha descrito más arriba).
Las RHS frente a los NN suelen presentarse con un exantema cutáneo y rara vez con un cuadro sistémico grave, con síndrome de Stevens-Johnson o con necrólisis epidérmica tóxica (tabla 13).
HepatotoxicidadEs, junto con el exantema, el efecto adverso específico del grupo más importante de los NN, si bien su intensidad suele ser leve o moderada y son raros los casos de hepatitis sintomática486. La NVP provoca elevación de aminotransferasas con mayor frecuencia y se desaconseja como TARV de inicio en mujeres con cifras de linfocitos CD4 superiores a 250células/μl y en varones con cifras superiores a 400células/μl debido a un mayor riesgo de hepatotoxicidad grave410,487. No obstante, parece ser que los pacientes pretratados, especialmente en el contexto de una simplificación del TARV, tienen un riesgo similar al de los pacientes que nunca llevaron TARV con inmunodepresión más profunda413,414. Los IP potenciados que se usan actualmente y los FAR de otras familias (incluidos los NN de segunda generación) tienen unas tasas de hepatotoxicidad más reducidas que los NN clásicos488–490 (tabla 13).
Trastornos neuropsiquiátricosEl EFV produce diversos síntomas neuropsiquiátricos (mareo, somnolencia, insomnio, sueños vívidos, confusión, ansiedad, despersonalización, etc.) en más del 50% de los casos, los que, aunque suelen remitir en las primeras 2–4 semanas, obligan a interrumpir el tratamiento en un pequeño porcentaje de los casos491,492 (tabla 13). Se aconseja evitar este fármaco en pacientes con trastornos psiquiátricos mayores, aunque en un estudio aleatorizado el riesgo de depresión fue similar con EFV que con los IP493. Aunque otros FAR, como la ZDV, pueden provocar síntomas neurológicos, estos son mucho menos frecuentes que los del EFV.
NefrotoxicidadEl TDF puede inducir toxicidad renal en una pequeña proporción de pacientes. Su incidencia en estudios de cohorte494,495 es mayor que la observada en ensayos clínicos, en los que solamente se ha encontrado una reducción discreta (≈10%) y no progresiva del filtrado glomerular496,497. Esta complicación consiste en una disfunción tubular y se manifiesta como un síndrome de Fanconi acompañado de una disminución del filtrado glomerular498. Es más frecuente cuando coincide con otros factores de riesgo (insuficiencia renal previa o concomitante, diabetes, hipertensión arterial, fármacos nefrotóxicos, edad avanzada, bajo peso corporal y cifras bajas de linfocitos CD4)221,226,496,498,499. La nefrotoxicidad por TDF suele revertir al retirar el fármaco. Con ABC se ha encontrado una discreta reducción del filtrado glomerular234. El IDV y, con mucha menor frecuencia, el ATV producen nefrolitiasis por depósito tubular de cristales (tabla 13).
Trastornos metabólicos y riesgo cardiovascularEste grupo de trastornos incluye dislipidemia, resistencia a la insulina y diabetes mellitus, todos más frecuentes con los IP clásicos que con los IP potenciados actualmente utilizados y con los análogos de la timidina que con los demás AN. Asimismo, todas estas anomalías son más comunes en los pacientes con redistribución de la grasa corporal.
Una dislipidemia caracterizada por aumento de los niveles plasmáticos de colesterol total, cLDL y, sobre todo, triglicéridos es la anomalía metabólica que con mayor frecuencia se asocia al TARV. Aunque tradicionalmente se ha relacionado esta dislipidemia con los IP, no todos tienen el mismo impacto sobre los lípidos, y otros FAR, especialmente los análogos de timidina, también inducen dislipidemia263,274,500–502. Respecto a los IP, diversos ensayos clínicos han revelado que el ATV y el FPV, sobre todo sin potenciar, tienen un mejor perfil lipídico; el ATV/r, el SQV/r (1.500/100mg en BID o 1.500/100mg en QD) y el DRV/r (600/100mg en BID u 800/100mg en QD) presentan perfiles intermedios, mientras que el FPV/r (1.400/100mg en QD o 700/100mg en BID), el LPV/r (400/100mg en BID) y el TPV/r (500/200mg en BID) tienen perfiles más desfavorables, sobre todo en lo que respecta a los triglicéridos239,272,273,276,336,341,348,349,429,503–505. El tratamiento de la dislipidemia se comenta en las tablas 14 y 15506–510.
Los IP pueden disminuir la disponibilidad de la glucosa periférica y la secreción pancreática de insulina de forma aguda y pueden descompensar o desencadenar una diabetes en pacientes ya diabéticos o en personas predispuestas a serlo. En general, estas alteraciones no se mantienen a medio-largo plazo, por lo que deben existir mecanismos compensadores de estas511,512. Entre ellos, el IDV, el RTV a dosis plenas y, en menor medida, el LPV/r son los que se han relacionado con el desarrollo de resistencia a la insulina513–515, mientras que los demás IP parecen tener poco o ningún efecto sobre la homeostasis de la glucosa. La diabetes mellitus es menos común (tabla 15) y su asociación con los IP no es constante en todos los estudios511,513,515. El tratamiento con análogos de la timidina (en particular d4T) y ddI constituye un factor de riesgo para el desarrollo de resistencia a la insulina y diabetes mellitus516. Los IInt y los antagonistas del CCR5 parecen tener un perfil metabólico favorable517–520.
Al igual que en la población general, los factores de riesgo tradicionales son los que determinan principalmente el riesgo de desarrollar una enfermedad cardiovascular en los pacientes infectados por el VIH. En estos, no obstante, la infección por el VIH no controlada y ciertos regímenes de TARV incrementan también este riesgo, aunque es muy probable que la contribución de estos últimos sea menor que la de los otros factores anteriormente mencionados. Aunque algunos estudios de cohortes han puesto de manifiesto que la duración del tratamiento con IP es un factor de riesgo independiente para el desarrollo de cardiopatía isquémica521–523, otros, en su mayoría retrospectivos y con poco tiempo de seguimiento, han obtenido resultados contrapuestos523–526. El efecto sobre el riesgo cardiovascular de los IP como familia está mediado, al menos en parte, por la dislipidemia asociada con el uso de estos fármacos. Además, un análisis de la cohorte D:A:D ha revelado que determinados IP (IDV, LPV/r) están relacionados con un mayor riesgo de infarto de miocardio, que no puede ser exclusivamente justificado por esta anomalía metabólica527. Este mismo estudio ha mostrado también que el uso reciente (últimos 6 meses) de ABC o ddI se asocia con un mayor riesgo de infarto agudo de miocardio, especialmente en los pacientes que tienen un riesgo cardiovascular más elevado527. No obstante, la relación entre ABC e infarto de miocardio es un motivo de controversia, pues, aunque ha sido constatada también en el estudio SMART237 y en sendos estudios de casos y controles528,529, ni un análisis conjunto de 52 ensayos clínicos aleatorizados que incluían un grupo de tratamiento con ABC530 ni otros ensayos clínicos y estudios de cohorte han observado tal asociación531–533 así como tampoco ninguna relación del ABC con potenciales mecanismos patogénicos que pudieran explicarla534,535. Todos estos estudios tienen numerosos sesgos que no es posible controlar de forma adecuada y que ponen en duda la contribución causal de los mencionados AN en el desarrollo de la enfermedad cardiovascular.
Anomalías de la distribución de la grasa corporalEl síndrome de lipodistrofia se caracteriza por la presencia, combinada o no, de pérdida de grasa periférica (lipoatrofia) y de acúmulo de grasa perivisceral o en el abdomen, las mamas y el cuello (lipoacumulación). La lipoatrofia, el efecto adverso más temido por los pacientes, se relaciona particularmente con los análogos de la timidina220,221,226,484,496,500,509,510. Aunque en su aparición pueden influir múltiples factores, las pautas con d4T y ZDV (particularmente junto con IP clásicos y EFV) han evidenciado un mayor riesgo de lipoatrofia, y su sustitución por ABC o TDF o por pautas sin AN se asocia a una mejoría de esta226,496,497,499,500,504,507–510 (tabla 13). Los resultados de 2 estudios comparativos entre EFV y LPV/r sugieren que el uso de EFV puede asociarse a una mayor pérdida de grasa subcutánea en comparación con el de LPV/r, lo que es particularmente evidente cuando el régimen incluye análogos de la timidina393,536. No obstante, el que no se haya observado lipoatrofia en numerosos ensayos en los que el EFV no estaba asociado a análogos de la timidina226,496,497,504,510 plantea la necesidad de nuevos estudios que esclarezcan este aspecto. En la figura 1 se comentan la evaluación y las opciones terapéuticas para las anomalías de la distribución de la grasa corporal537–540.
Otros efectos adversosLa osteopenia y la osteoporosis son más frecuentes en los pacientes infectados por el VIH, pero se desconoce la importancia relativa de los distintos factores invocados como favorecedores de estas, entre los que se incluyen el propio VIH y el TARV. Aunque los IP podrían desempeñar un papel patogénico en el desarrollo de estos trastornos en los pacientes infectados por el VIH, los datos disponibles hasta ahora no son concluyentes541. Más ambigua es aun la presunta relación entre el TARV y la osteonecrosis542.
Por último, el EFV es teratogénico, por lo que está contraindicado su uso durante el primer trimestre de la gestación.506,507,543,544
Recomendaciones
- •
Se debe monitorizar la tolerancia y las reacciones adversas agudas del TARV durante las primeras 2–4 semanas, particularmente en aquellos pacientes que tengan comorbilidades predisponentes o tomen concomitantemente otros fármacos cuyas interacciones puedan tener consecuencias clínicas, y llevar a cabo una eventual modificación del tratamiento según la gravedad de la reacción adversa y el fármaco implicado. Para esto debe facilitarse el contacto entre el paciente y los profesionales (nivel C).
- •
Se deben evitar fármacos que puedan reagudizar o empeorar enfermedades preexistentes (nivel C).
- •
Se recomienda monitorizar la glucemia y los lípidos plasmáticos (colesterol total, cHDL, cLDL y triglicéridos) en cada visita de control (nivel C)508,511,544.
- •
Se recomienda calcular el riesgo cardiovascular en la primera visita, al inicio del TARV y con posterioridad una vez al año (nivel C).
- •
Se recomienda evitar el tratamiento con análogos de la timidina siempre que sea posible, pero muy particularmente ante la aparición de lipoatrofia (nivel A).
- •
Se recomienda efectuar un estudio elemental de orina con proteinuria y calcular la tasa de filtrado glomerular renal (fórmula MDRD o Cockroft-Gault) en la primera visita y luego una vez al año si no hay factores de riesgo para el desarrollo de nefrotoxicidad o cada 6 meses si estos están presentes así como también antes de iniciar el TARV (nivel A)545,546. En los pacientes que ya reciben TARV se recomienda efectuar este estudio en todas las revisiones (nivel B), en especial si toman TDF (nivel C)546. Si el filtrado glomerular es inferior a 50 ml/min o hay proteinuria manifiesta, no se deben usar TDF (salvo que no haya otra opción disponible, y adecuar la dosis a la función renal) ni IDV, y se deben ajustar las dosis de los AN excepto de ABC (nivel C)545,546. No se recomienda usar TDF en los pacientes con deterioro agudo de la función renal o que el deterioro esté directamente relacionado con este fármaco (nivel C)546.
Las interacciones de los FAR entre sí o con otros medicamentos constituyen un problema de primera magnitud en el tratamiento de los pacientes con infección por el VIH, ya que sus consecuencias pueden tener una importante repercusión clínica547–550. Las más relevantes suelen ser las interacciones farmacocinéticas, especialmente a nivel del metabolismo de los fármacos. Diferentes sistemas enzimáticos están implicados en este metabolismo y en todos ellos pueden producirse interacciones. Los FAR son sustratos de uno o varios de estos sistemas enzimáticos y a la vez pueden comportarse como inductores o inhibidores de cualquiera de ellos. La inducción del metabolismo producirá una disminución de las concentraciones del fármaco en el lugar de acción, lo que puede disminuir la eficacia del tratamiento, mientras que la inhibición ocasionará un aumento de las concentraciones con un mayor riesgo de toxicidad. En general, la inducción se produce por un aumento de la síntesis proteica (enzimas) y es un proceso lento que requiere días o semanas, mientras que la inhibición suele ser competitiva y se produce de manera rápida, dependiendo de la concentración del inhibidor, y los efectos tóxicos de los sustratos pueden aparecer en pocas horas. Dado que ambos mecanismos son diferentes e independientes, algunos fármacos pueden ser inhibidores e inductores al mismo tiempo, y predominar uno u otro efecto.
El sistema metabólico más importante es el CYP y su principal isoenzima el CYP3A4. Muchos FAR, especialmente los IP y los NN, y muchos otros fármacos que a menudo reciben los pacientes con infección por el VIH son inhibidores o inductores de diferentes isoenzimas de CYP. La potente inhibición enzimática que produce el RTV se utiliza para potenciar la farmacocinética de otros IP (substratos de CYP3A4), con lo que se logran concentraciones plasmáticas más eficaces y menos susceptibles al efecto inductor de otros fármacos (p. ej., NN) y, al mismo tiempo, pautas más simples, con menos restricciones dietéticas.
Otra vía metabólica es la conjugación de los FAR o de sus metabolitos procedentes de la oxidación del fármaco por el CYP. Diversos FAR son inductores o inhibidores del complejo enzimático de las uridindifosfato-glucuroniltransferasas (UDPGT) (glucuronización). A menudo, los inductores del CYP son también inductores de la UDPGT y los inhibidores del CYP son inhibidores de la UDPGT, pero algunos inhibidores del CYP son inductores de la glucuronización y viceversa. Así, por ejemplo, el RTV y, en menor medida, el NFV inhiben varias subfamilias del CYP y son inductores de las UDPGT. La combinación TPV/r muestra un efecto inductor de la glucuronización. El ATV inhibe ambos sistemas enzimáticos.
Cada vez están adquiriendo mayor protagonismo una serie de proteínas transportadoras transmembrana, tales como la P-gp, capaces de alterar la biodisponibilidad de diversos FAR y su distribución por el organismo. A estas proteínas pueden inducirlas o inhibirlas diversos fármacos. Habitualmente la inducción o la inhibición del CYP y de la P-gp van en el mismo sentido pero, al igual que sucede con la glucuronización, ambos efectos pueden ser discordantes.
En las tablas 5–10 se detallan las interacciones de los diferentes FAR:
- •
Los AN tienen pocas interacciones metabólicas. La ZDV y el ABC se glucuronizan. La 3TC, la FTC, la d4T y el TDF se eliminan principalmente por vía renal y son poco susceptibles de tener interacciones metabólicas relevantes.
- •
En cuanto a los NN, el NVP se comporta como inductor del CYP3A y del CYP2B6, el EFV es fundamentalmente un inductor del CYP3A4, aunque in vitro se comporta también como inhibidor de este y de otras isoenzimas del CYP (CYP2C9, 2C19). La ETR actúa como sustrato e inductora del CYP3A4 y como inhibidora del CYP2C9 y 2C19551.
- •
Por lo que respecta a los IP, el RTV es un potente inhibidor de las isoenzimas CYP3A4, 2D6 y también tiene un efecto inductor de varias isoenzimas del CYP (1A2, 3A4, 2B6, 2C9, 2C19)552 así como de la glucuronización; además, es capaz de autoinducir su propio metabolismo. El NFV es inhibidor del CYP3A4 y, de forma más débil, del CYP2C19, 2D6, 1A2 y 2B6; en cambio, es inductor de la glucuronización. El IDV es un inhibidor del CYP3A4. El SQV es un inhibidor débil del CYP3A4. El amprenavir puede ser inhibidor o inductor del CYP3A4. El LPV/r inhibe al CYP3A4 in vitro y, en menor proporción, al CYP 2D6; in vivo induce su propio metabolismo, los CYP2C9 y 2C19553 y la glucuronización. El ATV es inhibidor del CYP3A4 y de la UDPGT1A1 (enzima encargada de la glucuronización de la bilirrubina). El TPV/r in vivo y en estado de equilibrio es un inductor del CYP2C9, CYP1A2 y de la glucuronización e inhibidor del CYP3A4 y 2D6554. Respecto a su efecto sobre la P-gp, los datos sugieren que el efecto neto de la combinación TPV/r en estado de equilibrio es de inducción de la P-gp. Debido al efecto antagónico de inhibición del CYP3A4 e inducción de la P-gp, es difícil predecir el efecto neto del TPV/r sobre fármacos que sean substratos de ambos.
- •
Antagonistas del correceptor CCR5: el MVC es sustrato del CYP3A4, pero no es inhibidor ni inductor. Los inhibidores e inductores del CYP3A4 alteran los parámetros farmacocinéticos del MVC, por lo que se recomiendan cambios en su dosis (tabla 9)555–558. En general se ajustarán las dosis como sigue: 150mg en BID cuando se administra con inhibidores del CYP3A4 como por ejemplo IP/r (con excepción del TPV/r y el FPV/r); 600mg en BID cuando se administra con fármacos inductores como EFV o rifampicina (con excepción de la NVP), en ausencia de inhibidores potentes, en cuya presencia predomina el efecto inhibidor, se administrarán 150mg en BID; 300mg en BID con otros fármacos (incluyendo TPV/r y FPV/r)559–581.
Tabla 9.Antagonistas del correceptor CCR5 e inhibidores integrasa
Grupo terapéutico Antagonistas correceptor CCR5 Inhibidores de la integrasa Nombre genérico Maraviroc Raltegravir Nombre comercial Celsentri® Isentress® Dosis 150, 300 o 600mg BID dependiendo de las interacciones con otros fármacos. 300mg BID en ausencia de inhibidores o inductores de CYP3A4 400mg BID Recomendación Puede tomarse con o sin alimentos Puede tomarse con o sin alimentos. Presentación comercial compr de 150 y de 300mg compr de 400mg Biodisponibilidad oral 23–33% 86% Semivida de eliminación plasmática 14–18h 9h Cmáx 0,618μg/ml 4,5μM Cmín 0,034μg/ml 142nM Concentración inhibitoria CI90: 2nM/ml CI95: 31nM/ml Actividad VIH–1 tropismo R5 VIH-1 y VIH-2, tropismo R5, X4 y dual Restricción dietética Con o sin alimentos Con o sin alimentos Metabolización CYP3A4 Glucuronidación (UGT1A1) (No inductor, ni inhibidor) (No inductor, ni inhibidor de CYP3A4 ni de UGT1A1) Efectos Náuseas, vómitos, flatulencia, dolor abdominal Diarrea, nauseas. Adversos Parestesia, disgeusia Cefalea Erupción cutánea Astenia. Interacciones Asociaciones contraindicadas Hypericum perforatum (hierba de San Juan) No se han descrito. Antiácidos No hay datos Antiácidos y anti-H2: No hay datos Antihistamínicos H2 No hay datos IBP: en voluntarios sanos ↑x3 AUC, ↑ 46% Cmín RAL. Datos en pacientes evidencian un menor grado de interacción (↑ 21% Cmín de RAL), sin que se observe aumento de efectos adversos. Probablemente escasa repercusión clínica en la mayoría de los pacientes Inhibidores bomba protones No hay datos Antimicobact. Rifampicina Dosis de maraviroc 600mg c/12h en ausencia de inhibidores enzimáticos potentesa Rifampicina redujo un 61% la Cmín de raltegravir y un 40% el AUC. Valorar aumento de dosis de raltegravir a 800mg c/12h Rifabutina No hay datos NRAD Claritromicina Dosis de maraviroc a 150mg c/12h en combinación con claritromicina o eritromicina Antiepilépticos: Carbamacepina, fenitoína, fenobarbital: Carbamazepina, fenitoína, fenobarbital, lamotrigina Dosis de maraviroc 600mg c/12h en ausencia de inhibidores enzimáticos potentesa Valorar aumento de dosis de raltegravir a 800mg c/12h (no es una recomendación formal del laboratorio). Lamotrigina: ausencia de interacción PK Anticoagulantes orales No hay datos No hay datos Anticonceptivos orales: Ausencia de interacción Ausencia de interacción Antifúngicos imidazólicos Itraconazol y ketoconazol: se recomienda reducir la dosis de maraviroc a 150mg c/12h No es de esperar que raltegravir presente interacción importante con los antifúngicos imidazólicos Fluconazol: los estudios farmacocinéticos poblacionales sugieren que no se requiere ajuste de dosis de maraviroc. Sin embargo, maraviroc 300mg c/12h debe administrarse con precaución cuando se administre con fluconazol hasta disponer de más datos Estatinas: No es de esperar que maraviroc presente interacción importante con las estatinas No es de esperar que raltegravir presente interacción importante con las estatinas Fármacos empleados para tratar la influenza Amantadina/oseltamivir /zanamivir: Teóricamente no deben esperarse interacciones Inmunosupresores: No hay datos Teóricamente con RAL no cabe esperar interacciones. Datos iniciales sobre el uso seguro de RAL con sirolimus, tacrolimus y ciclosporina Interferón/ribavirina No es de esperar que maraviroc presente interacción importante con interferon alfa ni con ribavirina Teóricamente RAL no caben esperar interacciones Metadona y otros opiáceos No es de esperar que maraviroc presente interacción importante con la metadona RAL no modifica las concentraciones de metadona Otros fármacosb Cotrimoxazol: ausencia de interacción Midazolam: ausencia de interacción Ezetimiba: NRAD Nefazodona: debido al efecto inhibidor enzimático potente de nefazodona, se recomienda reducir la dosis de maraviroc a la mitad (150mg c/12h) Midazolam: ausencia de interacción Una interacción con los fármacos utilizados para la disfunción eréctil (sildenafilo, vardenafilo o tadalafilo) es poco probable AN (ver tabla AN) (ver tabla AN) NN (ver tabla NN) (ver tabla NN) IP RTV Reducir la dosis de maraviroc a la mitad (150mg c/12h) Ausencia de interacción o clínicamente no significativa IDV Reducir la dosis de maraviroc a la mitad (150mg c/12h) Teóricamente, no es de esperar una interacción importante. SQV Reducir la dosis de maraviroc a la mitad (150mg c/12h) Teóricamente, no es de esperar una interacción importante. NFV Reducir la dosis de maraviroc a la mitad (150mg c/12vh) No hay datos FPV No requiere ajuste de dosis Un estudio en voluntarios sanos ha demostrado una reducción de Cp de ambos (RAL: ↓ 15–55% AUC, ↓25–68% Cmín; FPV: ↓ 0–36% AUC, ↓ 17–50% Cmín). Los niveles resultantes fueron superiores a x2 veces la IC90 para ambos fármacos, pero podría tener importancia en pretratados. LPV/r Reducir la dosis de maraviroc a la mitad (150mg c/12h) NRAD ATV Reducir la dosis de maraviroc a la mitad (150mg c/12h) NRAD (Con ATV/r 300/100mg/24h 41% AUC RAL sin toxicidad) TPV/r No requiere ajuste de dosis. Monitorizar transaminasas NRAD (↓ 24% AUC y 55% Cmín RAL, pero en los estudios BENCHMRK no disminuyó la eficacia) DRV/r Reducir la dosis de maraviroc a la mitad (150mg c/12h) No es de esperar una interacción importante Nota: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias. /r: potenciado con ritonavir; AN: inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido; AUC: área bajo la curva; ATV: atazanavir; BID: pauta de tratamiento administrada 2 veces al día; Cp: concentración plasmática; FPV: fosamprenavir; IBP: inhibidores de la bomba de protones; IDV: indinavir; IP: inhibidor de la proteasa; LPV: lopinavir; MT: metodona; NFB: nelfinavir; NN: inhibidores de la transcriptasa inversa no análogos de nucleósido; NRAD: no requiere ajuste de dosis; PK: farmacocinética; RAL: raltegravir; RTV: ritonavir; SQV: saquinavir; TID: pauta de tratamiento administrada 3 veces al día; TPV: tipranavir; VIH: virus de la inmunodeficiencia humana.
bFármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, sildenafilo, tacrolimus y trazodona, entre otros.
aEn presencia de inhibidores enzimáticos potentes como los IP (excepto TPV/r y FPV/r), antifúngicos imidazólicos (ketoconazol, itraconazol), macrólidos (eritromicina, claritromicina), nefazodona o telitromicina el efecto inhibidor predomina sobre el efecto inductor enzimático y, por tanto, se recomienda reducir la dosis de maraviroc a 150mg c/12h.
- •
IInt. El RAL no es sustrato ni influye en la actividad del CYP. Se metaboliza por glucuronización, sin inhibir ni inducir esta enzima. Los inhibidores e inductores de UGT1A1 modifican los parámetros farmacocinéticos de RAL, pero en la mayoría de los casos no se recomiendan cambios en su dosificación por el amplio margen terapéutico de este fármaco (tabla 9)582–596.
- •
Inhibidores de la fusión. La ENF se metaboliza a través de las vías catabólicas de las proteínas y aminoácidos. No es sustrato ni influye en la actividad de ninguno de los sistemas metabólicos de los otros FAR. No es susceptible de presentar interacciones metabólicas relevantes.
En las tablas 6–9 se especifican las dosis de los FAR cuando se administran en combinación con otros FAR597–604 o con otros fármacos (antituberculosos605,606, metadona607–654, estatinas655–697, interferón/ribavirina u otros547,698–723 y las asociaciones contraindicadas o no recomendadas)f. Debido a que la información científica relacionada con los FAR se renueva constantemente, se recomienda consultar la ficha técnica y la información actualizada de las compañías farmacéuticas y las autoridades sanitarias.
En la tabla 18 se especifican los ajustes de dosis de los FAR en caso de insuficiencia renal o hepática.
Algunas interacciones farmacodinámicas son de interés, como el antagonismo en la fosforilación intracelular que se produce entre ZDV y d4T. Desde el punto de vista de la coinfección por el VHC, tiene interés conocer que la ribavirina ha mostrado antagonismo in vitro con ZDV y d4T724. Sin embargo, en el subestudio farmacocinético del APRICOT, esta interacción no se produjo in vivo.
La ribavirina y la ddI producen toxicidad mitocondrial. Su incidencia se multiplicó por 5 en comparación con el uso de ribavirina y otros AN. Tres de los 23 casos comunicados a la Food and Drug Administration (FDA) fueron mortales, por lo que se recomienda evitar esta asociación. En lo posible se evitará también el uso simultáneo de ribavirina con ZDV o d4T por toxicidad hematológica o mitocondrial.
Recomendaciones
- •
Se deben reseñar en la historia clínica todos los medicamentos, los productos naturales y las medicinas alternativas para evaluar posibles interacciones.
- •
Se deben tener en cuenta las contraindicaciones y realizar los ajustes de dosis correspondientes cuando sea necesario.
- •
Se debe considerar la monitorización de los niveles plasmáticos cuando se administren 2 o más fármacos con posibles interacciones farmacocinéticas relevantes para evitar toxicidad o la ineficacia terapéutica (nivel C).
La hepatopatía crónica por el virus de la hepatitis es la comorbilidad más relevante que presentan los sujetos infectados por el VIH en España por su frecuencia, por la progresión a enfermedad hepática terminal y por aumentar la hepatotoxicidad del TARV.
Infección por el virus de la inmunodeficiencia humana, tratamiento antirretroviral e historia natural de la hepatitis crónica por el virus de la hepatitis C y BEn pacientes coinfectados por el VIH y virus hepatotropos, la buena situación inmunológica, el control de la replicación viral del VIH y el recibir TARV se asocian a mejor pronóstico global, menor velocidad de progresión de la enfermedad hepática y menor riesgo de complicaciones y muerte por causa hepática725–731. Se ha descrito la capacidad del VIH para infectar células estrelladas hepáticas y promover su activación con incremento de la síntesis de colágeno, lo que sugiere que la replicación del VIH puede contribuir directamente al mayor desarrollo de la fibrosis hepática en pacientes coinfectados724. Por esto, aun en ausencia de ensayos clínicos o estudios de observación prospectiva que valoren el impacto del TARV en la evolución de la fibrosis hepática en cohortes de pacientes coinfectados, las evidencias anteriormente descritas respaldan el control precoz de la replicación del VIH y el mantenimiento de una buena situación inmunológica en estos pacientes.
Recomendaciones
- •
En pacientes coinfectados por el VHC se debe adelantar el inicio del TARV con cifras de linfocitos CD4 por encima de 350células/μl, e individualizar la decisión en función de variables virológicas, histológicas y de motivación del paciente (nivel C)729–732.
- •
En pacientes coinfectados por el virus de la heptitis B (VHB), el TARV se debe iniciar cuando esté indicado el tratamiento del VHB (nivel C)732.
La toxicidad hepática se ha descrito con todas las familias de FAR, aunque con incidencia y mecanismos patogénicos diferentes13,733–735. La incidencia real es difícil de estimar por problemas metodológicos736. En primer lugar, el diagnóstico de toxicidad hepática por un fármaco implica una relación temporal y la exclusión de otras causas de elevación de enzimas hepáticas (EEH), y estos criterios no se cumplen en la mayoría de pacientes coinfectados por el VIH y el VHC/VHB con EEH. En segundo lugar, la definición de los distintos grados de hepatotoxicidad no es uniforme. En los ensayos clínicos se suele definir como hepatotoxicidad grave a una elevación mayor de 5 veces el límite superior de la normalidad de ALT o AST737. Sin embargo, esta definición está limitada al no considerar el fallo hepático, no tener en cuenta la hepatotoxicidad colestásica o mixta y ser más sensible para detectar hepatotoxicidad en pacientes con valores basales de aminotransferasas elevados. Para resolver este último problema se acepta considerar EEH grave asintomática a los incrementos de ALT o AST superiores a 3,5 veces la cifra basal para los pacientes con niveles elevados de aminotransferasa basales738.
En pacientes infectados por el VIH, la coinfección por el VHC/VHB aumenta de 2 a 10 veces las posibilidades de desarrollar EEH durante el TARV, aunque el desarrollo de fallo hepático debido a la hepatotoxicidad por TARV es raro y generalmente sucede en pacientes con hepatopatía avanzada subyacente. La incidencia de hepatotoxicidad aumenta en pacientes con hepatopatía previa738–740. De este modo, en pacientes coinfectados por el VIH/VHC tratados con TARV, la frecuencia de EEH grave asintomática es superior en los que presentan una fibrosis avanzada (estadios F≥3)741.
En pacientes coinfectados por el VIH y el VHC, el tratamiento de la hepatitis C reduce de modo notable el riesgo de toxicidad hepática742,743.
Recomendaciones
- •
No se puede contraindicar ningún FAR en caso de coinfección por el VHC/VHB si la función hepática está preservada (nivel B), pero se debe priorizar el uso de FAR con el menor potencial de hepatotoxicidad (nivel C)13,733–735.
- •
Se debe retirar el TARV en caso de hepatitis sintomática y en la asintomática si se sospecha que se debe a toxicidad mitocondrial, RHS o hiperaminotransferinemia de grado 4 (nivel C)734,735.
- •
En caso de hepatitis asintomática con hiperaminotransferinemia de grado 3, se debe considerar la suspensión del TARV en función de la situación clínica, inmunológica y virológica de los fármacos utilizados y de la historia previa de exposición a FAR (nivel C)734,735.
La hepatopatía crónica puede alterar el metabolismo y la biodisponibilidad de los FAR con incremento de toxicidad o alteración de la actividad antiviral657,681,690,744–748. Se sabe que la hepatitis crónica sin insuficiencia hepatocelular es una situación muy frecuente y la experiencia acumulada sugiere que se pueden usar los FAR a las dosis habituales y que su eficacia no está afectada. Sin embargo, en la insuficiencia hepatocelular se reduce el metabolismo de fármacos por vía P450 y la glucuronoconjugación. No hay datos sobre el TARV en casos de hepatitis aguda (tabla 17).
Recomendaciones
- •
Se debe evaluar el grado de fibrosis hepática y el grado de función hepática en los pacientes coinfectados por virus hepatotropos ya que pueden condicionar la elección del TARV, las dosis prescritas de los FAR y la estrategia de monitorización de su eficacia y toxicidad (nivel C)738–741.
- •
Los FAR se pueden usar a las dosis habituales en caso de hepatitis crónica sin insuficiencia hepatocelular o con insuficiencia hepatocelular leve (Child A), extremando la vigilancia por el mayor riesgo de toxicidad (nivel B) 657,681,690,744–748.
- •
En caso de hepatopatía crónica con signos de insuficiencia hepatocelular, se deberá ajustar la dosis de los fármacos, idealmente mediante la determinación de niveles plasmáticos, o en su ausencia, mediante las recomendaciones de la tabla 17 (nivel C)657,681,690,744–748.
- •
En caso de hepatitis aguda grave debe interrumpirse el TARV y reintroducirlo una vez superado el problema (nivel C)657,681,690,744–748.
Ajuste de dosis en insuficiencia renal y hepatica
| Antirretrovirales | Insuficiencia renal | Hemodiálisis/diálisis peritoneal | Insuficiencia hepatica |
| Inhibidores TI, análogos nucleósido | |||
| Abacavir | No requiere ajuste de dosis | Dosis habitual | IH leve (Child-Pugh 5 a 6): 200mg c/12h. Utilizar la solución oral de Ziagen® (10ml c/12h) |
| No administrar Combivir® y Trizivir® en pacientes con Cl <50ml/min (por separado, ajustar dosis adecuadamente) | HD: administrar independientemente de la sesión de HD, ya que se elimina mínimamente | IH moderada-grave: la seguridad, eficacia y propiedades farmacocinéticas no han sido evaluadas. Evitar en lo posible su uso | |
| Didanosina, cápsulas entéricas | ≥ 60kg | HD/CAPD: 125mg c/24h; los días de HD administrar post-HD/CAPD (no requiere suplemento) | Riesgo elevado de toxicidad hepática y descompensación |
| Cl ≥60: 400mg c/24h | Su uso prolongado se ha asociado a la aparición de hipertensión portal en pacientes no cirróticos | ||
| Cl 30–59: 200mg c/24h | En pacientes cirróticos, no se recomienda el uso de didanosina | ||
| Cl 10–29: 125mg c/24h | |||
| Cl <10: 125mg c/24h | En pacientes en tratamiento del VHC didanosina no debe administrarse conjuntamente con ribavirina | ||
| <60kg | HD/CAPD: no existen presentaciones adecuadas. Utilizar los comprimidos tamponados | ||
| Cl ≥60: 250mg c/24h | |||
| Cl 30–59: 125mg c/24h | |||
| Cl 10–29: 125mg c/24h | |||
| Cl <10: no existen presentaciones adecuadas. Utilizar los comprimidos | |||
| Emtricitabina | En comprimidos: | ||
| Cl ≥50: 200mg c/24h | HD: 200mg c/96h en compr o 60mg (6ml) en solución oral; los días de HD administrar post-HD | Dosis habitual (no hay datos, pero en base a su mínimo metabolismo hepático, es poco probable que requiera ajuste de dosis) | |
| Cl 30–49: 200mg c/48h | No se ha estudiado en diálisis peritoneal | ||
| Cl 15–29: 200mg c/72h | Truvada®: no administrar a pacientes en HD (administrar los componentes por separado, ajustando dosis adecuadamente) | ||
| Cl <15: 200mg c/96h | |||
| En solución: | |||
| Cl ≥50: 240mg (24ml) c/24h | |||
| Cl 30–49: 120mg (12ml) c/24h | |||
| Cl 15–29: 80mg (8ml) c/24h | |||
| Cl <15: 60mg (6ml) c/24h | |||
| Truvada®: no administrar a pacientes con Cl <30ml/min | |||
| Didanosina | ≥60 Kg | HD: 20mg c/24h; los días de HD administrar post-HD | |
| Cl≥50: 40mg c/12h | |||
| Cl 26–49: 20mg c/12h | |||
| Cl<25: 20mg c/24h | Dosis habitual. Utilizar con precaución por el riesgo de toxicidad mitocondrial y esteatosis hepática | ||
| <60kg | HD: 15mg c/24h; los días de HD administrar post-HD | ||
| Cl≥50: 30mg c/12h | |||
| Cl 26–49: 15mg c/12h | |||
| Cl<25: 15mg c/24h | |||
| Lamivudina | Cl≥50: 150mg c/12h o 300mg c/24h | HD: 25mg c/24h (primera dosis 50mg) Los días de la HD, administrar post-HD | Dosis habitual |
| Cl 30–49: 150mg c/24h (primera dosis de 150mg) | |||
| Cl 15–29: 100mg c/24h (primera dosis 150mg) | |||
| Cl 5–14: 50mg c/24h (primera dosis 150mg) | |||
| Cl <5: 25mg c/24h (primera dosis 50mg) | |||
| No administrar Combivir® y Trizivir® si Cl <50ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) | |||
| Zidovudina | Puede acumularse el metabolito glucurónido | 300mg c/24h | Se ha observado una reducción del aclaramiento oral de zidovudina el 32%, 63% y 70%, respectivamente, en pacientes con IH leve, moderada-grave o cirrosis comprobada por biopsia, en comparación con sujetos sin alteración hepática |
| HD/CAPD: no afecta la eliminación de ZDV y aumenta la eliminación de GZDV. Por precaución, se recomienda administrar la dosis diaria post-HD/CAPD | |||
| Cl 10–50: 250–300mg c/12h | Algunos autores sugieren reducir la dosis a 200mg c/12h en pacientes con IH grave. Se recomienda monitorizar estrechamente la aparición de toxicidad hematológica | ||
| Cl <10: 250–300mg c/24h | |||
| No administrar Combivir® y Trizivir® en pacientes con Cl <50ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) | |||
| Inhibidores TI, análogos nucleótido | |||
| Tenofovir | Cl≥50: no requiere ajuste de dosis | HD: habitualmente 300mg una vez por semana, después de una de las sesiones (asumiendo 3 sesiones de diálisis semanales de 4h) | Dosis habitual |
| Cl 30–49: 300mg c/48h | |||
| Cl 10–29: 300mg c/72 a 96h | |||
| No hay recomendaciones disponibles para pacientes con Cl <10 sin HD | |||
| Inhibidores de la TI, no análogos | |||
| Efavirenz | No requiere ajuste de dosis | HD: no parece necesario ajustar la dosis. Sin embargo, por la elevada variabilidad interindividual, se recomienda monitorizar niveles plasmáticos | IH leve a moderada: dosis habitual. Dada la elevada variabilidad interindividual, se recomienda monitorizar niveles plasmáticos y aparición de efectos adversos, especialmente a nivel de SNC |
| Atripla®: en pacientes con Cl <50ml/min, utilizar los principios activos por separado | CAPD: un estudio farmacocinético preliminar indica que no se requiere ajuste de dosis (datos de un solo paciente) | IH grave: datos escasos. Evitar en lo posible su uso/ monitorizar niveles plasmáticos. En un paciente con Child Pugh grado C, la semivida de EFV se duplicó. En dos pacientes con IH (uno de ellos con cirrosis) el AUC de EFV aumentó 4 veces. En 3 pacientes con fibrosis >12kPa (Fibroscan®) la Cmín fue 2,5 veces superior a la obtenida en 15 pacientes coinfectados por VHC con fibrosis <12kPa | |
| En otro estudio el 31% de los pacientes cirróticos presentaron unas concentraciones > 4.000ng/ml, en comparación con un 3% en los coinfectados no cirróticos | |||
| Nevirapina | No requiere ajuste de dosis | HD: los días de HD, se recomienda administrar la dosis después de la HD o un suplemento de 200mg posthemodiálisis | IH leve a moderada (Child-Pugh ≤7): dosis habitual. Sin embargo, en pacientes con IH moderada, se recomienda monitorizar estrechamente niveles plasmáticos y aparición de efectos adversos. En un estudio en 4 pacientes con IH moderada (Child-Pugh B), el AUC de NVP aumentó 41% |
| IH grave: Evitar en lo posible su uso (hepatotoxicidad) | |||
| En el estudio NEVADOSE 66% de los pacientes con un mayor grado de fibrosis (F4; Fibroscan®) presentaron una Cmín de NVP por encima del límite superior de normalidad (>6.000ng/ml). En otro estudio el 50% de los pacientes cirróticos presentaron unas concentraciones > 8.000ng/ml, en comparación con un 27% en los coinfectados no cirróticos | |||
| Se ha observado un aumento de riesgo de hepatotoxicidad en pacientes sin tratamiento previo con CD4 >250céls/μl (mujeres) o >400céls/μl (hombres) | |||
| Etravirina | No requiere ajuste de dosis | HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosis |
| IH grave: no hay datos; evitar en lo posible su uso | |||
| Inhibidores de la proteasa | |||
| Atazanavir | No requiere ajuste de dosis | ||
| HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH moderada (Child-Pugh B 7–9): según un estudio en pacientes coinfectados con VHC con IH leve a moderada, el ATV no potenciado (400mg/24h) puede no llegar a alcanzar la Cmín deseada (6/9 pacientes con niveles subterapéuticos) | ||
| HD: se recomienda su uso potenciado (ATV/r 300/100) para compensar el descenso de concentración de ATV (reducción del 28% en el AUC de ATV; la eliminación a través de la HD es de sólo el 2%). Monitorizar niveles plasmáticos cuando sea posible | IH grave: Datos limitados apoyan el uso de ATV no potenciado (400mg/24h) en pacientes en insuficiencia hepática en fase terminal pretrasplante | ||
| En 9 pacientes con fibrosis >12kPa (Fibroscan®) que recibieron ATV/r, la Cmín fue comparable a la obtenida en 26 pacientes coinfectados por VHC con fibrosis<12kPa. Un estudio en 12 pacientes coinfectados por VHC tratados con ATV/r, el AUC fue solo un 36% superior en los pacientes cirróticos (n=7) | |||
| Monitorizar niveles plasmáticos cuando sea posible | |||
| Darunavir | IR leve o moderada: no requiere ajuste de dosis | ||
| HD/CAPD: debido a la elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosis | ||
| IR grave o en estado terminal: no hay datos. Sin embargo, debido a su limitada eliminación renal, no es de esperar que el aclaramiento total disminuya en pacientes con IR | IH grave: no hay datos; evitar en lo posible su uso | ||
| Fosamprenavir | No requiere ajuste de dosis | HD/CAPD: debido a su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | FPV (no potenciado): Utilizar solamente en pacientes sin tratamiento previo |
| IH leve a moderada (Child-Pugh 5–8): 700mg c/12h | |||
| IH grave (Child-Pugh >9): 350mg/12h | |||
| Utilizar con precaución. Se recomienda la monitorizar niveles plasmáticos cuando sea posible | |||
| FPV/r en pacientes con o sin tratamiento previo: | |||
| IH leve (Child-Pugh 5–6): 700mg c/12h+RTV 100mg/24h | |||
| IH moderada (Child-Pugh 7–9): 450mg c/12h+RTV 100mg/24h | |||
| IH grave (Child-Pugh >9): 300mg c/12h+RTV 100mg/24h | |||
| Utilizar con precaución. Se recomienda la monitorizar niveles plasmáticos cuando sea posible | |||
| Indinavir | No requiere ajuste de dosis | HD: probablemente no requiera ajuste de dosis si función hepática conservada (datos de un solo paciente). Se elimina mínimamente a través de la HD | IDV (no potenciado): |
| IH leve a moderada: 600mg c/8h | |||
| IH grave: no hay datos | |||
| Se recomienda monitorizar niveles plasmáticos cuando sea posible | |||
| IDV/r: | |||
| Algunos pacientes coinfectados con VHC pueden requerir reducción de dosis, habitualmente IDV/r 400/100mg C/12h o, incluso IDV/r 200/100mg c/12h | |||
| Se recomienda monitorizar niveles plasmáticos cuando sea posible | |||
| Lopinavir/r | No requiere ajuste de dosis | HD: El AUC de LPV/r en 13 pacientes en HD fue equivalente a la de pacientes con función renal normal. No ajuste de dosis | |
| Diferentes estudios indican que la farmacocinética de LPV/r no se modifica de modo importante en presencia de insuficiencia hepática, aunque las concentraciones de RTV son algo mayores | |||
| CAPD: no hay datos. Debido a la elevada unión a proteínas plasmáticas de lopinavir y ritonavir, no es de esperar que se elimine en las sesiones de CAPD | En un estudio 11 pacientes con fibrosis >12kPa (Fibroscan®) la Cmín fue comparable a la obtenida en 28 pacientes coinfectados por VHC con fibrosis<12kPa. | ||
| Se recomienda monitorizar niveles plasmáticos cuando sea posible | |||
| Nelfinavir | No requiere ajuste de dosis | ||
| HD: no es probable que NFV se elimine significativamente a través de la HD. Datos de un paciente con IH mostraron la ausencia de eliminación de NFV durante una sesión de HD de 4h | Dosis habitual (aunque en presencia de IH aumenta el AUC de NFV entre un 49% y un 69%, los datos no parecen indicar que se produzca un aumento de toxicidad) | ||
| CAPD: no es probable que NFV se elimine significativamente a través de la CAPD. En un paciente tratado con 1.250mg c/12h de NFV, las concentraciones en el líquido de diálisis fueron inferiores al límite de detección | Se recomienda monitorizar niveles plasmáticos cuando sea posible | ||
| Rritonavir | No requiere ajuste de dosis | ||
| HD/CAPD: debido a la elevada unión a proteínas plasmáticas de ritonavir, no es de esperar que se elimine en las sesiones de HD/CAPD | No usar RTV a dosis plenas por el riesgo de hepatotoxicidad | ||
| Ritonavir como potenciador farmacocinético: | |||
| IH leve a moderada: dosis habitual | |||
| IH grave: no hay datos. Evitar en lo posible su uso | |||
| Saquinavir | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de ritonavir, no es de esperar que se elimine en las sesiones de HD/CAPD. Datos de un paciente indican escasa eliminación a través de HD | IH leve (SQV/r): dosis habitual |
| IH moderada (SQV+/−RTV): no hay datos. Utilizar con precaución. Se recomienda monitorizar niveles plasmáticos cuando sea posible | |||
| IH grave: no hay datos. Evitar en lo posible su uso (contraindicado en insuficiencia hepática descompensada) | |||
| Tipranavir | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de TPV/RTV, no es de esperar que se eliminen en las sesiones de HD/CAPD | Datos limitados. Elevado riesgo de toxicidad hepática: TPV/r se ha relacionado con casos de hepatitis clínica y descompensación hepática, incluyendo algunos casos mortales. Se recomienda un estrecho seguimiento de los pacientes coinfectados por VHB o VHC, por el aumento de riesgo de hepatotoxicidad que presentan |
| IH leve (Child-Pugh A): dosis habitual | |||
| IH moderada o grave (Child-Pugh B y C): contraindicado | |||
| Inhibidores de la fusión | |||
| Enfuvirtide | |||
| No requiere ajuste de dosis | HD: No requiere ajuste de dosis (datos limitados) | No hay datos. Algunos autores recomiendan utilizar la dosis habitual | |
| Inhibidores correceptor CCR5 | |||
| Maraviroc | En ausencia de inhibidores potentes del CYP3A4 probablemente no requiera ajuste de dosis | ||
| Sólo se recomienda un ajuste de dosis en pacientes con Cl <80ml/min y que están recibiendo inhibidores potentes del CYP3A4, como los IP (excepto TPV/r), ketoconazol, itraconazol, claritromicina o telitromicina: en estos casos administrar c/24h | No hay datos | Datos de un estudio con dosis únicas de 300mg MVR. En comparación con los voluntarios con función hepática normal | |
| En combinación con SQV/r reducir el intervalo a c/24h si Cl entre 80 y 50ml/min, c/48h si Cl <50–30ml/min y c/72h si Cl <30ml/min (Estos ajustes de dosis se recomiendan basándose en simulaciones farmacocinéticas, sin que su seguridad y eficacia hayan sido evaluadas clínicamente, por lo que se recomienda una estrecha monitorización) | IH leve: +25% AUC | ||
| IH moderada: +45% AUC | |||
| Se desconoce la importancia clínica que estos aumentos pueden suponer | |||
| Se han descrito casos de hepatotoxicidad precedidos de una reacción alérgica sistémica | |||
| Inhibidores de la integrasa | |||
| Raltegravir | No requiere ajuste de dosis | No hay datos. Dado que se desconoce su posible eliminación a través de la HD, se recomienda dosificar post- HD | IH leve-moderada: no requiere ajuste de dosisIH grave: no hay estudios. Utilizar con precaución |
ATV: atazanavir; AUC: área bajo la curva; CAPD: diálisis peritoneal; Cl: aclaramiento de creatinina en ml/min; EFV: efavirenz; FPV: fosamprenavir; GZDV: metabolito glucurónido; HD: hemodiálisis; IDV: indinavir; IH: insuficiencia hepática; IP: inhibidores de la proteasa; IR: insuficiencia renal; NFV: nelfinavir; NRAD: no requiere ajuste de dosis; RTV: ritonavir; SQV: saquinavir; TI: transcriptasa inversa; VHC: virus de la hepatitis C.
El tratamiento recomendado de la hepatitis crónica por el VHC en pacientes coinfectados por el VIH es la combinación de interferón pegilado y ribavirina749–757. Por otro lado, se han descrito brotes de hepatitis aguda C en homosexuales infectados por el VIH758–761, para cuyo tratamiento se recomienda interferón pegilado en caso de que la viremia C persista detectable a las 12 semanas762–765. La duración óptima del tratamiento en ambos casos está por definirse765. El uso simultáneo de interferón pegilado y ribavirina con los FAR puede afectar tanto a la eficacia como a la seguridad de ambos765–767. Se han comunicado datos de estudios retrospectivos que sugieren una disminución de la respuesta al tratamiento con interferón pegilado y ribavirina si el TARV incluía ABC702,768,769. Por el contrario, en estudios donde la ribavirina se ajustaba al peso no se ha observado esta asociación770,771. Hasta que se confirmen estos datos no se pueden establecer recomendaciones firmes. Sin embargo, parece razonable evitar, si es posible, el ABC durante el tratamiento de la hepatitis C en los pacientes con menor probabilidad de respuesta. En caso de que el TARV incluya ABC, deberá asegurarse que la dosis de ribavirina sea superior a 13,6mg/kg.
Los niveles plasmáticos de EFV aumentan en pacientes cirróticos por encima del dintel de toxicidad del SNC en un alto porcentaje de pacientes657,772, por lo que si se usa EFV en este escenario, debería hacerse con monitorización de los niveles del fármaco para evitar la sobreexposición a este. Por último, se ha comunicado que una sustancial proporción de pacientes en tratamiento estable con ATV experimentan hiperbilirrubinemia e ictericia tras el inicio de tratamiento para la hepatitis C con interferón mas ribavirina. Este hecho podría deberse al incremento de bilirrubina asociado a la hemolisis por ribavirina y a la afectación del normal aclaramiento de bilirrubina debido a la inhibición competitiva del ATV773.
Recomendaciones
- •
El TARV no debe iniciarse simultáneamente con el tratamiento del VHC (nivel C)764.
- •
Cuando se traten simultáneamente el VIH y el VHC, debe realizarse un seguimiento estrecho del paciente para detectar reacciones adversas (nivel B)765–767.
- •
No se debe asociar la ribavirina con ddI (nivel B)764.
- •
Se evitará el uso simultáneo de ribavirina con ZDV (nivel B)764.
- •
En todo paciente coinfectado por el VIH y virus hepatotropos se debe procurar que el tratamiento con ribavirina se ajuste al peso. Esta recomendación debe extremarse en caso de tratamiento concomitante con ABC (nivel C).
- •
No se considera necesario modificar la estrategia de monitorización del VIH durante el tratamiento simultáneo de la infección por el VHC (nivel C)764.
Los FAR activos frente al VIH y al VHB son 3TC, FTC y TDF732,774–782. Si alguno de ellos se retirara de un TARV que fracase, podría originar en coinfectados por VHB un rebrote del virus con daño hepatocelular783. El tratamiento de la hepatitis por VHB con 3TC o FTC en monoterapia facilita la aparición de resistencias al VIH777–782. El entecavir, un fármaco activo frente al VHB, ha demostrado actividad frente al VIH y capacidad para inducir igualmente mutaciones, como la M184V777,779.
Recomendaciones
- •
Se recomienda iniciar el TARV usando la asociación de TDF+FTC (o 3TC) como AN en pacientes coinfectados que requieran tratamiento del VIH o el VHB (nivel C)732,779
- •
Si se requiere tratamiento del VHB y se decide no tratar el VIH, se recomienda usar fármacos que no induzcan resistencias al VIH (nivel C)732,779
- •
No debe usarse entecavir en pacientes infectados por el VIH, salvo que su replicación esté controlada con otros fármacos (nivel B)732,779
- •
En pacientes coinfectados en los que por cualquier motivo se suspenda la 3TC, la FTC o el TDF, se debe incluir en el TARV otro fármaco con actividad anti-VHB (nivel C)732,779
La transmisión materno-fetal es la causa de prácticamente la totalidad de los casos de infección por el VIH en niños.
La tasa de transmisión vertical ha variado entre el 2–48%, dependiendo del tratamiento de la madre, la profilaxis del niño expuesto y el tipo de lactancia784,785. En el mundo desarrollado, el éxito del TARV y las noticias difundidas por los medios de comunicación sobre la disminución de la transmisión vertical han reavivado el interés por la procreación en parejas en las que uno o ambos miembros están infectados. A continuación se resumen las evidencias sobre las que se basan las recomendaciones del TARV en el embarazo y la prevención de la transmisión vertical. Si se quiere más información se aconseja la lectura de los documentos más amplios incluidos en la bibliografía784.
El riesgo de transmisión vertical depende de varios factores (maternos, virales, placentarios, obstétricos, lactancia, fetales, neonatales, etc.), pero la CVP de la madre durante el embarazo y en el parto es el factor determinante786. Aunque existe una relación clara entre CVP materna y riesgo de transmisión, no se conoce un nivel por encima del cual la transmisión sea del 100% ni tampoco un dintel por debajo del cual se garantice que no haya transmisión. Se ha descrito que la tasa de transmisión en mujeres en TARV y con CVP inferior a 1.000copias/ml es del 0,96% y 10 veces superior (9,8%) en mujeres no tratadas con CVP inferior a 1.000copias/ml, lo que enfatiza la importancia del TARV, incluso en caso de CVP baja787,788.
Para una correcta prevención de la transmisión vertical es imprescindible que la mujer sepa su situación de infectada. Por esto es obligado efectuar la serología frente al VIH a todas las embarazadas, independientemente de sus antecedentes epidemiológicos. Una vez conocida la seropositividad, las estrategias que se han perfilado como más importantes han sido el TARV, la cesárea programada y evitar la lactancia789.
Los ensayos clínicos aleatorizados efectuados en el campo de la transmisión materno-fetal han permitido extraer una serie de conclusiones aplicables en la práctica diaria: el tratamiento con ZDV (500mg/día de ZDV vía oral, desde las 14 y las 34 semanas, ZDV intravenosa en el parto y ZDV oral al neonato durante 6 semanas) disminuye el riesgo de transmisión del 25,5 al 8,3790. Solo una parte de esta eficacia se correlaciona con un descenso de la CVP materna; la hipótesis más aceptada es que se deba a efecto profilaxis postexposición (PPE)791.
Una dosis única de NVP en el momento del parto reduce el riesgo de transmisión en un 50% y mantiene su efectividad a los 18 meses en niños que se alimentan con lactancia materna792,793. Sin embargo, la aparición de la mutación K103N en más del 65% de los casos293 desaconseja el uso de esta estrategia en nuestro medio y la cuestiona en países pobres en recursos794.
Se ha demostrado en estudios de cohortes que la combinación de ZDV y 3TC reduce la transmisión vertical a un 1,6%795–798 y, en algunos estudios observacionales que incluyen mujeres con TARV con un IP, no ha habido transmisión vertical (0%; IC95%: 0–2). Cifras inferiores al 3% se están observando tanto en nuestro país como en Europa y EE. UU799,800.
Los datos de seguridad de los FAR para el feto son limitados (tabla 18). De los datos disponibles, se pueden destacar: 1) la ZDV es segura al menos a corto y medio plazo, aunque un estudio indicó riesgo de toxicidad mitocondrial en niños; 2) el EFV es un fármaco potencialmente teratógeno, por lo que está contraindicado al menos durante el primer trimestre; 3) es posible que los IP se asocien a bajo peso al nacer801 o prematuridad802; 4) la seguridad de otros fármacos es aun peor conocida y, aunque se catalogan como categoría «B» o «C» de la FDA (tabla 18), los datos disponibles de seguridad, especialmente a largo plazo, son limitados. Se tiene escasa información del TDF, el ATV, el FPV y el IDV, y muy escasa del TPV, el DRV, el RAL, la ETR y el MVC. Por esto se deben evitar estos fármacos, salvo en pacientes embarazadas en fracaso, en cuyo caso deberemos orientarnos en función de la poca información disponible; 4) en un registro establecido en 1989 (Antiretroviral Pregnancy Registry) se recogen de forma prospectiva los datos de exposición a FAR y la evolución de 10.405 niños expuestos a antirretrovirales durante el embarazo. La prevalencia de malformaciones entre los expuestos en el primer trimestre es del 2,9% de los nacidos vivos, cifra que no difiere de la población no expuesta (2,7%)803.
Seguridad de los antirretrovirales en el embarazo
| Fármaco | FDA* | Paso a través de placenta (cociente RN/madre) | Carcinogenicidad (animales) | Teratogenicidad (animales) |
| Zidovudina | C | 0,85 | Sí | Sí |
| Didanosina | B | 0,5 | No | No |
| Estavudina | C | 0,76 | Sí | No |
| Lamivudina | C | 1 | No | No |
| Abacavir | C | Si (ratas) | Sí | Sí |
| Tenofovir | B | 0,95–0,99 | Sí | No |
| Emtricitabina | B | 0,4–0,5 | No | No |
| Saquinavir | B | Mínimo | No | No |
| Indinavir | C | Mínimo | Sí | No |
| Ritonavir | B | Mínimo | Sí | Sí |
| Nelfinavir | B | Mínimo/Variable | Sí | No |
| Fosamprenavir | C | ¿? | Sí | No |
| Lopinavir | C | 0,07–0,3 | Sí | Sí |
| Atazanavir | B | Mínimo/Variable | Sí | No |
| Tipranavir | C | ¿? | No completado | No |
| Darunavir | B | ¿? | Sí | No |
| Nevirapina | B | 1 | Sí | No |
| Efavirenz | D | 1 | Sí | Sí |
| Etravirina | B | ¿? | No completado | No |
| Enfuvirtida | B | No (basado en muy pocos datos) | No realizado | No |
| Maraviroc | B | ¿? | No | No |
| Raltegravir | C | Ratas (1,5–2,5) | No completado | No |
| Conejos (0,02) |
FDA: Food and Drug Administration.
En cuanto a la madre, cabe reseñar que se han descrito casos de toxicidad mitocondrial y acidosis láctica en gestantes, que pueden estar más predispuestas a esta complicación. Estos efectos secundarios se asociaron inicialmente a ZDV, pero posteriormente se han descrito casos relacionados con d4T. La FDA ha comunicado 3 muertes maternas por acidosis láctica y 3 muertes fetales en mujeres tratadas con d4T y ddI como AN, por lo que desaconseja esta combinación. La acidosis láctica grave, no letal, se ha comunicado con otros AN803. Además se ha descrito que la hepatotoxicidad por NVP sería 12 veces más frecuente en gestantes con cifras de linfocitos CD4 superiores a 250células/μl.
La cesárea programada (antes del inicio del parto) como instrumento potencial para reducir la transmisión vertical se ha mostrado útil en algunas situaciones804. En un metaanálisis de estudios de cohorte, la cesárea programada redujo el riesgo de transmisión cerca del 50% (OR: 0,43; IC95%: 0,33–0,56). La transmisión disminuyó en un 87% cuando coincidían cesárea programada y tratamiento con ZDV (anteparto, intraparto y posparto)796. En parejas madre-hijo que recibieron ZDV (anteparto, intraparto y postparto), la transmisión vertical fue del 2% entre las 196 madres a las que se les realizó cesárea electiva y del 7,3% en las 1.255 madres con otras formas de parto.
Los datos disponibles sugieren que si en el momento del parto la CVP es inferior a 1.000copias/ml, la cesárea electiva no disminuye el riesgo de transmisión del parto vaginal (el 0,8 frente al 0,7%)805. La morbilidad relacionada con la cesárea en los países desarrollados no parece ser importante806. La lactancia está contraindicada. En países en vías de desarrollo existen datos sobre la utilidad del TARV para reducir la transmisión, con la limitación de la lactancia a los 6 primeros meses de vida.
Recomendaciones
- •
El test del VIH debe efectuarse a toda mujer embarazada (nivel B). Si hay prácticas de riesgo, debe repetirse en el tercer trimestre807.
- •
En las mujeres que llegan al parto sin conocer su estado respecto al VIH, se debe hacer un test rápido, ya que la cesárea electiva reduce la transmisión un 50% (nivel B).
- •
El objetivo del TARV en la gestación es conseguir una CVP indetectable (nivel B). La ZDV debe incluirse en el TARV, siempre que no haya resistencia o toxicidad grave documentadas previamente o dudas respecto a la adherencia, que se administrará durante el embarazo, en el parto y al recién nacido. Si se sabe que hay resistencias a la ZDV, debe indicarse por vía intravenosa durante el parto y al recién nacido (nivel A).
- •
Se debe informar a la madre de las ventajas del TARV para ella y su utilidad para reducir la transmisión vertical. Se debe informar igualmente de los efectos secundarios conocidos de los fármacos y de las incertidumbres respecto a la seguridad, tanto para ella como para el feto, a medio y largo plazo. Se deben realizar controles periódicos. Es fundamental planificar el control de la CVP antes del parto, hacia las 32–36 semanas, para decidir si se va a realizar cesárea electiva o no (niveles B y C).
- •
No deben utilizarse fármacos con riesgo teratogénico (como EFV) (nivel A) o con riego de toxicidad sobre el feto (IDV). Asimismo, deben evitarse, en la medida de lo posible, fármacos cuyo riesgo no es bien conocido (FPV, TDF, ATV, DRV, TPV, ENF, MVC, ETR y RAL) (nivel C).
- •
Se desaconseja la combinación de d4T+ddI por el riesgo de acidosis láctica (nivel B). Si no hay otras alternativas, el uso de esta combinación obliga a un seguimiento muy estrecho de la paciente (nivel C).
- •
Se desaconseja la utilización de NVP en monoterapia (nivel A). Tampoco se recomienda el inicio de TARV con NVP en mujeres con cifras de linfocitos CD4 superiores a 250células/μl si existen otras alternativas (nivel B).
- •
Si no se consigue una CVP suficientemente baja (<1.000copias/ml) o en el caso de que la mujer decida no llevar TARV o hacerlo solo con ZDV, se debe indicar una cesárea programada en la semana 37–38 (nivel A).
- •
Las pacientes que quedan embarazadas en fracaso virológico tienen el mayor riesgo de transmisión. En esta situación, se debe efectuar un estudio de resistencias para guiar el TARV (nivel C); debe utilizarse también ZDV (en el parto) e indicar cesárea programada en la semana 37–38 (nivel C).
- •
Las pacientes que conozcan su condición de infectadas muy cerca del parto deben recibir TARV. Además, debe recomendarse la cesárea programada si no consiguen una CVP inferior a 1.000copias/ml (nivel A).
- •
La dosis de ZDV intravenosa durante el parto es de 2mg/kg la primera hora y posteriormente 1mg/kg/h hasta la ligadura del cordón. Al recién nacido se le administran 2mg/kg/cada 6h durante 6 semanas, empezando tras el alumbramiento (nivel A).
El uso de TARV tras una exposición profesional al VIH reduce el riesgo de transmisión de este, aunque se han documentado transmisiones a pesar de una PPE correcta con 3 fármacos. El riesgo de transmisión del VIH tras exposición percutánea a sangre infectada oscila entre el 0,24–0,65% y es del 0,09% tras un contacto con mucosas o piel no intacta808. Los factores asociados a un mayor riesgo de transmisión del VIH son pinchazo profundo (OR: 15; IC95%: 6,0–41), con sangre visible en el dispositivo (OR: 6,2; IC95%: 2,2–21), recién extraído de vena o arteria (OR: 4,3; IC95%: 1,7–12) en paciente fuente con enfermedad avanzada (OR: 5,6; IC95%: 2–16). La PPE con monoterapia (ZDV) reduce la transmisión un 81% (OR: 0,19; IC95%: 0,06–0,52)809. No existen estudios comparados que permitan establecer recomendaciones firmes sobre el momento de inicio, la duración o los fármacos o combinaciones por emplear tras una exposición accidental.
Por modelos animales y estudios de caso-control sabemos que la PPE es tanto más eficaz cuanto antes se inicie499. Su duración no está establecida, pero en modelos animales los períodos de 3 o 10 días son menos eficaces que los de 28 días, por esto se ha consensuado el recomendar 4 semanas. No existen estudios que demuestren que la PPE con 3 fármacos sea mejor que con 2, aunque prevalece la opción de indicar tratamiento triple de modo similar al TARV de inicio. La elección de los FAR dependerá de los efectos adversos potenciales y de las preferencias de los sanitarios, teniendo en cuenta que la intolerancia a los FAR entre el personal sanitario es muy elevada (50%).
Para establecer la necesidad de profilaxis debemos conocer el tipo de exposición y solicitar, tras consentimiento informado, serología rápida frente al VIH, el VHB y el VHC del paciente fuente y del trabajador.
En las exposiciones que precisen profilaxis se recomienda un TARV que incluya 2 AN, con un IP potenciado. En los casos que no pueda administrase un TARV basado en IP o que sea intolerante, la sustitución de este por EFV (se debe recordar que no puede administrarse embarazadas) o la combinación de ZDV+3TC+TDF podrían ser buenas opciones810–812. La NVP no es aconsejable por las posibles toxicidades cutáneas y hepáticas810.
En caso de conocer o sospechar que el paciente fuente tiene un virus resistente, se deben seleccionar FAR sin resistencia cruzada. Se ha demostrado que una elevada proporción de virus de los casos fuente presentan mutaciones de resistencia, especialmente a AN y NN813. El MVC, el RAL o el T20 no se recomiendan para PPE, salvo en casos excepcionales de multirresistencia. El PNS/Gesida814, la EACS548,815 y otros organismos han actualizando las recomendaciones de TARV postexposición ocupacional y no ocupacional cuyo texto está disponible en sus respectivas páginas web.
A toda persona que se haya evaluado por PPE debe ofrecérsele un plan de seguimiento que incluirá información, apoyo psicológico y control de los posibles síntomas de primoinfección. Si se le prescribió PPE, se debe controlar dentro de las primeras 72hs para revalorar necesidad de profilaxis y conocer si el trabajador ha presentado reacciones adversas, interacciones y problemas de adherencia. Se programarán controles analíticos y serológicos a las 4 semanas y a los 3 y 6 meses.
Recomendaciones (niveles B y C)
- •
Los servicios sanitarios deben disponer de un manual escrito sobre las actuaciones y las derivaciones que se deben seguir en el caso de exposición al VIH, profesional o no, con disponibilidad de diagnóstico serológico rápido y con accesibilidad de 24h a los fármacos utilizados en la PPE.
- •
Se debe valorar el caso fuente (VIH confirmado o sospechoso), el estado serológico de la persona expuesta y las características de la exposición para indicar la PPE.
- •
La administración de PPE debe iniciarse lo antes posible, mejor en las primeras 4h, y hasta las 72h. No está indicada después de 72h y su duración será de 4 semanas.
- •
Cuando esté indicada la PPE, se recomienda una pauta convencional con 3 FAR. Se recomiendan combinaciones fijas (TDF+FTC o ZDV+3TC), asociadas a un IP potenciado (similar al tratamiento de inicio). Si no se puede administrar TARV basado en IP, podría sustituirse el IP potenciado por EFV o bien por un tratamiento con 3 AN: ZDV/3TC+TDF o TDF/FTC+ZDV.
- •
Si se sospecha que el virus del caso índice puede tener resistencia a uno o varios fármacos, la profilaxis no debe retrasarse y debe incluir medicamentos sin resistencia cruzada.
- •
En caso de duda sobre la indicación de la PPE, se recomienda administrar la primera dosis de forma inmediata y valorar su continuidad en las 24h posteriores por parte de un experto en infección por el VIH.
- •
El seguimiento debe incluir la revaloración de la indicación a las 24–72h del inicio del TARV y control del cumplimiento y la tolerabilidad del TARV así como serología al VIH, el VHB y el VHC (estos en caso de fuente infectada o con sospecha) a los 1, 3 y 6 meses tras la exposición.
La indicación de la PPE no ocupacional se basa en la patogenia de la infección por el VIH, en estudios observacionales realizados principalmente en mujeres víctimas de violaciones y en hombres con prácticas sexuales con otros hombres de alto riesgo, en la información procedente de otras profilaxis frente al VIH (exposición ocupacional, transmisión vertical) y en datos de experimentación animal. Todos ellos apoyan en mayor o menor grado la PPE no ocupacional con FAR.
El mayor riesgo de transmisión es la relación anal receptiva no protegida (0,5–3%) con varón VIH+, seguido del intercambio de jeringuillas (0,67%), la punción percutánea con VIH+ (0,3%), la relación vaginal receptiva (0,05–0,8%) o la vaginal o anal insertiva (0,05–0,065%). La relación orogenital receptiva e insertiva tiene un riesgo menor (0,005–0,01%)815–817. Aumentan también el riesgo la presencia de ITS o las agresiones sexuales.
Inicialmente existió cierta preocupación de que la extensión de la PPE no ocupacional pudiera reducir las medidas de prevención primaria al existir una supuesta «profilaxis para el día después» y relajar la seguridad en las prácticas sexuales o de las inyección de drogas. Sin embargo, se ha demostrado que si la PPE no ocupacional se acompaña de la oportuna intervención educativa se pueden reducir las prácticas de riesgo818. Es importante en este sentido realizar una historia sexual en la primera visita y de forma periódica, junto con cribado de ITS, y discutir con el paciente los métodos para la prevención de la transmisión del VIH en las relaciones sexuales. Algunos problemas de la PPE no ocupacional son que a menudo no se conoce la situación serológica de la fuente, el inicio de la profilaxis suele ser más tardío y el nivel de abandonos suele ser más alto, ya sea por efectos adversos de los FAR o por simples pérdidas del seguimiento818. Estudios de coste-eficacia demuestran que únicamente las relaciones de alto riesgo con fuentes documentadas HIV positivas son coste-efectivas819.
En las recomendaciones de los CDC815 y del PNS/Gesida814 se insiste en 2 aspectos claves de la PPE no ocupacional: 1) la actuación médica no debe ceñirse exclusivamente a valorar la indicación de PPE con FAR, sino que debe contemplar la oferta de la prueba para el VIH, la educación sanitaria para la reducción del riesgo de adquisición del VIH, la valoración del riesgo de transmisión de otras infecciones y el seguimiento clínico, y 2) la decisión de llevar a cabo PPE con FAR ha de ser tomada por el médico y el paciente de forma individualizada, valorando sus beneficios y su riesgos y desaconsejándola en personas con exposiciones repetidas. La PPE debe considerase teniendo en cuenta el nivel de riesgo, la vía de exposición, el estado serológico o las prácticas de riesgo de la persona fuente, así como el TARV recibido por el paciente fuente en caso de estar infectado por el VIH y la existencia de factores de riesgo añadidos820–823 (tabla 19).
Recomendaciones de profilaxis postexposición
| PPE recomendada si: | ||
| Exposición a: | Tipo exposición | Fuente |
| Sangre u otros fluidos potencialmente infectivos | Penetración SC o IM con aguja IM/IV o sistema IV | VIH+, o desconocido pero con factores de riesgo |
| Accidente percutáneo (instrumento cortante o aguja) | VIH+ | |
| Contacto >15min con mucosas o piel no intacta | ||
| Secreciones genitales | Sexo anal o vaginal | VIH+, o desconocido pero con factores de riesgo |
| Sexo oral receptivo con eyaculación | VIH+ | |
| UDVP | Intercambio de jeringuilla o agujas | VIH+ |
| Régimen terapéutico: | ||
| TDF/FTC o ZDV+3TC+IP/r | ||
| Alternativas¿: | ||
| TDF/FTC o ZDV+3TC+EFV | ||
| ZDV+3TC+TDF | ||
/r: potenciado con ritonavir; 3TC: lamivudina; EFV: efavirenz; FTC: emtricitabina; IP: inhibidor de la proteasa; IM: intramuscular; IV: intravenosa; SC: subcutánea; TDF: tenofovir; UDPV: usuarios de drogas por vía parenteral; VIH: virus de la inmunodeficiencia humana; ZDV: zidovudina.
La elección de los FAR , el inicio y la duración es similar a la PPE ocupacional, con la salvedad de que el EFV no es aconsejable por su baja concentración en las secreciones genitales (inferior al 10% de concentración en plasma) y su posible efecto teratógeno812.
Recomendaciones (nivel C)
- •
La PPE no ocupacional debe individualizarse y llevarse a cabo en el marco de una intervención médica integral.
- •
La PPE no ocupacional debe recomendarse en las situaciones denominadas de «riesgo apreciable» si se dan las siguientes condiciones: a) instauración precoz (similar a la PPE ocupacional); b) ausencia de contraindicaciones para tomar FAR; c) exposición excepcional, y d) garantía de seguimiento clínico y analítico del paciente.
- •
Los fármacos por emplear, su duración y el seguimiento de los pacientes será igual que en la PPE ocupacional.
- •
En caso de exposición sexual debe valorarse el riesgo de ITS y embarazo.
Las interrupciones supervisadas del TARV (IST) se plantearon inicialmente con algunos de los siguientes objetivos: 1) estimulación de la respuesta inmunitaria celular en pacientes con CVP indetectable (autoinmunización); 2) reversión de mutaciones del VIH en pacientes en multifracaso antes del TARV de rescate, y 3) reducción de la exposición al TARV, principalmente en pacientes con CVP indetectable, para prevenir o revertir efectos adversos, mejorar la calidad de vida y, en menor grado, disminuir el gasto sanitario (vacaciones terapéuticas).
Prácticamente se han abandonado los 2 primeros planteamientos al no obtener resultados positivos820–823. El planteamiento teórico de la IST para la autoinmunización era conseguir, mediante brotes de replicación viral intermitente, la estimulación de la respuesta inmunitaria específica frente al VIH con el fin de conseguir una baja replicación viral que permitiera mantener a los pacientes libres de TARV durante períodos prolongados. Algunos estudios demostraron que, aunque era posible inducir una respuesta inmunoespecífica frente al VIH, el porcentaje de pacientes que controlaron la replicación viral en ausencia del TARV fue muy bajo821–823.
Las IST previas a un TARV de rescate con el objetivo de revertir las resistencias a los FAR824,825 y mejorar la respuesta a este no han demostrado beneficio virológico o inmunológico377,378,826,827 y durante la IST existe un mayor riesgo de progresión clínica.
En un contexto similar, en pacientes con CVP detectable y en multifracaso, se han experimentado las llamadas interrupciones parciales de tratamiento. Estas consisten en interrumpir los IP manteniendo los AN a los que el virus es resistente. Con esta estrategia se perpetuán las mutaciones virales que condicionan baja capacidad replicativa, se contiene la replicación viral y se preserva los linfocitos CD4192,827. Por tanto, esta estrategia de interrupciones parciales de tratamiento podría plantearse en pacientes seleccionados hasta disponer de nuevos fármacos de rescate.
Las IST para reducir la exposición al TARV (vacaciones terapéuticas) tienen como objetivo evitar o revertir toxicidades, mejorar la calidad de vida y reducir costes manteniendo la eficacia clínica e inmunológica828–838. Los riesgos serían la presentación de un síndrome retroviral agudo con rebrote viral, el deterioro inmunológico y la progresión clínica, la aparición de nuevas mutaciones (resistencia), más posibilidades de transmisión del VIH y el aumento de enfermedades cardiovasculares y hepáticas no diagnósticas de sida830,833.
No es fácil comparar los resultados de los estudios publicados o comunicados por diferencias en el diseño, tipo de pacientes incluidos, criterios para suspender o reiniciar el tratamiento, etc. Algunos estudios han mantenido interrupciones fijas830,833,839 mientras que en otros las IST se han basado en las cifras de linfocitos CD4831,834,839 e incluso de la CVP192. En el mayor estudio aleatorizado realizado hasta la fecha, el SMART, los pacientes con IST progresaron más a sida o muerte y además presentaron en mayor proporción episodios cardiológicos o hepáticos192. Es probable que la cifra de linfocitos CD4 de 250células/ml como criterio de reinicio fuera demasiado baja y favoreciera un curso desfavorable. Así, en otros estudios en los que el TARV se reiniciaba con una cifra de linfocitos CD4 de 350células/μl834,836–839, la evolución fue favorable, especialmente en pacientes cuyo nadir de linfocitos CD4 era superior a 200células/μl836,838. Esta estrategia podría ser de utilidad en los que iniciaron el TARV con cifras de linfocitos CD4 superiores a 350–500células/μl y que permanecen con CVP indetectable si no han presentado trombocitopenia.
El riesgo de desarrollo de resistencias en las pautas que incluyen un NN829 se puede reducir interrumpiendo la NVP o el EFV una semana antes, lo que evita la «monoterapia» con fármacos de vida media prolongada834.
En cualquier caso, la principal razón para no recomendar en la actualidad las estrategias de «vacaciones terapéuticas» es el hallazgo en el estudio SMART de un aumento en la incidencia de enfermedades cardiovasculares y hepáticas192,840. En subestudios del SMART840 y otros estudios como el STACCATO841 y el estudio español STOPPAR842 se ha demostrado que la pérdida de control de la replicación viral daría lugar al aumento de citoquinas proinflamatorias como MCP-1, sVCAM-1 o IL-6, entre otras, lo que contribuiría al aumento del riesgo cardiovascular tras la interrupción del TARV.
Recomendaciones
- •
No se recomienda la IST como forma de autoinmunización (nivel B) ni como parte de una estrategia de rescate (nivel A)821–823,825,825,826.
- •
Se desaconseja la IST guiada por linfocitos CD4. Si se plantea en una situación muy seleccionada, se deberían cumplir las siguientes condiciones: 1) el paciente no está dispuesto a continuar el TARV de forma indefinida; 2) tiene cifras de linfocitos CD4 superiores a 500células/μl; 3) el nadir de linfocitos CD4 es superior a 200células/μl; 4) se reiniciará el TARV si las cifras de linfocitos CD4 son inferiores a 350células/μl; 5) el paciente debe conocer que existe un incremento del riesgo de enfermedades cardiovasculares y hepáticas si se interrumpe el TARV y se reinicia cuando los linfocitos CD4 descienden a menos de 250células/μl, y 6) el paciente es consciente de que la replicación viral y el aumento de la CVP suponen más posibilidades de transmitir el VIH y tomará las medidas adecuadas (nivel C)192,828.
El TARV suprime de forma eficaz la replicación viral, lo que se sigue de una reconstitución importante del sistema inmunitario. Sin embargo, la respuesta inmunoespecífica frente al VIH no suele recuperarse y además en algunos casos la reconstitución inmunológica es parcial. Para el primer caso se han ensayado las vacunas terapéuticas y en el segundo caso el tratamiento con inmunomoduladores como la IL-2.
Citoquinas: interleucina-2En algún ensayo clínico y series prospectivas843–845 se ha demostrado que la IL-2, administrada de forma intermitente por vía subcutánea (4,5 a 7,5MU cada 12h durante 5 días cada 8 semanas) en combinación con TARV aumentaba de forma importante el número de linfocitos CD4 y se asociaba con una mejor respuesta virológica en comparación con el TARV. Para saber si estos cambios inmunológicos se traducían en mejorías clínicas, se llevaron a cabo 2 grandes ensayos clínicos denominados SILCAAT (1.695 sujetos con cifras de linfocitos CD4 de entre 50–299células/μl) y ESPRIT (4.111 pacientes con cifra de linfocitos CD4 superiores a 300células/μl), cuyos resultados se han publicado846. El punto final de evaluación era el mismo en ambos estudios: presencia de EO o muerte. A pesar de que en ambos se evidenció un aumento significativo de linfocitos CD4 (una diferencia de 59 células a favor del grupo de IL-2 en el SILCAAT y de 160 en el ESPRIT), lamentablemente ambos estudios demostraron que el aumento de linfocitos CD4 como consecuencia del uso de IL-2 no se asociaba a una reducción de EO o a un aumento en la supervivencia de estos pacientes. El RR de EO/muerte fue de 0,91 (0,70–1,18; p=0,47) y de 0,93 (0,75–1,16; p=0,52), respectivamente. En cambio, los pacientes de las ramas de IL-2 presentaron mayor toxicidad, sobre todo grado 4, gastrointestinal y psiquiátrica. Los autores concluyeron que los linfocitos CD4 aumentados tras el uso de IL-2 no serían funcionalmente equivalentes a los CD4 resultantes de la supresión virológica tras el uso de TARV.
Recomendación
- •
Los resultados de 2 grandes ensayos clínicos desaconsejan el uso de IL-2 en pacientes infectados por el VIH con el objetivo de aumentar su inmunidad porque no se asocia a una reducción de EO ni de mortalidad y sí a un aumento de toxicidad (nivel A)846
El objetivo de las inmunizaciones terapéuticas es potenciar la respuesta inmunoespecífica frente al VIH. Se han realizado varios estudios con diferentes vacunas terapéuticas en los que se ha observado una respuesta inmunoespecífica variable frente al VIH, pero no se ha observado un claro beneficio inmunológico, virológico o clínico847. En la actualidad, las vacunaciones terapéuticas están en el ámbito exclusivamente experimental848,849.
Nuevos antirretroviralesA pesar de la larga lista de FAR disponibles, la imposibilidad de erradicar el VIH, los requerimientos de adherencia, las toxicidades a largo plazo y el desarrollo de resistencias cruzadas entre clases o familias de FAR obligan a buscar nuevos fármacos para el control duradero de la infección por el VIH.
Existen fármacos no comercializados pero en fases avanzadas de investigación y accesibles dentro de programas de acceso expandido o en fase iii de investigación: el NN rilpivirina (TMC278), el IInt elvitegravir (EVG) y el antagonista CCR5 VCV.
La rilpivirina (TMC278) es otro NN en fase iii, con buenos datos preliminares, que muestra una eficacia similar al EFV en pacientes sin tratamiento previo y con menor toxicidad sobre el SNC850. Tiene una vida media larga y se puede dar una vez al día.
El EVG es un nuevo IInt que se administra a dosis de 125mg/día potenciado con 100mg de RTV851. Tiene el inconveniente de presentar resistencia cruzada con el RAL. En un estudio de búsqueda de dosis, parcialmente ciego y con resultados a 48 semanas, se está evaluando que el EVG no presente inferioridad frente a un IP/r en pacientes con infección por el VIH con experiencia previa a otros FAR852. A las 24 semanas, el descenso de la CVP fue de −1,4, −1,7 y −1,2log10copias/ml en las ramas de EVG 50mg, EVG 125mg e IP/rC, respectivamente (p=0,02 a dosis de 125mg frente al IP/rC). el EVG potenciado con RTV fue bien tolerado y no se identificaron toxicidades relacionadas con la dosis del fármaco.
El S/GSK 1349572 es un IInt de nueva generación con un perfil de resistencias diferente a RAL y que presenta actividad in vitro frente a cepas de VIH resistentes a RAL. En la actualidad su desarrollo clínico está iniciándose853.
El VCV es nuevo antagonista de los correceptores CCR5 que se administra una vez al día potenciado con RTV y cuya eficacia y tolerancia se están estudiando en pacientes que reciben el primer tratamiento y en pretratados854–856. Un ensayo clínico en pacientes sin tratamiento previo en el que se comparaba el VCV con el EFV se suspendió por menor eficacia virológica del VCV855. En pretratados, VICTOR E-1856 es un ensayo clínico doble ciego que compara el VCV a dosis de 30 y de 20mg en QD frente a placebo, ambos combinados con un nuevo IP/r además del tratamiento optimizado, en pacientes con tropismo R5, con experiencia a 3 o más clases de FAR y con CVP de 1.000copias/ml o más a pesar de recibir TARV durante 6 semanas o más. El objetivo primario fue el cambio en la CVP a las 48 semanas y fueron objetivos secundarios conocer la proporción de pacientes con CVP inferior a 400 y a 50copias/ml. Se incluyó a 116 pacientes, de los que 33 (85%) lo completaron, 35 (88%) y 18 (49%) pacientes en cada grupo (VCV 30mg, VCV 20mg y placebo). A las 48 semanas, el descenso medio de la CVP fue de −1,77, −1,75 y −0,79log10, respectivamente; el incremento medio de linfocitos CD4 fue de 102, 136 y 63células/μl, y la proporción de pacientes que alcanzaron una CVP inferior a 50copias/ml fue del 56, el 52 y el 14% respectivamente. La dosis de VCV de 30mg mostró una mayor eficacia virológica en los pacientes con CVP basal superior a 100.000copias/ml. El porcentaje de efectos adversos grado 3–4 fue similar en los 3 grupos y no se relacionaron con la dosis de VCV.
También están en fase relativamente avanzada de investigación los inhibidores de la maduración857, y hay potenciales avances dentro de las familias existentes como inhibidores de la transcriptasa inversa con un nuevo mecanismo de acción o inhibidores de la fusión de vida media prolongada. Aunque la descripción de estos fármacos escapa a los objetivos de estas guías, vale la pena comentar que es probable que en pocos años aumente de forma considerable el arsenal terapéutico frente a la infección por el VIH.
Coste comparativo de las diferentes combinaciones de fármacos antirretroviralesEn los últimos años, gracias al TARV, se ha reducido la mortalidad relacionada con el sida y ha mejorado la calidad de vida de los pacientes. Sin embargo, el TARV tiene un elevado coste y, en un entorno donde los recursos son limitados, es necesario gestionar correctamente el gasto. Por esto, se considera conveniente introducir en estas guías unas tablas comparativas de los costes de las diferentes combinaciones de TARV utilizadas como tratamiento de inicio (fig. 2), ya que existen diferencias sustanciales entre ellas: el gasto mensual con pautas de eficacia similar puede diferir en cantidades superiores a los 600 euros.
Coste mensual de los tratamientos preferentes (según tabla 4).
En la tabla 20 se indica el precio de venta laboratorio con IVA (4%) de los antirretrovirales disponibles en España en el año 2010.
Coste mensual de los antirretrovirales de uso más frecuente¿
| Nombre genérico | Nombre comercial | Presentación | Coste (PVL+4% IVA) | Coste/unidad | Unidades/mes | Coste/mes | Coste/mes RTV | Coste total mensual de la pauta | Pauta |
| Análogos de nucleósido y nucleótido | |||||||||
| Abacavir | Ziagen | 300mg 60 comp. | 234,72 | 3,91 | 60 | 234,72 | 234,72 | ABC 300mg/12h | |
| Didanosina | Videx | 40mg 30 cáps. | 160,56 | 5,35 | 30 | 160,56 | 160,56 | ddI 400mg/24h | |
| Didanosina | Videx | 250mg 30 cáps. | 100,34 | 3,34 | 30 | 100,34 | 100,34 | ddI 250mg/24h | |
| Emtricitabina | Emtriva | 200mg 30 cáps. | 153,24 | 5,11 | 30 | 153,24 | 153,24 | FTC 200mg/24h | |
| Estavudina | Zerit | 40mg 448 cáps. | 1.213,84 | 2,71 | 60 | 162,57 | 162,57 | d4T 40mg/12h | |
| Estavudina | Zerit | 30mg 448 cáps. | 1.174,65 | 2,62 | 60 | 157,32 | 157,32 | d4T 30mg/12h | |
| Lamivudina | Epivir | 300mg 30 comp. | 153,24 | 5,11 | 30 | 153,24 | 153,24 | 3TC 300mg/24h | |
| Tenofovir | Viread | 245mg 30 comp. | 300,25 | 10,00 | 30 | 300,25 | 300,25 | TDF 300mg/24h | |
| Zidovudina | Retrovir | 300mg 60 comp. | 171,12 | 2,85 | 60 | 171,12 | 171,12 | ZDV 300mg/12h | |
| Zidovudina | Zidovudina combinopharm | 300mg 300 cáps. | 615,18 | 2,05 | 60 | 123,04 | 123,04 | ZDV 300mg/12h | |
| Análogos de nucleósido y nucleótido en combinación | |||||||||
| Abacavir+lamivudina | Kivexa | 600/300mg 30 comp. | 369,76 | 12,33 | 30 | 369,77 | 369,76 | Kivexa 1c/24h | |
| Emtricitabina+tenofovir | Truvada | 200/245mg 30 comp. | 450,04 | 15,00 | 30 | 450,04 | 450,04 | Truvada 1c/24h | |
| Zidovudina+LAMIVUDINA | Combivir | 150/300mg 60 comp. | 302,03 | 5,03 | 60 | 302,03 | 302,03 | Combivir 1c/12h | |
| Zidovudina+lamivudina+abacavir | Trizivir | 300/150/300mg 60 comp. | 509,93 | 8,50 | 60 | 509,93 | 509,93 | TZV 1c/12h | |
| Inhibidores de la transcriptasa inversa no nucleósidos | |||||||||
| Efavirenz | Sustiva | 600mg 30 comp. | 275,63 | 9,19 | 30 | 275,63 | 275,63 | EFV 600mg/24h | |
| Nevirapina | Viramune | 200mg 60 comp. | 207,68 | 3,46 | 60 | 207,68 | 207,68 | NVP 200mg/12h | |
| Etravirina | Intelence | 100mg 120 comp. | 468,00 | 3,9 | 120 | 468,00 | 468,00 | ETR 200 MG/12 H | |
| Inhibidores de la transcriptasa inversa no nucleósidos en combinación con análogos de nucleósidos y nucleótidos | |||||||||
| Efavirenz +emtricitabina+ tenofovir | Atripla | 600mg | 729,12 | 24,30 | 30 | 729,12 | 729,12 | Atripla 1c/24h | |
| 200mg | |||||||||
| 245mg | |||||||||
| Comp. | |||||||||
| Inhibidores de la protease | |||||||||
| Atazanavir | Reyataz | 200mg 60 cáps. | 454,05 | 7,57 | 60 | 454,05 | 454,05 | ATV 400mg/24h | |
| Atazanavir | Reyataz | 150mg 60 cáps. | 454,05 | 7,57 | 60 | 454,05 | 23,36 | 477,42 | ATV/r 300/100mg/24h |
| Atazanavir | Reyataz | 300mg 30 cáps. | 454,05 | 7,57 | 60 | 454,05 | 23,36 | 477,42 | ATV/r 300/100mg/24h |
| Darunavir | Prezista | 300mg 120 comp. | 666,40 | 5,55 | 120 | 666,40 | 46,72 | 713,17 | DRV/r 600/100mg/12h |
| Darunavir | Prezista | 600mg 60 comp. | 666,40 | 11,11 | 60 | 666,40 | 46,72 | 713,17 | DRV/r 600/100mg/12h |
| Darunavir | Prezista | 400mg 60 comp. | 444,30 | 7,40 | 60 | 444,30 | 46,72 | 467,66 | DRV/r 800/100mg/24h |
| Fosamprenavir | Telzir | 700mg 60 comp. | 329,57 | 5,49 | 60 | 329,57 | 46,72 | 376,29 | FPV/r 700/100mg/12h |
| Indinavir | Crixivan | 400mg 180 cáps. | 272,22 | 1,51 | 120 | 181,48 | 46,72 | 228,20 | IDV/r 800/100mg/12vh |
| Lopinavir+ritonavir comp | Kaletra | 120 comp. | 416,02 | 3,47 | 120 | 416,02 | 416,02 | LPV/r 2 comp/12h | |
| Nelfinavir | Viracept | 250mg 270 comp. | 306,91 | 1,14 | 300 | 341,02 | 341,02 | NFV 1250mg/12h | |
| Saquinavir | Invirase | 500mg 120 comp. | 316,11 | 2,63 | 120 | 316,12 | 46,72 | 362,84 | SQV/r 1000/100mg/12h |
| Ritonavir | Norvir | 100mg 336 cáps. | 261,65 | 0,78 | 60 | 46,72 | 46,72 | 46,72 | RTV 100mg/12h |
| Tipranavir | Aptivus | 250mg 120 cáps. | 733,20 | 6,11 | 120 | 733,20 | 93,44 | 826,64 | TPV/r 500/200mg/12h |
| Inhibidores de la fusion | |||||||||
| Enfuvirtida | Fuzeon | 90mg/ml 60 viales | 1.586,38 | 26,44 | 60 | 1.586,37 | 1586,37 | T20 90mg/12h | |
| Inhibidores de la union | |||||||||
| Maraviroc | Celsentri | 150 y 300mg comp. | 816, 00 | 13,6 | 60 | 816 | 816 | MVC 300 (o 150)mg/12h | |
| Inhibidores de la integrasa | |||||||||
| Raltegravir | Isentress | 400mg 60 comp. | 842,40 | 14,04 | 60 | 842,40 | 842,40 | RAL 400mg/12h | |
/r: potenciado con ritonavir; ATV: atazanavir; DRV: darunavir; FPV: fosamprenavir; IDV: indinavir; LPV: lopinavir; MVC: maraviroc; NFV: nelfinavir; PVL: precio de venta laboratorio; RAL: raltegravir; RTV: ritonavir; SQV: saquinavir.
A la hora de utilizar la información del coste, hay que tener en cuenta que además de los costes directos, cada alternativa posible presenta aspectos específicos como diferente perfil de reacciones adversas y otros aspectos relacionados con el seguimiento clínico que podrían requerir distinto consumo de recursos. Por esto, y a pesar de sus limitaciones, es deseable que se incorpore la evaluación farmacoeconómica con objeto de determinar la eficiencia de las nuevas estrategias o de los nuevos medicamentos. Este aspecto es especialmente relevante en el momento actual, ya que disponemos de múltiples alternativas de elevada eficacia para el control crónico de la infección por el VIH. Aunque las decisiones en el caso del tratamiento de rescate están muy condicionadas por factores tales como resistencias, adherencia o toxicidad, es probable que, en el caso del paciente sin fracaso previo o en situación de primer fracaso, pudiera incluirse el concepto de eficiencia (relación entre coste y resultados) en la toma de decisiones para seleccionar la alternativa. Algunos autores han aplicado esta idea en análisis farmacoeconómicos aplicados al TARV.
José López Aldeguer (Hospital Universitari La Fe, Valencia), Pere Domingo Pedrol (Hospital de la Santa Creu i Sant Pau. Barcelona), M. José Galindo (Hospital Clínico Universitario, Valencia), José Antonio Iribarren (Hospital Donostia, San Sebastián), Hernando Knobel (Hospital del Mar, Barcelona), Fernando Lozano (Hospital Universitario de Valme, Sevilla), Daniel Podzamczer (Hospital Univ. de Belvitge, L′Hospitalet. Barcelona), Joaquín Portilla (Hospital General, Alicante), Esteban Ribera (Hospital Universitari Vall d’Hebrón, Barcelona), Melcior Riera (Hospital de Son Dureta, Palma de Mallorca), Antonio Rivero (Hospital Reina Sofía, Córdoba), Jesús Santos (Hospital Universitario Virgen de la Victoria. Málaga), Jesús Sanz (Hospital de la Princesa, Madrid), Montserrat Tuset (Hospital Clínic, Barcelona), Antonio Antela (Complejo Universitario Hospitalario, Santiago), Jose R. Arribas (Hospital La Paz, Madrid), Julio Arrizabalaga (Hospital Donostia, San Sebastián), Juan Berenguer (Hospital Gregorio Marañón, Madrid), Bonaventura Clotet (Hospital Germans Trias i Pujol, Badalona), José M. Gatell (Hospital Clínic, Barcelona), Juan González García (Hospital La Paz, Madrid), José María Kindelán (Hospital Reina Sofía, Córdoba), Pablo Labarga (Hospital Carlos III, Madrid), Jaime Locutura (Hospital General Yagüe, Burgos), Juan Carlos López Bernaldo (Hospital Gregorio Marañón, Madrid), Josep Mallolas (Hospital Clínic, Barcelona), Esteban Martínez (Hospital Clínic, Barcelona), Celia Miralles, (Hospital Xeral, Vigo), José M. Miró (Hospital Clínic, Barcelona), Santiago Moreno (Hospital Ramón y Cajal, Madrid), Rosario Palacios (Hospital Universit. Virgen de la Victoria. Málaga), Francisco Pasquau (Hospital Marina Baixa, La Vila Joiosa, Alicante), Maria Jesús Pérez Elías (Hospital Ramón y Cajal, Madrid), Juan A. Pineda (Hospital de Valme, Sevilla), Rosa Polo (Plan Nacional sobre el Sida, MSPS), Federico Pulido (Hospital Doce de Octubre, Madrid), Rafael Rubio (Hospital Doce de Octubre, Madrid), Juan Miguel Santamaría (Hospital de Basurto, Bilbao), Ferran Segura (Consorci Hospitalari Parc Taulí, Sabadell), Vicente Soriano (Hospital Carlos III, Madrid), Pompeyo Viciana (Hospital Virgen del Rocío, Sevilla), Miguel A. Von Wichmann (Hospital Donostia, San Sebastián).
El listado de integrantes del Panel de expertos del Grupo de Estudio de Sida y el Plan Nacional sobre el Sida se muestra en el anexo 1
http://www.retic-ris.net/default_principal.asp?idx=&cidioma=2
http://indra.mullins.microbiol.washington.edu/webpssm/.
http://resdb.lanl.gov/Resist_DB/default.htm
http://hivdb6.stanford.edu/asi/deployed/hiv_central.pl?program=hivdb∾tion=showMutationForm