La primoinfección por citomegalovirus (CMV) durante el embarazo ocurre entre el 1 y el 4% de las gestantes seronegativas. En este caso, el 40% de los fetos se infecta, y un 10% presenta síntomas al nacimiento. La mitad de estos niños y el 13% de los que nacen asintomáticos tienen secuelas permanentes, especialmente hipoacusia neurosensorial. En España no se recomienda la realización de cribado serológico sistemático frente a CMV durante el embarazo debido a la ausencia de una vacuna eficaz, la imposibilidad de medidas preventivas y terapéuticas en la embarazada, la dificultad para diagnosticar una reactivación vírica y la posibilidad de infecciones congénitas sintomáticas en hijos de mujeres inmunes. En los últimos años se han producido interesantes novedades diagnósticas y terapéuticas que han abierto el debate sobre la necesidad de una serología sistemática en la gestante. Sin embargo, las nuevas técnicas son todavía difícilmente accesibles e insuficientemente probadas. Además, se desconoce por completo la prevalencia de CMV en embarazadas y en recién nacidos, y el porcentaje de niños con secuelas atribuibles a la infección. Por tanto, no parece recomendable por el momento incluir al CMV en el cribado serológico sistemático del embarazo. Sin embargo, se debe mejorar la información para la embarazada, contribuir al desarrollo del diagnóstico fetal y al conocimiento del grado de afectación fetal en caso de alteraciones ecográficas indicativas y asegurar el tratamiento antivírico de los recién nacidos con infección sintomática para prevenir el desarrollo de sordera.
Primary cytomegalovirus (CMV) infection occurs during pregnancy in 1% to 4% of seronegative women and may be transmitted to the fetus in up to 40% of cases. Up to 10% of intrauterine CMV infections result in symptomatic congenital disease at birth. Half of these children and 13% of those born with asymptomatic infection will develop significant clinical sequelae in infancy, especially sensorineural hearing loss. Routine CMV screening during pregnancy is not recommended in Spain owing to the absence of an effective CMV vaccine, the lack of preventive measures or therapy during pregnancy, the difficulty in diagnosing a reactivated infection, and the possibility of symptomatic congenital infections in children of immune women. However, sensitive and specific methods to diagnose primary maternal and fetal infection now exist, and new preventive and therapeutic measures have been developed. Currently, these procedures are not universally available and need to be tested in larger trials. Furthermore, the prevalence of seropositive status in pregnant women, the frequency of congenital infection, and the percentage of infants born with hearing impairment and mental retardation in our country are not known. Therefore, it would not be appropriate to introduce routine screening for CMV in pregnancy at the present time. However, increased efforts should be made to inform women about congenital CMV disease, to develop the diagnosis of fetal infection and methods to determine the extent of involvement in the case of suggestive ultrasound findings, and to treat symptomatic infected newborns with antivirals to reduce hearing impairment.
La infección por citomegalovirus (CMV) es la infección congénita más frecuente en los países desarrollados, y aparece entre un 0,3 y un 2,4% de los recién nacidos1. Las tasas son más elevadas en Estados Unidos y menores en Europa, donde se sitúan entre el 0,3 y el 0,6%1–4. En España no hay datos globales sobre su prevalencia. En un estudio en el que se utilizó cribado sistemático de orina en lactantes prematuros, se observó una tasa de infección congénita del 1%5. Otro estudio en recién nacidos hijos de madre infectada por el virus de la inmunodeficiencia humana (VIH) demostró una frecuencia de infección congénita por CMV del 4,6%, similar a la encontrada en otros trabajos europeos en este grupo poblacional6. Sin embargo, a pesar de estos porcentajes, la infección congénita por CMV sigue siendo una de las enfermedades «olvidadas» en España. Las principales sociedades científicas involucradas en el control serológico del embarazo, la Sociedad Española de Ginecología y Obstetricia, la Sección Española de Medicina Perinatal y la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica no recomiendan la realización de serología sistemática para CMV durante el embarazo7–10. El cribado serológico no se considera coste-efectivo por las siguientes razones: a) no hay una vacuna eficaz para prevenir la transmisión a mujeres seronegativas; b) se trata de una enfermedad con una elevada prevalencia en la población general y con diferentes mecanismos de transmisión, lo que imposibilita la definición de medidas preventivas higienicosanitarias en la embarazada; c) no está aprobado el tratamiento antivírico durante el embarazo; d) es difícil demostrar con seguridad una infección primaria en la madre; e) la serología no permite distinguir las infecciones maternas producidas por reinfección o reactivación vírica, que pueden dar lugar a infección sintomática en el recién nacido, y f) no es posible identificar con seguridad los fetos con riesgo de presentar complicaciones graves.
En los últimos años se han producido interesantes novedades diagnósticas y terapéuticas que han abierto el debate sobre la necesidad de un cribado serológico sistemático frente a CMV durante el embarazo11–15. La gran mayoría de los países europeos no lo realizan16 y el Colegio Americano de Obstetras y Ginecólogos lo recomienda a petición de los padres, si la embarazada presenta un síndrome mononucleótico o ante la presencia de alteraciones ecográficas fetales17,18. Sin embargo, se ha constatado un aumento del número de serologías solicitadas por ginecólogos en países de Europa, a pesar de las recomendaciones oficiales19. En el presente trabajo se realiza una revisión de los métodos preventivos, diagnósticos y terapéuticos de la infección por CMV en la embarazada y el feto y se discuten los pros y los contras del cribado serológico durante el embarazo.
EpidemiologíaEl CMV es un herpesvirus que, tras la infección, permanece en estado latente en el individuo, teniendo reactivaciones periódicas y excretándose de forma intermitente por orina, saliva, semen, secreción vaginal y leche materna20. La infección se adquiere por contacto directo con secreciones contaminadas. En España, el contagio se produce principalmente en la edad preescolar y a los 5 años el 45% de los niños son inmunes21. Después se produce una meseta hasta la adolescencia, momento en el que aumenta nuevamente con el inicio de las relaciones sexuales. Posteriormente hay un ascenso marcado, especialmente en mujeres con bajo nivel socioeconómico y con hijos en edad preescolar22. La prevalencia de infección en mujeres en edad fértil oscila entre el 60% entre los 15 y 24 años y el 95% en las mayores de 36 años22.
La gran mayoría de las infecciones congénitas por CMV se producen tras una primoinfección materna durante el embarazo, lo que ocurre entre el 1 y el 4% de las gestantes seronegativas23. En este caso, el 40% de los fetos se infecta y un 10% presenta síntomas al nacimiento24.
La infección congénita también puede ocurrir en mujeres previamente inmunes por reactivación o reinfección vírica. En esta situación, tan sólo del 1 al 2% de los fetos se infecta y la gran mayoría de los infectados (>90%) son asintomáticos al nacimiento25. Por último, hay riesgo de infección en mujeres con infección muy reciente antes del embarazo. En un estudio de 12 mujeres infectadas entre 2 y 18 semanas antes de la gestación se constató infección asintomática en un recién nacido26.
El CMV congénito presenta una elevada morbimortalidad. Un 4% de los neonatos sintomáticos fallece y se desarrollan secuelas permanentes entre un 40 y un 58%1, especialmente sordera neurosensorial y retraso psicomotor. Las secuelas también aparecen en un 13% de los niños asintomáticos al nacimiento1. En España, con más de 490.000 nacimientos anuales27, y si se supone una prevalencia de infección del 0,5%, el CMV afectaría a 2.450 recién nacidos cada año, de los que 245 presentarían síntomas al nacimiento, 10 fallecerían y 410 presentarían secuelas a largo plazo.
Diagnóstico de la infección en la embarazadaLa primoinfección en la embarazada suele ser asintomática, aunque en un 30% de los casos aparece fiebre prolongada, un cuadro seudogripal o un síndrome mononucleótico con alteración de las pruebas de función hepática, linfocitosis y trombocitopenia28. La infección puede ocurrir durante todo el embarazo, si bien la gravedad es mayor en el primer y en el segundo trimestre y la posibilidad de transmisión es mayor en el tercero24,29–31.
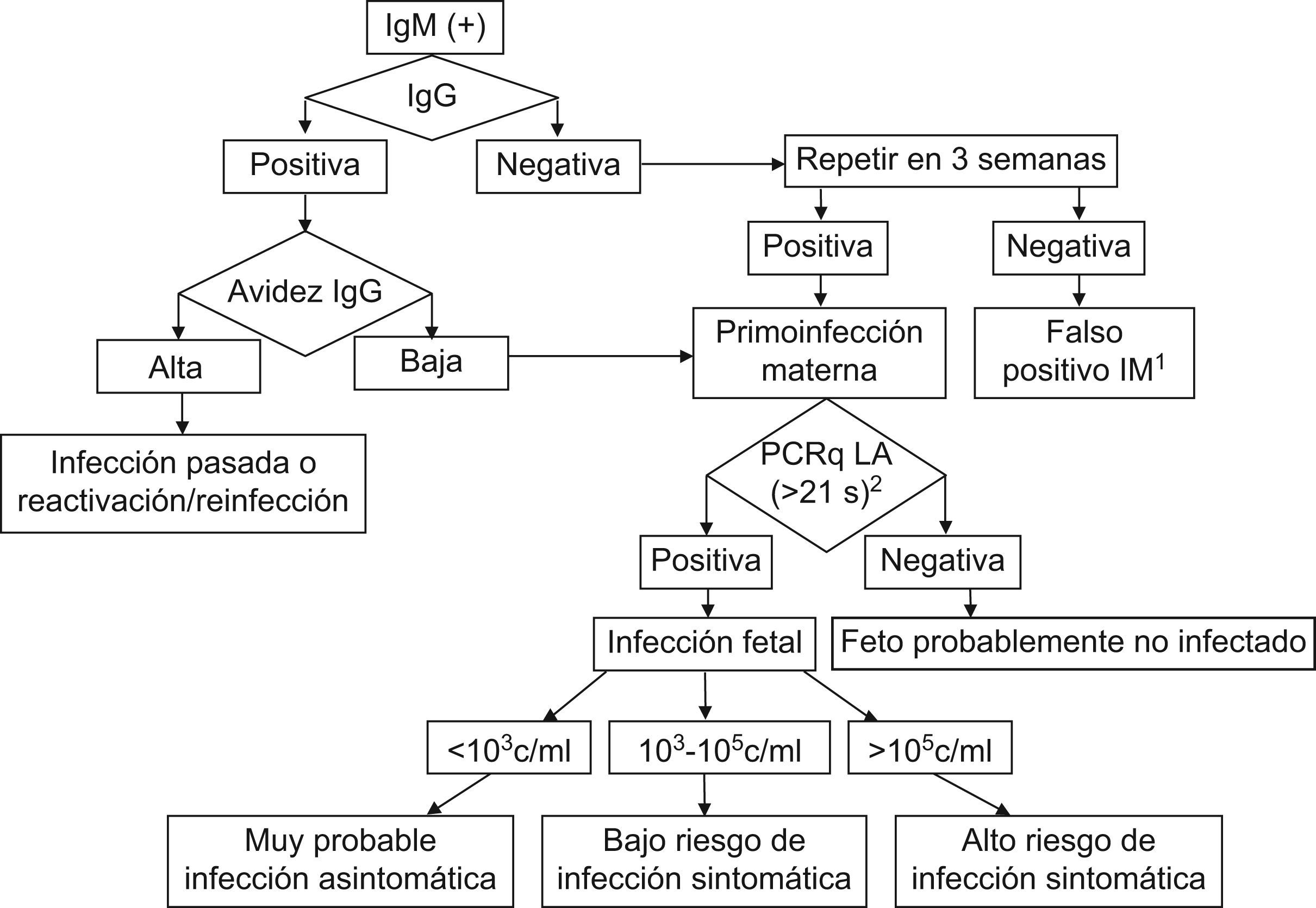
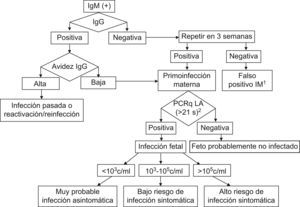
La serología es la prueba diagnóstica de referencia32. La demostración de seroconversión es el método más fiable para el diagnóstico de infección primaria. Sin embargo, la falta de controles pregestacionales hace que en muchas ocasiones sólo se disponga de un control aislado durante el embarazo realizado tras la aparición de alteraciones clínicas o ecográficas sugestivas. En este caso, se debe recurrir a la determinación de inmunoglobulina (Ig) M frente a CMV mediante enzimoinmunoanálisis de captura o inmunoblot para evitar falsos positivos32,33 (fig. 1). Ante una IgM positiva en ausencia de anticuerpos IgG, éstos se repetirán en las 2 a 3 semanas posteriores para demostrar seroconversión. Si la IgG sigue siendo negativa, se considerará un falso positivo de la IgM, que puede presentarse por reactividad heteróloga con otros herpesvirus, especialmente con el virus de Epstein-Barr.
Actitud ante una inmunoglobulina M positiva para citomegalovirus en el primer trimestre de gestación.
1. Descartar infección por otros herpesvirus, especialmente por virus de Epstein-Barr. 2. Reacción en cadena de la polimerasa cuantitativa para citomegalovirus en líquido amniótico desde la semana 21 de gestación.
Si la gestante presenta IgM e IgG positivas en la primera determinación, no se puede asegurar que la infección sea muy reciente, ya que, aunque los anticuerpos IgM suelen negativizarse entre los 3 a 4 meses, pueden persistir hasta 9 meses después de la primoinfección24. Además, la IgM puede positivizarse en gestantes previamente inmunes por reactivación o reinfección vírica32. Por tanto, es indispensable la realización de un estudio de avidez de los anticuerpos IgG33,34. La presencia de anticuerpos IgM y anticuerpos IgG de alta avidez en el primer trimestre puede deberse a una infección pregestacional o, con menos frecuencia, a reactivación o reinfección vírica. Una baja avidez dentro de los 3 meses previos a la determinación indica una primoinfección reciente33,34.
Diagnóstico de la infección fetalEl aislamiento del virus en orina, saliva o secreción cervical o la detección de viremia o antigenemia en la embarazada tienen baja sensibilidad y especificidad para detectar la transmisión vertical33. Por tanto, en las gestantes con seroconversión demostrada o anticuerpos IgM positivos y anticuerpos IgG de baja avidez debe tenerse en cuenta la posibilidad de una amniocentesis para diagnosticar si hay infección fetal. Debe realizarse a partir de la semana 21 de gestación ya que antes de esta semana el feto no excreta orina al líquido amniótico34. Además, es recomendable que transcurran al menos 7 semanas tras la fecha teórica de infección materna35. El cultivo vírico del líquido amniótico es 100% específico, pero tiene muchos falsos negativos34,36. El mejor método diagnóstico es la PCR (polymerase chain reaction 'reacción en cadena de la polimerasa'), que presenta una excelente sensibilidad (del 90 al 98%) y especificidad (del 92 al 98%), por lo que un resultado positivo prácticamente confirma la infección fetal, mientras que uno negativo la hace muy improbable33,34.
Diagnóstico del grado de afectación fetalTras el diagnóstico de una infección fetal, el verdadero reto es conocer si en el feto se va a desarrollar una infección sintomática al nacimiento, con mayor riesgo de presentar complicaciones graves. Esto es sencillo si aparecen alteraciones ecográficas indicativas, muchas veces asociadas a signos de engrosamiento placentario36,37. Entre estos hallazgos, los más importantes son la presencia de oligohidramnios o polihidramnios, hidropesía fetal, derrame pleural o pericárdico, retraso del crecimiento intrauterino, hepatoesplenomegalia, calcificaciones intrahepáticas, aumento de la ecogenicidad intestinal, microcefalia, dilatación ventricular, atrofia cortical y calcificaciones intracraneales36–41. Sin embargo, sólo una tercera parte de los niños con infección sintomática presenta hallazgos ecográficos cerebrales o digestivos durante el embarazo37. Además, muchas alteraciones aparecen tardíamente, por lo que no ayudan a establecer un pronóstico antes de la semana 22, límite para la interrupción voluntaria del embarazo en caso de malformación fetal11. Una alternativa es la obtención de sangre fetal mediante cordocentesis. La presencia de anemia, trombocitopenia o elevación de enzimas hepáticas indica una alta probabilidad de infección sintomática42. Sin embargo, esta técnica es complicada y con riesgo elevado de aborto espontáneo. Mucho más prometedora y menos invasiva es la determinación de la carga vírica en líquido amniótico mediante PCR cuantitativa. Los niños asintomáticos presentan habitualmente cargas víricas por debajo de 103copias/ml34,43. Por el contrario, la presencia de más de 105copias/ml tiene una alta especificidad en el diagnóstico de la infección congénita sintomática34,43. Las cargas víricas intermedias (de 103 a 105copias/ml) indican una probabilidad del 92% de ausencia de sintomatología al nacimiento43. Por tanto, la realización de una PCR cuantitativa en líquido amniótico a partir de la semana 21 de gestación permite el diagnóstico de infección fetal y determina con fiabilidad el grado de afectación fetal en mujeres con primoinfección durante el embarazo.
Prevención de la infección en la embarazada y en el fetoMuchos expertos opinan que el cribado serológico sistemático puede causar una gran ansiedad a las gestantes seronegativas al no poder establecer medidas efectivas de profilaxis. El CMV requiere para su transmisión un contacto directo con secreciones corporales y se destruye fácilmente mediante el calor, el jabón, los detergentes y los desinfectantes20.
El principal factor de riesgo para la embarazada es el contacto estrecho con niños en edad preescolar44. Se ha demostrado que el 40% de los niños en guardería excreta CMV por saliva u orina durante una media de 24 meses45. Por tanto, la probabilidad de seroconversión durante el embarazo es más alta en mujeres que trabajan asiduamente con estos niños (empleadas de hogar, de guardería o de hospitales) o tienen hijos en guardería.
Las vacunas se encuentran todavía en fase de experimentación, aunque hay estudios prometedores con la vacuna Towne de virus vivos atenuados o la vacuna recombinante de glucoproteína B y el adyuvante MF/5946–50. Ambas son seguras y producen anticuerpos neutralizantes en voluntarios sanos48,49. Sin embargo, la vacuna Towne no consiguió prevenir la infección de mujeres seronegativas con hijos en guardería que excretan CMV50. Hasta el completo desarrollo de las vacunas, las únicas medidas de prevención primaria son las higienicosanitarias (tabla 1). En un estudio, 166 mujeres seronegativas, embarazadas o que intentaban quedarse embarazadas y con hijos en edad preescolar se distribuyeron aleatoriamente en 2 grupos, uno que utilizaba estas medidas y otro que no las utilizaba51. Un 7,8% de las mujeres de cada grupo se infectó por CMV. El análisis logístico reveló 2 factores independientes predictores de infección materna: el tener un hijo que excretaba CMV y el estar intentando quedarse embarazada. De las 41 mujeres que tenían hijos en edad preescolar que excretaban CMV en orina, sólo una de las 17 que estaban embarazadas al principio del ensayo se infectó, frente a 10 de las 24 que estaban intentando quedarse embarazadas (p=0,008). En distintos estudios que han evaluado el valor de las medidas profilácticas, sólo una de 31 mujeres embarazadas adquirió la infección, frente a 60 de 147 mujeres no embarazadas (p<0,0001)51–53. Esto indica que las medidas higienicosanitarias preventivas son válidas, pero exclusivamente durante el embarazo, seguramente porque la gestante sigue las normas más estrictamente que la mujer no embarazada.
Medidas higienicosanitarias para prevenir la infección por citomegalovirus en la embarazada seronegativa en contacto con niños en edad preescolar
|
Recientemente se ha evaluado la prevención de la infección fetal en mujeres con primoinfección durante el embarazo mediante el uso de gammaglobulina (GG) humana contra CMV54. Se documentó infección congénita en el 16% de las mujeres que recibieron gammaglobulina mensual (100U/kg) hasta el momento del parto frente a un 56% de las que no la recibieron (p<0,001).
Tratamiento antivírico durante el embarazoLos antivíricos con mayor actividad frente a CMV (ganciclovir, cidofovir y foscarnet), tienen efectos teratógenos en animales y no se recomiendan durante el embarazo55,56. Sin embargo, en los casos en los que se ha administrado ganciclovir a mujeres gestantes, se ha alcanzado concentraciones adecuadas en líquido amniótico y en sangre fetal57,58 y no se ha observado efectos teratógenos en el feto59,60. Un estudio reciente ha evaluado el tratamiento con valaciclovir en 20 gestantes con infección fetal demostrada mediante PCR en líquido amniótico61. La dosis administrada fue de 8g/día desde la semana 28 hasta la finalización o interrupción del embarazo (media de 7 semanas). Valaciclovir consiguió disminuir la carga vírica fetal y 10 de los 13 recién nacidos no presentaron secuelas de la infección tras uno a 5 años de seguimiento. Sin embargo, los resultados son poco significativos debido a que 7 gestantes optaron finalmente por interrumpir su embarazo por progresión de las alteraciones ecográficas fetales. Más prometedor es el uso de gammaglobulina específica frente a CMV (GG-CMV) en embarazadas con infección fetal demostrada. En un estudio prospectivo multicéntrico, 31 gestantes con PCR positiva en líquido amniótico aceptaron ser tratadas con una dosis de GG-CMV (200U/kg) y 14 rechazaron el tratamiento54. Se evidenció infección fetal sintomática en una de las 31 mujeres tratadas frente a 7 de las 14 en el grupo control (p<0,001). El tratamiento con GG-CMV consiguió revertir alteraciones ecográficas fetales demostradas durante el embarazo y no causó efectos adversos significativos. La GG-CMV tiene efectos inmunomoduladores, reduce la carga vírica materna y disminuye la inflamación placentaria, consiguiendo un incremento del flujo sanguíneo que mejora la nutrición y la oxigenación fetal36.
Argumentos a favor del cribado serológico sistemático en el embarazo- 1)
Importante impacto de la infección congénita por CMV. Aunque la seroprevalencia de CMV en mujeres embarazadas no se ha estudiado en España, entre el 70 y el 80% de las mujeres de 20 a 40 años son inmunes frente al virus21. Estas tasas son mucho más bajas que las del virus de la rubéola, aunque claramente superiores a las de la sífilis, infección por VIH, virus de la hepatitis B o toxoplasmosis62. Sin embargo, la frecuencia de infección congénita por CMV en países con tasas de seroprevalencia similares a España se encuentra alrededor del 0,5%, siendo mucho más elevada que la del resto de las infecciones para las que se realiza cribado serológico sistemático1–4. La falta de un cribado serológico ha contribuido a que tan sólo el 20% de las gestantes conozca esta infección en los países desarrollados64. Este porcentaje está claramente por debajo de otras infecciones congénitas, cuando su morbimortalidad es superior65. De hecho, algunos autores aconsejan realizar únicamente serología frente a CMV en caso de alteraciones ecográficas fetales durante el embarazo63. Además, la seroprevalencia en mujeres en edad fértil ha disminuido en los últimos años21, lo que puede conducir a un aumento del número de infecciones congénitas en el futuro.
- 2)
Posibilidad de adoptar medidas profilácticas y terapéuticas. La serología sistemática identifica a las gestantes seronegativas, lo que puede ayudar a establecer medidas de profilaxis higienicosanitarias51. Además, permite el diagnóstico de la primoinfección materna mediante seroconversión o por la presencia de anticuerpos IgM junto a anticuerpos IgG de baja avidez. En estos casos, la realización de una PCR cuantitativa en líquido amniótico a partir de la semana 21 de gestación permite diagnosticar la infección fetal y determina con fiabilidad su grado de afectación34. Esto posibilitaría en el futuro la inclusión de la mujer en programas de tratamiento antivírico y ayudaría a decidir sobre la posibilidad de interrupción voluntaria del embarazo en casos con afectación ecográfica grave. La serología no diagnostica los casos de reinfección o reactivación vírica en mujeres previamente inmunes, pero en estos casos la probabilidad de infección congénita sintomática es baja.
- 3)
Detección precoz de los niños con infección congénita. Una gran ventaja del cribado serológico sistemático es que permite la detección de la gran mayoría de los niños con infección congénita, incluidos los pacientes asintomáticos. Debido a su alta prevalencia, el CMV es una de las causas más frecuentes de retraso psicomotor y sordera neurosensorial de origen infeccioso20,66. El porcentaje de secuelas al nacimiento es mayor en niños con síntomas que en niños asintomáticos (el 50 frente al 13%)1. Sin embargo, debido a que la infección congénita en el niño es mayoritariamente asintomática, dos terceras partes de las secuelas aparecen en niños sin síntomas al nacimiento1. La detección de estos niños mediante un cribado sistemático de orina al nacimiento no se considera coste-efectiva, por lo que muchas secuelas de la infección por CMV aparecen tardíamente y son difícilmente tratables. Una alternativa es la realización de una PCR sistemática para CMV en muestras de sangre seca de talón obtenidas para el cribado de enfermedades metabólicas en el recién nacido67. Sin embargo, esta técnica pierde sensibilidad en pacientes con cargas víricas bajas (<104copias/ml)68, por lo que no es adecuada en pacientes asintomáticos o poco sintomáticos. La detección sistemática de hipoacusia en el recién nacido tampoco es útil como técnica de cribado, ya que sólo detecta el 50% de las hipoacusias por CMV, que pueden ser fluctuantes y progresivas69–71. Por tanto, la única técnica válida para la detección de los pacientes asintomáticos es el cribado serológico sistemático de la embarazada. El seguimiento de estos niños permitiría el diagnóstico precoz de las secuelas y su inclusión en programas de rehabilitación auditiva, logopedia y estimulación psicomotriz. Además, el cribado serológico contribuiría al diagnóstico de los niños con infección sintomática para el inicio precoz de rehabilitación, fisioterapia y tratamiento antivírico. En un estudio de fase III, de distribución aleatoria se estudió la eficacia del ganciclovir en la prevención de la sordera neurosensorial en niños con infección congénita sintomática con afectación del sistema nervioso central72. Tras la administración de ganciclovir (12mg/kg/día en 2 dosis durante 6 semanas) se observó deterioro auditivo en el 21% de los niños tratados al año de seguimiento, en comparación con el 68% de los controles (p<0,01).
- 1)
Dificultad para realizar profilaxis primaria en la embarazada. A pesar de las interesantes novedades diagnósticas y terapéuticas, la mayoría de los países industrializados no han incluido el CMV en el control serológico sistemático de la embarazada16. Uno de los principales obstáculos es la imposibilidad de realizar una profilaxis primaria mediante vacunación. Las medidas higienicosanitarias en la gestante seronegativa con hijos en edad preescolar son difíciles de llevar a la práctica y la mujer puede infectarse a través de la saliva de otros familiares o mediante otras vías, como la sexual.
- 2)
Posibilidad de infección congénita en mujeres inmunes. En España, un elevado número de mujeres son inmunes al virus21. Esta población no se incluiría en los controles serológicos sucesivos por la dificultad de detectar una reactivación o reinfección vírica. La posibilidad de infección fetal en estos casos es inferior al 2%, pero en países con altas tasas de seroprevalencia este porcentaje representa un importante número de casos de infección congénita. Así, la proporción de infecciones congénitas debidas a reactivación o reinfección en países de Europa se encuentra alrededor del 25%3,24 llegando en algunos estudios al 50%73. Es decir, al menos uno de cada 4 niños con infección congénita nace de una mujer con inmunidad previa. Muchas de estas infecciones son asintomáticas, aunque cada vez se describen más casos de infecciones sintomáticas en hijos de mujeres inmunes71,74, incluso graves75. Estos casos y los que aparecen tras infecciones en el tercer trimestre del embarazo no se detectarían mediante el cribado sistemático, lo que conduciría a una mala percepción de los programas de cribado13,76.
- 3)
Baja accesibilidad de las técnicas diagnósticas. A pesar de la evidente mejoría en el diagnóstico prenatal, muchas de las técnicas (avidez, PCR cuantitativa) sólo se encuentran disponibles en laboratorios especializados, lo que puede dificultar el acceso universal a éstas. Los resultados de la PCR cuantitativa realizada a partir de la semana 21 podrían no estar disponibles antes de la semana 22, límite para la interrupción voluntaria del embarazo por malformación fetal en España. El diagnóstico tardío del grado de afectación fetal podría conducir a un número innecesariamente elevado de abortos.
- 4)
Baja eficacia diagnóstica en la población general de gestantes. La realización del diagnóstico serológico plantea muchos problemas asistenciales si se comparan riesgos y beneficios. La proporción de mujeres con IgM positiva en el primer trimestre en países de Europa oscila entre un 1,3 y un 2,7%3,13. En España, con más de 450.000 embarazos anuales, esto implica que unas 9.000 gestantes requerirían estudio posterior mediante estudio de avidez de anticuerpos. Esta técnica permitiría excluir a menos del 15% de las mujeres34, por lo que más de 7.500 embarazadas necesitarían confirmar la infección fetal mediante PCR en líquido amniótico con una pérdida fetal en el procedimiento estimada en un 1% (75 niños). Distintos estudios han confirmado que la probabilidad de infección fetal en mujeres con IgM positiva oscila entre un 7 y un 10%3,34, por lo que únicamente unas 750 mujeres con IgM positiva en el primer trimestre transmitirían la infección al feto y alrededor de 75 niños tendrían una infección sintomática. Esto implicaría que el número de niños con infección sintomática diagnosticados mediante cribado de IgM en el primer trimestre sería similar al de las pérdidas fetales provocadas por amniocentesis en la evaluación de estas gestantes. Además, la PCR cuantitativa en líquido amniótico no es 100% específica y existe la posibilidad de infecciones asintomáticas o muy poco sintomáticas en niños con cargas víricas superiores a 103copias/ml en líquido amniótico13. Sin embargo, en ausencia de alteraciones ecográficas, el verdadero grado de afectación fetal no puede conocerse hasta el nacimiento, lo que puede conducir nuevamente a un número innecesario de abortos.
- 5)
Baja eficiencia de la intervención terapéutica preventiva. El tratamiento antivírico durante el embarazo plantea de nuevo problemas de coste y accesibilidad. La GG-CMV sólo está disponible a través de medicamentos extranjeros y el coste de una sola dosis de 200 U/kg está entre 3.000 y 4.000 euros. Además, el único trabajo publicado54 debe ser confirmado en estudios amplios de distribución aleatoria y controlados con placebo77. Por último, aunque el cribado sistemático permitiera la detección de infecciones asintomáticas al nacimiento, estos niños no se beneficiarían de medidas preventivas inmediatas. El tratamiento antivírico en el recién nacido sólo se ha mostrado eficaz en la prevención de la sordera neurosensorial en lactantes sintomáticos y con afectación del sistema nervioso central70, que pueden ser detectados al nacimiento sin necesidad de cribado serológico en la gestante.
Actualmente se dispone de nuevos métodos diagnósticos y terapéuticos en la infección congénita por CMV, aunque son todavía difícilmente accesibles e insuficientemente probados. La evaluación del uso sistemático de estos métodos no es posible sin conocer la prevalencia de la infección por CMV en embarazadas, fetos y recién nacidos. Por el momento, y con los datos que se poseen, no parece recomendable incluir al CMV en el cribado serológico sistemático de la embarazada. Sin embargo, se pueden sugerir 4 tipos de actuaciones para mejorar el conocimiento y el pronóstico de la enfermedad:
- 1)
Las mujeres deben ser informadas de los riesgos de la infección durante el embarazo. La información permitiría a la embarazada decidir si establece medidas de profilaxis higienicosanitarias para disminuir la transmisión del virus. Además, debe tenerse en cuenta la posibilidad de control serológico a las mujeres con alto riesgo de infección, especialmente a las que trabajan habitualmente con niños.
- 2)
Ante la presencia de alteraciones ecográficas indicativas durante el embarazo, debe hacerse todos los esfuerzos necesarios para establecer si ha habido infección materna o infección fetal, y el grado de afectación fetal. Esto permitiría en el futuro la inclusión de la mujer en programas de tratamiento antivírico y ayudaría a decidir sobre la posibilidad de interrupción voluntaria del embarazo en caso de afectación fetal grave.
- 3)
Se debe mejorar el diagnóstico neonatal, apoyar la universalización de los programas de detección de hipoacusia en el recién nacido y realizar detección de CMV en orina a todos los niños prematuros, de bajo peso o con alteraciones clínicas o ecográficas indicativas de infección por CMV.
- 4)
Por último, se debe contribuir a que todos los niños con infección congénita sintomática, especialmente con afectación del sistema nervioso central, reciban tratamiento antivírico para prevenir el desarrollo de hipoacusia neurosensorial y evitar alteraciones en su lenguaje y su capacidad de aprendizaje.