Los Escherichia coli verotoxigénicos (ECVT), especialmente los del serotipo O157:H7, constituyen un importante grupo de patógenos emergentes para los seres humanos capaces de provocar desde una diarrea no sanguinolenta hasta una colitis hemorrágica (CH), con el síndrome urémico hemolítico (SUH) o la púrpura trombocitopénica trombótica como complicaciones más habituales, principalmente en niños, ancianos y pacientes inmunodeficientes. Desde su reconocimiento como patógeno en 1982, E. coli O157:H7 se ha identificado como responsable de innumerables brotes y casos esporádicos de CH y de SUH, ampliamente descritos en países anglosajones y en Japón. En España, las infecciones por ECVT son relativamente frecuentes y se han descrito hasta la fecha un total de 10 brotes. Por todo esto, resulta de especial interés el conocimiento de los aspectos clínicos y patogénicos de las infecciones ocasionadas por este tipo de patógenos.
Verocytotoxigenic Escherichia coli (VTEC), particularly serotype O157:H7, have recently emerged as an important group of food-borne pathogens in humans, causing diseases ranging from mild diarrhea to hemorrhagic colitis (HC), and complications such as hemolytic uremic syndrome (HUS) and thrombotic thrombocytopenic purpura, typically affecting children, the elderly, and immunocompromised patients. Since its identification as a pathogen in 1982, E. coli O157:H7 has been detected in many sporadic cases and outbreaks of HC and HUS, particularly in North America, the United Kingdom, and Japan. In Spain, VTEC is a relatively common cause of sporadic infection, and a total of 10 outbreaks have been reported to date. Thus, knowledge of the clinical and pathogenic aspects of these infections is of particular interest.
Con la denominación Escherichia coli verotoxigénicos (ECVT) se conocen todas aquellas cepas de E. coli capaces de producir alguno de los tipos existentes de una potente citotoxina conocida como verotoxina (VT), dada su capacidad de destruir in vitro las células Vero (línea celular del riñón de mono verde africano)1. Existen 2 tipos principales de VT, denominados VT1 y VT2, atendiendo a diferencias en su secuencia aminoacídica y en su reactividad inmunológica2. Esta clasificación considera además variantes o subtipos dentro de cada tipo, como revela el estudio de los genes que las codifican (genes stx). Si bien el grupo de la VT1 es relativamente homogéneo, el de la VT2 muestra una considerable heterogeneidad, de manera que se han identificado hasta el momento al menos 13 variantes3. No obstante, las variantes de la VT2 más prevalentes son Stx2c, Stx2d y Stx2e4. La variante Stx2c se ha asociado con diarrea y síndrome urémico hemolítico (SUH) en los seres humanos5; la Stx2d se ha asociado principalmente con enfermedad leve en seres humanos y mucho menos frecuentemente con SUH4,5; la Stx2e, la primera variante descrita de la toxina VT2, se ha identificado ocasionalmente en aislados humanos5,6, donde suele asociarse con enfermedad leve o infecciones asintomáticas7. Aunque la VT1 y la VT2 poseen similares mecanismos de acción, su toxicidad varía tanto in vivo como in vitro. En este sentido, se ha establecido que los ECVT que producen sólo VT2 o VT1 y VT2 tienen una mayor probabilidad de causar el SUH que aquellos que sólo producen VT15,8. Las VT también se conocen como toxinas Shiga (Stx1 y Stx2) o toxinas Shiga-like (SLT-I y SLT-II), debido a su probada similitud con la toxina Shiga de Shigella dysenteriae tipo I9, de ahí la denominación paralela de los ECVT como E. coli productores de SLT o, de manera más común, E. coli productores de toxinas Shiga.
Además de producir VT, muchos ECVT son capaces de colonizar la mucosa intestinal mediante el desarrollo de una lesión característica conocida como lesión attaching and effacing o lesión A/E, que consiste en la adherencia íntima de la bacteria a la membrana de la célula epitelial, mediante una adhesina específica denominada intimina, y el posterior borrado o destrucción localizada de las microvellosidades10.
Dentro de los ECVT, algunos serotipos se han vinculado claramente con brotes y casos esporádicos de colitis hemorrágica (CH) y SUH, principalmente en países anglosajones y Japón10,11. La mayoría de estas infecciones se ha atribuido a las cepas de ECVT del serotipo altamente virulento O157:H7, si bien cada vez se registran con mayor frecuencia casos de infección ocasionados por las cepas pertenecientes a serogrupos distintos del O157, como O26, O103, O111 y O145, entre otros, conocidas como ECVT no-O15712,13.
EpidemiologíaDesde su identificación como agente causal de CH y de SUH a principios de la década de 198014, el ECVT O157:H7 y los ECVT en general han visto incrementada su prevalencia hasta situarse actualmente entre los principales agentes infecciosos responsables de gastroenteritis15–18. Sin embargo, al comparar a este grupo de patógenos con otros causantes de toxiinfecciones alimentarias, los ECVT, y en concreto el ECVT O157:H7, permanecen en una significativa minoría, de manera que el interés suscitado por este tipo de infecciones se debe principalmente a la gravedad de las complicaciones que suelen llevar asociadas y a su mayor letalidad.
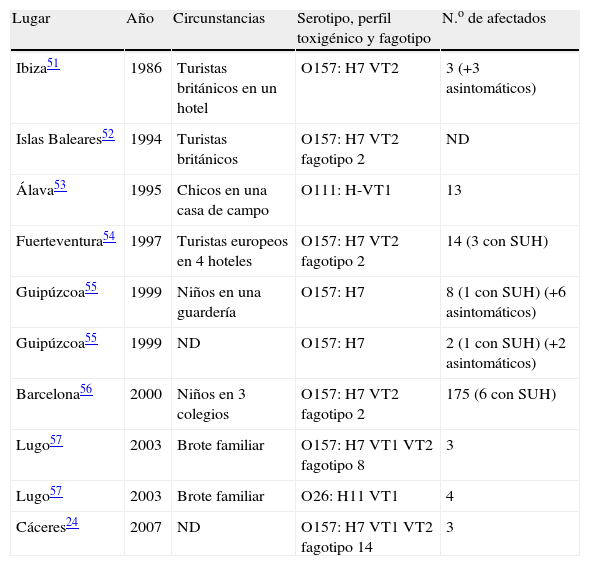
En España, hasta el momento se ha descrito un total de 10 brotes de infección por ECVT, 8 de éstos ocasionados por ECVT del serotipo O157:H7, otro por ECVT del serotipo O26:H11 y otro más por ECVT del serotipo O111:H- (tabla 1). Igualmente, existen algunas referencias a casos esporádicos de CH o SUH ocasionados por el ECVT O157:H7 en nuestro país19,20. En cuanto a la incidencia de este tipo de infecciones, Prats et al20 consideraron la CH por el ECVT O157:H7 poco frecuente en España, basándose en sus estudios y en otros anteriores21,22, que incluían más de 17.500 casos de enteritis. Posteriormente, Gómez et al23 no aislaron el ECVT O157:H7 en un total de 1.800 coprocultivos analizados, lo que indicaba una baja incidencia de este tipo de infecciones, al menos en el área estudiada. No obstante, los estudios llevados a cabo en los últimos años en el laboratorio de referencia de E. coli de la Universidad de Santiago de Compostela en Lugo indican que los ECVT constituyen una causa significativa de infecciones en seres humanos15. Concretamente, estos autores detectaron ECVT en el 2,5% de un total de 5.054 casos investigados (con prevalencias del 0,5% y del 1,7% para ECVT O157:H7 y ECVT no-O157, respectivamente), y registraron un aumento progresivo de la incidencia desde el 0% en 1992 hasta el 4,4% en 1999. Además, en estos estudios Blanco et al15 constataron que los ECVT constituyen el tercer patógeno bacteriano más frecuentemente aislado de coprocultivos de los pacientes con diarrea u otras alteraciones gastrointestinales en España, después de Salmonella spp. y Campylobacter spp. En esta línea, recientemente Martínez et al24 detectaron y aislaron el ECVT O157:H7 en 8 coprocultivos de un total de 1.675 analizados (0,5%), lo que confirma la tendencia apuntada por Blanco et al15. En cualquier caso, la incidencia real de este tipo de infecciones probablemente sea superior a lo que el escaso número de aislamientos parece indicar, si tenemos en cuenta el número de casos que no solicitan atención médica, los que no se diagnostican y los que no se declaran.
Relación de los brotes causados por los Escherichia coli verotoxigénicos en España
| Lugar | Año | Circunstancias | Serotipo, perfil toxigénico y fagotipo | N.o de afectados |
| Ibiza51 | 1986 | Turistas británicos en un hotel | O157: H7 VT2 | 3 (+3 asintomáticos) |
| Islas Baleares52 | 1994 | Turistas británicos | O157: H7 VT2 fagotipo 2 | ND |
| Álava53 | 1995 | Chicos en una casa de campo | O111: H-VT1 | 13 |
| Fuerteventura54 | 1997 | Turistas europeos en 4 hoteles | O157: H7 VT2 fagotipo 2 | 14 (3 con SUH) |
| Guipúzcoa55 | 1999 | Niños en una guardería | O157: H7 | 8 (1 con SUH) (+6 asintomáticos) |
| Guipúzcoa55 | 1999 | ND | O157: H7 | 2 (1 con SUH) (+2 asintomáticos) |
| Barcelona56 | 2000 | Niños en 3 colegios | O157: H7 VT2 fagotipo 2 | 175 (6 con SUH) |
| Lugo57 | 2003 | Brote familiar | O157: H7 VT1 VT2 fagotipo 8 | 3 |
| Lugo57 | 2003 | Brote familiar | O26: H11 VT1 | 4 |
| Cáceres24 | 2007 | ND | O157: H7 VT1 VT2 fagotipo 14 | 3 |
ND: dato no disponible; SUH: síndrome urémico hemolítico.
Está claramente establecido que los rumiantes domésticos constituyen el principal reservorio de ECVT, dado que diversos estudios han puesto de manifiesto que el ganado bovino, ovino y caprino, principalmente, albergan en su microbiota intestinal de forma totalmente asintomática ECVT, muchos de los cuales pertenecen a los mismos serotipos que las cepas causantes de infecciones en los seres humanos, estando presente asimismo el serotipo enterohemorrágico altamente virulento O157:H7 en diversas proporciones25–27.
El contagio humano de las infecciones por ECVT se produce principalmente tras el consumo de alimentos contaminados a partir de heces de animales portadores, como carne y productos cárnicos inadecuadamente cocinados, leche y productos lácteos sin pasteurizar, vegetales o agua de bebida, además de la utilización de aguas de baño contaminadas, la transmisión de persona a persona y el contacto directo con animales portadores o sus heces10. También se han descrito otras vías de contagio menos frecuentes, como la transmisión por vía aerógena28, y se han documentado asimismo infecciones nosocomiales e infecciones adquiridas en el laboratorio29.
Presentaciones clínicasEl ECVT O157:H7 puede provocar en seres humanos desde una diarrea no sanguinolenta hasta una CH, con el SUH o la púrpura trombocitopénica trombótica (PTT) como complicaciones más habituales. La presentación clínica más común es la CH, caracterizada por un cuadro grave de dolor abdominal y diarrea sanguinolenta que cursa generalmente sin fiebre y que aproximadamente en el 15% de los pacientes culmina con el desarrollo del SUH30. Este síndrome afecta fundamentalmente a los niños y se caracteriza por la presencia de anemia hemolítica microangiopática, trombocitopenia y fallo renal agudo, que puede requerir diálisis e incluso trasplante, con una mortalidad de entre el 5 y el 10% y graves secuelas en el 12 al 30% de los pacientes8,10,16,17,31. No en vano, este SUH posdiarreico está considerado como una de las causas más comunes de fallo renal agudo en niños17. En pacientes adultos la complicación más frecuente es la PTT posdiarreica; sus rasgos patológicos son esencialmente los mismos que los del SUH, si bien se diferencia de éste en la aparición de fiebre con una mayor frecuencia y de marcados síntomas neurológicos, como irritabilidad, letargia, convulsiones o coma, como consecuencia de la afectación del sistema nervioso central32.
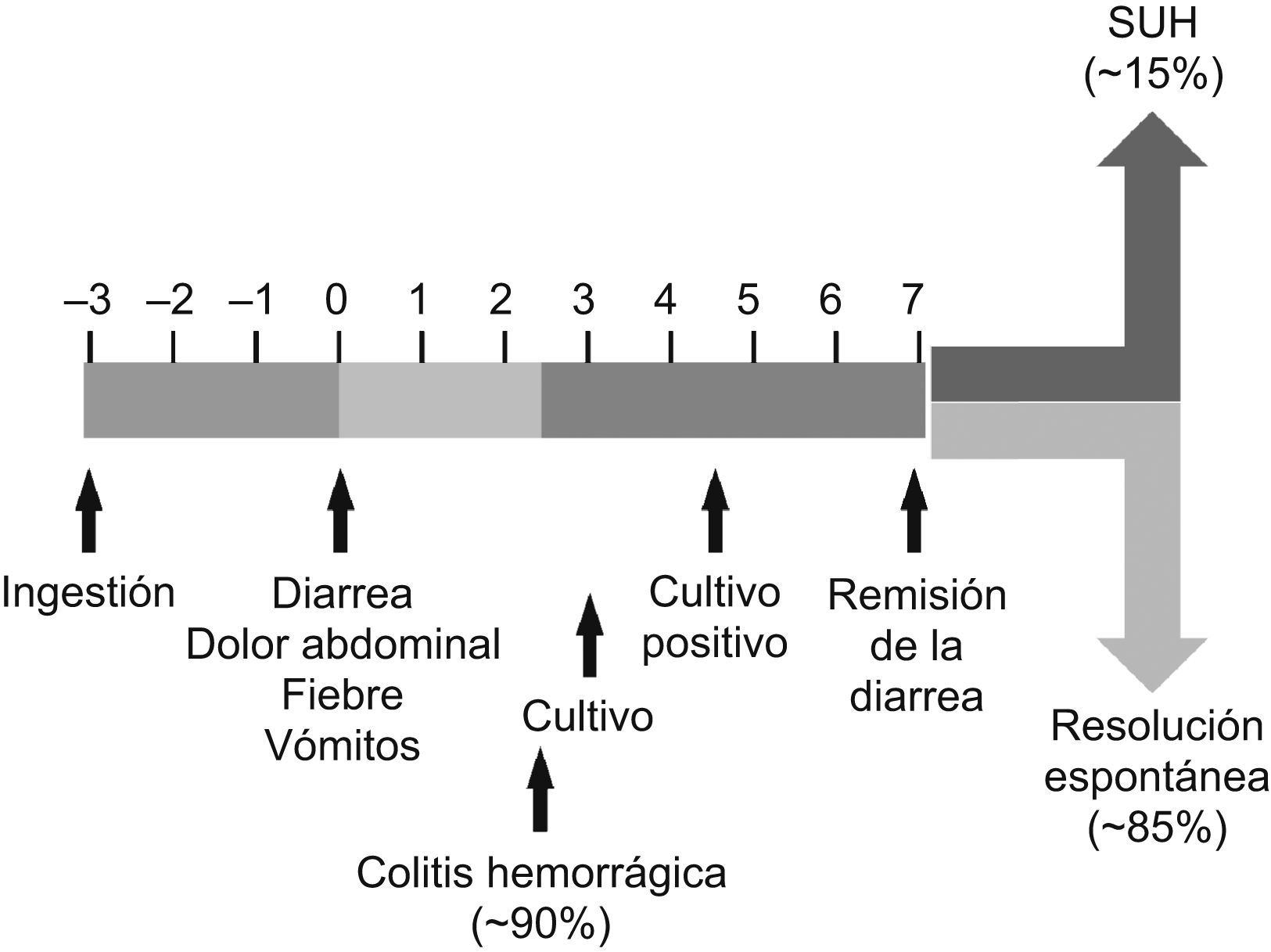
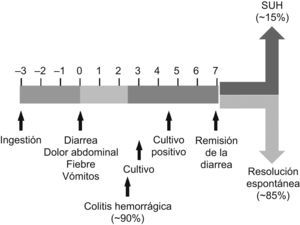
El intervalo de tiempo transcurrido entre la ingestión del vehículo contaminado con el ECVT O157:H7 y el comienzo de la diarrea, considerado el día 0 en el curso de la enfermedad (fig. 1), suele oscilar entre 2 y 12 días, y se ha establecido un período medio de incubación de 3 días33. Típicamente, este tipo de infecciones ocasiona entre 1 y 3 días de diarrea no sanguinolenta, que transcurrido ese tiempo se torna en CH. Esta evolución hacia un cuadro de CH ocurre aproximadamente en el 90% de los pacientes y suele ser lo que impulsa al paciente o a sus familiares a requerir asistencia médica30. Entre el 30 y el 60% de los casos cursa con vómitos, y se detecta fiebre, aunque escasa, en menos del 30% de los pacientes34. La duración media de la diarrea es de 7 días, tras éstos aparecen las complicaciones (SUH o PTT) aproximadamente en el 15% de los casos, el resto evoluciona hacia una resolución espontánea del proceso30. La eliminación del microorganismo una vez resuelto el proceso, por parte de los individuos asintomáticos, puede contribuir a una diseminación de la infección al colectivo, mediante la transmisión de persona a persona, si bien el período de mayor riesgo de transmisión probablemente sea la fase de diarrea aguda30.
Desarrollo de las infecciones por Escherichia coli verotoxigénicos O157:H7 en niños. SUH: síndrome urémico hemolítico. Basado en el original de Tarr et al30.
Pese a lo expuesto anteriormente, las infecciones producidas por el ECVT O157:H7 no siempre son agudas, sino que en ocasiones son autolimitantes, presentan un curso benigno y remiten sin necesidad de tratamiento alguno35. Por otro lado, en algunos casos de infección por el ECVT O157:H7 se ha aislado el microorganismo a partir de heces de pacientes con SUH que no habían tenido previamente un cuadro diarreico36. Incluso se han descrito infecciones por ECVT totalmente asintomáticas, tanto en los individuos escogidos al azar37 como en individuos relacionados con un determinado caso esporádico de infección15 o con un determinado brote, con un porcentaje de casos asintomáticos en algunos brotes recientes de cerca del 50%38.
Los principales rasgos clínicos que pueden distinguir las infecciones producidas por el ECVT O157:H7 de las causadas por otros patógenos entéricos como Campylobacter spp., Salmonella spp. o Shigella spp., son una historia de diarrea sanguinolenta, muestras de heces uniformemente teñidas de sangre, ausencia de fiebre en el momento de la valoración, recuento leucocitario superior a 10×109/l y flacidez abdominal a la palpación. Ninguno de estos rasgos es específico de forma aislada, pero considerados en conjunto son altamente significativos e indicativos de una infección por el ECVT O157:H716.
Las manifestaciones clínicas de las infecciones por ECVT no-O157, al igual que en el caso del ECVT O157:H7, pueden ir desde la diarrea acuosa no sanguinolenta hasta la CH, el SUH e incluso la muerte en un porcentaje considerable de los casos8. Se observa, eso sí, una mayor variabilidad en la sintomatología que puede acompañar a este tipo de infecciones, aspecto que se ha relacionado con la notable heterogeneidad genética presente en este grupo de patógenos, con respecto al ECVT O157:H7 propiamente dicho8. Aunque las cepas no-O157 suelen provocar cuadros de diarrea acuosa con más frecuencia que los del tipo de la CH, no puede considerarse la CH como una manifestación clínica exclusiva de las infecciones por ECVT O157:H7, teniendo en cuenta además que estas infecciones por ECVT O157:H7 no necesariamente conllevan episodios de CH8. Por otro lado, en los pacientes con infecciones por ECVT no-O157 se ha constatado una mayor duración del cuadro diarreico, con una media de 9,1 días, si bien la frecuencia de presentación de otros rasgos clínicos, como dolor abdominal, vómitos o fiebre, no parece diferenciarse con respecto a los pacientes infectados por ECVT O157:H78.
PatogénesisTras la entrada de la bacteria por vía oral, la resistencia demostrada de los ECVT al ácido, especialmente en el caso del ECVT O157:H7, facilita su supervivencia en el estómago, desde donde progresa a través del intestino delgado hasta alcanzar el colon, considerado como el principal lugar de colonización de los ECVT en los seres humanos, junto con la parte más distal del intestino delgado32. Una vez alcanzado el colon la bacteria se adhiere íntimamente a la membrana de las células epiteliales, dando lugar al borrado o destrucción localizada de las microvellosidades (lesión A/E), suficiente para provocar la aparición de diarrea no sanguinolenta10. Si se produce suficiente cantidad de toxina en el intestino ésta desencadena una isquemia mesentérica, consecuencia del daño ejercido sobre los vasos sanguíneos locales, que provoca que la diarrea acuosa existente evolucione hacia un cuadro de CH, con evidencias histopatológicas de edema y hemorragias en la lámina propia del tubo digestivo10. Por tanto, la CH se debe a la acción de las toxinas circulantes, más que al daño ocasionado por la bacteria directamente sobre el epitelio intestinal30.
No obstante, dado que los ECVT no son microorganismos invasivos, las VT deben absorberse a través del epitelio intestinal para acceder a la circulación sistémica8, donde se transportan unidas a los leucocitos polimorfonucleares39. De esta manera, la toxina absorbida a través del epitelio intestinal es transportada en la circulación desde el colon hasta sus órganos diana. Concretamente, las VT se unen al glucoesfingolípido globotriaosilceramida (receptor Gb3)40, circunstancia que tiene lugar en las células endoteliales, mesangiales y epiteliales de los glomérulos renales, además de otros tipos celulares, como macrófagos, monocitos y neutrófilos17, y en otras localizaciones orgánicas, como el cerebro8,32. Precisamente, diferencias en la expresión celular de la globotriaosilceramida explicarían la especificidad de órgano que se observa en la respuesta a las VT circulantes y que determina que el riñón sea su principal órgano diana17.
La acción de las VT sobre las células endoteliales microvasculares da lugar a una disminución tanto de su actividad antitrombótica como de su actividad fibrinolítica. Por un lado, el daño de la célula endotelial se traduce en un incremento de la generación intravascular de trombina, que se manifiesta por el aumento en la concentración de fragmento 1+2, y el consecuente depósito de fibrina, con altas concentraciones de dímeros D30. Además, aumenta la actividad del inhibidor del activador del plasminógeno de tipo 1, que bloquea la fibrinolisis, acelera la acumulación de fibrina en los vasos y exacerba el trastorno trombótico30. Por otro lado, el daño de la célula endotelial conduce a la formación de multímeros anormales del factor de Von Villebrand y la consecuente agregación plaquetaria y trombocitopenia31. En los glomérulos renales, estos depósitos de fibrina y trombocitos provocan un estrechamiento de la luz de los capilares que termina en una oclusión de éstos, con la consiguiente disminución del grado de filtración glomerular que conduce finalmente al fallo renal agudo característico del SUH10. Además, el paso de los eritrocitos a través de estos estrechamientos y oclusiones de la luz microvascular provoca un daño mecánico de éstos que se traduce en una anemia hemolítica microangiopática, y es frecuente la aparición de eritrocitos fragmentados con formas abigarradas en sangre periférica, lo que constituye un hallazgo típico del SUH10,31. Esta anemia que se observa en los niños que desarrollan el SUH se ha atribuido también a niveles inadecuadamente bajos de eritropoyetina sérica asociados con la necrosis de los túbulos renales41.
Además de la acción directa de las VT, también pueden desempeñar un papel en la patogénesis las interacciones entre éstas y los leucocitos y trombocitos circulantes39,42. En este sentido, algunos estudios han constatado que las VT y el lipopolisacárido bacteriano estimulan la producción, por parte de los monocitos humanos, de citoquinas proinflamatorias como la interleucina-1β y el factor de necrosis tumoral-α, que a su vez promueven la expresión de los receptores Gb3 en la membrana de las células endoteliales43, contribuyendo de esta forma al proceso de daño microvascular.
Problemática del tratamiento antibióticoUn problema adicional cuando tiene lugar este tipo de infecciones es el relativo al tratamiento antibiótico. En general, no deben administrarse antibióticos a los pacientes con infecciones entéricas por ECVT, tanto si la infección se ha confirmado como si sólo se sospecha8,30, ante la posibilidad, aún no confirmada, de que el uso de antibióticos pueda agravar el curso de la enfermedad y favorecer el desarrollo de SUH. En este sentido, Safdar et al44 analizaron una serie de estudios tanto retrospectivos como prospectivos que habían evaluado la asociación existente entre el tratamiento antibiótico en las infecciones entéricas provocadas por el ECVT O157:H7 y el riesgo de desarrollo del SUH, tanto en niños como en adultos. Entre los estudios retrospectivos considerados sólo uno mostró un efecto adverso estadísticamente significativo del uso de antibióticos sobre el desarrollo del SUH, 4 de éstos no mostraron ningún tipo de asociación y uno puso de manifiesto un efecto protector, aunque sólo en el análisis univariante44. En cuanto a los estudios prospectivos, uno de éstos constató un aumento estadísticamente significativo del riesgo de desarrollo del SUH, otro mostró un efecto protector de la fosfomicina en el tratamiento de la infección por ECVT O157:H7 y un tercero no encontró ningún tipo de asociación entre el uso de antibióticos y el desarrollo del SUH44. Los mecanismos mediante los cuales los antibióticos podrían aumentar el riesgo de desarrollar el SUH no se conocen exactamente, si bien se cree que podrían relacionarse con la lisis bacteriana, que promovería la liberación de VT45, con la eliminación de otras bacterias presentes en el colon, que aumentaría la absorción de toxinas a nivel sistémico10, o bien con la inducción de los bacteriófagos en los que generalmente se localizan los genes que codifican las VT, que se traduciría en un aumento de la producción de toxinas46.
Factores de riesgo para el desarrollo de complicacionesEl principal factor de riesgo de aparición de complicaciones, y especialmente de desarrollo del SUH, en pacientes con infecciones por ECVT es la edad. En este sentido, los menores de 5 años y los mayores de 65 años constituyen el principal grupo de riesgo11,47. Además, en el transcurso de algunos brotes de infección se ha observado que períodos cortos de incubación (menores de 4 días) y la presencia de taquicardia al ingreso del paciente se asocian con la progresión a SUH/PTT48. Del mismo modo, se ha constatado que los adultos con hipoclorhidria presentan un mayor riesgo de desarrollo de SUH/PTT y muerte, pese a la tolerancia demostrada del ECVT O157:H7 al ácido, y que una historia de isquemia cardíaca en los adultos se asocia con un mayor riesgo de muerte48. Por otro lado, hallazgos laboratoriales como un recuento elevado de células de la serie blanca o hipoalbuminemia en las 48h siguientes al comienzo del brote se han relacionado con el desarrollo de SUH/PTT y muerte48. Ikeda et al49 encontraron 3 factores predictivos del SUH durante los primeros 5 días de enfermedad: unos niveles de proteína C reactiva superiores a 1,2mg/dl, un recuento de células de la serie blanca superior a 11 × 109/l y una temperatura corporal superior a 38°C.
Como se ha apuntado anteriormente, algunos estudios señalan como factor de riesgo en el desarrollo de SUH la administración temprana de antibióticos44, y se ha descrito una asociación similar entre la administración de agentes antimotilidad o narcóticos de cualquier tipo y un aumento del riesgo de desarrollo de SUH o de complicaciones neurológicas33. Además, la presencia conjunta de los genes que codifican la toxina VT2 (gen stx2) y la intimina (gen eae) en los aislados de ECVT obtenidos a partir de las muestras clínicas de un paciente se ha considerado asimismo como un factor predictivo del SUH50.
No obstante, no existen fórmulas o factores que puedan aplicarse para excluir la posibilidad de la aparición de este tipo de complicaciones en los pacientes de cualquier edad, debiendo considerarse, por tanto, que todos los pacientes con infecciones por ECVT se encuentran en riesgo de desarrollar complicaciones del tipo SUH/PTT30.