Actualizar las recomendaciones sobre el tratamiento antirretroviral (TAR) para adultos infectados por el VIH-1.
MétodosEste documento ha sido consensuado por un panel de expertos de GESIDA y de la Secretaría del Plan Nacional sobre el Sida tras revisar los resultados de eficacia y seguridad de ensayos clínicos, estudios de cohortes y de farmacocinética publicados en revistas biomédicas (PubMed y Embase) o presentados en congresos. La fuerza de cada recomendación y la gradación de su evidencia se basan en una modificación de los criterios de la Infectious Diseases Society of America.
ResultadosSe recomienda el TAR en todos los pacientes infectados por el VIH-1. La fuerza y la gradación de la recomendación varían según la circunstancia clínica: enfermedades B o C de los CDC (A-I), pacientes asintomáticos según número de CD4+ (<350, A-I; 350-500, A-II; >500, B-III), comorbilidades (nefropatía por VIH, hepatitis crónica por VHB o VHC, edad superior a 55años, riesgo cardiovascular elevado, trastornos neurocognitivos o neoplasias, A-II) y prevención de la transmisión del VIH (materno-fetal o heterosexual, A-I; homosexual entre hombres, A-III). El objetivo del TAR es lograr una carga viral plasmática (CVP) indetectable. El TAR de inicio debe ser siempre una combinación de 3 fármacos que incluya una asociación de 2 ITIAN y otro fármaco de distinta familia (ITINN, IP/r o InInt). De las posibles pautas de inicio se han considerado algunas como alternativa. Se exponen las causas y los criterios para cambiar un TAR estando con CVP indetectable, así como en el fracaso virológico en el que en el TAR de rescate se deben usar 3 o 2 fármacos plenamente activos frente al virus. Se actualizan igualmente los criterios específicos del TAR en situaciones especiales (infección aguda, infección por VIH-2, embarazo) o comorbilidades (tuberculosis u otra enfermedad oportunista, afectación renal, hepatopatías y neoplasias).
ConclusionesEste nuevo documento actualiza las recomendaciones previas respecto a cuándo y con qué regímenes iniciar el TAR, cómo monitorizarlo y qué hacer cuando fracasa o desarrolla toxicidad. Se actualizan los criterios específicos del TAR en pacientes con comorbilidades y en situaciones especiales.
This consensus document is an update of combined antiretroviral therapy (cART) guidelines for HIV-1 infected adult patients.
MethodsTo formulate these recommendations a panel composed of members of the Grupo de Estudio de Sida and the Plan Nacional sobre el Sida reviewed the efficacy and safety advances in clinical trials, cohort and pharmacokinetic studies published in medical journals (PubMed and Embase) or presented in medical scientific meetings. Recommendations strength and the evidence in which they are supported are based on modified criteria of the Infectious Diseases Society of America.
ResultsIn this update, antiretroviral therapy (ART) is recommended for all patients infected by type 1 human immunodeficiency virus (HIV-1). The strength and grade of the recommendation varies with the clinical circumstances: CDC stage B or C disease (A-I), asymptomatic patients (depending on the CD4+ T-lymphocyte count: <350cells/μL, A-I; 350-500 cells/μL, A-II, and >500 cells/μL, B-III), comorbid conditions (HIV nephropathy, chronic hepatitis caused by HBV or HCV, age >55years, high cardiovascular risk, neurocognitive disorders, and cancer, A-II), and prevention of transmission of HIV (mother-to-child or heterosexual, A-I; men who have sex with men, A-III). The objective of ART is to achieve an undetectable plasma viral load. Initial ART should always comprise a combination of 3 drugs, including 2 nucleoside reverse transcriptase inhibitors and a third drug from a different family (non-nucleoside reverse transcriptase inhibitor, protease inhibitor, or integrase inhibitor). Some of the possible initial regimens have been considered alternatives. This update presents the causes and criteria for switching ART in patients with undetectable plasma viral load and in cases of virological failure where rescue ART should comprise 2 or 3 drugs that are fully active against the virus. An update is also provided for the specific criteria for ART in special situations (acute infection, HIV-2 infection, and pregnancy) and with comorbid conditions (tuberculosis or other opportunistic infections, kidney disease, liver disease, and cancer).
ConclusionsThese new guidelines updates previous recommendations related to cART (when to begin and what drugs should be used), how to monitor and what to do in case of viral failure or drug adverse reactions. cART specific criteria in comorbid patients and special situations are equally updated.
Desde el advenimiento en 1996 de fármacos antirretrovirales (FAR) que posibilitaron la conformación de combinaciones potentes de los mismos, el tratamiento antirretroviral (TAR) ha logrado enormes beneficios en cuanto a reducción de la morbimortalidad y transmisión de la infección por el virus de la inmunodeficiencia humana (VIH) y ha adquirido una gran complejidad como consecuencia de los numerosos FAR de distintas clases que han aparecido desde entonces y de sus múltiples facetas en cuanto a eficacia, toxicidad, resistencia, tropismo, interacciones farmacológicas, prevención de la infección por el VIH, uso en situaciones especiales, estudios de coste-eficacia, etc. Esta complejidad y la rapidez con que se suceden los cambios en su conocimiento exigen no solo la elaboración de guías y recomendaciones sobre TAR, sino también la frecuente actualización de las mismas. A este respecto, el Grupo de Estudio de Sida (GeSIDA), de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), y el Plan Nacional sobre el Sida (PNS) editan conjuntamente desde hace 15años un documento de consenso sobre TAR en adultos1, que, al igual que los de otras instituciones y sociedades científicas2-4, se ha venido actualizando anualmente. Dichas actualizaciones se publican tanto en la revista Enfermedades Infecciosas y Microbiología Clínica como en las páginas de GeSIDA (www.gesida-seimc.org) y del PNS (www.msssi.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/planNalSida).
El documento de 2014 se caracteriza porque todos sus apartados han sido reescritos completamente de nuevo y por tener una extensión considerablemente más corta. Por tal motivo no se pormenorizan en él determinados aspectos del TAR (adherencia, uso en pacientes coinfectados por el virus de la hepatitisB (VHB) o por el de la hepatitisC (VHC), en los que reciben tratamiento contra la tuberculosis, en la menopausia, la reproducción, el embarazo, el parto, la profilaxis de la transmisión vertical, la profilaxis postexposición, etc.), a los que tanto GeSIDA como el PNS, en colaboración con otras sociedades científicas, han dedicado documentos específicos y a los cuales se remite a los lectores interesados en ellos.
Los objetivos de este documento de consenso son facilitar a los profesionales que tratan a adultos infectados por el VIH el estado actual del conocimiento sobre el TAR y proporcionarles unas recomendaciones basadas en evidencias científicas para que puedan guiar sus actuaciones terapéuticas.
MetodologíaEl Panel del documento está integrado por clínicos expertos en la infección por el VIH y el TAR que han sido designados por la Junta Directiva de GeSIDA y el PNS, y que han aceptado participar voluntariamente en él y emitir una declaración de conflicto de intereses. Estos expertos se distribuyeron en diversos grupos formados por un redactor y varios consultores, cada uno de los cuales fue encargado de actualizar una sección del documento. Tres miembros del Panel (el presidente y el secretario de GeSIDA y la persona responsable del Área Asistencial del PNS) han actuado como coordinadores y otros 2 como redactores generales, cuyos cometidos han sido ensamblar todas las secciones del documento y encargarse de la redacción y edición final del mismo. El redactor de cada grupo revisó los datos más relevantes de las publicaciones científicas (PubMed y Embase; idiomas: español, inglés y francés) y de las comunicaciones a los congresos más recientes hasta el 30 de octubre de 2013.
Con ellos elaboró un texto, que fue sometido a la consideración de sus consultores y al que se incorporaron las aportaciones aceptadas por consenso. Una vez ensambladas todas las secciones, el documento fue discutido y consensuado en una reunión presencial de los miembros del Panel. Tras ser incorporadas las modificaciones aprobadas en dicha reunión, el documento fue expuesto durante 15días en las páginas web de GeSIDA y del PNS para que los profesionales, los pacientes u otras personas interesadas pudiesen hacer sugerencias, las cuales, tras su estudio y deliberación, fueron autorizadas o no por el Panel. Este aprobó también que en el caso de aparecer nuevas evidencias relevantes que implicasen cambios en las recomendaciones sobre TAR, estos fuesen incorporados al documento expuesto en las páginas web y, a ser posible, en la revista.
En este documento la fuerza de la recomendación y la gradación de las pruebas que la sustentan se basan en una modificación de los criterios de la Infectious Diseases Society of America (IDSA)5. Según estos criterios, cada recomendación debe ofrecerse siempre (A), en general (B) u opcionalmente (C), y ello basado en la calidad de los datos obtenidos a partir de uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio (I), de uno o más ensayos no aleatorizados o datos observacionales de cohortes (II), o de la opinión de expertos (III).
GeSIDA y el PNS seguirán actualizando este documento de consenso periódicamente, en función de la evolución de los conocimientos sobre TAR. No obstante, es preciso recordar que, dado que estos cambian muy frecuentemente, es conveniente que los lectores consulten también otras fuentes de información.
Para el control del seguimiento y la evaluación del impacto de estas recomendaciones sobre la respuesta al TAR de los pacientes seguidos en cada centro o por cada profesional, pueden utilizarse algunos de los parámetros específicos incluidos en el documento de indicadores de calidad asistencial en la atención a personas infectadas por el VIH, elaborado por GeSIDA6.
Evaluación clínica y de laboratorio para guiar el tratamiento antirretroviralEvaluación clínicaSe realizará una historia clínica completa que debe incluir una evaluación psicológica y psiquiátrica, riesgo cardiovascular, vacunaciones, viajes, hábitos sexuales, salud sexual de la pareja, uso de drogas y tóxicos, y una evaluación farmacológica exhaustiva para prevenir o detectar posibles interacciones entre los fármacos utilizados para tratar las comorbilidades y el TAR7,8. En las mujeres, además, es conveniente investigar aspectos relacionados con el deseo reproductivo, anticoncepción y otros aspectos ginecológicos específicos. También se debe realizar un examen físico general que incluya piel, orofaringe, corazón, pulmón, abdomen, ganglios linfáticos periféricos, musculoesquelético, neurológico con evaluación neurocognitiva, y anogenital. Esta evaluación se repetirá con periodicidad anual y/o siempre que la situación clínica del paciente lo requiera7,8.
Recomendación
- •
Se debe realizar historia clínica, evaluación farmacológica y examen físico a todo paciente infectado por el VIH, que se repetirá con periodicidad anual (A-II).
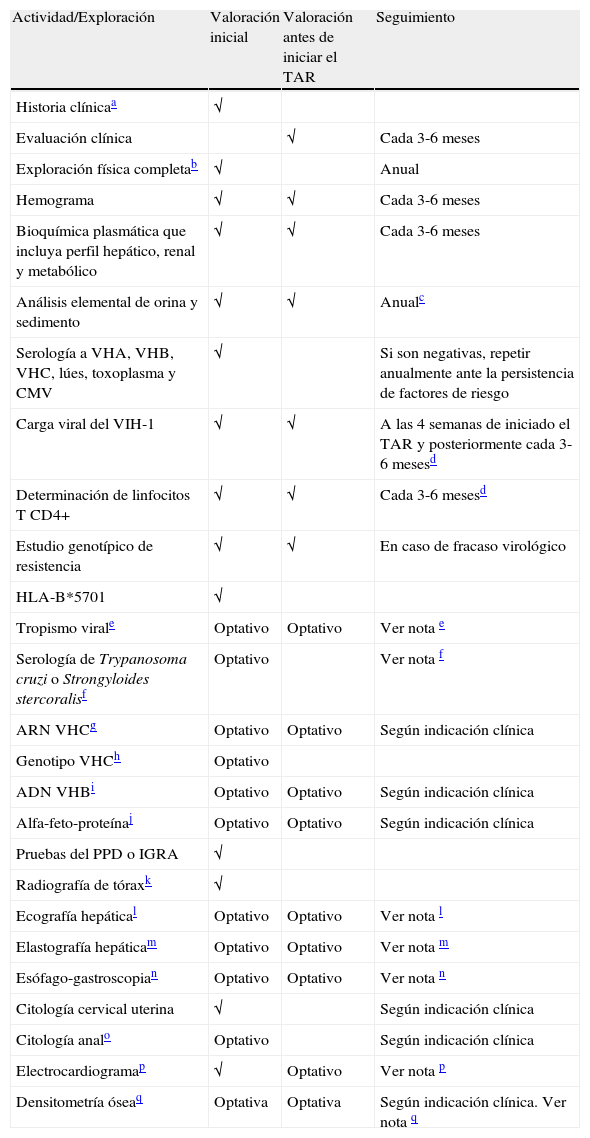
Se efectuarán determinaciones analíticas generales y, además, otras determinaciones específicas relativas al VIH. Los análisis generales incluyen hemograma, bioquímica básica con determinación de creatinina, filtrado glomerular (FG), enzimas hepáticas, perfil metabólico (glucosa, colesterol total, colesterolHDL, colesterolLDL y triglicéridos) y perfil óseo (calcio, fósforo y vitaminaD). Se debe efectuar una serología de toxoplasma, citomegalovirus, lúes, virus de la hepatitisA (VHA), VHB y VHC. En relación al propio VIH, se efectuarán un recuento de linfocitos CD4+, carga viral plasmática (CVP), estudio de resistencias frente a FAR, determinación de HLA-B*5701 y, eventualmente, estudio de tropismo. El recuento de linfocitos CD4+ y la CVP son los parámetros que se utilizan, además de la evaluación clínica, para indicar el TAR, monitorizar su efectividad y tomar decisiones respecto a cambios del mismo7,8. En la tabla 1 se describen los estudios complementarios recomendados en la evaluación inicial y el seguimiento periódico de un paciente infectado por el VIH. A continuación se comenta con mayor detalle la información relacionada con las determinaciones específicamente relacionadas con el VIH.
Exploraciones complementarias en la valoración inicial y el seguimiento de los pacientes con infección por el VIH-1
| Actividad/Exploración | Valoración inicial | Valoración antes de iniciar el TAR | Seguimiento |
| Historia clínicaa | √ | ||
| Evaluación clínica | √ | Cada 3-6 meses | |
| Exploración física completab | √ | Anual | |
| Hemograma | √ | √ | Cada 3-6 meses |
| Bioquímica plasmática que incluya perfil hepático, renal y metabólico | √ | √ | Cada 3-6 meses |
| Análisis elemental de orina y sedimento | √ | √ | Anualc |
| Serología a VHA, VHB, VHC, lúes, toxoplasma y CMV | √ | Si son negativas, repetir anualmente ante la persistencia de factores de riesgo | |
| Carga viral del VIH-1 | √ | √ | A las 4 semanas de iniciado el TAR y posteriormente cada 3-6 mesesd |
| Determinación de linfocitos T CD4+ | √ | √ | Cada 3-6 mesesd |
| Estudio genotípico de resistencia | √ | √ | En caso de fracaso virológico |
| HLA-B*5701 | √ | ||
| Tropismo virale | Optativo | Optativo | Ver nota e |
| Serología de Trypanosoma cruzi o Strongyloides stercoralisf | Optativo | Ver nota f | |
| ARN VHCg | Optativo | Optativo | Según indicación clínica |
| Genotipo VHCh | Optativo | ||
| ADN VHBi | Optativo | Optativo | Según indicación clínica |
| Alfa-feto-proteínaj | Optativo | Optativo | Según indicación clínica |
| Pruebas del PPD o IGRA | √ | ||
| Radiografía de tóraxk | √ | ||
| Ecografía hepátical | Optativo | Optativo | Ver nota l |
| Elastografía hepáticam | Optativo | Optativo | Ver nota m |
| Esófago-gastroscopian | Optativo | Optativo | Ver nota n |
| Citología cervical uterina | √ | Según indicación clínica | |
| Citología analo | Optativo | Según indicación clínica | |
| Electrocardiogramap | √ | Optativo | Ver nota p |
| Densitometría óseaq | Optativa | Optativa | Según indicación clínica. Ver nota q |
√ Realizar.
Estas recomendaciones deben considerarse orientativas y pueden ser modificadas de acuerdo con el juicio clínico de los profesionales responsables de la atención al paciente.
Se puede considerar determinar la CVP y los linfocitos T CD4+ con menos frecuencia (cada 6-12 meses) en pacientes clínicamente estables, con CVP repetidamente suprimida y cifras de linfocitos T CD4+ repetidamente superiores a 500 céls/μl.
Optativo en personas procedentes de áreas con alta prevalencia de infestación, sobre todo si se sospecha la misma (p. ej., eosinofilia).
Si coinfección por VHC, VHB u otra causa de daño hepático crónico, periodicidad según indicación clínica (c/6-12 meses).
Especialmente en pacientes pertenecientes a poblaciones con una elevada prevalencia de tuberculosis.
Si cirrosis hepática confirmada o elastografía >12,5 Kpa (F4) para descartar varices, periodicidad según indicación clínica.
Considerar en varones y en mujeres con patología vulvovaginal o de cérvix uterino por VPH (VIN, VaIN y CIN).
Recomendación
- •
La evaluación inicial de laboratorio debe incluir: hemograma, bioquímica general, serología de toxoplasma, citomegalovirus, lúes, VHA, VHB y VHC; CVP del VIH, linfocitos CD4+, resistencias primarias al VIH y HLA-B*5701 (A-II).
La cifra de linfocitos CD4+ es el principal indicador del estado inmunológico del paciente con infección por el VIH. Usualmente se utiliza el recuento absoluto, pero también puede utilizarse su porcentaje, que es más estable y objetivo, particularmente en pacientes con leucopenia9. La cifra de linfocitos CD4+ se utiliza para estadificar la infección por VIH y para evaluar la vulnerabilidad a determinadas infecciones oportunistas y la necesidad de profilaxis primaria de las mismas8, para establecer la indicación de TAR y para evaluar la respuesta inmunológica del paciente y la eventual discontinuación de las profilaxis10. Una vez instaurado el TAR, el aumento de la cifra de linfocitos CD4+, en los pacientes en los que están disminuidos, es lento pero constante en el tiempo. No hay datos que definan cuál es la respuesta inmunológica adecuada. Se admite que durante el primer año debería existir un aumento mínimo de 50-100 linfocitos CD4+/μl11. En algunos pacientes muy inmunodeprimidos no se produce el esperado aumento de linfocitos CD4+ a pesar de una correcta supresión virológica.
En los pacientes asintomáticos que no reciben TAR deben medirse los linfocitos CD4+ cada 3-6meses, y ante un hallazgo que justifique tomar una decisión terapéutica, debe repetirse en 4semanas12. Una vez iniciado el TAR, se determinarán a las 4semanas y posteriormente cada 3-6meses o siempre que cambios en la situación clínica lo hagan aconsejable. Los controles pueden ser más espaciados (hasta 12meses) en algunos pacientes clínicamente estables, con CVP suprimida y cifras de linfocitos CD4+ repetidamente mayores de 500 células/μl13.
Recomendación
- •
Se debe determinar periódicamente el número absoluto y el porcentaje de linfocitos CD4+ antes de iniciar el TAR y, una vez iniciado, como parámetro de monitorización periódica de la respuesta inmunológica al mismo (A-I).
Es necesario determinar la CVP antes de iniciar el TAR. La CVP desciende rápidamente tras el inicio del TAR8,14. El objetivo de supresión de la CVP es conseguir cifras inferiores a 20-50copias/ml, pues se ha comprobado que por debajo de ellas no se seleccionan mutaciones de resistencia15 y que la duración de la respuesta virológica es mucho mayor que con cifras comprendidas entre 50 y 500copias/ml. Los pacientes con CVP muy elevadas pueden tardar hasta 24semanas en conseguir que esta sea inferior a 20-50copias/ml. El punto de corte de 50copias/ml es orientativo, pues varía según la técnica utilizada. En pacientes con CVP habitualmente indetectable no es infrecuente la detección transitoria de viremia de bajo nivel (blips), que vuelve espontáneamente a ser indetectable sin ningún cambio en el TAR. Aunque en la mayoría de estudios no se ha observado que los blips aumenten el riesgo de fracaso virológico, en algunos pacientes pueden seleccionar MR16.
Los criterios de respuesta y fracaso virológicos son:
- •
Respuesta virológica. Reducción de la CVP superior a 1log10 tras 4semanas desde el inicio del TAR y CVP inferior a 50copias/ml tras 16-24semanas del mismo.
- •
Fracaso virológico. Cualquiera de las 2 situaciones siguientes: a)CVP detectable tras 24semanas del inicio del TAR; b)si tras alcanzar la indetectabilidad de la CVP, esta vuelve a ser >50copias/ml en 2 determinaciones consecutivas (separadas por 2-4semanas).
Es conveniente medir la CVP a las 4semanas del inicio del TAR y, posteriormente, cada 3-6meses, para comprobar la respuesta virológica y como medida indirecta de adherencia y de refuerzo a la misma17. En pacientes clínicamente estables con CVP repetidamente suprimida y cifras elevadas de linfocitos CD4+ este intervalo de tiempo puede alargarse incluso hasta 12meses15. Si la medida de la CVP se efectúa tras un proceso infeccioso intercurrente o vacunación, puede haber elevaciones transitorias.
Recomendaciones
- •
Se debe determinar la CVP antes del inicio del TAR (A-II).
- •
La CVP es el parámetro principal para evaluar la eficacia virológica del TAR y para definir el fracaso virológico (A-I).
- •
Los objetivos de supresión virológica se deben conseguir tanto en pacientes sin TAR previo como en individuos que han experimentado un fracaso previo (A-II).
- •
Debe utilizarse una técnica de determinación de CVP con un límite de cuantificación de al menos 50copias/ml y usar siempre la misma técnica (A-II).
- •
Si se van a tomar decisiones terapéuticas en función de un resultado de la CVP, se debe confirmar con una segunda determinación (A-II).
Las concentraciones plasmáticas de algunos FAR se correlacionan con su eficacia o toxicidad, por lo que su determinación podría ser útil para optimizar su uso. La monitorización de las concentraciones plasmáticas de FAR se limita a inhibidores de la transcriptasa inversa no nucleósidos (ITINN), inhibidores de la proteasa (IP), antagonistas de CCR5 e inhibidores de la integrasa (InInt). Se conocen determinadas variables o situaciones clínicas que se asocian a variaciones importantes en los niveles plasmáticos de FAR: sexo, edad, peso, superficie corporal, determinantes genéticos del huésped, interacciones medicamentosas, embarazo e insuficiencia hepática o renal18. Sin embargo, los ensayos clínicos aleatorizados han mostrado resultados discordantes sobre la efectividad de la determinación de concentraciones plasmáticas de FAR en relación con la eficacia y la toxicidad del TAR19. Las limitaciones para el uso rutinario de concentraciones plasmáticas de FAR en la clínica diaria son múltiples: resultados no concordantes acerca de su eficacia en estudios prospectivos, desconocimiento de rangos terapéuticos asociados a respuesta o reducción de efectos adversos, variabilidad intraindividual y falta de disponibilidad de la técnica en la mayoría de los laboratorios.
Recomendaciones
- •
No se recomienda la medición de concentraciones plasmáticas de FAR para el control habitual del paciente con infección por el VIH (A-II).
- •
La medición de concentraciones plasmáticas de FAR puede estar indicada en algunas situaciones clínicas: riesgo de interacciones farmacológicas, trasplantes de órganos, delgadez extrema u obesidad mórbida, embarazo, insuficiencia hepática o renal, etc., así como para confirmar la sospecha de un cumplimiento terapéutico deficiente (B-III).
El virus de la inmunodeficiencia humana tipo 1 (VIH-1) tiene una gran tendencia a producir mutantes resistentes. No todas las mutaciones tienen la misma importancia. Para cada FAR existen unas mutaciones llamadas «principales», cuya presencia determina resistencia, y otras «secundarias», que contribuyen a la resistencia en menor medida. Las variantes de VIH-1 mutadas tienen una menor eficiencia biológica y con frecuencia una menor capacidad replicativa (fitness)20. Las variantes resistentes pueden detectarse mediante técnicas genotípicas o fenotípicas. Las genotípicas detectan cambios específicos en el genoma de las enzimas diana de los FAR (transcriptasa inversa, proteasa, integrasa, envuelta), mientras que las fenotípicas determinan la respuesta de la población viral mayoritaria a concentraciones crecientes de los FAR20. Ambas comparten limitaciones, como dificultad de detección cuando la población mutada es inferior al 20% de la población viral o cuando la CVP es inferior a 1.000 copias/ml21, aunque existen técnicas que soslayan estos inconvenientes. Las técnicas genotípicas son las que se utilizan en la asistencia clínica, dado que son más sencillas, rápidas y accesibles.
Está indicado efectuar un estudio de resistencias antes del TAR de inicio y en pacientes tratados que presentan fracaso virológico. En los pacientes con fracaso virológico es imperativo efectuar un estudio de resistencias para adecuar el nuevo TAR al perfil de mutaciones del VIH20,21. Siempre que sea posible se efectuará el estudio durante el TAR activo, ya que la población viral resistente será sustituida por otra sensible a las pocas semanas de retirar los FAR. Por otra parte, los pacientes sin TAR previo pueden haber sido infectados por cepas de VIH-1 resistentes a algunos FAR (resistencia primaria), por lo que es conveniente efectuar un estudio de resistencias en el momento del diagnóstico, particularmente si la infección es reciente. Las cepas resistentes, de existir, se convierten en minoritarias a los pocos meses, debido a su menor fitness. Si se difiere el inicio del TAR en un paciente recientemente diagnosticado, debe realizarse un nuevo estudio de resistencias antes de iniciar el TAR22. La prevalencia de resistencias primarias en países occidentales se ha estabilizado23, y la última actualización en la cohorte de la Red de Sida (CoRIS) para el periodo 2011-2013 ha estimado una prevalencia global de resistencias primarias a inhibidores de la transcriptasa inversa y de la proteasa de primera línea del 6,9%24.
En relación con las variantes minoritarias, la información disponible sugiere que pueden estar implicadas en algunos fracasos virológicos25 y cada vez se les concede un mayor interés, especialmente si el TAR se inicia con ITINN, pero la tecnología necesaria para su determinación no está disponible en todos los laboratorios.
Estas recomendaciones y otros aspectos relacionados con las indicaciones y la interpretación de las pruebas genotípicas de resistencia a FAR han sido revisados recientemente de manera detallada en unas guías europeas26 y en diversos consensos de expertos27,28. También se pueden utilizar algoritmos de interpretación de las mutaciones asociadas con resistencia a FAR, que se actualiza periódicamente en las páginas web de la Red de Sida (www.retic-ris.net) y de la Universidad de Stanford (http://hivdb.stanford.edu/).
Recomendaciones
- •
Se recomienda realizar un estudio genotípico de resistencias del VIH en todos los pacientes, tanto en el momento del diagnóstico de la infección por VIH como antes de iniciar el TAR, si este se difiere (A-II).
- •
Se recomienda la realización de un estudio genotípico de resistencias del VIH en todos los pacientes con fracaso virológico confirmado (A-I).
Los portadores del alelo HLA-B*5701 tienen un riesgo significativamente superior de presentar una reacción de hipersensibilidad (RHS) a ABC respecto a los individuos que carecen de esta variante genética. La RHS a ABC es un síndrome multiorgánico que puede manifestarse con una combinación variable de exantema, fiebre, mialgias y síntomas respiratorios o gastrointestinales y puede llegar a ser fatal si se continúa tomando ABC o se reintroduce este FAR después de haberlo suspendido. Suele aparecer durante las primeras 6semanas de TAR y se presenta en el 5-8% de los pacientes que toman ABC29. Un ensayo clínico multicéntrico realizado en población caucásica ha demostrado fehacientemente que cuando no se prescribe ABC a los pacientes que son portadores del alelo HLA-B*5701 disminuye significativamente la incidencia de RHS por ABC30. Esta información también ha sido validada en población de raza negra, en la que la prevalencia de HLA-B*5701 es menor31. ABC no debe utilizarse por tanto en personas portadoras de HLA-B*5701. Una prueba de HLA-B*5701 negativa no descarta completamente la posibilidad de RHS por ABC, por lo cual se debe informar a los pacientes acerca de la RHS cuando se inicia un TAR con ABC y evaluar los síntomas que eventualmente puedan presentar.
Recomendaciones
- •
Se debe determinar el HLA-B*5701 en todos los pacientes antes de iniciar un régimen de TAR que contenga ABC (A-I).
- •
No se debe prescribir ABC si la prueba del HLA-B*5701 es positiva (A-I).
La disponibilidad de MVC, un FAR antagonista del correceptor CCR5, hace necesario conocer el tropismo del VIH para determinar si un paciente es eventualmente candidato a ser tratado con este fármaco. MVC se debe utilizar exclusivamente en los pacientes infectados por cepas R5 de VIH, que utilizan exclusivamente el correceptor CCR5 para penetrar en las células.
El tropismo del VIH se puede determinar mediante pruebas fenotípicas y genotípicas. La fenotípica (Trofile ESTA®) evalúa la capacidad de un virus recombinante, que contiene secuencias derivadas de la envoltura del virus del paciente, de infectar líneas celulares que expresan CCR5 o CXCR4 además de CD4. Es una técnica sensible pero la efectúan pocos laboratorios y es compleja y cara. Los sistemas genotípicos determinan la secuencia de la región V3 de la gp120, que determina el uso preferente de uno de los 2 correceptores por la cepa de VIH. Es la técnica de referencia actual, pues se puede llevar a cabo en cualquier laboratorio que realice estudios de resistencias, es rápida, no precisa una CVP elevada para obtener resultados fiables y reproducibles y su coste es menor32.
Diferentes grupos de consenso nacionales33 y europeos34 recomiendan determinar el tropismo en los pacientes que hayan fracasado a cualquier línea de tratamiento y vayan a iniciar un tratamiento de rescate que contemple el uso de antagonistas de CCR5 y en pacientes sin TAR previo en las que un FAR antagonista del receptor CCR5 pueda considerarse una buena opción terapéutica.
Recomendación
- •
Se debe determinar el tropismo viral antes de iniciar el tratamiento con un FAR inhibidor del receptor CCR5 (A-I).
Los principales motivos para iniciar el TAR son la reducción de la morbimortalidad asociada a la infección por VIH, la recuperación y preservación de la función inmunológica, evitar el efecto nocivo de la replicación del VIH sobre posibles comorbilidades existentes y la prevención de la transmisión del VIH. Es importante valorar de forma individual el momento de inicio del TAR y de los FAR que deben formar parte del régimen inicial, sopesando las ventajas e inconvenientes de cada una de las opciones. La disposición y la motivación del paciente es un factor crítico a la hora de tomar la decisión de cuándo empezarlo.
Cuándo iniciar el tratamiento antirretroviralNo existe ninguna duda sobre la necesidad de tratar a todos los pacientes con sintomatología relacionada con la infección por el VIH (eventos clínicosB o C de la clasificación de los CDC de 2003, incluyendo la nefropatía por VIH), puesto que el tratamiento se relaciona con mejora de la supervivencia.
En pacientes asintomáticos, los resultados de diferentes ensayos clínicos indican que el riesgo de progresión y/o muerte es mayor cuando se inicia el TAR con cifras de linfocitos CD4+ inferiores a 350células/μl que cuando se inicia con cifras por encima de esta35,36. La mejora en la seguridad de los tratamientos y la acumulación de datos que indican una mayor morbimortalidad por causas no relacionadas con el sida en pacientes asintomáticos con menos de 350linfocitos CD4+/μl en diferentes estudios observacionales37-40 y de subanálisis de algunos ensayos clínicos35,41 han modificado la recomendación de inicio del TAR en este grupo de pacientes
En la ART Cohort Collaboration37 el riesgo de progresión y/o muerte fue mayor cuando se inició el TAR entre 250-350linfocitos CD4+/μl que con 350-450/μl; sin embargo, el inicio con cifras de linfocitos CD4+ entre 450-550/μl no se relacionó con un descenso adicional del riesgo de progresión o muerte. En la cohorte HIV-CAUSAL39 el riesgo de progresión a sida o muerte fue mayor cuando se inició el TAR con menos de 350linfocitos CD4+/μl que cuando se inició entre 350 y 500/μl. En la CASCADE Collaboration40, iniciar TAR entre 350 y 500linfocitos CD4+/μl también disminuyó la mortalidad en comparación con la de los pacientes que lo iniciaron con cifras de CD4+ inferiores a 350/μl; sin embargo, empezar TAR entre 500 y 799 CD4+/μl no disminuyó el riesgo de progresión a sida o muerte con respecto al grupo que lo inició entre 350 y 500 CD4+/μl. Por el contrario, los datos de la cohorte NA-ACCORD38 sí muestran un mayor riesgo de muerte en los pacientes en los que se demora el inicio del TAR hasta recuentos de linfocitos CD4+ inferiores a 500/μl, comparado con los que lo inician más precozmente.
En un pequeño subestudio del ensayo SMART35, los pacientes que iniciaron TAR con cifras de linfocitos CD4+ mayores de 350/μl (mediana: 437/μl) presentaron menos complicaciones graves asociadas o no al sida que los que lo hicieron con menos de 250células/μl. Por último, en el estudio HPTN 05241, iniciar TAR entre 350-550 CD4+/μl disminuyó el riesgo de progresión clínica, pero no la mortalidad, con respecto a los que lo iniciaron con menos de 250 CD4+/μl.
Todos estos datos favorecen la recomendación de iniciar TAR con menos de 500 CD4+/μl. El debate actual se centra en torno a si es necesario iniciar TAR con más de 500linfocitos CD4+/μl. No existen de momento datos concluyentes, aunque la simplicidad y la tolerabilidad de los regímenes actuales tampoco justifican la demora para iniciar el TAR. Además, el incremento de la población tratada se ha relacionado con una disminución de las tasas de transmisión y, por tanto, de la disminución de nuevas infecciones42,43. Por todo ello, la recomendación de iniciar el TAR en toda persona infectada es compartida por un número creciente de expertos. En cualquier caso, el TAR debería recomendarse en aquellos grupos de pacientes con un mayor riesgo de progresión, como los que presentan CVP superior a 105 copias/ml y una edad igual o mayor de 55 años. También se recomienda iniciar TAR en pacientes con comorbilidades cuya progresión se ve facilitada por la propia infección por VIH, como la cirrosis hepática, la hepatitis crónica por VHC, la existencia de riesgo cardiovascular elevado, los tumores no relacionados con el sida y los trastornos neurocognitivos.
Por último, existen determinadas circunstancias en las que el TAR debe recomendarse con independencia de la situación inmunológica, como es el caso de las mujeres embarazadas (para disminuir el riesgo de transmisión maternofetal), la coinfección por hepatitisB subsidiaria de tratamiento antiviral, o las parejas serodiscordantes que deseen disminuir al máximo el riesgo de transmisión del VIH.
Como excepción se consideran los pacientes que mantienen CVP indetectable de forma mantenida sin TAR (controladores de élite). En este caso no existe información que permita valorar el efecto beneficioso del TAR, por lo que no se puede establecer una recomendación al respecto.
Recomendaciones
- •
Se recomienda la administración de TAR a todos los pacientes con infección por el VIH para evitar la progresión de la enfermedad, disminuir la transmisión del virus y limitar el efecto nocivo sobre posibles comorbilidades coexistentes. La fuerza de la recomendación varía según las circunstancias, como se detalla en la tabla 2.
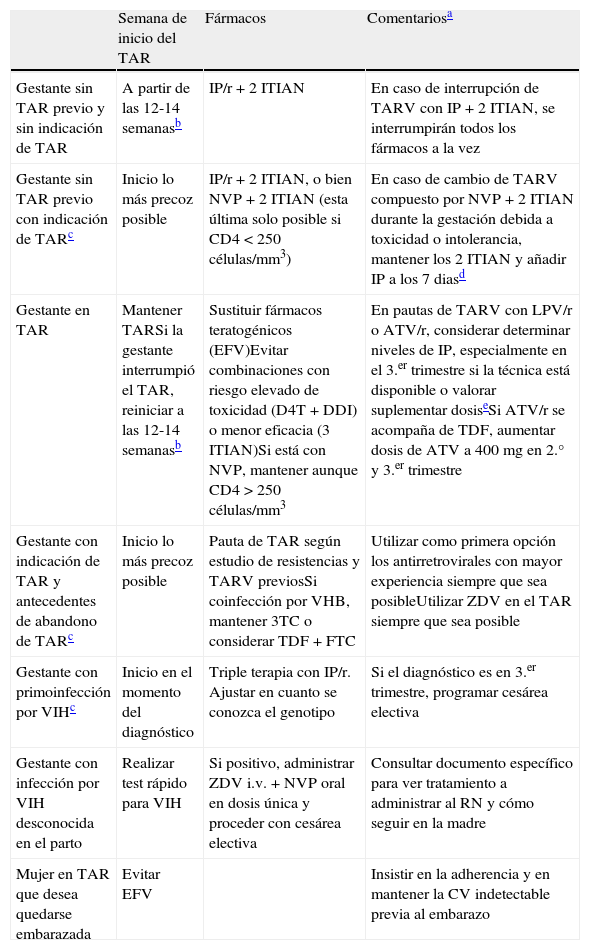
Tabla 2.Indicaciones de TAR en pacientes con infección crónica por el VIHa
Recomendación general Se recomienda la administración de TAR a todos los pacientes con infección por VIHb. La fuerza y gradación de la recomendación varía según las siguientes circunstancias: Condición/circunstancia Fuerza y gradación Enfermedades B o C del CDC A-I Cifra de linfocitos T CD4+ < 350/μl350 a 500/μl> 500/μl A-IA-IIB-III Comorbilidades Nefropatía por VIHHepatitis crónica por VHCHepatitis crónica por VHBEdad ≥55 añosRiesgo cardiovascular elevadoTrastornos neurocognitivosNeoplasias A-IIA-IIA-IIA-IIA-IIA-IIA-II Riesgo de transmisión Mujeres gestantesTransmisión heterosexualTransmisión sexual entre varones A-IA-IA-III aEs importante hacer una valoración individualizada del momento de inicio del TAR y de los FAR que deben formar parte del régimen inicial, sopesando las ventajas e inconvenientes de cada una de las opciones. La disposición y la motivación del paciente es un factor crítico a la hora de tomar la decisión de cuándo empezarlo.
- •
El inicio del TAR debe valorarse siempre individualmente. Antes de tomar la decisión de iniciarlo deben confirmarse las cifras de linfocitos CD4+ y CVP. Además, debe prepararse al paciente, ofertando las distintas opciones, adaptando el esquema terapéutico al estilo de vida, comorbilidades y posibles interacciones y valorando el riesgo de mala adherencia (A-III).
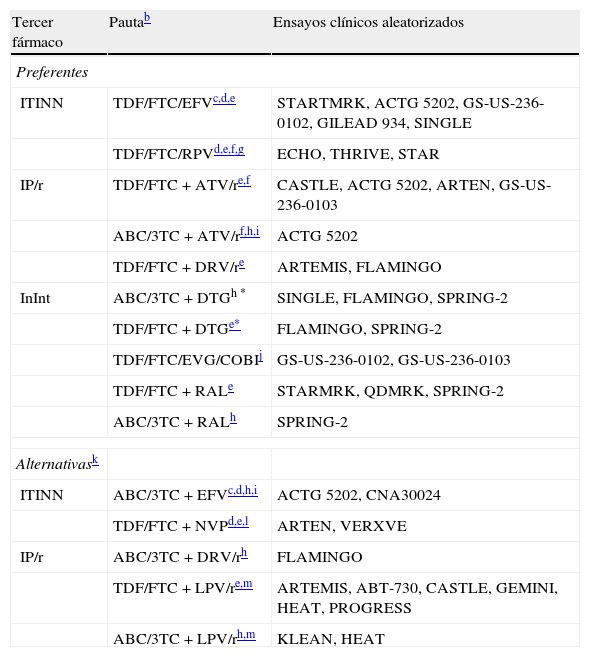
El tratamiento de elección de la infección por el VIH-1 en el momento actual consiste en una combinación de 3 fármacos que incluyan 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) asociado a un ITINN, un IP/r o un InInt (tabla 3). Con estas combinaciones se puede conseguir una CVP inferior a 50 copias/ml en más del 75% de los casos a las 48semanas.
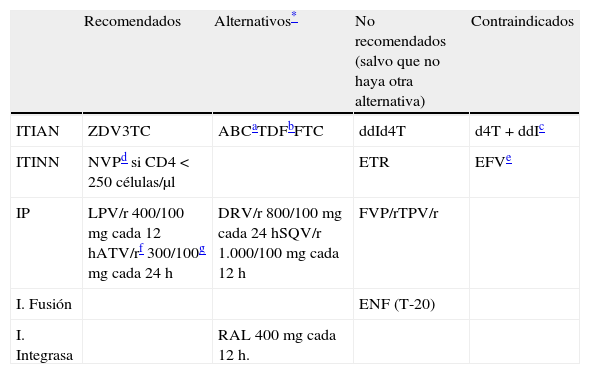
Combinaciones de TAR de inicio recomendadasa
| Tercer fármaco | Pautab | Ensayos clínicos aleatorizados |
| Preferentes | ||
| ITINN | TDF/FTC/EFVc,d,e | STARTMRK, ACTG 5202, GS-US-236-0102, GILEAD 934, SINGLE |
| TDF/FTC/RPVd,e,f,g | ECHO, THRIVE, STAR | |
| IP/r | TDF/FTC+ATV/re,f | CASTLE, ACTG 5202, ARTEN, GS-US-236-0103 |
| ABC/3TC+ATV/rf,h,i | ACTG 5202 | |
| TDF/FTC+DRV/re | ARTEMIS, FLAMINGO | |
| InInt | ABC/3TC+DTGh * | SINGLE, FLAMINGO, SPRING-2 |
| TDF/FTC+DTGe* | FLAMINGO, SPRING-2 | |
| TDF/FTC/EVG/COBIj | GS-US-236-0102, GS-US-236-0103 | |
| TDF/FTC+RALe | STARMRK, QDMRK, SPRING-2 | |
| ABC/3TC+RALh | SPRING-2 | |
| Alternativask | ||
| ITINN | ABC/3TC+EFVc,d,h,i | ACTG 5202, CNA30024 |
| TDF/FTC+NVPd,e,l | ARTEN, VERXVE | |
| IP/r | ABC/3TC+DRV/rh | FLAMINGO |
| TDF/FTC+LPV/re,m | ARTEMIS, ABT-730, CASTLE, GEMINI, HEAT, PROGRESS | |
| ABC/3TC+LPV/rh,m | KLEAN, HEAT | |
Ordenado alfabéticamente por tercer fármaco. Se recomienda el uso de preparados que combinen fármacos a dosis fijas. No existe en la actualidad suficiente información que permita considerar como equivalentes terapéuticos a FTC y 3TC, por lo que el uso de uno u otro fármaco en los regímenes seleccionados depende fundamentalmente de la experiencia disponible en su uso conjunto con los otros fármacos de la combinación. Para la valoración de las biterapias en el tratamiento de inicio, véase el texto.
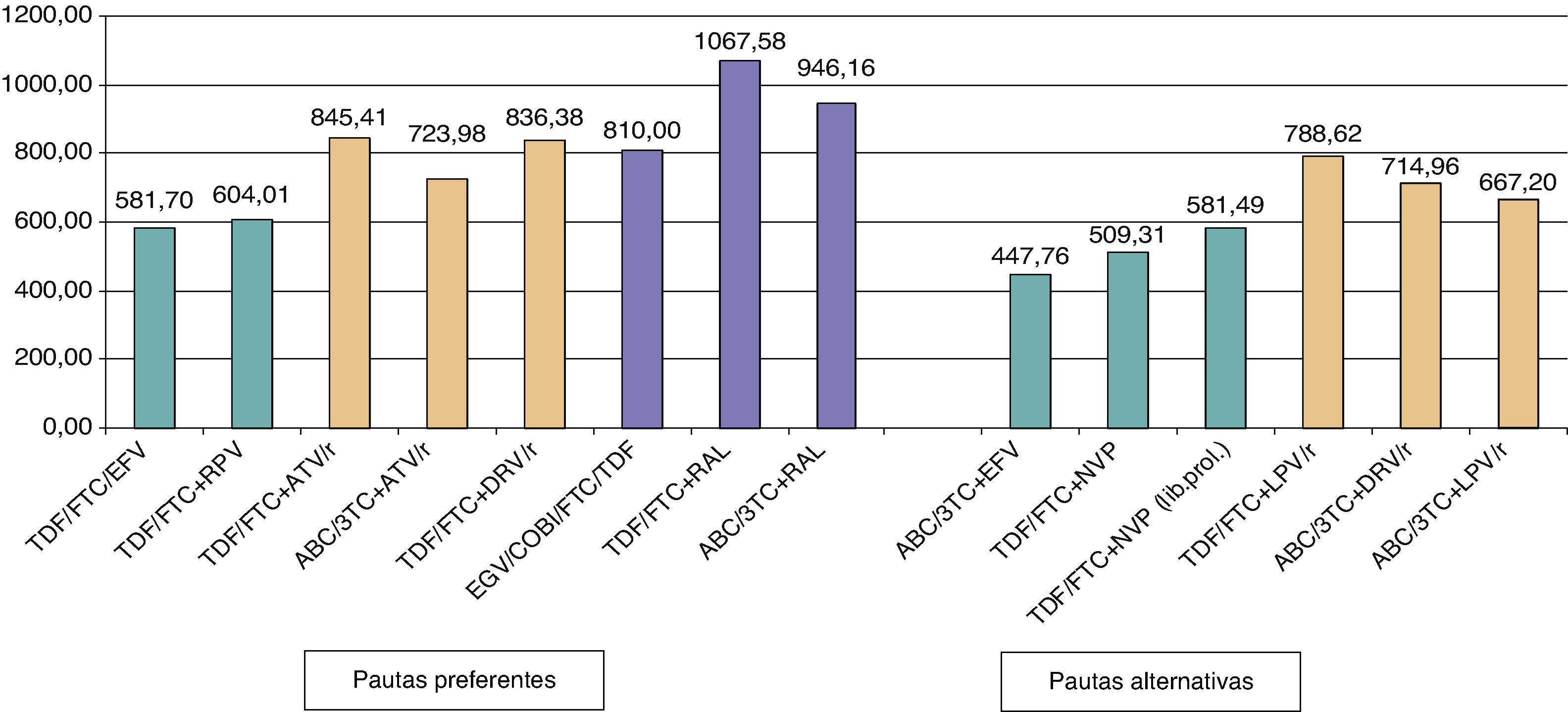
Los comentarios reflejan aspectos que se deben considerar en la elección de régimen, pero no pretenden ser una guía exhaustiva de las precauciones a tomar en el uso de los fármacos. Para mayor información se recomienda revisar el texto del documento así como las fichas técnicas de los fármacos. En otro apartado de estas guías se tratan aspectos de precio y de costes de los diferentes regímenes terapéuticos. Simultáneamente con las guías se publica un artículo en el que se hace un análisis formal de coste/eficacia de las pautas recomendadas como preferentes.
Evitar en mujeres que planean quedarse embarazadas y en pacientes con alteraciones neuropsiquiátricas no estabilizadas. Usar con precaución en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentración.
Usar TDF con precaución en pacientes con factores de riesgo para insuficiencia renal. Está contraindicado si FG<30ml/min y requiere ajuste de dosis si FG: 30-49ml/min. El uso combinado de IP/r y TDF incrementa particularmente el riesgo de nefrotoxicidad.
No autorizado en los pacientes con CVP>100.000 copias/ml; sin embargo, en pacientes con CVP<100.000 copias/ml ha mostrado mayor eficacia que el tratamiento con TDF/FTC/EFV. Tomar siempre con una comida.
Es preciso realizar previamente determinación de HLA-B*5701. No utilizar si el HLA-B*5701 es positivo.
No indicado en pacientes con aclaramiento de creatinina estimado <70ml/min. Usar con precaución en pacientes con aclaramiento de creatinina estimado <90ml/min.
Se han realizado estudios con diversas combinaciones de 2 FAR que excluyen uno o ambos ITIAN, pero en el momento actual ninguna puede ser considerada de elección para el inicio del TAR.
Recomendación
- •
Pueden utilizarse las combinaciones de 2 ITIAN+1 ITINN, 2 ITIAN+1 IP/r o 2 ITIAN+1 InInt como TAR de inicio (los FAR preferentes se detallan más adelante) (A-I) (tabla 3).
En España están comercializados 6 ITIAN: ZDV, ddI, d4T, 3TC, FTC y ABC. También se dispone de un análogo de nucleótido (TDF). A efectos prácticos, la abreviatura ITIAN incluye también al TDF en esta guía.
Se consideran como combinaciones de ITIAN de elección las formadas por TDF/FTC y por ABC/3TC, que deberían administrase siempre que sea posible en preparados coformulados. No existe en la actualidad suficiente información que permita considerar como equivalentes terapéuticos a FTC y 3TC, por lo que el uso de uno u otro ITIAN en los regímenes seleccionados depende fundamentalmente de la experiencia disponible en su uso conjunto con los otros FAR de la combinación.
La mayor toxicidad relacionada con el uso de ZDV, ddI y d4T no permite recomendar su uso en ninguna pauta de inicio.
Combinaciones con TDF/FTC frente a combinaciones con ABC/3TCEn el ensayo clínico ACTG 520244 se comparó de forma ciega el inicio de TAR con ABC/3TC o TDF/FTC en 1.857 pacientes. Los participantes fueron aleatorizados además a recibir ATV/r o EFV de forma abierta. Entre los pacientes con CVP basal igual o mayor de 100.000copias/ml, tanto el tiempo hasta el fracaso virológico como el tiempo hasta el primer efecto adverso de grado 3-4 fueron significativamente más cortos en el brazo de ABC/3TC que en el brazo de TDF/FTC, lo que ocasionó la interrupción del estudio para los pacientes en este estrato de CVP. En los pacientes con CVP menor de 100.000copias/ml no hubo diferencias en eficacia virológica entre ABC/3TC y TDF/FTC, independientemente de que se administraran con ATV/r o EFV45,46.
El estudio ASSERT47 es un ensayo clínico abierto en el que se compararon los perfiles de seguridad de TDF/FTC y ABC/3TC (ambos administrados con EFV) en pacientes HLA-B*5701-negativos. Aunque no fue diseñado para comparar eficacia, se observó que la proporción de pacientes con CVP inferior a 50copias/ml a las 48semanas fue significativamente superior con TDF/FTC que con ABC/3TC.
A diferencia de lo observado en el estudio ACTG 5202, en el estudio HEAT48 (doble ciego de 96semanas de duración) no se observaron diferencias en la eficacia virológica ni en la respuesta inmunológica de ABC/3TC comparado con TDF/FTC cuando se combinan con LPV/r, con independencia de la CVP de partida.
Tres estudios en faseiii diseñados para comparar el TAR de inicio con DTG, frente a otros FAR recomendados (EFV en el estudio SINGLE49, RAL en el estudio SPRING250 o DRV/r en el estudio FLAMINGO51), han mostrado una eficacia similar de ABC/3TC o TDF/FTC. Sin embargo, dichos ensayos clínicos no permiten establecer comparaciones formales puesto que o bien la elección de ITIAN no fue aleatorizada, quedando a criterio del investigador50,51, o las distintas combinaciones de ITIAN iban asociadas a un tercer fármaco también distinto49.
Finalmente, en un metaanálisis de ensayos clínicos no se observaron diferencias en la eficacia virológica de los tratamientos basados en ABC o TDF, aunque sí una mayor frecuencia de interrupciones debidas a efectos adversos con ABC52.
En el caso de seleccionar un régimen basado en ABC, se debe realizar siempre previamente la determinación del HLA-B*5701 del paciente, que de ser positivo contraindicaría su uso.
Recomendaciones sobre ITIAN
- •
Las combinaciones de ITIAN de elección para regímenes de inicio son TDF/FTC o ABC/3TC (A-I). Se recomienda su uso en coformulaciones (A-II).
- •
La combinación TDF/FTC debe utilizarse con precaución en pacientes con insuficiencia renal (A-II).
- •
La combinación ABC/3TC debe ser empleada con precaución en pacientes con CVP elevada (más de 100.000 copias/ml) cuando se combina con un ITINN o un IP/r distinto de LPV/r (A-II).
En España hay 4 ITINN comercializados (NVP, EFV, ETR y RPV). Son inductores de algunas isoenzimas del citocromo P450 y pueden interaccionar con otros fármacos. EFV se administra QD (un comprimido de 600mg/día, existiendo una presentación coformulada con TDF/FTC en un solo comprimido). Su principal limitación es la frecuente aparición de síntomas relacionados con el SNC, que aparecen al empezar su toma y que, aunque suelen ser leves y transitorios, pueden dar lugar a interrupciones del TAR. Esto hace que sea un fármaco a evitar en algunas circunstancias, tales como trabajos de riesgo que requieran concentración, turnos laborales cambiantes o trastornos psiquiátricos no controlados. Con EFV también existe riesgo de exantema durante las primeras semanas, lo que se debe advertir al paciente. EFV debe evitarse en mujeres gestantes o con deseo de gestación por el potencial riesgo de teratogenicidad.
RPV se administra QD (un comprimido de 25mg/día, existiendo también una presentación coformulada con TDF/FTC en un solo comprimido); debe administrarse con una comida y está contraindicado el uso de inhibidores de la bomba de protones. NVP se puede administrar tanto QD (400mg/día, en comprimido de liberación retardada) o como BID (200mg/12h), aunque durante los primeros 14días se administra un comprimido de 200mg/día. Está contraindicada en mujeres con más de 250 CD4+/μl y en varones con más de 400 CD4+/μl por presentar mayor riesgo de RHS. ETR (un comprimido de 200mg/12h) no está aprobada por la EMA para el TAR de inicio.
EFV se ha comparado en ensayos clínicos con otros ITINN. Tres ensayos clínicos han comparado el uso de EFV frente a RPV, ambos combinados con 2 ITIAN53-56. Los estudios ECHO53 y THRIVE54 incluyeron a pacientes adultos sin TAR previo y sin MR en el estudio genotípico basal. Los participantes fueron aleatorizados a recibir de forma ciega RPV o EFV junto a 2 ITIAN (TDF/FTC coformulado en el estudio ECHO y una pareja de ITIAN seleccionada por los investigadores en el estudio THRIVE, que en el 60% de los casos era también TDF/FTC). El análisis combinado de ambos estudios a las 96 semanas demostró la no-inferioridad de RPV con respecto a EFV. La tasa de fracaso virológico fue sin embargo superior con RPV en el subgrupo de pacientes con CVP al inicio del TAR mayor de 100.000copias/ml (17,6 vs. 7,6%), por lo que no se recomienda el uso de RPV/TDF/FTC en estos pacientes. El fallo virológico con RPV se asoció con mayor frecuencia a resistencia genotípica a otros ITINN y a ITIAN (especialmente por selección de la mutación M184I y M184V). La tolerabilidad fue mejor con RPV, con un menor número de discontinuaciones por efectos adversos y menos efectos adversos relacionados con el SNC55.
En el tercer ensayo clínico (STaR)56 se compararon de forma abierta 2 pautas de TAR basadas en regímenes de un solo comprimido en pacientes sin TAR previo: RPV/TDF/FTC frente a EFV/TDF/FTC. Se demostró la no-inferioridad de RPV/TDF/FTC frente a EFV/TDF/FTC en la población total tanto a las 48 como a las 96semanas. En el análisis de subgrupos RPV/TDF/FTC fue superior a EFV/TDF/FTC en los pacientes con CV igual o menor de 100.000copias/ml, no-inferior en los pacientes con CVP superior a 100.000copias/ml e inferior en pacientes con CVP mayor de 500.000copias/ml. Los pacientes tratados con RPV en relación a los tratados con EFV tuvieron una menor frecuencia de retirada del tratamiento por efectos adversos, una menor incidencia de efectos adversos del SNC y una menor frecuencia de efectos adversos psiquiátricos. No se dispone de comparaciones de RPV con otros FAR en el TAR de inicio.
NVP se ha comparado con EFV en el estudio 2NN57, en el que no logró demostrar la no-inferioridad. Además, el uso de NVP se asoció con mayor toxicidad.
EFV ha demostrado una eficacia superior frente a LPV/r58, SQV/r59 o APV/r60. El único IP/r que hasta el momento ha mostrado una eficacia equiparable a EFV es ATV/r. En el estudio ACTG 520244, la eficacia virológica resultó similar en los tratados con ATV/r que en los tratados con EFV, independientemente de que recibieran ABC/3TC o TDF/FTC. Entre los pacientes que experimentaron fracaso virológico, la emergencia de cepas con MR fue significativamente menor en los pacientes tratados con ATV/r que entre los tratados con EFV. El tiempo hasta el primer evento de seguridad y el primer evento de tolerabilidad fue significativamente más largo para los pacientes con ATV/r que para los pacientes con EFV cuando la pareja de ITIAN era ABC/3TC, pero no hubo diferencias en seguridad ni tolerabilidad entre ATV/r y EFV cuando la pareja de ITIAN era TDF/FTC.
Es en la comparación con los InInt donde se ha empezado a poner de manifiesto que es posible superar la eficacia demostrada con EFV. El estudio STARTMRK61 comparó el uso de EFV frente a RAL, asociados con TDF/FTC. El estudio mantuvo el diseño ciego durante los 5años de seguimiento. RAL resultó no-inferior a EFV durante los 3 primeros años de tratamiento, pero se mostró superior a partir del cuarto año. Además, se observó una mayor rapidez en la supresión virológica con RAL, efecto que posteriormente se ha observado con todas las pautas que incluyen un InInt, pero los datos de seguimiento no permiten afirmar que esta circunstancia tenga relevancia en la evolución clínica.
La combinación de EFV/FTC/TDF también ha sido evaluada en el estudio GS-US-236-010262, un ensayo clínico aleatorizado y doble ciego que comparó 2 regímenes administrados en un único comprimido: EVG/COBI/FTC/TDF y EFV/FTC/TDF. Se han comunicado datos a 3años que confirman la no-inferioridad de la pauta con EVG/COBI/FTC/TDF frente a EFV/FTC/TDF. No hubo diferencias significativas en lo que respecta a retirada del TAR por efectos adversos entre ambos brazos de tratamiento. El incremento en la creatinina sérica en la semana 48 fue mayor en los tratados con EVG/COBI/FTC/TDF que en los tratados con EFV/FTC/TDF, lo que se ha relacionado con cambios en la secreción tubular de creatinina y no a un efecto directo sobre el FG. Cabe resaltar que en este estudio se excluyeron los pacientes con un FG estimado inferior a 70ml/min y también la baja proporción de pacientes en fase avanzada (12% con menos de 200 CD4+/μl), lo que limita la generalización de los resultados a estos subgrupos.
En el estudio SINGLE49 se compararon de forma ciega EFV/FTC/TDF y DTG+ABC/3TC. Las tasas de respuesta (CVP inferior a 50copias/ml en la semana 48 por un análisis ITT, según el algoritmo snapshot de la FDA) fueron del 88% de los tratados con DTG+ABC/3TC y el 81% de los tratados con EFV/FTC/TDF (diferencia: 7,4%; IC95%: 2,5-12,3%), confirmándose la superioridad de DTG+ABC/3TC sobre EFV/FTC/TDF. La proporción de fracasos virológicos fue similar en ambos brazos (aproximadamente 4%). La proporción de interrupciones del tratamiento por efectos adversos fue, sin embargo, mayor en el brazo de EFV/FTC/TDF (10%) que en el brazo de DTG+ABC/3TC (2%). La detección de mutantes resistentes tras el fracaso virológico fue muy baja en ambos brazos de tratamiento, particularmente en el brazo de DTG+ABC/3TC, en el que no se detectaron MR al InInt en ningún caso. Al igual que el estudio anterior, la proporción de pacientes en fase avanzada fue baja (14%), por lo que tiene la misma limitación que aquel.
NVP se ha comparado con ATV/r, ambos combinados con TDF/FTC, en el ensayo ARTEN63, demostrándose la no-inferioridad de NVP frente a ATV/r a las 48semanas. La frecuencia de efectos adversos graves fue similar en ambos brazos, aunque las retiradas motivadas por efectos adversos resultaron más frecuentes con NVP que con ATV/r. Ninguno de los 28 pacientes con fracaso virológico del brazo de ATV/r seleccionó cepas de VIH con MR, mientras que ello ocurrió en 29 de los 44 pacientes con fracaso virológico del brazo de NVP.
Recomendaciones sobre ITINN
- •
La combinación de EFV/TDF/FTC se considera una opción preferente de tratamiento (A-I). La combinación de EFV+ABC/3TC debe evitarse en pacientes con CVP mayor de 100.000copias/ml (B-I).
- •
EFV está contraindicado durante el primer trimestre de la gestación. Se recomienda considerar otras opciones en mujeres que no utilicen métodos anticonceptivos eficaces. Asimismo, se debe evitar en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentración (A-III).
- •
Está contraindicado el uso de NVP en mujeres con cifras de linfocitos CD4+ superiores a 250células/μl y en varones con cifras superiores a 400células/μl (A-II).
- •
RPV no debe utilizarse en pacientes con CVP mayor de 100.000 copias/ml (A-II). En pacientes con CVP inferior a 100.000 la combinación RPV/TDF/FTC se considera como una opción preferente de tratamiento (A-I).
En el TAR de inicio solo se pueden usar IP cuando van potenciados con dosis bajas de RTV o COBI. En la actualidad los IP potenciados disponibles en la clínica son 6: ATV, DRV, LPV, FPV, SQV y TPV, aunque este último está aprobado por la EMA solamente para pacientes pretratados. Los IP son inductores e inhibidores del citocromo P450 y frecuentemente pueden originar interacciones farmacológicas. La elección final del IP se basará en datos de eficacia, tolerabilidad, farmacológicas, posología y farmacocinética. LPV se administra en comprimidos coformulados con RTV. COBI ha sido autorizado por la EMA para potenciar ATV o DRV.
Los IP se caracterizan por una elevada barrera genética que dificulta la selección de MR aun en situaciones desfavorables, como la baja adherencia. Por otra parte, son los FAR con peor perfil metabólico, asociándose a hiperlipidemia, aunque en menor medida en el caso de ATV y DRV. Las pautas basadas en IP suelen requerir la toma de un mayor número de comprimidos, aunque también aquí se ha mejorado con el uso de ATV/r o DRV/r que permiten regímenes de 3 comprimidos diarios.
LPV fue el primer IP desarrollado para utilizar potenciado y ha sido el referente de esta familia durante años. El resto de IP se han comparado con LPV/r en diversos ensayos clínicos demostrando la no-inferioridad de FPV/r64, SQV/r65, ATV/r66 y DRV/r67. LPV es el único IP comercializado en coformulación a dosis fijas con RTV. SQV/r y FPV/r tienen en la actualidad un uso muy limitado debido a que no aportan ventajas significativas en cuanto a simplicidad o tolerabilidad con los otros FAR de la familia.
DRV/r se utiliza en el TAR de inicio en dosis QD (un comprimido de 800mg/día potenciado con 100mg de RTV o 150mg de COBI). El estudio ARTEMIS67 comparó DRV/r (800/100mg, QD) frente a LPV/r en 689 pacientes que recibieron además TDF/FTC coformulados. A las 48semanas DRV/r resultó no-inferior a LPV/r. Los pacientes tratados con DRV/r presentaron menos diarrea de grado 2-4 y menores elevaciones de colesterol y triglicéridos que los tratados con LPV/r. A las 96semanas, DRV/r resultó superior a LPV/r (en el análisis TLOVR, no en el snapshot). El 4% de los pacientes de la rama de DRV/r y el 9% de los la rama de LPV/r abandonaron el tratamiento asignado. DRV/r se ha comparado con DTG en un ensayo clínico de TAR de inicio (FLAMINGO)51, en el que se observó menor eficacia a 48semanas con DRV/r, hecho motivado fundamentalmente por una mayor tasa de abandonos y efectos adversos.
ATV/r, se ha comparado también con LPV/r y con EVG/COBI en el TAR de inicio. El estudio CASTLE66 comparó la combinación TDF/FTC+ATV/r QD con la combinación TDF/FTC+LPV/r BID, demostrando la no-inferioridad de ATV/r frente a LPV/r a 48 y a 96semanas. ATV/r mostró mejor perfil lipídico (colesterol total, triglicéridos y colesterol no-HDL). La ictericia e hiperbilirrubinemia fueron más frecuentes en el grupo de ATV/r mientras que la diarrea y las náuseas lo fueron en el grupo de LPV/r. No hubo diferencias significativas en abandonos entre los 2 brazos de tratamiento. El estudio GS-US-236-010362, un ensayo clínico aleatorizado a doble ciego, comparó EVG/COBI/FTC/TDF (coformulados en un solo comprimido) y ATV/r+FTC/TDF, confirmando la no-inferioridad de EVG/COBI/FTC/TDF frente a ATV/r+FTC/TDF. En el grupo de EVG/COBI/FTC/TDF se efectuó genotipificación del VIH tras el fracaso virológico en 12 pacientes, en 5 de los cuales se objetivaron mutaciones, que conferían resistencia a los InInt en 4 de ellos (Q148R en 2, N155H en 2, T66I en 1 y E92Q en 1). En el grupo de ATV/RTV+FTC/TDF se realizó un estudio genotípico del VIH en 8 pacientes, con fracaso virológico, en ninguno de los cuales se detectaron mutaciones de resistencia. Ambos regímenes se toleraron bien y las interrupciones del tratamiento por efectos adversos fueron escasas en ambos brazos68.
La utilización de COBI como potenciador de los IP se valoró en el estudio 11469, en el que se comparó de forma ciega COBI frente a RTV como potenciador de ATV+TDF/FTC, en 692 pacientes sin TAR previo y con un FG estimado igual o superior a 70ml/min. Se demostró la no-inferioridad del tratamiento potenciado con COBI, aunque el estudio no fue capaz de demostrar ventajas significativas de tolerabilidad con el nuevo potenciador. COBI ha sido aprobado por la EMA como potenciador de ATV o DRV a dosis de 150mg/día. Por el momento, en España solo se comercializará en una coformulación a dosis única junto con EVG/TDF/FTC y no de forma aislada.
Existen diversas estrategias de uso de un IP/r junto a un segundo fármaco en el tratamiento de inicio (biterapia), aunque en la mayoría de los casos se trata de estudios pequeños, sin potencia para establecer recomendaciones. Los mejores resultados hasta este momento se han comunicado con la combinación LPV/r+3TC, que ha demostrado la no-inferioridad frente a LPV/r+2 ITIAN70, por lo que podría considerarse una alternativa a la triple terapia convencional cuando no se pueda utilizar TDF ni ABC. La combinación RAL+LPV/r también ha demostrado la no- inferioridad sobre LPV/r+TDF/FTC71, pero los pacientes incluidos en el estudio tenían CVP muy bajas y no es posible generalizar sus resultados.
Recomendaciones sobre IP
- •
Como regímenes basados en IP preferentes se recomiendan ATV/r QD+TDF/FTC, y DRV/r QD+TDF/FTC (A-I). La combinación de ATV/r+ABC/3TC también se considera preferente, aunque debe usarse con precaución en pacientes con CVP superior a 100.000copias/ml (A-I).
- •
Se consideran regímenes alternativos LPV/r, BID o QD+TDF/FTC o ABC/3TC (B-I). Es posible utilizar también la combinación DRV/r+ABC/3TC, aunque no ha sido formalmente investigada en ningún ensayo clínico (B-III).
- •
ATV y DRV pueden ser potenciados indistintamente con 100mg de RTV o 150mg de COBI (B-II).
- •
LPV/r+3TC y LPV/r+RAL pueden ser una alternativa a la triple terapia convencional cuando no se pueda utilizar TDF ni ABC (B-I).
Existen en este momento 3 InInt aprobados por la EMA en el TAR de inicio: RAL, EVG y DTG, aunque este no ha sido comercializado hasta este momento.
RAL fue el primer InInt comercializado y con el que se tiene la mayor experiencia. Se utiliza en una pauta administrada 2 veces al día (400mg BID), puesto que la administración de los 2 comprimidos juntos una única vez al día demostró una menor eficacia en un ensayo clínico de pacientes sin TAR previo72. Combinado con TDF/FTC, RAL BID ha demostrado ser no-inferior a EFV, alcanzando superior eficacia tras 4 y 5años de seguimiento61. EVG requiere potenciación farmacológica. Se ha comercializado coformulado con COBI (que hace la función de potenciador) +TDF/FTC en un solo comprimido. EVG/COBI/TDF/FTC ha demostrado la no-inferioridad con respecto a EFV/TDF/FTC62 y a ATV/r+TDF/FTC68 (ver los apartados de ITINN e IP) en estudios con una duración de 3años. Esta combinación está contraindicada en pacientes con un FG estimado inferior a 70ml/min y debe utilizarse con precaución en aquellos con un FG entre 70 y 90ml/min.
Recientemente el Committee for Medicinal Products for Human Use (CHMP) de la EMA ha recomendado la aprobación del uso de DTG. Este nuevo InInt se administra como un comprimido de 50mg una vez al día y no necesita potenciación. Se ha comparado en estudios en faseiii con FAR de las 3 familias actualmente recomendadas en el TAR de inicio, mostrando una eficacia superior a EFV49 y a DRV/r51 (ver los apartados de ITINN e IP). La comparación con RAL se realizó en un estudio doble ciego (SPRING-2) que confirmó la no-inferioridad de DTG50. Cabe destacar que no se ha seleccionado ninguna mutación de resistencia a DTG en ninguno de los 3 ensayos clínicos en faseiii de inicio de TAR, lo que hace pensar que DTG presenta una barrera genética superior a la de otros InInt, aunque se deberá confirmar cuando se disponga de mayor experiencia y seguimiento.
Recomendaciones
- •
RAL puede emplearse como tratamiento de inicio combinado con TDF/FTC (A-I) o ABC/3TC (A-I).
- •
Las combinaciones EVG/COBI/TDF/FTC (que no debe usarse en pacientes con FG estimado menor de 70ml/min) (A-I) y DTG con ABC/3TC (A-I) o TDF/FTC (A-I) pueden utilizarse como regímenes de TAR de inicio (las que incluyen DTG cuando este se comercialice).
Se considera que la CVP es indetectable cuando es menor de 50copias/ml. La mayoría de los ensayos clínicos de cambio de TAR incluyeron pacientes que habían mantenido este nivel de supresión virológica durante al menos 6meses. Los resultados son por lo tanto aplicables preferiblemente a pacientes con este período de supresión. Como norma general, cuanto más prolongado sea el período de supresión virológica, más probable es que el cambio de TAR no se asocie a fracaso virológico.
Objetivos del cambio de un régimen de tratamiento antirretroviral eficazExisten muchos motivos para cambiar un régimen de TAR eficaz (toxicidad, presencia de comorbilidades, interacciones farmacológicas, disminución del número de comprimidos o de dosis diarias, requerimientos dietéticos, embarazo y coste del TAR), cada uno de los cuales puede constituir un objetivo para el cambio. Sin embargo, todos los casos de cambio de TAR eficaz comparten el objetivo común y prioritario de mantener la CVP indetectable. Antes del cambio, el clínico debe realizar una evaluación minuciosa de la historia de fracasos virológicos del paciente y de los estudios de resistencias; además, debe valorar diferentes aspectos del nuevo régimen, como su potencial toxicidad, sus interacciones farmacológicas, sus restricciones dietéticas y su actividad sobre el VHB (en caso de que el paciente esté coinfectado por el VHB).
El cambio puede ser proactivo, cuando se realiza preventivamente, o reactivo, cuando el régimen actual ha dejado de ser el ideal para el paciente debido a alguno de los motivos anteriormente reseñados.
¿Cuándo se debe cambiar un régimen de tratamiento antirretroviral eficaz?El cambio proactivo es recomendable cuando existen firmes evidencias que avalan que el paciente tiene mayor riesgo de presentar un efecto adverso grave o irrecuperable si se mantiene el TAR actual que si se cambia. Un ejemplo paradigmático es la lipoatrofia causada por ITIAN timidínicos.
El cambio reactivo es obligado si el efecto adverso desaparece tras el cambio de TAR, como, por ejemplo, los efectos del SNC causados por EFV.
Los efectos adversos que motivan el cambio precoz del TAR inicial suelen ser de tal intensidad que frecuentemente el cambio se realiza antes de haberse alcanzado la supresión de la replicación viral. Es obvio que si un paciente tiene la CVP suprimida es porque es capaz de continuar tomando un TAR eficaz. El clínico no debe olvidar que en ocasiones ese nivel de adherencia se consigue gracias al sacrificio del paciente, que es capaz de sobrellevar efectos adversos que pueden ser erróneamente entendidos como inevitables. El médico no debe asumir que un TAR es óptimo para su paciente solo porque la CVP está suprimida. Este comité recomienda que en todas las revisiones el clínico pregunte con detalle acerca de la dificultad del paciente para cumplir adecuadamente con el TAR actual.
Consideraciones virológicas acerca del cambio de un régimen de tratamiento antirretroviral eficazDespués de efectuar un cambio de FAR —independientemente de las clases de estos implicadas en el cambio—, el mantenimiento de la supresión virológica es la regla en pacientes sin historia de fracasos virológicos. El cambio de TAR es más complicado en pacientes con fracasos virológicos previos que pueden haber causado el archivo de MR. En esta situación se debe diseñar una nueva pauta que no reduzca la barrera genética del régimen. Esto es crítico cuando se cambia un TAR que incluye IP potenciados con RTV. En esta situación se debe diseñar una nueva pauta que tenga en cuenta una eventual resistencia archivada, bien sea confirmada o bien sea sospechada.
Recomendación
- •
El cambio desde un pauta con 2 ITIAN más un IP/r a 2 ITIAN más un ITINN, RAL o ATV no potenciado con RTV solo debe hacerse si se puede garantizar la actividad antiviral de los 2 ITIAN y la del tercer fármaco acompañante (A-I).
Existen suficientes datos para hacer una recomendación fuerte de cambio de FAR (tabla 4) en los siguientes escenarios:
- •
Cambio proactivo de ITIAN timidínicos (ZDV, d4T) por ABC o TDF. En esta situación hay evidencias de alta calidad que avalan que los beneficios del cambio superan ampliamente el riesgo de aparición o empeoramiento de lipoatrofia, si se continúa el tratamiento con análogos timidínicos.
- •
Cambio reactivo de EFV en pacientes con efectos adversos del SNC.
- •
Cambio reactivo de IP/r si existe diarrea que interfiere con la calidad de vida del paciente.
- •
Cambio reactivo de TDF en pacientes con disminución del FG estimado o disfunción tubular. No hay datos para precisar un umbral de FG o parámetros de tubulopatía a partir del cual el cambio sea obligado. Recomendamos emplear el juicio clínico teniendo en cuenta la función renal/tubular antes del inicio de TDF, la edad y la existencia de otros factores que puedan empeorar la función renal.
- •
Cambio reactivo de TDF en pacientes con osteoporosis u osteomalacia. No hay datos para precisar un umbral de densidad mineral ósea a partir del cual el cambio sea obligado. Es preciso descartar múltiples causas secundarias, por ejemplo hipovitaminosisD, antes de atribuir la disminución de la densidad mineral ósea exclusivamente a TDF.
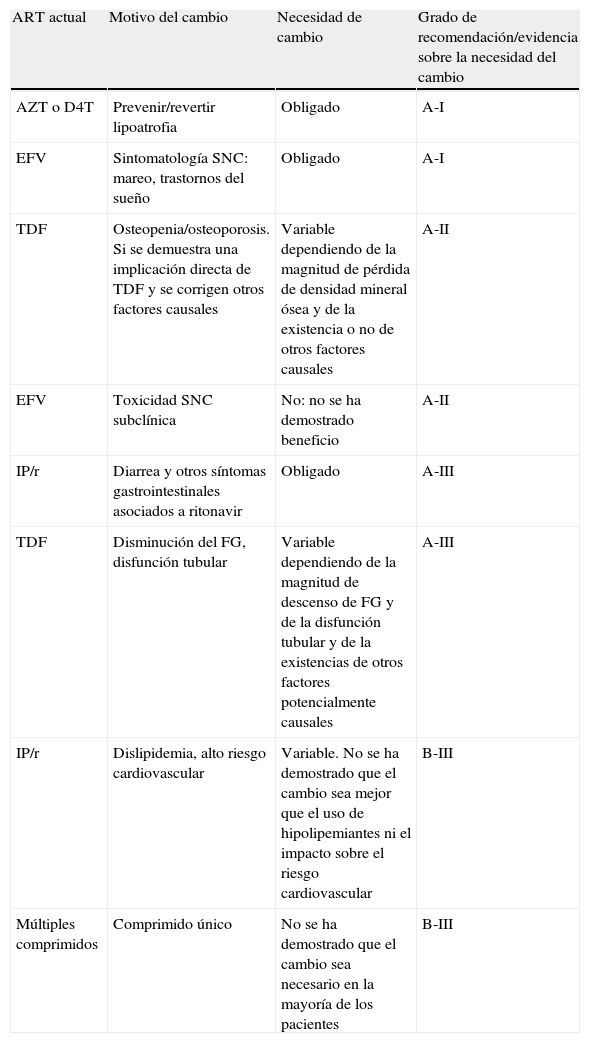
Recomendaciones sobre la necesidad de cambio de TAR asumiendo que se puede mantener la supresión virológica tras el mismo
| ART actual | Motivo del cambio | Necesidad de cambio | Grado de recomendación/evidencia sobre la necesidad del cambio |
| AZT o D4T | Prevenir/revertir lipoatrofia | Obligado | A-I |
| EFV | Sintomatología SNC: mareo, trastornos del sueño | Obligado | A-I |
| TDF | Osteopenia/osteoporosis. Si se demuestra una implicación directa de TDF y se corrigen otros factores causales | Variable dependiendo de la magnitud de pérdida de densidad mineral ósea y de la existencia o no de otros factores causales | A-II |
| EFV | Toxicidad SNC subclínica | No: no se ha demostrado beneficio | A-II |
| IP/r | Diarrea y otros síntomas gastrointestinales asociados a ritonavir | Obligado | A-III |
| TDF | Disminución del FG, disfunción tubular | Variable dependiendo de la magnitud de descenso de FG y de la disfunción tubular y de la existencias de otros factores potencialmente causales | A-III |
| IP/r | Dislipidemia, alto riesgo cardiovascular | Variable. No se ha demostrado que el cambio sea mejor que el uso de hipolipemiantes ni el impacto sobre el riesgo cardiovascular | B-III |
| Múltiples comprimidos | Comprimido único | No se ha demostrado que el cambio sea necesario en la mayoría de los pacientes | B-III |
Este panel distingue entre la fuerza de la recomendación para cambiar el TAR y la fuerza de la recomendación para priorizar una pauta de TAR alternativa. Recomendamos que el clínico consulte la tabla 4 para intentar responder a la pregunta ¿debo cambiar el TAR? Una vez establecida la necesidad del cambio, las tablas 5 y 6 gradúan la evidencia para recomendar una nueva pauta.
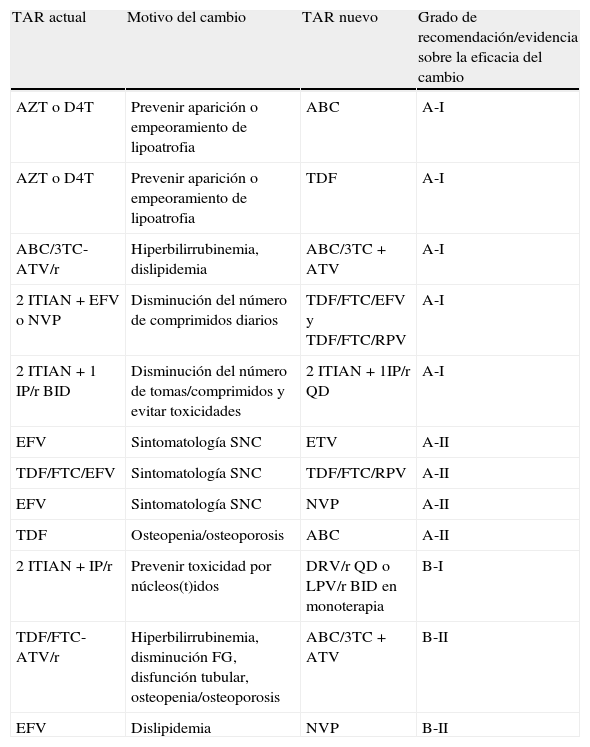
Recomendaciones sobre el cambio entre antirretrovirales de la misma clase según el motivo del mismo, ordenados por evidencia sobre la eficacia del cambio, asumiendo que se puede mantener la supresión virológica tras el cambio de TAR
| TAR actual | Motivo del cambio | TAR nuevo | Grado de recomendación/evidencia sobre la eficacia del cambio |
| AZT o D4T | Prevenir aparición o empeoramiento de lipoatrofia | ABC | A-I |
| AZT o D4T | Prevenir aparición o empeoramiento de lipoatrofia | TDF | A-I |
| ABC/3TC-ATV/r | Hiperbilirrubinemia, dislipidemia | ABC/3TC+ATV | A-I |
| 2 ITIAN+EFV o NVP | Disminución del número de comprimidos diarios | TDF/FTC/EFV y TDF/FTC/RPV | A-I |
| 2 ITIAN+1 IP/r BID | Disminución del número de tomas/comprimidos y evitar toxicidades | 2 ITIAN+1IP/r QD | A-I |
| EFV | Sintomatología SNC | ETV | A-II |
| TDF/FTC/EFV | Sintomatología SNC | TDF/FTC/RPV | A-II |
| EFV | Sintomatología SNC | NVP | A-II |
| TDF | Osteopenia/osteoporosis | ABC | A-II |
| 2 ITIAN+IP/r | Prevenir toxicidad por núcleos(t)idos | DRV/r QD o LPV/r BID en monoterapia | B-I |
| TDF/FTC-ATV/r | Hiperbilirrubinemia, disminución FG, disfunción tubular, osteopenia/osteoporosis | ABC/3TC+ATV | B-II |
| EFV | Dislipidemia | NVP | B-II |
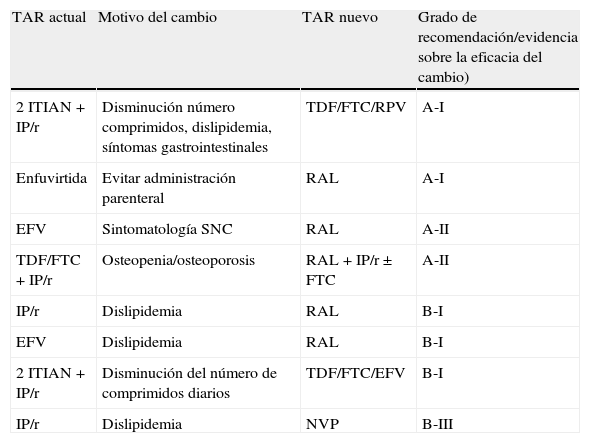
Recomendaciones sobre cambios a antirretrovirales de una nueva clase, según el motivo del mismo, ordenados por evidencia sobre la eficacia del cambio, asumiendo que se puede mantener la supresión virológica tras el cambio de TAR
| TAR actual | Motivo del cambio | TAR nuevo | Grado de recomendación/evidencia sobre la eficacia del cambio) |
| 2 ITIAN+IP/r | Disminución número comprimidos, dislipidemia, síntomas gastrointestinales | TDF/FTC/RPV | A-I |
| Enfuvirtida | Evitar administración parenteral | RAL | A-I |
| EFV | Sintomatología SNC | RAL | A-II |
| TDF/FTC+IP/r | Osteopenia/osteoporosis | RAL+IP/r±FTC | A-II |
| IP/r | Dislipidemia | RAL | B-I |
| EFV | Dislipidemia | RAL | B-I |
| 2 ITIAN+IP/r | Disminución del número de comprimidos diarios | TDF/FTC/EFV | B-I |
| IP/r | Dislipidemia | NVP | B-III |
Solo se han incluido cambios para los que al menos existe un ensayo clínico pertinente y con análisis sobre el efecto adverso particular.
La recomendación es fuerte si existe al menos un ensayo clínico de calidad que avale una mejoría del balance riesgo/beneficio después del cambio.
La recomendación puede ser débil para avalar el cambio de TAR, pero una vez que el cambio se ha decidido la recomendación sobre la pauta a cambiar puede ser fuerte. Un ejemplo apropiado es el cambio desde múltiples comprimidos a un comprimido único simplemente con el objetivo de simplificación. Aunque hay evidencia preliminar de que el TAR con un solo comprimido podría aumentar la adherencia y disminuir las hospitalizaciones73, en este momento el comité no considera que exista evidencia definitiva para hacer una recomendación fuerte que respalde este cambio en la mayoría de los pacientes. Sin embargo, si el clínico ha decidido que en un paciente la simplificación posológica está indicada, entonces el comité sí hace una recomendación fuerte sobre las pautas más apropiadas.
Cambio entre antirretrovirales de la misma claseInhibidores de la transcriptasa inversa análogos de nucleósidosCambio de d4T o ZDV por TDF o ABCVarios ensayos clínicos aleatorizados74-77 han demostrado que el cambio de d4T o ZDV por ABC o TDF es seguro virológicamente y produce una mejoría o estabilización de la pérdida de la grasa subcutánea. Si se realiza determinación del HLA-B*5701, no parecen existir diferencias entre ABC y TDF en cuanto al mantenimiento de la supresión virológica.
Recomendación
- •
Cambio proactivo de d4T o ZDV a TDF o ABC para prevenir o tratar de revertir la lipoatrofia asociada al tratamiento con ITIAN timidínicos (A-I).
Tres ensayos clínicos aleatorizados78-80 han demostrado que el cambio de ABC/3TC a TDF/FTC es seguro virológicamente y produce disminuciones de colesterol LDL y total y de triglicéridos, sin cambios en el cociente colesterol total/HDL. La caída del FG estimado es mayor en los pacientes que cambian a TDF/FTC especialmente si el tercer fármaco es un IP/r.
Recomendación
- •
La asociación de ABC con un incremento en la incidencia de eventos cardiovasculares es muy controvertida. Este comité no puede hacer una recomendación en el momento actual sobre fuerza de la evidencia para realizar un cambio de ABC/3TC a TDF/FTC.
TDF se ha asociado con una disminución de la densidad mineral ósea independiente de la presencia o no de otros factores de riesgo de osteoporosis, la cual es mayor que con ABC81,82. En un ensayo clínico aleatorizado con un reducido número de pacientes con osteopenia u osteoporosis, el cambio de TDF a ABC produjo un incremento de la densidad mineral ósea en el fémur pero no en la columna vertebral, si bien la ausencia de control por otros factores de riesgo de pérdida de densidad mineral ósea constituye una limitación del mismo83.
Recomendación
- •
El cambio de TDF a ABC es una opción en pacientes con osteopenia u osteoporosis asociada al uso de TDF, siempre que el HLA-B*5701 sea negativo (A-II).
Dos ensayos clínicos no aleatorizados con un reducido número de pacientes84,85 sugieren que el cambio es seguro virológicamente y puede mejorar la toxicidad persistente del SNC causada por EFV. La larga vida media de EFV y su capacidad de inducción enzimática sobre el CYP3A4 origina una disminución de las concentraciones plasmáticas de RPV que parece no tener trascendencia en pacientes que ya han alcanzado la supresión virológica. No hay datos que apoyen este cambio en pacientes con replicación del VIH no suprimida.
Recomendación
- •
En pacientes con efectos adversos del SNC causados por EFV/TDF/FTC el cambio a RPV/TDF/FTC es una de las opciones que puede mejorar los síntomas neuropsicológicos asociados a EFV (A-II). No hay datos para recomendar un cambio proactivo en pacientes sin síntomas del SNC ni datos comparativos de este cambio frente al de otros FAR que tampoco causan efectos adversos del SNC.
Este cambio es seguro virológicamente y puede mejorar la toxicidad persistente del SNC causada por EFV86. En pacientes estables sin efectos adversos del SNC causados por EFV no hubo cambios apreciables en la sintomatología del SNC87.
Recomendación
- •
En pacientes con efectos adversos del SNC causados por EFV, el cambio a ETR es una opción que puede mejorar los síntomas neuropsicológicos asociados a EFV (A-II). No hay datos para recomendar un cambio proactivo en pacientes sin síntomas del SNC ni datos comparativos de este cambio frente al de otros FAR que tampoco causan efectos adversos del SNC.
Un ensayo clínico aleatorizado con un reducido número de pacientes y un subanálisis post hoc de un ensayo clínico sugieren que el cambio es seguro virológicamente y puede mejorar la toxicidad persistente del SNC y la elevación del colesterol LDL causada por EFV. Tanto EFV como NVP son inductores del CYP3A4. Debido a la larga vida media de EFV y a su efecto inductor enzimático, cuando se cambia de EFV a NVP, las concentraciones de NVP pueden ser infraterapéuticas si esta se inicia a dosis de 200mg una vez al día. Cuando se realiza el cambio, NVP puede utilizarse a dosis completa (400mg/día) sin necesidad de escalada de dosis durante 2 semanas88-90.
En pacientes con CVP suprimida no se aplica la limitación de uso de NVP según la cifra de linfocitos CD4+ que se emplea en los pacientes sin TAR previo. Múltiples estudios en pacientes con CVP indetectable91-93 han demostrado que el riesgo de hepatotoxicidad de NVP no se incrementa cuando este FAR se administra por primera vez a pacientes con cifras de linfocitos CD4+ superiores a las recomendadas para el TAR de inicio.
Recomendación
- •
En pacientes con efectos adversos del SNC causados por EFV, el cambio a NVP es una opción que puede mejorar los síntomas neuropsicológicos (A-II). No hay datos para recomendar un cambio proactivo en pacientes sin síntomas del SNC ni datos comparativos de este cambio frente al de otros FAR que tampoco causan efectos adversos del SNC. El cambio también es una opción en pacientes con elevación del colesterol LDL causada por EFV (A-II).
Un ensayo clínico abierto ha demostrado que en pacientes tratados con 2 ITIAN y EFV o NVP el cambio a EFV/TDF/FTC es seguro virológicamente94.
Recomendación
- •
El cambio a EFV/TDF/FTC es una opción en pacientes que reciben TAR con EFV y NVP en los que convenga disminuir el número de comprimidos diarios (A-I).
Este cambio solo se puede realizar si ABC y 3TC son completamente activos. Un ensayo clínico ha demostrado que el cambio es seguro virológicamente y se asocia a una disminución de los niveles de bilirrubina, colesterol total, LDL y triglicéridos95.
Recomendación
- •
En pacientes que reciben tratamiento con ATV/r+ABC/3TC el cambio a ATV+ABC/3TC es una opción de simplificación cuando sea deseable evitar RTV debido a la potenciación de la toxicidad de ATV (hiperbilirrubinemia) o a toxicidad (dislipidemia, diarrea) o riesgo de interacciones con RTV (A-I).
Un ensayo clínico aleatorizado96 ha demostrado que el cambio de ATV/r+TDF/FTC a ATV+ABC/3TC es seguro virológicamente y se asocia con disminución de la concentración de bilirrubina plasmática y con mejoría de los biomarcadores de disfunción tubular renal y óseos. La relevancia clínica de los cambios en los biomarcadores tubulares y óseos es desconocida.
Recomendación
- •
En pacientes que reciben tratamiento con ATV/r+TDF/FTC el cambio a ATV+ABC/3TC es una opción para aquellos en los que convenga evitar el uso tanto de TDF como de RTV (A-II).
Un ensayo clínico de brazo único efectuado con un reducido número de pacientes tratados con un IP/r+TDF/FTC y que presentaban disminución de la densidad mineral ósea (T score de al menos –1) ha demostrado que el cambio de TDF a RAL (con o sin FTC) mantiene la supresión de la replicación vírica y se asocia a una mejoría significativa de la densidad mineral ósea en fémur y cadera, así como de los marcadores de remodelación ósea97.
Recomendación
- •
El cambio de TDF a RAL, en pacientes que además reciben un IP/r, es una opción en pacientes con disminución de la densidad mineral ósea (A-II).
En pacientes que toleran EFV, un ensayo clínico aleatorizado y doble ciego98 ha demostrado que el cambio de EFV a RAL mejora los niveles de lípidos (colesterol total y LDL y triglicéridos), así como que en algunos de ellos mejora las escalas de ansiedad y de estrés, manteniendo la supresión virológica.
Recomendación
- •
El cambio de EFV a RAL es una opción en pacientes con efectos adversos del SNC causados por EFV (A-II). No hay datos para recomendar un cambio proactivo en pacientes sin síntomas del SNC ni datos comparativos de este cambio frente al de otros FAR que tampoco causan efectos adversos del SNC.
- •
El cambio de EFV a RAL es una opción en pacientes con dislipidemia causada por EFV (A-I).
Un ensayo clínico aleatorizado99 ha demostrado que el cambio de ENF a RAL es seguro virológicamente y evita la administración parenteral.
Recomendación
- •
El cambio de ENF a RAL es un opción segura que evita la administración parenteral de enfuvirtida (A-I).
Un ensayo clínico abierto94 ha demostrado que en pacientes tratados con 2 ITIAN y un IP el cambio a EFV/TDF/FTC mantiene la supresión de la replicación vírica y se asocia con una mejoría de los triglicéridos y el colesterol HDL, pero que son más frecuentes los efectos adversos de EFV sobre el SNC.
Recomendación
- •
El cambio a EFV/TDF/FTC es una opción en los pacientes que reciben TAR con IP que permite disminuir el número de comprimidos diarios, pero es posible que experimenten los efectos adversos del SNC de EFV (B-I).
Múltiples estudios100-102 han demostrado que el cambio de IP —mayoritariamente no potenciados con RTV— a NVP mantiene suprimida la replicación viral, aunque se asocia con una mayor incidencia de efectos adversos hepáticos. No hay datos relevantes para el cambio desde un inhibidor de la proteasa potenciado con RTV.
Recomendación
- •
El cambio de un IP a NVP podría ser una opción en pacientes que reciben un IP potenciado con RTV cuando se desee evitar los efectos adversos de este (B-III).
Un ensayo clínico abierto103 ha demostrado que el cambio desde un régimen de 2 ITIAN+1 IP/r a la coformulación RPV/TDF/FTC es seguro virológicamente y se asocia a una mejoría en los niveles de colesterol total y LDL, del cociente colesterol total/HDL y de los triglicéridos, así como a una mejoría de los efectos adversos gastrointestinales causados por los IP.
Recomendación
- •
El cambio de un régimen de TAR con 2 ITIAN+1 IP a la coformulación RPV/TDF/FTC es una opción en pacientes con alteraciones gastrointestinales o dislipidemia que permite además disminuir el número de comprimidos diarios (A-I).
Dos ensayos clínicos104,105 han demostrado que el cambio de IP a RAL es seguro virológicamente si los 2 ITIAN son completamente activos. El cambio se asocia con una mejoría de los niveles de colesterol total y LDL, del cociente colesterol total/HDL y de los triglicéridos. Los resultados del estudio SPIRAL105 sugieren que si el tiempo de supresión viral es muy prolongado, el riesgo de fracaso virológico es menor, independientemente de la actividad de los ITIAN.
Recomendación
- •
El cambio a RAL más 2 ITIAN activos es una opción para pacientes con dislipidemia que reciben TAR con ITIAN+1 IP/r (B-I).
La monoterapia con DRV/r una vez al día106 o LPV/r 2 veces al día107 no han demostrado a largo plazo la no-inferioridad frente a la terapia triple en los análisis por intención de tratar, si se considera el cambio de terapia aleatorizada igual a fracaso. La no inferioridad sí se ha demostrado en los análisis por intención de tratar pura (ignorando los cambios de tratamiento, fundamentalmente las reinducciones con los ITIAN retirados previamente). No existe acuerdo sobre cuál de estos análisis es más relevante clínicamente.
En los ensayos clínicos de monoterapia con DRV/r o LPV/r con seguimiento virológico adecuado no se ha demostrado un incremento en el riesgo de selección de resistencia a inhibidores de la proteasa108. En los pacientes con monoterapia tampoco se ha demostrado un aumento en el riesgo de deterioro neurocognitivo asociado al VIH109, replicación viral discordante en el líquido cefalorraquídeo, aumento de los biomarcadores de inflamación110 o incremento del ADN celular del VIH integrado111.
Comparada con la TAR triple, la monoterapia con DRV/r o LPV/r no ha demostrado beneficios a largo plazo aparte del ahorro económico. Sin embargo, tampoco hay datos empíricos que justifiquen que si un paciente es capaz de mantener la supresión virológica con DRV/r o LPV/r en monoterapia sea necesario utilizar además 2 ITIAN.
Este panel considera que no existe evidencia suficiente para recomendar el cambio proactivo a monoterapia con DRV/r o LPV/r en aquellos pacientes que cumplan los criterios para el uso de esta estrategia. Sin embargo el panel considera que tampoco existen evidencias para oponerse al uso de monoterapia con DRV/r o LPV/r si el clínico quiere evitar o prevenir los efectos adversos causados por los ITIAN. Los factores que predicen el éxito de la monoterapia son: adherencia elevada, supresión virológica prolongada y profunda112, y cifra nadir de linfocitos CD4+ mayor de 100células/μl113.
La monoterapia con ATV/r no se recomienda debido a los peores resultados obtenidos en ensayos clínicos114,115.
Recomendación
- •
La monoterapia con DRV/r una vez al día o con LPV/r 2 veces al día es una opción para evitar o prevenir los efectos adversos causados por los ITIAN si el paciente cumple los siguientes criterios: 1)ausencia de hepatitis crónica B; 2)CVP menor de 50copias/ml durante al menos 6meses; 3)ausencia de mutaciones en el gen de la proteasa o de fracasos virológicos previos a IP, y 4)buena adherencia al TAR (B-I).
Después de un cambio de TAR en este contexto, se debe evaluar en un plazo de 3-6semanas el mantenimiento de la supresión virológica y las determinaciones de laboratorio pertinentes en función del motivo del cambio (lipidograma, función renal, etc.). Una vez demostrada la continuación de la supresión virológica, el paciente puede continuar con las revisiones periódicas cada 4 o 6meses.
Fracaso del tratamiento antirretroviralDefiniciones- •
Fracaso virológico. Dos determinaciones confirmadas de CVP superior a 50 copias/ml tras 24 semanas del inicio del TAR. Aunque algunas evidencias sugieren que CVP detectables inferiores a 50 copias/ml pueden predecir repuntes de la CVP, su importancia es controvertida. El fracaso virológico puede ocurrir con o sin selección de MR. En personas con CVP basales muy elevadas (más de 300.000 copias/ml) pueden precisarse más de 24 semanas en obtener una CV inferior a 50 copias/ml.
- •
Repuntes virológicos transitorios («blips»). Valores aislados y transitorios de CVP entre 50-200 copias/ml. Los blips no se asocian a un mayor riesgo de fracaso virológico, aunque algunos autores han reportado mayor riesgo de fracaso virológico y evolución genética cuando son frecuentes. Se recomienda evaluar la adherencia y la barrera genética del TAR116.
- •
Fracaso inmunológico. Incapacidad de obtener una cifra adecuada de linfocitos CD4+ a pesar de mantener una CVP menor de 50 copias/ml. No se recomienda modificar el TAR, con excepción de FAR o combinaciones como ZDV o TDF+ddI.
En España, la incidencia de fracaso virológico en pacientes que inician TDF/FTC+1 ITINN o 1 IP/r es del 13%117. No existen datos de incidencia o prevalencia de fracaso virológico en pacientes expuestos a varios regímenes de TAR.
Los factores que determinan el fracaso virológico pueden ser:
- –
Dependientes del paciente: adherencia al tratamiento.
- –
Dependientes del FAR: errores de dosificación, potencia del TAR, concentraciones plasmáticas inadecuadas por malabsorción, interacciones medicamentosas o relacionadas con la alimentación.
- –
Dependientes del VIH: pre-existencia de MR frente a alguno de los FAR que componen el TAR.
Se trata de conseguir de nuevo la supresión viral mantenida. Para ello debe instaurarse un nuevo régimen terapéutico con 3, o al menos 2, FAR activos. El TAR de rescate no debe retrasarse para evitar la acumulación de MR y la elevación de la CVP.
Estrategias para mejorar el éxito de los regímenes de tratamiento antirretroviral de rescate- 1.
Facilitar la adherencia al TAR. Identificar las causas de mala adherencia e intentar corregirlas; pautar un TAR cómodo y bien tolerado.
- 2.
Pruebas de resistencia. Los estudios genotípicos o fenotípicos de resistencia mejoran la eficacia del TAR de rescate118, especialmente cuando la prueba se realiza mientras el paciente recibe el TAR que ha fracasado. Cuando se dispone de estudios genotípicos previos, deben valorarse todas las MR acumuladas en los sucesivos fracasos virológicos. Algunos IP/r y ETR disponen de un índice ponderado (score) de resistencia genotípica que cuantifica el peso de cada una de las MR y establece un índice de respuesta al fármaco119 Estos score son accesibles en Internet (http://hivdb.stanford.edu/;www.retic-ris.net). La ausencia de selección de MR durante un fracaso virológico orienta a falta de adherencia, o realización inadecuada de la prueba genotípica (más de 4 semanas sin TAR). En estos casos puede pautarse el TAR previo, valorar la respuesta y realizar una nueva prueba de resistencia.
- 3.
Tropismo viral. Debe determinarse en cada fracaso virológico, excepto en los casos con tropismo previo no-R5. El tropismo en ADN-proviral permite obtener resultados con viremias bajas.
- 4.
Revisar el historial terapéutico del paciente. Identificar FAR que no fueron tolerados o provocaron toxicidad grave e identificar fracasos virológicos previos durante el tratamiento con FAR de barrera genética baja que hayan podido seleccionar mutaciones no detectadas en las pruebas de resistencia.
- 5.
Monitorización de concentraciones plasmáticas de FAR. Debe reservarse para situaciones especiales, incluyendo sospecha de mal cumplimiento terapéutico.
- 1.
CVP entre 50 y 200 copias/ml. En esta situación, la CVP puede volver a quedar indetectable o mantenerse en niveles bajos sin necesidad de cambiar el TAR. Los pacientes suelen mantener cifras de linfocitos CD4+ aceptables y no presentan progresión clínica. Debe tenerse en cuenta la técnica utilizada para cuantificar la CVP, ya que, por ejemplo, el método TaqMan® presenta una sensibilidad diferente al de Amplicor® y detecta con mayor frecuencia viremias entre 50-250 copias/ml120. La posibilidad de amplificar el ARN viral para detectar MR es baja121. En general no se recomienda modificar el TAR, aunque algunos estudios han demostrado selección de nuevas MR122 y asociación a translocación bacteriana e inflamación sistémica123.
- 2.
CVP entre 200 y 1.000 copias/ml. Este grado de viremia se asocia a selección de MR. Con viremias entre 200 y 400 copias/ml debe intentarse genotipificar el VIH, remitiendo una muestra a un laboratorio de virología con experiencia en técnicas de mayor sensibilidad para amplificar el ARN viral y secuenciar el genoma viral.
En ambas situaciones está contraindicada la intensificación del TAR mediante la adición de un solo fármaco activo. Deben valorarse: potencia del TAR, adherencia, errores de prescripción y posibles interacciones medicamentosas o alimentarias.
Fracaso virológico precozEs el fracaso virológico que ocurre tras la primera línea de TAR. La selección de MR y las pautas de segunda línea difieren en función del régimen de TAR de inicio utilizado:
- •
Fracaso virológico a 2 ITIAN +1 ITINN. Una única mutación (K103N, L100I o Y181C) es capaz de generar resistencia de alto nivel a EFV y NVP. El fracaso virológico puede acompañarse de otras MR a ITIAN (M184V, L74V o K65R).
- •
Fracaso virológico a 2 ITIAN+1IP/r. La probabilidad de seleccionar MR a IP es muy baja. Los IP/r protegen frente a la selección de MR a ITIAN.
- •
Fracaso virológico a 2 ITIAN+RAL. El fracaso virológico a RAL puede desarrollar 3 patrones diferentes: 1)N155H; 2)Q148HRK+GI40SA, y 3)Y143CR+T97A. RAL no evita la selección de MR a ITIAN. Con la excepción de la mutación Y143CR, el resto confieren resistencia a EVG.
Existen pocos ensayos clínicos aleatorizados que hayan evaluado la eficacia de diferentes combinaciones de FAR en pacientes con fracaso virológico a alguno de los TAR de primera línea (tabla 7). En general, se recomienda la utilización de un IP/r con 2 FAR, preferentemente ITIAN, que conserven actividad antiviral. ETR+2 ITIAN es inferior a un IP/r+2 ITIAN tras fracaso virológico con EFV o NVP y con MR a ITINN (estudio TMC125-C227)124.
Principales ensayos clínicos de tratamiento antirretroviral en pacientes con fracaso virológico precoz y avanzado
| Fármaco (ensayo clínico) | Criterios de inclusión | Diseño | Brazos de comparación | n | Endpoints 48 semanas | Principales conclusiones | Otros resultados |
| Estudios sobre rescate precoz | |||||||
| DRV/r (ODIN) | • CV > 1.000 cop.• CD4+> 50 céls.• No MR a DRV | Fase IIIbNo inferioridad(Δ: –12%)ITT-TLOVR | • DRV/r 800/100 qd• DRV/r 600/100 bid(ambos+ITIAN) | 294296 | • 72,1% <50 cop.• 70,9% < 50 cop.• Δ 1,2% (IC 95% –6,1 a 8,5%) | DRV/r qd es no inferior a DRV/r bid en pacientes con fracaso virológico sin mutaciones a DRV | • Menos efectos adversos en pauta qd (7,8%) que bid (15,2%) y con mejor perfil lipídico |
| LPV/R mono(HIV STAR) | • TAR: 2 ITIAN + ITNN• CV ≥ 1.000 cop.• IP naive | Fase IVAleatorizadoAbiertoNo inferioridad ITT | • LPV/r (monoterapia)• LPV/r+TDF+3TC | 9897 | • 61%<50 cop.• 83%<50 cop.ITT p < 0,01 | • LPV/r mono es menos eficaz que LPV/r+TDF+3TC como terapia de segunda línea | • CV > 5 log y presencia de TAMs se asociaron a más fracaso con LPV/r-monoterapia |
| LPV/r+RALSECOND-LINE | • CV > 500 cop.• 1.er TAR ≥ 24 sem.• Nunca LPV/r | Fase IIIb/4AleatorizadoAbiertoNo inferioridad(Δ: –12%) en ITT | • LPV/r+RAL• LPV/r+2/·ITIAN | 271270 | • 83%<200 cop. 48 sem.• 81%<200 cop. 48 sem.Δ: 1,8% (IC 95% –4,7 a 8,3) | • LPV/r+RAL es no inferior al estándar de tratamiento LPV/r+2 ITIAN | • LPV/r+RAL es una terapia bien tolerada y segura• Permite ahorrar ITIAN• No precisa realizar test genotípico |
| Estudios sobre rescate avanzado | |||||||
| DRV/rTITAN | • CV > 1.000 cop.• TAR ≥ 12 sem.• Nunca LPV/r, TVR, DRV o ENF | Fase IIIAleatorizadoNo ciegoNo inferioridad(Δ: –12%) ITT | • DRV/r bid + TO• LPV/r bid +TO | 298297 | • 71% < 50 cop. (77%<400 cop.)• 60% < 50 cop. (68%<400 cop.)Δ 11% (IC 95%: 3-19) < 50 cop. Δ 9% (IC 95%: 2-16)<400 cop. | DRV/r no inferior LPV/r y cumple criterios de superioridad para CV<50 cop. y 400 cop. | • DRV/r>LPV/r si CV > 5uLog• Fracaso virológico 10% (DRV), 22% (LPV)• MR a IP e ITIAN más frecuentes con LPV |
| DRV/rPOWER I/II | • CV > 1.000 cop.• Multifracaso• MR a IP ≥ 1 | Fase IIBAleatorizadoITT-LOVR | • DRV/r bid 600/100 + TO• IP/r comparador + TO | 131124 | • 45% < 50 cop.• 10%<50 cop.Δ 37% (IC 95%: 25-46) < 50 cop. | DRV/r 600/100 bid>IP/r comparador | • La superioridad de DRV/r fue independiente del uso de ENF, CV basal, n.° mut. a IP o fármacos activos en la TO |
| RALBENCHMRK I/II | • CV > 1.000 cop., mientras reciben TAR• Resistencia documentada al menos a un fármaco de las 3 familias: ITIAN, ITINN e IP | Fase IIIAleatorizadoDoble ciego | • RAL+TO• Placebo+TO | 462237 | • 62,1%<50 cop. sem. 48• 32,9% < 50 cop. sem 48p < 0,001 | En pacientes VIH con opciones limitadas, RAL+TO es superior a placebo+TO | • Cuando RAL se asoció a DRV/r+ENF la eficacia fue del 98%• La seguridad de RAL fue similar a placebo• RAL presenta una barrera genética baja |
| ETVDUET I/II | • >8 sem. con TAR• CV>5000 cop• ≥ 1 MR ITIAN• ≥ 3 MR IP | Fase IIIAleatorizadoDoble ciego | • DRV/r+ETV• DRV/r+placebo(ambos+ITIAN) | 599604 | • 61%, < 50 cop.• 40%, < 50 cop.p<0,0001 | • ETV es superior a placebo en pacientes con fracaso virológico y experiencia a varios TAR | • 91% de los pacientes con CV < 50 cop. sem 48 persisten en la sem. 96 con < 50 cop.• Los eventos de sida y muerte disminuyeron en pacientes con ETV+ENF |
| MVCMOTIVATE I/II | • CV>5000 cop• Tropismo R5• Fracaso virológico a ITIAN,NN e IP | Fase IIIAleatorizadoDoble ciego | • MVC qd+TO• MVC bid+TO• Placebo +TO | 414426209 | CV<50 cop: 43,2%CV<50 cop: 45,5%CV<50 cop: 16,7%p < 0,001 | MRV es superior a placebo en pacientes con tropismo R5 | • CV<50 cop.: 64% (TO con ENF)• CV<50 cop.: 61% (TO con ENF)• CV<50 cop.: 27% (TO con ENF) |
| DRV/RAL/ETVTRIO | • CV > 1.000 cop.• Naive a DRV/ETV/RAL• Fracaso virológico durante TAR• ≥ 3 mut. proteasa(sensible DRV)• ≥ 3 mut. ITIAN• Susceptible a ETV | Fase IIAbiertoNo comparativo | • DRV/r 600/100 bid+RAL 400mg bid+ETV 200mg bid | 103 | • CV<50 cop. sem. 24: 95% (IC 95% 85-96%)• CV<50 cop. sem. 48: 86% (IC 95%: 80-93%) | La eficacia de DRV/r+ETV+RAL es muy eficaz en pacientes con pocas opciones | • La mediana de CD4+ se incrementó en 108 céls./mm3• Incidencia EAs grado 3/4: 14,6% |
| EVG/r | • CV>1.000 cop.• MR o más de 6 meses ≥ 2 clases de FARV | Fase IIIDoble ciego, aleatorizadoNo inferioridadΔ: –10% en ITT | • EVG 150mg (85mg si LPV/r o ATV/r)• RAL 400mg/bidAmbas pautas con IP/r y otro FAR activo | 361363 | • CV<50 cop.: 59%• CV < 50 cop.: 58%Δ: 1,1% (IC 95% –6,0 a 8,2) | EVG en combinación es no inferior a RAL ambos con un IP/r | • La administración de EVG es qd.Sin diferencias de efectos adversos entre ambos brazos |
| DTGSAILING | • CV ≥ 1.000 cop./ml• Resistencia ≥ 2 familias de FAR• 1 o 2 FAR activos en la TO | Fase IIIAleatorizadoDoble ciegoNo inferioridad (Δ-12%) en ITTAnálisis superioridad | • DTG 50mg. qd + TO• RAL 400mg. bid+TO | 354361 | • 71%<50 cop. sem. 48• 64%<50 cop. sem. 48Δ: 7,4% (IC 95% 0,7 a 14,2%) en ITT | DTG 50mg qd. es superior a RAL bid ambos con TO en pacientes con fracaso virológico y experiencia previa a TAR | • Los pacientes con DTG presentaron menos fracaso virológico y menos mutaciones de resistencia a InInt• Los efectos adversos fueron similares en ambos grupos |
| DTGVIKING | • CV ≥ 1.000 cop./ml• Resistencia genotípica a RAL• Resistencia a ITIAN, ITNN, IF o IP• ≥ 1 FAR activo en TO de la cohorte 1 | Fase IIb2 cohortes1.ª fase monoterapia funcional: DTG2.ª fase DTG + TO | • DTG 50mg. bid +TO• DTG 50mg. qd+TO | 2427 | • 75%<50 cop. 24 sem.• 41%<50 cop. 24 sem. | DTG 50mg. bid+TO es más eficaz que DTG qd en pacientes con resistencia a RAL | • La toxicidad fue similar en ambos grupos• Selección resistencias a InInt: < 15% de todos los pacientes• No se detectaron nuevas mutaciones a InInt |
DRV/r es el IP/r que resulta más eficaz en cualquiera de las líneas de rescate analizadas. El estudio ODIN125 demostró que DRV/r (800/100mg, QD)+2 ITIAN es no-inferior a DRV/r (600/100mg, BID) en pacientes en situación de fracaso virológico y sin MR a DRV. El estudio TITAN126 demostró que en pacientes con exposición limitada a FAR (experiencia previa a ITIAN, ITINN e IP pero sin exposición previa a LPV/r), DRV/r (600/100mg, BID) es superior a LPV/r, ambos junto a terapia optimizada (TO).
En pacientes que fracasan a un primer régimen de TAR basado en ITINN (NVP, EFV), LPV/r+TDF/FTC es superior a LPV/r en monoterapia (estudio HIV STAR)127. En el mismo escenario una pauta de biterapia con LPV/r+RAL resulta no inferior a LPV/r+2 o 3 ITIAN (estudio SECOND LINE)128. Esta pauta es una opción en pacientes que no pueden recibir TDF o ABC.
Fracaso virológico avanzadoEl tratamiento tras el fracaso virológico de al menos 2 líneas de TAR se ha denominado terapia de rescate avanzado. En este escenario, la mayoría de los pacientes han experimentado fracaso virológico con las 3 familias de FAR más utilizadas: ITIAN, ITINN e IP, y pueden detectarse MR a todas ellas.
Varios ensayos clínicos han evaluado diferentes pautas de TAR de rescate (tabla 7). Estos estudios no son comparables entre sí por la heterogeneidad de la población, regímenes de TAR previos, criterios de eficacia, tiempo de seguimiento y TO utilizada. Tanto ENF como TPV/r, DRV/r, ETR, MVC y RAL han demostrado superioridad frente a placebo en combinación con la TO disponible en el momento de realización del estudio.
Los estudios RESIST129 compararon TPV/r con otro IP/r, ambos con TO. Los resultados a las 48 semanas demostraron superioridad de TPV/r frente al IP/r comparador. Actualmente TPV solo se utiliza cuando su actividad es superior a DRV/r BID y no requiere el uso de ETR. ENF acompañado de FAR activos resulta muy eficaz en pautas de rescate (estudios TORO)130. Desafortunadamente, su administración subcutánea dolorosa limita su uso. Solo se aconseja cuando no se puede conformar un tratamiento óptimo con otros FAR activos.
DRV/r (600/100mg, BID) es superior a otros IP/r en este escenario. En la actualidad es el IP de elección en los regímenes de rescate (estudios POWER131 y TITAN126). ETR es un ITINN de segunda generación activo frente a cepas virales resistentes a EFV o NVP. En pacientes con una o más MR a ITINN y 3 o más a IP, la combinación ETR+DRV/r+TO es significativamente superior a DRV/r+TO (estudios DUET)132.
En pacientes con fracaso virológico avanzado, añadir un FAR de una nueva familia farmacológica aumenta de forma significativa la eficacia del TAR de rescate. En pacientes con CVP mayor de 5.000 copias/ml, tropismo R5 y MR a más de un FAR o a más de 2 IP, MVC, en pauta BID o QD, +1 IP/r+TO mejora la eficacia del TAR (estudios MOTIVATE)133. RAL con TO en pacientes con CVP superior a 1.000 copias/ml y MR a al menos un FAR de cada una de las 3 clases (ITIAN, ITINN e IP) eleva significativamente el porcentaje de pacientes que alcanzan una CVP menor de 50 copias/ml a las 48 semanas (estudio BENCHMRK)134. El estudio TRIO135, abierto y no comparativo en pacientes con CVP mayor de 1.000 copias/ml e infección por VIH multirresistente, evaluó la eficacia y seguridad de un régimen de RAL+DRV/r+ETR. En la semana 48, 89 pacientes (86%; IC95%: 80-93%) lograron una CVP inferior a 50 copias/ml.
Dos nuevos InInt han sido evaluados recientemente en pacientes con fracaso virológico. EVG se comparó con RAL, ambos con TO (1 IP/r+1 FAR activo), en pacientes con CVP mayor de 1.000 copias/ml y experiencia o resistencia a 2 o más familias de FAR, resultando no inferior a RAL en la semana 48 (estudio GS-US-183-0145)136. DTG (50mg QD) fue superior a RAL, ambos con TO, en pacientes sin exposición previa a InInt con CVP mayor de 1.000 copias/ml y resistencia a 2 o más familias de FAR (estudio SAILING)137. El estudio VIKING138 analizó la eficacia de DTG a dosis de 50mg QD (cohortei) y de 50mg BID (cohorteii) en pacientes con resistencia previa a RAL. En la semana 24, el 41% de pacientes de la cohortei tenían una CVP menor de 50 copias/ml frente al 75% de la cohorteii. Este estudio sugiere que DTG 50mg BID es eficaz en pacientes con fracaso previo a RAL, siempre y cuando no se haya desarrollado la mutación Q148 junto con al menos otra MR secundaria a RAL (E138A/E/K/T, G140S, N155N/H).
Fracaso virológico en pacientes sin opciones terapéuticasEn este escenario resulta imposible diseñar un TAR con al menos 2 FAR plenamente activos. El fracaso virológico en el paciente multitratado no siempre conduce de forma rápida a inmunodeficiencia y progresión clínica. La mayoría de pacientes continúan con recuentos de linfocitos CD4+ relativamente estables, especialmente si continúan con TAR y la CVP se mantiene entre 10.000-20.000 copias/ml. En esta situación se recomienda:
- •
Remitir al paciente a un centro especializado con experiencia y acceso a nuevos FAR mediante ensayos clínicos o estudios de acceso expandido.
- •
Mantener un TAR no supresor cómodo de tomar, poco tóxico, que disminuya la capacidad replicativa viral y no acumule mutaciones que puedan comprometer futuros TAR. Se recomienda el uso de 2 o 3 ITIAN, que incluyan 3TC o FTC y simultáneamente ZDV o TDF. 3TC y FTC inducen la mutación M184V, que compromete la capacidad replicativa del VIH-1 y puede resultar útil en esta situación139. Debe cambiarse a un TAR supresor con 2 o 3 FAR activos en cuanto sea posible.
- •
La interrupción del TAR produce un descenso del número de linfocitos CD4+ respecto con la continuación del TAR no supresor. En general, no se recomienda la suspensión del TAR como opción electiva.
- •
El objetivo del TAR de rescate es conseguir una CVP-VIH <50 copias/ml (A-II).
- •
El cambio del TAR por fracaso virológico debe efectuarse precozmente para evitar la acumulación de mutaciones y facilitar la respuesta al nuevo tratamiento (A-III).
- •
El nuevo TAR debe contener 3 FAR totalmente activos. Si no es posible, se recomienda la combinación de 2 FAR plenamente activos y otros que conserven actividad virológica parcial, especialmente en caso de rescate avanzado con opciones terapéuticas limitadas (A-I).
- •
Se debe realizar un estudio de resistencia y de tropismo viral para conformar el mejor régimen alternativo. La prueba debe realizarse mientras el paciente está recibiendo el tratamiento fallido o lo antes posible tras su suspensión. Si se dispone de pruebas genotípicas previas, deben valorase todas las MR detectadas (A-I).
- •
Se deben analizar las causas que motivaron el fracaso virológico: adherencia, interacciones medicamentosas o alimentarias, historia farmacológica y toxicidades previas. El nuevo TAR debe ser cómodo y bien tolerado (A-III).
- •
En pacientes con fracaso virológico, DRV/r es el IP/r que ha demostrado mayor eficacia en todas las líneas de rescate. En pacientes con varios fracasos virológicos previos, con MR acumuladas, y dependiendo del test genotípico y del tropismo viral, la combinación de DRV/r±ETR+1-2 FAR de una familia no utilizada previamente (InInt, MVC o ENF) presenta las mayores tasas de eficacia (A-I).
- •
En pacientes con fracaso previo a RAL, DTG (50mg, BID) acompañado de TO es la pauta de elección (A-II).
- •
El uso de TPV/r, ENF o ITIAN timidínicos queda restringido a pacientes sin otras posibilidades terapéuticas (A-III).
- •
No se recomienda suspender el TAR en pacientes con fracaso virológico avanzado y sin opciones terapéuticas (A-II). En esta situación se recomienda usar FAR que disminuyan la capacidad replicativa viral y que no seleccionen nuevas MR que comprometan futuros tratamientos (por ejemplo: 3TC/FTC, TDF y AZT). Debe vigilarse estrechamente la evolución del recuento de linfocitos CD4+ y de la CVP (A-III).
- •
En fracasos virológicos avanzados es recomendable consultar con clínicos y virólogos expertos en resistencia, TAR de rescate y que tengan acceso a FAR de uso restringido a través de programas de acceso expandido (A-III).
Se entiende por adherencia al TAR la capacidad del paciente para implicarse correctamente en la elección, inicio y cumplimiento del mismo a fin de conseguir una adecuada supresión de la replicación viral. La adherencia incorrecta es la primera causa de fracaso terapéutico. Entre los factores asociados con mala adherencia destacan: mala relación médico-paciente, consumo de drogas, enfermedad mental, bajo nivel educativo, barrera idiomática, falta de apoyo social, complejidad y efectos secundarios del tratamiento, temor a las alteraciones morfológicas, deterioro neurocognitivo y dificultad para una alimentación adecuada. Por el contrario, el apoyo emocional y vital, la capacidad para incluir la medicación en las actividades de la vida diaria y la comprensión de la relación entre adherencia y desarrollo de resistencias son factores que predicen una adherencia correcta140-143. Respecto a la edad, clásicamente se ha encontrado peor cumplimiento en pacientes muy jóvenes y mejor cumplimiento en pacientes mayores de 65años143. Un metaanálisis reciente, que incluyó 12 grandes estudios, ha mostrado que los pacientes mayores tienen menos riesgo de mala adherencia144. Diversos estudios han reportado una menor adherencia al TAR en las mujeres, mientras que otros, en cambio, no han observado diferencias respecto a los varones.
Antes de iniciar el TAR conviene preparar al paciente, identificar las situaciones que puedan dificultar la adherencia correcta e intentar corregirlas. Durante el TAR es fundamental evaluar periódicamente la adherencia. Se recomienda utilizar varias técnicas, como la entrevista, los cuestionarios estructurados, el recuento de medicación sobrante y el registro de recogida de la medicación en la farmacia.
Cuando existen niveles subterapéuticos de FAR, el VIH puede replicarse y desarrollar resistencias. Debe destacarse que no solo es importante el porcentaje de dosis omitidas, sino también los patrones de adhesión subóptima: las interrupciones de tratamiento presentan mayor repercusión en la respuesta virológica que la omisión ocasional de dosis.
Determinados efectos secundarios impactan de forma más importante sobre la adherencia. Se ha visto que los pacientes que sufren fatiga, confusión, pérdida del gusto o náuseas son lo que tienen peor adherencia al TAR145.
A la hora de valorar la relación entre adherencia y desarrollo de resistencia se han encontrado diferencias en función de las familias de FAR: con los IP/r la aparición de resistencias es mucho más difícil con cualquier nivel de adherencia debido a su elevada barrera genética146. Por tanto, ante un paciente con alta sospecha de mala adherencia es mejor iniciar TAR con pautas basadas en IP/r, que evitan el riesgo de seleccionar MR relevantes en caso de incumplimiento y fracaso virológico.
Si se detecta falta de adherencia debe intervenirse de forma activa para corregirla. En ocasiones los pacientes presentan falta de adherencia selectiva —es decir, a alguno de los componentes del TAR—, y esta falta de adherencia se relaciona con fracaso virológico147. La coformulación de FAR simplifica el TAR y puede prevenir y corregir este problema, mejorando la adherencia global148 e impidiendo la adherencia selectiva en pacientes que reciben un régimen de TAR triple. En este sentido, el uso de regímenes completos en comprimido único constituye la estrategia más eficiente para prevenir la mala adherencia selectiva de fármacos. Además de mejorar la adherencia, un estudio reciente ha asociado el uso de regímenes en comprimido único con menores tasas de hospitalización y de costes en cuidados médicos, lo que los convierte en los más eficientes o coste-efectivos, si bien hay que tener en cuenta que es un estudio no aleatorizado149.
Las estrategias para mejorar la adherencia son múltiples. Probablemente la intervención que ha demostrado una mayor eficacia ha sido el soporte interpersonal estructurado, en el que personal sanitario entrenado emplea estrategias individualizadas.
Respecto al tratamiento directamente observado, en un metaanálisis de 17 estudios se ha demostrado que incrementa la probabilidad de conseguir CVP indetectable, mayor incremento de linfocitos CD4+ y adherencia superior al 95%150.
GeSIDA y el PNS, conjuntamente con la Sociedad Española de Farmacia Hospitalaria, han revisado los factores que influyen en la adherencia, los métodos de evaluación y las posibles estrategias de intervención. Remitimos a los lectores a este documento (http://www.msssi.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/recomendacionesAdherenciaTrtoAntirretroviral062008.pdf) para profundizar en el tema de la adherencia al TAR.
Recomendaciones
- •
Antes de iniciar el TAR se debe preparar al paciente e identificar y corregir las causas que pueden limitar su adherencia (A-III).
- •
Una vez iniciado el TAR se recomienda efectuar un primer control a las 2-4semanas para comprobar la adherencia y eventualmente corregirla (A-III).
- •
La adherencia debe monitorizarse y reforzarse coincidiendo con las visitas clínicas (A-III).
- •
El control de la adherencia debe realizarse por un equipo multidisciplinar, que incluya al médico, el personal de enfermería, los profesionales de apoyo psicológico y la farmacia hospitalaria (A-III).
- •
En pacientes con cumplimiento irregular es preferible utilizar pautas basadas en IP/r para dificultar la selección de resistencias (A-I).
- •
La combinación a dosis fijas de FAR simplifica el TAR y, por tanto, facilita la correcta cumplimentación mantenida. El uso de regímenes completos en comprimido único constituye la estrategia más eficiente para prevenir la mala adherencia selectiva de fármacos (A-II).
La tolerabilidad depende de aspectos relacionados con la toma del FAR (número y tamaño de los comprimidos, requisitos de administración y número e intensidad de efectos secundarios inmediatos), pero también de factores del paciente (edad, sexo, peso, situación clínica y expectativas respecto al tratamiento). En el último decenio tanto los FAR como su galénica han mejorado notablemente, lo cual ha favorecido su tolerabilidad y aceptación por los pacientes.
Clasificación cronológica de los efectos adversosLos efectos adversos de los FAR pueden ser inmediatos (a corto plazo) o tardíos (a largo plazo). Los efectos inmediatos se producen en los primeros días o semanas de tratamiento, mientras que los tardíos aparecen al cabo de meses o años después del inicio de este.
Efectos adversos inmediatosLos efectos adversos inmediatos están bien definidos; en algunos casos pueden anticiparse y suelen ser fáciles de controlar. Afectan principalmente a la esfera digestiva, cutánea o neuropsicológica, y su incidencia y los factores asociados son conocidos.
Entre los FAR actualmente recomendados: los IP/r pueden producir efectos digestivos66,151; los ITINN de primera generación (particularmente NVP), hepáticos y RHS152; ABC produce RHS en pacientes con HLA-B*5701 positivo30; DRV, exantema151, y EFV puede producir efectos neuropsicológicos152.
Recomendaciones
- •
Se debe evitar el uso de FAR cuyos efectos adversos inmediatos sean similares a manifestaciones clínicas o alteraciones de laboratorio ya presentes en un determinado paciente (A-II). La determinación del alelo HLA-B*5701 es obligada antes de prescribir ABC, ya que tiene un valor predictivo positivo de casi el 100% para el riesgo de RHS a este fármaco (A-I).
- •
Se debe explicar al paciente cómo tomar correctamente una pauta de TAR y la posibilidad de que ocurran determinados efectos adversos inmediatos. Al iniciar un régimen de TAR se debe explicar qué actitud debe tomar el paciente si ocurre un determinado efecto adverso y, en cualquier caso, se debe facilitar siempre la posibilidad de comunicación directa con el médico. Los efectos adversos inmediatos leves se pueden tratar sintomáticamente valorando la evolución de la tolerabilidad del paciente. Si el efecto adverso tiene gran intensidad o duración prolongada o no es asumible por el paciente, se debe cambiar el o los FAR potencialmente implicados (A-I).
Los efectos adversos tardíos se conocen peor que los inmediatos y son más difíciles de prever y controlar. Potencian los síntomas de las enfermedades crónicas asociadas al envejecimiento y afectan al funcionamiento de órganos y sistemas.
El perfil de órganos y sistemas al que pueden afectar los diversos FAR, así como los factores de riesgo asociados a tal afectación, no se conoce en su totalidad, particularmente en lo que concierne a los FAR más recientes. La tabla 8 resume los efectos secundarios tardíos más característicos de los FAR actuales66,153-170.
Efectos secundarios tardíos más característicos de los antirretrovirales más utilizados en la actualidad
| Fármacos | Efectos adversos |
| Tenofovir153-156(Factores de riesgo: afectación renal u ósea previas, presencia de factores de riesgo convencionales, duración de la exposición a TDF y concomitancia de tratamiento con IP/r)153-156 | • Descenso del FG. Puede aumentar el riesgo de insuficiencia renal• Disminución de la densidad mineral ósea. Puede aumentar el riesgo de osteoporosis y fracturas osteoporóticas• Puede producir hipofosfatemia por tubulopatía proximal renal y agravar un eventual déficit de vitamina D |
| Abacavir157-159 | • Se ha asociado a riesgo de infarto de miocardio en pacientes con alto riesgo cardiovascular, aunque este efecto clínico es controvertido |
| Inhibidores de la proteasa66,160-164 | • Puede aumentar el riesgo de enfermedad cardiovascular por su efecto lipídico y quizás por otros efectos que no se conocen bien• LPV/r ha sido asociado a un mayor riesgo de infarto de miocardio, ATV no ha sido asociado a infarto de miocardio, y sobre DRV/r no se dispone de información al respecto.• ATV puede producir hiperbilirrubinemia y excepcionalmente ictericia y colelitiasis• LPV/r y ATV/r (no hay datos de DRV/r) se han asociado a un mayor riesgo de disminución del FG estimado, aunque este efecto clínico es controvertido y podría deberse a la interacción con TDF cuando se administran concomitantemente• ATV/r y DRV/r se han asociado a litiasis renal |
| Efavirenz165-169 | • Trastornos neuropsicológicos mantenidos (aunque sean de bajo grado pueden resultar difíciles de tolerar a largo plazo)• Se ha asociado a un mayor riesgo de deterioro neurocognitivo, aunque este efecto clínico es controvertido. En cultivos neuronales induce neurotoxicidad• Disminuye el nivel plasmático de 25-OH vitamina D, pero el significado clínico de esta alteración es desconocido• Se ha asociado a ginecomastia, aunque este efecto clínico es controvertido• Puede ser teratogénico y está contraindicado en mujeres que deseen quedarse embarazadas |
| Raltegravir170 | • Puede producir elevación de enzimas musculares que es generalmente asintomática y en personas con alteración muscular previa |
El peso relativo que suelen tener los FAR en la producción o desarrollo de enfermedades crónicas es en general pequeño y mucho menor que el de otros factores de riesgo clásicos, ya conocidos en la población general, que en algunos casos están sobrerrepresentados en pacientes con infección por el VIH, como son el consumo de tabaco, alcohol u otras drogas, una dieta inadecuada, o la ausencia de ejercicio físico.
En general, el riesgo absoluto de efectos secundarios tardíos con los FAR actualmente recomendados es muy pequeño y el beneficio en términos de salud global de una pauta de TAR efectiva respecto a no tratar está fuera de duda. Sin embargo, en pacientes en alto riesgo o con enfermedades crónicas ya diagnosticadas, el efecto de determinados FAR puede contribuir por sí mismo a desencadenar o hacer progresar, respectivamente, tales enfermedades crónicas.
Recomendaciones
- •
Se debe individualizar el TAR evaluando el riesgo o la presencia de enfermedades crónicas de tal manera que la pauta elegida no contenga FAR que puedan favorecer la aparición o la progresión de las mismas (A-II).
- •
La retirada de algunos FAR implicados en efectos adversos tardíos puede mejorar, al menos parcialmente, la alteración clínica subyacente, aunque se desconoce si tal modificación puede alterar la historia natural de la enfermedad crónica en cuestión o la supervivencia. Los FAR contribuyen de forma colateral al riesgo o progresión de determinadas enfermedades crónicas, pero hay otros factores que generalmente son más importantes, y se recomienda priorizar la intervención sobre dichos factores (A-II).
Un número significativo de pacientes con infección por el VIH reciben diversos medicamentos además de los FAR. Ocasionalmente toman productos de herboristería, suplementos dietéticos o medicinas alternativas. Las interacciones de los FAR entre sí o con otros medicamentos pueden tener una importante repercusión clínica. En un estudio con 1.497 pacientes de la cohorte suiza se estimó que el 35% de los pacientes menores de 50años y el 51% de los mayores de esta edad podían presentar interacciones potencialmente importantes (asociaciones contraindicadas o que requerían ajuste de dosis que no había sido realizado)171.
Las interacciones más relevantes suelen ser las farmacocinéticas (dan lugar a una modificación de concentraciones), en especial las que afectan al metabolismo. Los FAR son sustratos de uno o varios sistemas enzimáticos y a la vez pueden comportarse como inductores y/o inhibidores de los mismos. La inducción producirá una disminución de las concentraciones del otro fármaco (sustrato), pudiendo disminuir su eficacia. La inhibición ocasionará un aumento de las concentraciones con mayor riesgo de toxicidad. En general, la inducción es un proceso lento (días o semanas), mientras que la inhibición se produce rápidamente (horas). Algunos FAR pueden ser inhibidores e inductores al mismo tiempo, predominando uno u otro efecto.
El sistema metabólico más importante es el citocromo P450 (CYP) y su principal isoenzima, el CYP3A4. Muchos FAR, especialmente los IP e ITINN, y muchos otros medicamentos que a menudo reciben los pacientes, son sustratos, inhibidores o inductores del CYP. La potente inhibición enzimática que producen RTV y COBI se utiliza para potenciar otros FAR. COBI, a diferencia de RTV, no presenta actividad antirretroviral.
Otra vía metabólica es la conjugación de los FAR o de sus metabolitos con otros productos, por ejemplo la glucuronidación (UDPGT). Diversos FAR son inductores o inhibidores de UDPGT. RTV inhibe varias subfamilias del CYP y es inductor de UDPGT, mientras que ATV inhibe tanto CYP como UDPGT.
Algunos transportadores, como la glucoproteína-P (P-gp), pueden alterar la biodisponibilidad de algunos FAR y su distribución por el organismo. Estos transportadores pueden ser también inducidos o inhibidos por diversos fármacos.
En la tabla 9 se detallan las características de los FAR como sustratos, inductores o inhibidores del CYP. Esta clasificación nos permite determinar posibles interacciones teóricas para una combinación determinada. Se indican también en ella las asociaciones contraindicadas. Los ITIAN tienen pocas interacciones metabólicas, por lo que no se han incluido.
Antirretrovirales como sustratos, inductores e inhibidores del citocromo P-450, glucuronidación (UGT), glucoproteína-P (P-gp) y otros transportadores. Asociaciones contraindicadas (no se incluyen otras asociaciones que requieren ajuste de dosis o mayor seguimiento: ver otras fuentes de información)
| Clase | Antirretroviral | Es substrato dea | Es inductor dea | Es inhibidor dea |
| ITINN | Efavirenz | CYP2B6, 3A4GlucuronidaciónUGT2B7 | CYP3A4CYP2C19 (in vivo; voluntarios sanos)CYP 2B6Glucuronidación(UGT1A1)Autoinduce su propio metabolismo | CYP2C9 y 2C19 (in vitro)3A4 (in vitro)CYP2C8UGT1A9 y UGT1A4 (in vitro)P-gp |
| Asociaciones contraindicadas o no recomendadas con efavirenz: | ||||
| Antirretrovirales:ATV/r (considerar ATV/r 400/200mg c/24h en naive; evitar en pacientes pretratados)DRV/r 800/100mg/24h (emplear DRV/r 600/100mg/12h)ETRFPV no potenciado (emplear FPV/r 700/100mg/12h)LVP/r (considerar LVP/r 500/125mg/12h-5 comp de 100/25mg por toma)MVC: ↑MVC 600mg/12hNVPRPVSQV no potenciado | VHC:Boceprevir contraindicado(Nota: permitido con telaprevir ↑ este a 1.125mg/8h) | Otros:Anticonceptivos oralesAmodiaquinaCarbamacepinaClaritromicina (para tratamiento de MAC, valorar azitromicina)Derivados de ergotaminaHypericum (hierba de San Juan)ItraconazolKetoconazolMidazolamPimozidaPosaconazolProguaniloTerfenadinaTriazolamVoriconazol (evitar/ajustar dosis) | ||
| Nevirapina | CYP3A4, 2B6, 2D6GlucuronidaciónP-gp | CYP3A4 (induce su propio metabolismo), 2B6P-gp | – | |
| Asociaciones contraindicadas o no recomendadas con nevirapina: | ||||
| Antirretrovirales:ATV/rEFVETRFPV no potenciado(se recomienda LVP/r 500/125mg/12h-5 comp de 100/25mg por toma-)RPVSQV no potenciado | VHC:boceprevir y telaprevir (por ausencia de datos) | Otros:Anticonceptivos oralesClaritromicina (para tratamiento de MAC, valorar azitromicina)Hypericum (hierba de San Juan)KetoconazolItraconazolRifampicinaVoriconazol | ||
| Etravirina | CYP3A4, CYP2C9/19CYP2C18glucuronidación (UGT1A3 y UGT1A8)(No es sustrato de P-gp) | CYP3A4 (débil) | CYP2C9/19 (débil)P-gp (débil) | |
| Asociaciones contraindicadas o no recomendadas con etravirina: | ||||
| Antirretrovirales:EFVNVPRPVTPV/r(Nota: en combinación con DRV/r 600/100mg/12h, ETR debe administrarse 2 veces al día: 200mg/12h) | VHC:(nota: boceprevirreduce un 29% la Cmin de ETR, significado clínico no establecido; ETR puede asociarse con telaprevir sin ajuste de dosis) | Otros:CarbamacepinaClaritromicina (para tratamiento de MAC, valorar azitromicina)Clopidogrel (teóricamente ETR podría reducir la formación del metabolito activo de clopidogrel; significado clínico no establecido)Dexametasona (considerar alternativa a dexametasona, especialmente en uso crónico)DiazepamFenitoínaFenobarbitalHypericum (hierba de San Juan)ItraconazolKetoconazolRifampicina | ||
| Rilpivirina | CYP3A4(No es sustrato de P-gp) | P-gp (in vitro; sin embargo, no afectó la farmacocinética de digoxina) | ||
| Asociaciones contraindicadas o no recomendadas con rilpivirina: en general, fármacos que puedan aumentar el metabolismo de rilpivirina (inductores del CYP3A4) o alterar el pH gástrico (inhibidores de la bomba de protones contraindicados) (Nota: puede darse con antihistamínicos H2 tipo ranitidina: 12horas antes o 4h después de rilpivirina; con antiácidos: 2h antes o 4h después de rilpivirina)Nota: en voluntarios dosis mayores a las terapéuticas de RPV (75mg una vez al día y 300mg una vez al día) prolongaron el intervalo QTc en el ECG. A la dosis 25mg QD no hay efecto clínicamente relevante sobre el intervalo QT | ||||
| Antirretrovirales: EfavirenzEtravirinaNevirapina | VHC:(Nota: puede asociarse con boceprevir y telaprevir. Dado que ambos aumentan niveles de rilpivirina, precaución en pacientes con riesgo ↑QT) | Otros:CarbamacepinaClaritromicina (no hay datos: ↑RPV, ambos ↑QT, considerar azitromicina)Dexametasona (excepto dosis única)Eritromicina (no hay datos: ↑RPV, ambos ↑QT, considerar azitromicina)Esomeprazol, fenitoínafenobarbitalHierba de San Juan o hipérico (Hypericum) (hierba de San Juan)LansoprazolOmeprazol, OxcarbacepinaPantoprazolRabeprazolRifampicinaRifabutina (nota: puede asociarse RPV con rifabutina:↑RPV a 50mg/día) | ||
| IP | Atazanavir | CYP3A4GlucuronidaciónP-gp | CYP2C8 (con ATV/r) | CYP3A4CYP2C8 (leve)UGT 1A1 y UGT 1A3P-gp (moderado)*** |
| Darunavir/r | Ver ritonavir | |||
| Fosamprenavir/r | Ver ritonavir | |||
| Indinavir/r | Ver ritonavir | |||
| Lopinavir/r | Ver ritonavir | |||
| Ritonavir | CYP3A4>CYP2D6P-gp | CYP1A2, 2B62C19 (potente) y en menor medida 2C9, 2C8 (in vivo), glucuronidación (UGT1A4)Autoinduce su propio metabolismo | CYP3A4 (potente) y 2D6 (potente)P-gp (potente inicialmente; puede reducirse en el transcurso del tiempo)*** | |
| Saquinavir | Ver ritonavir | |||
| Tipranavir/r(en estado de equilibrio)* | CYP3A4P-gp | 1A2 (moderado)2C9 (leve)CYP2B6glucuronidaciónP-gp (efecto mayor tras primera dosis y mínimo tras uso continuado) | CYP3A4 intestinal (potente)CYP3A4 hepático (moderado)2D6 (potente)CYP2C8** | |
| IP/r | Asociaciones contraindicadas o no recomendadas con IP potenciados con ritonavir:Con ATV: fármacos que puedan alterar el pH gástrico como inhibidores de la bomba de protones (IBP-contraindicados. Si IBP inevitable, ATV/r 400/100mg/24h y estrecha monitorización. La dosis del IBP no debe exceder 20mg de omeprazol o su equivalente). (Nota: en pacientes que no estén tomando tenofovir pueden administrarse antihistamínicos H2 sin superar una dosis equivalente a 20mg de famotidina 2 veces al día. Si fuese necesaria una dosis mayor considerar ATV/r 400/100mg/24h. En pacientes que estén tomando tenofovir, si se administra una antihistamínicos H2 dosificar ATV/r 400/100mg/24h y no superar 40mg/12h de famotidina o equivalente.Con ATV/r, LPV/r y SQV/r: Evitar fármacos que puedan prolongar el intervalo QT | |||
| Antirretrovirales:ATV/r+NVPATV/r+EFV(considerar ATV/r 400/200mg c/24h en naive; evitar en pretratados)DRV/r+EFV: emplear DRV/r 600/100mg/12h)DRV/r 600/100mg/12h+ETR: emplear ETR 2 veces al día: 200mg/12hLPV/r+EFV o NVP: considerar LVP/r 500/125mg/12h-5 comp. de 100/25mg por toma | VHC:Nota: solo está permitido el uso de ATV/r con telaprevir, monitorizando ↑ bilirrubina. Boceprevir+ATV/r: esta coadministración podría valorarse caso a caso cuando se considere necesario, en pacientes con cargas virales del VIH suprimidas y con cepas virales del VIH sin sospecha de resistencia al tratamiento frente al VIH (se alcanzan niveles similares al uso de ATV no potenciado)El resto de IP/r no deben asociarse a boceprevir o telaprevir | Otros:AlfuzosinaAmiodaronaAnticonceptivos orales (Nota: con ATV/r puede emplearse un anticonceptivo oral que contenga mínimo 30μg de etinilestradiolBudesonida (incluso inhalada)CloracepatoClozapinaColchicina (si insuficiencia renal o hepática) (Nota: si insuficiencia renal o hepática normales, usar dosis reducidas de colchicina)(Nota: dexametasona en uso prolongado puede reducir las concentraciones de los IP; precaución)DextropropoxifenoDiazepamDeriv. ergotaminaDisulfiram (no asociar a soluciones de Norvir® y Kaletra®)EncainidaEstazolam, éxtasisFenitoínaFenobarbitalFlecainidaFluracepamFusídico, ácidoFluticasonaHalofantrinaHypericum (hierba de San Juan)Irinotecan: con ATV/rLidocaína sistémicaLovastatinaLumefantrinaMeperidina o petidinaMetanfetaminaMidazolam oralPimozidaPiroxicamPropafenonaQuinidinaRifampicinaRivaroxabanSalmeterolSertindolSildenafilo (hipertensión pulmonar)SimvastatinaTerfenadinaTriazolamVoriconazol | ||
| ATV no potenciado | Asociaciones contraindicadas o no recomendadas con atazanavir no potenciado:En general, fármacos que puedan aumentar el metabolismo de atazanavir (inductores del CYP3A4) o alterar el pH gástrico (inhibidores de la bomba de protones [IBP] contraindicados). (Nota: puede darse con antihistamínicos H2 tipo ranitidina: 12h antes o 4h después de rilpivirina; con antiácidos: 2h antes o 4h después de rilpivirina.)Evitar fármacos que puedan prolongar el intervalo QT. | |||
| Antirretrovirales:Efavirenz (considerar ATV/r 400/200mg c/24h en naive; evitar en pretratados)IndinavirNevirapina | VHC:No asociar atazanavir no potenciado con boceprevir o telaprevir (ausencia de datos) | Otros:AlfuzosinaBosentanCarbamacepinaColchicina (si insuficiencia renal o hepática) (Nota: si insuficiencia renal o hepática normales, usar dosis reducidas de colchicina)Deriv. ergotaminaEsomeprazolFenitoínaFenobarbital(Nota: fluticasona: precaución especialmente en uso a largo plazo)Hypericum (hierba de San Juan)IrinotecanLansoprazolLovastatinaMidazolam oralOmeprazolPantoprazolPimozidaRabeprazolRifampicinaSalmeterolSildenafilo (hipertensión pulmonar)SimvastatinaTriazolamVoriconazol (por ausencia de datos | ||
| Inhibidoresde la fusión | Enfuvirtide | Al ser un péptido se elimina mediante catabolismo proteico. No es sustrato ni influye en la actividad del citocromo P-450Ausencia de interacciones clínicamente importantes | ||
| Antagonistas CCR5 | Maraviroc | CYP3A4P-gp | Otros medicamentos que actúan sobre el CYP3A4 pueden modificar las concentraciones de maraviroc. Sin embargo, es poco probable que maraviroc modifique las concentraciones de otros fármacosMaraviroc in vitro inhibe la P-gp; sin embargo, no afectó la farmacocinética de digoxina | |
| Asociaciones contraindicadas o no recomendadas con maraviroc:En general, combinaciones de 2 inductores enzimáticos importantes (p. ej: rifampicina+efavirenz) | ||||
| Antiretrovirales:FPV/r | VHC:(Nota: puede asociarse con boceprevir y telaprevir ajustando maraviroc a 150mg/12h) | Otros:Hypericum perforatum (hierba de San Juan) | ||
| Inhibidoresde laintegrasadel HIV | Raltegravir | UGT1A1(No es sustrato del citocromo P-450)P-gp no juega un papel importante | – | In vitro: no inhibe UGT1A1 ni UGT2B7; sin embargo según un estudio clínico,in vivopuede existir cierta inhibición de la UGT1A1No inhibe P-gp |
| Asociaciones contraindicadas o no recomendadas con raltegravir: No se recomienda su administración simultánea con antiácidos que contienen aluminio y/o magnesio: espaciar 4h. No se han descrito otras asociaciones contraindicadas o no recomendadas con raltegravir(Nota: raltegravir puede asociarse a telaprevir y boceprevir sin que se requiera ajuste de dosis) | ||||
| Dolutegravirb | UGT1A1 (mayoritario)CYP3A4 (minoritario)In vitro es sustrato de UGT1A3, UGT1A9 y de transportadores BCRP y P-gp | Probablemente el efecto inhibidor sobre 3A4 carezca de importancia clínicaTransportador OCT2 | ||
| Asociaciones contraindicadas o no recomendadas con dolutegravir:En general, fármacos que puedan aumentar su metabolismo (inductores del CYP3A4) o que contengan cationes. | ||||
| Antirretrovirales:Etravirina (si no va asociada a IP)NevirapinaNota: con inductores como efavirenz, fosamprenavir/ritonavir tipranavir/ritonavir o rifampicina dosificar dolutegravir 50mg/12h o considerar alternativas. Esta pauta solo se recomienda en pacientes naive o en pretratados que sean naive a inhibidores de la integrasa | VHC:(Nota: dolutegravir puede asociarse a telaprevir y boceprevir sin que se requiera ajuste de dosis) | Otros:CarbamacepinaDofelitideFenitoínaFenobarbitalHypericum (hierba de San Juan)OxcarbazepinaMedicamentos que contengan cationes: antiácidos, laxantes, sucralfato, hierro, calcio, administrados simultáneamente. (Debe administrarse dolutegravir 2h antes o 4h después)Nota: con rifampicina, dosificar dolutegravir 50mg/12h o considerar alternativas. Se recomienda monitorizar concentraciones de metformina al iniciar o parar la administración de DTG | ||
| Elvitegravir(ver también cobicistat, que se emplea como potenciador farmacocinético) | CYP3A4 (mayoritario)UGT1A1/1A3 (minoritarios) | Inductor de escasa potencia sobre CYP2C9 y UGTInductor débil de CYP3A4 | Inhibidor débil de P-gp (sin relevancia clínica) | |
| Potenciador farmacocinético | Cobicistatb | CYP3A4 (mayoritario)CYP2D6 (minoritario)(no es sustrato de UGT) | CYP3A4 (potente)CYP2D6 (débil)P-gp (potencia similar a RTV)BCRP en intestinoOAT1B1 y OAT1B3 en hígado | |
| Asociaciones contraindicadas o no recomendadas con elvitegravir/cobicistat:En general, evitar fármacos que puedan reducir su eficacia (inductores del CYP3A4) o los antiácidos (espaciando 4h el antiácido se evita esta interacción). Evitar también fármacos que se metabolicen mediante el CYP3A pues COBI es un potente inhibidor de este y puede incrementar las concentraciones plasmáticas de aquellos | ||||
| Antirretrovirales: Stribild® es una combinación de ARV, por lo que no debe asociarse a otros ARV | VHC: (Nota: telaprevir aumenta la Cmin de EVG un 29% y la Cmin de COBI un 249%Pendiente de establecer recomendacionesNo hay datos con boceprevir | Otros:AlfuzosinaAmiodaronaAnticonceptivos orales: utilizar un anticonceptivo hormonal que contenga mínimo 30μg de etinilestradiol y que contenga norgestimato como progestágeno, o usar un método alternativo fiable. No hay datos con otros progestágenos: evitar.Antiácidos de Al/Mg simultáneamente (espaciar 4h)Atorvastatina (evitar o valorar beneficio/riesgo)BosentánCarbamacepinaColchicina (si insuficiencia renal o hepática) (Nota: en pacientes con función renal y hepática normal puede requerir ajuste de dosis)Derivados de la ergotaminaFenobarbitalFenitoína(Nota: Fluticasona precaución y estrecha monitorización; preferiblemente beclometasona)Hypericum (hierba de San Juan)LovastatinaMidazolam por vía oralOxcarbazepinaPimozidaQuinidinaRifabutinaRifampicinaSalmeterolSildenafilo (en hipertensión pulmonar)SimvastatinaSuplementos vitamínicos simultáneamente (espaciar 4 horas)TriazolamVoriconazol (evitar o valorar riesgo/beneficio) | ||
Se indican en negrita los datos procedentes de la ficha técnica del producto. Los datos de dolutegravir y atazanavir no potenciado proceden de la ficha técnica americana.
Estos antirretrovirales no se encuentran todavía comercializados en noviembre de 2013, pero se espera su próxima comercialización, por lo que se han incluido en las tablas.
Los efectos de TPV/r sobre el CYP3A4 y la P-gp son complejos y diferentes tras la primera dosis o en estado de equilibrio estacionario (dosis múltiples). Tras la primera dosis inhibe de forma leve el CYP1A2 y el CYP2C9, inhibe de forma moderada el CYP3A4/5 hepático, el CYP2D6 y la P-gp intestinal e inhibe de forma potente el CYP3A4 intestinal. En estado de equilibrio inhibe de forma moderada del CYP3A4/5 hepático, inhibe de forma potente el CYP2D6 y el CYP3A4/5 intestinal, induce el CYP1A2 y el CYP2C9 y tiene efecto mínimo sobre la P-gp.
Existen diversas páginas web que permiten buscar posibles interacciones172-174. Debido a que la información científica relacionada con los FAR se renueva constantemente, se recomienda consultar también la ficha técnica y la información actualizada por las compañías farmacéuticas y las autoridades sanitarias175,176.
Algunas interacciones farmacodinámicas (modificación del efecto a nivel de receptor, sin cambios en las concentraciones) tienen interés clínico. Dan lugar a adición, sinergia o antagonismo, ya sea reduciendo o aumentando la eficacia o la toxicidad. Algunos ejemplos son el incremento del riesgo de toxicidad mitocondrial al asociar ribavirina con ddI, de toxicidad renal al asociar TDF a otros nefrotóxicos, o de anemia al asociar ZDV con los nuevos IP del VHC (boceprevir y telaprevir) más interferón y ribavirina.
Se han descrito interacciones importantes entre los IP del VHC y los FAR, que pueden consultarse en una página web específica177, así como en las recomendaciones elaboradas por la Agencia Española del Medicamento y Productos Sanitarios178.
Recomendaciones
- •
Se deben reseñar en la historia clínica todos los medicamentos, productos naturales y medicinas alternativas que toma el paciente para evaluar posibles interacciones entre ellos (A-III).
- •
Se deben tener en cuenta las contraindicaciones y realizar los ajustes de dosis correspondientes cuando sea necesario (A-I).
- •
Se debe considerar la monitorización de los niveles plasmáticos cuando se administren 2 o más fármacos con posibles interacciones farmacocinéticas relevantes, para evitar toxicidad o ineficacia terapéutica (A-II).
Se caracteriza en más de la mitad de los casos por un síndrome febril agudo autolimitado similar a la gripe o a la mononucleosis infecciosa179-181. Las pruebas de ELISA de cuarta generación, que incluyen la determinación simultánea de anticuerpos y del antígeno p24 del VIH, acortan el periodo ventana y permiten el diagnóstico en el 80-90% de casos. La infección aguda (primeros 30días) no debe confundirse con la infección reciente, que hace referencia a pacientes diagnosticados en los primeros 6meses (180días) de la infección.
La indicación del TAR en la infección aguda es controvertida179-181. Las ventajas serían acortar la duración y la gravedad de los síntomas, suprimir la replicación viral, reducir la diversidad viral y el reservorio, reducir el riesgo de transmisión del VIH, normalizar la cifra de linfocitos CD4+, reducir la activación inmunológica y preservar o restaurar la inmunidad específica frente al VIH-1, lo que en teoría podría permitir el control inmunológico de la replicación viral sin TAR. Por el contrario, las principales desventajas del TAR en esta etapa son la exposición a los FAR sin un beneficio clínico claramente demostrado, su duración indefinida, el riesgo de efectos secundarios, de desarrollo de resistencias si el cumplimiento no es adecuado, la posible reducción de la calidad de vida y el tratamiento innecesario de individuos controladores de elite.
Para evitar un TAR indefinido se han realizado en los últimos años diversas estrategias terapéuticas179-181: 1)administrar el TAR durante un periodo limitado de tiempo (ensayos clínicos SPARTAC, PRIMO-SHM y ACTG A5217); 2)administrarlo de forma intermitente, a fin de potenciar la respuesta VIH-específica y controlar la replicación viral sin FAR; 3)combinar el TAR con inmunosupresores (hidroxiurea, ciclosporinaA, ácido micofenólico) o citoquinas (IL-2, interferón), y 4)asociar las vacunas terapéuticas (QUEST, ACTG A5187) al TAR. En la mayoría de los pacientes ninguna de estas estrategias ha conseguido que el sistema inmune controle la replicación viral de forma sostenida sin TAR. Solo se ha observado control virológico en el 4-8% de los pacientes182,183 que en general iniciaron el TAR precozmente (primeros 90días), pero paradójicamente las características virológicas, inmunológicas y genéticas de estos «controladores post-TAR»184 son completamente diferentes a los controladores de elite. Por tanto, en la práctica clínica, si se inicia el TAR durante la infección aguda, este se debe mantener de forma indefinida.
El TAR en la infección reciente debe iniciarse en los primeros 4meses de la infección por el VIH, ya que es cuando se puede conseguir el máximo beneficio inmunológico (alcanzar más de 900 linfocitos CD4/μl)185.
Finalmente, siempre debe valorarse la inclusión de estos pacientes en protocolos de investigación o ensayos clínicos que busquen la erradicación o la cura funcional del VIH.
Recomendaciones
- •
En los pacientes con una infección aguda sintomática se recomienda iniciar TAR de forma inmediata en todos los casos graves (con afectación neurológica o de otro órgano, sintomatología prolongada [más de 7 días de duración], eventos clínicos B o C de la clasificación de los CDC de 2003, o un recuento de linfocitos CD4+ inferior a 350 células/μl) (A-II) y se debe considerar el TAR en el resto de pacientes (B-III).
- •
En los pacientes asintomáticos con infección aguda o reciente se recomienda iniciar TAR en los primeros 4meses si el paciente tiene una cifra inferior a 500 linfocitos CD4+/μl o una CVP superior a 100.000 copias/ml (B-II).
- •
Se debe recomendar iniciar el TAR en todos los casos en los que exista un alto riesgo de transmisión del VIH (A-II).
- •
Se debe recomendar el inicio del TAR en aquellas indicaciones de inicio de TAR que sean independientes de la cifra de linfocitos CD4+ y que se describen en el apartado de la infección crónica por el VIH (A-II) (tabla 2) y cuando la infección aguda por el VIH ocurre durante el embarazo (A-I).
- •
Si se decide iniciar TAR se recomienda hacerlo con las mismas pautas preferentes para tratar la infección crónica por el VIH (A-I) (tabla 3). Una pauta con 2 ITIAN y un inhibidor de la integrasa podría reducir más rápidamente la CVP durante las primeras 4-8 semanas en comparación con los IP o los ITINN, lo que podría facilitar la reducción de la transmisión del VIH. La combinación de RAL+2 ITIAN (preferentemente TDF/FTC) tendría, además, la ventaja de alcanzar mayores concentraciones en las secreciones genitales (B-III).
- •
Se debe efectuar siempre una prueba de resistencia y un tropismo viral en el momento del diagnóstico de la infección aguda o reciente, se vaya a iniciar TAR o no (A-II).
- •
Si no se dispone del resultado del estudio de resistencias es preferible comenzar con una pauta basada en un IP/r hasta tener los resultados (A-II).
- •
Si se inicia el TAR, este debe administrarse por tiempo indefinido (A-I). En los pacientes sin criterios de TAR se recomienda reevaluar la indicación del mismo a los 6meses, cuando la infección pasa a ser crónica.
El VIH-2 posee una organización genómica similar al VIH-1, aunque con diferencias estructurales que van a influir de forma significativa en su patogenicidad y en su sensibilidad a los FAR186.
Diversas circunstancias provocan que la toma de decisiones acerca del TAR en los pacientes con infección por el VIH-2 tenga una mayor dificultad: 1)La historia natural del VIH-2 difiere de la del VIH-1 y carecemos de las evidencias necesarias que permitan identificar el momento óptimo de inicio del TAR en estos pacientes. 2)Los algoritmos genotípicos utilizados para predecir resistencias a FAR en la infección por VIH-1 no son directamente aplicables al VIH-2. 3)No disponemos de evidencias procedentes de ensayos clínicos que permitan identificar los regímenes de uso preferencial en el escenario de la infección por VIH-2. 4)En el momento actual tampoco disponemos de una prueba comercial para medir la carga viral del VIH-2, ni de pruebas de resistencia fenotípicas o genotípicas validadas para uso clínico. Pese a estas limitaciones, parece razonable asumir que los principios generales del TAR en los pacientes con infección por el VIH-2 deben ser los mismos que para el VIH-1.
El VIH-2 presenta importantes diferencias respecto al VIH-1 en su perfil de sensibilidad a los FAR. El VIH-2 presenta resistencia intrínseca a los ITINN187. En contraposición, es sensible a los ITIAN, aunque su barrera genética frente a estos es más baja que frente al VIH-1188. Además, el VIH-2 presenta una sensibilidad variable frente a los IP, siendo LPV, SQV y DRV los más activos189. RAL tiene actividad in vitro frente al VIH-2190. Sin embargo, el uso de MVC en el tratamiento de la infección por VIH-2 está limitado por la no disponibilidad de un adecuado test de tropismo y por la capacidad del VIH-2 para utilizar, además del CCR5 y el CXCR4, otros correceptores191. Por último, el VIH-2 presenta resistencia intrínseca a ENF192. En este escenario, hasta no disponer de nuevas evidencias, como régimen preferente para el TAR de inicio en pacientes infectados por el VIH-2 o con infección dual por VIH-1/2 parece razonable recomendar la combinación de 2 ITIAN y un IP/r.
Recomendaciones
- •
Los principios generales del TAR en pacientes con infección por el VIH-2 deben ser los mismos que para la infección por el VIH-1 (A-III).
- •
El régimen de TAR de inicio de uso preferente en estos pacientes es la combinación de 2 ITIAN+1 IP/r (A-III).
- •
El uso de ITINN, MVC o ENF están contraindicados para el tratamiento de la infección por el VIH-2 (A-I).
El TAR en el embarazo está incluido en un documento de consenso elaborado por el PNS en colaboración con GeSIDA y otras sociedades científicas193. Se recomienda su lectura y el de otra guía internacional sobre el tema194 para cualquier duda al respecto. En este apartado nos limitamos a presentar las recomendaciones acerca del TAR en este contexto. El manejo obstétrico y del recién nacido está fuera de los objetivos y del alcance de esta guía.
Recomendaciones
- •
Es imprescindible realizar una serología de VIH en toda mujer embarazada y, si fuera negativa, repetirla en el tercer trimestre (A-II).
- •
El consejo preconcepcional debe formar parte de la asistencia a la mujer con infección por el VIH en edad reproductiva193 (A-II).
- •
El TAR está indicado en todas las gestantes, independientemente del número de linfocitos CD4+ y de la CVP que presenten con el objetivo de mantener la CVP indetectable (A-I).
- •
La elección de los FAR concretos se basará en el estudio de resistencias, en la seguridad de los mismos y en su facilidad de cumplimiento (tablas 10–12). Si no hay resistencias, el TAR de elección es ZDV+3TC+LPV/r (A-I); en caso contrario, podrán recibir cualquiera de los FAR «recomendados» y «alternativos» tras una valoración individualizada (A-III)193-198. En la tabla 11 se recoge la actitud recomendada ante diferentes situaciones.
Tabla 10.Fármacos antirretrovirales y embarazo
Antirretrovirales (categoría FDA) Toxicidad potencial en la gestación Comentarios ITIANZDV (C)d4T (C)ddI (B)ABC (C)3TC (C)FTC (B) MielotoxicidadToxicidad mitocondrialReacción de hipersensibilidad ZDV: amplia experiencia, uso seguro Con d4T+ddI: incremento del riesgo de muerte materna por acidosis láctica y fallo hepáticoABC: reacción de hipersensibilidad potencialmente grave en presencia del alelo HLA B5701 ITIANTDF (B) NefrotoxicidadAlteraciones del metabolismo P/Ca Alternativa por el riesgo potencial de nefrotoxicidad y alteraciones óseas fetales ITINNEFV (D)NVP (B)ETR (B)RPV (B) Alteraciones del SNCHepatotoxicidad EFV: contraindicado por riesgo de anencefalia y defectos del tubo neural en primates y humanos en el primer trimestre de la gestaciónNVP: amplia experiencia de uso durante la gestación; riesgo de hepatotoxicidad grave con CD4 > 250 CD4/mm3, especialmente en mujeres con coinfección por VHB y VHC. Este efecto adverso no es extrapolable a mujeres que ya estaban en TAR con NVP al inicio de la gestación y/o que han tomado NVP previamente IPRitonavir (B)Lopinavir (C)Saquinavir (B)Atazanavir (B)Darunavir (C)Fosamprenavir (C)Tipranavir (C) HiperglucemiaRiesgo de prematuridad ATV: riesgo de aumento de hiperbilirrubinemia neonatal, aunque parece poco relevante en estudios realizados en embarazadasSQV y LPV son bien tolerados en el embarazo I. FusiónEnfuvirtida (B) Datos escasos en la gestación I. IntegrasaRaltegravir (C)Elvitegravir (B) Datos escasos en la gestación Antagonistas CCR5Maraviroc (B) Datos escasos en la gestación Tabla 11.Manejo del TAR en la gestación en distintas situaciones
Semana de inicio del TAR Fármacos Comentariosa Gestante sin TAR previo y sin indicación de TAR A partir de las 12-14 semanasb IP/r+2 ITIAN En caso de interrupción de TARV con IP+2 ITIAN, se interrumpirán todos los fármacos a la vez Gestante sin TAR previo con indicación de TARc Inicio lo más precoz posible IP/r+2 ITIAN, o bien NVP+2 ITIAN (esta última solo posible si CD4<250 células/mm3) En caso de cambio de TARV compuesto por NVP+2 ITIAN durante la gestación debida a toxicidad o intolerancia, mantener los 2 ITIAN y añadir IP a los 7 diasd Gestante en TAR Mantener TARSi la gestante interrumpió el TAR, reiniciar a las 12-14 semanasb Sustituir fármacos teratogénicos (EFV)Evitar combinaciones con riesgo elevado de toxicidad (D4T+DDI) o menor eficacia (3 ITIAN)Si está con NVP, mantener aunque CD4>250 células/mm3 En pautas de TARV con LPV/r o ATV/r, considerar determinar niveles de IP, especialmente en el 3.er trimestre si la técnica está disponible o valorar suplementar dosiseSi ATV/r se acompaña de TDF, aumentar dosis de ATV a 400mg en 2.° y 3.er trimestre Gestante con indicación de TAR y antecedentes de abandono de TARc Inicio lo más precoz posible Pauta de TAR según estudio de resistencias y TARV previosSi coinfección por VHB, mantener 3TC o considerar TDF+FTC Utilizar como primera opción los antirretrovirales con mayor experiencia siempre que sea posibleUtilizar ZDV en el TAR siempre que sea posible Gestante con primoinfección por VIHc Inicio en el momento del diagnóstico Triple terapia con IP/r. Ajustar en cuanto se conozca el genotipo Si el diagnóstico es en 3.er trimestre, programar cesárea electiva Gestante con infección por VIH desconocida en el parto Realizar test rápido para VIH Si positivo, administrar ZDV i.v.+NVP oral en dosis única y proceder con cesárea electiva Consultar documento específico para ver tratamiento a administrar al RN y cómo seguir en la madre Mujer en TAR que desea quedarse embarazada Evitar EFV Insistir en la adherencia y en mantener la CV indetectable previa al embarazo aSe recomienda ZDV como parte del TAR en el embarazo y ZDV en el parto y el neonato, según el protocolo ACTG 076.
bEn mujeres con CVP elevada o con indicación de TAR por salud materna, debe considerarse iniciar lo más precozmente posible, siempre que se comience con fármacos seguros y que no haya una hiperémesis gravídica incontrolable.
cCuando en esta situación la presentación es próxima al parto, se puede valorar también la adición de raltegravir, dado su rápido paso placentario, a dosis de 600mg/12h, aunque la experiencia con este fármaco es escasa; y/o de NVP oral al menos 2h antes del parto asociada a ZDV i.v. (ver documento específico para ampliar la información).
Tabla 12.Recomendaciones de uso de fármacos antirretrovirales en el embarazo
Recomendados Alternativos* No recomendados (salvo que no haya otra alternativa) Contraindicados ITIAN ZDV3TC ABCaTDFbFTC ddId4T d4T+ddIc ITINN NVPd si CD4 < 250 células/μl ETR EFVe IP LPV/r 400/100mg cada 12hATV/rf 300/100g mg cada 24h DRV/r 800/100mg cada 24hSQV/r 1.000/100mg cada 12h FVP/rTPV/r I. Fusión ENF (T-20) I. Integrasa RAL 400mg cada 12h. bRiesgo potencial de alteraciones renales y óseas y alteraciones del metabolismo calcio-fósforo tanto en animales como en pacientes VIH. No se recomienda de manera general como primera elección, aunque debe considerarse para el tratamiento en pacientes con confección por VHB si los beneficios son superiores al riesgo. Además, datos recientemente publicados sugieren que su utilización es eficaz y probablemente segura.
dMayor riesgo de hepatotoxicidad en gestantes coinfectadas por VHC, VHB o con linfocitos CD4 > 250 célulass/mm3.
eCategoría D, potencialmente teratógeno, aunque datos observacionales sugieren la posibilidad de mantenerlo, especialmente si el diagnóstico de embarazo se hace a partir de la 5.ª-6.ª semana.
fHiperbilirrubinemia, riesgo potencial de kernicterus. En adultos se ha descrito un aumento de la bilirrubina no conjugada con el uso de este fármaco. Sin embargo, en una pequeña serie de 40 gestantes tratadas con este fármaco no se ha descrito una mayor incidencia de hiperbilirrubinemia en los neonatos con respecto a la población general.
- •
El tratamiento intraparto debe ser ZDV por vía intravenosa, especialmente en mujeres con CVP mayor de 400-1.000 copias/ml, con independencia del TAR que hubiese realizado previamente la paciente (A-I)193,194,198.
- •
La cesárea programada está indicada, en la semana 38, en mujeres cuya CVP previa al parto es mayor de 1.000 copias/ml (A-II).
- •
Las madres deben abstenerse de forma absoluta de lactar a sus hijos y alimentarlos con una fórmula adaptada (A-I)193,194.
En la actualidad se recomienda iniciar el TAR en fases precoces de la infección por el VIH. A pesar de ello, una proporción considerable de pacientes acude por primera vez en fases avanzadas, con inmunodepresión profunda y, en ocasiones, presentando enfermedades oportunistas, la mayoría infecciosas (IO).
El momento idóneo para iniciar el TAR en un paciente con una IO es motivo de controversia199. Las posibles ventajas de un inicio temprano incluyen una recuperación inmune más rápida, una mayor resolución de la IO, prevenir la aparición de otras IO y reducir el riesgo de mortalidad. Entre los inconvenientes del inicio precoz del TAR están el número elevado de comprimidos a tomar para el tratamiento concomitante de la IO y del VIH, posibles interacciones y toxicidades, y el llamado síndrome inflamatorio de reconstitución inmunológica (SIRI)199. Este último es una respuesta inflamatoria que provoca un empeoramiento paradójico de la IO, que está relacionada, al menos en parte, con la carga antigénica del patógeno en cuestión y, por ello, aparece con más frecuencia en pacientes que inician el TAR muy poco después del inicio del tratamiento de la IO.
La IO en la que más se ha estudiado el mejor momento para iniciar el TAR es la tuberculosis, que se trata en otro apartado. Existen pocos estudios aleatorizados y de cohortes que hayan evaluado este tema en otras IO. El ensayo clínico aleatorizado ACTG A5164 demostró una reducción en la progresión a sida/muerte (OR: 0,51; IC95%: 0,27-0,94) en pacientes que iniciaban TAR dentro de una mediana de 12días tras el inicio del tratamiento de la IO frente a los que lo demoraban hasta una mediana de 45 días200. No se observaron diferencias significativas en efectos adversos, incidencia de SIRI ni aparición de este según se usasen o no esteroides para la IO. Más del 60% de los pacientes tenían neumonía por Pneumocystis jiroveci (NPJ), pero dado el pequeño número y variedad de otras IO es difícil extraer conclusiones para cada una de ellas por separado. En todo caso, parecía haber una tendencia favorable al inicio precoz en las infecciones fúngicas, incluyendo la meningitis criptocócica (MC).
Un estudio prospectivo de cohorte, realizado por el grupo PISCIS, halló también una mayor progresión a sida/muerte en los pacientes que iniciaron el TAR entre 30-270días frente a los que lo hicieron antes de 30días, tanto en IO en general como en la NPJ (p=0,002; RR: 1,83; IC95%: 1,25-2,68)201.
Una de las IO más complicadas de tratar por su elevada morbimortalidad es la MC, sobre todo en los países empobrecidos. La ausencia de un tratamiento estandarizado para el aumento de la presión intracraneal, la falta de 5-fluorocitosina y la dificultad para acceder al TAR en esos países seguramente contribuyen a su mayor mortalidad.
Algunos estudios han intentado evaluar la importancia del momento de iniciar el TAR en pacientes con MC. En Zimbabwe, Makadzange et al.202 observaron una peor supervivencia en los pacientes que iniciaron el TAR (d4T/3TC/NVP) antes de 72h del comienzo del tratamiento de la MC respecto a los que lo iniciaron después de 10semanas (RR: 2,85; IC95%: 1,1-7,23). Sin embargo, hay que tener en cuenta que en dicha mala evolución pueden haber influido varios factores, como la ausencia de un protocolo de manejo de la hipertensión intracraneal, el uso de fluconazol en lugar de anfotericina B como tratamiento antifúngico, con lo cual la carga antigénica pudo ser mayor de la deseable, lo que se habría sumado al inicio «demasiado» precoz del TAR.
En un reciente estudio aleatorizado en Botswana, Bisson et al.203 evaluaron a 27 pacientes que iniciaron TAR con una mediana de 7 frente a 32días tras la aleatorización, todos en tratamiento con anfotericinaB. No encontraron diferencias en el aclaramiento del criptococo del líquido cefalorraquídeo (LCR), aunque sí una tendencia a menor mortalidad a pesar de una mayor frecuencia de SIRI en los pacientes con inicio precoz del TAR. No obstante, este estudio tiene la limitación de su pequeño tamaño muestral, menor del previsto en el diseño por problemas de selección.
Finalmente, el estudio Cryptococcal Optimal ART Timing (COAT), organizado por la Universidad de Minnesota y realizado en África (NCT01075152), se suspendió por mayor mortalidad de los pacientes con MC que iniciaron precozmente el TAR. Los pacientes fueron aleatorizados a inicio precoz o tardío del TAR (antes de 48h o después de 4semanas después de haber comenzado el tratamiento con anfotericinaB).
Por tanto, a pesar de la limitación de los datos, en las IO en general parece haber una menor progresión de la enfermedad en aquellos pacientes que inician TAR de forma precoz (antes de los 30días), aunque no está claro si, además de la NPJ, esto es cierto para todas las IO. Concretamente, en la MC parece prudente retrasar al menos unos días el inicio del TAR, hasta que se haya reducido la carga antigénica y, si es posible, se haya aclarado el LCR, preferentemente con el tratamiento recomendado (anfotericina B+5-fluorocitosina)204 y con un estrecho control de la hipertensión intracraneal.
Recomendaciones
- •
En pacientes con IO se debe iniciar el TAR dentro de los primeros 15-30días del inicio del tratamiento de la infección (A-II).
- •
En el caso de la meningitis criptocócica, parece prudente esperar —unos 15días— a que se haya aclarado el LCR, o al menos haya descendido la carga antigénica, para iniciar el TAR (A-II). Además se debe seguir un control estrecho de la hipertensión intracraneal (A-I).
El tratamiento de la tuberculosis (TB) en adultos con infección por el VIH ha sido objeto de un documento de consenso reciente de GeSIDA/Secretaría del PNS205. Se recomienda su lectura para cualquier duda relacionada con el tratamiento de la TB o de la infección por VIH en pacientes que padecen las 2 enfermedades. En este apartado nos limitamos a presentar de modo resumido los aspectos más relevantes del TAR en este contexto.
Momento de inicio óptimo del tratamiento antirretroviral en pacientes con infección por VIH y tuberculosisEsta importante cuestión se ha visto resuelta gracias a 3 ensayos clínicos realizados en diferentes partes del mundo cuyos resultados fueron, con pequeñas diferencias, congruentes entre sí206-208.
Recomendaciones
- •
En función de los mencionados ensayos, se recomienda iniciar TAR siempre durante el tratamiento de la TB, independientemente del recuento de linfocitos CD4+, ya que se disminuye el riesgo de muerte (A-I). El momento óptimo de iniciarlo depende del recuento de células CD4+.
- •
Si el recuento de linfocitos CD4+ es inferior a 50 células/μl, el TAR debe iniciarse lo antes posible, tras comprobar la tolerancia al tratamiento antituberculoso y no más tarde de las 2 primeras semanas (A-I).
- •
Si el recuento de linfocitos CD4+ es superior a 50 células/μl, el inicio del TAR puede retrasarse hasta finalizar la fase intensiva del tratamiento antituberculoso (8semanas). De este modo se disminuye el riesgo de efectos adversos y el desarrollo de SIRI, sin comprometer la supervivencia (A-I).
La principal dificultad en el tratamiento adecuado simultáneo de la TB y la infección por VIH radica en las posibles interacciones medicamentosas. Estas son especialmente relevantes en el caso de las rifamicinas, por ser potentes inductores del sistema enzimático CYP3A4, implicado en el metabolismo de la mayoría de las familias de FAR.
Como principio general, debe intentarse, siempre que se pueda, incluir rifampicina en el tratamiento de la TB e incluir en el TAR aquellos FAR con menos problemas de interacciones. Para el paciente que inicia TAR, la elección del régimen debe seguir las mismas normas que para la población sin TB y debe incluir, por tanto, 2 ITIAN y un tercer fármaco. Para pacientes que han recibido previamente TAR y han desarrollado resistencia o intolerabilidad, el régimen debe construirse de acuerdo con los principios para la elección de FAR en pacientes en tratamiento para TB que se resumen a continuación. Las recomendaciones pueden sintetizarse en los siguientes puntos:
Recomendaciones
- •
Elección de los ITIAN. No existe interacción significativa entre los fármacos antituberculosos y los ITIAN, ni hay evidencia de la potenciación de la toxicidad entre ellos. Por tanto, ABC, TDF, 3TC o FTC pueden ser utilizados en estos pacientes sin riesgos añadidos (A-I).
- •
Elección del tercer fármaco. La mayor experiencia y los mejores resultados se han obtenido con EFV, por lo que este constituye el FAR de elección (A-I). La dosis de EFV es la estándar en todos los pacientes (600mg/día), independientemente del peso, sin necesidad de aumentarla a 800mg/día209 (A-I).
- •
Alternativas terapéuticas como terceros fármacos. Existe evidencia para recomendar como alternativas pautas que incluyan NVP a dosis habituales210 (A-II), RAL a dosis de 800mg/12h211 (A-II) y MVC a dosis de 600mg/12h en ausencia de inhibidores potentes del CYP3A4212 (A-III).
- •
Fármacos que no pueden utilizarse. No se deben coadministrar con rifampicina los otros ITINN (RPV y ETR), ningún IP (potenciado o no con RTV) ni EVG. En el caso excepcional de que un IP fuese la única opción de TAR, debe sustituirse rifampicina por rifabutina y realizar el ajuste correspondiente en las dosis de los fármacos213 (A-II).
El SIRI es una complicación frecuente del TAR en pacientes con TB, especialmente en los que tienen recuentos de células CD4+ muy bajos y cuando el TAR se inicia muy precozmente en relación al inicio del tratamiento antituberculoso.
Recomendaciones
- •
En caso del desarrollo del SIRI, no debe interrumpirse el tratamiento antituberculoso ni el TAR (A-III).
- •
Para el manejo de los síntomas del SIRI pueden añadirse antiinflamatorios no esteroideos en el caso de formas leves-moderadas (A-III) o corticoesteroides en las formas moderadas-graves (A-II)214.
Para una visión completa del diagnóstico, prevención y tratamiento de las alteraciones renales en pacientes con infección por VIH se recomienda consultar el documento de consenso ad hoc elaborado por GeSIDA y el PNS215.
En este contexto se contemplan 2 supuestos:
Nefropatía asociada a la infección por VIHRecomendaciones
- •
El TAR (A-II) y los fármacos bloqueadores de la angiotensina (B-III), IECA o ARA-2, solos o en combinación, en dosis crecientes para intentar reducir la proteinuria a valores inferiores a 1g/día y con el objetivo de lograr cifras de presión arterial inferior a 130/80mmHg, constituyen las principales estrategias terapéuticas en los pacientes con nefropatía asociada a la infección por VIH.
- •
El tratamiento esteroideo solo debe considerarse cuando no se produzca una mejoría de los parámetros de la función renal con el TAR y los fármacos bloqueantes de la angiotensina (C-III).
- •
Las indicaciones de tratamiento renal sustitutivo con diálisis o trasplante en estos pacientes son similares a las de otras nefropatías crónicas en la población general (A-III).
Recomendaciones
- •
Es necesario ajustar las dosis de los ITIAN, excepto en el caso de ABC (A-II).
- •
No se requiere ajuste de dosis para los ITINN, IP, ENF ni RAL (A-II).
- •
MVC requiere ajuste de dosis si se emplea en combinación con inhibidores potentes del CYP3A4, como los IP (excepto TPV/r), ketoconazol, itraconazol, claritromicina y telitromicina (A-II).
- •
Se desaconseja el uso de coformulaciones de FAR en pacientes con insuficiencia renal significativa. En estos casos deben emplearse los FAR por separado y realizar los ajustes pertinentes.
- •
En los pacientes con cualquier grado de insuficiencia renal se recomienda vigilar estrechamente la función renal y evitar los fármacos nefrotóxicos (A-III).
- •
En los pacientes con IRC avanzada se debe realizar el ajuste de dosis recomendado por las fichas técnicas de cada medicamento, teniendo en cuenta las posibles interacciones entre los diferentes fármacos, más frecuentes y peligrosas en esta situación (A-II).
Tabla 13.Ajuste de dosis de los fármacos antirretrovirales en la insuficiencia renal y en hemodiálisis
Familia Fármacos Dosis habitual Dosis en insuficiencia renal En hemodiálisis ITIAN Abacavir (ABC) 300mg/12h No requiere ajuste de dosisNo administrar Combivir®™ y Trizivir® en pacientes con Cl <50ml/min (por separado, ajustar dosis adecuadamente) Dosis habitualHD: administrar independientemente de la sesión de HD, ya que se elimina mínimamente Didanosina, cápsulas entéricas (ddI) Peso≥60 kg 400mg c/24h ≥ 60 kgCl ≥60: 400mg c/24hCl 30-59: 200mg c/24hCl 10-29: 125mg c/24hCl < 10:Emplear Videx® polvo para solución pediátrica 75mg/24h HD/CAPD: 125mg c/24h; los días de HD administrar post-HD/CAPD (no requiere suplemento) Peso<60 kg 250mg c/24h < 60kgCl ≥ 60: 250mg c/24hCl 30-59: 125mg c/24hCl 10-29: 125mg c/24hCl < 10: Emplear Videx® polvo para solución pediátrica 75mg/24h HD/CAPD: Emplear Videx® polvo para solución pediátrica 75mg/24h Emtricitabina (FTC) 200mg c/24h (cápsulas)240mg c/24h (solución oral) En cápsulasCl ≥ 50: 200mg c/24hCl 30-49: 200mg c/48hCl 15-29: 200mg c/72hCl < 15: 200mg c/96hEn solución (10mg/ml)*:Cl ≥ 50: 240mg (24ml) c/24hCl 30-49: 120mg (12ml)c/24hCl 15-29: 80mg (8ml) c/24hCl < 15: 60mg (6ml) c/24hTruvada®: no administrar a pacientes con Cl < 30ml/min HD: en comprimidos 200mg c/96h, en solución (10mg/ml) 60mg (6ml) c/24hLos días de HD administrar post-HDNo se ha estudiado en diálisis peritonealTruvada®: no administrar a pacientes en HD (administrar los componentes por separado, ajustando dosis adecuadamente) Estavudina (d4T) ≥ 60 kg: 40mg c/12h ≥ 60 kgCl ≥ 50: 40mg c/12hCl 26-49: 20mg c/12hCl ≤ 25: 20mg c/24h HD: 20mg c/24h; los días de HD administrar post-HD <60kg: 30mg c/12h < 60kgCl ≥ 50: 30mg c/12hCl 26-49: 15mg c/12hCl ≤ 25: 15mg c/24h HD: 15mg c/24h; los días de HD administrar post-HD Lamivudina (3TC) 150mg c/12h o300mg c/24h Cl≥50: 150mg c/12h o 300mg c/24hCl 30-49: 150mg c/24h (primera dosis de 150mg)Cl 15-29: 100mg c/24h (primera dosis 150mg)Cl 5-14: 50mg c/24h (primera dosis 150mg)Cl < 5: 25mg c/24h (primera dosis 50mg)No administrar Combivir® y Trizivir® si Cl < 50ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) HD: 25mg c/24h (primera dosis 50mg) Los días de la HD, administrar post-HD Tenofovir (TDF)** 300mg c/24h Cl≥50: no requiere ajuste de dosisCl 30-49: 300mg c/48hCl 10-29: 300mg c/72 a 96hNo hay recomendaciones disponibles para pacientes con Cl < 10 sin HD HD: habitualmente 300mg una vez por semana, después de una de las sesiones (asumiendo 3 sesiones de diálisis semanales de 4h) Zidovudina (AZT) 300mg c/12h Puede acumularse el metabolito glucurónido (GAZT)Cl 10-50: 250-300mg c/12hCl < 10: 250-300mg c/24hNo administrar Combivir® y Trizivir® en pacientes con Cl <50ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) 300mg c/24hHD/CAPD: no afecta la eliminación de AZT y aumenta la eliminación de GAZT. Por precaución, se recomienda administrar la dosis diaria post-HD/CAPD ITINN Efavirenz (EFV) 600mg/24h No requiere ajuste de dosisAtripla®: en pacientes con Cl < 50ml/min, utilizar los principios activos por separado HD: no parece necesario ajustar la dosisCAPD: un estudio farmacocinético preliminar indica que no se requiere ajuste de dosis (datos de un solo paciente) Etravirina (ETR) 200mg/12h o 400mg/24h No requiere ajuste de dosis HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD Rilpivirina (RPV) 25mg/24h IR leve-moderada: no requiere ajuste de dosisIR grave: no hay datos. Emplear con precaución HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD Nevirapina (NVP) 200mg/12h No requiere ajuste de dosis HD: los días de HD, se recomienda administrar la dosis después de la HD o un suplemento de 200mg posthemodiálisis Inhibidores de la proteasa Atazanavir (ATV) 300mg/24h (con 100mg/24h RTV)400mg/24h (sin RTV) No requiere ajuste de dosis HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPDHD: se recomienda su uso potenciado (ATV/r 300/100) para compensar el descenso de concentración de ATV (reducción del 28% en el AUC de ATV los días sin HD y del 42% los días de HD; la eliminación a través de la HD es de solo el 2%). Monitorizar niveles plasmáticos cuando sea posible Darunavir (DRV) 800mg/24h (con 100mg/24h RTV) No requiere ajuste de dosis HD/CAPD: debido a la elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD Fosamprenavir (FPV) 700mg/12h (con 100mg/12h RTV) No requiere ajuste de dosis HD/CAPD: debido a su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD Indinavir (IDV) 800mg/8h No requiere ajuste de dosis HD: probablemente no requiera ajuste de dosis si función hepática conservada (datos muy limitados). Se elimina mínimamente a través de la HD Lopinavir (LPV/r) 400/100mg/12h, o800/200mg/24h No requiere ajuste de dosis HD: el AUC de LPV/r en 13 pacientes en HD fue equivalente a la de pacientes con función renal normal. No ajuste de dosisCAPD: debido a la elevada unión a proteínas plasmáticas de LPV y RTV, no es de esperar que se elimine en las sesiones de CAPD Saquinavir (SQV/r) 1.000mg/12h (con 100mg/12h de RTV) No requiere ajuste de dosis HD/CAPD: debido a la elevada unión a proteínas plasmáticas de ritonavir, no es de esperar que se elimine en las sesiones de HD/CAPD Tipranavir (TPV/r) 500mg/12h (con 200mg/12h de RTV) No requiere ajuste de dosis HD/CAPD: debido a la elevada unión a proteínas plasmáticas de TPV/RTV, no es de esperar que se eliminen en las sesiones de HD/CAPD Inhibidores de la integrasa RAL (raltegravir) 400mg/12h No requiere ajuste de dosis HD: no es probable que RAL se elimine significativamente a través de la HD. Datos de 2 pacientes con ERCA mostraron la ausencia de eliminación de RAL durante una sesión de HD de 4h Elvitegravir (EVG)/cobicistat/TDF/FTC (Stribild®) 150/150/200/245mg Cobicistat reduce levemente el FG renal estimado de creatinina (aunque no altera el FG real) debido a la inhibición de la secreción tubular de creatininaStribild® no debe iniciarse en pacientes con Cl < 70ml/min. Si el Cl durante el tratamiento se reduce a Cl<50ml/min debe suspenderse, dado que no se puede realizar el ajuste de dosis adecuado para TDF/FTC No procede. Stribild® no debe emplearse si Cl < 50ml/min Dolutegravir (DTG) 50mg/24h No requiere ajuste de dosis. No obstante, dado que los pacientes con IR presentan concentraciones plasmáticas de DTG más bajas, se recomienda precaución en pacientes con IR avanzada con experiencia previa a InInt que presenten MR o sospecha de resistencia a estos fármacos. Antagonistas del CCR5 Maraviroc 150mg/12h junto con IP/r, excepto TPV/r300mg/12h junto con TPV/r, ITIAN y RAL600mg/12h junto con EFV y NVP En ausencia de inhibidores potentes del CYP3A4 no requiere ajuste de dosisSolo se recomienda un ajuste de dosis en pacientes con ClCr <80ml/min y que están recibiendo inhibidores potentes del CYP3A4, como los IP (excepto TPV/r), ketoconazol, itraconazol, claritromicina o telitromicina, boceprevir, telaprevir: en estos casos administrar 150mg c/24h. Si el ClCr es <30ml/min se recomienda mucha precaución debido al aumento de riesgo de hipotensión posturalCon ClCr <80ml/min y en combinación con TPV/r no se requiere ajuste de dosis (300mg c/12h)(Estos ajustes de dosis se recomiendan basándose en los datos de un estudio en insuficiencia renal y simulaciones farmacocinéticas, sin que su seguridad y eficacia hayan sido evaluadas clínicamente, por lo que se recomienda una estrecha monitorización.) HD: en ausencia de inhibidores potentes del CYP3A4 no se requiere ajuste de dosis. En presencia de los mismos, dosificar igual que para Cl <80ml/min (datos limitados)Escasa eliminación a través de la HD
La administración de TAR y el control subsiguiente de la replicación viral se han asociado en estudios de cohortes a una menor velocidad de progresión de la enfermedad hepática por VHC y a una mejor evolución clínica, incluso en pacientes con cirrosis descompensada. Por ello se recomienda la administración precoz de TAR en la mayoría de estos pacientes, para mantener controlada la replicación del VIH y una buena situación inmunológica216,217.
TDF suprime el VHB en la inmensa mayoría de los pacientes coinfectados por VIH/VHB218. Por ello en estos pacientes, si existe indicación de tratar la infección por VHB, se debe iniciar TAR incluyendo TDF.
En el caso de pacientes que han de recibir a corto plazo tratamiento frente al VHC, muchos expertos consideran razonable que, si no hay otra razón que aconseje iniciar de forma inmediata el TAR, en pacientes con más de 500 linfocitos CD4+/μl se difiera el mismo y se inicie el tratamiento frente al VHC, para evitar interacciones y toxicidades aditivas o sinérgicas. En el resto de los pacientes es preferible comenzar el TAR y posteriormente el tratamiento de la hepatitis, generalmente después de un mínimo de 24semanas.
Recomendaciones
- •
En pacientes coinfectados por el VHC se recomienda iniciar el TAR independientemente de la cifra de linfocitos CD4+ (A-II).
- •
En pacientes coinfectados por VIH/VHB con indicación de tratamiento frente al VHB, se debe iniciar TAR incluyendo TDF (A-I).
- •
En pacientes con más de 500 CD4+/μl que precisan tratamiento de la hepatitisC es preferible diferir el inicio del TAR hasta que el otro concluya (A-II).
La elección de los FAR en un paciente coinfectado por VIH y virus de la hepatitis ha de tener en cuenta la hepatotoxicidad potencial de estos, la existencia de cirrosis hepática, de coinfección por VHB y la necesidad de tratar simultáneamente frente el VHC.
La hepatitis aguda tóxica asociada al TAR es más frecuente en pacientes coinfectados por VIH y VHC que en no coinfectados. Sin embargo, si se exceptúan los asociados a dideoxinucleósidos y NVP, que pueden causar fallo hepático agudo en escenarios específicos, la mayoría de los cuadros de hepatitis tóxica por TAR son leves. Con los FAR actualmente usados la frecuencia de hepatitis tóxica aguda por TAR es baja219. No está claro que la existencia de fibrosis avanzada o cirrosis previas al tratamiento incrementen esta frecuencia. En cambio, sí se ha observado que la consecución de respuesta viral sostenida tras el tratamiento de la hepatitisC reduce el riesgo de este evento. En cuanto a toxicidad hepática a largo plazo, tampoco se ha demostrado de forma concluyente que algún FAR ejerza un efecto más favorable que otro sobre la esteatogénesis o la fibrogénesis en el paciente con hepatopatía. En enfermos sin infecciones por virus de la hepatitis, la exposición acumulada a ddI se ha asociado a fibrosis hepática. Por ello, en enfermos con daño hepático es razonable evitar este fármaco.
En pacientes con cirrosis claseA de Child-Pugh se puede usar cualquier FAR, con las consideraciones antes expuestas. Si hay mayor insuficiencia hepatocelular (clasesB y C), se altera el metabolismo de fármacos por la vía del citocromo P450 y la glucuronoconjugación. Los niveles plasmáticos de EFV aumentan en pacientes cirróticos en mayor medida que los IP/r220, por lo que son preferibles estos. Se dispone de datos farmacocinéticos de FPV/r221 en pacientes en claseB y C de Child-Pugh, recomendándose FPV (450mg/12h) con RTV (100mg/24h) en los primeros y FPV (300mg/12h) con RTV (100mg/24h) en los segundos. Con otros FAR deberían monitorizarse los niveles plasmáticos, pero como usualmente ello no es posible, reducciones de dosis o aumentos del intervalo entre ellas similares a los expuestos para FPV/r son razonables con otros IP/r, pero con una vigilancia estrecha de eficacia y toxicidad. En un estudio con un número reducido de pacientes en claseC de Child-Pugh, la administración de RAL se asoció a una elevación tolerable de niveles plasmáticos, por lo que su uso en este escenario puede ser razonable222.
El tratamiento para los genotipos no-1 del VHC sigue siendo la combinación de interferón pegilado (Peg-IFN) y ribavirina (RBV). En los enfermos con genotipo1 el tratamiento de elección es la combinación de estos 2 fármacos y telaprevir o boceprevir. En los pacientes que reciben Peg-IFN y RBV, ddI está contraindicado y ZDV y d4T deben evitarse, ya que la toxicidad de estos fármacos y la de la RBV se potencian. El uso de EFV concomitantemente con Peg-IFN aumenta la frecuencia de efectos adversos del SNC, probablemente por adición de toxicidades.
Telaprevir y boceprevir son sustratos e inhibidores del isoenzima CYP3A del citocromo P450 y sustratos de la glucoproteína p, por lo que pueden interaccionar con los FAR (tabla 14)223-228.
Interacciones más relevantes desde el punto de vista clínico entre fármacos antirretrovirales y antivirales directos frente al VHC detectadas en sujetos sanos
| Antirretroviral (dosis) | Interacción con telaprevir (TVR) 750mg/tid | Recomendación | Interacción con boceprevir (BOC) 800mg/tid | Recomendación |
| ATV/r 300mg/100mg qd | Incremento del AUC de ATV del 17% | Se pueden coadministrar (A1). Vigilar niveles de bilirrubina | Reducción del AUC de ATV del 35% | Se puede considerar esta combinación en caso de carga viral de VIH suprimida, no sospecha de resistencia al TAR y aumentado la vigilancia de la carga viral de VIH (B1) |
| DRV/r 600mg/100mg bid | • Disminución del AUC de TVR del 35%• Disminución del AUC de DRV del 40% | Combinación no recomendada (A1) | • Reducción del AUC de DRV del 44%.• Reducción del AUC BOC del 32%) | Combinación no recomendada (A1) |
| LPV/r 400mg/100mg/bid | Disminución del AUC de TVR del 54% | Combinación no recomendada (A1) | • Reducción de AUC de LPV del 34%• Reducción AUC BOC del 45% | Combinación no recomendada (A1) |
| EFV 600mg/qd | Disminución de la Cmin de TVR del 47% | Aumentar la dosis de TVR a 1125/8h (A1) | Descenso de la Cmin de BOC del 44% | Combinación no recomendada (A1) |
| RPV 25mg/qd | Aumento del AUC de RPV del 78%) | Se pueden coadministrar. Vigilar intervalo QT, especialmente en enfermos que reciben otros fármacos que lo alargan, como metadona (A1) | Aumento del AUC de RPV del 51% | Se pueden coadministrar (A1) |
| ETR 200mg/bid | Disminución de la Cmin de TVR del 25% | Se pueden coadministrar (A1) | Reducción de la Cmin de ETR del 29% | Se pueden coadministrar aumentando la vigilancia de la carga viral de VIH (A1) |
| RAL 400mg/bid | Aumento del AUC de RAL del 31% | Se pueden coadministrar (A1) | • Descenso de la Cmin de RAL del de la 25%• Descenso de la Cmin de BOC del 26% | Se pueden coadministrar (A1) |
| EVG/COBI 150/150mg | Aumento de la Cmin de EVG del 29%Aumento Cmin COBI del 249% | Pendiente de establecer recomendaciones | No hay datos | No hay datos |
| MVC 150mg/bid | Aumento del AUC de MVC del 949%) | Administrar MVC a dosis de 150mg/24h | Aumento del AUC de MVC del 302% | Administrar MVC a dosis de 150mg/12h |
| TDF 300mg/qd | Aumento del AUC de TDF del 30% | Se pueden coadministrar. Vigilar toxicidad TDF (A1) | Aumento de la Cmax de tenofovir del 32% | Se pueden coadministrar (A1) |
Recomendaciones
- •
Cualquier FAR puede usarse en pacientes con hepatopatía crónica y función hepática normal, incluidos los enfermos cirróticos claseA de Child (A-I), aunque es razonable evitar ddI (A-III).
- •
Si hay insuficiencia hepatocelular (ChildB o C) se deberá ajustar la dosis de los FAR, idealmente determinando las concentraciones plasmáticas de los mismos (B-II). Si no es posible, se debe tener en cuenta que el margen terapéutico de los IP es superior al de EFV en este escenario (A-III). Los terceros fármacos de elección en estos pacientes son FPV/r en dosis ajustadas al estadio de Child (A-I) y RAL, sin necesidad de ajuste de dosis (A-III).
- •
Se debe evitar la asociación de RBV con ddI, d4T y ZDV (A-I).
- •
Si se usan simultáneamente Peg-IFN y EFV, debe vigilarse estrechamente la aparición de efectos adversos del SNC (A-II).
- •
Si un paciente que requiere TAR va a iniciar telaprevir, se podrá administrar ABC, 3TC, FTC, TDF, RAL, ATV/R, ETR, RPV y EFV (aumentando con EFV la dosis de telaprevir a 1.125mg/8h). Si se utiliza TDF, se recomienda supervisar estrechamente la toxicidad de este FAR, y si se utiliza RPV, monitorizar el intervalo QT en el electrocardiograma (A-I).
- •
Si se usa boceprevir en un paciente que requiere TAR, pueden administrarse TDF, ABC, 3TC, FTC, RAL, RPV, ETR (A-I), estrechando, en este último caso, la monitorización de la viremia del VIH. En pacientes con CVP del VIH indetectable, sin sospecha de resistencia al TAR usado, se puede administrar ATV/r (B-I), también aumentando la vigilancia de la CVP del VIH.
Se recomienda la lectura de los 2 documentos realizados por GeSIDA en los que se trata de forma amplia las neoplasias en pacientes con infección por el VIH229,230. En este apartado nos limitamos a presentar de modo resumido los aspectos más relevantes del TAR en este escenario.
Al diseñar la pauta de TAR es muy importante considerar el perfil de toxicidad y las posibles interacciones farmacocinéticas (principalmente de aquellos FAR que se metabolizan por la vía del CYP450, como los citostáticos231.
Los IP/r se asocian a neutropenia más profunda y más prolongada cuando se usan con la quimioterapia de los linfomas229; algunos de ellos (ATV, LPV y SQV) alargan el intervalo QT, lo que podrían potenciar este efecto cuando se usan con muchos fármacos anticancerosos232. Además, en un estudio presentaron mayor toxicidad, más interacciones y menor eficacia virológica que los ITINN y RAL233.
Recomendaciones
- •
El TAR es un pilar fundamental en el tratamiento de pacientes con infección por el VIH con sarcoma de Kaposi o linfomas no Hodgkin229,230 (A-II).
- •
En pacientes con otro tipo de neoplasias, como consideración general, si no están con TAR, este ha de empezarse tan pronto como sea posible230 (A-III).
- •
RAL por sus características farmacológicas, su excelente tolerancia y mínimas interacciones debe ser el FAR de elección, siempre que sea posible, en pacientes que reciban quimioterapia (A-III).
El TAR ha reducido la mortalidad relacionada con el sida y ha mejorado la calidad de vida de los pacientes. Sin embargo, su coste es elevado, y en un entorno donde los recursos son limitados, es necesario gestionar adecuadamente el presupuesto. En la figura 1 se comparan los costes de las diferentes combinaciones de TAR utilizadas como terapia de inicio, ya que existen diferencias sustanciales entre ellas: el gasto mensual con pautas de eficacia similar puede diferir en cantidades de hasta casi 500euros. Para su elaboración se ha empleado el precio de venta laboratorio (PVL) de los FAR disponibles en España en noviembre de 2013, con la deducción obligatoria del 7,5% sobre el precio de compra de medicamentos no genéricos y no afectados por el sistema de precios de referencia adquiridos con cargo a fondos públicos del Sistema Nacional de Salud, a través de los servicios de farmacia de los hospitales, centros de salud y estructuras de atención primaria (Real Decreto-Ley 8/2010, de 20 de mayo: Medidas extraordinarias para la reducción del déficit público). En el caso de que hubieran transcurrido 10años desde la fecha de inicio de financiación con fondos públicos (11años en el caso de haber sido autorizada una nueva indicación), la deducción sería del 15%, salvo en los medicamentos que cuenten con protección de patente de producto en todos los Estados miembros de la Unión Europea (Real Decreto-Ley 9/2011, de 19 de agosto). Sin embargo, ninguno de los FAR incluidos en los regímenes recomendados como terapia de inicio tiene deducción del 15% a noviembre de 2013. Cabe considerar que pueden existir variaciones entre los precios finales de adquisición, que pueden variar entre comunidades autónomas e incluso entre distintos hospitales en una misma comunidad. Se ha empleado el PVL–7,5%+4%IVA como aproximación, por ser unitario en todo el Estado.
Coste mensual en euros de los regímenes recomendados para tratamiento antirretroviral de inicio (según tabla 3)*. Calculado según (PVL–7,5%)+4%IVA (basándose en los combos Truvada®, Kivexa®, Atripla®, Eviplera® y Stribild®). Esta deducción no es aplicable a los medicamentos genéricos. Coste mensual: Truvada® 403,80€, Kivexa® 282,38€, Atripla® 581,70€, Eviplera® 604,01€, Stribild® 810,00€; Norvir® 100mg 21,61€, Prezista® 800mg 410,98€, Reyataz® 300mg 420,00€, Isentress® 663,78€, efavirenz genérico 600mg 165,38€, nevirapina genérico de 200mg (400mg/día) 105,51€, Viramune® RX 400mg 177,69€, Kaletra® 384,82€.
* Ordenado por fuerza de recomendación y tercer fármaco. No se incluyen las pautas recomendadas basadas en dolutegravir porque en el momento de la redacción de estas recomendaciones no se dispone del precio de este fármaco.
Una evaluación farmacoeconómica con objeto de determinar el posicionamiento de nuevas estrategias o de nuevos medicamentos debe contemplar no solamente el coste, sino también la eficacia (ensayos clínicos) o la efectividad (práctica clínica habitual) de forma conjunta. Por este motivo, en los últimos años se publica conjuntamente con estas guías un estudio farmacoeconómico en el que se realiza una evaluación económica de costes y eficiencia (coste/eficacia) mediante construcción de árboles de decisión a partir de las pautas recomendadas como preferentes en las mismas234. A pesar de sus limitaciones, que se detallan en la publicación, este estudio234 demuestra que no son más eficientes ni las pautas con mayor eficacia clínica ni las más baratas. Por ello, si analizamos los datos de forma parcial podemos llegar a conclusiones erróneas.
Es importante que cada centro utilice sus precios para obtener datos de eficiencia. A tal efecto, dicho estudio234 ofrece una aplicación informática en la que, introduciendo los respectivos precios, se obtiene el posicionamiento de las distintas pautas de inicio. Esta aplicación (para Windows) puede descargarse de forma gratuita desde http://taiss.net/arti/aplicacion-tarv-vih-2013.exe o también desde la página de GeSIDA (www.gesida-seimc.org).
Otra consideración a tener en cuenta es que los estudios farmacoeconómicos probablemente subestimen la efectividad del TAR, dado que habitualmente no incluyen la reducción en el riesgo de transmisión de la enfermedad de los pacientes tratados235. Este hecho puede tener un impacto económico importante.
Recomendación
- •
Se recomienda incluir criterios de coste-efectividad en la toma de decisiones sobre el TAR de inicio en pacientes sin TAR previo (A-II).
Antonio Antela ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Gilead Sciences y Janssen-Cilag; ha recibido compensaciones económicas por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare, así como pagos por desarrollo de material educacional para Boehringer Ingelheim, Gilead Sciences y ViiV Healthcare.
José R. Arribas ha efectuado labores de consultoría en los laboratorios AbbVie Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, Tobira y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Janssen, MSD y Gilead; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare
Víctor Asensi ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, Boehringer-Ingelheim, GlaxoSmithKline y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, Boehringer-Ingelheim, GlaxoSmithKline y ViiV Healthcare; ha recibido pagos por desarrollos de presentaciones educacionales para Bristol-Myers Squibb.
Juan Berenguer ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead, Janssen-Cilag, Janssen-Therapeutics, Merck Sharp & Dohme y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Bristol-Myers Squibb, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare.
José R. Blanco ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Janssen, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Janssen, Merck y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Gilead Sciences y Bristol-Myers Squibb.
Bonaventura Clotet ha efectuado labores de consultoría o ha participado en ensayos clínicos o en charlas retribuidas con los siguientes laboratorios farmacéuticos: BMS, AbbVie, Gilead, Janssen, Merck (MSD) y ViiV Healthcare
Pere Domingo ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
M. José Galindo ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, y Merck; ha disfrutado de becas para investigación clínica de AbbVie, Boehringer Ingelheim, Glaxo, Janssen y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche; ha colaborado en la elaboración de materiales educativos para Janssen, Pfizer, ViiV, Glaxo y AbbVie.
José M. Gatell ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare.
Juan González ha efectuado labores de consultoría en los laboratorios Abbott, Abbvie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott, Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
José Antonio Iribarren ha efectuado labores de consultoría en los laboratorios Gilead Sciences y Janssen-Cilag; ha recibido becas de investigación clínica de laboratorios AbbVie, Bristol-Myers Squibb, Gobierno Vasco, FIPSE y FISS, ayudas para asistencia a Congresos de AbbVie, Gilead, Janssen-Cilag y ViiV, y ha participado en actividades educativas, charlas o simposios patrocinados por AbbVie, Bristol-Myers Squibb, Gilead, Merck, Novartis Janssen, Pfizer y ViiV.
Jaime Locutura ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Gilead Sciences y ViiV Healthcare; ha recibido compensaciones económicas por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare, así como pagos por desarrollo de material educacional para AbbVie, Boehringer Ingelheim y ViiV Healthcare.
José López Aldeguer ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Bristol-Myers Squibb, ViiV Healthcare y Merck, y ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Juan Carlos López Bernaldo de Quirós ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck-Sharp & Dome, Roche Pharmaceuticals y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck-Sharp & Dome, Roche Pharmaceuticals y ViiV Healthcare. También ha recibido pagos por desarrollo de material educacional para Boehringer Ingelheim Gilead Sciences y ViiV Healthcare.
Fernando Lozano ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare.
Josep Mallolas ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Merck, Janssen, Roche y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Roche, Merck y ViiV Healthcare.
Esteban Martínez ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Theratechnologies, Tibotec y ViiV Healthcare; ha recibido compensaciones económicas por charlas de los laboratorios AbbVie, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Theratechnologies, Tibotec y ViiV Healthcare, así como pagos por desarrollo de presentaciones educacionales para AbbVie, Boehringer-Ingelheim, Bristol-Myers Squibb, GlaxoSmithKline y ViiV Healthcare.
Celia Miralles ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha recibido compensaciones económicas por escritura de manuscritos de los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
José M. Miró ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Merck, Novartis y Sanofi; ha disfrutado de becas para investigación clínica de Cubist, Novartis, Merck, Fondo de Investigaciones Sanitarias (FIS) del Instituto de Salud Carlos III (Madrid), Fundación para la Investigación y Prevención del Sida en España (FIPSE, Madrid), Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI, Madrid), National Institutes of Health (NIH, Bethesda, MA, EE. UU.) y NEAT, y ha recibido compensación económica por charlas de Novartis y ViiV Healthcare
Santiago Moreno ha efectuado labores de consultoría en los laboratorios Abbvie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche; ha disfrutado de becas para investigación clínica de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche, y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche.
Rosario Palacios ha efectuado labores de consultoría en los laboratorios Boehringer Ingelheim y ha recibido compensación económica por charlas de Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, ViiV Healthcare y Roche.
María J. Pérez Elías ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de laboratorios AbbVie, Gilead Sciences, ViiV Healthcare y Janssen; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, así como pagos por desarrollo de presentaciones educacionales para AbbVie, Bristol-Myers Squibb, Janssen, Merck y ViiV Healthcare.
Juan A. Pineda ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, GlaxoSmithKline, Gilead Sciences, Janssen, Merck, Pfizer, Shering-Plough y ViiV Healthcare; ha disfrutado de becas para investigación clínica de AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, GlaxoSmithKline, Gilead Sciences, Janssen, Merck, Pfizer, Roche, Shering-Plough y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Gilead Sciences, Janssen, Merck, Roche, Shering-Plough y ViiV Healthcare.
Daniel Podzamczer ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare.
Rosa Polo declara no tener conflictos de interés.
Joaquín Portilla ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de AbbVie, Janssen, Merck y ViiV Healthcare, y ha recibido compensación económica por charlas de AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, Roche y ViiV Healthcare.
Federico Pulido ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Esteban Ribera ha realizado asesorías o ha recibido ayudas para investigación o docencia en relación con la infección por el VIH de los siguientes laboratorios farmacéuticos: AbbVie, Boehringer Ingelheim, BMS, Ferrer International, Gilead, GSK, Janssen-Cilag, MSD, Pfizer, Roche Farma, Schering Plough y ViiV.
Melchor Riera ha recibido ayudas para viajes a reuniones y Congresos de Janssen y Gilead Sciences y aportaciones económicas al servicio por labores docentes o de investigación de laboratorios AbbVie y Bristol-Myers Squibb.
Antonio Rivero ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de laboratorios AbbVie, Gilead Sciences, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Rafael Rubio ha efectuado labores de consultoría en los laboratorios AbbVie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead, GlaxoSmithKline, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott, Gilead, Janssen y Roche, y ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck, Roche y ViiV Healthcare.
Jesús Santos ha efectuado labores de consultoría en los laboratorios Bristol-Myers Squibb, Gilead Sciences y Janssen; ha recibido compensación económica por charlas de Bristol-Myers Squibb, MSD, Janssen y Gilead Sciences, y pagos por desarrollo de presentaciones educacionales para Bristol-Myers Squibb, Gilead Sciences, Janssen y MSD
Jesús Sanz ha efectuado labores de consultoría en los laboratorios AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, ViiV Healthcare y Boehringer Ingelheim; ha recibido compensación económica por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck, ViiV Healthcare y Boehringer Ingelheim, y ha recibido pagos por desarrollo de presentaciones educacionales para ViiV Healthcare.
Montse Tuset ha disfrutado de becas para investigación clínica de laboratorios Bristol-Myers Squibb, Gilead Sciences, Merck y Janssen; y ha recibido compensación económica por charlas de Janssen, Merck, Gilead y ViiV Healthcare
Francesc Vidal ha recibido compensación económica por charlas de AbbVie, Merck y Gilead Sciences.
La Junta Directiva de GeSIDA y el Plan Nacional sobre el Sida agradecen las aportaciones y opiniones de: David Alonso, Marisa Álvarez, Piedad Arazo, Ivan Bernardo, Esther Cabrero, Manuel Cotarelo, Manuel Crespo, Adrián Curran, Federico García, Henar Hevia, Juan Emilio Losa y Nuria Sánchez.
Juan Berenguer, Hospital General Universitario Gregorio Marañón, Madrid
Rosa Polo, Secretaría del Plan Nacional sobre el Sida, Ministerio de Sanidad, Servicios Sociales e Igualdad
Fernando Lozano, Hospital Universitario Virgen de Valme, Sevilla
José López Aldeguer, Hospital Universitario La Fe, IIS La Fe, Valencia
Antonio Antela, Hospital Clínico Universitario, Santiago de Compostela, La Coruña
José Ramón Arribas, Hospital Universitario La Paz, IdiPAZ, Madrid
Víctor Asensi, Hospital Universitario Central de Asturias, Oviedo
José Ramón Blanco, Hospital San Pedro, Logroño
Bonaventura Clotet, Hospital Germans Trias i Pujol, Badalona, Barcelona
Pere Domingo, Hospital de la Santa Creu i Sant Pau, Barcelona
María José Galindo, Hospital Clínico Universitario, Valencia
José María Gatell, Hospital Clínic/IDIBAPS, Universidad de Barcelona, Barcelona
Juan González-García, Hospital Universitario La Paz, IdiPAZ, Madrid
José Antonio Iribarren, Hospital Universitario Donostia, San Sebastián
Jaime Locutura, Hospital Universitario, Burgos
Juan Carlos López, Hospital General Universitario Gregorio Marañón, Madrid
Josep Mallolas, Hospital Clínic/IDIBAPS, Universidad de Barcelona, Barcelona
Esteban Martínez, Hospital Clínic/IDIBAPS, Universidad de Barcelona, Barcelona
Celia Miralles, Complejo Hospitalario Xeral, Vigo
José M. Miró, Hospital Clínic/IDIBAPS, Universidad de Barcelona, Barcelona
Santiago Moreno, Hospital Ramón y Cajal, IRYCIS, Madrid
Rosario Palacios, Hospital Universitario Virgen de la Victoria, Málaga
María Jesús Pérez Elías, Hospital Ramón y Cajal, IRYCIS, Madrid
Juan Antonio Pineda, Hospital Universitario Virgen de Valme, Sevilla
Daniel Podzamczer, Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, Barcelona
Joaquín Portilla, Hospital General Universitario, Alicante
Federico Pulido, Hospital Doce de Octubre, Madrid
Esteban Ribera, Hospital Vall d’Hebron, Barcelona
Melchor Riera, Hospital Son Espases, Palma de Mallorca
Rafael Rubio, Hospital Doce de Octubre, Madrid
Jesús Santos, Hospital Universitario Virgen de la Victoria, Málaga
Jesús Sanz, Hospital Universitario de la Princesa, Madrid
Montserrat Tuset, Hospital Clínic/IDIBAPS, Universidad de Barcelona, Barcelona
Francesc Vidal, Hospital Universitario Joan XXIII, Tarragona
Antonio Rivero, Hospital Reina Sofía, Córdoba