Introducción
Las infecciones por virus continúan siendo una importante fuente de morbilidad y mortalidad en los pacientes trasplantados, tanto de órgano sólido (TOS) como de progenitores hematopoyéticos (TPH). La adquisición de estas infecciones puede producirse de forma exógena, a través de los órganos del donante (citomegalovirus, virus de Epstein-Barr), mediante transfusión de hemoderivados o bien por exposición en la comunidad (Influenza, adenovirus). Además de esta vía exógena, la reactivación endógena de virus latentes, fundamentalmente herpesvirus, es un problema frecuente en los pacientes trasplantados y puede conducir a la aparición tanto de efectos directos como indirectos sobre el órgano trasplantado. Esta clasificación permite distinguir los efectos producidos por la invasión viral directa que acarrean daño celular y tisular (p. ej., neumonitis por citomegalovirus), de los efectos inmunomoduladores mediados por la respuesta inflamatoria o por las alteraciones en el sistema inmune del huésped.
Cronología de la infección viral en el paciente trasplantado
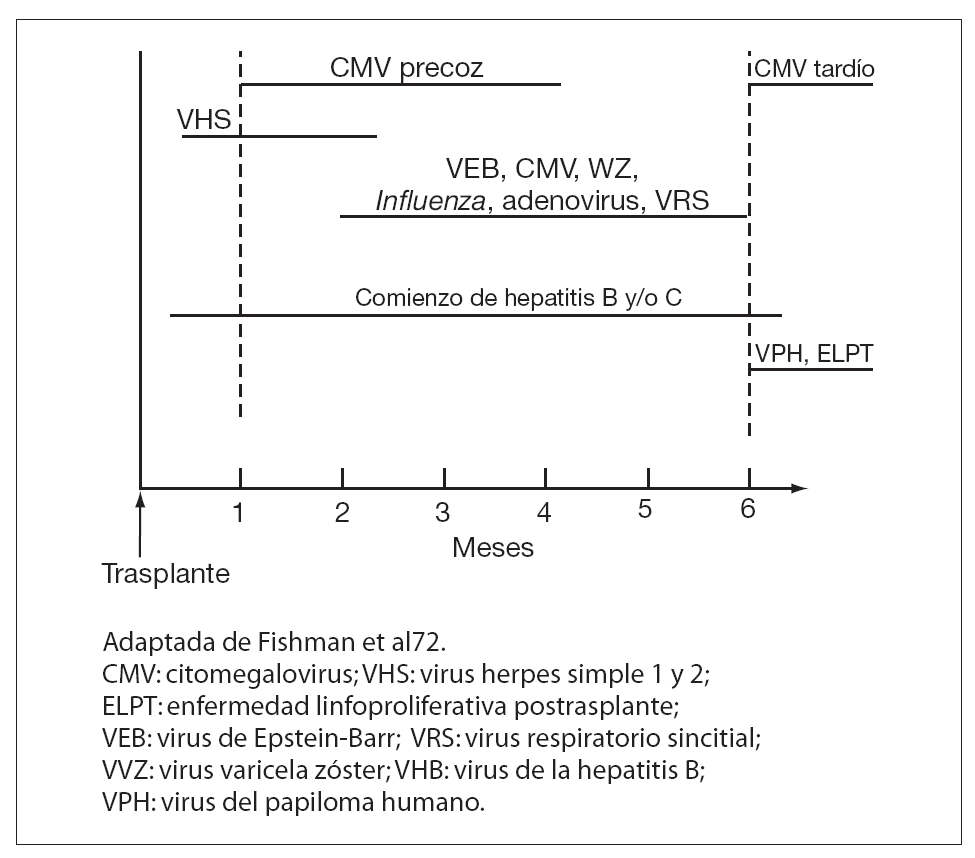
El riesgo de infección viral tras el trasplante está condicionado por la suma de muchos factores entre los que se incluyen la intensidad, virulencia y mecanismos de la exposición viral, la intensidad y tipo del régimen de inmunosupresión y la presencia o ausencia de inmunidad antiviral preexistente. A pesar de esta variabilidad, podemos distinguir un patrón general en la cronología de estas infecciones tras el trasplante1 (fig. 1). De este modo, los pacientes infectados por virus de herpes simple (VHS) pueden presentar una reactivación precoz durante los primeros dos meses postrasplante. Igualmente, las infecciones adquiridas a través del injerto, como las producidas por virus de la hepatitis B (VHB) y C (VHC) y virus de la inmunodeficiencia humana (VIH) pueden aparecer en el primer mes tras la cirugía. Respecto al citomegalovirus (CMV), tanto la reactivación como la infección adquirida en período peritrasplante, suelen producirse entre el primero y el cuarto mes postrasplante, aunque en la actualidad se describen cada vez con más frecuencia episodios de enfermedad por CMV más allá de este período (enfermedad tardía por CMV). Ello se ha relacionado fundamentalmente con las pautas de profilaxis universal en el caso de TOS o con la aparición de enfermedad injerto contra huésped (EICH) crónica en receptores de TPH. Otros virus latentes como el virus de Epstein-Barr (VEB) y el virus herpes-zoster (VHZ) se presentan mayoritariamente entre el segundo y el sexto mes postrasplante. En el caso del poliomavirus BK, se ha observado una distribución bimodal en la presentación de los casos; el 50% de ellos aparece durante las primeras 8 semanas postrasplante y el resto en períodos posteriores que pueden abarcar desde meses hasta años tras el trasplante. Finalmente, las infecciones por virus adquiridos en la comunidad como Influenza, virus sincitial respiratorio (VSR) y adenovirus pueden aparecer en cualquier período.
Figura 1. Cronología de la infección viral tras el trasplante.
Citomegalovirus
La infección por CMV es la principal causa de morbilidad y mortalidad de origen viral en los pacientes trasplantados. Este virus se encuentra distribuido ampliamente en la población general con tasas de seroprevalencia que oscilan entre el 60 y el 90%. Después de la infección primaria, el CMV permanece latente, y puede encontrarse su genoma en múltiples tipos celulares como los monocitos CD14+ y las células progenitoras CD34+, aunque su reservorio y los mecanismos por los cuales permanece latente son mal conocidos.
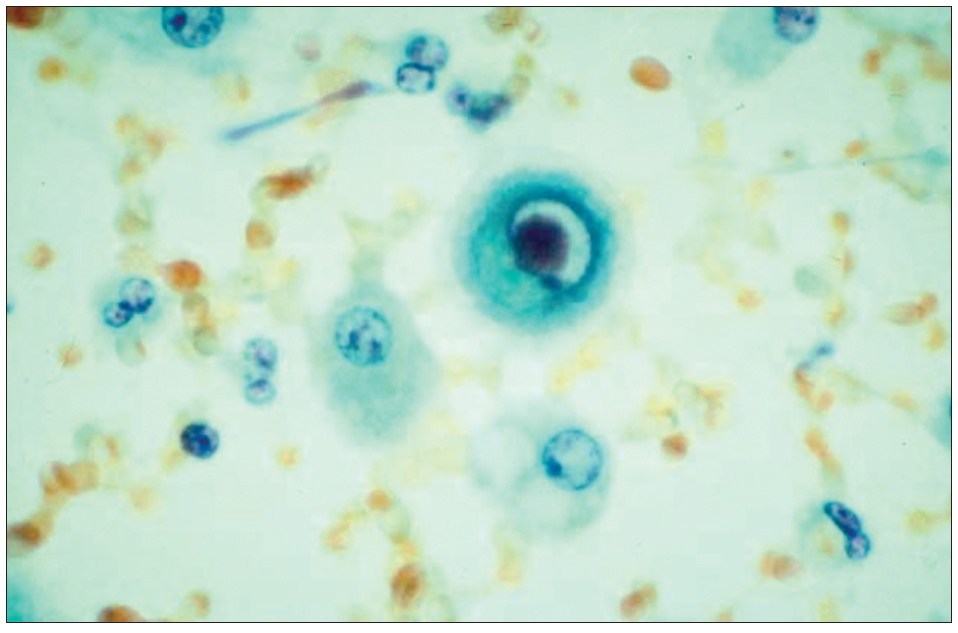
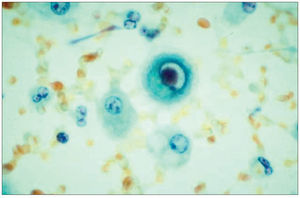
El CMV puede producir tanto efectos directos como indirectos. Entre los efectos directos se incluyen el síndrome viral (fiebre acompañada de neutropenia, trombopenia o alteración de transaminasas) y la enfermedad invasora por CMV, cuyo riesgo se incrementa de forma exponencial con el aumento de la carga viral2,3. Entre los órganos más frecuentemente afectados se encuentran el pulmón, el hígado, el tracto gastrointestinal y la retina, en los cuales se produce una respuesta inflamatoria responsable del daño tisular. Para el diagnóstico de certeza de enfermedad por CMV se requiere la presencia de un cuadro clinicoanalítico compatible junto con la demostración de lesiones histológicas en una biopsia (inclusiones intracelulares en "ojo de lechuza") y/o cultivo positivo para CMV (fig. 2). En el caso de la neumonía, se acepta la detección del virus en el lavado broncoalveolar4.
Figura 2. Inclusiones citomegálicas en "ojo de lechuza".
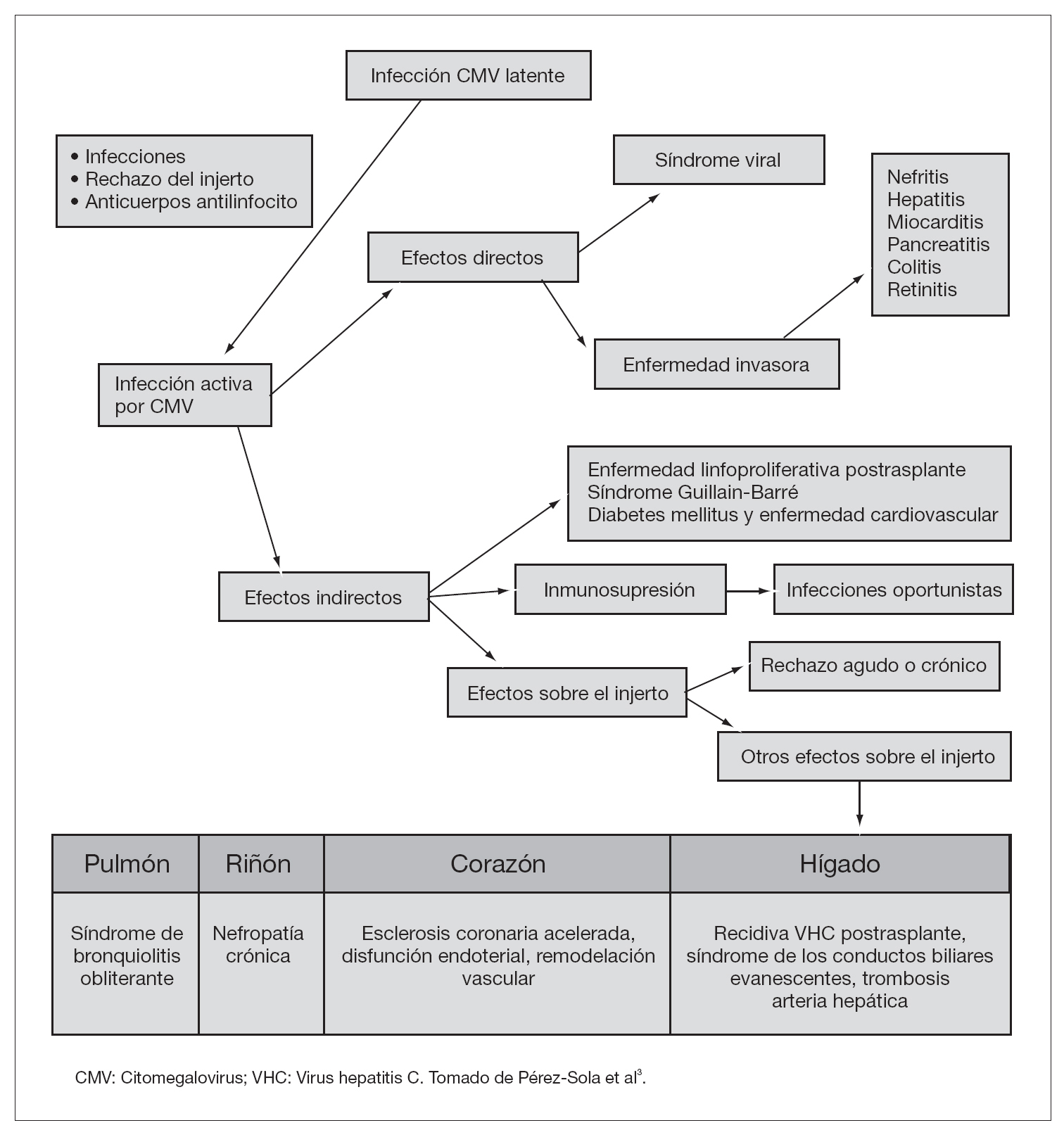
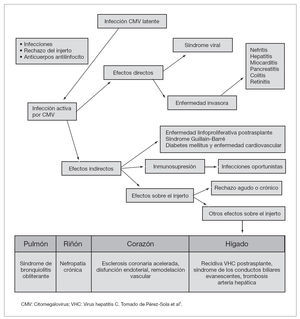
Los efectos indirectos, a diferencia de la enfermedad invasora, son independientes del grado de viremia, y resultan de la interacción del CMV con la respuesta inmune del huésped5. Estos efectos pueden estar, al menos en parte, relacionados con la presencia durante largos períodos de tiempo de baja concentración de replicación viral, lo que facilitaría una disfunción de los linfocitos CD4+ y macrófagos inducida directamente por el CMV e indirectamente a través de la producción de citocinas supresoras. Entre los numerosos efectos indirectos del CMV descritos hasta el momento se encuentran un aumento en el riesgo de rechazo y disfunción del injerto, ateroesclerosis acelerada en el trasplante cardíaco, bronquiolitis obliterante (BOS) en el trasplante pulmonar, infecciones oportunistas, neoplasias, síndrome de Guillain-Barré y diabetes mellitus postrasplante2,6 (fig. 3).
Figura 3. Efectos de citomegalovirus en pacientes trasplantados.
La asociación entre infección por CMV y rechazo se ha evidenciado en estudios aleatorizados con fármacos frente a CMV en receptores de trasplante renal. En uno de ellos se observó que receptores seronegativos que habían recibido injertos procedentes de donantes seropositivos (D+/R) presentaron una reducción del 50% en la incidencia de rechazo cuando se empleó profilaxis frente a CMV respecto a placebo7. En otros estudios realizados en trasplante renal se ha evidenciado una mayor supervivencia y una menor tasa de rechazo a los 3 años del trasplante en aquéllos sometidos a profilaxis8. En el caso del trasplante hepático, la profilaxis frente a CMV se ha relacionado con una mayor supervivencia del injerto, una menor tasa de rechazo y una disminución de la mortalidad de los pacientes9. Este aumento de la supervivencia se ha observado igualmente en el análisis retrospectivo de una cohorte de trasplantados renales y cardíacos en situación D+/R sometidos a profilaxis frente a CMV8.
Además del rechazo, la disfunción del injerto y la disminución de la supervivencia, la enfermedad cardiovascular ha sido relacionada con la infección por CMV en pacientes trasplantados. En un análisis post hoc de un ensayo que incluyó a pacientes aleatorizados a recibir ganciclovir o placebo durante los primeros 28 días postrasplante, los pacientes que recibieron profilaxis con ganciclovir y gammaglobulina presentaron menor riesgo de arteriopatía coronaria que los del grupo placebo10.
Por otro lado, el efecto inmunosupresor mediado por CMV, puede traducirse en un aumento en la incidencia de infecciones oportunistas así como de neoplasias. En este sentido se ha considerado la infección por CMV un factor de riesgo de infecciones bacterianas y fúngicas (Pneumocystis jiroveci, Aspergillus spp. y Candida spp.), así como de enfermedad linfoproliferativa postrasplante asociada al virus de Epstein-Barr11.
En la actualidad desconocemos el impacto de las diferentes pautas de profilaxis frente a CMV sobre la aparición de efectos indirectos12. Entre estas pautas se incluyen la terapia anticipada (vigilancia y administración de antivirales cuando se detectan concentraciones significativas de viremia) y la profilaxis universal (administración de antivirales a todos los pacientes). En trasplantados hepáticos, la terapia anticipada se ha asociado con tasas de infección oportunista, rechazo y supervivencia similares a las de los pacientes que no han recibido ninguna profilaxis antiviral13. Igualmente, no se han encontrado diferencias entre las tasas de rechazo y disfunción renal al comparar pacientes trasplantados renales sometidos a terapia anticipada frente a aquéllos en quienes se ha empleado tratamiento diferido de la enfermedad14. La incapacidad de la terapia anticipada para impedir la presencia de baja replicación viral podría justificar estos resultados. Por el contrario y desde un punto de vista teórico, las pautas de profilaxis universal al impedir cualquier grado de replicación del CMV podrían disminuir el riesgo de aparición de efectos indirectos. Sin embargo, estos beneficios podrían contrarrestarse por un mayor riesgo de aparición de resistencias y por una mayor probabilidad de aparición de enfermedad tardía por CMV tras la retirada de dicha profilaxis15.
En la actualidad, la aparición de enfermedad por CMV más allá de los primeros 6 meses postrasplante es un hecho cada vez más frecuente, el cual se encuentra relacionado con la supervivencia a largo plazo de estos pacientes16. En un ensayo realizado con pacientes sometidos a trasplante hepático que realizaron profilaxis con ganciclovir oral, la mediana del comienzo de aparición de enfermedad por CMV fue de 10 meses17. Igualmente, en otro ensayo que comparó valganciclovir con ganciclovir oral en profilaxis durante 90 días en receptores de TOS (hepático, cardíaco, renal y páncreas y riñón) en situación D+/R, se observó cómo en ambos grupos todos los casos de enfermedad por CMV aparecieron después de los primeros 6 meses postrasplante18.
La aparición tardía de enfermedad por CMV probablemente sea debida a una alteración en la reconstitución inmune dependiente de los linfocitos T específicos frente al virus. De hecho, se ha comprobado que la disminución en la inmunidad celular específica frente a CMV es un factor de riesgo de enfermedad posterior por este virus19. La profilaxis antiviral se ha postulado como un factor fundamental en el desarrollo de alteraciones de la reconstitución inmune responsables de la enfermedad tardía por CMV, tanto en receptores de TOS como de TPH. En el caso del TPH, los pacientes que reciben profilaxis con ganciclovir durante los primeros 100 días postrasplante presentan una disfunción en la respuesta específica frente a CMV por parte de los linfocitos CD4+ y de los CD8+, cuando se les compara con pacientes que no reciben dicha profilaxis19. De la misma forma, en receptores de trasplante hepático en tratamiento durante 6 semanas con ganciclovir oral, se ha comprobado una mayor supresión de la respuesta inmune inducida por linfocitos T-helper específicos en comparación con pacientes que no habían recibido ganciclovir20. Estos resultados podrían explicarse porque en los pacientes que reciben ganciclovir existe una disminución en la proliferación de células T, así como una menor velocidad de expansión de precursores de células T específicas frente a CMV.
La enfermedad tardía por CMV ha sido igualmente asociada con los regímenes no mieloablativos de TPH. Aunque estos pacientes presentan una baja incidencia de enfermedad por CMV en los primeros 100 días postrasplante cuando se comparan con los que reciben regímenes mieloablativos, las tasas de enfermedad por CMV al año son similares en ambos grupos, y es más tardío el comienzo de los síntomas en receptores de TPH no mieloablativo21. Este hecho podría deberse al efecto protector de las células T residuales procedentes del receptor en el postrasplante inmediato y a un comienzo tardío de la EICH en estos pacientes.
La aparición cada vez más frecuente de complicaciones tardías relacionadas con el CMV ha motivado que en la actualidad la profilaxis antiviral esté siendo sometida a evaluación. Aunque se desconoce cuál será la mejor estrategia para evitar estas complicaciones, parece razonable pensar que entre las posibles alternativas se encuentren el desarrollar estrategias que faciliten la reconstitución inmune de los pacientes D+/R en los primeros meses postrasplante, la prolongación de la profilaxis antiviral más allá de los primeros 3 meses postrasplante en pacientes de alto riesgo y el empleo de terapia anticipada basada en la antigenemia pp6522 o en la detección de ADN viral mediante reacción en cadena de la polimerasa (PCR). En estos casos sería deseable desarrollar marcadores objetivos de riesgo de padecer enfermedad tardía (virológicos o inmunológicos), para extender la profilaxis únicamente en estos pacientes. Para el tratamiento de la enfermedad establecida por CMV ganciclovir continúa siendo el fármaco de elección tanto en TOS como en TPH. La buena biodisponibilidad de valganciclovir, un L-valyl éster de ganciclovir ha posibilitado que sea empleado por algunos clínicos como una alternativa a ganciclovir, aunque su eficacia deberá ser demostrada en ensayos bien diseñados. La resistencia a ganciclovir puede deberse a mutaciones en los genes UL97, UL54 o ambos. Como pautas alternativas se han propuesto el foscarnet, cidofovir y la leflunomida. Además, otros fármacos como benzimidazol, adefovir, lobucavir y maribavir se encuentran actualmente en estudio, aunque no disponemos de datos clínicos. En pacientes sometidos a TPH que presentan neumonitis por CMV se recomienda, además del tratamiento antiviral, el empleo de gammaglobulina inespecífica. No existe evidencia de que la inmunoglobulina hiperinmune específica frente a CMV sea más eficaz que la inespecífica. En receptores de TOS no existen datos concluyentes sobre el beneficio de ninguna de estas inmunoglobulinas.
Virus de Epstein-Barr y enfermedad linfoproliferativa postrasplante
La enfermedad linfoproliferativa postrasplante (ELPT) engloba a un grupo heterogéneo de trastornos linfoproliferativos que comprenden desde un síndrome mononucleósico inducido por el VEB hasta proliferaciones monomórficas muy agresivas, las cuales pueden ser indistinguibles de formas graves de linfoma23 (tabla 1). Esta proliferación linfoide aparece como consecuencia de las pautas de inmunosupresión que son instauradas tras el trasplante, las cuales condicionan un descenso en la función de células T específicas frente al VEB. Esto desencadena una proliferación incontrolada de células B infectadas por dicho virus.
La ELPT, sin embargo, no se asocia exclusivamente con la infección por el VEB, sino que cada vez más frecuentemente aparecen formas de ELPT negativas a VEB, las cuales tienden a desarrollarse en períodos más tardíos tras el trasplante y presentan mayor mortalidad. De hecho, para el diagnóstico de ELPT no se requiere la presencia de VEB en células tumorales24.
El período de mayor riesgo de aparición de ELPT es el primer año postrasplante. En receptores de TOS la mediana del tiempo de comienzo de ELPT es de 6 meses, mientras que en el caso del TPH es de 2 meses tras el trasplante, presentándose generalmente con formas más extensas y agresivas de la enfermedad23.
La incidencia de ELPT varía según el tipo de trasplante, y son el trasplante pulmonar y el de intestino delgado los que presentan mayor incidencia (5-32%) y el trasplante renal el de menor riesgo, con una incidencia inferior al 1%. Estas diferencias pueden deberse a la mayor intensidad de la inmunosupresión empleada en estos tipos de trasplante, la cual es uno de los factores de riesgo más importantes para el desarrollo de ELPT. En este sentido, se ha evidenciado que la inducción y el tratamiento del rechazo con OKT3 y globulina antitimocítica se relacionan con un mayor riesgo de ELPT25.
En la actualidad no existen datos concluyentes sobre la asociación particular entre algunos de los fármacos inmunosupresores con el desarrollo de ELPT. Aunque existe discusión a este respecto sobre los efectos del tacrolimus en comparación con ciclosporina A, el fármaco más reciente micofenolato mofetil no se ha asociado con mayor riesgo de ELPT25. El efecto de los inhibidores de la serina-treonina cinasa de mamíferos, sirolimus y evorolimus no se ha aclarado aún. Sin embargo, podríamos pensar que dado su efecto inhibidor sobre las celulas derivadas de ELPT en modelos animales, su empleo no se asocie a mayor riesgo de ELPT26.
En general, podemos concluir que probablemente el grado de inmunosupresión global más que cada fármaco inmunosupresor en particular, interviene de forma más importante en el desarrollo de ELPT.
Además de con la inmunosupresión, la ELPT se ha relacionado con el estado serológico del receptor frente al donante respecto al VEB. De esta forma, los receptores seronegativos que reciben órganos de donantes seropositivos presentan entre 10 y 50 veces mayor riesgo de ELPT como consecuencia del desarrollo de infección primaria por VEB27. Esto justifica además la mayor incidencia de ELPT en la población pediátrica en períodos precoces tras el trasplante.
El mayor riesgo de ELPT en receptores seronegativos que reciben injertos de donantes seropositivos frente a VEB ha posibilitado que se haya sugerido la inmunización pretrasplante frente al virus como una de las estrategias de prevención de la enfermedad. Sin embargo, y aunque se encuentra en desarrollo, en la actualidad no se dispone de una vacuna frente al VEB28. Por otro lado, existen datos contradictorios sobre la utilidad de la profilaxis frente a CMV para la prevención de ELPT. Además, se ha observado que el CMV es un factor de riesgo independiente de ELPT en pacientes seronegativos con respecto al VEB, que reciben injertos de donantes seropositivos. La correcta profilaxis frente a CMV en esta población es crucial para evitar la ELPT asociada al VEB29.
La localización donde puede desarrollarse la ELPT parece estar en relación con el tiempo transcurrido desde la realización del trasplante. En receptores de trasplante pulmonar, más del 50% de todas las ELPT durante el primer año se desarrollan sobre el injerto, mientras que esta localización se afecta solamente en el 15% de las ocasiones tras este período30. Este hecho se ha comprobado igualmente en el caso del trasplante renal30.
Además de la implicación del injerto, otras localizaciones extralinfoides pueden verse afectadas por la ELPT; predomina fundamentalmente el tracto gastrointestinal. Se ha especulado que la continua exposición antigénica que tiene lugar en esta localización podría desencadenar una respuesta inflamatoria local que sería la responsable de la aparición de ELPT. Otras localizaciones frecuentemente afectadas por la ELPT son los senos paranasales, el sistema nervioso central, los ganglios linfáticos y la piel.
Para el diagnóstico precoz de ELPT se requiere un alto grado de sospecha clínica, debido a que generalmente no existen formas clínicas específicas de presentación. Esto es especialmente importante cuando se produce afectación del injerto por ELPT. Los receptores de trasplante renal con ELPT del injerto se presentan por lo general con insuficiencia renal, hidronefrosis o fiebre. En estos casos, la ultrasonografía puede revelar la presencia de adenopatías. Si se tiene en cuenta que el aparato gastrointestinal es una localización frecuente de ELPT, la aparición de síntomas como diarrea o sangrado digestivo deben hacernos pensar en la posibilidad de ELPT como causante del cuadro.
Debido a la inespecificidad de los síntomas, resulta necesario el empleo de métodos diagnósticos que permitan establecer un diagnóstico de certeza de la forma más precoz posible. Entre estos métodos se encuentra la detección del ADN de VEB mediante técnicas de PCR, entre las cuales se considera de elección la de PCR cuantitativa en tiempo real. Sin embargo, existen dudas respecto al tipo de muestra a emplear (plasma, células mononucleares de sangre periférica o sangre total) y en cuanto a los valores de carga viral más adecuados como punto de corte. Estas limitaciones condicionan que el incremento en la carga viral de VEB en un paciente concreto, en lugar de los valores aumentados sobre un determinado punto de corte, presente mayor valor para identificar a los pacientes en riesgo de ELPT31.
Además de la detección del ADN viral, otros autores han sugerido que la detección de las concentraciones de interleucina-10, un factor que interviene en el crecimiento de las células B transformadas por el VEB, podría tener un valor predictivo de desarrollo de ELPT, lo cual ha de ser confirmado en posteriores estudios32.
En cuanto al diagnóstico por imagen, la tomografía por emisión de positrones con fluodeoxiglucosa se ha mostrado superior a la tomografía computarizada y a la ultrasonografía en la visualización de linfomas malignos, en la detección de localizaciones extralinfoides y en la evaluación de enfermedad residual tras el tratamiento23.
Respecto al tratamiento de la ELPT, no existen grandes ensayos prospectivos y aleatorizados, por lo que la mayoría de las recomendaciones se han establecido a partir de resultados extraídos de series de casos y análisis retrospectivos. En general, el tratamiento de la ELPT debe orientarse hacia el aumento de la respuesta inmune, la destrucción de las células malignas y la eliminación del VEB.
La reducción en la inmunosupresión se considera la primera línea de tratamiento de la ELPT33. El grado de reducción del tratamiento inmunosupresor debe individualizarse en cada paciente, y puede estar limitado por el riesgo de rechazo o cuando el injerto es imprescindible para la supervivencia del paciente. Esta estrategia presenta diferentes tasas de respuesta, que oscilan entre el 0 y el 89%, en función de factores pronósticos tales como valores elevados de láctico deshidrogenasa, la afectación multiorgánica de ELPT y la presencia de disfunción orgánica en el momento del diagnóstico34.
La quimioterapia citotóxica convencional puede ser empleada en pacientes con ELPT que no presentan respuesta o cuando resulta imposible reducir el grado de inmunosupresión. Varios regímenes de quimioterapia como el CHOP (ciclofosfamida, adriamicina, vincristina y prednisona) han sido empleados en estos pacientes con buenos resultados, aunque la alta mortalidad asociada a las complicaciones del tratamiento limita su empleo en numerosas ocasiones.
En cuanto al valor de los fármacos antivirales como aciclovir o ganciclovir en el tratamiento de la ELPT existe una experiencia limitada que incluye un pequeño número de estudios no aleatorizados con diferentes poblaciones de riesgo y dosificaciones desiguales33.
Finalmente, los anticuerpos monoclonales constituyen una opción atractiva para el tratamiento de ELPT debido a su baja capacidad inmunosupresora, su actividad frente a células linfocitarias y su potencial para activar las células del sistema inmune. Entre este grupo, rituximab, un anticuerpo monoclonal quimérico anti-CD20 ha demostrado los mejores resultados. Choquet et al35 realizaron un ensayo prospectivo y multicéntrico de rituximab en pacientes con ELPT en el que se incluyeron pacientes pediátricos y adultos tratados con dosis estándar de 375 mg/m2 semanalmente durante 4 semanas. El 68% de los pacientes presentó respuesta mantenida al año de seguimiento con una baja incidencia de efectos adversos.
Hasta hace poco tiempo, los pacientes con ELPT sin respuesta a la disminución del tratamiento inmunosupresor eran sometidos a tratamiento con quimioterapia citotóxica convencional. En la actualidad no existen estudios que hayan comparado de forma prospectiva y aleatorizada las pautas de quimioterapia frente a rituximab. Sin embargo, en un estudio retrospectivo que incluyó a 35 pacientes, las tasas de supervivencia y curación fueron similares en ambos grupos, aunque con una menor toxicidad y mortalidad relacionada con el tratamiento en el grupo que recibió rituximab36. Estos resultados han posibilitado que algunos autores sugieran que rituximab debería ser considerado antes que la quimioterapia como segunda línea de tratamiento en los casos de ELPT CD20 positivos, reservando la quimioterapia para los pacientes en los que no pueda usarse o que no respondan a rituximab33.
Otros herpesvirus: herpes-6, herpes-7, herpes-8, herpes simple-1, herpes simple-2 y virus varicela zóster
Virus herpes 6 (VHH-6) y virus herpes 7 (VHH-7)
VHH-6 y VHH-7 son beta-herpesvirus linfotropos que generalmente causan infección en los primeros años de vida. La infección primaria casi siempre es asintomática o se manifiesta únicamente como una enfermedad febril de la infancia, posteriormente permanece en estado latente al igual que ocurre con otros herpesvirus. En adultos la seroprevalencia llega hasta el 90%, lo que condiciona que la mayoría de infecciones en pacientes trasplantados se producen por reactivación del virus latente. En el trasplante de órgano sólido las tasas de infección por VHH-6 oscilan entre el 31 y el 55%37, y existen dos variantes distintas del virus, VHH-6A y VHH-6B; esta última es la responsable de la mayoría de infecciones en pacientes trasplantados. En el TPH, la tasa de infección documentada llega hasta el 40%. En el caso del VHH-7 las tasas de infección oscilan entre el 0 y el 46%, aunque la información disponible es menor que para el VHH-6.
En receptores de TOS, la mayoría de infecciones por VHH-6 ocurren entre las dos y cuatro semanas postrasplante, y se han asociado con el empleo de anticuerpos monoclonales frente a CD3 (OKT3) o globulina antitimocítica, y con los regímenes que contienen sirolimus y anticuerpos frente al receptor IL-12 como terapia de inducción38. En el caso del TPH, el mayor nivel de replicación se alcanza dentro de las primeras 4 semanas postrasplante, siendo el TPH alogénico, la presencia de enfermedad hematológica avanzada, el tratamiento con esteroides y la presencia de antígeno mayor de histocompatibilidad (HLA) no idéntico entre donante y receptor los principales factores de riesgo.
Al igual que ocurre con el CMV, las manifestaciones clínicas del VHH-6 y VHH-7 pueden producirse por la acción directa del virus o bien a través de sus efectos inmunomoduladores. Las infecciones sintomáticas parecen ser más frecuentes en receptores de TPH que en pacientes sometidos a TOS, y pueden estar relacionadas con el tipo de trasplante y la intensidad de la inmunosupresión. En receptores de TOS, la primoinfección suele ser asintomática39 y la manifestación clínica más frecuente es la aparición de un síndrome febril inespecífico. En este sentido, se ha especulado que los cuadros febriles atribuidos al CMV en pacientes trasplantados pudieran estar relacionados con infecciones concomitantes por VHH-6 o VHH-7, más que con infección únicamente por CMV. De hecho, se ha comunicado que el 89% de los receptores de trasplante hepático con infección por CMV presentan infección concomitante por VHH-6 variedad B o VHH-740.
Por otro lado, el VHH-6 puede producir afectación del sistema nervioso central tanto en pacientes sometidos a TOS como a TPH. Esta afectación puede traducirse en encefalitis, alteración del estado mental y convulsiones, y son poco frecuentes los síntomas de focalidad.
Además de estos síntomas se han descrito otras manifestaciones asociadas al VHH-6 como hepatitis, enfermedad gastrointestinal y mielosupresión, generalmente en forma de leucopenia o trombopenia y que aparecen tanto en TOS como en TPH.
Entre los efectos indirectos asociados al VHH-6 en TOS se han comunicado un mayor riesgo de desarrollo de enfermedad por CMV y de infección fúngica invasora en trasplantados hepáticos. En estos pacientes la infección por VHH-6 se ha asociado además a formas más agresivas de recurrencia de la hepatopatía por virus de la hepatitis C y con disfunción del injerto41,42. Otros efectos indirectos descritos son un mayor riesgo de enfermedad por VEB, virus varicela-zóster y micobacterias. En pacientes sometidos a TPH, existen datos conflictivos respecto a la influencia del VHH-6 en el riesgo de rechazo así como de EICH.
En general, de los datos disponibles podemos deducir que en el caso del TOS la afectación producida por el VHH-6 se manifiesta fundamentalmente a través de los efectos indirectos, y son menos frecuentes los casos de enfermedad invasora. Sin embargo, en los pacientes sometidos a TPH, las secuelas clínicas directas parecen ser predominantes, aunque los efectos indirectos especialmente sobre la EICH podrían contribuir a un aumento de la mortalidad de estos pacientes.
En cuanto al diagnóstico, al igual que para otros herpesvirus la serología no resulta de utilidad en el postrasplante ya que carece de la suficiente sensibilidad en el momento de la infección aguda. Las técnicas de PCR son las que aportan mayor sensibilidad para detectar estos virus, aunque presentan la limitación de no diferenciar entre infección latente y activa, lo que puede evitarse mediante el empleo de técnicas cuantitativas. En la actualidad no existe suficiente evidencia para recomendar la monitorización sistemática de VHH-6 y VHH-7 en pacientes asintomáticos.
Carecemos de la suficiente evidencia para recomendar profilaxis universal o terapia anticipada frente a VHH-6 y VHH-7. Existen datos in vitro que han evidenciado actividad de ganciclovir, foscarnet y cidofovir frente a VHH-643. Estos datos se han confirmado in vivo por la disminución de reactivaciones de VHH-6 en pacientes sometidos a tratamiento con ganciclovir o foscarnet. Ambos fármacos se han empleado con éxito en el tratamiento de meningoencefalitis por VHH-6 tras el trasplante. Sin embargo, la tasa de curación de este tratamiento que podemos extraer de los casos publicados llega únicamente al 60%37. Tanto VHH-6 como VHH-7 presentan baja sensibilidad frente a aciclovir. La elección del fármaco antiviral deberá basarse fundamentalmente en el perfil de seguridad del mismo. Aunque ganciclovir presenta riesgo de nefrotoxicidad, parece razonable evitar la administración de foscarnet en pacientes con riesgo elevado o que presentan insuficiencia renal. Por el contrario, en aquellos casos en los que existan citopenias hematológias, foscarnet puede ser una alternativa debido a que no posee los efectos mielosupresores de ganciclovir.
Virus herpes 8 (VHH-8)
El VHH-8 es un gamma-herpesvirus conocido por ser el agente etiológico del sarcoma de Kaposi (SK), linfoma de cavidades y la enfermedad de Castleman44,45. A diferencia de otros herpesvirus, la infección por este virus no es ubicua, presenta tasas de seroprevalencia que oscilan dependiendo de las regiones geográficas entre el 0 y el 5% en Norteamérica, el 5 y el 20% en el área Mediterránea y más del 50% en regiones de África.
El riesgo de reactivación y de infección primaria después del trasplante dependerá, por tanto, de la seroprevalencia del virus en la región, lo que justifica las diferentes tasas de incidencia de SK que han sido comunicadas (0,5% en Norteamérica y Norte de Europa, y 5,3% en Arabia Saudí)46. La seropositividad previa al trasplante, así como la infección primaria adquirida a través del donante, incrementan el riesgo de SK. Además, la intensidad de la inmunosupresión y el empleo de productos antilinfocitarios pueden desempeñar un papel importante en la patogenicidad del VHH-847.
La realización de técnicas de PCR constituye una opción atractiva para monitorizar la carga viral del VHH-8, sobre todo si tenemos en cuenta que las concentraciones de VHH-8 en linfocitos de sangre periférica se han asociado con el desarrollo de SK48. El empleo de cribado serológico del donante y receptor puede resultar útil sobre todo en poblaciones de alto riesgo. Sin embargo, la utilidad de la detección rutinaria de la carga viral en el seguimiento de estos pacientes deberá demostrarse en futuras investigaciones.
Aunque existen estudios in vitro que han demostrado actividad de ganciclovir, foscarnet y cidofovir frente a VHH-8, el papel de estos antivirales en estrategias de profilaxis o terapia anticipada resulta incierto. Se desconoce si las estrategias empleadas para la prevención del CMV ejercen un efecto frente a la infección por VHH-8. En cuanto a la prevención, resulta complicado realizar recomendaciones específicas. En receptores seropositivos frente a VHH-8 o que reciben un órgano de un donante seropositivo, la monitorización de la carga viral podría resultar de utilidad. En pacientes con SK, la reducción de la inmunosupresión puede llevar a la regresión del tumor y constituye la primera línea de tratamiento46. En pacientes que no responden a esta medida puede emplearse radiación o quimioterapia. El empleo de fármacos antivirales en pacientes trasplantados con SK u otras manifestaciones de infección por VHH-8 requiere futuras investigaciones.
Virus herpes simple-1 y -2 y virus varicela zóster
El virus herpes simple (VHS)-1 y VHS2, y el virus varicela zóster (VVZ) pertenecen a la familia de los alfaherpesvirus. Las tasas de seroprevalencia para VHS varían entre las diferentes poblaciones. Oscila entre el 60 y el 80% para el VHS-1, con cifras algo inferiores para VHS-2. La incidencia de enfermedad por VHS en pacientes que no reciben profilaxis oscila entre el 25 y el 35%, y el período de máximo riesgo son las primeras 4 semanas postrasplante49. En los pacientes trasplantados la mayoría de las infecciones por VHS son originadas por reactivación de una infección latente, aunque se han descrito infecciones primarias transmitidas desde el injerto. La presentación más frecuente es la gingivoestomatitis causada por VHS-1 o la enfermedad genital o perianal originada por VHS-2. Además de estas manifestaciones el VHS puede ocasionar enfermedad invasora y producir esofagitis, hepatitis y neumonitis, que afectan fundamentalmente a pacientes trasplantados de pulmón o de pulmón y corazón50.
En cuanto al VVZ, la seroprevalencia se sitúa en torno al 75% y al igual que para otros herpesvirus, en la mayoría de los casos la enfermedad en pacientes trasplantados se origina a partir de la reactivación de una infección latente. La incidencia de herpes zóster se sitúa entre el 2 y el 10% en trasplante renal y hepático y en el 20% para el trasplante cardíaco49,51,52. En el caso del TPH la incidencia es mayor y puede llegar hasta el 50%. En estos pacientes la afectación puede ser metamérica o generalizada y aparece la mayoría de los casos después de los primeros 3 meses postrasplante. Al igual que para VHS, además de la afectación superficial el VVZ puede producir complicaciones viscerales como neumonitis, hepatitis y encefalitis.
El estado serológico del receptor condiciona el riesgo de infección después del trasplante. Los pacientes seropositivos para VHS o VVZ previamente al trasplante presentan mayor riesgo de reactivación posterior. Los pacientes seronegativos pueden adquirir la infección a partir de la exposición en la comunidad. En receptores de TPH, la EICH aguda y crónica, los receptores HLA no idénticos y el trasplante autólogo por linfoma se han descrito como factores de riesgo de reactivación clínica de VVZ38. Además, la EICH aguda y el desarrollo de varicela por infección primaria se han asociado a mayor riesgo de enfermedad diseminada en estos pacientes. En el caso del TOS la intensidad de la inmunosupresión empleada condiciona el riesgo de reactivación viral.
En la mayoría de los casos las manifestaciones clínicas típicas de la enfermedad por VHS y VVZ son la principal herramienta para el diagnóstico. Los métodos de laboratorio se reservan para los casos de presentación atípica o afectación visceral. Entre estos métodos, el cultivo viral obtenido de muestras de la lesión es comúnmente empleado, así como las técnicas de PCR que pueden emplearse para detectar el genoma viral tanto en muestras de tejido como de fluidos.
En cuanto a la profilaxis, aciclovir y valaciclovir han mostrado ser efectivos para prevenir la enfermedad por VHS y VVZ53. Además, los regímenes empleados en la profilaxis frente a CMV son efectivos para la prevención de VSH y probablemente también para VVZ7. En candidatos a trasplante que son seronegativos frente a VVZ, la vacunación con virus atenuados estaría indicada para prevenir la infección primaria postrasplante. En estos pacientes se aconseja un intervalo de entre cuatro y seis semanas entre la vacunación y la realización del trasplante al ser una vacuna de virus atenuados. Además, y debido a su alta contagiosidad, en estos pacientes resulta recomendable la vacunación de los potenciales contactos seronegativos. La administración de la vacuna se desaconseja una vez que se ha realizado el trasplante al ser una vacuna de virus atenuados. Finalmente, los pacientes seronegativos frente a VVZ expuestos a un caso de varicela, zóster o exantema tras vacunación deben recibir profilaxis postexposición mediante la administración de gammaglobulina específica tan pronto como sea posible (dentro de las 92 h siguientes)54. Pasado este período la administración de antivirales como profilaxis postexposición debe ser considerada.
En pacientes seropositivos la profilaxis con aciclovir no se recomienda de forma sistemática dada la buena respuesta al tratamiento y el riesgo potencial de desarrollo de resistencias asociado a la profilaxis.
Para el tratamiento de la enfermedad por VHS o VVZ, el fármaco de elección es aciclovir administrado por vía intravenosa. La administración de aciclovir oral, famciclovir o valaciclovir puede considerarse en casos de afectación orolabial por VHS o de zóster monometamérico. En los pacientes trasplantados la resistencia a aciclovir es un hecho infrecuente y el tratamiento con foscarnet es la alternativa en estos casos.
Virus de la hepatitis B
El VHB se encuentra distribuido ampliamente en todas las zonas del mundo; existen aproximadamente unos 500 millones de portadores crónicos y una incidencia de infección de 30.000-50.000 casos al año, de los cuales el 10 y el 15% desarrollarán hepatitis crónica.
La prevalencia de VHB entre los pacientes incluidos en programa de hemodiálisis y trasplantados renales se encuentra entre el 0,1 y el 1,4%. En estos pacientes, la positividad del antígeno de superficie del virus de la hepatitis B (Hbs-Ag) implica un peor pronóstico que los pacientes negativos de Hbs-Ag, especialmente cuando se acompaña de coinfección por virus de la hepatitis C55. En trasplantados cardíacos, la prevalencia de infección por VHB se sitúa en el 3-10%. La mayoría de estos pacientes permanecen asintomáticos durante largos períodos aunque hasta un 50% desarrollará cirrosis a los 7-10 años del trasplante. En el caso de los trasplantados hepáticos, a pesar de que el empleo de inmunoglobulina específica frente al VHB (IgHB) junto con lamivudina ha reducido las tasas de recurrencia hasta menos del 10%, la recidiva de la infección postrasplante continúa limitando el pronóstico especialmente en aquellos con replicación activa en el momento de ser trasplantados55.
Entre los principales factores de riesgo de adquisición de novo de VHB tras el trasplante se encuentran el estado serológico donante/receptor, la intensidad de la inmunosupresión, el empleo de hemoderivados y la ausencia de vacunación previa al trasplante56. El trasplante de un órgano positivo de Hbs-Ag a un receptor seronegativo supone un alto riesgo de transmisión del virus57. En los casos de donantes negativos de Hbs-Ag y positivos de Hbc-Ac existe un alto riesgo de transmisión a receptores de trasplante hepático a menos que se administre una pauta intensiva de profilaxis. Sin embargo, el riesgo de transmisión a receptores de trasplante no hepático seronegativos es escaso58. Por otro lado, los candidatos positivos de Hbs-Ag que presentan ADN viral o HBe-Ag positivo tienen una mayor mortalidad de origen hepático que aquellos Hbs-Ag positivos sin ADN viral o HBe-Ag.
Para la prevención de la infección por VHB se aconseja la vacunación de forma precoz de los candidatos negativos de HBs-Ag, realizando una monitorización anual de los títulos de anticuerpos con administración de una dosis de recuerdo si el título desciende por debajo de 10 mU/ml59. Además de la vacunación debe realizarse un cribaje riguroso de los hemoderivados así como la monitorización de parámetros serológicos y virales en todos los pacientes en programa de hemodiálisis.
Para prevenir o al menos retrasar la reinfección por VHB tras el trasplante hepático se recomienda el empleo combinado de IgHB y lamivudina. En trasplantados no hepáticos puede emplearse lamivudina en casos de hepatitis activa y alta carga viral, teniendo en cuenta que el tratamiento con interferón alfa es menos eficaz en este contexto y que ha sido asociado con un mayor riesgo de rechazo. En algunos casos de resistencia a lamivudina, la continuación de este tratamiento se ha mostrado eficaz en algunas ocasiones. Además, otro fármaco como adefovir ha sido satisfactoriamente empleado en infecciones por VHB resistentes a lamivudina, aunque debido a la posibilidad de toxicidad renal su empleo puede estar limitado en pacientes con disfunción renal asociada a los inhibidores de la calcineurina.
Virus de la hepatitis C
En la actualidad se estima que existen 150 millones de pacientes infectados por el VHC en todo el mundo. De los pacientes infectados, el 85% desarrolla una infección crónica mientras que el 10-30% evolucionan a cirrosis a largo plazo. Los factores de riesgo universales para la adquisición de la infección son la transfusión de hemoderivados y el uso de drogas por vía parenteral. Además, el VHC puede transmitirse a través del injerto con un riesgo que varía en función del órgano trasplantado. En pacientes en diálisis la incidencia de infección por VHC de novo ha disminuido mediante la aplicación de medidas de control y el cribaje de productos sanguíneos, hasta situarse actualmente en el 0,7-3%60. Una vez que se realiza el trasplante renal, la infección por VHC se asocia con mayor morbilidad y mortalidad que los pacientes trasplantados VHC negativos. Además, los receptores de trasplante renal infectados por VHC presentan mayor riesgo de glomerulonefritis membranoproliferativa, membranosa, vasculitis leucocitoclástica y crioglobulinemia61. Es importante destacar que en estos pacientes no existe correlación entre el grado de elevación de transaminasas, la carga viral y el genotipo del VHC con la gravedad de las lesiones histológicas. La enfermedad hepática avanzada, particularmente la cirrosis, en pacientes con insuficiencia renal crónica, se considera una contraindicación para el trasplante renal aislado, por lo que se debe considerar la biopsia renal para los candidatos sin evidencia clínica de cirrosis. En estos casos se recomienda evaluar la realización de trasplante doble de riñón e hígado.
Una vez que se realiza el trasplante renal, la disfunción en la respuesta de los linfocitos T puede originar una menor progresión de la enfermedad, lo que podría explicar la mayor supervivencia de los pacientes trasplantados infectados por VHC en comparación con los pacientes VHC positivos en hemodiálisis62. Ésta es la razón por la que se recomienda aceptar a los pacientes con insuficiencia renal terminal para la realización de trasplante.
En receptores de trasplante cardíaco negativos de VHC el empleo de donantes seropositivos implica un significativo riesgo de transmisión del VHC, aunque no parece existir gran influencia sobre el injerto y la supervivencia del paciente.
Respecto al trasplante hepático, la hepatopatía crónica por VHC constituye su principal indicación a pesar de que la tasa de reinfección sobre el injerto es virtualmente universal, y en el 50-80% se desarrollará hepatitis del injerto. De hecho, la supervivencia tanto del órgano trasplantado como del paciente es inferior a la de los trasplantados hepáticos negativos de VHC, dependiendo del grado de replicación viral previa al trasplante.
Además de la intensidad de la replicación, el tipo y la intensidad de la inmunosupresión presentan una influencia sobre la progresión de la hepatopatía por VHC postrasplante, con una mayor incidencia de fibrosis del injerto y cirrosis con pautas de doble o triple terapia que la inmunosupresión con un único fármaco.
En algunos estudios se ha evidenciado que el trasplante hepático desde un donante positivo de VHC a un receptor seropositivo parece ser una estrategia segura63. Sin embargo, y dado que el genotipo 1 presenta menor respuesta al tratamiento antiviral y requiere una mayor duración de éste, se recomienda evitar el trasplante de órganos de un donante con genotipo 1 a un receptor seropositivo pero con un genotipo más favorable como el 2 o 3.
El diagnóstico de infección crónica y activa se realiza detectando el ARN del virus en sangre.
El interferón alfa en combinación con ribavirina es el tratamiento más eficaz para la hepatopatía crónica por VHC. Sin embargo, en trasplantados renales el empleo de interferón se ha asociado a rechazo, pérdida del injerto y a un rebote de la carga viral a los valores anteriores al tratamiento, por lo que se desaconseja su uso en estos pacientes. La eficacia a largo plazo de la monoterapia con ribavirina en esta población es desconocida. En contraste con los trasplantados renales, el tratamiento con interferón en monoterapia o combinado con ribavirina se ha recomendado en receptores de trasplante hepático positivos de VHC. La respuesta virológica completa se presenta hasta en el 50% de los pacientes, aunque sólo una parte de ellos presentará respuesta viral sostenida después de la retirada del tratamiento. La escasez de los datos disponibles sobre tratamiento del VHC en trasplantados cardíacos, pulmonares o de pulmón y corazón no permite realizar recomendaciones generales en el momento actual.
Virus BK
El virus BK pertenece a la familia de los poliomavirus y se encuentra ampliamente distribuido con tasas de seroprevalencia del 80%. En el huésped inmunocomprometido la mayoría de casos de infecciones por virus BK suceden como consecuencia de la reactivación del virus latente, que se encuentra fundamentalmente en las células epiteliales del túbulo renal. En esta población, hasta el 90% de las infecciones son asintomáticas aunque pueden aparecer una gran variedad de manifestaciones como viruria y viremia, ulceración y estenosis uretral, cistitis hemorrágica y nefritis intersticial64.
La mayoría de casos de infecciones por virus BK se producen en pacientes sometidos a trasplante renal. En estos pacientes la nefritis tubulointersticial (nefropatía BK) constituye la expresión más frecuente de enfermedad por este virus65. Esta entidad se manifiesta típicamente como una elevación en la concentración de creatinina plasmática como consecuencia de una progresiva pérdida de función del injerto, por lo que puede resultar difícil su distinción del rechazo o de toxicidad farmacológica.
Aunque los factores de riesgo no están bien definidos, el estado donante/receptor D+/R y D+/R+, la intensidad de la inmunosupresión, el empleo de algunos inmunosupresores específicos (tacrolimus y ácido micofenólico) y la presencia de rechazo se han asociado a mayor riesgo de nefropatía BK38.
Para el diagnóstico definitivo de enfermedad por virus BK se requiere la realización de biopsia renal. En estadios iniciales de la enfermedad, pueden observarse inclusiones virales junto con un pequeño grado de inflamación. Las fases tardías se caracterizan por un infiltrado de células mononucleares con invasión focal del uroepitelio y el túbulo renal. Las células infectadas muestran grandes núcleos hipercromáticos junto con inclusiones virales intranucleares. Este hallazgo es importante ya que para confirmar el diagnóstico resulta necesaria la demostración del virus en el interior de la célula infectada, lo que permite distinguir a la nefropatía BK del rechazo.
Además del examen anatomopatológico pueden emplearse otros métodos no invasores, como el estudio citológico de la orina que permite la visualización de las células decoy (células epiteliales con grandes núcleos e inclusiones basófilas). La presencia de estas células es sugestiva de viruria, y presentan una sensibilidad de aproximadamente el 100% para el diagnóstico de infección por virus BK, aunque con un valor predictivo positivo del 30%66. Esto puede ser debido a que las células decoy pueden aparecer en la infección por otros virus como el JC, CMV o adenovirus, o bien porque la presencia de viruria presenta escasa correlación con la nefritis por virus BK. La escasa especificidad del estudio citológico ha motivado el empleo de técnicas moleculares en sangre y orina para el diagnóstico de esta infección. De esta forma se ha evidenciado cómo la viremia plasmática de BK se correlaciona con la presencia de nefropatía por este virus y puede emplearse para monitorizar la respuesta al tratamiento66.
Para el tratamiento de la nefropatía BK la medida más importante consiste en la disminución de la inmunosupresión. Sin embargo, en algunas ocasiones la aplicación de esta estrategia se encuentra limitada por el rechazo de forma concomitante con la nefritis viral. Esto ha motivado el empleo de fármacos antivirales como vidarabina, cidofovir y leflunomida, de los cuales disponemos de escasos datos sobre su eficacia67.
Parvovirus B-19
Parvovirus B-19 es un virus ADN cuya seroprevalencia en adultos oscila entre el 60% y el 90%. La infección primaria por este virus ocurre más frecuentemente en la infancia y se manifiesta clásicamente como eritema infeccioso, aunque en la mayoría de ocasiones se presenta de forma asintomática. En adultos, la infección primaria por parvovirus B-19 puede manifestarse como artritis y en los casos de adquisición durante el embarazo se ha asociado con el desarrollo de Hydrops fetalis.
En pacientes trasplantados la incidencia de infección por parvovirus B-19 es baja, a pesar de que el virus persiste en los tejidos de los individuos seropositivos, y que, por tanto, podría transmitirse potencialmente a través del injerto o de productos sanguíneos trasfundidos al receptor68.
En pacientes sometidos a TOS la infección por parvovirus B-19 se manifiesta típicamente por el desarrollo de aplasia pura de serie roja con un escaso o ausente recuente reticulocitario. Ello es debido a que parvovirus B-19 infecta a los precursores eritroides mediante la unión al receptor conocido como antígeno P. Además, parvovirus B-19 se ha asociado con otras manifestaciones como hepatitis, neumonitis, miocarditis y disfunción del injerto. En receptores de TPH, la anemia asociada a parvovirus B-19 es un hecho infrecuente probablemente por el efecto profiláctico de la inmunoglobulina intravenosa que es administrada en muchos de estos pacientes.
Para el diagnóstico de infección por parvovirus B-19 se han empleado la serología, el examen histológico de la médula ósea y la detección del ADN viral mediante PCR. La serología presenta la importante limitación de su escasa sensibilidad en pacientes inmunosuprimidos, por lo que la presencia de IgM negativa frente a parvovirus B-19 no descarta el diagnóstico de infección. En estos pacientes el diagnóstico puede realizarse mediante técnicas de PCR en sangre periférica. En los casos en los que exista alta sospecha de enfermedad por parvovirus B-19 en los que el resultado de la PCR haya sido negativo, el diagnóstico puede confirmarse mediante estudio histológico de la médula ósea68.
Para el tratamiento de la enfermedad por parvovirus B-19 no existen en la actualidad fármacos antivirales disponibles, por lo que se aconseja si es posible la reducción en la inmunosupresión. El hecho de que la viremia desaparezca con la generación de anticuerpos, ha llevado a la inclusión de la inmunoglobulina intravenosa en el tratamiento de la enfermedad por parvovirus B-1969. La inmunoglobulina intravenosa contiene inmunoglobulinas específicas frente a parvovirus B-19 y resulta útil en el tratamiento de la anemia asociada a la replicación viral. Sin embargo, en la actualidad se desconocen tanto las dosis como la duración óptima del tratamiento con inmunoglobulina y se observan recaídas tras el cese de su administración. Para el diagnóstico precoz de estas recaídas puede ser recomendable la monitorización de las concentraciones de hemoglobina una vez suspendido el tratamiento y considerar la realización de PCR en aquellos pacientes que desarrollen anemia. En aquellos pacientes en quienes se confirme el diagnóstico, el retratamiento con inmunoglobulina intravenosa puede ser empleado.
Virus respiratorios
Los virus respiratorios causan frecuentemente enfermedad que afecta al tracto respiratorio tanto en pacientes inmunosuprimidos como inmunocompetentes, y afectan sobre todo a la población infantil. Entre estos virus se incluyen el virus respiratorio sincitial (VRS), parainfluenza (VP), influenza (VI), adenovirus, rhinovirus, coronavirus y enterovirus.
El VRS es un virus ARN causante de epidemias anuales por todo el mundo. Aunque los síntomas de la infección por VRS son generalmente leves en niños y adultos, se han descrito casos de enfermedad invasora fundamentalmente en receptores de TPH relacionados con la adquisición de la infección por debajo del primer año de edad, la enfermedad pulmonar subyacente y el grado de inmunosupresión70. El diagnóstico definitivo se realiza mediante el cultivo del virus en determinadas líneas celulares, aunque el coste y el tiempo requeridos para su crecimiento han posibilitado la aparición de otras alternativas como la detección antigénica y los métodos de shell vial. Para estas infecciones se recomienda el tratamiento de soporte en los casos de afectación del tracto respiratorio superior en ausencia de factores de riesgo. En los casos de afectación del tracto respiratorio inferior o de presencia de factores de riesgo se recomienda el empleo de aerosoles de ribavirina en combinación con inmunoglobulina intravenosa o palivizumab, un anticuerpo monoclonal específico frente a VRS38.
El VI se considera uno de los virus causantes de morbimortalidad más importantes a lo largo de todo el mundo. En la actualidad la información prospectiva sobre la incidencia de este virus en la población trasplantada es escasa. Sin embargo, en estudios retrospectivos se ha evidenciado el papel del virus en la aparición de enfermedad grave en pacientes pediátricos. En trasplantados adultos la gravedad de la enfermedad por VI se ha relacionado con la intensidad de la inmunosupresión, el tipo de trasplante y la variación estacional en su virulencia38. El diagnóstico de certeza de infección por VI se obtiene por el aislamiento del virus en el cultivo. Además, otros métodos como el cultivo shell vial, la detección antigénica y la detección de actividad neuraminidasa son relativamente sensibles y específicos aunque no siempre se encuentran disponibles. El tratamiento precoz de la infección por influenza A con amantadina o los inhibidores de neuraminidasa zanamivir y oseltamivir se ha mostrado efectivo en adultos sanos. Únicamente estos últimos presentan eficacia frente a influenza B. El tratamiento de VI con zanamivir inhalado u oseltamivir oral parece reducir el riesgo de complicaciones respiratorias aunque ninguno de estos fármacos ha demostrado eficacia en la prevención de complicaciones graves del VI. A pesar de la ausencia de datos en pacientes trasplantados, algunos autores recomiendan el uso de un antiviral para el tratamiento de los pacientes trasplantados con infecciones por VI. La vacunación de los pacientes de alto riesgo parece la medida más eficaz frente al VI. Esta vacuna debe administrarse además a los contactos cercanos y a los trabajadores sanitarios38. La respuesta a la vacuna en los pacientes trasplantados no es, sin embargo, tan intensa como la que aparece en la población general.
Las infecciones por los tipos 1 y 2 del VP se producen generalmente en invierno, a diferencia del tipo 3, cuyas infecciones se distribuyen a lo largo de todo el año. El VP puede producir enfermedad grave en pacientes pediátricos y en receptores de trasplante pulmonar de cualquier edad. En estos últimos, la infección por VP se ha asociado con la presencia de rechazo agudo y bronquiolitis obliterante. Las manifestaciones clínicas de esta infección incluyen desde un cuadro catarral de vías altas hasta insuficiencia respiratoria grave. Al igual que para el VRS y el VI, el cultivo del virus y la detección antigénica mediante inmunofluorescencia constituyen las principales herramientas para el diagnóstico. A ellas se ha sumado recientemente la detección del ARN viral. Aunque no se dispone de tratamiento antiviral específico frente a VP, se ha propuesto el empleo de ribavirina en aerosol en pacientes de alto riesgo con enfermedad grave asociada a este virus. Sin embargo, en el análisis de esta estrategia procedente de estudios no aleatorizados en receptores de TPH se ha evidenciado escasa respuesta clínica. Las medidas de control de la transmisión nosocomial representan la mejor actitud profiláctica ya que no existen pautas específicas de profilaxis frente a VP.
Virus West Nile
Los pacientes trasplantados pueden adquirir el virus West Nile (VWN) a través del donante, mediante transfusión o a través de exposición en la comunidad. En estos pacientes, el riesgo de desarrollo de meningoencefalitis tras la exposición es mayor que en individuos inmunocompetentes. En áreas endémicas, el cribado de los hemoderivados, la monitorización de los donantes y las medidas de precaución de los receptores frente a la adquisición comunitaria del virus constituyen las principales estrategias preventivas. La reducción de la inmunosupresión representa la principal estrategia en los receptores con enfermedad por VWN71.
Agradecimientos
Financiado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
Correspondencia: Dr. J. Torre-Cisneros.
UGC de Enfermedades Infecciosas.
Hospital Universitario Reina Sofía.
Avda. Menéndez Pidal, s/n. 14004 Córdoba. España.
Correo electrónico: julian.torre.sspa@juntadeandalucia.es
Manuscrito recibido el 6-6-2007; aceptado el 13-6-2007.