Introducción
La tuberculosis sigue siendo la enfermedad infecciosa más prevalente. En 2005, la Organización Mundial de la Salud (OMS) informaba que continuaba aumentando en todo el mundo a razón de un 1% anual. Durante 2003 se detectaron 8,8 millones de casos nuevos, lo que corresponde a una tasa de 140/100.000 habitantes. De ellos, 3,9 millones (62/100.000) eran bacilíferos y 674.000 (11/100.000) estaban además infectados por el virus de la inmunodeficiencia humana (VIH)1.
Mycobacterium tuberculosis se caracteriza por tener un tiempo de generación prolongado y posee la capacidad de entrar en períodos de latencia con actividad metabólica limitada, lo que dificulta la acción de los antimicrobianos2. Debido a este comportamiento biológico, M. tuberculosis da origen a poblaciones bacterianas heterogéneas y mutantes naturales. Se debe utilizar, por tanto, una terapia combinada para evitar la selección de estos mutantes resistentes. Si tratáramos al M. tuberculosis con un solo fármaco destruiríamos rápidamente la mayoría de los bacilos, pero quedarían los bacilos resistentes naturales que harían recidivar la enfermedad. La combinación de 3 fármacos hace matemáticamente imposible que se generen resistentes naturales a los 3 fármacos a la vez. Además, el tratamiento debe ser lo suficientemente prolongado que permita eliminar todas las poblaciones bacilares: extracelulares, intracelulares y bacilos con actividad metabólica alta o baja2. La incorporación al régimen actual de rifampicina y piracinamida ha permitido reducir el tiempo total de tratamiento a sólo 6 meses.
El problema se produce cuando varios fármacos administrados durante un período prolongado de tiempo ocasionan un elevado grado de incumplimiento. Todo ello se ve agravado porque los pacientes que hay que tratar, en numerosas ocasiones, pertenecen a grupos sociales con grandes dificultades para cumplir cualquier tratamiento3. Por tanto, insistir en el cumplimiento tiene sentido porque el objetivo del tratamiento es múltiple: incluye la curación sin recidivas, evitar la muerte, interrumpir la transmisión y prevenir la aparición de resistencias secundarias4-6. La administración del tratamiento directamente observado o supervisado debería ser la estrategia terapéutica de elección.
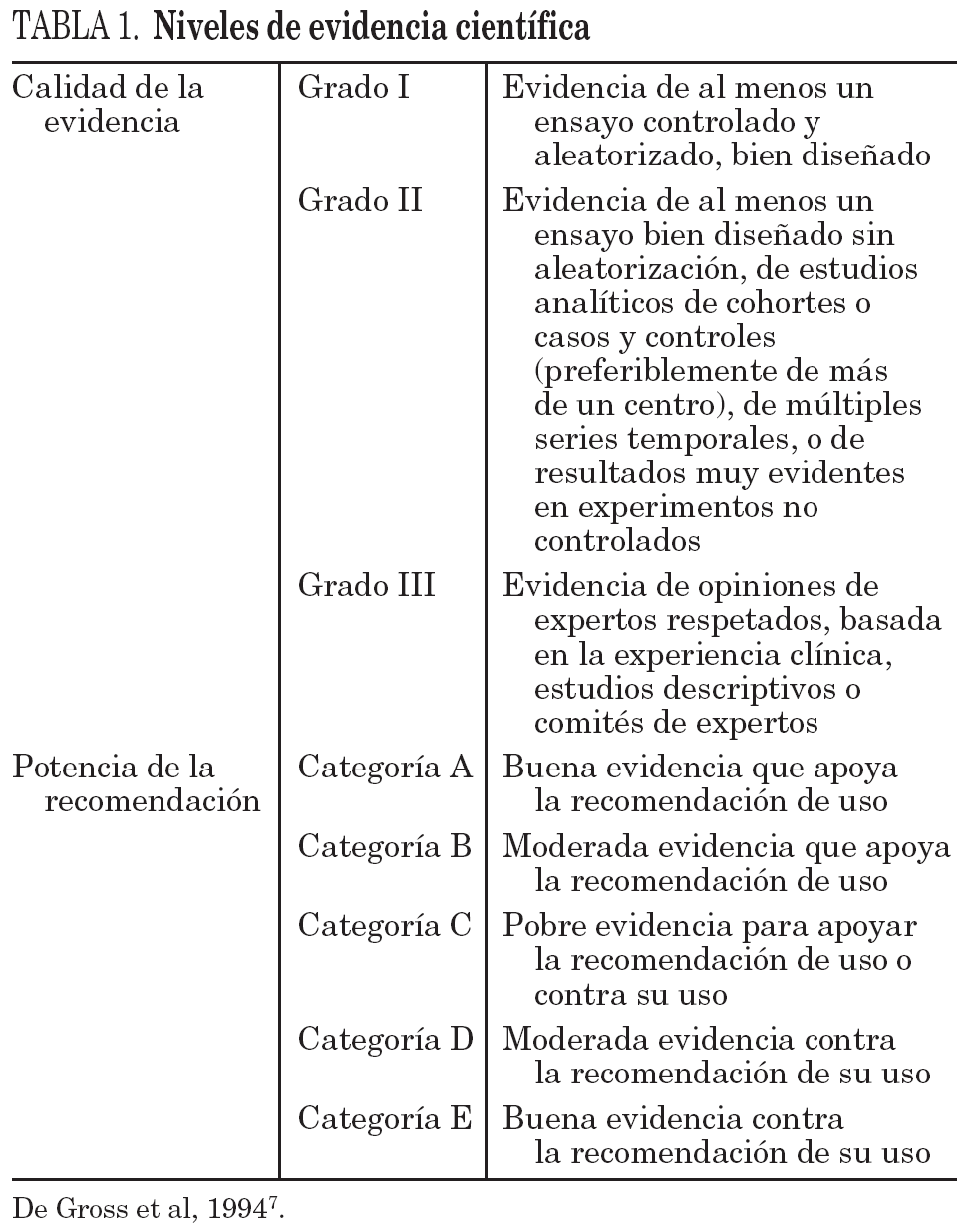
El presente documento es una guía sobre el tratamiento de los pacientes con tuberculosis, para su uso en la práctica clínica diaria, basada en la evidencia existente en el momento de su elaboración y, por tanto, sujeta a las modificaciones derivadas de las nuevas evidencias que en el futuro estén disponibles. Para graduar dicha evidencia se han seguido los estándares de calidad propuestos por la Infectious Diseases Society of America7. La opinión de expertos se ha valorado con evidencia B III (tabla 1).
Como método de elaboración de esta guía se propuso un equipo compuesto por especialistas en medicina interna expertos en enfermedades infecciosas. Las fuentes bibliográficas consultadas han sido: publicaciones escritas y electrónicas (ensayos clínicos, guías, metaanálisis, etc.) y bases de datos bibliográficas (Medline, Cochrane, etc.). El borrador se difundió a través del portal de internet de la Sociedad Andaluza de Enfermedades Infecciosas (www.saei.org), para su estudio por todos los miembros de la SAEI durante 30 días y el envío de sugerencias al coordinador del documento. Con las sugerencias recibidas, el grupo de trabajo elaboró el borrador final, el cual fue finalmente debatido y aprobado en una sesión de trabajo el 24 de junio de 2006. La versión actual, documento de consenso de la SAEI, se ha finalizado a partir de las modificaciones introducidas en la reunión.
Apartados del documento
1.Tratamiento estándar de la tuberculosis pulmonar inicial.
2.Tratamiento de la tuberculosis extrapulmonar.
3.Tratamiento de la tuberculosis resistente.
4.Tratamiento de la tuberculosis en pacientes infectados por el VIH.
5.Tuberculosis e inmigración.
6.Tratamiento de la tuberculosis en otras situaciones especiales.
7.Tratamiento de la tuberculosis en situaciones de abandono de la terapia, recidiva o fracaso. Cumplimiento del tratamiento.
Tratamiento estándar de la tuberculosis pulmonar inicial
Indicaciones de inicio de tratamiento
La tuberculosis tiene un tratamiento eficaz que asegura, en los casos no complicados, una tasa de curación del 95%8.
La decisión de iniciar la quimioterapia antituberculosa se debe basar en datos epidemiológicos, clínicos, radiológicos y microbiológicos. La terapia empírica se inicia cuando hay una alta sospecha con la suma de estos datos, aun estando pendiente la confirmación microbiológica (A III)9-11. El umbral para iniciar el tratamiento empírico debería ser especialmente bajo en pacientes con formas clínicas potencialmente mortales como meningitis o tuberculosis miliar.
Fármacos antituberculosos de primera línea
Los fármacos antituberculosos se clasifican en 2 grupos (primera y segunda línea) en función de su eficacia, potencia, toxicidad y tolerancia. Actualmente los fármacos de primera línea son isoniacida (H), rifampicina (R), piracinamida (Z), etambutol (E) y estreptomicina (S) (tabla 2). Existen otras rifamicinas con actividad tuberculostática como son la rifapentina y la rifabutina. Rifapentina es una nueva rifamicina que permite una dosificación semanal pero que no está disponible todavía en España. La indicación de la rifabutina sería el tratamiento de pacientes con infección por el VIH que precisen continuar con inhibidores de proteasas o pacientes en tratamiento con ciclosporina o tacrolimus en los que se desaconseja la rifampicina (B III)2,9.
Isoniacida y, en menor grado, etambutol pueden causar neuropatía periférica. Es más probable que ocurra en caso de que haya factores de riesgo preexistentes (p. ej., diabetes, alcoholismo, embarazo, malnutrición o infección por el VIH). El uso de piridoxina (25-50 mg/día) puede prevenir la neuropatía, pero sólo debería administrarse en el caso de que existan factores de riesgo (B III). Se puede ver también un aumento moderado de las transaminasas en un 10-20% de los casos (hepatitis subclínica). El riesgo de hepatitis aguda clínica aumenta con la edad, siendo extremadamente rara en personas menores de 30 años (0,1%), elevándose al 4% en pacientes de más de 65 años. Es fácilmente previsible con controles clínicos periódicos, y en los casos con factores de riesgo (etilismo y hepatopatía crónica) con controles analíticos periódicos. Otros efectos secundarios poco frecuentes son: disartria, visión borrosa e hiperreflexia. En menos de un 1% de los casos puede aparecer fiebre, crisis convulsivas, depresión, psicosis, exantema y artralgias9.
La mayoría de los pacientes toleran bien la rifampicina a las dosis habituales, pero en algunos casos la intolerancia gastrointestinal (dolor epigástrico, anorexia, náuseas, vómitos y diarrea) obligan a la retirada del fármaco. Es frecuente, al inicio del tratamiento, una elevación moderada de la bilirrubina y de las enzimas de colestasis, pero suele ser transitoria y no tiene importancia clínica. La hepatitis asociada a rifampicina es rara pero posible. Se produce, sobre todo, cuando la rifampicina se asocia a otros fármacos hepatotóxicos, como es este caso (2,7%). Es dosis dependiente, por lo que se aconseja no pasar de la dosis de 10 mg/kg (dosis máxima 600 mg al día, diaria o intermitente)9 (B III).
La erupción cutánea con o sin síndrome seudogripal, trombocitopenia y fiebre aparece en un 1-5% de los casos, y es claramente más frecuente en los enfermos infectados por el VIH y en la administración intermitente del fármaco. Una reacción grave de hipersensibilidad a la rifampicina es infrecuente en la población general (< 1%), pero puede elevarse hasta el 10% en pacientes con infección por VIH y/o dosificación intermitente. Los cuadros clínicos descritos son muy variados y se cree que están desencadenados por inmunocomplejos circulantes, pero el mecanismo patogénico exacto no se conoce. Se han descrito cuadros de fiebre, ataxia, eosinofilia, síndrome flu-like, trombocitopenia, anemia hemolítica y/o insuficiencia renal con o sin nefritis intersticial. Estos cuadros precisan en ocasiones del uso de corticoides. En el caso de que la reacción de hipersensibilidad no haya sido grave, puede reintroducirse la rifampicina con dosis ascendente12 (B III). La rifampicina induce el metabolismo hepático de muchos medicamentos por competencia con el citocromo P450: anticonceptivos, antifúngicos, metadona, corticoides, hipoglucemiantes, anticoagulantes, digoxina, fenitoína, inhibidores de proteasas, ciclosporina y tacrolimus9.
La toxicidad más importante de la piracinamida es la hepática. Disminuye el riesgo de toxicidad con dosis de piracinamida menor a 35 mg/kg/día. La asociación de piracinamida y rifampicina para el tratamiento de la tuberculosis latente se ha asociado a un aumento significativo de la hepatotoxicidad13, pero, sin embargo, no se ha demostrado esto mismo cuando se usa la asociación triple (con isoniacida) en la primera fase del tratamiento antituberculoso, sin que se conozca cuál es la explicación de esta paradoja. La hiperuricemia es frecuente (por inhibición de la secreción tubular renal), pero las manifestaciones clínicas de ésta son poco comunes, salvo en pacientes gotosos. Por lo que, en ausencia de gota, no hay que retirar el fármaco ni tratar la hiperuricemia9.
Manejo clínico de la toxicidad
Antes de iniciar el tratamiento de la tuberculosis debe descartarse que el paciente tenga alguna enfermedad de base, fundamentalmente hepática, que contraindique o modifique el uso de alguno de los fármacos de elección.
Si hay una erupción eritematosa generalizada, sobre todo con fiebre, hay que suspender el tratamiento. Si la tuberculosis es grave, se inicia un tratamiento triple con un aminoglucósido (estreptomicina) y 2 agentes orales alternativos. Si no es grave, puede posponerse la reintroducción del tratamiento. Cuando la erupción desaparece, deben reintroducirse los fármacos uno a uno, con intervalos de 2-3 días. Se comienza por la rifampicina (principal agente antituberculoso), después isoniacida y por último piracinamida. Si con alguno reaparece la erupción, se sustituye por etambutol y se alarga la duración del tratamiento (C I)3.
Los pacientes que reciben H, R o Z deben ser avisados para que consulten si aparecen síntomas sugestivos de hepatitis: náuseas, astenia, pérdida de apetito, fiebre inexplicada de más de 3 días, orina colúrica, ictericia, etc.2,9. En este caso, el tratamiento debería ser suspendido hasta que las cifras se normalicen o alcancen una estabilidad. Aunque la causa específica de la hepatitis no puede ser identificada por el patrón de las alteraciones analíticas, la rifampicina produce con más frecuencia un patrón de colestasis. En cambio, cuando se observa un patrón citolítico, cualquiera de los tres (H, R o Z) puede ser la causa (B III).
Si la cifra de transaminasas supera en cinco veces el valor basal sin síntomas o más de tres veces con síntomas, deben retirarse los 3 fármacos, porque todos son hepatotóxicos. Dado que la reintroducción de fármacos antituberculosos, una vez normalizadas la transaminasas, suele ser más tardío que con la erupción, el paciente debe tratarse mientras tanto con 3 fármacos no hepatotóxicos (p. ej., estreptomicina, etambutol y una quinolona) hasta poder reintroducir el tratamiento de primera línea. Cuando las transaminasas vuelven a cifras inferiores a dos veces los valores basales, se reintroduce primero rifampicina, después isoniacida y por último piracinamida (B III). Si con alguno reaparece la elevación de transaminasas, éste se sustituye por etambutol y se alarga la duración del tratamiento. Si la elevación ha sido sólo a expensas de las enzimas de colestasis, suele ser la rifampicina la implicada y es ésta la que hay que retirar9.
Fases del tratamiento estándar y duración del tratamiento
Todas las pautas actuales de tratamiento de la tuberculosis inicial no resistente constan de una fase inicial "intensiva" de 2 meses, diseñada para eliminar los bacilos de crecimiento activo y "semidormidos". Tiene como misión acortar el período de infectividad o contagio. El cultivo se "negativiza" en un 80-90% de los casos en los primeros 2 meses5,6,9,10,14-16. En la actualidad se recomienda la realización sistemática de test de sensibilidad a drogas de primera línea en las muestras basales positivas de todo paciente con tuberculosis, debiendo repetirse a los 3 meses si el cultivo continúa siendo positivo14.
Después se inicia una segunda fase, de mantenimiento o continuación que tiene como misión eliminar todos los bacilos intracelulares y evitar las recidivas16,17.
La duración total del tratamiento será de 6 meses. La fase inicial dura 2 meses y la de continuación 4 meses (A I). En caso de formas clínicas en las que los cultivos permanecen positivos más allá de los primeros 2 meses de terapia inicial (sobre todo formas cavitadas muy bacilíferas)18 y en situaciones especiales (infección por VIH con menos de 200 CD4 y/o ciertas formas extrapulmonares) la fase de continuación se alarga hasta los 7 meses, ya que con pautas más cortas la recidiva se eleva hasta el 20% (A II)9.
Hasta ahora no existen estudios definitivos que aconsejen pautas inferiores a 6 meses. En una revisión reciente de la biblioteca Cochrane de 7 ensayos de pautas menores de 6 meses (rango 2-5 meses) concluyen que los períodos más cortos (3 meses) son igual de efectivos pero que tendrían una tasa de recidiva mayores19. La OMS está llevando a cabo, también, un ensayo clínico en fase III en el que incorporan gatifloxacino a la pauta estándar, para demostrar si es posible reducir la duración total a 4 meses. No obstante, es pronto para cambiar las recomendaciones de la duración de la terapia estándar y se necesitan estudios comparativos de pautas con distintas duraciones de tratamiento16,19,168-172.
Regímenes terapéuticos recomendados
La administración de todos los fármacos ha de ser simultánea, en una sola toma, lo que aumenta la eficacia y el cumplimiento, y en ayunas, de media a una hora antes del desayuno. Parece ser que con la comida se produce un ligero retraso en la absorción de estos principios activos, pero tiene poca relevancia clínica, dado el amplio margen terapéutico de los mismos. Por ello, si el paciente tiene molestias epigástricas o náuseas con el tratamiento, es mejor administrar la dosis con comidas a que no lo tome o lo vomite2,20.
Pauta de la fase inicial (tabla 3)
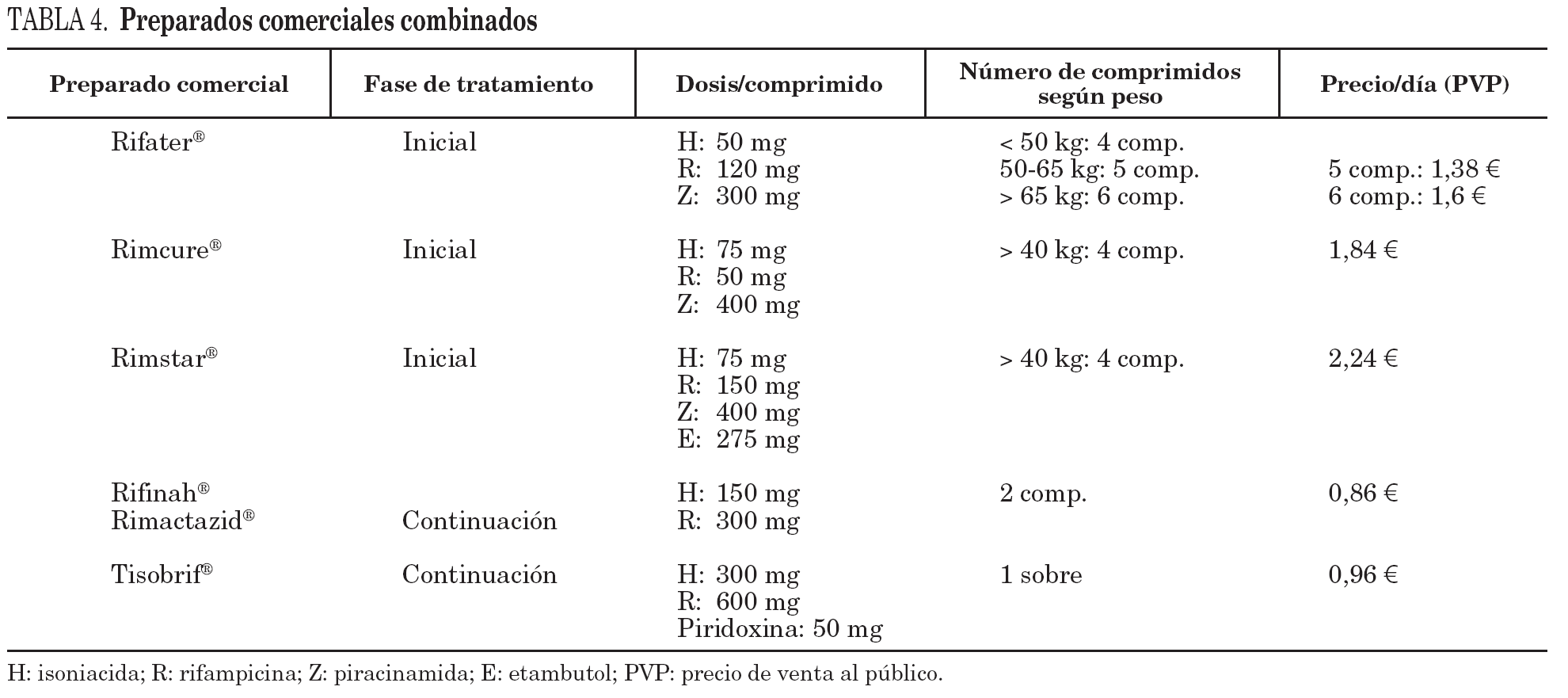
La pauta de la fase inicial consiste en la administración de isoniacida, rifampicina y piracinamida durante 2 meses. La administración durante la fase inicial es preferible que sea diaria, no en pauta intermitente16,21 (A I). La dosificación de los preparados comerciales a dosis fijas se resumen en la tabla 4.
Existen dos grandes documentos de consenso publicados en relación al tema del tratamiento de la tuberculosis. Uno es nacional, publicado en dos fases, en 1992 y 19995,6, pero todavía vigente y que recomienda iniciar el tratamiento con sólo 3 fármacos y otro más reciente (2003) que recoge el consenso de las 3 sociedades científicas norteamericanas más importantes en el terreno de las enfermedades infecciosas (American Thoracic Society [ATS], Centers for Disease Control and Prevention [CDC] e Infectious Diseases Society of America [IDSA])9. En esta guía indican iniciar con una pauta de 4 fármacos (H + R + P + E) dada la alta tasa de resistencia primaria a isoniacida existente en Estados Unidos, superior al 10% según datos de la OMS (A I)14,15. Una vez realizado el antibiograma, en caso de que los bacilos sean sensibles, se suspende el etambutol3.
Indicaciones para el uso del cuarto fármaco en la fase inicial en nuestro medio
En España no existe un estudio nacional sobre resistencias a fármacos antituberculosos, pero los resultados publicados en diferentes comunidades autónomas evidencian una baja tasa de resistencia primaria a la isoniacida23,24. Esto hace que en España no esté justificado el uso del etambutol como cuarto fármaco inicial de forma sistemática como recomiendan las guías americanas9,17. Sólo lo usaremos en inmigrantes procedentes de áreas con resistencia primaria a isoniacida alta (casi todos los países en vías de desarrollo) (B III) y, aunque no hay estudios concluyentes al respecto, también en pacientes con infección por el VIH (B III). En la mayoría de los casos este cuarto fármaco será el etambutol. Aunque diversos ensayos clínicos han demostrado eficacia equivalente entre estreptomicina y etambutol, el aumento de resistencia a la estreptomicina y la vía de administración no lo convierten en un buen candidato.
Pauta de la fase de continuación
Tras esta fase de inicio se puede continuar con isoniacida y rifampicina, administradas de forma diaria o intermitente (dos o tres veces por semana con supervisión u observación directa) durante 4 meses (A I) o 7 meses en las indicaciones anteriormente citadas (tabla 3). Existen preparados comerciales con los 2 fármacos asociados que mejoran el cumplimiento y disminuyen la posibilidad de monoterapia (tabla 4).
Formulaciones comerciales combinadas (asociaciones a dosis fijas)
Hasta el momento, sólo se disponía de Rifater® como asociación de H + R + Z, pero su dosificación hay que ajustarla al peso y no se alcanzan las cantidades exactas que recomienda la OMS20,25, lo que sí ocurre con las nuevas presentaciones (Rimstar® o Rimcure®) (tabla 4).
Si se usa etambutol en la fase inicial, con sólo 4 comprimidos diarios (Rimstar®) se consigue la dosis óptima del adulto, disminuyendo el tratamiento clásico en 4-5 comprimidos diarios.
Aunque no hay evidencia que indique que estas asociaciones sean superiores a las formulaciones monofármaco, las opiniones de expertos sugieren que éstas deben ser empleadas preferentemente5,6,25-27. Además, tanto la OMS como la International Union Against Tuberculosis and Lung Disease (IUATLD) promueven su utilización, ya que presentan varias ventajas (B III)4,10,25, ya que mejora el cumplimiento y simplifica el tratamiento, tanto por parte del prescriptor (menor posibilidad de errores de prescripción y dosificación) como del paciente, que tiene que ingerir menor número de comprimidos al día. Por esta razón, el uso de estas presentaciones combinadas son recomendadas también por los Comités de Evaluación de Nuevos Medicamentos de los Servicios de Salud de Andalucía, Cataluña y País Vasco20.
Tratamiento de la tuberculosis extrapulmonar
Aunque la localización pulmonar es la forma más frecuente de presentación de la tuberculosis, cualquier órgano o tejido puede verse afectado por la enfermedad. La tuberculosis extrapulmonar ocurre con mayor frecuencia en inmunodeprimidos y su incidencia se ha incrementado en los últimos años debido fundamentalmente a la infección por el VIH28, 62-64. Por tanto la recomendación de hacer determinación de VIH en todo paciente con tuberculosis11 (A III) es más necesaria si cabe en los pacientes con tuberculosis extrapulmonar.
Dada la excelente penetración tisular de los medicamentos antituberculosos y la relativa escasez de bacilos de Koch presentes en las localizaciones extrapulmonares, los principios básicos del tratamiento de la tuberculosis pulmonar les son aplicables3,29, aunque con algunas diferencias puntuales. En general, son escasos los ensayos clínicos controlados sobre el tratamiento de la tuberculosis extrapulmonar y por tanto, el grado de evidencia es menor. La pauta de 6 meses es la más recomendada para tratar la enfermedad producida por cepas sensibles. Las excepciones serían la tuberculosis del sistema nervioso central cuyo tratamiento debería durar 12 meses3,30 y la tuberculosis osteoarticular que debería tratarse durante 9 meses (tabla 5).
Tuberculosis miliar
La tuberculosis miliar es produce como consecuencia de la diseminación linfohematógena masiva de M. tuberculosis. La afectación multiorgánica es probablemente más frecuente de lo que se reconoce, ya que cuando se diagnostica tuberculosis en una localización generalmente no se investigan otras4.
No existen estudios controlados que evalúen la duración del tratamiento, aunque la ATS3 recomienda en adultos la pauta de 6 meses (B III).
Los estudios que analizan el empleo de corticoides en esta forma de tuberculosis son escasos y difícilmente valorables31, por tanto se acepta que no estarían indicados salvo en casos de insuficiencia respiratoria refractaria32 (B III).
Tuberculosis pleural
Mycobacterium tuberculosis puede producir derrame pleural por dos mecanismos distintos que requieren un abordaje terapéutico y tienen un pronóstico diferente: una reacción de hipersensibilidad cuando un escaso número de bacilos procedentes del pulmón alcanza el espacio pleural o, menos frecuentemente, un empiema4 si se produce un paso masivo de bacilos al espacio pleural por la rotura de una cavidad o una fístula broncopleural.
Se aconseja un régimen de 6 meses para el tratamiento de la tuberculosis pleural (A II). La fibrosis pleural residual es una complicación que puede aparecer en más de la mitad de los casos y en algunos muy evolucionados requerir intervención quirúrgica incluyendo decorticación33. El tratamiento del empiema pleural tuberculoso requiere drenaje (frecuentemente quirúrgico) asociado a tratamiento antituberculoso cuya duración óptima no ha sido establecida (B III).
Se han utilizado varias estrategias asociadas al tratamiento antituberculoso para acelerar la resolución del derrame y minimizar el riesgo de fibrosis pleural:
1.Varios estudios controlados han intentado determinar la utilidad de los corticoides asociados al tratamiento antituberculosos en el tratamiento de la tuberculosis pleural31. Los resultados son contradictorios en cuanto a su eficacia para mejorar los síntomas y resolver el derrame pleural, pero coinciden en que no reducen la frecuencia de complicaciones pleurales como la fibrosis34-36. Un estudio controlado, doble ciego, realizado sobre un total de 197 pacientes infectados por el VIH con pleuritis tuberculosa desaconseja el uso de corticoides por falta de eficacia e incrementar el riesgo de sarcoma de Kaposi37. En conclusión, no se disponen de datos suficientes para recomendar el uso sistemático de corticoides en el tratamiento de la tuberculosis pleural37,38 (C I).
2. La asociación de drenaje de la cavidad pleural mediante catéter y tratamiento antituberculoso eficaz no ha demostrado beneficio clínico adicional ni reduce la probabilidad de desarrollar una fibrosis pleural residual en casos de tuberculosis pleural no complicada39.
3. En un estudio controlado a doble ciego el empleo de urocinasa en derrames pleurales tuberculosos loculados se mostró potencialmente beneficioso para reducir el grado de fibrosis pleural residual33 (B I).
Tuberculosis ganglionar
El tratamiento recomendado para la tuberculosis ganglionar es la pauta estándar de 6 meses que se ha mostrado tan eficaz como otras de mayor duración40,41 (A I). El drenaje o la punción-aspiración pueden estar indicados en casos de adenopatías fluctuantes con riesgo de drenaje espontáneo. La extirpación quirúrgica sólo se realiza en casos excepcionales en los que existan dudas diagnósticas. En el curso del tratamiento es posible el incremento del tamaño de los ganglios linfáticos afectados, la aparición de fluctuación por acumulación de caseum e incluso el crecimiento de otros nuevos sin que ello signifique necesariamente fracaso terapéutico (expansión paradójica). Este hecho puede verse en cualquier paciente, pero es más frecuente en los pacientes infectados por el VIH que inician tratamiento antirretroviral como manifestación del síndrome de reactivación inmune. Aunque no hay estudios al respecto, los expertos opinan que este cuadro debe ser tratado con metilprednisolona en dosis de 1 mg/kg/día con dosis decreciente durante 1-2 semanas (B III).
Tuberculosis ósea y articular
En principio, el bacilo de Koch puede afectar a cualquier zona del esqueleto. Ordenadas por orden de frecuencia podemos distinguir las siguientes localizaciones:
1. Tuberculosis de la columna vertebral, tuberculosis espinal o mal de Pott (40% de los casos). Se comporta como una osteoartritis. En niños es típica la afectación de la columna torácica y en adultos la lumbar.
2. Artritis de las grandes articulaciones de soporte: caderas y rodillas42.
3. Osteomielitis, otras afectaciones articulares, bursitis, tendinitis y piomiositis tuberculosas.
El tratamiento de las localizaciones óseas y articulares no difiere significativamente del recomendado para otras formas de tuberculosis. Algunos ensayos clínicos han confirmado que son útiles las pautas cortas de 6 meses43-45 (A I). Sin embargo por motivos de penetración tisular y dificultad para controlar la respuesta microbiológica, buena parte de los expertos se inclinan por prolongar el tratamiento hasta los 9 meses9,46 (B III). En general, la terapia adyuvante con corticoides no está recomendada (D III), salvo en casos de respuesta paradójica con gran componente inflamatorio46.
La base del tratamiento de la mielopatía inicial con o sin afectación neurológica que aparece en la fase activa del mal de Pott continúa siendo la quimioterapia antituberculosa44-49. La cirugía estaría indicada en casos de:
1. Falta de respuesta al tratamiento antituberculoso adecuado.
2. Deterioro neurológico progresivo o recurrente de causa compresiva.
3. Estabilización de la columna y prevención del desarrollo de cifosis y paraplejías tardías9,50.
La inmovilización mediante corsés ortopédicos estaría indicada en casos de afectación cervical, compresión medular o inestabilidad de la columna hasta que se plantee la cirugía.
Pericarditis tuberculosa
La pericarditis es una localización poco frecuente de la tuberculosis pero con una mortalidad elevada (30-40%) a pesar de un diagnóstico y tratamiento adecuados. El tratamiento óptimo de la enfermedad no está bien establecido y el diagnóstico etiológico en zonas con baja incidencia puede ser laborioso. El tratamiento tendría un doble objetivo: inicialmente disminuir los síntomas y evitar la acumulación de líquido en la cavidad pericárdica disminuyendo el riesgo de taponamiento cardíaco y a más largo plazo evitar la constricción pericárdica. La pauta antituberculosa recomendada es la habitual de 6 meses (A II). Un estudio doble ciego, prospectivo, aleatorizado realizado en Sudáfrica51 demostró que el uso de corticoides disminuye el riesgo de muerte y la necesidad de pericardiocentesis repetidas para el control del derrame pericárdico52.
A la vista de estos resultados se recomienda el uso de esteroides asociados al tratamiento antituberculoso (A I), incluyendo pacientes con infección por el VIH53.
Respecto a las indicaciones de cirugía, la pericardiotomía subxifoidea es una técnica quirúrgica que evita la acumulación de líquido pericárdico y, por tanto, de pericardiocentesis de repetición y permite la toma de biopsia pericárdica. El uso sistemático de drenaje quirúrgico abierto en lugar de pericardiocentesis de repetición en las pericarditis exudativas no ha mostrado beneficios en cuanto a mortalidad ni evolución a pericarditis constrictiva51. La pericardiectomía estaría indicada cuando, a pesar de un tratamiento con quimioterapia antituberculosa y corticoides, la evolución es hacia una pericarditis constrictiva.
Tuberculosis genitourinaria
La tuberculosis genitourinaria es una forma relativamente poco común de tuberculosis que puede afectar a los riñones, uréteres, vejiga y órganos genitales. El tratamiento indicado es de 6 meses para todas la formas de tuberculosis genitourinaria54,55 (A II). El tratamiento adyuvante con corticoides es un tema de debate en la literatura urológica para evitar la uropatía obstructiva en caso de afectación ureteral, pero la evidencia científica es escasa54 (C III).
Aunque la quimioterapia antituberculosa es la base del tratamiento, ocasionalmente se requiere cirugía ablativa o reparadora. Las indicaciones serían: en caso de hidronefrosis e insuficiencia renal progresiva causada por obstrucción, el drenaje de la vía urinaria (mediante catéter o nefrostomía) debe de realizarse inmediatamente. La nefrectomía total o parcial está indicada en casos de riñones no funcionantes o escasamente funcionantes sobre todo si se acompaña de dolor intenso en flancos o hipertensión arterial. El drenaje de grandes abscesos tuboováricos54, la histerectomía en caso de metrorragia que no responde a otras terapias, el tratamiento de la infertilidad de causa obstructiva y la cirugía reparadora en casos de afectación grave de la vejiga serían otras indicaciones. La nefrectomía no está indicada en tuberculosis renal no complicada.
Tuberculosis meníngea
La tuberculosis del sistema nervioso central es la forma más grave de afectación tuberculosa. Puede producir graves secuelas neurológicas en la tercera parte de los supervivientes a pesar de un tratamiento adecuado56-58. La tuberculosis cerebral puede manifestarse de diversas formas: meningitis, tuberculoma, absceso cerebral, tuberculosis miliar, encefalopatía tuberculosa y vasculopatía tuberculosa. La mortalidad y las secuelas dependen directamente del estadio de la enfermedad y del momento del inicio del tratamiento.
El tratamiento de la afectación tuberculosa del sistema nervioso central debería iniciarse lo más pronto posible, aún sin confirmación microbiológica. La duración total del tratamiento será de 12 meses (B II) 59, si bien la duración óptima del tratamiento no ha sido determinado mediante estudios clínicos aleatorizados.
Se han realizado múltiples estudios controlados sobre el empleo de corticoides para mejorar la respuesta del tratamiento antituberculoso, la mayoría de ellos muestran beneficio en cuanto a reducción de la mortalidad y de las secuelas neurológicas31,60. Sin embargo es difícil extraer conclusiones definitivas debido a sus limitaciones metodológicas. La ATS y los CDC en junio del 2003 recomiendan el empleo de corticoides en todos los pacientes con meningitis tuberculosa, principalmente aquellos con disminución del nivel de consciencia9 (A I). Con posterioridad, ha sido publicado un estudio controlado, doble ciego realizado en Vietnam61 que incluye un total de 575 pacientes. Los autores concluyen que el empleo de corticoides disminuye la mortalidad en pacientes mayores de 14 años con meningitis tuberculosa independientemente del grado de severidad de la enfermedad, disminuye los efectos secundarios de la medicación, pero no disminuye la morbilidad.
Hasta en el 20% de los casos de meningitis tuberculosa pueden aparecer o crecer tuberculomas cerebrales durante las primeras semanas o meses en el contexto de un síndrome de respuesta paradójica sin que necesariamente signifique fallo terapéutico. La cirugía quedaría reservada para el tratamiento del empiema intracraneal tuberculoso, hidrocefalia y drenaje de abscesos.
Tratamiento de la tuberculosis resistente
La tuberculosis resistente a fármacos (TB-R) es un problema clínico y epidemiológico de amplia distribución mundial, elevada morbimortalidad, y supone una dificultad añadida para el control sanitario de la enfermedad65.
La existencia de cepas de M. tuberculosis con resistencia a fármacos es un fenómeno natural que está presente en toda población bacilar, pero un tratamiento adecuado impide su desarrollo, de ahí que se considere que la TB-R es consecuencia de un mal tratamiento de la enfermedad y por tanto hay una cierta responsabilidad del sistema sanitario en el que se presente66,67. La tuberculosis resistente a múltiples fármacos o multirresistente (TB-MR) se refiere a la enfermedad producida por cepas resistentes a dos o más fármacos de primera línea, habitualmente isoniacida y rifampicina.
La resistencia puede ser primaria si el paciente no ha recibido tratamiento antituberculoso previo, y secundaria o adquirida cuando ya se ha realizado éste o se está recibiendo en el momento de detectarse la resistencia72,73,84-86,180.
En las últimas décadas, coincidiendo con la aparición de la epidemia de VIH/SIDA en el mundo, se asistió a un aumento en el número de casos declarados de tuberculosis en países donde se había apreciado una disminución progresiva de las tasas de la enfermedad, y se comunicaron brotes producidos por cepas altamente resistentes en instituciones cerradas como hospitales, prisiones y residencias, afectando tanto a pacientes como al personal sanitario, con mayor frecuencia entre enfermos de VIH/SIDA y con una evolución fatal en un elevado porcentaje de casos68-71.
Bases del tratamiento de la tuberculosis resistente
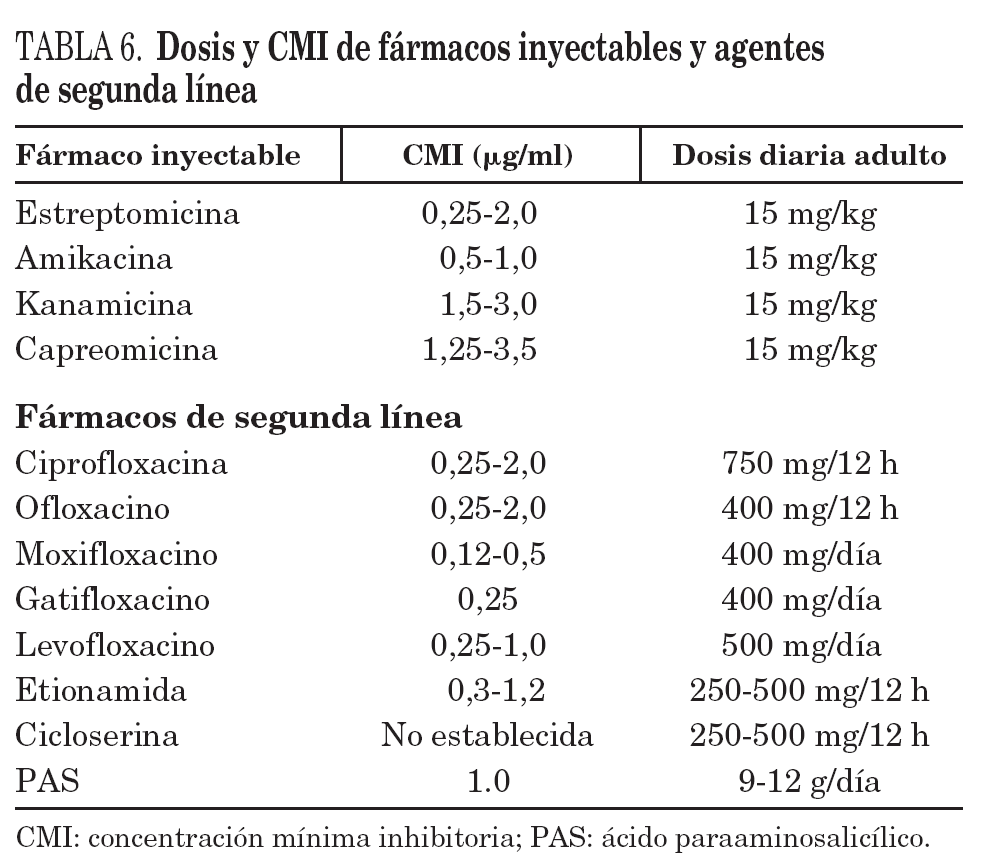
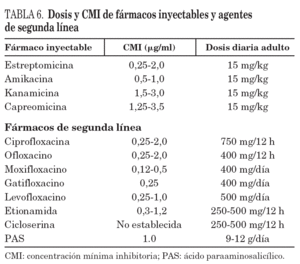
El tratamiento empírico inicial de la tuberculosis en áreas de alta prevalencia de TB-MR requiere el tratamiento estándar y añadir 2 fármacos o más que aseguren recibir al menos 4 fármacos a los que haya sensibilidad, lo cual requiere un régimen de 6 fármacos, hasta disponer de los estudios microbiológicos67. Nunca se debe utilizar un régimen de administración intermitente cuando se trata una tuberculosis por cepas resistentes salvo para los agentes inyectables tras un período inicial de 2-3 meses de administración diaria9,81-84. En la tabla 6 se muestra la dosificación de los principales fármacos de segunda línea usados en el tratamiento de la TB-R.
No hay ensayos controlados que estudien las distintas opciones del tratamiento de la TB-MR y las pautas se basan en una combinación de recomendaciones generales, extrapolaciones y opiniones de expertos (B III). La duración del tratamiento se recomienda que sea más prolongada en pacientes con infección por el VIH. Es conveniente que los tratamientos se inicien en el hospital, y si es preciso con aislamiento prolongado en hospitales especializados, y continuar en un régimen de tratamiento supervisado por personal muy experto en los mismos, que esté familiarizado con los efectos adversos de los mismos67,80,88,89. El tratamiento directamente observado (TDO) ha significado una mejora en los resultados al disminuir el número de fracasos terapéuticos.
Pautas de tratamiento en pacientes con tuberculosis resistente
En la tabla 7 se muestran algunas de las recomendaciones de tratamiento en caso de resistencia y multirresistencia. Los resultados del tratamiento de la TB-MR se han evaluado en algunos estudios de revisión y se ha comprobado que entre pacientes sin infección VIH/sida se puede conseguir entre un 83-96% de respuesta clínica, aunque el número de los que tienen que interrumpirlo por efectos adversos es elevado (17-73%) y muchos no lo completan74-76,79.
Se asocian a malos resultados terapéuticos un hematócrito bajo y un bajo índice de masa corporal75-78. También los pacientes de más edad, el haber utilizado un mayor número de fármacos previamente, la resistencia a ofloxacino y una baja frecuencia de uso del mismo, se han asociado a peores resultados74. La inclusión de piracinamida y etambutol en un régimen cuando el aislado es sensible, mejora el porcentaje de curaciones76. El uso de quinolonas puede ser un factor predictivo de respuesta favorable que conlleva mejor superviviencia78.
La mortalidad oscila entre el 4-22% en series de pacientes74-79 siendo más elevadas en los brotes descritos en pacientes con infección VIH/sida68-71,87 que alcanzaban más del 80% de los casos.
Papel de la cirugía en el tratamiento de la tuberculosis resistente
No existen estudios aleatorizados que analicen el papel de la cirugía en el tratamiento de la tuberculosis multirresistente y afectación pulmonar extensa, pero hay publicaciones que apuntan en el sentido de contribuir a la curación de la enfermedad, al reducir la carga de bacilos tras la resección de lesiones pulmonares78. La cirugía podría estar indicada, por tanto, en casos de TB-MR con enfermedad localizada, cuando a pesar de un tratamiento adecuado se mantienen positivos los cultivos más de 3 meses o cuando hay resistencia a todos los fármacos de primera línea, circunstancias que se asocian a un peor pronóstico.
Se precisa una reserva de capacidad respiratoria suficiente. Debe de ser realizado por equipos con experiencia y tras un tratamiento médico durante 1-3 meses antes del procedimiento (B III).
Tratamiento de la tuberculosis en pacientes infectados por el VIH
La coinfección por el VIH incrementa significativamente el riesgo de desarrollo de la tuberculosis90-92. De este modo en áreas con alta prevalencia de infección por el VIH se ha comprobado un gran incremento del número de casos de tuberculosis. La relación es tan estrecha que se aconseja evaluar la posibilidad de infección por el VIH en todo paciente con tuberculosis 15.
El tratamiento antirretroviral (TAR) ha modificado de forma sustancial el pronóstico, porque ha disminuido de forma notable la incidencia de infecciones oportunistas y la mortalidad por sida93,94. Sin embargo la incidencia de tuberculosis en España continúa siendo elevada debido a que con frecuencia los pacientes infectados por el VIH presentan otros factores de riesgo para su desarrollo como son el consumo de drogas, la marginalidad social y la estancia en prisiones.
¿Cómo tratar la tuberculosis en pacientes infectados por el VIH?
En la actualidad se dispone del nivel de evidencia suficiente para poder afirmar que la pauta estándar de tratamiento de la tuberculosis en pacientes infectados por el VIH tiene la misma eficacia que en pacientes no infectados98-104. Por tanto la recomendaciones en cuanto a regímenes de tratamiento de la tuberculosis son las mismas que en la población general.
Rifabutina es una rifamicina con concentración mínima inhibitoria (CMI) frente a M. tuberculosis inferior y vida media plasmática superior a la rifampicina. Diversos estudios han demostrado que su eficacia en el tratamiento de la tuberculosis es equivalente95-97. Sin embargo no se disponen en la actualidad de asociaciones galénicas de fármacos antituberculosos que incluyan rifabutina, por lo que, al aumentar el número de fármacos y comprimidos, puede disminuir la adherencia al mismo y posibilita la realización de monoterapias y con ello el desarrollo de mutantes resistentes. Por todas estas razones consideramos que regímenes basados en rifampicina deben ser considerados preferenciales en el tratamiento de la tuberculosis y que regímenes basados en rifabutina deben ser considerados como alternativos.
En pacientes en los que el uso de rifamicinas se encuentre contraindicado por alguna razón (resistencias, toxicidad, decisión médico/paciente de no poner en riesgo un TAR eficaz, etc.), se recomienda la asociación de isoniacida, piracinamida y etambutol, con o sin estreptomicina. Estos regímenes se asocian a altas tasas de recidivas por lo que en estos casos la duración del tratamiento deberá ser de al menos 12-18 meses.
¿Cuánto debe durar el tratamiento de la tuberculosis en pacientes infectados por el VIH?
No disponemos de ensayos clínicos comparativos que permitan precisar cuál es la duración óptima del tratamiento de la tuberculosis en pacientes infectados por el VIH. Los datos disponibles derivan de estudios no diseñados para precisar esta cuestión y ofrecen resultados a veces discrepantes. De este modo las recomendaciones realizadas por organismos oficiales no son homogéneas. Así, mientras las guías de práctica clínica anglosajonas recomiendan que en pacientes infectados por el VIH la duración no debe diferir de la recomendada para pacientes no infectados, es decir 6 meses9,105, las guías realizadas en nuestro país recomiendan que la duración debe ser 9 meses106, recomendación compartida también por algunos expertos103,107.
En pacientes con tuberculosis la respuesta inicial al tratamiento y el tiempo de negativización de los cultivos de esputo parecen ser equiparable para pacientes infectados y no infectados por el VIH98,101,108. Sin embargo los datos relativos a las tasas de recidivas (recurrencia de la tuberculosis después de completar con éxito un tratamiento adecuado) tras un tratamiento anti-TB de 6 meses no son homogéneos. En un estudio realizado en Zaire en el que 307 pacientes con tuberculosis fueron tratados con una pauta de 6 meses de tratamiento, la tasa de recidiva tras un período de seguimiento de 12 meses fue del 9% entre pacientes infectados por el VIH y 5,3% entre los no infectados109. Otros estudios observacionales también han comprobaron que la tasa de recidivas de la tuberculosis en pacientes infectados por VIH era mayor en pacientes que recibieron 6 meses de tratamiento que en los que recibieron 9 meses110,112,113,115.
Por el contrario en un estudio similar realizado en Costa de Marfil en el que 300 pacientes con tuberculosis fueron tratados con una pauta de 6 meses de tratamiento, la tasa de recidiva tras un seguimiento de 18 meses fue la misma (3%) entre pacientes infectados y no infectados por el VIH111.
En nuestra opinión, en ausencia de un estudio aleatorizado que compare la eficacia de regímenes de 6 y 9 meses de duración, no es posible realizar recomendaciones firmes en cuanto a la duración del tratamiento de la tuberculosis en pacientes infectados por el VIH, y en tanto no dispongamos de datos más concluyentes, creemos que se debe adoptar una actitud más conservadora e incrementar el tiempo de tratamiento a 9 meses en todo paciente infectado por el VIH con situación de inmunocompromiso, especialmente en aquellos que presenten cifras de linfocitos CD4+ < 200 céls./ml.
Tuberculosis e inmigración
La tuberculosis ha sido a lo largo de la historia una enfermedad ligada a la emigración y a la pobreza. En la actualidad esta enfermedad tiene mayores tasas de incidencia y prevalencia en países de renta baja, mientras que en los países de renta elevada la incidencia en la población autóctona disminuye progresivamente182. En estos países se observan dos ondas epidémicas; una descendente en la población autóctona y otra ascendente en la población inmigrante116-118. En España, desde la entrada del nuevo siglo, este hecho está adquiriendo una relevancia significativa, especialmente en poblaciones y zonas geográficas con una alta tasa de inmigración como Madrid, Barcelona o el Poniente Almeriense donde la tuberculosis en la población inmigrante se acerca o supera el 50% de los casos diagnosticados en los últimos años119-122.
Las características diferenciales más relevantes de la tuberculosis en la población inmigrante respecto a pacientes autóctonos son las siguientes:
1.La mayoría de los casos ocurren en los primeros 5 años desde la llegada al país de acogida, especialmente en los primeros 2 años112-127.
2.Aunque la mayoría de los casos se deben a reactivación endógena, la reinfección exógena puede ser responsable de hasta el 20% de los casos en algunas poblaciones, según estudios recientes de epidemiología molecular128-130.
3.La enfermedad predomina en varones jóvenes (ligado al fenómeno migratorio)126,131.
4.La localización pulmonar es la más frecuente, aunque las formas extrapulmonares son más frecuentes que en la población autóctona126,132.
5.La coinfección TB-VIH es menos frecuente, excepto en poblaciones procedentes del África Subsahariana122,123.
6.La tasa de resistencias a un solo fármaco y multirresistencias es mayor, en relación con la mayor tasa de resistencia en los países de origen126,133,134.
7.El cumplimiento del tratamiento de la tuberculosis activa y de la infección tuberculosa latente es menor en relación con barreras idiomáticas o culturales, la diferente percepción de enfermedad, la movilidad geográfica y la irregularidad legal126,135-139.
Aunque no existe un programa de cribado de tuberculosis en inmigrantes en España, se debe aprovechar su primer contacto con el sistema sanitario para ofertar un programa de control de la tuberculosis119,136,139 (B III). La técnica diagnóstica más útil es la radiografía de tórax que permite la identificación de lesiones sugestivas de actividad y de imágenes residuales, complementada con la baciloscopia y cultivo de esputo119,137-140 (B III).
Tratamiento de la tuberculosis en inmigrantes
Desde el punto de vista terapéutico los principios en los que se basa el tratamiento de la tuberculosis son los mismos en la población autóctona que en la inmigrante119,136-139,144-154. Sin embargo se pueden hacer algunas recomendaciones especiales:
1.Antes de iniciar un tratamiento empírico se debe insistir especialmente en los antecedentes epidemiológicos del paciente (caso inicial o tratamiento previo) y conocer el patrón y tasa de resistencias de su país de origen119,133,138 (B III). Se debe realizar un antibiograma en todos los casos119,137-139 (A II).
2.El tratamiento empírico en la fase inicial se debe hacer con 4 fármacos (A I), (habitualmente H + R + Z + E)119,137-139. Se debe garantizar el tratamiento de la tuberculosis a todos los pacientes119 (B III). Se recomienda la supervisión de su cumplimiento, con una estrategia individualizada de tratamiento119,137,182 (A II). Se recomienda usar TDO sobre todo en los colectivos con mayor riesgo de incumplimiento terapéutico, tales como pacientes que vivan con hacinamiento o en residencias, indigentes, retratamientos o abuso de drogas/alcohol119,141-143 (B III).
Tratamiento de la tuberculosis en otras situaciones especiales
Embarazo y lactancia
Debido a la posibilidad de transmisión al feto, el tratamiento de la madre debe realizarse precozmente. El régimen utilizado es el que combina una pauta de isoniacida con rifampicina durante 9 meses, complementado con etambutol los primeros 2 meses. Esta es la pauta recomendada por la ATS/CDC155. No existen datos sobre teratogenicidad con piracinamida y probablemente este fármaco también pueda utilizarse con seguridad y así lo avalan organizaciones como la OMS156. Estreptomicina es el único fármaco de primera línea desaconsejado durante el embarazo debido a la posibilidad de sordera congénita157. El tratamiento con quinolonas se ha asociado a malformaciones óseas cuando se utilizaron durante el primer trimestre de la gestación, por lo que deben evitarse si es posible157-159.
No es necesario la retirada de la lactancia materna cuando el tratamiento se realiza con fármacos de primera línea ya que las concentraciones en la leche materna son muy bajas y no producen toxicidad. Se recomienda suplemento de 25-50 mg de piridoxina junto al tratamiento con isoniacida, durante todo el tratamiento.
Hepatopatía crónica
De los fármacos de primera línea, isoniacida, rifampicina y piracinamida, pueden originar hepatotoxicidad y por tanto, pueden descompensar pacientes con hepatopatía crónica previa. Sin embargo, dada la efectividad de estos 3 fármacos, deben usarse siempre que sea posible. Se aconseja controles analíticos semanales las primeras 2 semanas y posteriormente cada 2 semanas durante los primeros 2 meses160-164.
En caso de enfermedad hepática grave e inestable puede ser necesario un régimen sin fármacos hepatotóxicos, entre los que se incluirían etambutol, estreptomicina, una quinolona y/u otro fármaco de segunda línea. No existen datos que orienten en la elección de fármacos, duración ni efectividad. La duración debiera ser entre 12 y 18 meses dependiendo de la extensión de la enfermedad y la respuesta155 (B III).
Trasplante de órgano sólido
El problema fundamental deriva de las interacciones de rifampicina, debido a su acción inductora enzimática, con fármacos inmunosupresores como ciclosporina y tacrolimus. Se han notificado hasta un 25% de rechazo en pacientes que usaron rifampicina y estos inmunosupresores, por lo que hay expertos que no recomiendan su uso. Estudios observacionales no aleatorizados han puesto de manifiesto resultados similares de pautas con y sin rifampicina. En cualquier caso, si se decide usar una pauta con rifampicina, tendría que incrementarse la dosis de ciclosporina y tacrolimus entre tres y cinco veces y realizarse controles de niveles frecuentes hasta conseguir la estabilidad de los mismos165,166. Es preferible, por tanto, la pauta sin rifampicina, que combinaría isoniacida, etambutol y piracinamida en la fase inicial del tratamiento. La rifabutina es una alternativa a la rifampicina en estos pacientes porque su interacción con los fármacos anticalcineurínicos es menor y permite la coadministración con más seguridad, aunque no existen estudios clínicos aleatorizados.
La duración total será de 18 meses, si se usa una pauta de continuación con isoniacida y etambutol. La duración podrá reducirse a un año si se añade un tercer fármaco que podría ser una quinolona o piracinamida167.
Tratamiento de la tuberculosis en situaciones de abandono de la terapia, recidiva o fracaso. Cumplimiento del tratamiento
Tratamiento tras el abandono
Las interrupciones del tratamiento de la tuberculosis son frecuentes y por tanto no es raro plantearse qué tratamiento ofrecer a un paciente después de una interrupción del mismo. No hay ensayos o estudios que contesten cuál es la mejor práctica en este escenario tan heterogéneo, por lo que las recomendaciones suelen tener un nivel de evidencia B III84,173,174.
Los factores que más influyen en la decisión sobre si continuar o iniciar un nuevo ciclo de tratamiento serán si el paciente está en la fase inicial o de continuación, la duración de la interrupción del tratamiento y el estado bacteriológico antes y después de la interrupción173.
Si la interrupción ha ocurrido en la fase inicial del tratamiento y ha durado más de 2 semanas, se debe comenzar de nuevo el tratamiento; si la interrupción es menor de 2 semanas, el régimen puede continuar, manteniendo el número de dosis totales programadas173 (B III). Si la interrupción ha ocurrido en la fase de continuación, y el paciente ha recibido al menos el 80% de las dosis programadas, se puede continuar el tratamiento hasta completar el total de las dosis previstas173 (B III). Si el paciente no ha recibido el 80% de las dosis programadas o la interrupción es mayor de 3 meses, el tratamiento debe reintroducirse desde el principio, con 4 fármacos, hasta recibir los resultados de la sensibilidad173 (B III).
En todos los casos se deben repetir cultivos y antibiograma (B III). Si los cultivos son positivos, el régimen de tratamiento debe comenzar desde el principio con 4 fármacos, hasta conocer la sensibilidad. En todos los casos de abandono, el tratamiento se debe reintroducir como TDO (B III).
Tratamiento en la recidiva
Hablamos de recidiva cuando un paciente que había conseguido tener y mantener cultivos negativos, tras la finalización del tratamiento, vuelve a tener bacilos ácido-alcohol resistentes (BAAR) o cultivos positivos, o empeora clínica/radiológicamente por un cuadro sugestivo de tuberculosis activa175.
El esfuerzo para confirmar el diagnóstico microbiológico de la recidiva y conseguir muestras para determinar la sensibilidad de la cepa debe ser máximo84,173.
Las recidivas, que ocurren en la mayoría de los casos entre los 6-12 meses posteriores a la finalización del tratamiento, se deben en la mayoría de los casos a reactivación de la infección original que no consiguió esterilizar el tratamiento prescrito173,176. En raras ocasiones, especialmente si han transcurrido años tras la finalización del tratamiento, podría tratarse de una reinfección177.
Los factores que se asocian a un mayor riesgo de recidiva son: la presencia de cultivos positivos después de 2 meses de tratamiento correcto y el uso de tratamientos autoadministrados o sin rifampicina173. En el primer caso la mayoría de las recidivas muestran el mismo patrón de sensibilidad que la cepa inicial84,178. En el segundo, el riesgo de una recidiva con resistencia adquirida es alto173.
La selección del tratamiento empírico debe basarse en la historia de tratamientos previos y en la gravedad de la enfermedad84,173,174. Las siguientes recomendaciones tienen un nivel de evidencia B III ante la ausencia de ensayos o estudios dirigidos acerca de esta cuestión.
Para los pacientes que no recibieron TDO o que tuvieron un cumplimiento irregular es prudente inferir un riesgo elevado de resistencia adquirida y comenzar con un régimen que emplee H + R + Z junto con 2-3 fármacos adicionales, que podrían incluir etambutol, una fluorquinolona y un agente inyectable como estreptomicina (si no se usó en el régimen inicial) o amikacina (B III)173-176.
Si la recidiva ocurre en un paciente en el que existe seguridad de que recibió un tratamiento correcto (supervisado con observación directa) puede ser apropiado iniciar el tratamiento con 4 fármacos, al menos hasta disponer de las pruebas de sensibilidad173,174,178 (A II).
Tratamiento tras el fracaso
Se define como fracaso la persistencia de cultivos positivos continuos o recurrentes tras 4 meses de tratamiento apropiado o a la reaparición de dos nuevos cultivos positivos consecutivos, tras una conversión temporal174,178. En ambos casos se debe asumir que el paciente puede tener una infección por una bacteria resistente y debe ser tratado empíricamente con varios fármacos que no haya recibido previamente84,173. Nunca se debe añadir un solo fármaco a un régimen de tratamiento que está fracasando84,173 (A II). La elección del tratamiento tras el fracaso es complejo y se recomienda el consejo de un experto 84,173 (B III).
La causa más probable del fracaso es el cumplimiento inapropiado del tratamiento173,174. Con menor frecuencia, el paciente podría tener una cepa con resistencias primarias, un síndrome de malaabsorción, tratarse de un error de laboratorio o simplemente no responder a un tratamiento que se presupone efectivo84,173. En pacientes coinfectados por el VIH que empeoran clínicamente (adenopatías, fiebre) o radiológicamente (lesiones más graves, derrame pleural) se debe descartar un síndrome de reconstitución inmune, especialmente si han comenzado el TAR de gran actividad84,173.
Se deben obtener siempre muestras para cultivo y antibiograma que incluya fármacos antituberculosos de primera y segunda línea (B III). Si el régimen inicial incluyó H + R + Z ± E se puede añadir un agente inyectable como la estreptomicina y una fluorquinolona. Si la cepa era resistente se aconseja añadir uno o más fármacos orales de segunda línea como cicloserina, protionamida, PAS (ácido paraaminosalicílico) o claritromicina84,173,178,180 (B III). El tratamiento se ajustará posteriormente en función de los resultados del antibiograma.
Cumplimiento del tratamiento
El tratamiento de la tuberculosis va más allá de la prescripción de un tratamiento correcto. El cumplimiento adecuado del mismo es la piedra angular del control de la enfermedad181,182.
Los pacientes no cumplidores mantienen su capacidad infectiva más tiempo, tardan más en completar el tratamiento, tienen más recaídas, fracasos, resistencias y consumen más recursos183.
El cumplimiento de un programa de tratamiento de la tuberculosis requiere una asistencia sanitaria accesible y apropiada184. Los pacientes necesitan ser diagnosticados correctamente, recibir información apropiada sobre su enfermedad y tratamiento y que se les provean los fármacos necesarios4,184. Los sistemas de salud son los responsables de la organización y supervisión del tratamiento de la tuberculosis4,184,185 (B III). Los mejores resultados se consiguen con un abordaje multifactorial centrado en el paciente quién participa activamente junto a un equipo de profesionales sanitarios (médicos, enfermeros), sociales y comunitarios (mediadores), entre otros, en el diseño y monitorización del tratamiento186,188 (A II). Es aconsejable la asignación de un responsable que coordine las actuaciones, facilite un acuerdo entre el paciente y el equipo y refuerce la contribución mutua para conseguir la curación del paciente188,189 (B III).
Se deben explorar así mismo la presencia de determinadas situaciones asociadas a mayor riesgo de incumplimiento o de fracaso, tales como: personas sin hogar o que viven solas sin apoyo, enfermedades psiquiátricas o mentales, adicción a drogas o alcohol, historia previa de tuberculosis o de mal cumplimiento del tratamiento, negación del diagnóstico o coinfección con el VIH183,192. Determinadas variables demográficas como la etnia, el sexo o el género no se deben utilizar como predictivas del cumplimiento192.
En todo caso, la capacidad de predicción de un cumplimiento adecuado por el personal sanitario que atiende a un paciente es bastante limitado, por lo que se debe monitorizar sistemáticamente en todos los pacientes192. Para mejorar el cumplimiento se han probado y desarrollado una variedad de intervenciones que tienen como finalidad superar las barreras que condicionan el incumplimiento e influir en el comportamiento del personal sanitario, en la organización del servicio o en el comportamiento de la persona con tuberculosis. Entre estas intervenciones destaca el TDO como la más eficaz.
El TDO consiste en la administración directa por personal entrenado del tratamiento antituberculoso y la observación de la ingestión del mismo193. El TDO es la estrategia de tratamiento recomendada por la OMS y por las guías americanas desarrolladas por la ATS, los CDC y la IDSA para todos los pacientes con tuberculosis (A II) 3,4,11. Esta recomendación se basa en los resultados de múltiples estudios observacionales que han demostrado que la implantación de programas de TDO en diversos escenarios geográficos y socioeconómicos, se sigue de aumentos significativos del número de pacientes que finalizan el tratamiento y se curan3,4,190-199.
En la actualidad, no hay razones de peso para aconsejar el uso rutinario de TDO hasta que se demuestren mejor las situaciones en que pueda ser beneficioso187,201-215, pero la mayoría de las guías y expertos coinciden en recomendar el TDO a aquellos pacientes que presenten especial riesgo de contagiosidad o de incumplimiento del tratamiento tales como: toxicómanos, alcohólicos, presos, indigentes, con antecedentes de abandono, recidiva o fracaso terapéutico, con enfermedades psiquiátricas o mentales, sin apoyo social, con multirresistencia o con regímenes de tratamiento intermitente114,115,189,192,196,200,201 (B III).
Correspondencia: Dr. A. Domínguez-Castellano.
Unidad de Gestión de Enfermedades Infecciosas. Hospital Virgen Macarena.
Avda. Dr. Fedriani, 3. 41009 Sevilla. España.
Correo electrónico: adomin@saludalia.com
Manuscrito recibido el 19-7-2006; aceptado el 6-9-2006.