Introducción
Con los términos ehrlichiosis y anaplasmosis denominamos a un grupo de infecciones bacterianas transmitidas por garrapatas duras (Ixodidae), que afectan al ser humano y a los animales. Son de distribución universal, y están provocadas por diferentes especies de los géneros Anaplasma y Ehrlichia (familia Anaplasmataceae). Taxonómicamente pertenecen al orden rickettsiales (α1 proteobacteria), y se caracterizan por ser gramnegativas, pleomórficas y de crecimiento intracelular obligado. Una característica que las diferencia de las rickettsias es que se replican en unas vacuolas derivadas de la membrana celular de las células que infectan, principalmente leucocitos y plaquetas. Ehrlichia sp. y Anaplasma sp. no crecen en los medios de cultivo habituales, y precisan para su crecimiento líneas celulares (células promielocíticas HL-60 y precursores mielomonocíticos). No se tiñen con la tinción de Gram, aunque se pueden poner de manifiesto en las células que infectan, en una especie de agregados citoplasmáticos denominados "mórulas", mediante las tinciones de Wright y Giemsa 1.
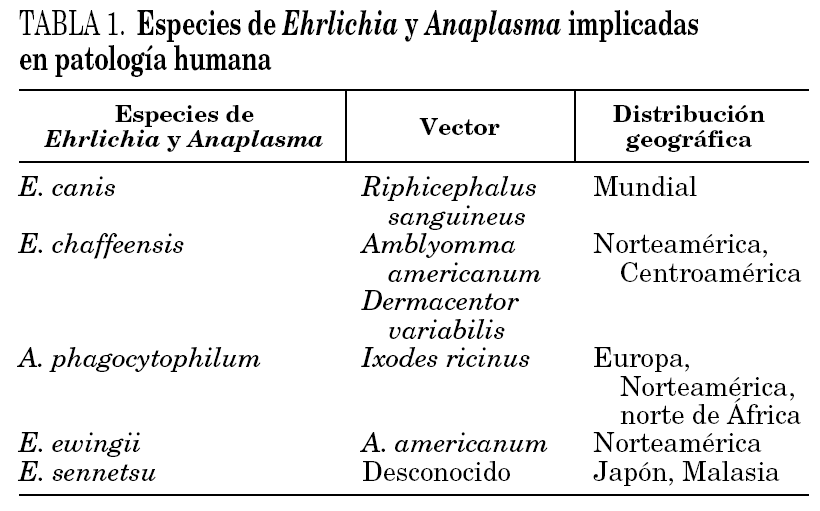
La primera descripción de una ehrlichiosis humana data de 1953. En Japón se describió el primer aislado de E. sennetsu en un paciente con un cuadro clínico similar a la mononucleosis infecciosa. Desde entonces se han relacionado en patología humana nuevas especies de Ehrlichia y Anaplasma y en la actualidad se considera que las ehrlichiosis (y anaplasmosis) son un problema emergente. En la tabla 1 se muestran las diferentes especies de Ehrlichia y Anaplasma relacionadas en patología humana.
Epidemiología
En el área occidental son tres las especies de ehrlichias que tienen importancia por su incidencia y potencial gravedad: E. chaffeensis, agente productor de la ehrlichiosis humana monocítica (EHM); A. phagocytophilum (denominación actual que engloba a los antiguamente denominados: agente de la ehrlichiosis humana granulocítica, E. phagocytophila y E. equi) productora de la anaplasmosis humana granulocítica (AHG) (denominada antigua ehrlichiosis humana granulocítica) y E. ewingii responsable de un cuadro similar a la AHG en inmunodeprimidos 1. Hasta la fecha no existen datos convincentes de la presencia en Europa de otras ehrlichiosis humanas diferentes a la AHG 2, si bien la reciente descripción de una nueva especie de Ehrlichia, denominada provisionalmente E. walkerii, en Ixodes ricinus tomados de la superficie corporal de pacientes picados por esta garrapata podría justificar algunos casos dudosos de EHM diagnosticados en Europa 3.
La EHM fue descrita en 1987 en Estados Unidos. Aunque en un principio se implicó a E. canis (agente productor de la ehrlichiosis monocítica canina) como la bacteria responsable (reacción serológica cruzada), en la actualidad sabemos que el agente causal es E. chaffeensis, denominada así por aislarse en Fort Chaffee (Arkansas) 4. Desde entonces se han comunicado miles de casos de EHM en Estados Unidos. En ese mismo país, en 1994, se describió por primera vez la AHG provocada por A. phagocytophilum5 y en 1999 se descubrió que E. ewingii, un patógeno reconocido como agente causal de ehrlichiosis granulocítica en perros, podía también causar infección en seres humanos con inmunodepresión 6. Tras estos hallazgos se han descrito en Estados Unidos más de 1.000 casos de AHG, lo que contrasta con los 65 casos descritos en Europa (incluida España) desde su primera descripción en Eslovenia en 1997 2,7-9.
En el momento de escribir esta revisión sólo se puede afirmar que E. canis es el causante de la ehrlichiosis canina. No obstante, esta ehrlichia, ampliamente distribuida por todo el mundo, y vehiculada por la garrapata marrón del perro, Riphicephalus sanguineus, se ha descrito como patógeno humano en Venezuela 10.
A pesar de que las dianas de E. chaffeensis y A. phagocytophilum son diferentes (monocitos y granulocitos, respectivamente) presentan un cuadro clínico superponible, por lo que en esta revisión se tratarán ambas entidades en conjunto, señalando las diferencias cuando estas existan. Además, al no existir datos sobre la presencia en Europa de otras ehrlichiosis humanas diferentes a AHG nos centraremos en la descripción de AHG en Europa.
Las ehrlichias y anaplasmas se mantienen en la naturaleza en un ciclo biológico similar al de la borreliosis de Lyme (garrapata-mamífero-garrapata), y los hombres son infectados ocasionalmente por la picadura de diferentes especies de garrapatas duras 2.
En Europa la principal garrapata implicada en la transmisión de A. phagocytophila es I. ricinus. La AHG y la borreliosis de Lyme guardan un estrecho paralelismo, ya que comparten vector, reservorio y como tal, ambiente epidemiológico. Los pequeños mamíferos, en especial Apodemus silvaticus, A. flavicolis, Xores areneus y especialmente Clethrinomys glareolus se han implicado como reservorio de A. phagocytophilum. Esta también se ha detectado en grandes mamíferos como cabras, ovejas, caballos, vacas, jabalís y perros. Al igual que sucede en la borreliosis de Lyme, las aves pueden desempeñar un papel importante en la diseminación de la enfermedad 2,8. En lo que respecta a la EHM, los ciervos son reservorios de E. chaffeensis; el vector más asociado es Amblyomma americanum y, en menor medida, Dermacentor variabilis.
El contacto con sangre de animales infectados, el empleo de hemoderivados (transfusiones) y la transmisión perinatal son vías excepcionales de adquisición de la enfermedad. La mayor incidencia de estas infecciones se produce en los meses en los que las diferentes especies de garrapatas implicadas en la transmisión de estas bacterias están más activas (primavera-verano y principio de otoño) 2.
En Europa se han realizado diferentes estudios de prevalencia de la infección por A. phagocytophilum en seres humanos y garrapatas 2,9,11 y en ellos destaca la elevada prevalencia que se encuentra en la garrapata vector (hasta el 45%), y los pocos casos en seres humanos que se diagnostican. A este respecto se ha apuntado que es posible que algunas variedades de A. phagocytophilum, como la variante AP-1 descrita inicialmente en Estados Unidos, y que también se ha detectado aquí en España, en I. ricinus de La Rioja, no sean patógenas 12.
Patogenia
No se conoce con exactitud la fisiopatología de las ehrlichiosis y anaplasmosis. Al igual que en otras enfermedades transmitidas por garrapatas, las ehrlichias llegan a la sangre tras la picadura de una garrapata. Desde allí infectan a los leucocitos circulantes y a las células del sistema reticuloendotelial 13. Estos microorganismos penetran en el interior de las células por fagocitosis. Una vez en el interior es posible que inhiban la fusión fagosoma-lisosoma y retrasen la apoptosis celular, facilitando la multiplicación de las bacterias. Una característica de las diferentes especies de Ehrlichia y Anaplasma es que se aglomeran en el citoplasma formando unas inclusiones que se pueden observar al microscopio óptico, denominadas mórulas. Estas mórulas se forman a los pocos días, y pueden ser observadas fundamentalmente en sangre periférica, pero también en médula ósea, sinusoides hepáticos y/o esplénicos, e incluso en las células del LCR 1. La afinidad de las diferentes especies de este tipo de bacterias por sus células diana es la responsable de las citopenias observadas (leucopenia, trombocitopenia) que en ocasiones pueden provocar grados importantes de inmunodepresión. Este hecho facilita la aparición ocasional de infecciones oportunistas.
Los principales determinantes antigénicos de las ehrlichias son las proteínas de la membrana de superficie. Si bien se cree que la infección confiere una protección duradera frente a nuevas infecciones, se han confirmado casos de reinfección por la misma especie de Ehrlichia. Asimismo existen datos de la posible persistencia de estas bacterias en el citoplasma de las células infectadas durante largos períodos de tiempo.
Las ehrlichiosis y anaplasmosis son infecciones sistémicas, por lo que provocan daño en diferentes órganos y sistemas, y pueden encontrarse granulomas y megacariocitosis en médula ósea, necrosis focal hepática y la existencia de un infiltrado linfohistiocítico perivascular que afecta a hígado, meninges, cerebro, corazón, etc. 13.
Manifestaciones clínicas y alteraciones analíticas
La AHG es una enfermedad febril aguda en la que la mayoría de los pacientes recuerdan la picadura de una garrapata en los días o semanas previos. Se han comunicado más casos en varones que en mujeres 2,8,14. El período de incubación varía entre 5-21 días (media: 11 días). La mayor parte de los casos europeos se han producido entre abril y octubre (época de actividad del vector) con un pico en julio 2. Los pacientes se presentan con fiebre de comienzo súbito (> 38,5 °C), malestar general, cefalea, mialgias y artralgias. La exploración física no muestra datos destacables, salvo la presencia ocasional de conjuntivitis y adenopatías. Las megalias no son frecuentes. Además del cuadro seudogripal pueden existir otras manifestaciones clínicas: respiratorias (tos), digestivas (náuseas, vómitos, diarrea, dolor abdominal, anorexia) y neurológicas (meningitis). La presencia de exantema es más frecuente en los pacientes con EHM y muy rara en la AHG 2. Más de la mitad de los pacientes requieren hospitalización durante la enfermedad en las series americanas. En la AHG europea las manifestaciones clínicas parecen menos graves, si bien algunos casos de AHG se presentan como una neumonía atípica 15-17. Entre las complicaciones de estas afecciones se han descrito, entre otras, coagulación intravascular diseminada, dificultad respiratoria del adulto, neuropatías periféricas, parálisis facial, pancarditis y rabdomiólisis. La inmunodepresión (leucopenia) provocada en algunas ocasiones se acompaña de infecciones oportunistas (neumonía micótica), que pueden llevar a la muerte al paciente. En Norteamérica, entre el 0 y el 5% de los pacientes con AHG fallecen, y la mayoría de las muertes se deben a infecciones oportunistas o a enfermedades concomitantes, si bien estos aspectos no se describen en la literatura médica europea 2.
Aunque los hallazgos de laboratorio (hematológicos y bioquímicos) son inespecíficos, estos pueden ayudar al diagnóstico 2,14. Así, la mayoría de los pacientes presentan en la fase aguda de la enfermedad leucopenia y trombocitopenia, además de elevación moderada de las transaminasas (aspartato aminotransferasa y alalino aminotransferasa), lactato deshidrogenasa y proteína C reactiva. Estas alteraciones se suelen resolver en la AHG europea en unos 14 días del inicio del cuadro 14. En los pacientes con AHG que presentan signos meníngeos, el análisis del LCR suele ser normal, a diferencia de los pacientes con EHM en los que se observa pleocitosis linfocitaria, con aumento de proteínas, y mayor prevalencia de clínica neurológica 18. La glucorraquia suele encontrarse en los límites de la normalidad 2.
Por último, se debe recordar que puesto que los vectores de estas bacterias pueden transmitir otras enfermedades como la borreliosis de Lyme, encefalitis centroeuropea o las babesiosis, se puede dar el caso de que coexista más de una enfermedad en el paciente picado por garrapatas, y observarse manifestaciones clínicas de más de una de ellas 19.
Diagnóstico
Recogida y conservación de las muestras
Para el aislamiento de A. phagocytophilum se debe obtener sangre durante la fase aguda de la enfermedad, que es cuando existe la mayor concentración de leucocitos infectados en sangre periférica. La sangre debe ser extraída preferiblemente en tubos de ácido etilendiaminotetraacético (EDTA), y preservada a temperatura ambiente no más de 48 h o congelada a 20 °C antes de la inoculación en los medios de cultivo. La sangre infectada con A. phagocytophilum recogida en tubos de heparina también se ha mostrado útil para el cultivo durante 10 días a temperatura ambiente y hasta 13 días conservada a 4 °C. No obstante, se recomienda no utilizar estos tubos ya que comprometen su posterior utilización para la posible amplificación del genoma mediante técnicas de reacción en cadena de la polimerasa (PCR) 14.
Para el diagnóstico serológico se deben tomar al menos dos muestras de suero, una durante la fase aguda y otra a los 14-21 días en la fase de convalecencia. Se debe tener en cuenta que los anticuerpos pueden persistir durante años tras la infección 20. Si el suero no va a ser procesado rápidamente es mejor congelarlo 14.
Para la observación de leucocitos infectados lo mejor es preparar las extensiones de sangre periférica inmediatamente después de la extracción de sangre. Deben secarse al aire y conservarse a temperatura ambiente para su observación 14.
Técnicas diagnósticas
Cultivo
Se realiza en muy pocos centros, y para su realización se recomienda un laboratorio con un grado mínimo de seguridad de tipo 3. La línea celular más empleada para el cultivo de A. phagocytophilum es la de células promielocíticas leucémicas HL-60. La sangre fresca (100 μl), o 5 ml de la capa leucocitaria de sangre en EDTA congelada previamente a 20 °C debe ser inoculada en frascos de 25 cm 2 con células HL-60 con una densidad de 2 x 10 5 células. La infección puede ser comprobada mediante tinciones de Giemsa, y generalmente son visibles mórulas a los 3-7 días de la inoculación 14,21.
Serología
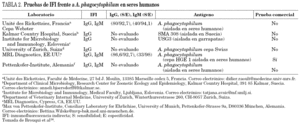
La serología es la técnica de laboratorio más utilizada para el diagnóstico microbiológico de estas infecciones. Dentro de las diferentes técnicas serológicas, la técnica de inmunofluorescencia indirecta (IFI) es la más empleada. En la actualidad se dispone de diferentes antígenos (tabla 2) para el diagnóstico de la AHG, que bien son preparados con sustrato de células infectadas o con antígenos puros. Su mayor limitación es la existencia de reacciones cruzadas entre las diferentes especies de Ehrlichia y Anaplasma. No obstante, al no existir en Europa ninguna prueba que haya demostrado la presencia de otras ehrlichiosis humanas diferentes a la de la AHG, ante un cuadro clínico indicativo, una serología positiva ha de hacernos pensar en una AHG. También se han descrito reacciones cruzadas entre estas bacterias y otros rickettsiales, como R. rickettsii y R. typhi. En nuestra experiencia también se pueden producir reacciones cruzadas en la mononucleosis infecciosa, en la fiebre Q y en la infección por R. slovaca 14,22,23.
Detección molecular
Se realiza mediante métodos basados en la PCR. Estos métodos no están estandarizados y pueden mostrar resultados discrepantes. Se ha logrado la detección de ADN de A. phagocytophilum de sangre y de suero en la fase aguda. En la actualidad se dispone de múltiples dianas, habiéndose demostrado como más sensibles los fragmentos del gen epank, los fragmentos homólogos del gen msp2, o los que amplifican un fragmento del gen ARNr 16S24-26. En todo caso cualquier fragmento amplificado con cualquiera de las dianas que se expresan en la tabla 3 debe secuenciarse para confirmar la presencia de ADN específico 14.
Criterios diagnósticos
El diagnóstico de las ehrlichiosis y anaplasmosis requiere una gran sospecha clínica. Los hallazgos de laboratorio (trombocitopenia, leucopenia y aumento de las transaminasas) y los antecedentes epidemiológicos nos deben hacer sospechar esta posibilidad. Estas infecciones deben tenerse en cuenta en aquellos individuos previamente sanos que presentan fiebre tras realizar actividades al aire libre y en aquellos pacientes que refieren el antecedente de picadura de garrapata y que no responden al tratamiento con betalactámicos o macrólidos, especialmente en áreas endémicas para la borreliosis de Lyme. La normalidad de los parámetros analíticos no descarta la enfermedad 2,14,27. En la tabla 4 se exponen los criterios de la European Society of Clinical Microbiology and Infectious Diseases Group for Coxiella, Rickettsia, Anaplasma and Bartonella (ESCAR) para el diagnóstico de la AHG 14. Existen también criterios de los Centers for Diseases Control and Prevention (CDC) para el diagnóstico de la AHM y AHG 28.
Profilaxis
Las ehrlichiosis y anaplasmosis se previenen evitando la picadura de las garrapatas. A este respecto, llevar una indumentaria adecuada en los lugares boscosos y con hierba alta, el uso de repelentes y la revisión del cuerpo tras las excursiones en búsqueda de estos artrópodos y su correcta extracción mediante pinzas constituyen las medidas de profilaxis primaria 29. Por el momento no existen vacunas, y no hay evidencia de que la profilaxis antibiótica tras la picadura de garrapatas sea coste-efectiva.
Tratamiento
En nuestra opinión, ante la sospecha clínica de ehrlichiosis y anaplasmosis se ha de administrar tratamiento de forma empírica sin esperar la confirmación microbiológica, ya que esta puede tardar semanas o no producirse. Son muchos los antibióticos que han demostrado ser eficaces, y al igual que en las rickettsiosis, la doxiciclina es el tratamiento de elección incluidos niños (100 mg cada 12 h durante 7 a 14 días y en niños ajustar según peso). Las quinolonas (ciprofloxacino, ofloxacino y levofloxacino) y la rifampicina son posibles alternativas terapéuticas 30. La respuesta al tratamiento es buena y los síntomas se resuelven 24-48 h después de iniciarse el tratamiento. En ausencia de respuesta al tratamiento se han de descartar otras posibilidades diagnósticas o coinfección por otros agentes.