VINCat es un programa de vigilancia de la infección nosocomial en los hospitales de Cataluña. El objetivo del estudio fue evaluar el cumplimiento de las medidas de control de Staphylococcus aureus resistente a meticilina (SARM) en dichos centros.
MétodosDe enero a marzo de 2013 se realizó una encuesta por correo sobre las características de los hospitales y la aplicación de las medidas de control de SARM.
ResultadosRespondieron 53 hospitales (>500 camas: 7; 200-500 camas: 14;<200 camas: 32; tenían UCI: 29). Disponían de alerta informática de reingresos el 63%. Realizaban vigilancia activa de los traslados de otro hospital el 46,2%, o centro de larga estancia el 55,8%, siendo ambas medidas significativamente más frecuentes en hospitales con una tasa de SARM≤22% (mediana global). Observaban el cumplimento de higiene de manos el 77,4% de los centros y fue mayor al 50% en el 69,7%. Todos los hospitales aplicaban precauciones de contacto, aunque el 62,3% no disponían de material clínico de uso frecuente exclusivo. La limpieza de la habitación se realizaba más frecuentemente en el 54,7% y tenían programas de adecuación del uso de antibióticos el 67,9%.
ConclusionesEste estudio informa sobre la implementación de medidas preventivas de SARM en hospitales del programa VINCat. Aunque la mayoría de los hospitales disponen de un protocolo específico, el cumplimento de las medidas es mejorable, especialmente la detección activa en pacientes de riesgo, la adherencia a la higiene de manos, la limpieza más frecuente de la habitación y la optimización del uso de antibióticos.
VINCat is a nosocomial infection surveillance program in hospitals in Catalonia. The aim of the study was to determine the surveillance and control measures of methicillin-resistant Staphylococcus aureus (MRSA) in these centres.
MethodsAn e-mail survey was carried out from January to March 2013 with questions related to the characteristics of the hospitals and their control measures for MRSA.
ResultsA response was received from 53 hospitals (>500 beds: 7; 200-500 beds: 14;<200 beds: 32; had ICU: 29). Computer alert of readmissions was available in 63%. There was active surveillance of patients admitted from another hospital (46.2%) or a long-term-care centre (55.8%), both being significantly more common measures in hospitals with a rate of MRSA≤22% (global median). Compliance with hand hygiene was observed in 77.4% of the centres, and was greater than 50% in 69.7% of them. All hospitals had contact precautions, although 62.3% did not have exclusive frequently used clinical material in bedrooms. The room cleaning was performed more frequently in 54.7% of hospitals, and 67.9% of them had programs for the appropriate use of antibiotics.
ConclusionsThis study provides information on the implementation of measures to prevent MRSA in hospitals participating in the VINCat program. Most of the centres have an MRSA protocol, however compliance with it should be improved, especially in areas such as active detection on admission in patients at risk, hand hygiene adherence, cleaning frequency and optimising the use of antibiotics.
Staphylococcus aureus resistente a meticilina (SARM) es una causa frecuente de infección nosocomial que aumenta la morbimortalidad, la duración del ingreso y el coste de la asistencia sanitaria1,2. Entre los factores de riesgo de colonización por SARM en el hospital destacan la comorbilidad grave, el tratamiento antibiótico, la realización de técnicas invasivas y el contacto frecuente con el personal sanitario3.
El control del SARM es una de las prioridades en los programas de prevención de la infección nosocomial. Las estrategias de prevención se basan en la aplicación de un conjunto de medidas dirigidas a evitar la transmisión y reducir el reservorio mediante la detección precoz y el tratamiento de los pacientes colonizados por SARM, además de la limpieza ambiental y la optimización del uso de los antibióticos4–6.
El programa VINCat tiene como objetivo el control de las infecciones nosocomiales en la red hospitalaria de Cataluña a través de diversos indicadores, entre ellos, la vigilancia epidemiológica de microorganismos de especial relevancia epidemiológica, como el SARM. La vigilancia de SARM se realiza en los pacientes atendidos en cualquier área de agudos del hospital a través de los siguientes indicadores: porcentaje de SARM, incidencia de casos nuevos de SARM, incidencia de bacteriemia por SARM y, más recientemente, la incidencia de casos nuevos de SARM de adquisición nosocomial. Dichos indicadores muestran que SARM es endémico en nuestro medio, con una tasa media global del 22-24%7. El programa VINCat ha elaborado un documento con las precauciones para prevenir la diseminación del SARM en los centros sanitarios basado en las guías publicadas8. La evaluación del grado de aplicación de dichas medidas en los centros que participan en el programa permitiría planificar acciones de mejora en la prevención del SARM.
El presente estudio tiene como objetivo evaluar el cumplimiento de las medidas de control del SARM que se aplican en los hospitales que participan en el programa VINCat, atendiendo al tamaño y a la tasa de SARM del centro.
MétodosÁmbito de estudioEl estudio se realizó en los 58 centros que participaron en 2012 en el programa VINCat, 9 con más de 500 camas, 17 con 200-500 camas, y 32 con menos de 200 camas. Cuarenta y seis de dichos centros (los 9 con más de 500 camas, 16 con 200-500 camas y 21 con menos de 200 camas) reportaron indicadores de SARM al programa VINCat en 2012.
Diseño del estudioSe diseñó un cuestionario con 29 preguntas basado en las medidas de control recomendadas en las distintas guías publicadas hasta ese momento. Se recogieron datos relativos a: 1) las características de los hospitales: número de camas, disponibilidad o no de UCI, y 2) el cumplimento de las medidas de vigilancia y control del SARM. Las medidas de vigilancia evaluadas incluían: información diaria del Laboratorio de Microbiología al equipo de control de infección, detección activa de casos nuevos (indicaciones, muestras de cribado y métodos microbiológicos) y alerta informática de los reingresos. Las medidas de control evaluadas fueron: higiene de manos (formación, disponibilidad de dispensadores de preparados de base alcohólica en el punto de atención al paciente y observación del cumplimento), precauciones de contacto en habitación individual o compartida (indicaciones, tipo y duración), descolonización (indicaciones y métodos), limpieza ambiental y optimización del uso de antibióticos.
El cuestionario fue enviado en enero de 2013 a través de correo electrónico por el centro coordinador del programa a los profesionales de cada centro hospitalario responsables de facilitar los indicadores del programa VINCat. Los resultados fueron recibidos entre enero y marzo de 2013 e introducidos en una base de datos para su posterior análisis. Se contactó con los centros cuando fue necesario aclarar o completar alguna respuesta.
Análisis estadísticoSe realizó un análisis descriptivo utilizando el índice de tendencia central y de dispersión para las variables cuantitativas, y la frecuencia y el porcentaje para las categóricas.
Se realizó un estudio comparativo de las variables relacionadas con las medidas de control de SARM según el tamaño del hospital (menos de 200 camas, entre 200 y 500 camas, y más de 500 camas) mediante la prueba de comparación de proporciones o chi cuadrado, asumiendo un nivel de confianza del 95%.
Se realizó un estudio comparativo del cumplimiento de las medidas de los hospitales con una tasa de SARM igual o superior a la mediana (22%) con los que tenían una tasa inferior, mediante la prueba de comparación de proporciones o chi cuadrado, asumiendo un nivel de confianza del 95%.
Aspectos éticosEl proyecto fue aprobado para su implementación por el centro coordinador del programa VINCat. La respuesta de los cuestionarios se trató anónimamente, garantizando en todo momento la confidencialidad de los datos.
ResultadosDe los 58 centros a los que se les envió el cuestionario, contestaron la encuesta 53, lo que supone una tasa de respuesta del 91,4%. Según el tamaño, respondieron 7 (78%) de los centros con más de 500 camas, 14 (82,3%) con 200 a 500 camas y 32 (100%) con menos de 200 camas. Veintinueve hospitales tenían cuidados intensivos (todos los centros de más de 200 camas y 8 de los 32 con menos de 200 camas). Los centros participantes representaban el 70% de los hospitales de enfermos agudos de uso público de Cataluña y 2 eran privados. Los hospitales estaban distribuidos en todo el territorio (33 en la provincia de Barcelona, 8 en Girona, 7 en Tarragona y 5 en Lleida). Cincuenta hospitales (94,3%) disponían de un protocolo específico para el control de SARM, incluyendo 29 (90,6%) centros con menos de 200 camas y todos los de mayor tamaño. Cuarenta y uno de los 53 centros (77,4%) habían reportado la tasa de SARM al programa VINCat en 2012, con una mediana de 22% (percentil 25 de 17% y percentil 75 de 30,4%).
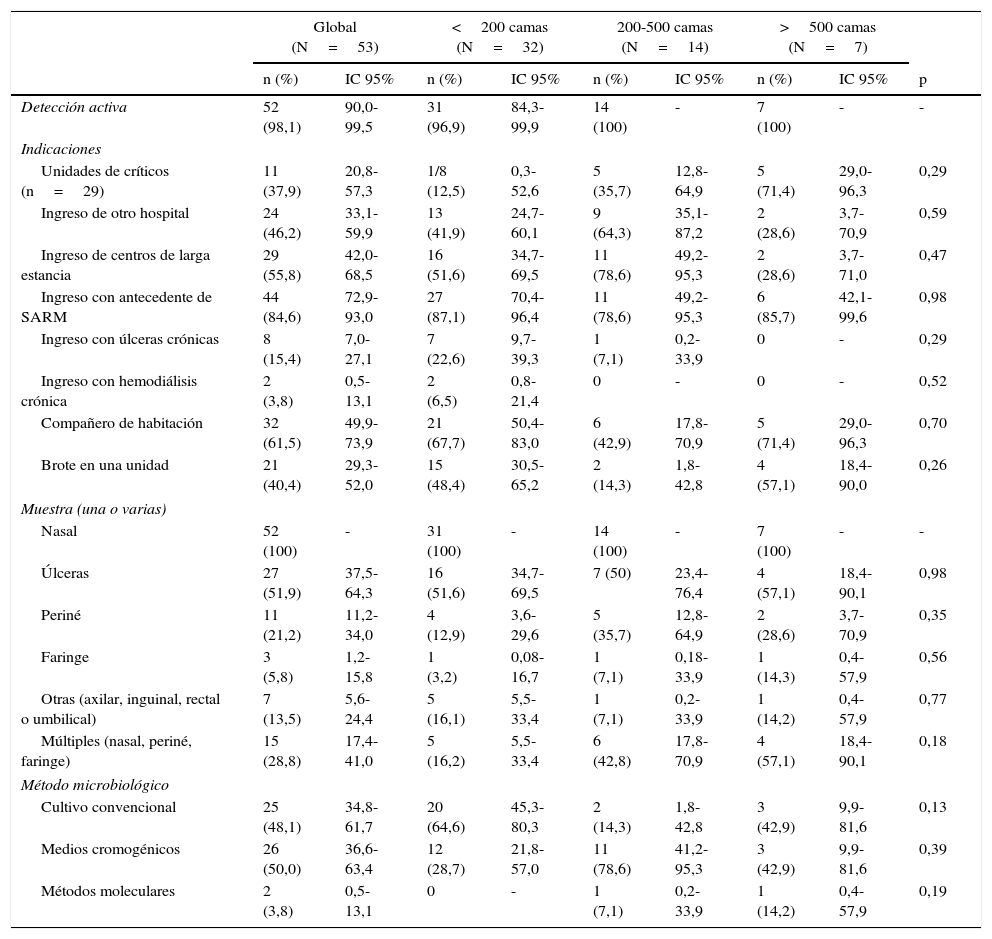
VigilanciaEl Laboratorio de Microbiología informaba diariamente al equipo de control de infección nosocomial de los casos nuevos detectados en 47 centros (88,7%): 26 (81,2%) de los hospitales con menos de 200 camas y todos los hospitales de mayor tamaño. Treinta y cuatro hospitales (64,1%) disponían de un sistema de alerta informática del reingreso de pacientes con SARM: 17 (53,1%) de los hospitales con menos de 200 camas, 11 (78,6%) con 200-500 camas y 6 (85,7%) con más de 500 camas. Cincuenta y dos de los 53 centros realizaban algún tipo de detección activa de la colonización por SARM a los pacientes (tabla 1). Cuarenta y siete hospitales (88,6%) estudiaban la colonización del personal sanitario, habitualmente en situación de brote. No se observaron diferencias estadísticamente significativas en las medidas de vigilancia atendiendo al tamaño del hospital.
Detección activa de Staphylococcus aureus resistente a meticilina global y según el tamaño del hospital
| Global (N=53) | <200 camas (N=32) | 200-500 camas (N=14) | >500 camas (N=7) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | p | |
| Detección activa | 52 (98,1) | 90,0-99,5 | 31 (96,9) | 84,3-99,9 | 14 (100) | - | 7 (100) | - | - |
| Indicaciones | |||||||||
| Unidades de críticos (n=29) | 11 (37,9) | 20,8-57,3 | 1/8 (12,5) | 0,3-52,6 | 5 (35,7) | 12,8-64,9 | 5 (71,4) | 29,0-96,3 | 0,29 |
| Ingreso de otro hospital | 24 (46,2) | 33,1-59,9 | 13 (41,9) | 24,7-60,1 | 9 (64,3) | 35,1-87,2 | 2 (28,6) | 3,7-70,9 | 0,59 |
| Ingreso de centros de larga estancia | 29 (55,8) | 42,0-68,5 | 16 (51,6) | 34,7-69,5 | 11 (78,6) | 49,2-95,3 | 2 (28,6) | 3,7-71,0 | 0,47 |
| Ingreso con antecedente de SARM | 44 (84,6) | 72,9-93,0 | 27 (87,1) | 70,4-96,4 | 11 (78,6) | 49,2-95,3 | 6 (85,7) | 42,1-99,6 | 0,98 |
| Ingreso con úlceras crónicas | 8 (15,4) | 7,0-27,1 | 7 (22,6) | 9,7-39,3 | 1 (7,1) | 0,2-33,9 | 0 | - | 0,29 |
| Ingreso con hemodiálisis crónica | 2 (3,8) | 0,5-13,1 | 2 (6,5) | 0,8-21,4 | 0 | - | 0 | - | 0,52 |
| Compañero de habitación | 32 (61,5) | 49,9-73,9 | 21 (67,7) | 50,4-83,0 | 6 (42,9) | 17,8-70,9 | 5 (71,4) | 29,0-96,3 | 0,70 |
| Brote en una unidad | 21 (40,4) | 29,3-52,0 | 15 (48,4) | 30,5-65,2 | 2 (14,3) | 1,8-42,8 | 4 (57,1) | 18,4-90,0 | 0,26 |
| Muestra (una o varias) | |||||||||
| Nasal | 52 (100) | - | 31 (100) | - | 14 (100) | - | 7 (100) | - | - |
| Úlceras | 27 (51,9) | 37,5-64,3 | 16 (51,6) | 34,7-69,5 | 7 (50) | 23,4-76,4 | 4 (57,1) | 18,4-90,1 | 0,98 |
| Periné | 11 (21,2) | 11,2-34,0 | 4 (12,9) | 3,6-29,6 | 5 (35,7) | 12,8-64,9 | 2 (28,6) | 3,7-70,9 | 0,35 |
| Faringe | 3 (5,8) | 1,2-15,8 | 1 (3,2) | 0,08-16,7 | 1 (7,1) | 0,18-33,9 | 1 (14,3) | 0,4-57,9 | 0,56 |
| Otras (axilar, inguinal, rectal o umbilical) | 7 (13,5) | 5,6-24,4 | 5 (16,1) | 5,5-33,4 | 1 (7,1) | 0,2-33,9 | 1 (14,2) | 0,4-57,9 | 0,77 |
| Múltiples (nasal, periné, faringe) | 15 (28,8) | 17,4-41,0 | 5 (16,2) | 5,5-33,4 | 6 (42,8) | 17,8-70,9 | 4 (57,1) | 18,4-90,1 | 0,18 |
| Método microbiológico | |||||||||
| Cultivo convencional | 25 (48,1) | 34,8-61,7 | 20 (64,6) | 45,3-80,3 | 2 (14,3) | 1,8-42,8 | 3 (42,9) | 9,9-81,6 | 0,13 |
| Medios cromogénicos | 26 (50,0) | 36,6-63,4 | 12 (28,7) | 21,8-57,0 | 11 (78,6) | 41,2-95,3 | 3 (42,9) | 9,9-81,6 | 0,39 |
| Métodos moleculares | 2 (3,8) | 0,5-13,1 | 0 | - | 1 (7,1) | 0,2-33,9 | 1 (14,2) | 0,4-57,9 | 0,19 |
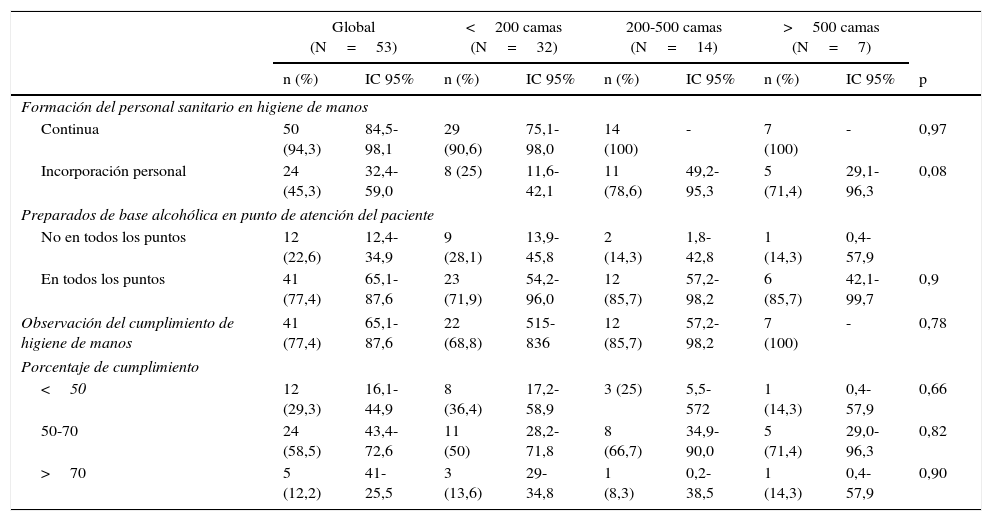
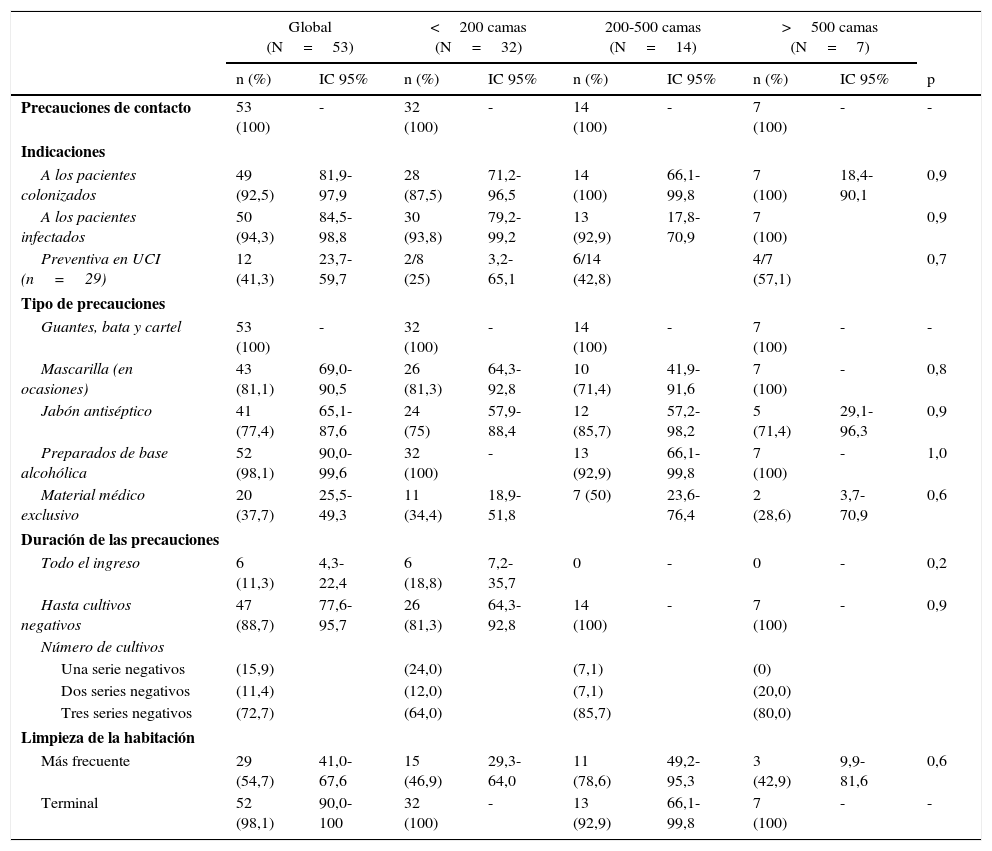
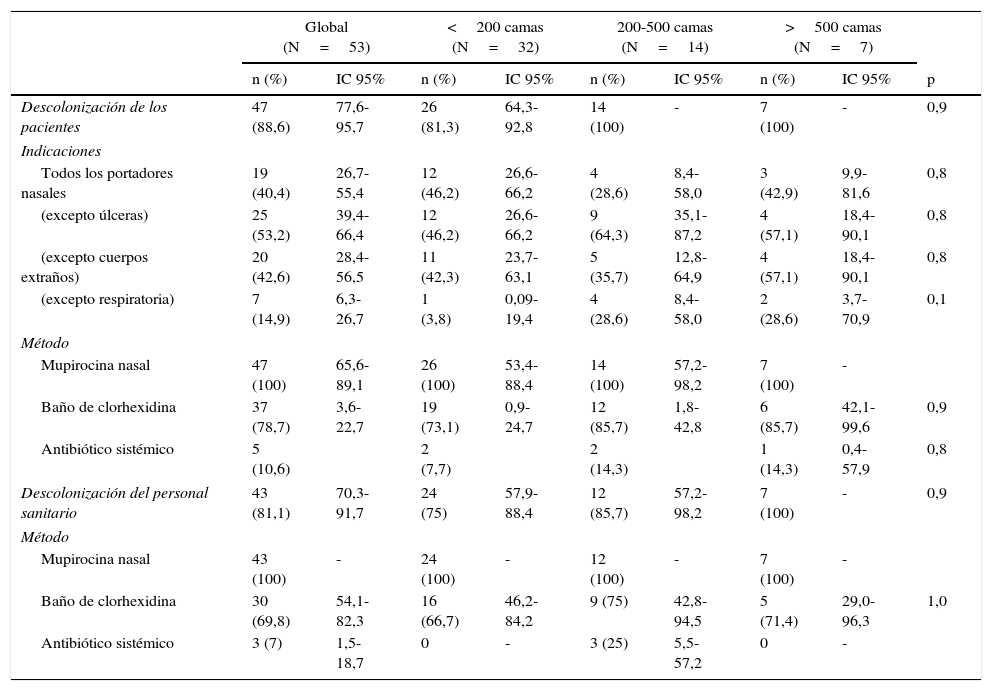
El 94,3% realizaban formación continua en higiene de manos, aunque solo el 45,3% la impartían a la incorporación de personal nuevo. Disponían de dispensadores de preparados de base alcohólica en todos los puntos de atención al paciente el 77,4% de los hospitales. Cuarenta y un centros (77,4%) realizaban observación del cumplimento de la higiene de manos. En el 29,3% de estos el cumplimiento fue inferior al 50% (tabla 2). Todos los hospitales aplicaban precauciones de contacto a los pacientes colonizados o infectados por SARM (tabla 3). Cuarenta y siete de los 53 hospitales (88,6%) descolonizaban a los pacientes portadores de SARM y 43 (81,1%) al personal sanitario (tabla 4). No se observaron diferencias estadísticamente significativas en estas medidas de control según el tamaño del hospital.
Medidas de higiene de manos global y según el tamaño del hospital
| Global (N=53) | <200 camas (N=32) | 200-500 camas (N=14) | >500 camas (N=7) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | p | |
| Formación del personal sanitario en higiene de manos | |||||||||
| Continua | 50 (94,3) | 84,5-98,1 | 29 (90,6) | 75,1-98,0 | 14 (100) | - | 7 (100) | - | 0,97 |
| Incorporación personal | 24 (45,3) | 32,4-59,0 | 8 (25) | 11,6-42,1 | 11 (78,6) | 49,2-95,3 | 5 (71,4) | 29,1-96,3 | 0,08 |
| Preparados de base alcohólica en punto de atención del paciente | |||||||||
| No en todos los puntos | 12 (22,6) | 12,4-34,9 | 9 (28,1) | 13,9-45,8 | 2 (14,3) | 1,8-42,8 | 1 (14,3) | 0,4-57,9 | |
| En todos los puntos | 41 (77,4) | 65,1-87,6 | 23 (71,9) | 54,2-96,0 | 12 (85,7) | 57,2-98,2 | 6 (85,7) | 42,1-99,7 | 0,9 |
| Observación del cumplimiento de higiene de manos | 41 (77,4) | 65,1-87,6 | 22 (68,8) | 515-836 | 12 (85,7) | 57,2-98,2 | 7 (100) | - | 0,78 |
| Porcentaje de cumplimiento | |||||||||
| <50 | 12 (29,3) | 16,1-44,9 | 8 (36,4) | 17,2-58,9 | 3 (25) | 5,5-572 | 1 (14,3) | 0,4-57,9 | 0,66 |
| 50-70 | 24 (58,5) | 43,4-72,6 | 11 (50) | 28,2-71,8 | 8 (66,7) | 34,9-90,0 | 5 (71,4) | 29,0-96,3 | 0,82 |
| >70 | 5 (12,2) | 41-25,5 | 3 (13,6) | 29-34,8 | 1 (8,3) | 0,2-38,5 | 1 (14,3) | 0,4-57,9 | 0,90 |
Aplicación de las precauciones de contacto y limpieza ambiental global y según el tamaño del hospital
| Global (N=53) | <200 camas (N=32) | 200-500 camas (N=14) | >500 camas (N=7) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | p | |
| Precauciones de contacto | 53 (100) | - | 32 (100) | - | 14 (100) | - | 7 (100) | - | - |
| Indicaciones | |||||||||
| A los pacientes colonizados | 49 (92,5) | 81,9-97,9 | 28 (87,5) | 71,2-96,5 | 14 (100) | 66,1-99,8 | 7 (100) | 18,4-90,1 | 0,9 |
| A los pacientes infectados | 50 (94,3) | 84,5-98,8 | 30 (93,8) | 79,2-99,2 | 13 (92,9) | 17,8-70,9 | 7 (100) | 0,9 | |
| Preventiva en UCI (n=29) | 12 (41,3) | 23,7-59,7 | 2/8 (25) | 3,2-65,1 | 6/14 (42,8) | 4/7 (57,1) | 0,7 | ||
| Tipo de precauciones | |||||||||
| Guantes, bata y cartel | 53 (100) | - | 32 (100) | - | 14 (100) | - | 7 (100) | - | - |
| Mascarilla (en ocasiones) | 43 (81,1) | 69,0-90,5 | 26 (81,3) | 64,3-92,8 | 10 (71,4) | 41,9-91,6 | 7 (100) | - | 0,8 |
| Jabón antiséptico | 41 (77,4) | 65,1-87,6 | 24 (75) | 57,9-88,4 | 12 (85,7) | 57,2-98,2 | 5 (71,4) | 29,1-96,3 | 0,9 |
| Preparados de base alcohólica | 52 (98,1) | 90,0-99,6 | 32 (100) | - | 13 (92,9) | 66,1-99,8 | 7 (100) | - | 1,0 |
| Material médico exclusivo | 20 (37,7) | 25,5-49,3 | 11 (34,4) | 18,9-51,8 | 7 (50) | 23,6-76,4 | 2 (28,6) | 3,7-70,9 | 0,6 |
| Duración de las precauciones | |||||||||
| Todo el ingreso | 6 (11,3) | 4,3-22,4 | 6 (18,8) | 7,2-35,7 | 0 | - | 0 | - | 0,2 |
| Hasta cultivos negativos | 47 (88,7) | 77,6-95,7 | 26 (81,3) | 64,3-92,8 | 14 (100) | - | 7 (100) | - | 0,9 |
| Número de cultivos | |||||||||
| Una serie negativos | (15,9) | (24,0) | (7,1) | (0) | |||||
| Dos series negativos | (11,4) | (12,0) | (7,1) | (20,0) | |||||
| Tres series negativos | (72,7) | (64,0) | (85,7) | (80,0) | |||||
| Limpieza de la habitación | |||||||||
| Más frecuente | 29 (54,7) | 41,0-67,6 | 15 (46,9) | 29,3-64,0 | 11 (78,6) | 49,2-95,3 | 3 (42,9) | 9,9-81,6 | 0,6 |
| Terminal | 52 (98,1) | 90,0-100 | 32 (100) | - | 13 (92,9) | 66,1-99,8 | 7 (100) | - | - |
Descolonización de pacientes y personal sanitario con Staphylococcus aureus resistente a meticilina global y según el tamaño del centro
| Global (N=53) | <200 camas (N=32) | 200-500 camas (N=14) | >500 camas (N=7) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | n (%) | IC 95% | p | |
| Descolonización de los pacientes | 47 (88,6) | 77,6-95,7 | 26 (81,3) | 64,3-92,8 | 14 (100) | - | 7 (100) | - | 0,9 |
| Indicaciones | |||||||||
| Todos los portadores nasales | 19 (40,4) | 26,7-55,4 | 12 (46,2) | 26,6-66,2 | 4 (28,6) | 8,4-58,0 | 3 (42,9) | 9,9-81,6 | 0,8 |
| (excepto úlceras) | 25 (53,2) | 39,4-66,4 | 12 (46,2) | 26,6-66,2 | 9 (64,3) | 35,1-87,2 | 4 (57,1) | 18,4-90,1 | 0,8 |
| (excepto cuerpos extraños) | 20 (42,6) | 28,4-56,5 | 11 (42,3) | 23,7-63,1 | 5 (35,7) | 12,8-64,9 | 4 (57,1) | 18,4-90,1 | 0,8 |
| (excepto respiratoria) | 7 (14,9) | 6,3-26,7 | 1 (3,8) | 0,09-19,4 | 4 (28,6) | 8,4-58,0 | 2 (28,6) | 3,7-70,9 | 0,1 |
| Método | |||||||||
| Mupirocina nasal | 47 (100) | 65,6-89,1 | 26 (100) | 53,4-88,4 | 14 (100) | 57,2-98,2 | 7 (100) | - | |
| Baño de clorhexidina | 37 (78,7) | 3,6-22,7 | 19 (73,1) | 0,9-24,7 | 12 (85,7) | 1,8-42,8 | 6 (85,7) | 42,1-99,6 | 0,9 |
| Antibiótico sistémico | 5 (10,6) | 2 (7,7) | 2 (14,3) | 1 (14,3) | 0,4-57,9 | 0,8 | |||
| Descolonización del personal sanitario | 43 (81,1) | 70,3-91,7 | 24 (75) | 57,9-88,4 | 12 (85,7) | 57,2-98,2 | 7 (100) | - | 0,9 |
| Método | |||||||||
| Mupirocina nasal | 43 (100) | - | 24 (100) | - | 12 (100) | - | 7 (100) | - | |
| Baño de clorhexidina | 30 (69,8) | 54,1-82,3 | 16 (66,7) | 46,2-84,2 | 9 (75) | 42,8-94,5 | 5 (71,4) | 29,0-96,3 | 1,0 |
| Antibiótico sistémico | 3 (7) | 1,5-18,7 | 0 | - | 3 (25) | 5,5-57,2 | 0 | - | |
Entre otras medidas, 36 (67,9%) de los centros disponían de alguna persona responsable de revisar los tratamientos antibióticos con el objetivo de mejorar su uso, incluyendo 17 (53,1%) con menos de 200 camas, 12 (85,7%) con 200-500 camas y todos los de más de 500 camas (p=0,01). Asimismo, 30 centros (56,6%) disponían de una hoja informativa del SARM para los pacientes y familiares, incluyendo 15 (46,9%) de los centros con menos de 200 camas, 11 (78,6%) de aquellos con 200-500 camas y 4 (57,1%) con más de 500 camas, sin observar diferencias significativas según el tamaño del centro.
Los hospitales con una tasa de SARM menor o igual a la mediana (22%) realizaban con mayor frecuencia detección activa de SARM en pacientes procedentes de otro hospital o de un centro de larga estancia que los que tenían una tasa superior (76,2 vs. 20%, p=0,001, y 81 vs. 35%, p<0,04, respectivamente). Asimismo, dichos hospitales utilizaban múltiples muestras para el estudio de la colonización más frecuentemente que los centros con tasas mayores (47,6 vs. 15%, p=0,04). En cambio, los hospitales con una tasa de SARM más baja realizaban con menor frecuencia cribado en situación de brote (19 vs. 60%, p=0,01). La comparación de otras medidas no mostró diferencias significativas entre ambos grupos de hospitales.
DiscusiónLos resultados de la encuesta realizada en 53 centros que participan en el programa VINCat muestran que la mayoría disponen de un protocolo específico de control de SARM, aunque existen diferencias en la aplicación de las diversas medidas.
La identificación precoz de los casos nuevos de SARM se realizaba en la mayoría de los hospitales mediante la comunicación diaria de los casos nuevos por el Laboratorio de Microbiología al equipo de control de infección. En cambio, solo el 64% de los centros (generalmente con más de 200 camas) disponían de un sistema de alerta informática del reingreso de los pacientes colonizados o infectados por SARM, que facilita la adopción de medidas para evitar la transmisión de este microorganismo3.
La vigilancia activa permite detectar los pacientes colonizados por SARM, que representan un importante reservorio no diagnosticado a partir de las muestras clínicas. Las guías de control de SARM recomiendan realizar detección activa al ingreso en pacientes con riesgo elevado de colonización por SARM (previamente colonizados, procedentes de otros centros, sometidos a hemodiálisis crónica o portadores de úlceras crónicas) o durante los brotes que no se controlan con medidas de prevención básicas como la higiene de manos y las precauciones de contacto4,9–11. La detección activa de SARM estaría indicada también en los pacientes ingresados en unidades de críticos y los compañeros de habitación de un paciente con SARM por tener un riesgo más elevado de colonizarse por SARM durante el ingreso12–14. Sin embargo, el cribado de SARM debe asociarse a otras medidas de control y adaptarse a las características de cada centro.
La mayoría de los centros encuestados realizaban vigilancia activa al ingreso de los pacientes con antecedente de SARM. En cambio, solo la mitad de estos cribaban a los enfermos derivados de centros de larga estancia o de otros hospitales, siendo más frecuente esta práctica en los centros con una tasa de SARM inferior o igual a la mediana (22%). Esta relación podría indicar una mayor oportunidad de aplicar precauciones de contacto y descolonizar a los pacientes, así como reflejar una mejor prevención global del SARM en los centros con tasas de este más bajas.
El cribado de los pacientes con otros factores de riesgo, como úlceras crónicas o hemodiálisis crónica, fue poco frecuente (15 y 3,7% de los centros, respectivamente), al igual que la detección activa en unidades de críticos (35%). Finalmente, solo el 62% de los centros encuestados estudiaban al compañero de habitación de un caso nuevo de SARM y menos de la mitad realizaban cribado de los pacientes de una unidad en situación de brote.
El frotis nasal fue la muestra de cribado utilizada en todos los centros, al considerarse la más sensible. Sin embargo, solo una tercera parte de estos asociaban otras muestras (faríngea, perineal, axilar, rectal y/o umbilical) para aumentar la sensibilidad en la detección de SARM. Esta práctica fue significativamente más frecuente en los centros con una tasa de SARM menor o igual a la mediana (22%), posiblemente por reducir la transmisión a partir del reservorio oculto15,16. Solo la mitad de los centros utilizaban métodos microbiológicos rápidos (generalmente cromogénicos), que permiten un diagnóstico en menos de 24h frente a los métodos convencionales, que tardan más de 48h.
La higiene de manos es una de las medidas más importantes para prevenir la transmisión cruzada de SARM y otros microorganismos multirresistentes17. Es una medida simple y barata, aunque es difícil conseguir un cumplimento elevado y mantenido18. La disponibilidad de preparados de base alcohólica en el punto de atención al paciente, así como la formación y evaluación del personal sanitario, ayudan a mejorar el cumplimento de la higiene de manos19. La mayoría de los hospitales del VINCat han participado en los últimos años en un plan de promoción de la higiene de manos del Departamento de Salud de Cataluña basado en la estrategia de la OMS que ha aumentado el cumplimento de la higiene de manos20. Un 24% de los centros encuestados no disponían de dispensadores de preparados de base alcohólica en todos los puntos de atención al paciente, siendo este un punto de mejora. Todos los centros realizaban formación continua en higiene de manos, pero solo el 45,3% del total la aplicaban al personal de nueva incorporación. La higiene de manos debería ser incluida en la formación de acogida de los profesionales sanitarios, atendiendo al impacto de esta medida en la prevención de las infecciones nosocomiales. La observación del cumplimento de la higiene de manos, aunque es una medida costosa, se realizaba en un porcentaje elevado de los hospitales encuestados (77,4%). El cumplimiento de la higiene de manos fue superior al 50% en el 69,7% de los centros, y aunque es mejorable en la mayoría de los hospitales, se asemeja al de estudios recientes21.
Todos los centros aplicaban precauciones de contacto a los pacientes colonizados y/o infectados por SARM en una habitación individual o compartida. Las medidas incluían el uso de bata y guantes en todos los centros. Sin embargo, solo el 37% de estos utilizaban de forma exclusiva determinado material clínico, como el fonendoscopio. Dicho material se ha relacionado con algún brote de SARM, y un estudio reciente muestra que el nivel de contaminación del estetoscopio es comparable al de la mano dominante del médico22.
No existe consenso en la duración de las precauciones de contacto ni en el número de cultivos necesarios, aunque es recomendable realizar más de una serie en ausencia de tratamiento antibiótico14. La mayoría de los centros (88,9%) aplicaba esta medida hasta la negatividad de los cultivos, aunque un 11,3% lo hacía durante todo el ingreso. Asimismo, el 72,7% requerían 3 series de cultivos negativos, mientras que el resto solo precisaban una o 2 series para suspender las precauciones de aislamiento.
La contaminación ambiental tiene un papel fundamental en la persistencia y la transmisión del SARM. La limpieza más frecuente de la habitación, con especial dedicación a las superficies de contacto habitual del entorno del paciente y del material clínico, es fundamental para reducir la transmisión cruzada de SARM14. La limpieza de la habitación al alta o traslado del paciente infectado o colonizado con SARM era una práctica habitual en la mayoría de los centros. En cambio, solo la mitad de estos realizaban una limpieza más frecuente de la habitación durante el ingreso.
La descolonización de los portadores de SARM era una práctica habitual en la mayoría de los centros. Esta medida reduce el riesgo de infección por SARM de los pacientes colonizados, así como el reservorio y la transmisión nosocomial de este microorganismo3. Sin embargo, es necesario seleccionar a los pacientes, teniendo en cuenta el potencial de recolonización en presencia de factores de riesgo como úlceras, cuerpos extraños o ingreso en centros de larga estancia, así como los efectos secundarios del tratamiento23. El 40,4% de los centros descolonizaban a todos los portadores nasales, mientras que el resto excluían a los pacientes con úlceras (53,2%), cuerpos extraños (42,6%) y/o colonización respiratoria (14,9%). Todos los hospitales utilizaban mupirocina nasal, el 78,7% asociaban el baño con jabón de clorhexidina, y el 10,6%, el tratamiento antibiótico sistémico. El 79,8% de los centros encuestados descolonizaban también al personal sanitario, especialmente los hospitales de mayor tamaño.
La presión de selección que se deriva del uso de los antibióticos es un factor de riesgo de adquisición y transmisión de SARM24. Por el contrario, la disminución de su uso se asocia a una reducción en la incidencia de SARM25. Los resultados del estudio confirman la necesidad de implementar programas de optimización del uso de antibióticos, especialmente en los centros con menos de 200 camas.
Finalmente, solo la mitad de los centros disponían de folletos informativos para los pacientes con SARM. La educación e información de los pacientes y sus familiares en relación con el SARM y las precauciones recomendadas mejora la adherencia a las medidas de control y reduce la ansiedad que producen.
Una posible limitación del estudio es la utilización de una encuesta autocumplimentada y no anónima en lugar de una auditoría externa. Aunque no se puede descartar un cierto sesgo en alguna respuesta con objeto de que el centro aparezca con mejores resultados, los responsables de facilitar las respuestas fueron informados de que no se publicarían los resultados particulares de cada centro, minimizando así el riesgo de que se produjera dicho sesgo. Esta metodología nos ha permitido detectar puntos de mejora en las medidas de control de SARM en los hospitales encuestados.
En conclusión, este estudio proporciona información sobre la implementación de medidas de prevención de SARM en los hospitales de Cataluña que participan en el programa VINCat. Aunque la mayoría de los hospitales disponen de un protocolo específico de control de SARM, el cumplimiento de las medidas es mejorable, especialmente la detección activa al ingreso en pacientes de riesgo, como los procedentes de otros centros, la adherencia a la higiene de manos, la limpieza más frecuente de la habitación y la optimización del uso de antibióticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Delia García Pares, H. U. Dr. Trueta (Girona); Manel Panisello, H. Comarcal d’Amposta; David Castander, H. Sant Pau i Santa Tecla (Tarragona); Graciano Garcia Pardo, H. U. Joan XXIII (Tarragona); Jose Carlos de la Fuente Redondo, H. Comarcal de Móra d’Ebre; Eva Palau Gil, Clínica Girona; Maria de Gracia García Ramírez, Centre Medicoquirúrgic de Reus; Julià Gómez, H. del Mar (Barcelona); Silvia Caro Oruzco, Clínica de Ponent (Lleida), Eduard Sanjurjo, H. Comarcal del Pallars (Tremp); Paula Gassiot Cordomi, H. de Figueres, Fundació Salut de l’Empordà; Ana Lérida Urteaga, H. de Viladecans; Joaquin Lopez-Contreras,H. de Sant Pau (Barcelona); Rosa Vázquez Sáez, H. General de Granollers; Carlota Gudiol, H. Duran i Reynals (Hospitalet de Llobregat); Josep Maria Tricas, H. de Mollet; Carme Agustí Hanacsek, H. de Sant Celoni; M. Teresa Ros Prat, Fundació Sant Hospital (La Seu d’Urgell); Mercè Clarós Ferret, H. Sant Rafael (Barcelona); Nieves Larrosa, H. Vall d’Hebron (Barcelona); Inmaculada Fernández Moreno, Corporació Sanitària Parc Taulí (Sabadell); Rafael Pérez Vidal, Althaia-xarxa assistencial de Manresa; Lourdes Grabulosa Juncà, H. de Campdevànol; Amaia Concepción Oteiza Ubanell, H. de Palamós (Girona); Mar Olga Perez Moreno, H. Verge de la Cinta (Tortosa); Marisa Jofre Valls, H. Santa Caterina (Salt, Girona); Irene Montardit Bertral, H. Santa Maria (Lleida); Susana Casas Rodriguez, H. Dos de Maig (Barcelona); Roser Ferrer Aguilera, H. Comarcal Sant Jaume (Calella); Maria Jesús Martínez, H. General de Vic; David Blancas Altabella, Consorci Sanitari del Garraf-Hospital Sant Camil; M. Dolores Quesada, H. Germans Trias i Pujol (Badalona); Montserrat Riera i Garcia, H. Mútua de Terrassa; Montse Trias Pau, Clínica Salus Infirmorum; Maria Cuscó, H. Comarcal Alt Penedés (Vilafranca); Angeles Garcia Flores, H. Comarcal de Blanes; Francesc Marco Reverte, H. Clínic de Barcelona; Raimon Camps Salat, H. Plató (Barcelona), Cristina Berbel, Centre Mèdic Delfos; Elena Espejo, Hospital de Terrassa; M. Pilar Barrufet Barque, H. de Mataró; Montse Brugués Brugués, H. de Igualada; Montserrat Sierra, H. de Barcelona-SCIAS; María Asunción Gasós Rubio, H. Sant Joan de Déu de Martorell; Roger Malo Barres, Capio-H. General de Catalunya; Manel Villó Domingo, Pius-H. de Valls; Elsa Gimeno Sierra, Fundació Puigvert; Jordi Grau Amorós, H. Municipal de Badalona; Josep Bisbe Company, Fundació H. Sant Jaume d’Olot; Rosa Garcia-Penche Sánchez, H. U. Sagrat Cor; Pilar Ciércoles Julve, H. de Bellvitge; Alfredo Jover-Sáenz, H. U. Arnau de Vilanova (Lleida); Vicens Diaz de Brito, Parc Sanitari Sant Joan de Déu.