El primer brote conocido de virus ebola ocurrió en 1976, y desde entonces habían sido comunicados otros 24 brotes esporádicos circunscritos a África Central que nunca sobrepasaron los 425 afectados. El brote actual de ebola de África Occidental es el mayor de la historia, ha afectado a 28.220 personas y ha causado 11.291 muertos hasta la fecha. La magnitud de la epidemia ha producido una alarma mundial. Por primera vez se han atendido pacientes en países fuera de África y se han producido casos secundarios en España y en Estados Unidos. La epidemia actual ha hecho avanzar el conocimiento sobre la epidemiología, la clínica, las manifestaciones de laboratorio y la virología de la enfermedad por virus ebola. Por primera vez se han utilizado tratamientos experimentales y se han producido grandes avances en el desarrollo de vacunas. En el presente artículo revisamos estos avances en el conocimiento de la enfermedad por virus ebola
The first known Ebola outbreak occurred in 1976. Since then, 24 limited outbreaks had been reported in Central Africa, but never affecting more than 425 persons. The current outbreak in Western Africa is the largest in history with 28,220 reported cases and 11,291 deaths. The magnitude of the epidemic has caused worldwide alarm. For the first time, evacuated patients were treated outside Africa, and secondary cases have occurred in Spain and the United States. Since the start of the current epidemic, our knowledge about the epidemiology, clinical picture, laboratory findings, and virology of Ebola virus disease has considerably expanded. For the first time, experimental treatment has been tried, and there have been spectacular advances in vaccine development. A review is presented of these advances in the knowledge of Ebola virus disease.
El virus ebola (VE) fue descubierto en 1976 en 2 brotes simultáneos en la República Democrática del Congo y en Sudán que produjeron 318 afectados y 280 fallecidos. Desde entonces se habían notificado 24 brotes, todos en África Central, que nunca llegaron a afectar a más de 425 pacientes1. La mortalidad ha variado según la especie de VE implicada: 40% para Bundibugyo, 50% para Sudan y 90% para Zaire. Reston y Taï Forest no han producido fallecimientos humanos1.
EpidemiologiaEcología. Reservorio naturalLa hipótesis más aceptada es que el reservorio natural de los filovirus son murciélagos frugívoros de la familia Pteropodidae (Hypsignathus monstrosus, Epomops franqueti y Myonycteris torquata)2.
Magnitud de la epidemia actualLa epidemia actual de enfermedad por virus ebola (EVE) se ha denominado como la «de las primeras veces», porque ha sucedido en países que previamente no habían notificado casos, porque ha afectado a un número ingente de personas, porque nunca antes había alcanzado áreas urbanas incluyendo capitales de los países, y porque por primera vez se han producido casos autóctonos fuera de África y se han utilizado terapias experimentales.
La epidemia actual de EVE comenzó probablemente en diciembre de 2013 en Meliandou, una aldea rural de Guinea Conakri cercana a la frontera con Liberia y Sierra Leona3. Se cree que el caso índice —un niño de 2años— se infectó jugando con una colonia de murciélagos presentes en la oquedad de un árbol cercano a su domicilio2. El VE causante de la epidemia —la variante Makona de la cepa Zaire4— se identificó en marzo de 2014. El seguimiento de los cambios genéticos de VE durante la epidemia actual han mostrado cambios consistentes con la tasa esperada de mutación durante un período prolongado de transmisión interhumanos, sin que existan datos de que la variante Makona haya aumentado su virulencia o transmisibilidad o se hayan producidos sucesivas transmisiones desde el reservorio animal5.
El número aproximado de afectados por EVE en África Occidental en el momento de escribir este artículo asciende a 28.220, con 11.291 fallecidos6. La enfermedad ha afectado a 881 trabajadores sanitarios, de los cuales 513 fallecieron. Además de Guinea Conakry, Liberia y Sierra Leona, la epidemia se extendió a Nigeria, Mali y Senegal debido a la migración de personas afectadas. Afortunadamente Nigeria, Mali y Senegal pudieron contener precozmente la epidemia. En España y en Estados Unidos se han producido casos secundarios en personal sanitario que atendió a pacientes con EVE: una auxiliar de enfermería y 2 enfermeras, respectivamente7,8. La tasa de mortalidad en pacientes hospitalizados en África, dependiendo de la cohorte analizada, ha variado entre el 43 y el 74%9-11.
Probables causas de la magnitud de la epidemia actualLos 3 países mayoritariamente afectados están al final de las lista del índice de desarrollo humano de la ONU y tienen sistemas sanitarios completamente insuficientes12. Esta situación de pobreza, junto a la densidad de población, la porosidad de las fronteras y los ritos funerarios, que favorecen la transmisión del VE, se han invocado como las causas fundamentales de la magnitud del brote actual.
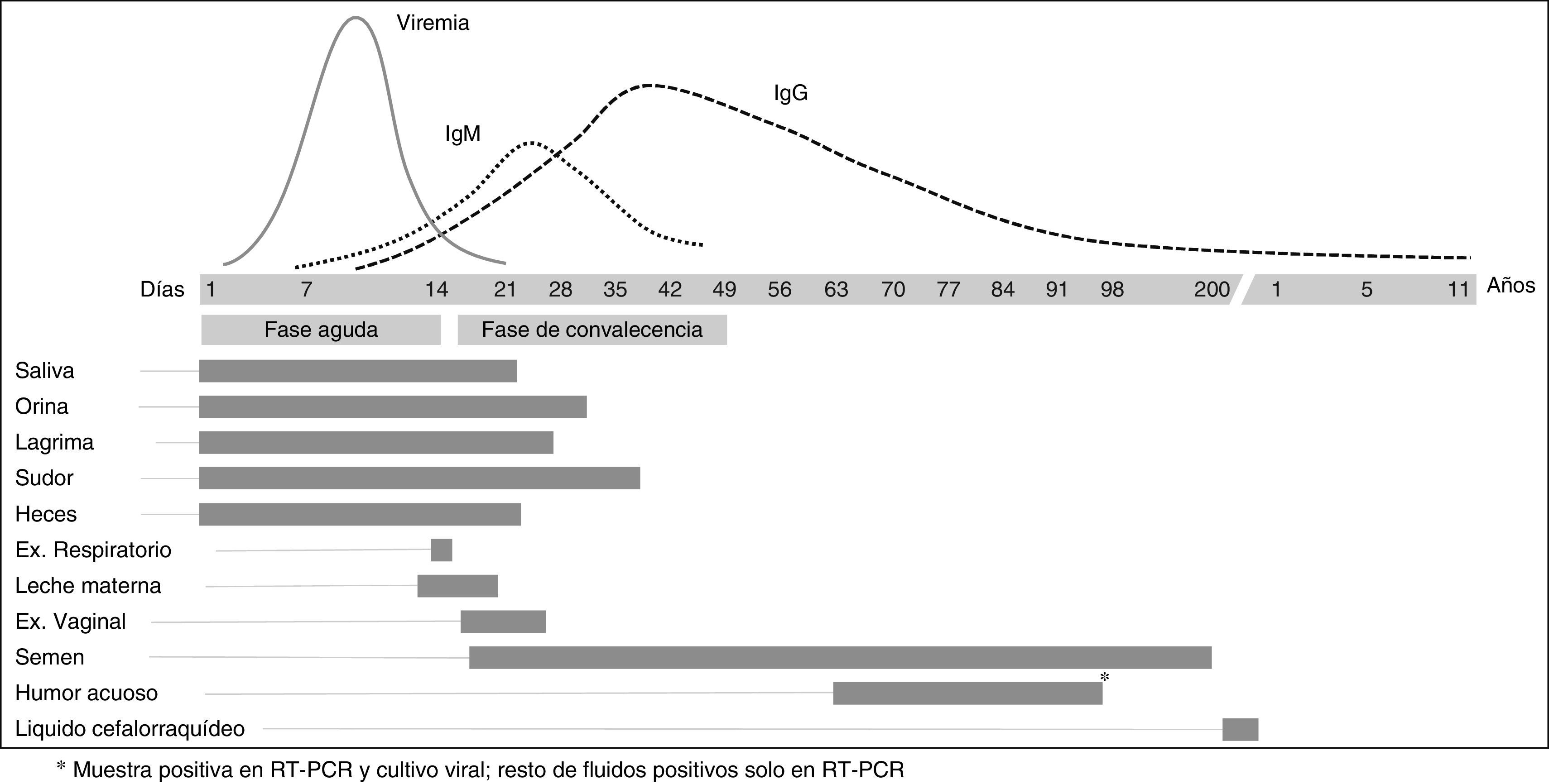
TransmisiónDespués de que se produzca la primera infección humana desde un animal infectado, la vía principal de transmisión es por contacto directo con pacientes o con fluidos orgánicos infectados13. El VE ha podido cultivarse a partir de muestras de saliva, leche materna, orina, humor acuoso y semen de pacientes infectados. Además, mediante PCR se ha podido detectar ARN viral en heces, lágrimas, sudor, orina y exudados rectales, conjuntivales y vaginales (fig. 1). Antes de la epidemia actual se sabía que los hombres infectados podían excretar VE viable o ARN viral en su semen hasta 82 y 101 días, respectivamente, después del comienzo de la enfermedad, aunque la posible transmisión sexual había sido comunicada solo en un caso con virus Marburg, no VE. Durante la epidemia actual se ha descrito un caso de posible transmisión sexual de EVE en una mujer en Liberia cuyo único factor de riesgo fue relaciones sexuales con un hombre en cuyo semen se pudo detectar ARN viral 199días después del comienzo de su enfermedad14. Debido a casos como este, y hasta que no exista mayor conocimiento de los riesgos, la OMS recomienda abstinencia sexual y/o uso de preservativo hasta 6meses después del comienzo de la EVE o hasta que la PCR en semen para VE haya sido negativa en 2 ocasiones consecutivas15.
La transmisión a través de fómites puede suceder, aunque parece que la contribución de este mecanismo es pequeña. Varios estudios han demostrado que los Filoviridae pueden sobrevivir en superficies sólidas —y sobre todo líquidas— durante varios días o semanas16. No se ha demostrado la transmisión a través de la ingesta de agua o alimentos, pero sí mediante la manipulación de animales infectados que van a ser ingeridos.
Hasta el momento actual no se ha podido verificar la transmisión respiratoria a través de gotas o aerosoles de partículas pequeñas entre humanos. Aunque el contagio a través de los aerosoles que genera una persona infectada se considera biológicamente plausible, el consenso actual es que este mecanismo no es responsable de la transmisión entre humanos en la mayoría de los casos. Hacen falta más estudios para concretar la importancia de la posible transmisión aérea, especialmente en el contexto de unidades donde se realicen intervenciones susceptibles de generar aerosoles tales como la intubación y la ventilación mecánica13.
Durante la epidemia actual ha seguido verificándose que la transmisión entre humanos de VE no ocurre por contagio desde personas asintomáticas durante el periodo de incubación o cuando el paciente empieza a desarrollar los primeros síntomas. Los casos de transmisión secundaria en Madrid y en Dallas permanecieron en la comunidad durante los primeros días de enfermedad sin producir nuevos contagios8,17. El mayor riesgo de transmisión se produce a medida que el paciente se hace más sintomático, simultáneamente con el incremento de la viremia y sobre todo cuando el paciente sufre diarrea, vómitos o sangrados copiosos. A partir de episodios de transmisión desde un único paciente a numerosos casos secundarios se ha postulado que algunos pacientes infectados se pudieran comportar como «supertransmisores», aunque sus características aún no están bien definidas13.
Aspectos virológicosEl VE es un virus pleomórfico con envuelta. Su material genético, ARN de polaridad negativa y 19kb de longitud, consta de 7 unidades de transcripción18,19.
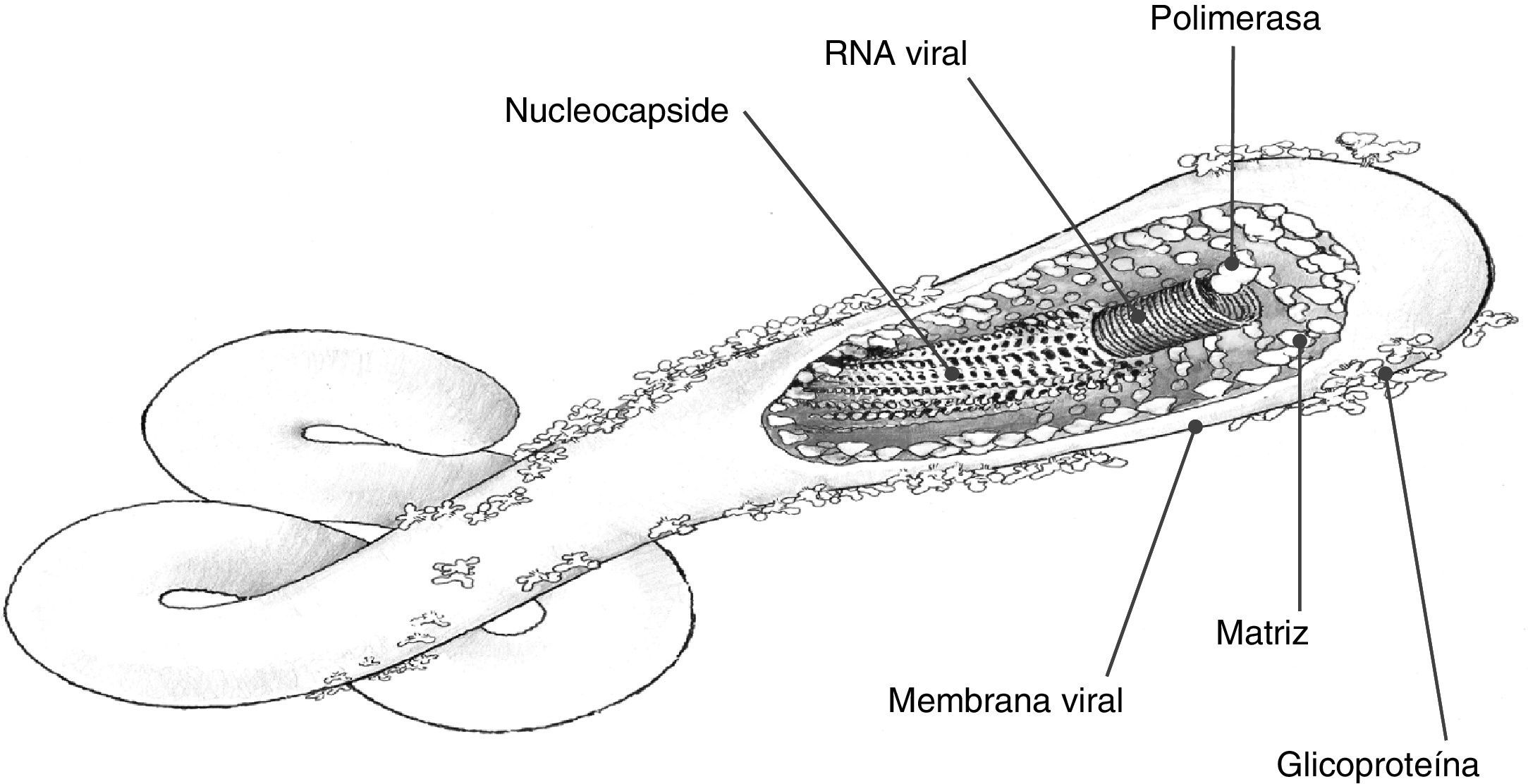
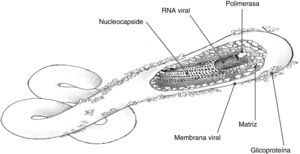
Estructura viralEl ARN forma un complejo junto a nucleoproteínas virales (NP), proteínas virales (VP) de codificación VP35, VP30 y la proteínaL (large protein, componente enzimático de la ARN-polimerasa). Una envuelta lipídica con glucoproteínas (GP) rodea la nucleocápside (fig. 2). La envuelta exterior se forma en el momento de la salida del virus a partir de elementos de la membrana plasmática de la célula. Contiene GP que se encargan del acoplamiento y de la entrada19. Dos subunidades, GP1 y GP2, están unidas entre sí por bandas disulfuro. Entre las 2 subunidades forman un cáliz, donde la GP1 sería la copa y la GP2 la base. Además, la superficie externa de esta membrana contiene fosfatidilserina, importante para la entrada en la célula huésped. Entre la nucleocápside y la cara interna de la envuelta existe una matriz de proteínas VP40 y VP24 que proporcionan soporte estructural.
Ciclo viralEl cáliz GP1-GP2 está protegido de los anticuerpos neutralizantes del huésped por moléculas de glucanos y dominios mucínicos. Unas proteasas, las catepsinasL y B, retiran estas moléculas protectoras en el momento de la unión del VE con la célula y queda expuesto el dominio de ensamblaje al receptor de la GP1. A continuación el virus interacciona con la célula a través de 2 receptores no específicos: lectinas tipoC, que interaccionan con las GP, y receptores de fosfatidilserina, que interactúan con la fosfatidilserina de la envoltura viral19.
La internalización del VE se realiza mediante macropinocitosis, y es transportado en endosomas. Una vez en el interior de la célula, el dominio de ensamblaje al receptor se une al receptor lisosomal de Niemann-Pick C120 para facilitar la salida del virus del lisosoma al citoplasma, donde la ARN-polimerasa dependiente de ARN produce ARNm que codificará las proteínas virales, comenzando la replicación y la transcripción viral.
PatogeniaDaño celular y tisularEl VE es un virus pantrópico que solo respeta a algunos subtipos celulares, notablemente los linfocitos. Ataca y escapa precozmente de la actividad del sistema fagocítico mononuclear. Hay replicación activa en el interior de los macrófagos y células dendríticas, liberándose al espacio extracelular nuevos virus que son capaces de una temprana invasión de ganglios linfáticos y bazo21.
Las células dendríticas son el enlace entre la inmunidad innata y la adquirida. La replicación viral en su interior bloquea su maduración, resultando células dendríticas ineficaces para activar a las célulasT, lo que explicaría en parte la inmunodepresión inducida por el VE. En este proceso la VP35 tiene un papel importante. Los hepatocitos también son afectados en esta fase temprana.
Posteriormente el VE se disemina a fibroblastos de diferentes tejidos y se facilita su expansión a otras poblaciones celulares. Por tanto, se alcanzan viremias elevadas. La replicación masiva desencadena una gran respuesta sistémica con liberación de sustancias pirógenas y quimiotácticas que atraen células proinflamatorias y elementos como citoquinas, factores tisulares o el interferón (IFN) que aumentan la permeabilidad vascular y la vasodilatación. Las GP y la VP40 también activan el sistema endotelial, lo que, sumado a la liberación del factor tisular desde los macrófagos así como la afectación hepática, contribuye al proceso de coagulopatía.
El daño celular alcanza múltiples poblaciones: células endoteliales del sistema nervioso central, células corticales de las glándulas adrenales, sistema digestivo tanto por el daño sobre células epiteliales y glandulares como por las sustancias liberadas en la respuesta proinflamatoria. La diarrea parece tener un mecanismo secretor y un mecanismo inflamatorio según datos autópsicos, donde se ha observado inflamación en la lámina propia intestinal.
Se ha observado un amplio rango de fenotipos de patogenia no asociados a mutaciones virales, lo cual sugiere que la respuesta del huésped influye sobre el desarrollo de la enfermedad. Rasmussen et al.22 han demostrado que determinadas variabilidades genéticas de roedores infectados con VE presentaban menor gravedad y viremia. En las poblaciones de roedores susceptibles el virus mostraba mayor tropismo por hepatocitos, y en las poblaciones más resistentes, por células endoteliales y de Kupffer. Así mismo, determinadas características genéticas en las células esplénicas acelerarían las cascadas proinflamatorias y la extensión al resto de órganos linfoides.
Respuesta inmuneAunque el VE activa tanto el sistema inmunitario innato como el adaptativo, la interacción virus-huésped reduce la respuesta inmune innata facilitando que las células sean infectadas.
El IFN es fundamental en la respuesta inmunitaria innata antiviral, ya que bloquea la internalización y la replicación del virus. El IFN es codificado por un gen IFNb y por múltiples genes IFNa, activados mediante cascadas citoplasmáticas, como la vía RLR (RIG-I-like receptor). El VE interfiere a múltiples niveles con la producción de IFN. La VP35 de VE bloquea el ARN bicatenario que interviene en la cascada RLR de producción de IFN. La proteína VP24 de VE bloquea la vía Jak-STAT, altamente implicada en la regulación del sistema inmune. El IFN induce la proteína transmembrana teterina, que inhibe la liberación de los virus con envuelta. Las GP de EV interfieren con la acción de la teterina. La VP35 de VE y componentes proteicos de cascadas de activación intracelulares (PACT, uORFs), que se modulan en respuesta al estrés celular, podrían mediar para esquivar el sistema inmune y facilitar la síntesis del ARN viral.
ClínicaLa mayoría de los infectados tienen entre 15 y 44años10. El periodo de incubación de EVE es de 2-21días1. Durante la epidemia actual se han reportado períodos de incubación en series africanas de entre 6 y 12días, con una media de 11,4días10,11. El 95% de los pacientes empezaron con síntomas durante los 21días siguientes al contacto, que sigue siendo el período de seguimiento recomendado tras un contacto, aunque algún autor ha planteado que excepcionalmente podría ser superior23.
Síntomas y signosDurante la epidemia actual se han visto grandes variaciones en cuanto a la gravedad de la EVE, la forma de presentación y la duración de los síntomas9,10,11,24-26, pero esquemáticamente se pueden distinguir cuatro fases clínicas27:
- 1.
Fase inicial, febril: predominan síntomas inespecíficos, como fiebre, malestar general, astenia y mialgias. La aparición de la fiebre coincide con el aumento de la viremia. Habitualmente se mantiene hasta el tercer día de enfermedad.
- 2.
Segunda fase, gastrointestinal: aproximadamente desde el día 3 al 10, caracterizada por dolor epigástrico, náuseas, vómitos y diarrea; puede persistir la fiebre, astenia, cefalea, inyección conjuntival, odinofagia, exantema, dolor torácico, artralgias, mialgias, hipo y hasta desorientación. Las pérdidas digestivas a través de vómitos y diarrea, sumadas a las pérdidas por transpiración, pueden ocasionar complicaciones graves.
- 3.
Tercera fase, entre el día 7 y 12 de enfermedad, en la cual el paciente se encamina hacia la recuperación o hacia el shock. En el primer supuesto existe una mejoría del paciente. En el segundo, el paciente comenzaría con deterioro del nivel de conciencia que puede acabar en coma, oliguria, anuria, taquipnea, pulso rápido y filiforme y muerte.
- 4.
Cuarta fase de complicaciones tardías. Es a partir del día10 cuando pueden aparecer hemorragias gastrointestinales, las infecciones secundarias, la menigoencefalitis o las alteraciones neurocognitivas.
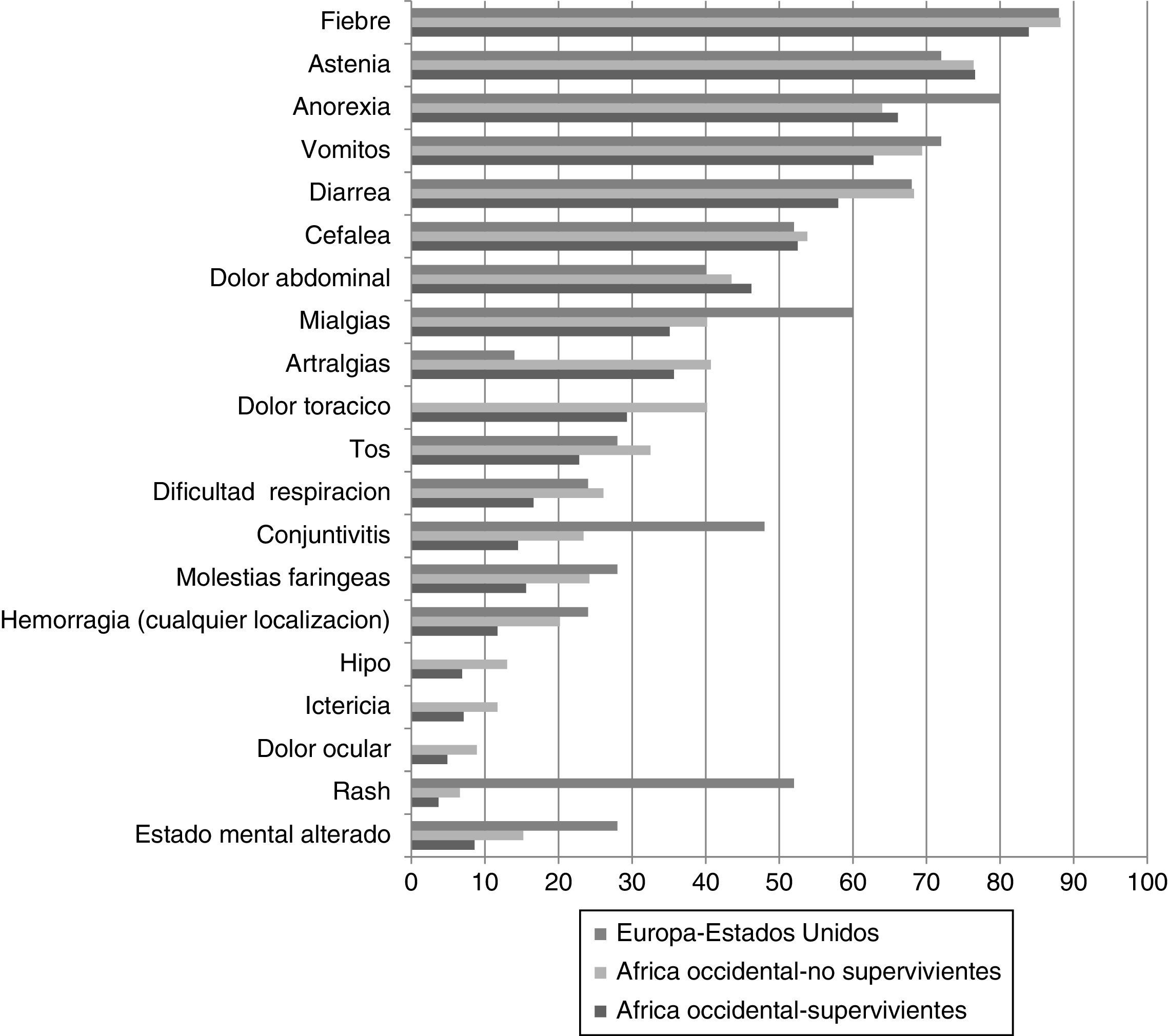
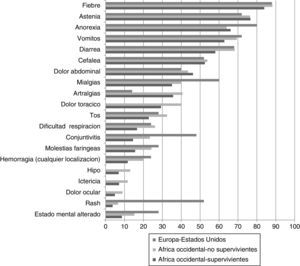
Los estudios realizados en África Occidental durante la epidemia actual confirman9,10,11,24-26 que los síntomas más frecuentes son la fiebre (84-89%), la astenia (66-76%), los vómitos (55-68%), la diarrea (44-66%), la anorexia (38-64%), el mareo (60%), la cefalea (53%), el dolor abdominal (32-44%) y las mialgias y artralgias (18-39%) (fig. 3).
Síntomas y signos en pacientes con enfermedad por virus ebola.
Nota: Datos de África occidental tomados de los compilados por WHO en los 9 primeros meses de la actual epidemia (13), separados según mortalidad (supervivientes: 359 y no supervivientes: 1056). Datos de los primeros 24 pacientes atendidos en Europa y Estados Unidos: comunicación personal, Dr T Uyeki.
Como puede observarse, los síntomas más comunes son muy inespecíficos. Lado et al.25, en un estudio retrospectivo realizado en Sierra Leona han comunicado que la combinación de 3 o más síntomas (astenia intensa, confusión, conjuntivitis, hipo, diarrea o vómitos) aumentó más de 3 veces la probabilidad de EVE confirmada por PCR. Resulta preocupante que en su estudio los criterios de definición de caso de la OMS tuvieron una baja sensibilidad y especificidad: 79,7 y 31,5%, respectivamente28.
En contraste con brotes previos y sin que exista una explicación convincente, las manifestaciones hemorrágicas (inyección conjuntival, sangrado nasal, sangrado en zona de inserción del catéter, hematuria, hematoquecia…) se han observado con menor frecuencia (18% de los casos) y raramente han sido graves10. Por este motivo durante esta epidemia hablamos de EVE y no de fiebre hemorrágica por VE.
Hallazgos de laboratorioLos hallazgos más frecuentes en pacientes atendidos en África son anemia, leucopenia o leucocitosis, linfocitosis, trombocitopenia, prolongación del INR, aumento de la creatinina y de la urea plasmática, aumento marcado de las transaminasas, fosfatasa alcalina y amilasa, ligera elevación de la bilirrubina, aumento marcado de la CPK, hipoalbuminemia, hiperlactacidemia y alteraciones hidroelectrolíticas, como hipopotasemia, hiponatremia, hipomagnesemia o hipocalcemia26. En los pacientes individuales tratados en el mundo desarrollado las alteraciones de laboratorio reportadas han sido similares7-35.
Hallazgos virológicosEn los pacientes atendidos en el mundo desarrollado se ha realizado determinación diaria de viremias por VE. El pico máximo de viremia se suele ver los días 8 y 9 de enfermedad (fig. 1). La viremia suele aclararse a partir del día 16-17 de enfermedad7,29-35. Durante esta epidemia se ha estudiado la posible permanencia del virus en fluidos corporales una vez negativizada la PCR para VE en sangre. En la mayoría de los fluidos en los cuales la detección de ARN de VE por PCR fue positivo (saliva, conjuntiva, heces, orina, sudor, semen y secreción vaginal), el cultivo viral fue negativo7. En un paciente sí se ha aislado virus viable en orina 9días después de la negativización de PCR en sangre32.
Factores pronósticosLa actual epidemia ha permitido conocer factores pronósticos clínicos, analíticos y virológicos relacionados con la mortalidad. En África la muerte se suele producir entre los días7 y 10 de enfermedad, principalmente por shock y/o encefalopatía10,11. Hay 2 factores estrechamente relacionados con el pronóstico de la enfermedad: la edad y la carga viral en sangre. A mayor edad y mayor carga viral, mayor mortalidad9,10,11,26 (tabla 1). En un estudio realizado en Sierra Leona se observó una mortalidad del 57% entre los menores de 21años, comparado con la mortalidad del 94% entre los mayores de 45años. En cuanto a la viremia, cifras menores a 100.000copias presentaban una mortalidad del 33% comprado con los que tenían una carga viral mayor de 107 copias por mililitro, que fallecían en el 94% de los casos11. El descenso rápido de la carga viral también se ha identificado como marcador de buen pronóstico36. Respecto a los datos analíticos, la presencia de insuficiencia renal26,36 y el aumento marcado de transaminasas también se asocian a mayor mortalidad26.
Factores de riesgo de mortalidad
| Clínicos |
| Edad mayor de 45 años |
| Disnea y taquipnea al comienzo de la enfermedad |
| Diarrea |
| Presencia de hemorragia |
| Mialgia |
| Debilidad |
| Mareo |
| Mayor fiebre |
| Presencia de hipo |
| Analíticos |
| Viremia elevada |
| Alteraciones hematológicas: hemoconcentración, leucocitosis |
| Insuficiencia renal |
| Alteraciones hidroelectrolíticas |
| Elevación de transaminasas |
| Rabdomiólisis |
| Elevación de PCR |
Un factor de buen pronóstico sería el acceso a cuidados intensivos en hospitales bien equipados. La diferencia de mortalidad apreciada entre los pacientes atendido en EU-US (21,7%, comunicación personal Dr. Tim Uyeki) y África occidental (43-74%) puede estar en relación al mayor acceso de los primeros al tratamiento intensivo de soporte9,10,11.
Evolución y convalecenciaTras el brote de ebola Bundibugyo de 2007, en Uganda se había descrito en supervivientes una mayor frecuencia de alteraciones oculares (dolor retroorbital y visión borrosa), pérdida de audición, alteraciones neurológicas, trastornos del sueño, artralgias, pérdida de memoria y otros síntomas constitucionales37. Tras el brote de Kikwit (ebola Zaire) en 1995 se describieron complicaciones oftalmológica tardías —uveítis— en 4 pacientes38. Los aún escasos estudios de supervivientes de la epidemia actual han descrito anorexia, artralgias, mialgias, lumbalgia39 e hipotiroidismo autoinmune7. Se ha descrito un paciente que después de 9semanas del aclaramiento de viremia en sangre presentó una uveítis anterior unilateral izquierda, con PCR positiva y cultivo de virus viable en humor vítreo pero con PCR en conjuntiva y lágrima negativas40.
DiagnósticoTécnicas molecularesEn la actualidad, el diagnóstico de la EVE se basa en la detección del genoma viral mediante la reacción en cadena de la polimerasa (PCR) precedida de un paso de retrotranscripción, que copia el ARN viral en ADN. En el momento actual no hay una técnica estandarizada —existen técnicas comerciales y «caseras»—, y se desconocen su sensibilidad y su especificidad41. Ante un resultado positivo, se recomienda secuenciar el fragmento amplificado o realizar una amplificación adicional en otra región genómica, para descartar que se trate de una contaminación cruzada o de una amplificación inespecífica. Hay que tener en cuenta la variabilidad genética del virus, y por tanto las técnicas deben ser capaces de detectar VE incluso en presencia de mutaciones41.
La cuantificación de la carga viral de VE se realiza sobre una curva patrón que se obtiene ensayando muestras cuyo contenido en ARN viral se conoce de antemano. La interpolación del resultado obtenido sobre la muestra del paciente en esa curva patrón permite estimar la carga viral presente. En el momento actual la RT-PCR cuantitativa para determinar el nivel de viremia no está estandarizada, e incluso falta consenso entre la equivalencia de ciclos de PCR y copias por mililitro.
Se recomienda no descartar la EVE hasta disponer de una PCR negativa que se haya realizado al menos 72h después del comienzo de los síntomas de la enfermedad. Durante los 3primeros días de la EVE la viremia puede ser todavía demasiado baja y se pueden producir falsos negativos. Y al contrario, recientemente se ha comunicado el caso de una mujer embarazada que ingresó con rotura precoz de membranas, sin ningún otro síntoma, cuya PCR para VE fue positiva hasta en 2 ocasiones antes de mostrar síntomas compatibles con EVE y que sí surgieron al tercer día de hospitalización42.
Detección de antígenoSu principal atractivo podría ser el diagnóstico rápido. Recientemente se ha desarrollado un test antigénico rápido que detecta en suero extraído de muestra de sangre capilar la VP40 (ReEBOV). En un primer estudio, comparando con la técnica de PCR habitual, muestra buenos resultados, si bien es cierto que tendría limitaciones en fases muy tempranas de la enfermedad y que necesita refrigeración. No obstante, poder hacer el diagnóstico en sangre capilar y en el mismo punto de cuidado reduciría el riesgo de exposición para el personal sanitario y acortaría los tiempos diagnósticos en zona de epidemia43.
SerologíaAunque la serología no es útil para el diagnóstico de la EVE en su fase aguda, podría tener interés para el diagnóstico retrospectivo en áreas de epidemia, como posible marcador de buen pronóstico (desarrollo de IgM específica) y para conocer la respuesta frente a futuras vacunas.
CultivoUtilidad limitada por la necesidad de un laboratorio de bioseguridad nivel 4 (no disponible en España). Aunque el tiempo de crecimiento lento (más de 14días) invalida la técnica para la toma de decisiones clínicas en tiempo real, puede resultar de interés para conocer si la excreción residual de VE (RT-PCR positiva en fluidos) en convalecientes de EVE se traduce en algún riesgo de trasmisión (cultivo viral positivo) o no
Diagnóstico diferencialEl diagnóstico diferencial se basa en criterios clínicos, siempre acompañados de criterios epidemiológicos. Los síntomas iniciales de la EVE son inespecíficos y coinciden con los de otras enfermedades, como malaria, gripe, diarrea del viajero, fiebre tifoidea o meningitis. Entre las denominadas fiebres hemorrágicas, cabría diferenciar de fiebre amarilla, fiebre de Lassa, fiebre del Valle del Rift y Marburg.
TratamientoA día de hoy no hay tratamientos específicos que hayan demostrado eficacia (tabla 2). La mortalidad de los pacientes atendidos en el mundo desarrollado ha sido de aproximadamente el 22%44, claramente menor que en África. Esta mejor supervivencia no puede atribuirse a un tratamiento experimental específico, puesto que los pacientes han recibido fármacos experimentales muy diferentes. El único factor terapéutico común de los pacientes del mundo desarrollado es que todos han recibido tratamiento de soporte basado fundamentalmente en la reposición hidroelectrolítica agresiva y en prevenir las complicaciones del shock.
Tratamientos experimentales para EVE priorizados por OMS
| Grupo terapéutico | Fármaco | Diana | Administración | Fase | Comentarios |
|---|---|---|---|---|---|
| Análogos de nucleósidos | Favipiravir (T-705) | ARN-polimerasa | Oral | II | Fármaco antiinfluenza. Datos preliminares en humanos no permiten afirmar su eficacia. Podría ser eficaz en fases precoces de EVE |
| Brincidofovir | Desconocida (inhibidor de ADN polimerasa) | Oral | II | Ensayo clínico suspendido por falta de eficacia. No continúa desarrollo para EVE | |
| BCX4430 | ARN-polimerasa | Intramuscular | I | Ensayo clínico de seguridad en humanos | |
| Moléculas silenciadoras del ARN y oligómeros antisentido | TKM-100802 (si ARN) | ARN de interferencia que silencia genes | Intravenoso | II | Ensayo clínico en humanos suspendido por baja probabilidad de mostrar eficacia |
| Inmunoterapia | Cocktail de 3 anticuerpos monoclonales (ZMapp) | GP1, GP2 y glucanos del complejo | Intravenoso | II | Ensayo clínico multicéntrico en marcha |
| Suero de convaleciente | GP1, GP2 | Intravenoso | II/III | Varios ensayos clínicos en marcha | |
| Otros | FX06 | Péptido usado contra el aumento de la permeabilidad capilar | Intravenoso | Uso compasivo. No datos de eficacia | |
| Amiodarona | Desconocida | Oral, intravenoso | Observacional | No ensayos clínicos | |
| Interferones | Inmunomodulador | Subcutáneo | II | Ensayo clínico en humanos | |
| Atorvastatina+Irbesartán±Clomifeno | Desconocido | Oral | Eficacia desconocida. No ensayos activos | ||
| Amiodaquina | Desconocido | Oral | Eficacia desconocida. No ensayos activos |
Las alteraciones hidroelectrolíticas son muy frecuentes y precisan reposición acorde a los datos analíticos que se detecten. Se deben corregir la hiponatremia, la hipocalcemia, la hipopotasemia y la hipomagnesemia, que pueden ser muy frecuentes29. En las presentaciones de EVE llamadas «coléricas» con diarrea muy copiosa la necesidad de aporte hídrico diaria puede superar los 10l32. Hay que tener en cuenta que en algunos pacientes el aporte hidroelectrolítico puede verse complicado por edema agudo de pulmón, sobre todo si existe una aumento de la permeabilidad capilar («vascular leak syndrome»)30.
La translocación bacteriana debido a la intensa afectación intestinal en el EVE es un fenómeno frecuente, y se ha descrito bacteriemia por bacilos gramnegativos32. La cobertura antibiótica empírica para cubrir patógenos entéricos es una práctica habitual. Cuando los pacientes provienen de zona malárica debe instaurarse también el tratamiento antimalárico.
Como parte del tratamiento de soporte hay que incluir la oxigenoterapia, la analgesia y los antipiréticos. Al ser una enfermedad con alteraciones en los factores de coagulación, se suele dar preferencia al paracetamol sobre los antiinflamatorios no esteroideos. Las náuseas y vómitos pueden tratarse con metoclopramida, clorpromazina y ondansetrón45. Para la diarrea, aunque no hay ensayos clínicos específicos, se postula el empleo de loperamida por su función antisecretora y antiperistáltica46. Para la agitación y la confusión, la OMS recomienda diazepam.
Otras medicaciones que han sido utilizadas como tratamiento de soporte en África son la vitaminaK al momento del ingreso y sulfato de cinc24. Los hemoderivados se usan en caso de hemorragia y/o shock hemodinámico y/o hemoglobina inferior a 7mg/dl.
Cuidados críticosPor primera vez durante esta epidemia se han proporcionado cuidados críticos —canalización de vías centrales, intubación endotraqueal, ventilación mecánica y técnicas de depuración renal— a pacientes con EVE en el mundo desarrollado, y en las fases finales de la epidemia también en África Occidental. Proporcionar cuidados críticos a pacientes con EVE es una intervención de elevada complejidad que requiere una gran inversión en programación, recursos humanos y materiales y grados muy altos de entrenamiento47.
Los cuidados críticos aumentan el riesgo de contagio del personal sanitario, motivo por el que hay que extremar las medidas de precaución mediante la adherencia a estrictos procedimientos de trabajo. Aunque no hay datos en humanos que respalden la transmisión aérea de VE, los aerosoles generados durante la ventilación con presión positiva podrían incrementar el riesgo para los sanitarios. Otro reto añadido es la realización de las maniobras invasivas con los equipos de protección individual que dificultan la realización de los procedimientos. Hasta el momento los cuidados críticos a pacientes con EVE han sido realizados en unidades de aislamiento de alto nivel con equipos sanitarios altamente entrenados. El Instituto Nacional de la Salud de Estados Unidos ha realizado recomendaciones precisas sobre cómo llevar a cabo cuidados críticos en pacientes con EVE47.
Tratamiento antiviralAnálogos de nucleósidosFavipiravir (T-705). Es un antiviral de administración oral aprobado para el tratamiento de la infección por el virus influenzaA en Japón, que inhibe la ARN-polimerasa del virus e induce mutagénesis. Es activo también frente a otros virus ARN, como virus del Nilo Occidental, fiebre amarilla y Bunyaviridae48. Frente a VE ha demostrado eficacia in vitro y en modelo murino49. La dosis necesaria para tratar EVE es superior a la empleada para influenza. Los resultados del ensayo clínico JIKI sugieren que favipiravir podría ser eficaz en pacientes con EVE y cargas virales bajas, pero el diseño del estudio que empleó exclusivamente controles históricos no permite establecer conclusiones definitivas36. De forma experimental, se ha empleado en al menos 8 de los pacientes atendidos en EU-US, con tratamiento completo en 5 de ellos7,33 (tabla 2).
Brincidofovir. Es un conjugado lipídico del cidofovir con amplio espectro in vitro e in vivo contra virus ADN (adenovirus, poxvirus, herpesvirus). Aunque había demostrado capacidad in vitro contra VE, se desconoce su eficacia en humanos. Ha sido utilizado en casos individuales34. Recientemente la compañía anunció la suspensión del desarrollo de brincidofovir para EVE.
Moléculas silenciadoras del ARN y oligómeros antisentidoTKM Ebola. ARN de interferencia vehiculizado en nanopartículas lipídicas, cuya diana es el ARN para la polimerasaL, llamado TKM-100802, de administración intravenosa. Ha sido utilizado en pacientes individuales31 y en un ensayo clínico en Sierra Leona. Recientemente la compañía productora anunció la suspensión del ensayo, aparentemente por falta de eficacia.
InmunoterapiaSuero de convalecientes. Desde la epidemia de Kikwit de 1995, el suero de convalecientes de EVE se ha utilizado para tratar la enfermedad, aunque su eficacia no ha sido demostrada50,51. La OMS ha priorizado el estudio de esta intervención y ha emitido una guía orientativa sobre el uso del plasma o la sangre total de convaleciente. Se desconoce cuál es el mejor momento para efectuar la donación, porque no hay datos secuenciales de la evolución de la producción de anticuerpos neutralizantes en supervivientes de EVE52. Hay ensayos clínicos en marcha en Liberia y en Sierra Leona. Se ha empleado en varios de los pacientes expatriados a países desarrollados7,29. Nuestro grupo ha descrito un caso de posible lesión pulmonar aguda producida por transfusión de suero de convaleciente7.
Anticuerpos monoclonales. Otra alternativa es inmunoterapia con anticuerpos monoclonales. El Zmapp es un cóctel compuesto de 3 anticuerpos monoclonales recombinantes específicos contra VE, producido en plantas de tabaco modificadas genéticamente. Ha demostrado su eficacia en primates no humanos administrado incluso 5días después de la inoculación de una dosis normalmente letal de VE53. Ha sido utilizado en pacientes expatriados a países desarrollados29,31, y en la actualidad hay ensayos clínicos en marcha en África
Protección del personal sanitarioEquipos de protección individualTodas las medidas de prevención deben ir encaminadas a evitar el contacto directo con los fluidos de una persona infectada. El personal sanitario debe mantener una distancia de al menos un metro respecto al enfermo mientras no esté realizando tareas específicas, y debe utilizar siempre un equipo de protección individual (EPI), ventilado o no, que cubra íntegramente la piel y las mucosas.
Las recomendaciones sobre las características del EPI han ido evolucionando desde el comienzo de esta epidemia, sin que exista evidencia para recomendar un tipo u otro54. Independientemente de sus características técnicas, probablemente el factor de seguridad más importante sea la meticulosidad a la hora de la puesta y retirada del EPI, que siempre debe ser supervisada. La estructura física de la unidad en la que se atienden pacientes con EVE debe ser adecuada, y hay que limitar el tiempo que los trabajadores sanitarios pasan con el EPI puesto.
Profilaxis postexposiciónRecientemente se ha publicado un algoritmo para la evaluación del riesgo de la personas con exposición accidental a VE55. Para individuos con exposición de riesgo significativo se puede plantear profilaxis con favipiravir, Zmapp o vacuna VSV-ZEBOV56.
VacunasDurante la epidemia actual se han producido grandes avances en el desarrollo de una vacuna frente al VE. Se han utilizado 3 tipos de vectores
VSV-ZEBOVEsta vacuna utiliza el virus de la estomatitis porcina (VSV) modificado genéticamente, de forma que el gen de la glucoproteína de VSV ha sido sustituido por el gen de la glucoproteína de VE Zaire (Kikwit). VSV-ZEBOV recombinante es replicativo y causa una infección transitoria sistémica después de una inyección única56. Produce una respuesta inmune rápida. En un ensayo clínico reciente en Guinea57 VSV-ZEBOV fue altamente eficaz, confiriendo protección al 100% de los pacientes vacunados.
Ad3-ZEBOVEn este caso la glucoproteína de VE es presentada en el adenovirus 3 de chimpancé, que no es replicativo. Se ha demostrado que Ad3-ZEBOV induce inmunidad en voluntarios sanos58. Se ha intentado aumentar esta respuesta inmune mediante la utilización secuencial de un «booster» con una vacuna basada en una modificación del virus vaccinia Ankara. Hay ensayos clínicos en marcha en África
Advac/MVA-BNEl régimen consiste en 2 vacunas (prime-booster) también con adenovirus y virus vaccinia modificado. Se ha demostrado respuesta inmunológica en voluntarios sanos.
Adenovirus 5A diferencia de las vacunas anteriores, la vacuna basada en adenovirus5 expresa la glucoproteína de la cepa del virus actual (Makona) en lugar de la de 197659. La importancia de este hecho aún no se ha dilucidado, puesto que un estudio en primates ha demostrado que VSV-ZEBOV protege frente a la cepa actual60.
ResumenLa epidemia 2013-2015 de EVE en África Occidental ha cambiado para siempre nuestra perspectiva médica sobre la enfermedad. A partir de esta epidemia la EVE ya no volverá a ser considerada como un problema restringido a países africanos sino como un problema sanitario y de seguridad mundial. Los grandes avances en la terapéutica y la prevención que han ocurrido durante esta epidemia harán que probablemente estemos mejor preparados si un nuevo brote de similar magnitud vuelve a ocurrir.
FinanciaciónRed de Investigación Cooperativa en Enfermedades Tropicales RD06/0021/0000; RICET http://www.ricet.es/. Los financiadores no han tenido ningún papel en el diseño del estudio, la recolección de datos, la decisión de publicar o la preparación del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.