Introducción
El género Borrelia comprende las espiroquetas transmitidas por artrópodos. Además de los procesos de interés veterinario, estos microorganismos son responsables de dos enfermedades: la de Lyme o borreliosis de Lyme, que se transmite por garrapatas duras de la familia Ixodidae, y la fiebre recurrente, transmitida por garrapatas blandas de la familia Argasidae, y la forma epidémica de esta enfermedad, transmitida por el piojo del cuerpo (Pediculus humanus humanus).
La borreliosis de Lyme producida por B. burgdorferi sensu lato (B. burgdorferi en sentido lato o amplio, s.l.) es una enfermedad multisistémica en la que predominan las manifestaciones dermatológicas, reumáticas, neurológicas y cardíacas. Su característica principal es una lesión cutánea denominada eritema migratorio1. La fiebre recurrente se caracteriza desde el punto de vista clínico por ciclos de fiebre y apirexia1.
Tanto la borreliosis de Lyme como la fiebre recurrente se consideran enfermedades emergentes en Europa2.
Etiología de las enfermedades producidas porBorrelia
Las bacterias del género Borrelia pertenecen al orden Spirochaetales, que comprende las familias Spirochaetaceae, Serpulinaceae y Leptospiraceae3. Borrelia se engloba dentro de la familia Spirochaetaceae, y junto con Treponema, son los géneros de esta familia que engloban especies patógenas para el hombre. Las espiroquetas son organismos filamentosos, extraordinariamente largos y flexibles y con una forma característica en espiral. Al igual que el resto de las espiroquetas, Borrelia spp. posee un cilindro protoplásmico que se encuentra rodeado de forma consecutiva por la membrana citoplásmica y la envuelta externa. Los flagelos están anclados de forma subproximal en el cuerpo bacteriano y se sitúan en el espacio periplásmico. Son similares a las otras espiroquetas en longitud (3 a 30 μm) pero son más anchas (0,2 a 0,5 μm) y poseen normalmente entre 7 y 11 flagelos4, habiéndose descrito hasta 265. El genoma está compuesto por un cromosoma lineal, inusual en las bacterias, de aproximadamente 1 Mb y varios plásmidos tanto lineales como circulares. La relación de guanina-citosina oscila entre el 23 y el 32%6.
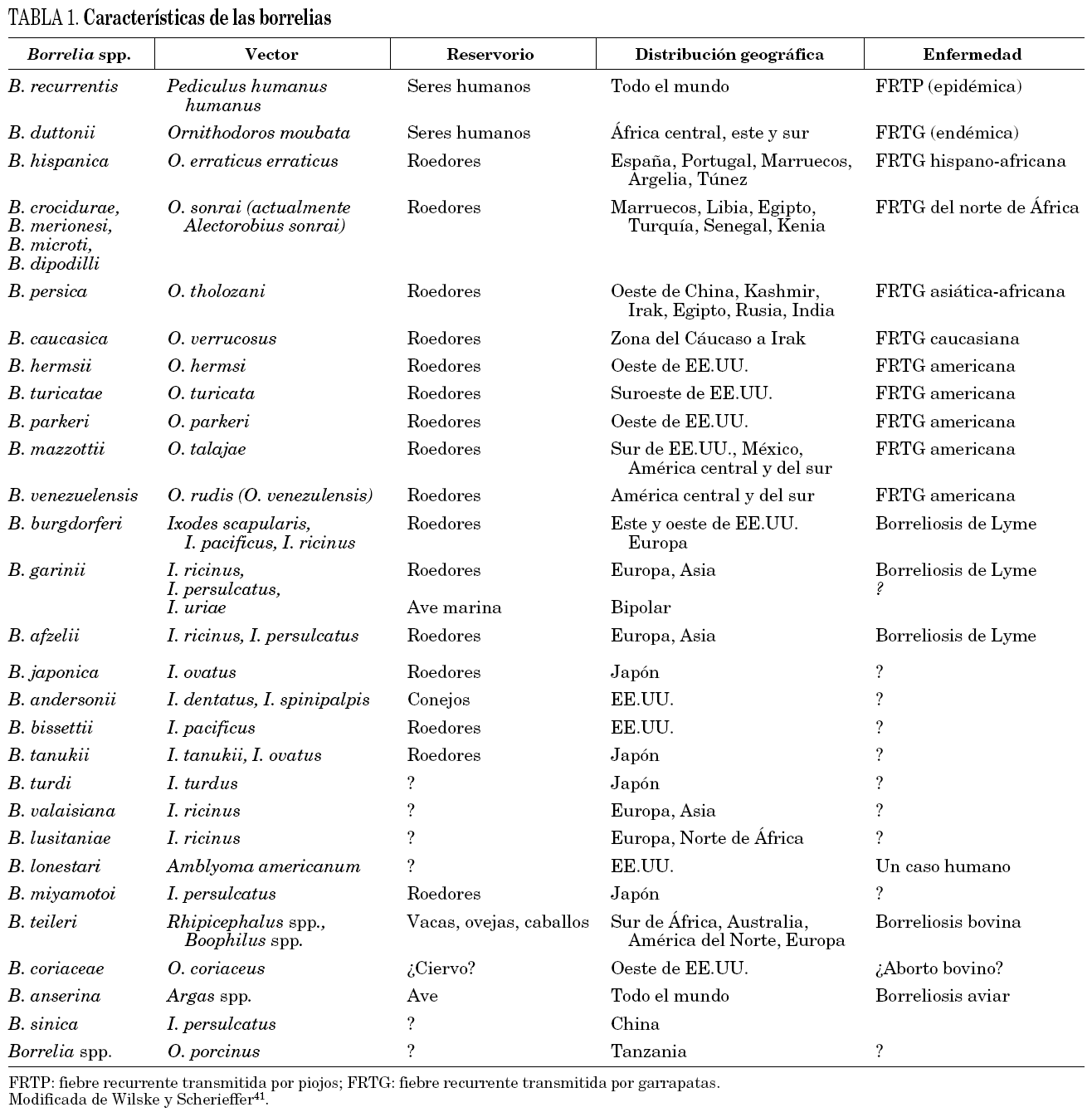
Las especies del género Borrelia son microaerófilas, móviles y se transmiten por medio de un vector artrópodo, característica fundamental que las distingue de las otras espiroquetas como Treponema y Leptospira. En la actualidad se han descrito casi 30 especies entre patógenos humanos y animales (tabla 1).
Agente etiológico de la borreliosis de Lyme
El agente causal de la borreliosis de Lyme fue descrito por Burgdorfer et al7 a principios de los años ochenta después de que en 1976 se iniciara en la localidad de Lyme (Connecticut, EE.UU.) un brote de lo que parecía artritis reumatoide juvenil. Algunas de las manifestaciones de la enfermedad se conocían con anterioridad en Europa bajo diferentes nombres (eritema crónico migratorio, síndrome de Bannwarth o acrodermatitis crónica atrófica). El aislamiento de una borrelia, a la que se llamó B. burgdorferi, a partir de ninfas de Ixodes scapularis y de pacientes con borreliosis de Lyme temprana, aclaró de manera definitiva la etiología de esta enfermedad.
En la actualidad, se conocen 11 genoespecies de B. burgdorferi s.l.8,4, de las cuales B. burgdorferi sensu stricto (B. burgdorferi s.s.), B. garinii y B. afzelii son las únicas, hasta el momento, claramente patógenas para el hombre4, si bien B. valaisiana ha demostrado su capacidad infectiva en un modelo animal9 y B. lusitaniae se ha aislado recientemente de una biopsia cutánea de un paciente con infección cutánea crónica10. El principal vector de la borreliosis de Lyme en Europa es I. ricinus, y cinco de las 11 genoespecies están presentes en este continente (B. burgdorferi s.s., B. garinii, B. afzelii, B. valaisiana y B. lusitaniae). En España, el primer aislamiento de B. burgdorferi s.l. se realizó a partir de I. ricinus en 199211. Aunque la borreliosis de Lyme se conocía en nuestro país desde 1977, y desde entonces se habían publicado diferentes series de casos12,13, hasta 1998 no se realiza el primer aislamiento a partir de una muestra clínica de paciente con borreliosis de Lyme14.
El genoma completo de la cepa B31 de B. burgdorferi s.s. es de aproximadamente 1,5 Mb, y comprende un cromosoma lineal de 950 kb y 9 plásmidos circulares y 12 lineales4. Las características más importantes de este genoma residen en el gran número de secuencias que codifican lipoproteínas, incluyendo las proteínas de envuelta externa (Osp's, del inglés Outer Surface Proteins) OspA hasta OspF6, así como la elevada cantidad de los llamados seudogenes, o genes incompletos. Las borrelias de este grupo crecen en medio líquido Barbour-Stoenner-Kelly II15 a 30-34 °C en ambiente microaerófilo y se dividen cada 8-12 h durante la fase logarítmica de su crecimiento.
Agente etiológico de la fiebre recurrente
La fiebre recurrente tiene dos formas principales: la epidémica, transmitida por los piojos del cuerpo (FRTP), y la forma endémica, transmitida por garrapatas blandas del género Ornithodoros (FRTG) (tabla 1). La primera está producida por B. recurrentis, espiroqueta que fue aislada por primera vez en 1994, aunque ya se había descrito en 186716. Las especies de Borrelia causantes de FRTG deben su nombre, en algunos casos, al vector que las transmite. Así, B. turicatae, B. parkeri y B. hermsii son transmitidas por garrapatas Ornithodoros turicata, O. parkeri y O. hermsi, respectivamente. En otros casos esta asociación especie-vector está cuestionada, ya que si bien B. duttonii, B. crocidurae y B. hispanica están transmitidas por O. moubata, O. sonrai (actualmente Alectorobius sonrai) y O. erraticus, respectivamente, son capaces de adaptarse experimentalmente al piojo16. A excepción de B. crocidurae y B. hispanica, el resto de estas borrelias son cultivables, aunque en ocasiones necesiten condiciones especiales de crecimiento. Si bien todas las borrelias causantes de fiebre recurrente están transmitidas por garrapatas blandas, recientemente se han descrito dos especies transmitidas por garrapatas duras: B. lonestari, transmitida por Amblyomma americanum en Estados Unidos, y B. miyamotoi transmitida por I. persulcatus y roedores en Japón. En España pocas han sido las descripciones de fiebre recurrente, aunque sí se conocen desde principios del siglo pasado asociadas con B. hispanica5. Recientemente se ha aislado en nuestro país una nueva especie de Borrelia causante de FRTG estrechamente relacionada con otras especies productoras de fiebre recurrente en el Viejo Mundo5.
Epidemiología
La borreliosis de Lyme es una zoonosis de distribución mundial con la mayor parte de los casos humanos descritos en el Hemisferio Norte4. En áreas endémicas de Estados Unidos se estiman entre 20 y 100 casos por cada 100.000 habitantes y año, siendo las especies encontradas B. burgdorferi s.s., B. andersonii y B. bissettii, si bien sólo la primera se ha aislado de pacientes17. En Europa, aunque la borreliosis de Lyme no se encuentra entre las enfermedades de declaración obligatoria (EDO), se estima que las mayores tasas de incidencia se alcanzan en Alemania, Austria, Eslovenia, Suecia y Escandinavia, pudiendo llegar a los 155 casos por 100.000 habitantes y año17. También se han descrito casos en Rusia, China y Japón, y no se consideran, sin embargo, endémicas para esta enfermedad Australia, África y América del Sur, así como el sur de Estados Unidos, donde sí se han detectado casos diagnosticados por serología pero sólo se ha aislado el agente causal a partir de vectores y reservorios, pero no de pacientes18. B. garinii y B. afzelii son las especies que con más frecuencia se aíslan en Europa, distribuyéndose a lo largo de todo el continente, mientras que B. burgdorferi s.s. se encuentra fundamentalmente en el oeste del mismo. En España, se ha aislado B. garinii a partir de muestras clínicas de pacientes, mientras que B. burgdorferi s.s., B. garinii, B. afzelii, B. valaisiana y B. lusitaniae se han cultivado de garrapatas9,19. Por otra parte, en España la borreliosis de Lyme no se considera una EDO, por lo que su incidencia real es difícil de determinar, aunque se podría estimar, tomando como fuente los casos diagnosticados por zonas y los datos de altas hospitalarias, en alrededor de 0,25 casos por 100.000 habitantes. En determinadas comunidades autónomas la incidencia es menor (como la gallega, valenciana o andaluza)20,21.
La fiebre recurrente se encuentra distribuida mundialmente, con excepción de zonas del sureste del Pacífico. La FRTP se presenta en forma de focos endémicos en zonas donde coinciden determinadas condiciones de pobreza, desintegración social por catástrofes y guerras, lo cual favorece la infestación por piojos. Por su parte, la distribución de FRTG está condicionada a la presencia de sus vectores, y está producida en Europa y África por B. crocidurae, B. hispanica y B. duttonii, mientras que en Estados Unidos los agentes causales son B. hermsii, B. parkeri y B. turicatae. La incidencia de FRGT en España es inferior a 0,2 por 100.000 habitantes y año, según los datos del sistema SIM, aunque probablemente está infravalorada por la baja sospecha de la enfermedad y la dificultad en el diagnóstico. La FRGT se detecta en algunas zonas como Andalucía, Castilla y León y Extremadura.
El reservorio de la FRTG lo constituyen los roedores (ratas, ardillas) y pequeños animales, además de las propias garrapatas por transmisión transovárica. La bacteria contenida en la sangre que sirve de alimento a la garrapata, se multiplica con rapidez y al cabo de horas invade todos los tejidos, incluyendo las glándulas salivales y otros órganos como el sistema genital de la garrapata. El pase transovárico de la espiroqueta a la descendencia de la garrapata es un mecanismo importante para la continuidad de la espiroqueta, ya que las garrapatas pueden sobrevivir hasta 15 años sin alimentarse. Las garrapatas del género Ornithodoros prefieren ambientes húmedos y templados y alturas entre 500 y 1.800 m. Su capacidad de movimiento es limitada, pero los roedores las transportan pasivamente. El hombre se infecta por la picadura o por la inoculación de líquido coxal de la garrapata infectada; su mordedura no es dolorosa y completan su alimentación de la sangre en 5-20 min.
Patogenia
Para mantener su ciclo enzoótico, B. burgdorferi tiene que adaptarse a diferentes ambientes. Entre las proteínas mencionadas anteriormente como Osp, OspA se expresa fundamentalmente durante el otoño, invierno y comienzo de la primavera, cuando la garrapata permanece inactiva22. Cuando ésta comienza a alimentarse a finales de primavera y verano, Borrelia expresa fundamentalmente OspC. De igual manera, B. hermsii aumenta la síntesis de otra lipoproteína, Vsp33 (también llamada VmpC), homóloga de OspC, lo que sugiere una función, común para estas proteínas, relacionada con la transmisión de las espiroquetas de la garrapata al hospedador vertebrado23.
La infección humana en la FRTG se produce a través de la saliva o excremento de la garrapata durante el tiempo que se alimenta en el humano. Tras un período de incubación de 4 a 18 días, aparecen los primeros síntomas de la enfermedad24. Borrelia spp. pasa al torrente sanguíneo y permanece durante los episodios febriles, desaparece durante los lapsos afebriles y queda secuestrada en diversos órganos. Cuando la espiroqueta pasa a la sangre se produce el episodio febril, que cesa tras la producción de anticuerpos específicos frente a la proteína variable de membrana de la Borrelia. Al producirse una nueva variante antigénica y replicarse, reaparece el episodio febril. La producción secuencial de anticuerpos específicos y nuevas variantes antigénicas determinan el curso recurrente de la fiebre. Con las recaídas sucesivas, las borrelias revierten a un contenido antigénico similar al presente en las primeras recaídas. La finalización de las manifestaciones clínicas se atribuye, primariamente, a la actividad humoral específica de anticuerpos más que a la de las células fagocíticas.
El mecanismo completo de evasión de la respuesta inmunitaria en las recurrencias de fiebre no se conoce con exactitud, ni tampoco se conoce cómo las espiroquetas alcanzan el torrente sanguíneo una vez que son inoculadas por el vector. Sin embargo, son bien conocidas las variaciones antigénicas que se producen en las lipoproteínas de envuelta externa Vmps (del inglés variable major proteins) una vez dentro del hospedador vertebrado. Los genes vmp, situados en plásmidos lineales de la bacteria, sufren recombinaciones interplasmídicas a la vez que mutaciones, lo que conlleva a variaciones en las proteínas que codifican, definiendo diferentes serotipos23. Algo similar sucede en la borreliosis de Lyme, donde una lipoproteína llamada VlsE experimenta una variación antigénica mediante recombinación durante las primeras fases de la enfermedad22.
En el caso de la borreliosis de Lyme, se conoce que una vez que la espiroqueta se encuentra en el hospedador vertebrado, ésta facilita su diseminación mediante su unión a plasminógeno y a activadores de plasminógeno17,22. La activación del complemento y la resistencia al suero también desempeñan un papel importante en la patogénica de la borreliosis de Lyme17. Las lipoproteínas expresadas durante la infección activan diferentes tipos celulares y desencadenan la respuesta inflamatoria. La enfermedad entonces cursa en estadios, con remisiones y exacerbaciones y diferentes manifestaciones clínicas en cada uno de ellos. No se ha encontrado, hasta el momento, explicación para la relación entre el bajo número de espiroquetas encontradas en tejido y la gravedad de la enfermedad en un estadio determinado, pero se sabe por estudios experimentales que las borrelias pueden permanecer en la piel durante largos períodos de tiempo sin causar enfermedad sistémica, a menos que se produzca una bajada de las defensas del hospedador22.
Sintomatología de la borreliosis de Lyme
B. burgdorferi s.l. determina la aparición de alteraciones inflamatorias que comienzan en la piel; semanas o meses más tarde, algunos pacientes desarrollan anomalías neurológicas o cardíacas y, por último, la enfermedad se puede expresar como una poliartritis migratoria, con ataques intermitentes de oligoartritis o artritis crónica, sobre todo de la rodillas25 (tabla 2).
El primer estadio o infección temprana localizada de la borreliosis de Lyme se caracteriza por el eritema migratorio y por síntomas gripales inespecíficos. La lesión se extiende de forma centrífuga, tiende a aclararse en el centro y adopta una disposición anular; suele superar los 5 cm de diámetro. El eritema migratorio es el mejor marcador clínico de la enfermedad y aparece dentro del mes de la exposición a zonas de hierbas, matorrales o bosque. Después de unos días o meses del eritema migratorio inicial aparecen las manifestaciones de la infección diseminada. Se encuentran eritemas anulares más pequeños en la mitad de los enfermos y anomalías neurológicas entre el 8 y el 63% de los casos.
En España predominan los síntomas neurológicos que presentan el 63% de los pacientes de nuestra serie12. La meningitis linfocitaria con neuritis craneal (en particular con parálisis facial periférica) o radiculoneuritis (síndrome de Bannwarth) es la anomalía más frecuente del sistema nervioso. La enfermedad se revela también como una polirradiculoneuropatía o polirradiculopatía axonal sensomotora crónica.
La artritis, en general intermitente, y, en menor proporción, crónica, aparece en la mitad de los enfermos no tratados. Se debe considerar la artritis de Lyme cuando hayan aparecido episodios de hinchazón articular en una o pocas articulaciones y no se disponga de otro diagnóstico alternativo. En España, se detectó sintomatología musculosquelética en casi la mitad de los enfermos diagnosticados por nosotros y la artritis aparecía en la cuarta parte de ellos26. El carácter intermitente, característico de la artritis de Lyme, se pierde para transformarse en mono u oligoartritis crónica (especialmente de rodilla) en el 10% de los que padecían episodios articulares. Sin embargo, no es típica de la enfermedad la artritis crónica progresiva no precedida de ataques intermitentes de artritis o la poliartritis crónica simétrica.
La expresión cardiológica más típica es el bloqueo fluctuante de diverso grado auriculoventricular de comienzo agudo que suele ser transitorio y resolverse en días o semanas, aunque en ocasiones es irreversible27. A veces se asocia a otras manifestaciones de miocarditis e incluso de pancarditis.
El linfocitoma, que se manifiesta preferente en lóbulos de la oreja o pezones, es una manifestación más del estadio de infección diseminada no tardía en la que se pueden encontrar manifestaciones tan distintas como musculosqueléticas (dolores migratorios sin artritis), neurológicas diversas aparte de las meningitis (neuritis motoras o sensitivas, encefalitis subaguda, mononeuritis múltiple, manifestaciones secundarias a desmielinización), linfáticas (lifadenopatía regional), oculares (conjuntivitis), hepáticas (hepatitis), respiratorias (tos, dolor faríngeo) o datos constitucionales (astenia). La infinidad de manifestaciones clínicas de la borreliosis de Lyme le ha valido el apelativo, al igual que lo tuvo la sífilis, de la "gran imitadora".
Entre las manifestaciones tardías de la infección o estadio de persistencia se encuentran la acrodermatitis crónica atrófica, lesiones cutáneas similares a escleroderma localizado, la artritis crónica, encefalomielitis crónica, paraparesia espástica, polirradiculopatía desórdenes mentales subagudos, marcha atáxica, etc. La acrodermatitis crónica atrófica aparece como una coloración violácea de una piel edematosa, que afecta sobre todo la porción distal de los miembros superiores; este aspecto puede persistir años pero conduce a la atrofia cutánea.
Manifestaciones clínicas de la fiebre recurrente
Las manifestaciones clínicas de la FRTG y de la FRTP son similares. Tras un período medio de incubación de 7-8 días aparece el primer episodio febril, que suele durar entre 3 y 5 días, con una duración media de apirexia cercana a una semana24,28,29.
La FRTP se caracteriza por episodios febriles con pocas recidivas (una o dos recaídas a diferencia de la fiebre recurrente endémica, que recidiva con mayor frecuencia). Se acompañan de escalofríos, cefaleas, mialgias, fotofobia y vómitos. Se encuentra con frecuencia hepatosplegomegalia y en ocasiones sufusión conjuntival o un exantema petequial. En una tercera parte de los casos se detecta afección neurológica y en una proporción similar, tos. En algunos pacientes se observan leucopenia y trombocitopenia.
Los episodios febriles duran entre 2 y 9 días y los intervalos entre episodios de unos 9 días de media, pero puede extenderse hasta 18 días. El número de recidivas febriles puede alcanzar los cinco, pero habitualmente son uno o dos. Los pacientes con FRTP padecen una enfermedad más grave que la ocasionada por la fiebre recurrente endémica.
Las variaciones clínicas de la FRTG se relacionan con las diferencias entre las cepas, inóculo bacteriano, inmunidad del huésped y condición general del paciente. Inicialmente, en los períodos febriles aparecen, de forma similar a la enfermedad transmitida por piojos, fiebre alta, cefalea, mialgias y artralgias. A menudo, se añaden erupción cutánea (con mayor frecuencia que en la FRTP) y hepatosplenomegalia (con menor frecuencia que en la FRTP). La erupción cutánea es de tipo macular, papular o petequial. En ocasiones, como en la FRTP, pero con menor frecuencia, también aparece afección del sistema nervioso central: coma, convulsiones, parálisis de pares craneales, hemiplejía y meningitis24. En los siguientes episodios febriles, la fiebre y el resto de manifestaciones clínicas van disminuyendo en intensidad. El número medio de recaídas es de tres, aunque puede alcanzar las 13.
Es frecuente la aparición de anemia, leucocitosis, elevación de la velocidad de sedimentación globular (VSG), alteración de la bioquímica hepática y renal. En los casos con afección neurológica se puede encontrar en el líquido cefalorraquídeo aumento de la presión, células y proteínas con glucorraquia dentro de la normalidad.
El diagnóstico diferencial de los episodios recidivantes debe efectuarse con la malaria y otras fiebres recurrentes (babesiosis, etc.). El diagnóstico clínico de fiebre recurrente epidémica se debe considerar en un paciente con fiebre al regreso de una región endémica, especialmente si se acompaña de ictericia, esplenomegalia, erupción cutánea, signos de hemorragia o meningoencefalitis o de fiebre recurrente sobre todo si no se detecta Plasmodium en sangre periférica30.
La leucopenia, trombocitopenia y elevación de las enzimas hepáticas junto a una prueba reagínica de serología luética (VDRL) falsamente positivo sugieren analíticamente el diagnóstico.
Diagnóstico de laboratorio de la borreliosis de Lyme
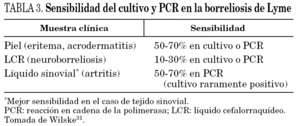
Excepto en los casos que presentan la manifestación patognomónica de la borreliosis de Lyme, el eritema migratorio, el diagnóstico de esta infección requiere la confirmación mediante métodos microbiológicos. En términos generales, el cultivo presenta una sensibilidad muy baja (alrededor del 30%) debido, entre otros factores, al bajo número de organismos presentes en las muestras, por lo que no se considera un método diagnóstico eficaz31. Por otra parte, la amplificación del ADN mediante reacción en cadena de la polimerasa (PCR), si bien tiene una eficacia probada en el diagnóstico de otras enfermedades, no la tiene en la borreliosis de Lyme. Varias han sido las dianas elegidas para su amplificación, como los genes plasmídicos ospA y ospB, el gen cromosómico que codifica la proteína flagelar, o los genes que codifican el 16S ARNr y el espacio intergénico 5S-23S ARNr31. En el caso de líquido sinovial en pacientes con artritis, la PCR tiene una buena sensibilidad31 (hasta el 70%, tabla 3). Las muestras de orina o sangre no se consideran recomendables en el diagnóstico por PCR de la borreliosis de Lyme.
La detección de anticuerpos es, por lo tanto, esencial para el diagnóstico microbiológico de la enfermedad. El esquema aceptado hasta la fecha, tanto por los CDC (Centers for Disease Control and Prevention, 1995)4 como por la Sociedad Alemana de Higiene y Microbiología (SAHM) (www.dghm.org/red/index.html?cname = MIQ), incluye un cribado mediante métodos con una buena sensibilidad y confirmación mediante immunoblot (IB). Cabe destacar que sólo entre el 30 y el 40% de los pacientes con eritema migratorio son seropositivos en la fase aguda, y hasta el 70% serán positivos en la fase convaleciente, de 2 a 4 semanas más tarde32. En la neuroborreliosis se produce una síntesis intratecal de anticuerpos. B. burgdorferi posee numerosos antígenos inmunodominantes y los anticuerpos que primero aparecen en el curso de la enfermedad van dirigidos a la proteína flagelar de 41 kDa, así como a OspC. Más tarde, como norma general, en el estadio II se dirigirán contra p39 y p58, OspA y OspB. Finalmente, en el estadio III, el repertorio de anticuerpos afecta a una gran variedad de proteínas (p83/100, p58, p43, p39, p30, p21, Osp17 y p14)32. En este estadio es rara la detección de anticuerpos IgG contra OspC. Sin embargo, sí pueden persistir anticuerpos de tipo inmunoglobulina M (IgM) contra esta proteína durante meses, incluso después de la recuperación del paciente.
ELISA
La variedad de métodos de enzimoabsorción ligada a enzimas (ELISA) disponibles actualmente en el mercado hace muy difícil su estandarización. Sin embargo, en principio un ELISA es válido si se trata de una prueba de segunda generación, es decir, si usa un extracto antigénico purificado o enriquecido de la bacteria31. Sin embargo, incluso en estos casos la heterogeneidad de las cepas circulantes en una determinada zona geográfica debe ser tenida en cuenta a la hora de elegir la mejor prueba de ELISA, por lo que la combinación de antígenos derivados de dos o más cepas puede ser una buena alternativa para obtener una buena sensibilidad. Recientemente se han descrito estudios de ELISA en los que se utilizan antígenos recombinantes (p. ej., VlsE) o péptidos sintéticos (p. ej., el C6 derivado del VlsE) con buenos resultados, sobre todo en casos con neuroborreliosis33, y que están diseñados para eliminar la necesidad de una segunda prueba de confirmación.
Immunoblot. El IB es la técnica de elección en la confirmación del diagnóstico de borreliosis de Lyme. Es imprescindible que el antígeno utilizado en caso de extractos lisados exprese los antígenos inmunodominantes OspC y Osp17. Diversos estudios demuestran que las recomendaciones dadas por los CDC para la interpretación del IB no son aplicables en Europa31. Además existen grandes discordancias entre los resultados obtenidos en distintos laboratorios debidas, entre otras razones, a la cepa utilizada en las técnicas serológicas. Los criterios adoptados por la SAHM recomiendan la utilización de la cepa PKo de B. afzelii, ya que ésta aporta al IB igual sensibilidad que la utilización de B. burgdorferi s.s. (PKa2) y B. garinii (PBi) y permite un criterio "dos bandas" para la IgG, es decir, al menos dos bandas positivas de entre las siguientes: p83/100, p58, p43, p39, p30, OspC, p21, Osp17 y p14 (tabla 4), requisito fundamental recomendado por la SAHM. En el caso IgM, para considerar un suero positivo debe aparecer reactividad frente, al menos, una banda de entre p41 (en este caso con gran intensidad), p39, OspC y Osp17. Recientemente se han desarrollado métodos de IB en los que se utiliza VlsE recombinante y homólogos de Osp17 que aumentan la sensibilidad del 52 al 86% en los casos de neuroborreliosis31. Por lo tanto, los nuevos IB recombinantes son prometedores para la estandarización y para lograr una mayor sensibilidad de las técnicas serológicas en el diagnóstico de la borreliosis de Lyme.
Finalmente, cabe destacar las reacciones cruzadas descritas entre B. burgdorferi y Mycobacterium tuberculosis, Rickettsia conorii, Bartonella henselae, Legionella pneumophila, Treponema pallidum, borrelias causantes de fiebre recurrente, virus de Epstein-Barr, virus de la inmunodeficiencia humana, artritis reumatoide, lupus eritematoso sistémico y esclerosis múltiple. Los resultados serológicos de la borreliosis de Lyme deben interpretarse siempre a la luz de los datos clínicos y epidemiológicos, con exclusión de otras enfermedades y teniendo en cuenta, en ocasiones, la respuesta del paciente al tratamiento34.
Diagnóstico de laboratorio de la fiebre recurrente
La observación directa de espiroquetas en sangre periférica es del 70% en los picos febriles de la enfermedad. Los microorganismos se pueden detectar en preparaciones frescas de sangre bajo microscopio de campo oscuro, o bien con tinciones de Wright o Giemsa, naranja de acridina o inmunofluorescencia. Por otra parte la serología, con técnicas de aglutinación y de fijación de complemento entre otras, no es útil, debido a los cambios antigénicos que las espiroquetas experimentan en las recurrencias de la enfermedad.
Tratamiento
Los tratamientos empleados con mayor frecuencia en la borreliosis de Lyme son la doxiciclina (primera elección) y amoxicilina (para niños y embarazadas) durante 14-21 días en las manifestaciones precoces localizadas o durante 1 o 2 meses en la artritis35,36.
La doxiciclina, en dosis de 100 mg, se administra 2 veces al día por vía oral en adultos. La cefuroxima axetilo, la amoxicilina con probenecida y los macrólidos son también efectivos en la enfermedad temprana (aunque los macrólidos son la cuarta elección para pacientes que no pueden recibir doxiciclina, la amoxicilina o la cefuroxima)37. Para el tratamiento de las manifestaciones neurológicas a excepción de la parálisis facial aislada (donde el tratamiento oral puede ser adecuado) o para el bloqueo auriculoventricular de alto grado (segundo o tercer grado), se prefiere la vía parenteral con ceftriaxona durante 2 a 4 semanas (o penicilina durante 4 semanas). La ceftriaxona se utiliza en dosis de 2 g, una vez al día. Para la artritis intermitente o crónica, la doxiciclina o amoxiciclina se emplean durante 30-60 días.
Los fracasos terapéuticos ocurren con cualquiera de los regímenes y puede ser necesaria una segunda tanda de tratamiento38. El tratamiento antibiótico no es efectivo en la fibromialgia o fatiga crónica asociada o desencadenada por la borreliosis de Lyme.
En el tratamiento de las fiebres recurrentes el tratamiento de elección es la tetraciclina, pero la penicilina, el cloranfenicol o los macrólidos son también efectivos24. Las tetraciclinas en una sola dosis (0,5 g) son el tratamiento de elección de la FRTP. En los niños menores de 8 años y mujeres embarazadas se utiliza la eritromicina en dosis única.
El tratamiento más adecuado de las FRTG es la doxiciclina, 100 mg cada 12 h (o tetraciclina 0,5 g cada 6 h) durante 5-10 días. Si el paciente vomita, las tetraciclinas se administran por vía intravenosa, aunque el riesgo de reacción de Jarisch-Herxheimer es mayor. En niños pequeños y mujeres embarazadas puede utilizarse la eritromicina, aunque se han descrito fracasos con los macrólidos. Otras posibilidades terapéuticas son la penicilina, las cefalosporinas de tercera generación o el cloranfenicol39. Cuando existe meningitis o encefalitis se recomienda la penicilina, la cefotaxima o la ceftriaxona por vía intravenosa durante al menos 14 días en la fiebre recurrente endémica.
La mortalidad de la FRTG se sitúa entre el 2 y el 5%, mientras que la de la FRTP se sitúa entre el 4 y el 40%, aunque la mortalidad de la enfermedad tratada es inferior al 5%.
La reacción de Jarisch-Herxheimer se ha descrito en infecciones producidas por espiroquetas después del tratamiento antibiótico, incluyendo la borreliosis de Lyme y la fiebre recurrente40. Se manifiesta con aumento de temperatura, leucopenia, taquicardia, taquipnea e hipotensión coincidiendo con la antibioterapia. Por ello se recomienda en las fiebres recurrentes mantener al paciente durante 2 h en observación después de iniciar el tratamiento.
Prevención y vigilancia epidemiológica
La FRTG, tras la entrada en vigor del Real Decreto 2210/1995, pasó a ser declaración obligatoria en zonas endémicas para aquellas comunidades autónomas que la tienen incluida en su lista de EDO.
Entre las medidas preventivas de las borreliosis se encuentra la educación a la población, respecto al modo de transmisión de estas enfermedades. La erradicación de la población de garrapatas de las áreas geográficas es imposible dada la gran variedad de hospedadores.
La prevención se centra en evitar en la medida de lo posible las zonas de garrapatas infectadas, el uso de repelentes aplicados a la ropa o piel y mediante el uso de ropa adecuada además del examen corporal para eliminar las garrapatas adheridas después de permanecer en zona habitada por garrapatas. La forma más adecuada para eliminar la garrapata es realizar con pinzas una tracción perpendicular a la piel suave y constante para evitar que el hipostoma de la garrapata quede introducido en la piel.
En la mayoría de las regiones españolas no está indicada la profilaxis con antimicrobianos después de una picadura de garrapata.
La vacuna para la borreliosis de Lyme sería de utilidad en determinadas circunstancias pero fue retirada del mercado en 2002 por escasa rentabilidad económica.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, ésta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante 1 mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Puesta al día en Métodos Microbiológicos para el Diagnóstico Clínico"
Disponible en http://www.doyma.es/eimc/formacion
17 enero / 31 marzo 2005