Introducción
Pese a que diversos estudios han puesto de manifiesto el alto riesgo de desarrollar enfermedad tuberculosa que tienen los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) con anergia cutánea1,2, los diversos ensayos clínicos realizados no han servido para demostrar de forma concluyente el beneficio de instaurar quimioprofilaxis antituberculosa en esta población3,4. Por ello, las recomendaciones iniciales de instaurar quimioprofilaxis antituberculosa en pacientes infectados por VIH anérgicos5, han sido posteriormente desestimadas6 y en la actualidad no se recomienda la práctica generalizada de las pruebas cutáneas de hipersensibilidad retardada7, ni la realización de quimioprofilaxis en estos pacientes8.
Sin embargo, existen evidencias de que determinados grupos de pacientes infectados por el VIH y anérgicos, como reclusos, consumidores de drogas o indigentes, pueden tener un alto riesgo de tuberculosis1,2,8,9, e incluso un estudio observacional ha demostrado una reducción del riesgo de tuberculosis con el uso de quimioprofilaxis con isoniacida durante 12 meses en pacientes infectados por el VIH con anergia cutánea10.
Se presentan los resultados de un ensayo clínico prospectivo, cuyo objetivo principal ha sido determinar la eficacia en la prevención de la tuberculosis y la tolerancia de tres regímenes de quimioprofilaxis en pacientes infectados por el VIH con anergia cutánea.
Métodos
Diseño y población
El estudio se diseñó como un ensayo clínico, controlado, abierto, aleatorizado y multicéntrico que fue llevado a cabo entre el 1 de junio de 1994 y el 31 de diciembre de 1998 en 12 hospitales públicos españoles, uno de ellos ubicado en Madrid y los otros 11 en Andalucía. El estudio fue autorizado por los Comités de Ética e Investigación Clínica de todos los hospitales participantes y se obtuvo el consentimiento informado por escrito de todos los sujetos reclutados en él. Los criterios de inclusión en el estudio fueron:
1. Infección por el VIH confirmada por enzimoinmunoanálisis y Werstern blot.
2. Edad comprendida entre 18 y 65 años.
3. Expectativas de vida superiores a 2 años.
4. Diagnóstico de anergia cutánea definida como ausencia (0 mm) de induración en las pruebas de reactividad cutánea con los antígenos de tuberculina, Candida albicans y parotiditis a las 72 h de la inoculación.
Las pruebas de hipersensibilidad cutánea retardada fueron efectuadas en la cara volar del antebrazo izquierdo con la técnica de Mantoux utilizando: 0,1 ml de tuberculina con 2 U de derivado proteico purificado RT23 (2 U de PPD-RT23), 0,1 ml de antígeno de C. albicans a concentración 1:10 y 0,1 ml de antígeno de la parotiditis a concentración 1:10.000.
Los criterios de exclusión fueron:
1. Existencia de tuberculosis activa.
2. Antecedentes de terapia o de quimioprofilaxis antituberculosa previa.
3. Presencia de síntomas o de signos indicativos de tuberculosis pulmonar o extrapulmonar.
4. Historia de hipersensibilidad a los fármacos en estudio (isoniacida, rifampicina o piracinamida).
5. Concentraciones plasmáticas de aspartato-aminotransferasa y/o de alanino-aminotransferasa iguales o superiores al cuádruple de sus valores normales, de bilirrubina total superiores a 2 mg/ml, y/o de creatinina superiores a 2 mg/ml.
6. Gestación.
7. Realización simultánea de otros tratamientos incompatibles con alguno de los fármacos utilizados en el estudio.
Aleatorización e intervenciones
Los pacientes fueron aleatorizados a uno de los siguientes cuatro brazos: isoniacida durante 6 meses (6H), rifampicina más isoniacida durante 3 meses (3HR), rifampicina más piracinamida durante 2 meses (2ZR) o sin tratamiento (NT). Los fármacos se autoadministraron a diario por los propios pacientes, por vía oral, en las siguientes dosis: isoniacida, 5 mg/kg/día (máxima 300 mg/día); rifampicina, 10 mg/kg/día (máxima 600 mg/día); piracinamida, 1.500 mg/día para los pacientes de peso inferior a 50 kg, 2.000 mg/día para los de peso comprendido entre 50 y 70 kg, y 2.500 mg/día para los de peso superior a 70 kg.
En todos los sujetos participantes se realizó un estudio basal que incluyó: historia clínica y epidemiológica, exploración física, radiografía de tórax, hemograma, concentraciones séricas de creatinina, nitrógeno ureico en sangre, ácido úrico, aspartato-aminotransferasa, alanino-aminotransferasa, fosfatasa alcalina y bilirrubina total, así como un recuento de linfocitos T CD4+.
Durante la quimioprofilaxis los pacientes fueron evaluados con periodicidad quincenal en los primeros 2 meses y mensual posteriormente. En cada visita de evaluación se recogía el cumplimiento terapéutico, los posibles efectos adversos de los fármacos y se realizaba un hemograma y un estudio bioquímico de función hepática y renal.
La adherencia al tratamiento se evaluó en cada revisión por el médico responsable mediante entrevista al paciente. Se definió el cumplimiento terapéutico como la toma de, al menos, el 80% de las dosis totales de los fármacos prescritos. Se suspendió la quimioprofilaxis cuando así lo desearon los pacientes o por cualquiera de los siguientes motivos: aparición de efectos adversos grado III o IV atribuibles a los fármacos en estudio; aumento de las cifras de aspartato-aminotransferasa y/o de alanino-aminotransferasa al triple o más de sus valores basales; desarrollo de tuberculosis; o diagnóstico de enfermedades que aconsejaron la interrupción del tratamiento.
Variables de valoración y seguimiento
La variable principal del estudio fue el desarrollo de tuberculosis. Se consideró tuberculosis confirmada el aislamiento de Mycobacterium tuberculosis de cualquier muestra; tuberculosis probable la presencia de bacilos ácido alcohol-resistentes en cualquier muestra sin confirmación o tipificación posterior en los cultivos, y como tuberculosis posible a la enfermedad clínicamente compatible y con respuesta al tratamiento antituberculoso. Otras variables estudiadas fueron la suspensión de la quimioprofilaxis (debida a efectos adversos, a interacciones medicamentosas o a abandono voluntario) y la mortalidad. Una vez finalizada la quimioprofilaxis, se realizó un seguimiento clínico de los pacientes durante 2 años en el cual se efectuó un estudio idéntico al basal cada 6 meses. En los casos sospechosos de tuberculosis se realizaron las exploraciones complementarias necesarias para llegar a un diagnóstico, incluyendo siempre tinciones de Ziehl-Neelsen y cultivos en medio de Löwenstein-Jensen en los fluidos o en los especímenes de los tejidos obtenidos. Si estos últimos resultaban positivos se procedía de forma sistemática a la tipificación de la micobacteria y a la realización de pruebas de sensibilidad de la misma.
Tamaño muestral
El estudio se diseñó con un tamaño muestral de 332 pacientes (83 pacientes por rama de tratamiento). El tamaño muestral se calculó asumiendo un nivel de confianza del 95%, una potencia del 80%, una incidencia de tuberculosis en el grupo de pacientes anérgicos que no recibirían tratamiento del 12,5% y una incidencia de tuberculosis en los grupos que recibirían tratamiento del 2%.
Análisis estadístico
El análisis de variables continuas se realizó mediante la prueba de la t de Student o el test de Mann-Whitney. El análisis de las variables cualitativas se realizó mediante la prueba de la χ2 o el test de Fisher. La tasa de incidencia de tuberculosis/100 personas año se calculó dividiendo los casos de tuberculosis por la suma de los tiempos de seguimiento de cada sujeto. El riesgo relativo de tuberculosis en función de la pauta de quimioprofilaxis se realizó mediante el cálculo de la razón de riesgo a través de una regresión de riesgos proporcionales o regresión de Cox.
Resultados
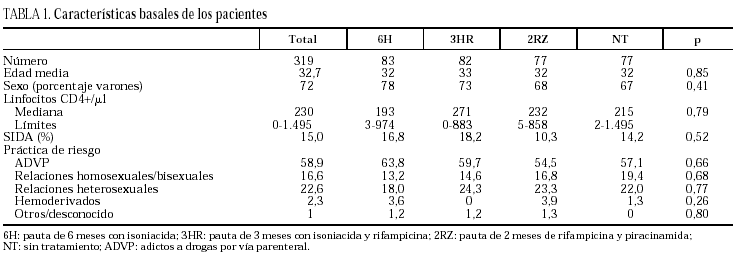
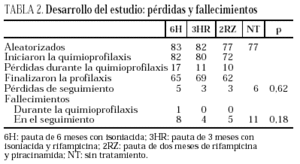
Se incluyeron en el ensayo 319 pacientes cuyas características basales, equiparables en los diferentes grupos del estudio, se describen en la tabla 1. Tras la aleatorización, 10 pacientes no iniciaron quimioprofilaxis (dos por diagnóstico de tuberculosis activa, dos por neumonías por Pneumocystis carinii, uno por enfermedad por M. avium intracellulare, uno por leishmaniasis visceral, uno por metrorragia, uno por embarazo, uno por haberse comprobado la realización de tratamiento previo frente a M. tuberculosis y uno por hiperbilirrubinemia). No se apreciaron diferencias entre los grupos en cuanto a pérdidas durante el período de quimioprofilaxis o durante el período de seguimiento (tabla 2). Dos pacientes en tratamiento con metadona asignados a regímenes que contenían rifampicina abandonaron voluntariamente el estudio para evitar ajustes en la dosis de metadona.
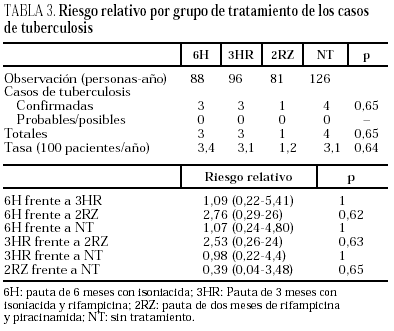
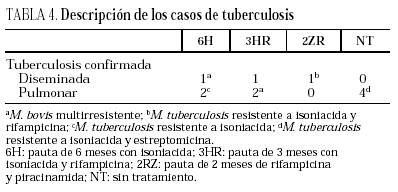
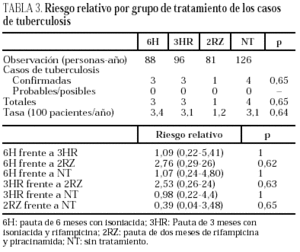
Durante el seguimiento se produjeron 11 casos de tuberculosis, tres en el brazo 6H, 3 en el 3HR, uno en el 2ZR y cuatro en el NT (p = 0,65). Todos los casos de tuberculosis se confirmaron bacteriológicamente. Los casos de tuberculosis aparecieron tras una media de 14,5 meses de seguimiento (límites, 4-24 meses; mediana, 13 meses), sin diferencias estadísticamente significativas entre los distintos grupos del estudio. El seguimiento fue de 88 (6H), 96 (3RH), 81 (2RZ) y 126 (NT) personas/año de observación, respectivamente. Las tasas de tuberculosis en los distintos grupos fueron: 3,4 casos/100 personas/año en el brazo 6H; 3,1 casos/100 personas/año en el 3RH; 1,2 casos/100 personas/año en el 2RZ, y 3,1 casos/100 personas/año en el NT (p = 0,64). Los casos de tuberculosis y el riesgo relativo con el intervalo de confianza de los diferentes regímenes entre sí se recogen en la tabla 3 y las características clínicas y diagnósticas de los casos de tuberculosis en la tabla 4. En 34 pacientes se presentaron reacciones adversas que obligaron a retirar la medicación sin que se observasen diferencias significativas entre los distintos grupos de tratamiento (tabla 5). De los 9 pacientes con hepatotoxicidad sólo la retirada del tratamiento se realizó por hepatitis sintomática en un caso (6H), realizándose en los 8 restantes por elevación asintomática de las transaminasas, definida como un aumento de transaminasas superior a 3 veces el valor basal con ausencia de síntomas de hepatitis.
Fallecieron durante el seguimiento 29 pacientes por causas no relacionadas con la tuberculosis. Los fallecimientos se atribuyeron a los siguientes procesos: seis a enfermedad por citomegalovirus; cuatro a enfermedad VIH terminal; tres a sepsis; dos a toxoplasmosis cerebral; dos a leucoencefalopatía multifocal progresiva; dos a neumonía por P. carinii; dos a sobredosis de heroína; dos a linfomas; uno a meningitis bacteriana; uno a criptococosis meníngea; uno a insuficiencia respiratoria; dos a absceso cerebral; uno a sarcoma de Kaposi y dos a causa no determinada. La letalidad en el grupo de pacientes que no recibieron tratamiento fue del 14,3% y la de los pacientes tratados (18/234) del 7,7% (p = 0,08).
Discusión
La infección por el VIH produce un importante defecto en la inmunidad mediada por células que puede reflejarse en la incapacidad para desarrollar una respuesta de hipersensibilidad retardada cutánea a uno o varios antígenos11. Sin embargo, la capacidad para diagnosticar infección latente por M. tuberculosis en muchos pacientes infectados por el VIH se encuentra a menudo disminuida y en algunas personas infectadas, la coinfección por M. tuberculosis puede no ser identificada.
La exploración de la anergia cutánea es una forma sencilla y poco costosa de evaluar la función inmunitaria en pacientes infectados por el VIH12,13. Un aspecto importante para valorar la anergia es el criterio empleado para su definición. En nuestro estudio para la definición de anergia hemos exigido la ausencia de reactividad a 3 antígenos administrados por el método de Mantoux (PPD, C. albicans y antígeno de parotiditis). Este criterio, recomendado por organismos internacionales14,15, ha demostrado ser el más eficaz para definir anergia cutánea en pacientes infectados por el VIH16.
La quimioprofilaxis antituberculosa es una medida de gran eficacia para reducir la incidencia de tuberculosis en pacientes coinfectados por el VIH y M. tuberculosis4,17-19. En diversos estudios se ha demostrado que el riesgo de desarrollo de tuberculosis en pacientes infectados por el VIH con anergia cutánea es mayor que el de pacientes no anérgicos y no reactores a la tuberculina20-23. Incluso un estudio retrospectivo realizado en España, ha demostrado que el riesgo puede ser mayor que el de pacientes infectados por el VIH reactores a la tuberculina que no reciben quimioprofilaxis antituberculosa2.
En el diseño del estudio realizado en 1993-1994, no se tuvo en cuenta registrar del empleo de tratamiento antirretroviral de gran actividad (TARGA). Por ello, el uso de TARGA durante el seguimiento no se recogió prospectivamente y no ha sido posible evaluar su efecto en la incidencia de tuberculosis. Ello constituye una importante limitación del estudio.
En nuestro estudio la incidencia de tuberculosis en el grupo de pacientes anérgicos que no recibieron quimioprofilaxis ha sido de 3,1 casos/100 pacientes año. La incidencia de tuberculosis en pacientes infectados por el VIH anérgicos depende de diversos factores, la prevalencia de tuberculosis en el área, los criterios utilizados para definir anergia, el tipo de estudio prospectivo o retrospectivo, el grado de inmunocompromiso de los pacientes y los criterios diagnósticos empleados para la definición de tuberculosis. La incidencia obtenida en nuestro estudio es similar a la obtenida en otros estudios prospectivo realizados en áreas de alta prevalencia de tuberculosis, como el de Whalen et al4 realizado en Uganda (3,1 casos/100 pacientes año), y el de Guelar et al20 realizado en España (2,6 casos/100 pacientes año). Por el contrario, nuestra incidencia es mayor que la obtenida en estudios realizados en áreas de baja incidencia de tuberculosis, como el de Gordin et al3 realizado en Estados Unidos (0,9 casos/100 pacientes año). Llama la atención la alta incidencia de tuberculosis en anérgicos (12,4 casos/100 personas años) obtenida por Moreno et al2 en un estudio retrospectivo realizado en España que resultó superior, incluso que la de pacientes reactores a la tuberculina que no recibieron quimioprofilaxis incluidos en el mismo estudio. El hecho de que el estudio fuera retrospectivo, incluyera pacientes con una proporción mayor de consumidores de drogas por vía parenteral (80%) y más inmunodeprimidos (recuento medio de linfocitos CD4+: 135/μl), podrían justificar la diferencia respecto a nuestros resultados.
El objetivo principal de nuestro estudio ha sido evaluar la eficacia de tres regímenes de quimioprofilaxis para disminuir la incidencia de tuberculosis en pacientes infectados por el VIH con anergia cutánea. El primero de los 3 regímenes evaluados ha sido 6H. En sujetos reactores a la tuberculina no infectados por el VIH, este esquema disminuye la incidencia de tuberculosis en un 69%24. En pacientes infectados por el VIH reactores a la tuberculina se han obtenido resultados discrepantes. Whalen et al4 demostraron que 6H disminuía el 68% la incidencia de tuberculosis, mientras que Hawken et al19 no encontraron diferencias respecto al placebo. En pacientes infectados por el VIH con anergia, 2 ensayos clínicos aleatorizados no han podido demostrar una reducción significativa del riesgo de tuberculosis respecto al placebo con el empleo de 6H3,4, aunque en uno de estos estudios, redujo el riesgo de tuberculosis en el 56%3. En nuestro estudio, la incidencia de tuberculosis en pacientes que recibieron 6H no redujo la incidencia de tuberculosis respecto al grupo de pacientes no tratados.
La segunda de las pautas evaluadas, 3RH ha demostrado capacidad para reducir el riesgo de tuberculosis en pacientes infectados por el VIH reactores a la tuberculina en el 60%4. Sin embargo, su utilización ha sido poco evaluada en pacientes con anergia cutánea. En un estudio realizado en España presentó una eficacia similar a 12H; pero el estudio incluyó tanto a pacientes reactores a la tuberculina como anérgicos y carecía del poder suficiente para demostrar la equivalencia de ambos regímenes25 En nuestro estudio, 3RH no redujo la incidencia de tuberculosis respecto al grupo de pacientes que no recibieron quimioprofilaxis.
La última de las pautas evaluadas, 2RZ, se ha considerado como una de las dos pautas electivas de quimioprofilaxis antituberculosa en pacientes infectados por el VIH reactores a la tuberculina9, desde que Gordin et al26, confirmando los resultados obtenidos en un estudio previo27, demostraron que era tan eficaz como la pauta de 12H. En nuestro estudio, a pesar de que la pauta 2RZ redujo en el 62% el riesgo de tuberculosis respecto al grupo de pacientes que no recibió quimioprofilaxis, esta diferencia no resultó estadísticamente significativa. Se han comunicado casos de hepatitis graves o fatales en sujetos sin infección por el VIH que recibían 2RZ como quimioprofilaxis tuberculosa, que ha hecho desaconsejar su uso en la quimioprofilaxis antituberculosa de pacientes no infectados por el VIH28. En nuestro estudio, al igual que en otros ensayos clínicos26, no se ha apreciado mayor incidencia de hepatotoxicidad entre los pacientes que recibieron 2RZ. Ninguno de los pacientes incluidos en nuestro estudio falleció por hepatitis tóxica, no se apreciaron diferencias significativas en cuanto a hepatotoxicidad entre los 3 brazos de tratamiento, y los 4 pacientes tratados con 2RZ que se retiraron del estudio por hepatotoxicidad, presentaban elevación asintomática de las transaminasas.
El desarrollo de exantema es un efecto adverso bien conocido del tratamiento con rifampicina que puede originar la retirada del fármaco29. En nuestro estudio el exantema fue más frecuente en los pacientes que recibieron alguno de los dos regímenes que contenían rifampicina, aunque la diferencia no resultó estadísticamente significativa.
La mortalidad entre pacientes no tratados (14,3%) fue superior a la de pacientes tratados considerados globalmente (7,7%). No se ha encontrado una explicación a esta diferencia que, aunque algo superior al límite de significación estadística (p = 0,08), merece ser destacada. La causa por la que la profilaxis frente a una enfermedad infecciosa consigue disminuir la mortalidad en una población es disminuir la mortalidad provocada por esa infección. Sin embargo, este hecho no se ha verificado en nuestro estudio, ya que ninguno de los pacientes del grupo de no tratados falleció por tuberculosis.
En resumen nuestro estudio, aunque obtiene una reducción de la incidencia de tuberculosis en el brazo de 2RZ respecto a pacientes que no recibieron tratamiento del 62%, no demuestra una reducción significativa del riesgo de tuberculosis con ninguna de las tres pautas evaluadas. Por tanto, nuestros resultados no apoyan el empleo de quimioprofilaxis antituberculosa en pacientes con anergia cutánea. Sin embargo, la inesperada baja incidencia de tuberculosis entre anérgicos no tratados obtenida en nuestro estudio y la reducción obtenida a pesar de ello en la incidencia de tuberculosis entre pacientes tratados con 2RZ y los no tratados (62%) no permiten descartar del todo el beneficio de esta estrategia. En cualquier caso, en pacientes infectados por el VIH con anergia cutánea las recomendaciones para evitar el desarrollo de tuberculosis deben seguir siendo prevenir la exposición y, en el caso de que ésta se produzca, la rápida instauración de una quimioprofilaxis adecuada.
Agradecimiento
Al Dr. Agustín Gómez de la Cámara de la Unidad de Investigación del Hospital 12 de Octubre de Madrid por su ayuda en las valoraciones estadísticas.