La histoplasmosis y la paracoccidioidomicosis están aumentando en España asociadas a la inmigración y los viajes a regiones endémicas. En las últimas tres décadas se han comunicado 128 casos de histoplasmosis en España, 59 en viajeros, 63 en inmigrantes, tres autóctonos por consumo de drogas contaminadas, dos por contagio en el laboratorio y uno en un receptor de trasplante de órgano sólido. El primer caso de paracoccidioidomicosis publicado data del año 1969, desde entonces se han publicado 21 casos en nuestro país. Estos casos evolucionaron de forma crónica tras largos periodos de latencia, que fueron de hasta 50 años. No se ha detectado un aumento similar en la frecuencia de otras micosis consideradas endémicas como la blastomicosis, la coccidioidomicosis, la lobomicosis, la pitiosis o la esporotricosis. Los hongos endémicos deben ser manipulados en instalaciones que cumplan los requisitos de bioseguridad para patógenos del grupo 3, lo que debería ser considerado en todos los cultivos realizados con muestras procedentes de enfermos con cuadros clínicos compatibles.
Histoplasmosis and paracoccidioidomycosis are emerging infections in Spain associated with immigration and travelling. In last three decades a total of 128 cases of histoplasmosis have been reported in Spain, 59 in travellers, 63 in immigrants, three associated to drug abuse, two in laboratory workers, and one in a solid organ transplant receptor. In 1969 the first Spanish case of paracoccidioidomycosis was published and a total of 21 cases have been reported so far. Those patients suffered from the chronic form of the disease with period of latency as long as 50 years. Other endemic mycoses such as blastomycosis, coccidioidomycosis, lobomycosis, pythiosis and sporotrichosis have not increased in frequency. Microbiological cultures of endemic fungi must be handled in facilities which comply with international biosafety regulations and must also be taken into account for cultures from patients with suspected endemic mycosis.
La frecuencia de las micosis endémicas ha aumentado en España en las últimas décadas. Este incremento se ha asociado a algunos cambios que se han producido en la sociedad española. En primer lugar, se ha observado un aumento de la población inmigrante procedente de regiones endémicas. Según el censo de 2010 (ww.ine.es), el porcentaje de inmigrantes ascendía al 12,2% de la población, con un tercio procedente de países sudamericanos y un 16% de países africanos donde las micosis endémicas son frecuentes. Por otro lado, los desplazamientos turísticos y profesionales de los españoles al extranjero se incrementan cada año, en concreto en el año 2009 fueron 12,8 millones los viajes realizados fuera de nuestras fronteras (www.iet.tourspain.es), de los que un 40% fueron realizados a zonas con micosis endémicas.
La micosis endémica que se describe con mayor frecuencia en nuestro país es la histoplasmosis, producida por el hongo dimórfico Histoplasma capsulatum1. La infección se adquiere por inhalación de las conidias presentes en suelos ricos en materia orgánica, preferentemente guano de murciélagos o de pájaros2. Aunque este hongo tiene una distribución cosmopolita, se encuentra sobre todo en el continente americano (H. capsulatum var. capsulatum), en los valles de los ríos Mississippi y Ohio, en América Central y del Sur y en el continente africano donde la variedad capsulatum convive con la variedad duboisii3,4. La infección está asociada a actividades ocupacionales que impliquen remover el suelo, visitar cuevas donde existan murciélagos y, en general, realizar actividades al aire libre. Este hongo causa desde infecciones asintomáticas a infecciones pulmonares graves agudas y crónicas (<5%), aunque en enfermos inmunodeprimidos, especialmente en enfermos VIH+, origina micosis diseminadas de mal pronóstico.
También ha aumentado en España la frecuencia de la paracoccidioidomicosis (PCM), infección causada por Paracoccidioides brasiliensis5, hongo dimórfico cuyo hábitat natural está asociado a regiones húmedas de bosques tropicales o subtropicales6. La enfermedad se adquiere por inhalación de unas estructuras fúngicas en forma de propágulos7. La PCM es la micosis sistémica más frecuente de América tropical, endémica desde México hasta Argentina siendo Brasil el país donde se presentan el 80% de los casos8. Esta micosis se caracteriza por largos periodos de latencia hasta que la enfermedad se desarrolla. Respecto a las formas clínicas, existe una forma juvenil aguda con afectación sistémica y una forma crónica del adulto con manifestaciones pulmonares y lesiones extra-pulmonares especialmente en piel y mucosas. Esta enfermedad es mucho más frecuente en hombres debido a que los estrógenos inhiben la transición de fase micelial a la fase levaduriforme, que es la forma patógena del microorganismo9.
Debe indicarse que no se ha detectado un aumento similar en la frecuencia en nuestro país de otras micosis consideradas endémicas como la blastomicosis, la coccidioidomicosis, la lobomicosis, la pitiosis o la esporotricosis.
H. capsulatum y P. brasiliensis son patógenos primarios, lo que implica que pueden causar infección en personas inmunocompetentes, por lo que deben ser manipulados en laboratorios con instalaciones adecuadas para el manejo de patógenos pertenecientes al grupo 3, según la clasificación de niveles de bioseguridad10. La exposición accidental puede poner en riesgo la vida del trabajador. En los últimos años, se han descrito en nuestro país dos casos de histoplasmosis adquiridas en el laboratorio, uno de ellos debido a la manipulación de la fase micelial en instalaciones que no cumplían los requisitos legales para el manejo de estos hongos11 y el otro originado por una inoculación accidental12.
Este texto pretende analizar la epidemiología de estas micosis en España en los últimos años, ofreciendo al lector además una revisión sobre los métodos diagnósticos disponibles y sobre el manejo de estas especies en el laboratorio.
EpidemiologíaHistoplasmosisLa mayor parte de los casos de histoplasmosis en España se observan en viajeros y en inmigrantes, con antecedentes de estancias en regiones endémicas8,13. Desde finales de la década de los años 80 del siglo XX, se han descrito un total de 128 casos en nuestro país, 59 en viajeros, 63 en inmigrantes, tres autóctonos por consumo de drogas contaminadas, dos por contagio en el laboratorio y uno en un receptor de trasplante de órgano sólido (tabla 1). De estos 128 casos, 113 (88,3%) se han comunicado desde el año 2000, y 4 (3%) fueron causados por la variedad africana del hongo (var. duboisii). Respecto al cuadro clínico, 60 (46,9%) fueron infecciones pulmonares y 64 (50%) histoplasmosis diseminadas progresivas.
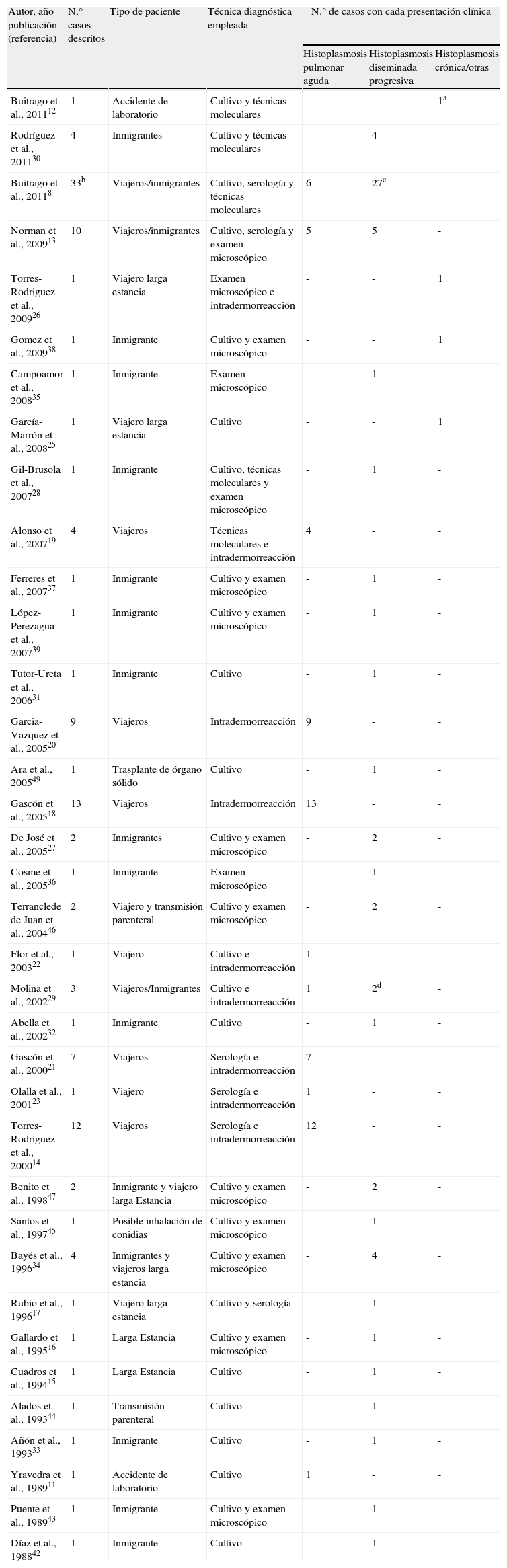
Casos de histoplasmosis en España según las publicaciones revisadas. La tabla incluye tipo de paciente, técnicas diagnósticas utilizadas y la presentación clínica
| Autor, año publicación (referencia) | N.° casos descritos | Tipo de paciente | Técnica diagnóstica empleada | N.° de casos con cada presentación clínica | ||
| Histoplasmosis pulmonar aguda | Histoplasmosis diseminada progresiva | Histoplasmosis crónica/otras | ||||
| Buitrago et al., 201112 | 1 | Accidente de laboratorio | Cultivo y técnicas moleculares | - | - | 1a |
| Rodríguez et al., 201130 | 4 | Inmigrantes | Cultivo y técnicas moleculares | - | 4 | - |
| Buitrago et al., 20118 | 33b | Viajeros/inmigrantes | Cultivo, serología y técnicas moleculares | 6 | 27c | - |
| Norman et al., 200913 | 10 | Viajeros/inmigrantes | Cultivo, serología y examen microscópico | 5 | 5 | - |
| Torres-Rodriguez et al., 200926 | 1 | Viajero larga estancia | Examen microscópico e intradermorreacción | - | - | 1 |
| Gomez et al., 200938 | 1 | Inmigrante | Cultivo y examen microscópico | - | - | 1 |
| Campoamor et al., 200835 | 1 | Inmigrante | Examen microscópico | - | 1 | - |
| García-Marrón et al., 200825 | 1 | Viajero larga estancia | Cultivo | - | - | 1 |
| Gil-Brusola et al., 200728 | 1 | Inmigrante | Cultivo, técnicas moleculares y examen microscópico | - | 1 | - |
| Alonso et al., 200719 | 4 | Viajeros | Técnicas moleculares e intradermorreacción | 4 | - | - |
| Ferreres et al., 200737 | 1 | Inmigrante | Cultivo y examen microscópico | - | 1 | - |
| López-Perezagua et al., 200739 | 1 | Inmigrante | Cultivo y examen microscópico | - | 1 | - |
| Tutor-Ureta et al., 200631 | 1 | Inmigrante | Cultivo | - | 1 | - |
| Garcia-Vazquez et al., 200520 | 9 | Viajeros | Intradermorreacción | 9 | - | - |
| Ara et al., 200549 | 1 | Trasplante de órgano sólido | Cultivo | - | 1 | - |
| Gascón et al., 200518 | 13 | Viajeros | Intradermorreacción | 13 | - | - |
| De José et al., 200527 | 2 | Inmigrantes | Cultivo y examen microscópico | - | 2 | - |
| Cosme et al., 200536 | 1 | Inmigrante | Examen microscópico | - | 1 | - |
| Terranclede de Juan et al., 200446 | 2 | Viajero y transmisión parenteral | Cultivo y examen microscópico | - | 2 | - |
| Flor et al., 200322 | 1 | Viajero | Cultivo e intradermorreacción | 1 | - | - |
| Molina et al., 200229 | 3 | Viajeros/Inmigrantes | Cultivo e intradermorreacción | 1 | 2d | - |
| Abella et al., 200232 | 1 | Inmigrante | Cultivo | - | 1 | - |
| Gascón et al., 200021 | 7 | Viajeros | Serología e intradermorreacción | 7 | - | - |
| Olalla et al., 200123 | 1 | Viajero | Serología e intradermorreacción | 1 | - | - |
| Torres-Rodriguez et al., 200014 | 12 | Viajeros | Serología e intradermorreacción | 12 | - | - |
| Benito et al., 199847 | 2 | Inmigrante y viajero larga Estancia | Cultivo y examen microscópico | - | 2 | - |
| Santos et al., 199745 | 1 | Posible inhalación de conidias | Cultivo y examen microscópico | - | 1 | - |
| Bayés et al., 199634 | 4 | Inmigrantes y viajeros larga estancia | Cultivo y examen microscópico | - | 4 | - |
| Rubio et al., 199617 | 1 | Viajero larga estancia | Cultivo y serología | - | 1 | - |
| Gallardo et al., 199516 | 1 | Larga Estancia | Cultivo y examen microscópico | - | 1 | - |
| Cuadros et al., 199415 | 1 | Larga Estancia | Cultivo | - | 1 | - |
| Alados et al., 199344 | 1 | Transmisión parenteral | Cultivo | - | 1 | - |
| Añón et al., 199333 | 1 | Inmigrante | Cultivo | - | 1 | - |
| Yravedra et al., 198911 | 1 | Accidente de laboratorio | Cultivo | 1 | - | - |
| Puente et al., 198943 | 1 | Inmigrante | Cultivo y examen microscópico | - | 1 | - |
| Díaz et al., 198842 | 1 | Inmigrante | Cultivo | - | 1 | - |
aEl paciente sufrió histoplasmosis primaria cutánea. bNo se incluyen los casos publicados en trabajos previos recogidos en la tabla. cSe incluyen tres casos con histoplasmosis africana. dSe incluye un caso con histoplasmosis africana.
Las primeras publicaciones de histoplasmosis en viajeros que aparecen en España datan del año 200014, aunque en ellas se revisan casos de los años 9015–17. Desde entonces y hasta hoy se han descrito 59 casos de histoplasmosis en viajeros, la mayoría de ellos procedentes del continente americano, en concreto de América Central y del Sur (58/59, 98%) (tabla 1).
Un estudio realizado en 2005 incluyendo 342 personas que habían realizado un primer viaje a Latinoamérica observó que el 20% de los viajeros tenían una intradermorreacción con histoplasmina positiva, lo que indicaba que una quinta parte de la población podía haber inhalado conidias de Histoplasma durante su viaje18. La probabilidad de positivización de la reacción cutánea era mayor en los viajes a Centroamérica y, como era de esperar, en estancias de larga duración o cuando se realizaron actividades en la naturaleza.
La mayor parte de estos viajeros no mostraban síntomas de infección y solo 13 casos fueron diagnosticados de histoplasmosis. En seis pacientes se pautó tratamiento con itraconazol. La sintomatología fue inespecífica con malestar, fiebre, tos y, en ocasiones, infiltrados pulmonares. Solo la fiebre (p=0,002) y la tos (p=0,009) se asociaron significativamente con la histoplasmosis. Por tanto, es una infección difícil de diagnosticar en su fase aguda si no se valora el antecedente del viaje a una zona endémica.
Debe indicarse que también se han descrito pequeños brotes14,18–23 en viajeros procedentes de distintos países de América Central y del Sur expuestos a una fuente común de infección (Ecuador, Republica Dominicana y Guatemala). Asimismo, existen descripciones de casos aislados en viajeros procedentes de Latinoamérica19. En la mayoría de las ocasiones los pacientes habían realizado actividades en la naturaleza consideradas de riesgo como visita de cuevas, excavaciones, obras de reconstrucción, estancia en zonas rurales y colaboración en tareas agrícolas. Esto pone de manifiesto que la inhalación de conidias puede darse en diferentes lugares y no solo visitando cuevas con guano, hecho que debe ser considerado en las consultas especializadas de medicina del viajero.
Otro aspecto a revisar son las manifestaciones crónicas de la infección. Una de las características de la histoplasmosis es que pueden aparecer signos de la infección años después del contacto, incluso en enfermos que tuvieron infecciones agudas asintomáticas. En ocasiones, quedan como secuela de las infecciones pulmonares nódulos fibrosos que van calcificándose y formando bronquiolitos. En algunos enfermos, como consecuencia de una respuesta inmune excesiva, se pueden producir complicaciones fibrosantes como mediastinitis granulomatosa y pericarditis. En pacientes con enfermedades pulmonares crónicas se han observado cavidades, fibrosis e histoplasmomas14,24,25. Incluso se han descrito reactivaciones de la infección26. Las manifestaciones crónicas de la histoplasmosis son aún más difíciles de detectar que las infecciones agudas. Actualmente no son frecuentes, pero debe señalarse que es muy probable que aumenten en el futuro debido a la gran cantidad de personas que pueden haber sufrido una infección asintomática tras viajar por zonas endémicas en los últimos años.
Como se indicó anteriormente, el otro grupo de riesgo de la histoplasmosis en España son los inmigrantes. A diferencia de los viajeros, la histoplasmosis en inmigrantes se observa en personas con alguna clase de inmunodepresión, mayoritariamente en pacientes con VIH8,13,27–39, aunque también se han descrito casos con otras enfermedades de base, como tratamientos con corticoides por dermatomiositis30, cáncer y cuadros hematológicos8,27. En estos pacientes suele observarse una histoplasmosis diseminada progresiva cuyo origen puede ser una reactivación endógena del hongo al desarrollarse la inmunodepresión en pacientes que tenían una infección crónica o latente, aunque también se han descrito reinfecciones. Los síntomas son fiebre, pérdida de peso, astenia, tos, disnea, infiltrados pulmonares, adenopatías, lesiones cutáneas y hepato-esplenomegalia. Hay casos de afectación neurológica, digestiva y laríngea. La mortalidad sin tratamiento es muy elevada8,40. Es fácil confundir esta enfermedad con una tuberculosis diseminada, con sarcoidosis o con otras afecciones del sistema mononuclear fagocítico. Además, en un 15% de los casos de histoplasmosis en pacientes VIH positivos, se ha observado la co-infección por tuberculosis41. Según las recomendaciones24,28, la histoplasmosis diseminada debe ser tenida en cuenta en el diagnóstico diferencial en pacientes con sida con recuentos de linfocitos CD4+ por debajo de 150 células/μl, con fiebre prolongada que hayan viajado o residido en área endémica o que sean consumidores de drogas por vía parenteral.
En inmigrantes de origen subsahariano puede darse la histoplasmosis africana, micosis producida por la variedad duboisii, que cursa de forma diferente. Aparecen lesiones osteolíticas en costillas, vértebras y huesos largos, así como nódulos subcutáneos y úlceras cutáneas. No suele existir afectación pulmonar.
Respecto a los datos epidemiológicos sobre la histoplasmosis en inmigrantes en nuestro país, las primeras publicaciones aparecen a finales de los años 80 y se trata de pacientes con sida42,43, en total se han descrito 63 casos. A estos, hay que añadir 3 casos con una clínica similar a la del inmigrante, histoplasmosis diseminada progresiva, en pacientes que no tenían antecedentes de viajes pero eran HIV+ consumidores de drogas y se contagiaron por vía parenteral al compartir jeringuillas con personas infectadas con Histoplasma o por inhalación (tabla 1)44–46.
Benito et al. realizaron la primera revisión de casos entre los años 1988 y 1998, describiendo 13 casos, todos ellos con sida como enfermedad de base, posteriormente Gil-Brusola et al. revisaron los casos de histoplasmosis diseminada en pacientes con sida publicados desde el año 1988 hasta el 2004. En total describieron 23 casos, la mayoría hombres (91%), todos ellos menores de 50 años. La mayor parte de los casos eran inmigrantes sudamericanos con las características descritas en los párrafos precedentes28,47,48.
Buitrago et al.8 describieron 39 casos de histoplasmosis importada, de los cuales 30 eran inmigrantes, todos ellos inmunodeprimidos, la mayoría de ellos con sida (97%) con una histoplasmosis diseminada progresiva. La edad media de los pacientes fue de 34 años y el porcentaje de hombres y mujeres fue similar. La mayoría de los pacientes procedía de Sudamérica, pero también describen un 14% de pacientes procedentes de países africanos y en tres casos los autores pudieron verificar que la cepa causante de la infección pertenecía a la especie H. capsulatum var. duboisii, los tres eran pacientes con sida y presentaban una histoplasmosis diseminada.
Por último, como se indicó previamente, existe un caso en la literatura de un receptor de trasplante de órgano sólido aunque no existían antecedentes epidemiológicos en el donante ni en el receptor49 así como dos casos de histoplasmosis adquirida en el laboratorio11,12.
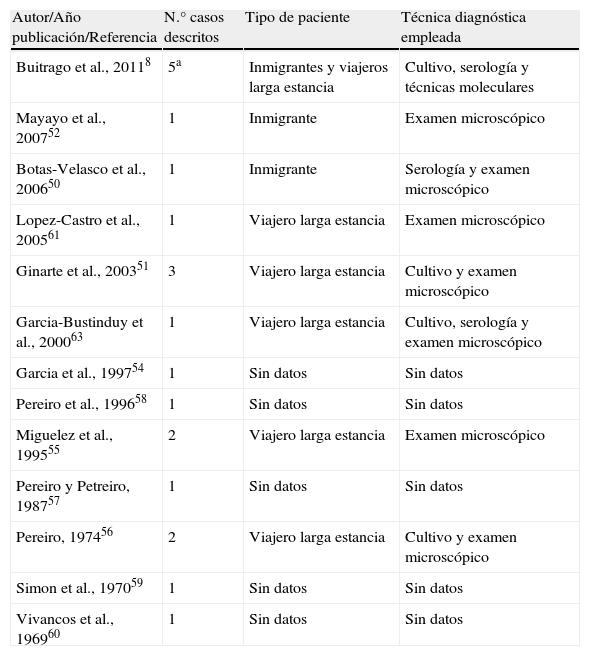
ParacoccidioidomicosisLa PCM en España es una enfermedad menos frecuente que la histoplasmosis pero cuya presencia también ha aumentado en los últimos años. Los casos publicados en España corresponden a inmigrantes procedentes de regiones endémicas o personas que han vivido largos periodos en dichas regiones8,50–59. El primer caso publicado data del año 196960, desde entonces se han publicado 21 casos en nuestro país (tabla 2). Estos casos tuvieron un curso crónico tras largos periodos de latencia, que fueron de hasta 50 años51, lo que complicó su diagnóstico. Se caracteriza por un síndrome constitucional, tos, disnea progresiva y lesiones en la mucosa oral y la laringe. Pueden aparecer infiltrados intersticiales pulmonares bilaterales. En pacientes con sida, la reactivación de un foco latente puede producir una infección diseminada, parecida a la forma aguda de PCM. Casi todos los casos publicados corresponden a hombres y en gran parte de ellos el diagnóstico inicial fue erróneo8,50.
Casos de paracoccidioidomicosis en España según las publicaciones revisadas. La tabla incluye tipo de paciente y técnicas diagnósticas utilizadas. Todos los casos descritos en España han sido infecciones crónicas del adulto
| Autor/Año publicación/Referencia | N.° casos descritos | Tipo de paciente | Técnica diagnóstica empleada |
| Buitrago et al., 20118 | 5a | Inmigrantes y viajeros larga estancia | Cultivo, serología y técnicas moleculares |
| Mayayo et al., 200752 | 1 | Inmigrante | Examen microscópico |
| Botas-Velasco et al., 200650 | 1 | Inmigrante | Serología y examen microscópico |
| Lopez-Castro et al., 200561 | 1 | Viajero larga estancia | Examen microscópico |
| Ginarte et al., 200351 | 3 | Viajero larga estancia | Cultivo y examen microscópico |
| Garcia-Bustinduy et al., 200063 | 1 | Viajero larga estancia | Cultivo, serología y examen microscópico |
| Garcia et al., 199754 | 1 | Sin datos | Sin datos |
| Pereiro et al., 199658 | 1 | Sin datos | Sin datos |
| Miguelez et al., 199555 | 2 | Viajero larga estancia | Examen microscópico |
| Pereiro y Petreiro, 198757 | 1 | Sin datos | Sin datos |
| Pereiro, 197456 | 2 | Viajero larga estancia | Cultivo y examen microscópico |
| Simon et al., 197059 | 1 | Sin datos | Sin datos |
| Vivancos et al., 196960 | 1 | Sin datos | Sin datos |
aNo se incluyen los casos publicados en trabajos previos recogidos en la tabla.
Es fácil confundir la PCM con tuberculosis, sarcoidosis o carcinoma de células escamosas51. Se ha descrito un caso fatal de esta micosis en un inmigrante que fue tratado con corticoides sistémicos al ser diagnosticado erróneamente de sarcoidosis61. No se han descrito brotes de esta enfermedad62. Por último, se ha comunicado un caso de PCM cutánea primaria producida por un corte accidental con una cuchilla de barbero en un paciente que había vivido en Venezuela63.
Dado que el porcentaje de inmigrantes en España procedente de Sudamérica es elevado es bastante probable que muchos casos no se estén detectando o se confundan con otros procesos. Por tanto, es esencial realizar una buena anamnesis y hay que considerar la PCM en personas procedentes de áreas endémicas o con larga estancia en esas áreas con lesiones mucocutáneas o infiltrados pulmonares bilaterales aunque haya pasado mucho tiempo desde que salieron de la región endémica.
Diagnóstico microbiológicoEl diagnóstico de ambas micosis es difícil fuera de las regiones endémicas. El método de referencia sigue siendo el cultivo, aunque estos hongos son de crecimiento lento y se requieren instalaciones con nivel de bioseguridad para microorganismos del grupo 3.
HistoplasmosisLos cultivos son negativos en la mayoría de los casos de histoplasmosis asintomática o leve64, como es la que aparece en viajeros. En estos enfermos la histoplasmina y las pruebas serológicas pueden ser de utilidad en el diagnóstico retrospectivo de la infección. En casos pulmonares graves, con antecedentes epidemiológicos compatibles, la visión de levaduras en muestras respiratorias debería ser considerada como una histoplasmosis probable65. El cultivo e identificación del hongo constituye el diagnóstico de certeza. En infecciones pulmonares graves, la sensibilidad del hemocultivo es variable.
En el caso de infecciones diseminadas en pacientes inmunodeprimidos, el examen microscópico de líquidos orgánicos estériles y de tejidos ayuda al diagnóstico, aunque se ha descrito hasta un 50% de falsos negativos en los exámenes histopatológicos41,66. Los hemocultivos son positivos en un porcentaje elevado de casos de histoplasmosis diseminada progresiva especialmente mediante el uso de sistemas de lisis-centrifugación40. La serología es positiva en un 50% de los pacientes y solo indica contacto previo con el hongo, lo que es habitual en inmigrantes procedentes de zonas endémicas24,67,68.
La baja rentabilidad de la microscopía y de los cultivos ha hecho que se desarrollen técnicas alternativas al cultivo. La detección de anticuerpos por inmunodifusión o fijación de complemento tienen utilidad. Los anticuerpos aparecen entre la segunda y la sexta semana de infección y como se ha indicado, no suelen servir para detectar la infección aguda aunque sí pueden ayudar a diagnosticar las complicaciones crónicas y la meningitis24,67,68.
La detección de un polisacárido de H. capsulatum en suero, lavado broncoalveolar y orina se ha convertido en una técnica alternativa al cultivo de gran utilidad diagnóstica, pero que no se encuentra disponible fuera de zonas endémicas y no se ha comercializado69–72. En enfermos VIH+ con infección diseminada, la sensibilidad es más elevada en orina y lavados broncoalveolares (80-90%) que en suero (50-80%). En pacientes no VIH, la antigenuria y la antigenemia son menos intensas, por lo que se recomienda la detección del antígeno en secreciones respiratorias ya que tiene una sensibilidad del 90% en infecciones pulmonares73.
En las recomendaciones diagnósticas de la infección fúngica de la SEIMC24, se considera que la detección de antígeno es una técnica útil, pero que su falta de disponibilidad fuera de los EE.UU. es una limitación insalvable. Por ello, se han desarrollado técnicas diagnósticas basadas en la PCR. Se han empleado en varias decenas de enfermos y parecen ser muy útiles en pacientes VIH+ con infección diseminada y en viajeros con infecciones respiratorias graves. Son métodos con una sensibilidad excepcional en muestras respiratorias y en biopsias (>90%), y con menos fiabilidad en sangre y suero. No existen técnicas comercializadas, aunque se encuentran disponibles en centros de referencia8,67,68,74–76.
Del total de 123 casos descritos en España, la histoplasmosis fue diagnosticada mediante cultivo en 49 casos (40%), aunque en dos de estos casos el hongo se aisló a partir de una necropsia27,30. La mayoría de los casos en los que se aisló el microorganismo correspondían a pacientes con histoplasmosis diseminada. Las técnicas serológicas como la inmunodifusión o la fijación del complemento se realizaron en 66 casos (54%). La reacción intradérmica de la histoplasmina se empleó en total en 46 pacientes (37%), todos ellos viajeros y el diagnóstico se basó solamente en esta técnica en 22 casos. La observación directa y las pruebas histopatológicas sirvieron para el diagnóstico en 24 casos (19%) y, por último, las técnicas moleculares se emplearon en 41 casos (33%). En algunas ocasiones se emplearon varias técnicas diagnósticas para detectar la infección (tabla 1). En estos casos en los que se pudieron realizar comparaciones sobre la rentabilidad de las técnicas diagnósticas (45 pacientes), el cultivo presentó una sensibilidad del 70%, la serología del 40% y las técnicas basada en la PCR en tiempo real del 85%8.
ParacoccidioidomicosisEn el caso de las infecciones por P. brasiliensis, el examen microscópico y el cultivo son también las técnicas de referencia, aunque su rentabilidad sea discreta. Las lesiones cutáneas y mucosas que suelen darse en la PCM facilita la toma de muestras. El diagnóstico presuntivo se realiza por visión directa de las levaduras en un caso compatible. Estas levaduras son esféricas u ovaladas, con pared doble y protuberancias, que le dan aspecto de timón de barco. La confirmación se realiza mediante el cultivo del hongo.
También se han desarrollado técnicas alternativas al cultivo para el diagnóstico de esta micosis. Existen pruebas de detección de anticuerpos, que muestran una gran sensibilidad en enfermos inmunocompetentes, con títulos más elevados en aquellos pacientes que tienen la forma grave de la enfermedad. La seroconversión se produce varias semanas después del contacto y los títulos son detectables hasta dos años después. Por tanto, la serología no es útil en el diagnóstico de la infección en enfermos inmunodeprimidos y en pacientes con la forma crónica de la infección, que son los casos más frecuentes en España24.
Para estos casos se han diseñado técnicas de detección antigénica. La detección del antígeno circulante gp43 es una técnica desarrollada en Brasil y que se usa en laboratorios de este país para el diagnóstico de la infección77,78. Se ha evaluado en muestras sanguíneas demostrando una gran sensibilidad diagnóstica. También muestra una buena fiabilidad en LCR y muestras respiratorias, así como para realizar el seguimiento de la infección.
Existen también técnicas de detección de ácidos nucleicos que han demostrado su utilidad diagnóstica. Poseen una elevada sensibilidad y especificidad, especialmente en muestras respiratorias y biopsias. Son más rápidas que el cultivo y evitan la manipulación de los cultivos. También se ha demostrado que sirven para la monitorización de la carga fúngica una vez iniciado el tratamiento8,79.
Respecto a las técnicas diagnósticas que sirvieron para el diagnóstico en los casos descritos en España, el cultivo fue positivo en siete casos de los 18 que se tienen datos. En doce casos (57,1%) se emplearon técnicas de observación directa y de histopatología. En ocho casos se emplearon técnicas serológicas de inmunodifusión. Las técnicas moleculares basadas en la PCR en tiempo real se emplearon en seis casos (28,6%), todos ellos publicados recientemente8,79.
Manipulación de muestras clínicas y cultivos. envío de muestrasComo ya se ha indicado, la manipulación de los cultivos de estos hongos debe realizarse en un laboratorio con instalaciones para el manejo de patógenos pertenecientes al grupo 3 de bioseguridad. Ambos son hongos dimórficos, lo que significa que en el ambiente se encuentran en su forma micelial y en el enfermo en forma de levadura. La forma micelial es la que puede ser inhalada y supone un riesgo para el personal del laboratorio80. Los enfermos y las muestras clínicas, que tienen el hongo en su forma levaduriforme, no necesitan ser tratados con precauciones especiales y no se recomienda el aislamiento de los enfermos.
En los años 80 ya se publicó un caso en España de histoplasmosis adquirida en el laboratorio al trabajar con los cultivos fuera de la cabina de bioseguridad11. Por tanto, ante el actual incremento de casos de histoplasmosis en España, se deben extremar las precauciones en todos los cultivos realizados con muestras procedentes de enfermos con cuadros clínicos compatibles. La sospecha clínica y el antecedente epidemiológico son fundamentales, por lo que es necesario que el personal del laboratorio reciba esa información para que los cultivos sean manipulados en las instalaciones que les corresponde.
La visión de levaduras en muestras de enfermos con cuadros clínicos compatibles en un examen microscópico directo o en un estudio anatomo-patológico debe ser puesta en conocimiento del personal del laboratorio. No obstante, debe insistirse en que un examen microscópico negativo no descarta la infección.
Para la siembra se recomiendan tubos de plástico con tapón de rosca y, si esto no es posible, las placas deben estar dentro de cajas o bolsas con cierre hermético. Si es necesario el concurso de un centro de referencia, las muestras clínicas con sospecha de micosis endémica no necesitan requisitos adicionales de bioseguridad ya que portan la forma levaduriforme, pero los cultivos sí que deben ser enviados en paquetes especiales y con medidas de contención según las recomendaciones de la OMS y el artículo 21 del Convenio Postal Universal (B.O.E. n.° 303 de 27 de diciembre de 1966)81,82. Es obligatorio que todo el que manipule el paquete esté informado sobre el riesgo que conlleva el cultivo.
Se ha descrito recientemente un caso de histoplasmosis cutánea primaria adquirida en el laboratorio12. La infección se produjo por una inoculación accidental en un dedo con una aguja que contenía material de una adenopatía procedente de un paciente con histoplasmosis diseminada. El tratamiento inicial con itraconazol no fue eficaz y fue necesario realizar un drenaje quirúrgico para limpiar la lesión. Este caso, aunque poco frecuente, pone de manifiesto la necesidad de extremar la atención por parte del personal sanitario en la toma de muestras, en su envío y en el manejo de cultivos. Las recomendaciones internacionales y nacionales82 aconsejan que se elaboren procedimientos de laboratorio con protocolos específicos para el manejo de estos microorganismos y con planes de actuación en el caso de que se produzca un accidente en el laboratorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.