La endocarditis infecciosa (EI) es una enfermedad poco frecuente y grave. Actualmente, en países industrializados, los pacientes con EI son de edad avanzada, usualmente con algún tipo de valvulopatía degenerativa, y hasta en un 30% de los casos la infección es adquirida en relación con la atención sanitaria. En consecuencia, los microorganismos detectados con más frecuencia, como agentes etiológicos de la EI, son diferentes especies de estafilococos. El tratamiento de la EI ha experimentado cambios substanciales en las últimas décadas. En el caso de Staphylococcus aureus, agente causal más común de la enfermedad en el momento actual, la resistencia a la cloxacilina dificulta la elección de un tratamiento antibiótico óptimo. Otros agentes etiológicos frecuentes, como los enterococos y diversas especies de estreptococos, también muestran porcentajes elevados de resistencia a los antibióticos recomendados en las guías de práctica clínica. Pese a los continuos avances en el diagnóstico y en el tratamiento médico y quirúrgico, la mortalidad intrahospitalaria de la EI sigue siendo elevada. Los profundos cambios epidemiológicos observados en los últimos años condicionan que la profilaxis antibiótica pueda evitar pocos casos de esta enfermedad. La prevención de las bacteriemias de origen nosocomial, el diagnóstico precoz de la enfermedad, la identificación temprana de los pacientes con más riesgo, así como un abordaje multidisciplinar pueden ser estrategias válidas para mejorar el pronóstico de estos enfermos.
Infective endocarditis (IE) is an uncommon and severe disease. Nowadays, in developed countries, IE patients are older, usually have a degenerative heart valve disease, and up to 30% acquire this infection within the health care system. In consequence, staphylococci species are the most frequently isolated microorganisms. Antimicrobial treatment for IE has significantly changed over the last decades. In IE episodes due to Staphylococcus aureus, cloxacillin-resistance makes antimicrobial election more difficult. Other microorganisms, such as enterococci and some species of streptococci, show high rates of resistance to antimicrobial agents established in guidelines. Despite improvements in the diagnosis, and medical and surgical treatment of IE, this disease continues to be associated with high rates of in-hospital mortality. At present, due to epidemiological changes, antimicrobial prophylaxis can avoid few cases of IE. Prevention of nosocomial bacteremia, an early diagnosis of IE, prompt identification of IE patients at a higher risk of mortality, and a multidisciplinary approach of this disease could be valid strategies in order to improve the outcome of these patients.
La endocarditis infecciosa (EI) ha sido de forma constante una enfermedad infecciosa que ha despertado un enorme interés para la comunidad científica. Si se revisa con atención la literatura de las últimas décadas, se puede observar que hay un gran número de publicaciones (tanto guías1,2), revisiones3–5 y editoriales6–8 como estudios poblacionales9 y multicéntricos10,11) en que se aborda el concepto de endocarditis como enfermedad en constante evolución.
Aunque bien es cierto que esta enfermedad tiene poco que ver con lo que clásicamente incluían los tratados de medicina acerca de una infección estreptocócica, que anidaba en las válvulas patológicas de pacientes que habían sufrido fiebre reumática11,12, probablemente la situación no haya cambiado tanto desde finales del siglo xx. Lo que sí es seguro es que nuestra visión es ahora más profunda y más amplia, fruto del trabajo de un gran número de investigadores en todo el mundo. Por tanto, además de un cambio de la enfermedad en sí nos encontraríamos ante un cambio en una mayor calidad científica de los análisis realizados sobre la enfermedad. En los últimos años, los profesionales han tomado conciencia de que, como consecuencia del progreso médico, pueden ser responsables de un gran número de las infecciones10,13; que, a pesar de ello, son difícilmente prevenibles4,14; que los pacientes tienen cada vez una edad más avanzada15; que hay algunos enfermos que tienen unas características especiales que los hacen agrupables y analizables de forma independiente16–21, y que pese a los avances en el diagnóstico y en el tratamiento médico y quirúrgico de esta enfermedad, su mortalidad se mantiene estable a lo largo del tiempo22–25. En la presente revisión se abordarán los cambios epidemiológicos, terapéuticos y pronósticos más relevantes detectados en los últimos años y su posible impacto sobre la atención de los pacientes afectos de esta grave enfermedad infecciosa.
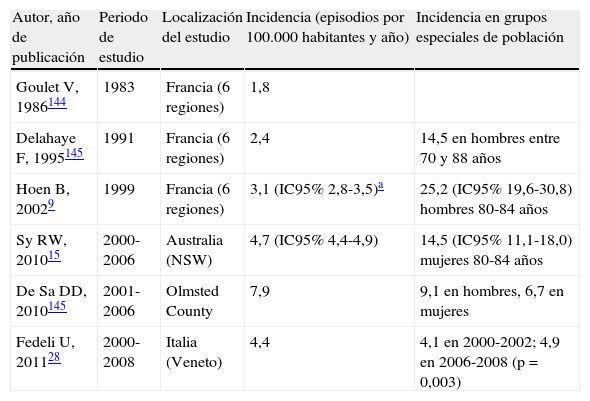
Cambios epidemiológicosIncidenciaEs indiscutible afirmar que la EI es una enfermedad poco frecuente. Se ha estimado que su incidencia cruda se mantiene estable entre 3,1 y 7,9 casos por 100.000 habitantes y año9,26. Sin embargo, este concepto de estabilidad se ha ido desdibujando con la publicación de los últimos estudios poblacionales27,28, en los que ya se ha acumulado suficiente evidencia como para afirmar que la incidencia es creciente y máxima en hombres mayores de 70 años, tal y como puede apreciarse en la tabla 1. Esta tendencia creciente es debida, en gran medida, a las infecciones adquiridas en relación con la atención sanitaria11,15.
Incidencia de la endocarditis infecciosa según diversos estudios poblacionales
| Autor, año de publicación | Periodo de estudio | Localización del estudio | Incidencia (episodios por 100.000 habitantes y año) | Incidencia en grupos especiales de población |
| Goulet V, 1986144 | 1983 | Francia (6 regiones) | 1,8 | |
| Delahaye F, 1995145 | 1991 | Francia (6 regiones) | 2,4 | 14,5 en hombres entre 70 y 88 años |
| Hoen B, 20029 | 1999 | Francia (6 regiones) | 3,1 (IC95% 2,8-3,5)a | 25,2 (IC95% 19,6-30,8) hombres 80-84 años |
| Sy RW, 201015 | 2000-2006 | Australia (NSW) | 4,7 (IC95% 4,4-4,9) | 14,5 (IC95% 11,1-18,0) mujeres 80-84 años |
| De Sa DD, 2010145 | 2001-2006 | Olmsted County | 7,9 | 9,1 en hombres, 6,7 en mujeres |
| Fedeli U, 201128 | 2000-2008 | Italia (Veneto) | 4,4 | 4,1 en 2000-2002; 4,9 en 2006-2008 (p=0,003) |
IC95%:intervalo de confianza al 95%; NSW: New South Wales.
La EI no es solo una enfermedad infrecuente, también es extremadamente grave (con una mortalidad intrahospitalaria entre el 18 y el 30%11,29, y hasta del 46% cuando se adquiere en relación con la atención sanitaria13) y compleja en su diagnóstico y manejo30, de lo que se derivan al menos dos consecuencias. En primer lugar, debería ser tratada por equipos multidisciplinares con suficiente experiencia, pues diferentes estudios han demostrado que este tipo de abordaje es capaz de disminuir la mortalidad intrahospitalaria31,32 y, al contrario, decisiones incorrectas en el momento del diagnóstico pueden llegar a triplicar el riesgo de fallecimiento33. En segundo lugar, los estudios existentes están sesgados por necesidad. Eso hace que la literatura sea en ocasiones discordante y poco clara y no puedan hallarse en ella las respuestas a muchas de las grandes preguntas de investigación.
Limitaciones de los estudios publicados (sesgo de selección y de referencia)La EI es una infección muy poco frecuente y muy grave que a menudo requiere de un tratamiento combinado médico y quirúrgico, por lo que los pacientes tienden a acumularse en hospitales de referencia que disponen de cirugía cardíaca. En consecuencia, son estas instituciones las que suelen generar la mayor parte de las publicaciones. En estos centros el sesgo es, al menos, doble. Por un lado, los hospitales de referencia atienden, en general, pacientes con un mayor grado de complejidad y realizan más procedimientos invasivos que los hospitales comunitarios, por lo que es esperable hallar un porcentaje más elevado de pacientes con EI que adquieren la infección en relación con la atención sanitaria (sesgo de selección). Por otro lado, reciben pacientes derivados desde otros hospitales con el diagnóstico o la sospecha de EI con el objetivo de ser sometidos a recambio valvular. No se suelen derivar pacientes sin ningún tipo de complicación o en estado terminal, lo que pone de manifiesto un claro sesgo de referencia33–35. Finalmente, la EI es una enfermedad que precisa un alto índice de sospecha para su diagnóstico, por lo que es probable que queden casos sin diagnosticar en hospitales con escasa experiencia clínica.
Así, las series publicadas por hospitales de referencia no tienen por qué reflejar fielmente la epidemiología de esta enfermedad, una limitación que ha sido reconocida en el único estudio multinacional publicado sobre la epidemiología actual de la endocarditis infecciosa11. Diversos estudios poblacionales, algunos de ellos de reciente publicación, han intentado que la foto de la EI sea más nítida. Sin embargo, estos estudios tampoco están exentos de sesgos. Por un lado, son escasos y abarcan zonas geográficas muy concretas. Por otro, aunque la definición de caso ha sido escrupulosamente establecida por algunos autores, la validez de dicha definición suscita algunas dudas en otros trabajos27,28.
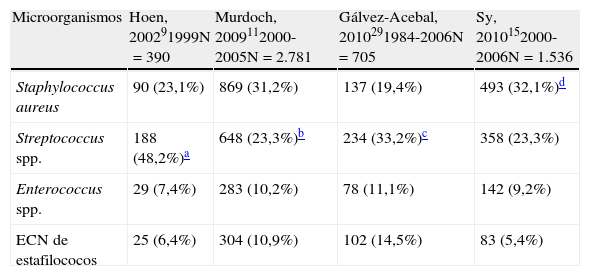
EtiologíaLa tabla 2 muestra la etiología de la EI en diferentes estudios recientes, tanto multicéntricos como poblacionales. Tal y como puede apreciarse, estafilococos y estreptococos (orales y del grupo D) son los microorganismos más frecuentemente aislados.
Etiología más frecuente de la endocarditis infecciosa en diferentes estudios multicéntricos y poblacionales
| Microorganismos | Hoen, 200291999N=390 | Murdoch, 2009112000-2005N=2.781 | Gálvez-Acebal, 2010291984-2006N=705 | Sy, 2010152000-2006N=1.536 |
| Staphylococcus aureus | 90 (23,1%) | 869 (31,2%) | 137 (19,4%) | 493 (32,1%)d |
| Streptococcus spp. | 188 (48,2%)a | 648 (23,3%)b | 234 (33,2%)c | 358 (23,3%) |
| Enterococcus spp. | 29 (7,4%) | 283 (10,2%) | 78 (11,1%) | 142 (9,2%) |
| ECN de estafilococos | 25 (6,4%) | 304 (10,9%) | 102 (14,5%) | 83 (5,4%) |
ECN: especies coagulasa negativo.
Desde una perspectiva de cambio epidemiológico merece la pena destacar, entre los microorganismos menos frecuentes, los bacilos gram-negativos. Estos representan menos del 2% de todos los casos de EI. Sin embargo, así como en el pasado estaban relacionados con el uso de drogas por vía parenteral, actualmente se asocian a la adquisición de la infección en relación con la atención sanitaria36.
Finalmente, técnicas diagnósticas relativamente nuevas han permitido llegar al diagnóstico definitivo de las endocarditis con hemocultivos negativos, que representan entre un 2,5 y un 31% de todos los casos37, variando el porcentaje en función de la epidemiología de cada hospital. En nuestra experiencia, menos del 4% de las endocarditis entran dentro de esta categoría, en su mayor parte por toma previa de antibióticos. Aunque se ha sugerido un algoritmo diagnóstico para estos casos que incluye serologías de Coxiella burnetti y Bartonella, PCR en sangre de Tropheryma whipplei, Bartonella y hongos, así como la aplicación de la biología molecular a las muestras de biopsias valvulares para la detección de secuencias de amplio espectro de RNA ribosomal 16S y 18S38, lo más útil es conocer la epidemiología de cada centro antes de abordar estudios microbiológicos específicos.
Factores de riesgoValvulopatías y dispositivos intracardíacosAunque Staphylococcus aureus y los enterococos tienen la capacidad de adherirse al endotelio sano, lo habitual es que la endocarditis comience en una lesión preexistente, conocida o no39. En países industrializados, la incidencia de enfermedad valvular reumática ha descendido dramáticamente hasta casi desaparecer, por lo que hoy en día prácticamente no se tiene en cuenta como factor de riesgo de EI en este medio. De forma paralela al descenso de la patología reumática ha aumentado el porcentaje de personas con algún tipo de valvulopatía degenerativa, que puede llegar a ser del 50% en mayores de 60 años40, lo que conlleva un mayor riesgo de EI. En un estudio multinacional, el 32% de los pacientes tenían algún tipo de patología predisponente sobre las válvulas nativas y el 12% tenían algún tipo de valvulopatía congénita11.
La incidencia de endocarditis protésica en pacientes con recambio valvular es de 0,3 a 0,7 episodios por cada 100 personas y año41,42 y las endocarditis protésicas representan entre el 13 y el 22% del total de endocarditis infecciosas11,15. El factor de riesgo más importante para la infección precoz de la válvula protésica, entendida como la que ocurre durante el primer año tras su inserción43, es la contaminación durante el acto quirúrgico, por lo que los microorganismos más frecuentemente detectados son las especies de estafilococo coagulasa negativo (ECN), usualmente resistentes a la cloxacilina. Una vez transcurrido este periodo de tiempo, la válvula queda recubierta de endotelio y la microbiología de la endocarditis protésica se asemeja a la de la endocarditis sobre válvula nativa.
Finalmente, estudios poblacionales han demostrado que el número de endocarditis asociadas a dispositivos intracardíacos se ha ido incrementando a medida que también ha aumentado el número de dispositivos insertados44,45. Un trabajo francés describió una incidencia de 55 episodios por 100.000 pacientes con marcapasos y año46. La mayor parte de las infecciones se producen durante la inserción del dispositivo o durante el recambio del generador, pueden permanecer asintomáticas durante meses e incluso años, el microorganismo más frecuentemente aislado es una especie de ECN y necesitan de la retirada de todo el sistema para su curación definitiva47.
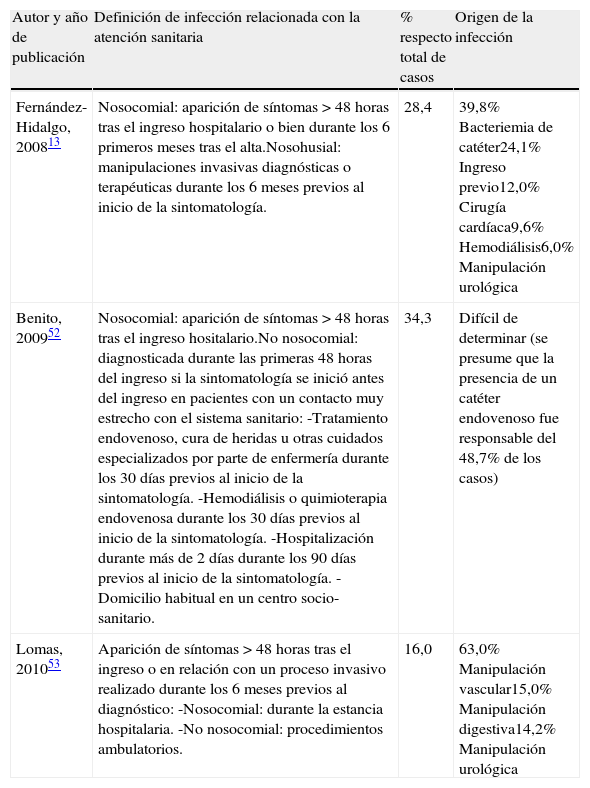
Endocarditis relacionada con la atención sanitaria (ERAS)Pese a que a lo largo de la última década del siglo pasado y la primera del presente se han publicado diversos estudios sobre endocarditis nosocomial48–50, este factor de riesgo ya fue descrito por Osler en 188551. En su revisión de 209 casos, 37 pacientes habían sido diagnosticados durante el transcurso de un ingreso hospitalario por traumatismo o durante el puerperio. Sin embargo, la aportación más importante en los últimos tres años ha sido la toma de conciencia del hecho de que la endocarditis puede adquirirse tanto como consecuencia de un ingreso hospitalario como de las manipulaciones diagnósticas o terapéuticas realizadas de forma ambulatoria13,52,53. Esto ha llevado a substituir el concepto de endocarditis nosocomial por el de endocarditis relacionada con la atención sanitaria y a extremar las medidas de asepsia en la realización de cualquier procedimiento invasor1.
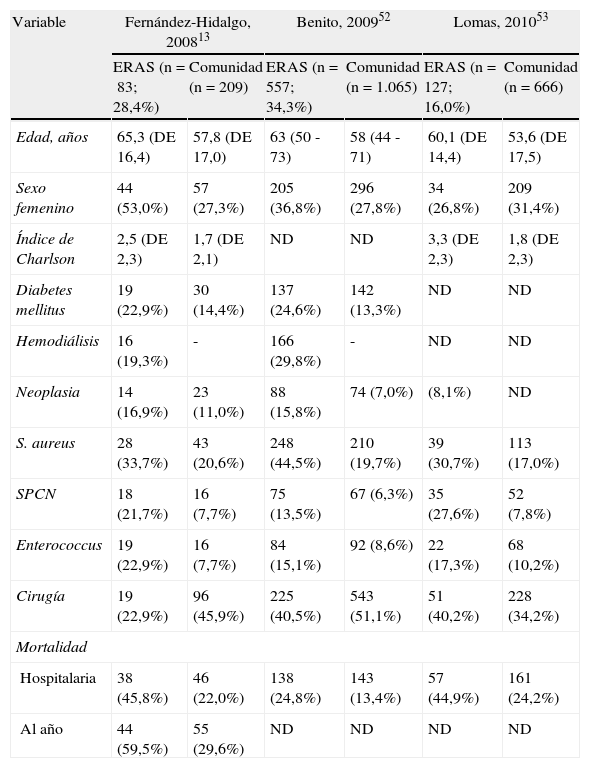
Pese a la heterogeneidad de los estudios sobre ERAS, con divergencias considerables en la definición de caso tal y como puede apreciarse en la tabla 3, todos coinciden en una serie de características. En comparación con los pacientes que adquieren la infección en la comunidad, aquellos con ERAS tienen una edad media entre 5 y 8 años mayor, presentan más comorbilidad asociada, medida tanto por el índice de Charlson como por el porcentaje individual de determinadas afecciones (diabetes mellitus, fallo renal crónico en hemodiálisis, neoplasias), presentan más infecciones estafilocócicas y enterocócicas, así como una mortalidad intrahospitalaria claramente superior. Finalmente, la adquisición de la infección en relación con la atención sanitaria es un factor de riesgo independiente de la mortalidad intrahospitalaria y después del primer año de seguimiento13,52,53 (tabla 4).
Definición de endocarditis relacionada con atención sanitaria y origen presumible de la infección en 3 estudios prospectivos y contemporáneos
| Autor y año de publicación | Definición de infección relacionada con la atención sanitaria | % respecto total de casos | Origen de la infección |
| Fernández-Hidalgo, 200813 | Nosocomial: aparición de síntomas >48 horas tras el ingreso hospitalario o bien durante los 6 primeros meses tras el alta.Nosohusial: manipulaciones invasivas diagnósticas o terapéuticas durante los 6 meses previos al inicio de la sintomatología. | 28,4 | 39,8% Bacteriemia de catéter24,1% Ingreso previo12,0% Cirugía cardíaca9,6% Hemodiálisis6,0% Manipulación urológica |
| Benito, 200952 | Nosocomial: aparición de síntomas >48 horas tras el ingreso hositalario.No nosocomial: diagnosticada durante las primeras 48 horas del ingreso si la sintomatología se inició antes del ingreso en pacientes con un contacto muy estrecho con el sistema sanitario:-Tratamiento endovenoso, cura de heridas u otras cuidados especializados por parte de enfermería durante los 30 días previos al inicio de la sintomatología.-Hemodiálisis o quimioterapia endovenosa durante los 30 días previos al inicio de la sintomatología.-Hospitalización durante más de 2 días durante los 90 días previos al inicio de la sintomatología.-Domicilio habitual en un centro socio-sanitario. | 34,3 | Difícil de determinar (se presume que la presencia de un catéter endovenoso fue responsable del 48,7% de los casos) |
| Lomas, 201053 | Aparición de síntomas >48 horas tras el ingreso o en relación con un proceso invasivo realizado durante los 6 meses previos al diagnóstico:-Nosocomial: durante la estancia hospitalaria.-No nosocomial: procedimientos ambulatorios. | 16,0 | 63,0% Manipulación vascular15,0% Manipulación digestiva14,2% Manipulación urológica |
Comparación de las características de los pacientes con endocarditis relacionada con la atención sanitaria (ERAS) con las de los pacientes que adquieren la endocarditis en la comunidad
| Variable | Fernández-Hidalgo, 200813 | Benito, 200952 | Lomas, 201053 | |||
| ERAS (n=83; 28,4%) | Comunidad (n=209) | ERAS (n=557; 34,3%) | Comunidad (n=1.065) | ERAS (n=127; 16,0%) | Comunidad (n=666) | |
| Edad, años | 65,3 (DE 16,4) | 57,8 (DE 17,0) | 63 (50 - 73) | 58 (44 - 71) | 60,1 (DE 14,4) | 53,6 (DE 17,5) |
| Sexo femenino | 44 (53,0%) | 57 (27,3%) | 205 (36,8%) | 296 (27,8%) | 34 (26,8%) | 209 (31,4%) |
| Índice de Charlson | 2,5 (DE 2,3) | 1,7 (DE 2,1) | ND | ND | 3,3 (DE 2,3) | 1,8 (DE 2,3) |
| Diabetes mellitus | 19 (22,9%) | 30 (14,4%) | 137 (24,6%) | 142 (13,3%) | ND | ND |
| Hemodiálisis | 16 (19,3%) | - | 166 (29,8%) | - | ND | ND |
| Neoplasia | 14 (16,9%) | 23 (11,0%) | 88 (15,8%) | 74 (7,0%) | (8,1%) | ND |
| S. aureus | 28 (33,7%) | 43 (20,6%) | 248 (44,5%) | 210 (19,7%) | 39 (30,7%) | 113 (17,0%) |
| SPCN | 18 (21,7%) | 16 (7,7%) | 75 (13,5%) | 67 (6,3%) | 35 (27,6%) | 52 (7,8%) |
| Enterococcus | 19 (22,9%) | 16 (7,7%) | 84 (15,1%) | 92 (8,6%) | 22 (17,3%) | 68 (10,2%) |
| Cirugía | 19 (22,9%) | 96 (45,9%) | 225 (40,5%) | 543 (51,1%) | 51 (40,2%) | 228 (34,2%) |
| Mortalidad | ||||||
| Hospitalaria | 38 (45,8%) | 46 (22,0%) | 138 (24,8%) | 143 (13,4%) | 57 (44,9%) | 161 (24,2%) |
| Al año | 44 (59,5%) | 55 (29,6%) | ND | ND | ND | ND |
DE: desviación estándar; ND: no disponible.
Un subgrupo especial de pacientes que adquieren la infección en relación con la atención sanitaria es el de aquellos en tratamiento substitutivo con hemodiálisis. En las series generales, estos representan entre un 2 y un 6% del total de pacientes con EI13,29. Los factores predisponentes para EI en esta población son el deterioro inmunitario inherente a la enfermedad renal, la calcificación valvular por alteración del metabolismo fosfocálcico y, fundamentalmente, la presencia de un acceso intravascular en continuo uso. Respecto a este último, se estima que el riesgo relativo de bacteriemia es de 7,6 para los portadores de catéteres, frente a 1,3 en los portadores de fístulas54.
Es difícil establecer la incidencia real de endocarditis en esta población ya que las bacteriemias relacionadas con el catéter son frecuentes, no se practican ecocardiogramas de forma sistemática ante cada episodio de bacteriemia e incluso, aunque se realizaran, las calcificaciones valvulares pueden hacer muy difícil interpretar las imágenes obtenidas. Sin embargo, diversos estudios han estimado que la incidencia de endocarditis es entre 50 y 60 veces superior a la de la población general9,55 y tres veces superior en el caso de infección del acceso venoso54.
A pesar de que el principal factor de riesgo es la presencia de un acceso intravenoso permanente, la mayoría de las infecciones no se localizan en el lado derecho del corazón sino en las válvulas mitral y aórtica, por este orden. S. aureus es el microorganismo aislado con más frecuencia (40-80%) y la mortalidad es del 25-50%, significativamente superior a la de la población general18,54–57.
AncianosLa edad media de los pacientes con EI se ha ido incrementando con el paso del tiempo9,15 y, a su vez, la incidencia de la enfermedad aumenta con la edad9 (tabla 1). Esto último es debido a que los pacientes de edad avanzada tienen una mayor prevalencia de cardiopatías predisponentes, así como de patología genitourinaria y gastrointestinal16,58. En consecuencia, son más proclives a ser sometidos a técnicas diagnósticas y terapéuticas invasoras y, por tanto, a adquirir la infección en relación con la atención sanitaria59. Con la edad, también aumenta la proporción de mujeres16,60 y la prevalencia de enfermedades de base como la diabetes mellitus y las neoplasias16,58.
Dos estudios multicéntricos muestran que en esta población el microorganismo más frecuentemente aislado es S. aureus, con una proporción creciente de resistencia a la cloxacilina en función de la edad, seguido de enterococo y Streptococcus bovis16,58. Estos mismos coinciden en describir que los pacientes de mayor edad presentan con menos frecuencia embolias y fenómenos inmunitarios. Sin embargo, no hay consenso en qué grupo de edad presenta vegetaciones y complicaciones perianulares con más frecuencia.
No hay consenso respecto a si la edad es un factor pronóstico independiente, ya que diversos estudios muestran resultados dispares. El estudio más extenso realizado hasta la fecha demostró que una edad superior a 65 años era un factor independiente de mortalidad58. Sin embargo, un estudio multicéntrico español objetivó que, pese a que existía una tendencia creciente en la mortalidad intrahospitalaria en función de la edad, las diferencias se debían a un incremento en la mortalidad postoperatoria, ya que la mortalidad de los pacientes no sometidos a cirugía se mantuvo estable en los diferentes grupos de edad16.
Pacientes con cirrosis hepáticaEn diferentes cohortes españolas, la prevalencia de hepatopatía crónica en pacientes con EI oscila entre el 5 y el 17%29,61, siendo la de cirrosis hepática hasta del 10%17.
Si bien estas cifras han de ser tomadas con cautela, es indiscutible que la cirrosis hepática predispone al desarrollo de infecciones bacterianas, ya sea por la propia inmunodepresión asociada a la hepatopatía, o por la realización de procedimientos invasivos. De hecho, una serie reciente muestra que alrededor del 40% de pacientes cirróticos padecían una ERAS, frente a menos del 20% en el resto de los enfermos17. En este mismo estudio, los pacientes cirróticos tenían una edad media 10 años inferior a la de los pacientes sin hepatopatía y el microorganismo más frecuentemente aislado fue S. aureus (25%), seguido por los estreptococos beta-hemolíticos (20%). Aunque no se objetivaron diferencias significativas entre los dos grupos respecto a complicaciones como insuficiencia cardíaca o émbolos isquémicos cerebrales, la insuficiencia renal fue más frecuente en cirróticos. También estos pacientes fueron sometidos a cirugía de recambio valvular con menos frecuencia (menos de un 50% de los pacientes con indicación quirúrgica teórica) por un riesgo inasumible. La mortalidad cruda fue del 51%, 17% en pacientes en estadio Child A y aproximadamente del 75% en pacientes con estadios Child B y C. Estos datos han sido corroborados por un estudio multicéntrico29, por lo que la cirugía debería ser indicada de forma muy cuidadosa en estos pacientes y probablemente ser desaconsejada en caso de enfermedad hepática avanzada.
Adicción a drogas por vía parenteral (ADVP)En las últimas publicaciones se considera que uno de los cambios epidemiológicos ha sido la aparición de las endocarditis relacionadas con la ADVP5,7,11. Si bien es cierto que el estudio multinacional más importante sobre endocarditis demuestra que un 10% de todas las endocarditis infecciosas recogidas entre enero de 2000 y agosto de 2005 ocurría en adictos a drogas por vía parenteral11, este estudio no está exento de sesgos de selección y de referencia por lo que los datos han de ser evaluados con cautela. En los países europeos que participaron en el estudio, la proporción de ADVP era del 9%. Aunque no se publicaron los datos por países, es fácil pensar que estas diferencias existen. La ADVP fue un problema muy importante en la Europa central y occidental durante los años 80. Desde entonces, el problema se ha desplazado a los países del antiguo bloque del este. Muestra de ello es que en una serie de 469 episodios de endocarditis recogidos desde enero de 2000 hasta mayor de 2011 en nuestro hospital, el 6% de los pacientes eran adictos, la mayor parte de ellos concentrados en la primera mitad del periodo de estudio. Porcentajes similares pueden observarse en una cohorte andaluza que incluye pacientes entre 1984 y 2006 (7%)29.
Factores protectoresGénero femeninoLas diferentes series publicadas coinciden en el hecho de que la EI es una enfermedad más frecuente entre los hombres que entre las mujeres, con una razón aproximadamente de 2:111,15,28. Para explicar esta diferencia se ha sugerido que los estrógenos tienen un papel protector frente al daño endotelial62. Muestra de ello es que, en general, las enfermedades cardiovasculares aparecen más tarde en las mujeres.
A pesar de ser un factor protector, los datos crudos de diversos estudios centrados en las diferencias de género en la EI indican que el pronóstico de esta enfermedad es peor en mujeres que en hombres, con una mortalidad intrahospitalaria del 22,5 al 35% frente al 12,7-28%21,63,64. Sin embargo, un análisis pormenorizado de las series demuestra que el exceso de riesgo de mortalidad intrahospitalaria en las mujeres no se debe al género en sí, sino a las comorbilidades acompañantes.
¿Profilaxis antibiótica?La base teórica de la profilaxis de la EI es bien sencilla: administrar antibióticos para disminuir el riesgo de bacteriemia en procedimientos invasores. Este concepto es el que llevó a ampliar progresivamente las indicaciones de profilaxis hasta finales del siglo pasado4, momento en que se contemplaba administrar antibióticos incluso ante la realización de una traqueostomía.
Sin embargo, a principios del siglo xxi, un nuevo movimiento de opinión consideró que se debería revisar las guías de profilaxis por diversos motivos: 1) no existe una evidencia clara de la utilidad de la profilaxis en procedimientos dentales65,66; 2) la profilaxis tiene poco impacto en el número total de endocarditis en la comunidad67; 3) es mucho más probable que la EI se produzca como consecuencia de bacterias asociadas con actividades diarias (cepillado de dientes, mascar chicle) que por manipulaciones dentales, gastrointestinales o del tracto genitourinario68,69; 4) el mantenimiento de una higiene bucal óptima puede reducir la incidencia de la bacteriemia asociada con las actividades diarias y es más útil que la profilaxis antibiótica, y 5) el riesgo de efectos adversos por antibióticos excede el beneficio potencial, si existe, de la profilaxis antibiótica.
A partir de estos supuestos, las guías europea1 y americana2 redujeron las indicaciones de profilaxis a procedimientos de riesgo en personas de alto riesgo: procedimientos dentales en pacientes con válvulas protésicas, con válvulas reparadas utilizando material protésico, con lesiones congénitas cardíacas, con trasplante cardíaco, con lesiones valvulares o con endocarditis previa. La guía europea remarcó, además, la importancia de la asepsia en la manipulación de catéteres venosos y la realización de cualquier procedimiento invasor13.
En vista de la escasa evidencia científica a favor de la profilaxis, el UK National Institute for Health and Clinical Excellence (NICE) publicó en marzo de 2008 su recomendación de abandonar completamente la profilaxis antibiótica en pacientes con riesgo de endocarditis70. Un estudio poblacional evaluó retrospectivamente las consecuencias de las nuevas recomendaciones y observó que tras la instauración de las normas hubo una disminución del 78,6% en la prescripción de antibióticos como profilaxis. Pese a ello, no se modificó la tendencia creciente en la incidencia de endocarditis durante los dos años siguientes27. Los autores concluyeron que este estudio apoyaba las recomendaciones del NICE, aunque los resultados no excluyen que pueda existir un pequeño número de pacientes (como por ejemplo, los portadores de válvulas protésicas) que puedan beneficiarse de la profilaxis.
Cambios terapéuticosTratamiento antimicrobiano de los patógenos más comunesLa EI es una infección caracterizada por la presencia de vegetaciones relacionadas con la invasión del endocardio de las válvulas nativas o la superficie de las protésicas por microorganismos, especialmente bacterias. Antes del desarrollo de la antibioticoterapia era una enfermedad invariablemente fatal. Sin embargo, en la actualidad alrededor de un 80% de los pacientes sobreviven tras la aplicación de una terapéutica, en ocasiones combinada médica y quirúrgica, adecuada. En algunas circunstancias (EI causada por organismos muy virulentos, como S. aureus u hongos, EI protésicas precoces o EI con múltiples complicaciones) la mortalidad puede ser muy elevada a pesar de la elección de una pauta antimicrobiana con eficacia frente al patógenos causal11,33,71.
La respuesta al tratamiento antimicrobiano en la EI depende de la erradicación completa de los organismos en el interior de la lesión valvular. La propia estructura de las vegetaciones y la elevada densidad del inóculo microbiano (a menudo de 109 o 1010 unidades formadoras de colonias/g), que además puede estar en unas situaciones de actividad metabólica y de división celular reducidas, condicionan que la acción de la mayoría de antimicrobianos, sobre todo los betalactámicos, dependa de alcanzar concentraciones muy elevadas en el medio y tiempos prolongados de exposición con el objetivo de evitar las recidivas de la infección72,73.
Tal y como hemos visto, la EI es una infección relativamente infrecuente, por lo que es muy compleja la validación de su tratamiento en estudios aleatorizados. La mayoría de la información se obtiene de los estudios de actividad microbiológica in vitro de los antimicrobianos usados para su terapéutica, de los resultados de los modelos de experimentación animal y de la evolución clínica de los numerosos estudios observacionales publicados. Diversas organizaciones aportan periódicamente guías para el tratamiento de la EI que, habitualmente, son seguidas de manera uniforme por los profesionales que atienden a estos pacientes1,2,74–77.
Tratamiento antibiótico empíricoEn general, la terapia de la EI tendría que dirigirse hacia los organismos detectados en los hemocultivos, que resultan positivos en al menos el 90% de los episodios. En los pacientes con sospecha de EI sin síntomas agudos o de gravedad la terapia empírica no es siempre necesaria, ya que el resultado de los cultivos se demora únicamente 48-72 horas y su conocimiento es crucial para la asignación del tratamiento antimicrobiano de mayor utilidad.
En los casos de infección aguda grave y sospecha elevada de EI puede iniciarse una terapia antibiótica empírica, tras la extracción previa de al menos dos o tres muestras separadas de sangre por venopunción para la práctica de hemocultivos. La elección inicial depende de diversas consideraciones: a) los antecedentes de toma previa de antimicrobianos; b) el tipo de EI (sobre válvulas nativas o sobre prótesis valvulares, de inicio precoz o tardío), y c) la frecuencia local de determinados organismos, en especial, de bacterias resistentes a los antibióticos. En la tabla 5 se exponen, con algunas modificaciones aportadas por los autores de este artículo, las recomendaciones actuales aportadas por la European Society of Cardiology para el tratamiento empírico de los pacientes afectos de EI1.
Recomendaciones terapéuticas empíricas de la endocarditis infecciosa (tomada de referencia 1 con modificaciones)
| Régimen antibiótico | Dosis y vía de administración | Duración (semanas) | Comentarios |
| Amoxicilina-ácido clavulánicomás gentamicinaa | 2g/6-8h iv3mg/Kg/d iv o im dividido en 2-3 dosis | 4-64-6 | Pacientes con hemocultivos negativos y bajo la supervisión de un experto en enfermedades infecciosas |
| Vancomicinabcongentamicinaaconciprofloxacinoc | 15mg/Kg/12h iv3mg/Kg/d iv o im dividido en 2-3 dosis500mg/12h oral o 400mg/8h iv | 4-64-64-6 | Si no pueden administrarse betalactámicos. Si existe riesgo de toxicidad renal, la daptomicina (a dosis de 8-10mg/Kg cada 24h iv) puede sustituir a la vancomicina y la gentamicina |
| Vancomicinabcongentamicinaaconrifampicina | 15mg/Kg/12h iv3mg/Kg/d iv o im dividido en 2-3 dosis600mg/12h oral | 626 | Pauta para endocarditis protésicas precoces. En ausencia de respuesta clínica se ha de considerar la cirugía y ampliar la cobertura frente a bacterias gram negativo. Si existe riesgo de toxicidad renal, la daptomicina (a dosis de 8-10mg/Kg cada 24h iv) puede sustituir a la vancomicina y la gentamicina |
La función renal y las concentraciones plasmáticas de gentamicina se han de monitorizar al menos una vez por semana. Si se administra en dosis única diaria, el valor pre-dosis (valle) debe de ser inferior a 1μg/mL y el valor pos-dosis (pico) estar situado alrededor de 10-12μg/mL.
Las diversas especies de estreptococos que constituyen el grupo viridans (EGV) y los estreptococos del grupo D no enterococos (S. bovis, ahora denominado S. gallolyticus) ocasionan aproximadamente la mitad de las endocarditis de las válvulas nativas adquiridas en la comunidad y son, en general, altamente sensibles a la penicilina (concentración mínima inhibitoria [CMI]≤0,12μg/mL). Algunas cepas muestran una sensibilidad intermedia (CMI 0,12-0,5μg/mL) y, en raras ocasiones, la infección está causada por una especie considerada resistente (CMI>0,5μg/mL). Además, aproximadamente un 15% de las cepas de S. mutans muestran un valor de CMI bajo (<0,1μg/mL), aunque con una concentración mínima bactericida (CMB) mucho más elevada (de 1,25 a 50μg/mL). Estos organismos deberían ser considerados como tolerantes a la penicilina y valorarse por ello la administración de un tratamiento antibiótico diferenciado78,79.
La tolerancia a la penicilina por parte de los EGV se define como la existencia de un cociente CMB:CMI igual o superior a 32. La mayoría de cepas de las variantes nutricionalmente deficientes de estreptococos muestran tolerancia a la penicilina. La influencia del fenómeno de la tolerancia en la respuesta al tratamiento con penicilina en la endocarditis no es bien conocida, ya que los resultados en el modelo experimental son contradictorios y no existe suficiente información en la infección en humanos. Únicamente en los casos de variantes nutricionalmente deficientes, la demostración de la tolerancia por una cepa de SGV ha de influenciar en las decisiones del tratamiento antibiótico80,81.
La EI causada por EGV con sensibilidad intermedia a la penicilina o por especies nutricional-deficientes han de ser tratadas con dosis elevadas de penicilina G sódica (24 millones UI/día) o ceftriaxona (2g/día) durante 4 semanas. La gentamicina, a dosis de 3mg/Kg de peso y día iv o im, tanto en dosis única como dividida en 3 administraciones diarias, se ha de añadir siempre durante las dos primeras semanas. Algunas cepas de estreptococos orales y otros organismos semejantes (ej.: Abiotrophia defectiva, Granulicatella spp. y Gemella spp.) pueden tener una CMI a la penicilina>0,5μg/mL y por ello se consideran como altamente resistentes a este antibiótico. Estas infecciones deberían tratarse con las recomendaciones aplicadas a las endocarditis enterocócicas. En raras ocasiones, la CMI para la penicilina puede ser ≥4μg/mL, situación que obliga a utilizar terapias alternativas como glucopéptidos o daptomicina, previa realización de estudios de sensibilidad de la cepa detectada en los hemocultivos78–82.
Aunque la mayoría de otras especies de estreptococos son muy sensibles a la penicilina, algunas cepas de estreptococos betahemolíticos de los grupos B, C y G (incluyendo el grupo S. milleri [S. constellatus, S. anginosus y S. intermedius]) pueden mostrar disminución de la sensibilidad. El tratamiento antibiótico ha de ser similar al de la EI causada por estreptococos orales, excepto que no se utiliza nunca la pauta de terapia corta. Algunos autores recomiendan añadir gentamicina durante las primeras 2 semanas a un tratamiento de 4-6 semanas de duración83–85.
EnterococosEn el momento actual, las diversas especies de enterococo ocasionan alrededor de un 5-15% del total de las EI, afectando generalmente a las válvulas izquierdas de varones de edad avanzada con patología genitourinaria o digestiva previa. Alrededor de un 90% de los casos están causadas por Enterococcus faecalis y el resto por E. faecium y otras especies menos frecuentes11,33,59,86.
Los enterococos presentan una menor sensibilidad a los antibióticos que los estreptococos. La mayoría de las especies son resistentes a concentraciones bajas de penicilina, mostrando también una resistencia relativa a las penicilinas de amplio espectro y a la vancomicina y total a las cefalosporinas y a los aminoglucósidos, cuando los mismos se utilizan a las dosis estándar de tratamiento. Los valores de CMI para la penicilina oscilan entre 0,4 y 12,5μg/mL, mientras que la ampicilina tiene aproximadamente el doble de actividad in vitro. E. faecium es más resistente a los betalactámicos que E. faecalis. Los valores de CMB son muy superiores en todos los antibióticos activos frente a enterococos, por lo que son considerados siempre como bacteriostáticos y han de ser utilizados de forma combinada para el tratamiento de esta enfermedad. En los estudios in vitro y en los modelos experimentales se ha comprobado una acción sinérgica y bactericida con la asociación de penicilina, ampicilina o vancomicina con un aminoglucósido, como la gentamicina87.
Además de lo anteriormente expuesto, los enterococos pueden exhibir diferentes mecanismos de resistencia a los antibióticos. De forma excepcional, se han descrito cepas de E. faecalis (y en menor grado de E. faecium) productoras de betalactamasas mediada por plásmidos, que presentan generalmente asociada una resistencia de alto nivel a los aminoglucósidos. En más de un 20% de las cepas de enterococos causantes de EI se detecta resistencia de alto nivel (CMI≥2.000μg/mL) a la gentamicina y en más de un 60% a la estreptomicina. Este tipo de resistencia, debida a enzimas modificantes de aminoglucósidos, condiciona la pérdida del efecto sinérgico de dichos antibióticos. E. faecium y E. raffinosus muestran de manera habitual resistencia elevada (CMI≥128μg/mL) a los betalactámicos por un mecanismo, de tipo cromosómico, de perturbación de las proteínas fijadoras de penicilina de la pared bacteriana. Por último, en años recientes se han descrito casos de EI causados por enterococos con resistencia elevada a la vancomicina y a la ampicilina, mostrando alguno de ellos sensibilidad a la teicoplanina88–90.
En estudios in vitro se ha comprobado que la asociación de dos betalactámicos, como la ampicilina y la ceftriaxona, muestra un claro efecto sinérgico y bactericida frente a E. faecalis. Este efecto se debe a la posibilidad de ambos antibióticos de saturar al menos cuatro de las cinco mayores proteínas fijadoras de penicilina de los enterococos91. En el modelo experimental de endocarditis enterocócica esta asociación es capaz de reducir de manera significativa el número de bacterias viables en el interior de las vegetaciones (llegando incluso a su esterilización en un gran número de casos) respecto al tratamiento con ampicilina o vancomicina de forma aislada. El efecto sinérgico se observa de igual manera en las cepas sensibles y en las que muestran resistencia de alto nivel a los aminoglucósidos92,93.
Los patrones de sensibilidad de los enterococos a los antibióticos tienen un gran impacto sobre la elección del tratamiento de la endocarditis enterocócica. Para la terapia de las EI causadas por cepas consideradas como sensibles se recomienda la combinación de un betalactámico, ampicilina o penicilina a las dosis máximas por vía iv, con gentamicina a las dosis habituales divididas en tres administraciones diarias. Esta combinación, administrada durante 4 semanas, se considera adecuada si la duración de la sintomatología clínica no excede los 3 meses. En los casos de duración más prolongada de la enfermedad, así como en las endocarditis sobre la válvula mitral, recidivantes o protésicas, la terapéutica antibiótica ha de extenderse hasta las 6 semanas. En un estudio prospectivo reciente, realizado en Suecia, se ha comprobado que la administración de la gentamicina durante las primeras dos semanas del tratamiento ofrece una tasa de curación superior al 80%, con la disminución potencial de la nefrotoxicidad asociada94. En los pacientes con hipersensibilidad a los betalactámicos se ha de utilizar la combinación de vancomicina y gentamicina a las dosis habituales, durante un periodo de 6 semanas, o bien, realizar una desensibilización si fuera posible.
La terapéutica de las infecciones causadas por cepas con alto nivel de resistencia a los aminoglucósidos no está completamente estandarizada. En los casos excepcionales de infección por cepas resistentes a gentamicina y sensibles a estreptomicina, este antibiótico (a dosis capaces de obtener una concentración plasmática máxima de 9,1μg/mL) puede añadirse al betalactámico para la terapéutica. En la mayoría de casos la resistencia elevada a todos los aminoglucósidos obliga a utilizar una pauta prolongada (8 a 12 semanas) de penicilina (20 a 40 millones de UI por día en 6 dosis) o ampicilina (2 a 3g cada 4 horas o la misma dosis en infusión continua) con unas tasas de curación que no son superiores al 50%, por lo que un gran número de pacientes precisan de cirugía para la curación de la enfermedad. En el momento actual, se considera que la asociación de ampicilina, a dosis de 2g cada 4 horas, con ceftriaxona, a dosis de 2g cada 12 horas, puede ser la terapia de elección para los pacientes con EI causadas por estas cepas altamente resistentes a los aminoglucósidos. Con esta combinación también se han comprobado buenos resultados para el tratamiento de infecciones causadas por cepas sensibles a los aminoglucósidos y, por ello, debería ser contemplada como de primera elección en todos los pacientes con riesgo potencial de nefrotoxicidad secundaria a dichos antibióticos95.
La terapéutica de las endocarditis causadas por cepas resistentes a la vancomicina no está bien establecida. La teicoplanina, el linezolid o la daptomicina podrían ser de utilidad en combinación con gentamicina si existe sinergia demostrada, en casos de demostrarse actividad en los estudios de sensibilidad. La triple combinación de penicilina a dosis elevadas, vancomicina y gentamicina parece ser prometedora en el modelo animal, aunque no existe experiencia clínica de su uso96–98.
EstafilococosStaphylococcus spp. constituye en el momento actual la etiología más frecuente de la EI. S. aureus ocasiona más del 25% de los casos en las series recientes. El éxito terapéutico en la endocarditis estafilocócica depende de factores del paciente (incluyendo si están afectadas las válvulas derechas o las izquierdas o si la infección es sobre una válvula nativa o protésica) y de factores relacionados con el patógeno (con la inclusión de si la prueba de la coagulasa del organismo es negativa o positiva y de su correspondiente sensibilidad antimicrobiana). La mortalidad asociada continúa siendo muy elevada, superior al 25% en las formas agudas de la enfermedad, en especial en varones, en pacientes de edad superior a los 50 años, en la afectación de las válvulas izquierdas y en aquellos con manifestaciones del sistema nervioso central10,99–101.
Recientemente se ha publicado que la daptomicina, a dosis diaria de 6mg/Kg de peso, posee una eficacia equivalente al tratamiento estándar de la bacteriemia y la endocarditis por S. aureus con un menor riesgo de toxicidad renal102. En diferentes registros observacionales posteriores a su autorización en EE.UU. y en Europa, se ha comprobado una eficacia elevada de este antibiótico para el tratamiento de la EI causada por este microorganismo, tanto afectando a las válvulas derechas como a las izquierdas con independencia de su nivel de sensibilidad a los betalactámicos103,104. La posible aparición de resistencia durante el tratamiento, con el consiguiente fracaso clínico y bacteriológico, hace recomendar a muchos autores el uso de la daptomicina a dosis diarias más elevadas (8-10mg/Kg de peso) que las aprobadas para la terapia de las infecciones bacteriémicas por S. aureus105,106.
La vancomicina ha sido el antimicrobiano de referencia para el tratamiento de las infecciones por S. aureus resistente a la meticilina (SARM) y es el fármaco con el que hay más experiencia acumulada, incluyendo la terapia para infecciones graves como la neumonía, la endocarditis, la meningitis y la osteomielitis. Sin embargo, las publicaciones de los últimos años sugieren que la vancomicina puede tener una menor eficacia en la terapéutica de las infecciones causadas por cepas con una sensibilidad a la vancomicina superior a 1μg/mL107,108. El aumento relevante de la prevalencia de estas cepas en infecciones sistémicas hace aconsejable conocer la sensibilidad a la vancomicina en el momento de la elección del tratamiento antibiótico de dichas infecciones109.
En estudios recientes, se ha comprobado la existencia de una mayor tasa de fracasos terapéuticos con vancomicina cuando la CMI oscila entre 4 y 8μg/mL110. Asimismo, también se ha observado que existe una reducción en la eficacia de la vancomicina en infecciones sistémicas producidas por cepas de SARM con CMI de vancomicina de 1-2μg/mL111–113, lo que sugiere que pequeños cambios en la CMI pueden explicar fracasos clínicos incluso dentro de los límites de CMI definidos como con sensibilidad a la vancomicina. El análisis multivariante de los factores asociados con la mortalidad en la bacteriemia por SARM ha demostrado un claro incremento de la misma cuando los pacientes reciben tratamiento con vancomicina, a las dosis habituales, y la cepa causal tiene una CMI superior a 1μg/mL114. Por lo tanto, para el tratamiento de las infecciones graves estafilocócicas es necesario determinar la CMI de la vancomicina y considerar este antibiótico como un posible tratamiento subóptimo en casos de aislados de SARM con una CMI a la vancomicina superior a 1μg/mL.
La posibilidad del ajuste de dosis de la vancomicina para obtener un valle terapéutico superior a 15μg/mL ha sido evaluada en estudios clínicos no controlados de eficacia y seguridad, para la terapia de infecciones graves producidas por cepas con disminución de la sensibilidad a la vancomicina. Esta estrategia, potencialmente útil desde el punto de vista teórico, tiene el principal inconveniente del aumento importante de la nefrotoxicidad asociada, sobre todo en tratamientos prolongados, en pacientes con deterioro basal de la función renal o en casos de uso concomitante de otros fármacos nefrotóxicos, que impide completar la pauta terapéutica en la mayoría de los pacientes115,116. Por lo tanto, la vancomicina tendría que utilizarse como terapia de primera elección solamente en pacientes con infecciones producidas por cepas de SARM con una CMI igual o inferior a 1μg/mL, en ausencia de fracaso renal previo y de uso de otros fármacos con potencial de nefrotoxicidad asociada117,118.
Las alternativas terapéuticas a la vancomicina, en la actualidad disponibles en nuestro país, son el linezolid, la daptomicina y la tigeciclina. La daptomicina, a dosis de 6mg/Kg de peso y día, es una opción adecuada para la terapéutica de las infecciones graves que cursen con bacteriemia, con la inclusión de las endocarditis de las cavidades derechas102,103,119. Para las endocarditis de las cavidades izquierdas podría valorarse la posibilidad de utilizar dosis más elevadas de daptomicina (hasta 10mg/Kg de peso y día) o la posible asociación sinérgica con aminoglucósidos o rifampicina, aunque no existe experiencia clínica publicada y en el modelo experimental no ha podido demostrarse un incremento de la eficacia con el uso de ambas combinaciones de antimicrobianos120,121. Se ha comprobado que el aumento de la dosis de daptomicina no comporta mayor riesgo de toxicidad122,123. Se han publicado experiencias clínicas favorables con la asociación de daptomicina con betalactámicos, como la cloxacilina, o con fosfomicina en bacteriemias persistentes por SARM124,125. El linezolid y la tigeciclina, por su acción bacteriostática, no deberían usarse inicialmente en pacientes graves con infecciones bacteriémicas.
Aunque muy infrecuentes, se han descrito fracasos terapéuticos de la vancomicina en EI causadas por especies de S. aureus con resistencia intermedia a la vancomicina (denominados VISA o GISA), con una CMI a dicho fármaco de 4-16μg/mL, o con fenómenos de heteroresistencia (CMI≤2μg/mL, aunque con subpoblaciones que crecen a concentraciones más elevadas). La actitud terapéutica en estas situaciones no está bien estudiada, aunque se apunta la posibilidad de utilizar daptomicina, a la dosis máxima posible, u otros antibióticos o combinaciones de los mismos105,111,126.
Tratamiento quirúrgicoEn el momento actual, la cirugía valvular durante el tratamiento antibiótico es necesaria en casi la mitad de pacientes con EI hospitalizados en centros de referencia, con el objetivo de evitar la mortalidad y las complicaciones asociadas. Los avances experimentados en las técnicas quirúrgicas y los resultados favorables del tratamiento combinado médico-quirúrgico en publicaciones recientes han condicionado que este abordaje terapéutico sea ofrecido a numerosos pacientes.
Aunque no existen estudios prospectivos aleatorios sobre la eficacia de la cirugía en la fase activa de la enfermedad, en las guías internacionales recientes de práctica clínica se indica claramente que debería ser considerada en tres situaciones de riesgo: la existencia de fallo cardíaco o la posibilidad de desarrollarlo en un corto espacio de tiempo, un proceso infeccioso no controlado o una enfermedad causada por un microorganismo con tratamiento antimicrobiano subóptimo y la elevada probabilidad de aparición de fenómenos embólicos127. Los datos recopilados en Europa señalan que alrededor de un 50% de los pacientes con EI son operados durante la fase activa de la infección, siendo las indicaciones más frecuentes el fallo cardíaco (60%), la sepsis refractaria (40%), las complicaciones embólicas (18%) y el tamaño de las vegetaciones (48%), estando presentes en muchos casos una combinación de diferentes situaciones clínicas128.
En las series contemporáneas publicadas, la mayoría aportando información de una sola institución de referencia, la mortalidad global hospitalaria de la cirugía en la EI oscila entre el 6 y el 25% y la supervivencia a largo plazo de los pacientes intervenidos es superior al 70%129. Estos datos han de ser evaluados con precaución ya que las series son muy heterogéneas, los análisis son usualmente de tipo retrospectivo y, en general, ha existido una selección de los pacientes intervenidos basada en criterios de posible evolución desfavorable y riesgo quirúrgico asumible. En estudios publicados en los últimos años, usando modelos sofisticados de clasificación de propensión de riesgo, se han reportado resultados contradictorios sobre el beneficio real de la cirugía130–134. En el futuro será necesario diseñar estudios prospectivos de alta calidad para evaluar de forma clara las indicaciones precisas de la cirugía en esta enfermedad135.
En la guía reciente de la ESC se especifica por primera vez el momento óptimo para la práctica de la cirugía en sus diferentes indicaciones (tabla 6)1. Según estas recomendaciones existirían situaciones en que la cirugía sería necesaria con carácter de urgencia vital (dentro de las primeras 24 horas) o urgente (en los días siguientes), sin relación con la duración previa del tratamiento antibiótico. En otras situaciones la cirugía puede posponerse varias semanas o incluso hasta la finalización de la terapia médica, bajo unos estrictos controles clínicos y ecocardiográficos hasta que el procedimiento electivo sea realizado127,129. Es evidente que la aplicación adecuada de estas recomendaciones requiere de un equipo experimentado de clínicos y cirujanos que asuma en todo momento la responsabilidad de determinar la indicación quirúrgica y el momento óptimo para su realización.
Indicaciones y momento óptimo de la cirugía en la endocarditis aguda (tomada de de referencia 1 con modificaciones)
| Indicaciones de cirugía | Tipo de indicacióna |
| Fallo cardíaco | |
| • Insuficiencia valvular aguda grave con edema pulmonar refractario o shock cardiogénico | Emergente |
| • Existencia de una fístula intracardíaca o al pericardio con edema pulmonar refractario o shock cardiogénico | Emergente |
| • Insuficiencia valvular aguda grave con fallo cardíaco persistente o con signos ecocardiográficos de mala tolerancia hemodinámica (cierre prematuro de la válvula mitral o hipertensión pulmonar) | Urgente |
| • Insuficiencia valvular aguda grave sin fallo cardíaco | Electiva |
| Infección no controlada | |
| • Lesiones valvulares no controladas (abscesos, fístulas, pseudoaneurismas o vegetaciones que aumentan de tamaño) | Urgente |
| • Fiebre persistente y hemocultivos positivos tras más de 7-10 días del tratamiento médico adecuado | Urgente |
| • Infecciones producidas por hongos, levaduras o determinadas bacterias resistentes | Urgente o electiva |
| Prevención de la embolización | |
| • Vegetaciones en las válvulas izquierdas de tamaño superior a 10mm tras episodios embólicos sistémicos a pesar de un tratamiento antibiótico adecuado | Urgente |
| • Vegetaciones en las válvulas izquierdas de tamaño superior a 10mm y otros predoctores de curso complicado (fallo cardíaco, infección persistente o abscesos valvulares) | Urgente |
| • Existencia aislada de vegetaciones de un tamaño superior a los 15mm en las válvulas izquierdas | Urgente |
Aunque a mediados del siglo pasado la disponibilidad de tratamiento antibiótico y la aparición de la cirugía de recambio valvular aórtico consiguieron una disminución considerable de la mortalidad de la EI, el pronóstico de estos pacientes no ha cambiado de forma sustancial desde entonces136–138. La explicación a este estancamiento se halla en la evolución que ha sufrido esta enfermedad, que ha pasado de ser una infección estreptocócica sobre válvulas nativas de pacientes jóvenes a ser una infección fundamentalmente estafilocócica en personas mayores con mucha patología de base10,11. Los estudios poblacionales franceses llevados a cabo entre 1991 y 1999 muestran que la mortalidad cruda se encuentra alrededor del 20%, sin cambios significativos durante el periodo de estudio9,24. En la misma línea, el estudio multinacional de la International Collaboration on Endocarditis (ICE) mostró que la mortalidad cruda era del 18%, porcentaje que se mantenía estable en todas las regiones geográficas estudiadas11. Sin embargo, este porcentaje crudo no nos es útil a la hora de evaluar individualmente el pronóstico de los pacientes con EI ya que este puede variar en función de diversos factores como las enfermedades de base y el modo de adquisición de la endocarditis, siendo máxima en pacientes con ERAS. Ante este panorama desalentador, es obligado preguntarse cómo se puede disminuir la mortalidad.
El primer paso sería la prevención de la infección. Como se ha discutido extensamente con anterioridad, la profilaxis antibiótica indiscriminada no es útil para prevenir la EI. Sin embargo, esto no significa que la prevención no sea posible. Por un lado, es fundamental mantener una higiene correcta de la cavidad oral. Por otro, las bacteriemias de origen en catéteres venosos son la vía más importante de adquisición de la ERAS13,52,53 y es posible actuar a este nivel. Diferentes experiencias han demostrado la utilidad de programas multimodales para la prevención de la bacteriemia de catéter139,140, por lo que debemos seguir insistiendo en la higiene de manos y en extremar las medidas de asepsia ante cualquier procedimiento invasivo.
En segundo lugar, se tendría que mejorar la capacidad de detectar precozmente la infección en pacientes de riesgo. Así como es muy difícil diagnosticar episodios subagudos en pacientes sin factores predisponentes, los profesionales deberíamos estar atentos ante cualquier bacteriemia de origen nosocomial en pacientes con valvulpatía, especialmente de origen estafilocócico o enterocócico. También los pacientes de alto riesgo deberían ser los primeros en dar la voz de alarma ante cualquier fiebre sin foco aparente y consultar a su médico de referencia, por lo que se aconseja plantear estrategias educativas en esta población.
En tercer lugar, una vez la infección está establecida y ha sido diagnosticada, se han de identificar los pacientes con mayor riesgo de mortalidad para actuar con prontitud. En este sentido, recientemente ha sido validado una sencilla clasificación de riesgo compuesta por 3 variables fácilmente identificables durante las primeras 72 horas tras el diagnóstico: infección por S. aureus, insuficiencia cardíaca congestiva y complicación perivalvular141,142. En el caso de infecciones por S. aureus en pacientes que reciben anticoagulación, es aconsejable retirarla durante los primeros días para disminuir el riesgo de complicaciones neurológicas143.
En cuarto lugar, se ha de tomar conciencia de la necesidad de abordar de forma multidisciplinar el manejo de estos pacientes, ya que diferentes experiencias en hospitales de segundo y de tercer nivel han demostrado la utilidad de este tipo de estrategia para disminuir la mortalidad de los pacientes con endocarditis infecciosa31,32.
En quinto y último lugar, se ha de continuar trabajando para responder a las grandes preguntas de investigación sin olvidar que el objetivo último es el de mejorar el pronóstico de nuestros pacientes. En la actualidad se está llevando a cabo un ensayo clínico para establecer el momento óptimo de la cirugía de recambio valvular en pacientes con endocarditis infecciosa e indicación quirúrgica no urgente135. Otros estudios son necesarios para determinar el posible papel de la antiagregación para la disminución del riesgo embólico durante el tratamiento de la endocarditis y para establecer el momento óptimo de la cirugía de recambio valvular en pacientes con eventos en el sistema nervioso central, por poner algunos ejemplos.
FinanciaciónFinanciado por el Ministerio de Sanidad y Consumo. Instituto de Salud Carlos III–FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Financiado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III - FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).