La información generada durante los últimos 20 años permite ya describir los rasgos generales de la epidemiología y la ecología del virus de la hepatitis E en España. Las cepas del genotipo 3, y en especial las del subgenotipo 3f, circulan entre el ganado porcino y entre algunos mamíferos salvajes, y se transmitirían esporádicamente a las personas por contacto directo con los reservorios o por el consumo de alimentos procedentes de ellos. Asimismo, los mariscos bivalvos contaminados por el virus a través de las aguas residuales podrían desempeñar algún papel en dicha transmisión. Con las dificultades que aún plantea la interpretación de los datos, puede estimarse que la prevalencia de anticuerpos frente al virus de la hepatitis E en la población española sería inferior al 10%, aumentando significativamente con la edad. Entre los, aproximadamente, 150 casos de hepatitis E aguda comunicados ya en la literatura internacional, predominan los casos autóctonos observados en varones mayores de 40 años. Por otra parte, la enfermedad podría ser más frecuente en las regiones del norte de España que en otras. Aunque las hepatitis E agudas que suceden en nuestro medio no suelen presentar gran trascendencia clínica, los hallazgos puntuales de casos de hepatitis fulminante y de infecciones crónicas en pacientes inmunodeprimidos que no responden bien a la terapia con ribavirina aconsejan vigilar esta infección e incorporar su diagnóstico etiológico a la rutina de los laboratorios clínicos en mayor medida que la actual.
The general features of the epidemiology and ecology of hepatitis E virus in Spain are already known after 20 years of investigations. Genotype 3 strains, mainly from sub-genotype 3f, circulated among swine livestock and certain wild mammals, and would be sporadically transmitted to humans through direct contact with the reservoirs or by consumption of foods derived from them. Bivalve shellfish contaminated by hepatitis E virus from sewage could also play a role in transmission. Although the interpretation of results from seroprevalence studies in low endemic settings is still controversial, antibody to hepatitis E virus displays an overall prevalence less than 10% among the population of Spain, increasing significantly with age. From the, approximately, 150 cases of acute hepatitis E recorded in the international literature, males older than 40 years, suffering a mild, locally acquired disease predominate. In addition, hepatitis E might be more frequent in the North of the country than in other regions. Although the disease does not usually have a great clinical relevance, the occasional finding of cases of fulminant hepatitis, and of ribavirin-resistant, chronic hepatitis E virus infections among the immunocompromised would recommend the surveillance of the infection by the public health authority and a better implementation of specific diagnostic procedures in clinical laboratories.
La denominación «virus de la hepatitis E» (VHE) abarca un conjunto muy diverso de cepas virales que se ubican en 2 grupos desde el punto de vista epidemiológico. Las cepas epidémicas de transmisión fecal-oral del genotipo 1 son características del centro, sur y sureste de Asia y de África, aunque también circulan en Cuba y Venezuela1,2. Las del genotipo 2b son africanas3, y el genotipo 2a solo se conoce por una única cepa que se encontró hace años con ocasión de un brote epidémico en México4. El VHE de genotipo 1 es responsable frecuente de casos de hepatitis E aguda importados a Europa por viajeros internacionales procedentes, principalmente, de Asia5–9. El único hospedador natural conocido para estas cepas epidémicas es la especie humana.
Por otro lado, las cepas del genotipo 3 son ubicuas y circulan en mamíferos salvajes y domésticos pertenecientes a diferentes órdenes taxonómicos, incluyendo cerdos, conejos, jabalíes, ciervos, mangostas, muflones y ratas grises. Estas cepas causan casos esporádicos de hepatitis E aguda entre los seres humanos por transmisión zoonótica o alimentaria10. En condiciones de inmunodepresión, el virus puede persistir y causar hepatitis crónica de rápida evolución hacia la cirrosis hepática11. Las cepas del genotipo 4 exhiben propiedades parecidas, aunque su frecuencia es mucho menor fuera del Sudeste Asiático y el Extremo Oriente. No obstante, se han comunicado casos autóctonos de hepatitis E aguda producidos por este genotipo en Europa, incluyendo un brote epidémico discreto en Italia que respondió, probablemente, al consumo de ostras contaminadas12. La detección de VHE de genotipo 3 en mejillones y ostras cultivados en Europa apoyaría también que los mariscos filtradores tienen algún papel en la trasmisión alimentaria del VHE13,14.
Al margen de los casos importados por los viajeros internacionales, la hepatitis E aguda autóctona se ha documentado ya ampliamente en Europa, incluyendo los países nórdicos7,8. Tanto las series de casos de infección aguda como los estudios de seroprevalencia sugieren que la incidencia de la hepatitis E sería desigual en el continente, con la posible existencia de regiones que constituirían «zonas calientes» para esta infección15,16. La exposición profesional a excrementos de ganado porcino y el consumo de carne de cerdo poco cocinada se consideran los principales factores de riesgo para la adquisición de la infección, si bien es cierto que la mayoría de los pacientes europeos con hepatitis E aguda no refieren dichos antecedentes6. Salvando las excepciones mencionadas antes, las cepas responsables de esas infecciones pertenecen al genotipo 3. Dentro de una misma región, las que se detectan en los animales y en las personas suelen pertenecer al mismo subgenotipo, sin que exista ninguno que pueda considerarse característico del conjunto europeo. Podría decirse no obstante, a muy grandes rasgos, que el subtipo 3f es más común en el sur de Europa y el 3i en el centro y el norte, aunque con muchas excepciones y con la circulación simultánea de otros subtipos.
Los estudios destinados a investigar la epidemiología del VHE en España se remontan al año 1993, cuando se comunicaron desde Cataluña los primeros casos de hepatitis E aguda17. Aún dentro de esa década, se comunicaron también los primeros datos sobre prevalencia de anticuerpos frente al VHE (anti-VHE) en diferentes grupos de población de Granada18, y los primeros estudios de detección del virus en las aguas residuales de Barcelona19. Muy pronto se documentaría, además, la presencia del VHE en el ganado porcino20. Desde entonces, los conocimientos sobre la epidemiología y la ecología del VHE en España se han ampliado mucho. El objeto de este artículo es revisar el estado actual de dichos conocimientos dos décadas después de aquella primera comunicación, como complemento a la excelente revisión de carácter general publicada en esta revista recientemente21.
Prevalencia de anticuerpos frente al virus de la hepatitis E en EspañaLa obtención e interpretación de cualquier dato sobre la prevalencia de anti-VHE en una población dada, y muy especialmente en las áreas endémicas para el genotipo 3, se halla actualmente sujeta a un intenso debate de carácter técnico. Por un lado están quienes defienden que la gran mayoría de los métodos de enzimoinmunoanálisis (EIA) disponibles para su detección subestiman la prevalencia por causa de una insuficiente sensibilidad22. Por otro, quienes utilizando el inmunoblot recombinante (IBR) para estudiar las muestras reactivas por EIA proponen que los datos que proporciona dicha técnica la sobreestiman, lo que se sabe que es habitual cuando se estudia cualquier infección de baja prevalencia23,24. En todo caso, los datos que se desprenden de todos los estudios no se corresponden bien con la aparente rareza de la hepatitis E aguda entre las correspondientes poblaciones25, y el debate técnico está aún lejos de cerrarse satisfactoriamente26,27. Se requieren, por consiguiente, estudios amplios de colaboración internacional que puedan llegar a generar nuevos datos y el necesario consenso.
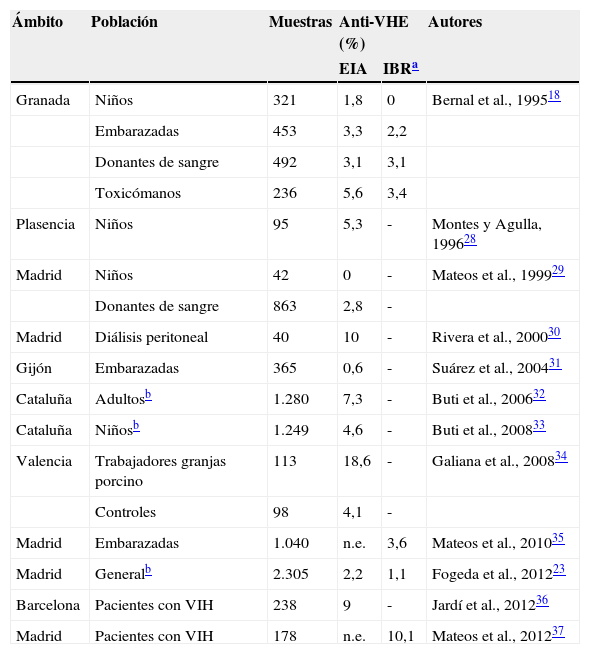
La tabla 1 ofrece una lista de los estudios de prevalencia de anti-VHE realizados en España y recogidos por la literatura internacional. Considerando los 4 estudios que siguieron la estrategia de confirmación por IBR, y a excepción de uno que se realizó en pacientes infectados por el virus de la inmunodeficiencia humana, las cifras fueron siempre inferiores al 5%, con un máximo de un 3,6% para las mujeres embarazadas de Madrid. Entre los restantes, y exceptuando esta vez un estudio realizado en individuos con riesgo laboral de exposición, las prevalencias fueron siempre iguales o inferiores al 10%.
Prevalencias de anti-VHE encontradas en España en 12 estudios publicados entre 1995 y 2012
| Ámbito | Población | Muestras | Anti-VHE (%) | Autores | |
|---|---|---|---|---|---|
| EIA | IBRa | ||||
| Granada | Niños | 321 | 1,8 | 0 | Bernal et al., 199518 |
| Embarazadas | 453 | 3,3 | 2,2 | ||
| Donantes de sangre | 492 | 3,1 | 3,1 | ||
| Toxicómanos | 236 | 5,6 | 3,4 | ||
| Plasencia | Niños | 95 | 5,3 | - | Montes y Agulla, 199628 |
| Madrid | Niños | 42 | 0 | - | Mateos et al., 199929 |
| Donantes de sangre | 863 | 2,8 | - | ||
| Madrid | Diálisis peritoneal | 40 | 10 | - | Rivera et al., 200030 |
| Gijón | Embarazadas | 365 | 0,6 | - | Suárez et al., 200431 |
| Cataluña | Adultosb | 1.280 | 7,3 | - | Buti et al., 200632 |
| Cataluña | Niñosb | 1.249 | 4,6 | - | Buti et al., 200833 |
| Valencia | Trabajadores granjas porcino | 113 | 18,6 | - | Galiana et al., 200834 |
| Controles | 98 | 4,1 | - | ||
| Madrid | Embarazadas | 1.040 | n.e. | 3,6 | Mateos et al., 201035 |
| Madrid | Generalb | 2.305 | 2,2 | 1,1 | Fogeda et al., 201223 |
| Barcelona | Pacientes con VIH | 238 | 9 | - | Jardí et al., 201236 |
| Madrid | Pacientes con VIH | 178 | n.e. | 10,1 | Mateos et al., 201237 |
n.e.: no especificado.
Solo se han realizado aquí, por el momento, 2 estudios sobre muestras representativas de la población general estratificadas por edad. En el realizado en Cataluña32,33 no se utilizó la confirmación por IBR, y se hallaron prevalencias del 4,6% entre los niños y del 7,3% entre los adultos, con un máximo del 12% entre los mayores de 64 años. Como se verá más adelante, los casos de hepatitis E autóctona se concentran en España en los mayores de 40 años y son muy infrecuentes entre los niños, por lo que esos resultados solo podrían justificarse si la infección fuese muy mayoritariamente asintomática durante la infancia. Es de interés señalar que el 1,8% de prevalencia obtenido años atrás entre los niños de Granada mediante EIA se redujo a cero tras analizar por IBR las muestras reactivas18.
En el estudio realizado en Madrid23 sí se utilizó el IBR para confirmar las muestras reactivas en EIA. Así, se pasó del 2,2% global obtenido inicialmente al 1,1% tras la confirmación por IBR, que se obtuvo solo en la mitad de las muestras. El aumento más significativo en la prevalencia se observó al comparar los grupos etarios de 11-20 y 21-40 años (0,58 vs. 2,20%). Entre los menores de 11 años, la prevalencia fue del 0,28%, y el porcentaje de confirmación por IBR fue en ese grupo etario significativamente menor que entre los mayores de 19 años (28,6 vs. 61,3%). Este hallazgo sugiere que, en nuestro medio, los métodos de EIA podrían ser especialmente proclives a proporcionar resultados positivos falsos para anti-VHE cuando se estudian muestras procedentes de niños.
Con todas esas limitaciones en cuanto a la tecnología utilizada y la interpretación de los resultados, podría concluirse que la prevalencia global de anti-VHE en la población española se situaría por debajo del 7-8%, y que aumentaría con la edad desde cifras que, probablemente, deben ser en realidad muy bajas entre los menores de 15 años. Como se verá a continuación, esta descripción general se correspondería bien, al menos en lo cualitativo, con los datos disponibles sobre los casos de hepatitis E aguda comunicados a día de hoy.
Casos de hepatitis E aguda encontrados en EspañaConsiderando los datos anteriores, el diagnóstico de la infección actual por VHE en un paciente con hepatitis aguda no puede basarse en la mera detección de anti-VHE total o de la clase IgG, salvo que se pueda documentar la seroconversión al comparar pares de muestras. El desarrollo de métodos para detección de anti-VHE de la clase IgM (anti-VHE IgM) y de procedimientos de amplificación genómica para detectar la viremia obviaron pronto esa necesidad. Actualmente, el diagnóstico comporta la detección de uno u otro marcador, y los resultados se interpretan según criterios bien establecidos38. La detección de viremia permite diagnosticar la infección durante el período de ventana serológica, y también en los días inmediatos a la seroconversión. No obstante, la inestabilidad del genoma del VHE requiere trabajar sobre muestras frescas, por lo que los estudios retrospectivos que se realicen con muestras de colección pueden arrojar rendimientos engañosamente bajos para la detección de la viremia. Por su parte, la detección de anti-VHE IgM rinde muy bien durante los momentos en los que suele plantearse el diagnóstico diferencial de una hepatitis aguda en el ámbito clínico, excluyendo, naturalmente, el período de ventana11. Además, los resultados que se obtienen para este marcador al comparar entre sí reactivos diferentes son más consistentes que los que obtienen los métodos de detección de anti-VHE de la clase IgG26. Si no se investiga paralelamente la viremia, o si esta resulta no detectable, conviene también investigar marcadores de infección primaria aguda por citomegalovirus y virus de Epstein-Barr en los casos positivos para anti-VHE IgM, con el fin de evitar errores en el diagnóstico39. El mejor rendimiento se logra, por consiguiente, investigando ambos marcadores en primera intención. Además, la diferenciación entre infección autóctona e importada en pacientes con antecedente de viaje reciente a áreas de alta endemia requiere identificar el genotipo viral, lo que supone usar métodos moleculares. Las técnicas de diagnóstico molecular del VHE comienzan ya a estar disponibles en el mercado de reactivos.
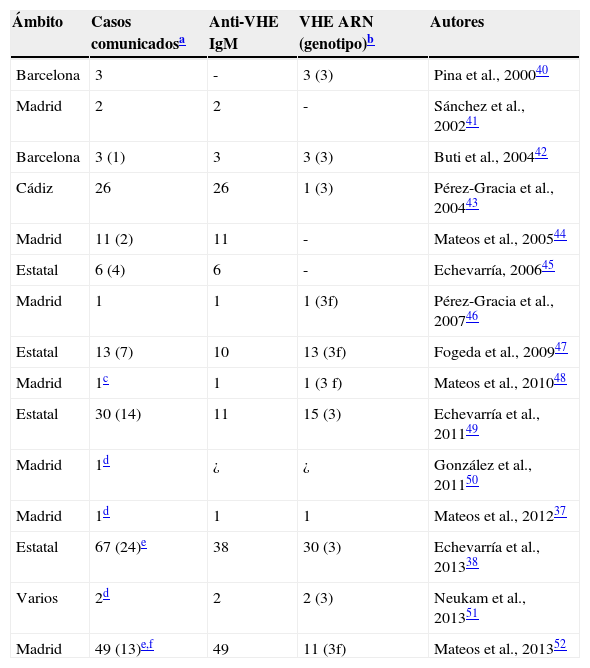
La tabla 2 recoge los casos de hepatitis aguda comunicados de España en la literatura internacional de acuerdo a esos criterios diagnósticos. Algunos estudios acumularon nuevos casos a otros ya publicados anteriormente, pero cabe estimar que los datos disponibles sumen ya unos 150 casos, 38 importados y los restantes autóctonos. La serie incluye 5 casos de presentación fulminante y 4 pacientes que desarrollaron infecciones crónicas, 3 de ellos infectados por el virus de la inmunodeficiencia humana y uno sin déficits de inmunidad conocidos. Dos de ellos fueron tratados con ribavirina sin que se lograse erradicar definitivamente la infección51, aunque esto es excepcional.
Casos de infección actual por VHE (diagnóstico por detección de IgM específica y/o genoma viral en suero) comunicados hasta la fecha en España
| Ámbito | Casos comunicadosa | Anti-VHE IgM | VHE ARN (genotipo)b | Autores |
|---|---|---|---|---|
| Barcelona | 3 | - | 3 (3) | Pina et al., 200040 |
| Madrid | 2 | 2 | - | Sánchez et al., 200241 |
| Barcelona | 3 (1) | 3 | 3 (3) | Buti et al., 200442 |
| Cádiz | 26 | 26 | 1 (3) | Pérez-Gracia et al., 200443 |
| Madrid | 11 (2) | 11 | - | Mateos et al., 200544 |
| Estatal | 6 (4) | 6 | - | Echevarría, 200645 |
| Madrid | 1 | 1 | 1 (3f) | Pérez-Gracia et al., 200746 |
| Estatal | 13 (7) | 10 | 13 (3f) | Fogeda et al., 200947 |
| Madrid | 1c | 1 | 1 (3f) | Mateos et al., 201048 |
| Estatal | 30 (14) | 11 | 15 (3) | Echevarría et al., 201149 |
| Madrid | 1d | ¿ | ¿ | González et al., 201150 |
| Madrid | 1d | 1 | 1 | Mateos et al., 201237 |
| Estatal | 67 (24)e | 38 | 30 (3) | Echevarría et al., 201338 |
| Varios | 2d | 2 | 2 (3) | Neukam et al., 201351 |
| Madrid | 49 (13)e,f | 49 | 11 (3f) | Mateos et al., 201352 |
Los casos importados correspondieron a inmigrantes y viajeros procedentes de Asia, África y Latinoamérica. Predominaron las infecciones adquiridas en el Subcontinente Indio y debidas al genotipo 1a47. La serie incluye algunas infecciones supuestamente adquiridas en países del Caribe (Cuba y Santo Domingo) y de Sudamérica (Brasil, Ecuador y Perú). Aunque se acostumbra a considerar a Latinoamérica como una región de alta endemia para la infección por VHE, los datos demuestran que tal afirmación general es errónea y que solo cabe esperar infecciones importadas en viajeros procedentes del ámbito caribeño, en el que circulan cepas epidémicas del genotipo 153. Uno de los 2 pacientes procedentes de Santo Domingo se hallaba infectado por una cepa del genotipo 3, lo que no apoya su carácter importado, y en ninguno de los restantes se caracterizó el virus involucrado.
La primera comunicación de casos autóctonos de hepatitis E en España debidos a cepas del genotipo 3 se realizó desde Cataluña en 200040. Todas las infecciones autóctonas caracterizadas posteriormente a nivel de subgenotipo se debieron al subtipo 3f46–48, incluyendo un caso con presentación fulminante48. En lo que concierne a ámbitos geográficos concretos, las series más amplias correspondieron a Madrid52 y a Cádiz43. La primera incluyó 33 casos en pacientes sin antecedente de viaje reciente, y solo pudo constatarse algún riesgo específico de exposición al VHE en 3 casos (riesgo ocupacional). La segunda no contempló la recogida de datos epidemiológicos. Se deduce del conjunto de los datos disponibles que el retrato robot del paciente español con hepatitis E adquirida localmente correspondería a un varón de más de 40 años de edad que no refiere circunstancias significativas en cuanto a riesgo de exposición, cuyos parámetros analíticos son claramente indicativos de hepatopatía aguda, y cuya enfermedad evoluciona espontáneamente hacia la curación. De los 2 estudios que aportaron algún denominador para los casos comunicados se deduce que el VHE sería responsable en nuestro medio de un 7-11% de los casos de hepatitis aguda no filiada tras descartar los agentes infecciosos más comunes para esas patologías43,49. Al igual que en algunas otras series54, algunos pacientes españoles presentaron aparentes infecciones dobles por VHE y virus de la hepatitis A37, una circunstancia que todavía no se ha confirmado nunca detectando la presencia de ambos virus por métodos moleculares.
Sin tratarse de estudios prospectivos y válidos para ello, solo las series aportadas por el Centro Nacional de Microbiología permiten realizar algún análisis sobre la mayor o menor frecuencia de la hepatitis E en relación con el ámbito geográfico considerado. En ese sentido, los datos que sugirieron inicialmente una mayor frecuencia de la enfermedad en las regiones aledañas a la cordillera cantábrica se confirmaron al ampliar la serie de 16 a 43 casos autóctonos38,49. Con las limitaciones ya señaladas, el hecho de que la última observación se apoyase en las muestras enviadas para estudio por 60 centros sanitarios ubicados en 14 de las 17 comunidades autónomas del Estado le presta cierta solidez, y abre la posibilidad de que esas regiones constituyan realmente «zonas calientes» para la hepatitis E a semejanza de lo observado en el Reino Unido y en Francia.
El virus de la hepatitis E en los animales, los alimentos y el medio ambienteDentro del carácter dual de enfermedad importada y autóctona atribuible a la hepatitis E en Europa, la enfermedad adquirida localmente recibe la consideración de una zoonosis de reservorios diversos y modos de transmisión aún no completamente aclarados10. El ganado porcino se interpreta, no obstante, como reservorio principal, y tal vez como fuente para la contaminación del medio hídrico y para la transmisión del virus a la fauna salvaje a través del agua en la naturaleza. Las infecciones humanas responderían al contacto profesional con el propio ganado o con los animales salvajes y al consumo de alimentos derivados de ellos, bien contaminados en origen o durante su manipulación en los mataderos y salas de despiece. A esto habría que añadir el papel que desempeñe el consumo de moluscos filtradores, como ya se señaló antes.
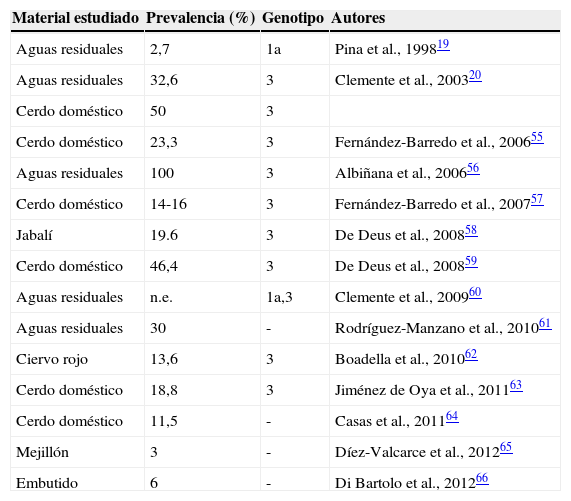
La tabla 3 resume los resultados de los estudios de detección del VHE en animales, aguas residuales y alimentos realizados en España y recogidos en la literatura internacional. La infección por VHE de genotipo 3 sucede en los lechones a una edad muy temprana y es común en las explotaciones de ganado porcino españolas, con tasas de detección de virus en heces, suero o hígado que llegan a alcanzar casi el 50%. Alcanza, además, al jabalí y al ciervo rojo, que son especies comunes en buena parte del territorio español, objeto frecuente de la actividad cinegética, y fuente para el consumo de carne de caza. En consonancia con todo ello, el VHE de genotipo 3 se ha detectado repetidamente en aguas residuales de la provincia de Barcelona. Sin embargo, el hallazgo inicial de VHE de genotipo 1 en dichas aguas, confirmado en un estudio posterior19,60, resulta más difícil de interpretar. Dado que no existe evidencia de casos autóctonos de infección por virus de ese genotipo en la región, los hallazgos habrían de ser consecuencia de las infecciones importadas, y carecerían de significado epidemiológico en el contexto de unas instalaciones de saneamiento público de alta calidad. No obstante, su llegada hasta los moluscos filtradores vendría avalada por su presencia en mejillones de cultivo65. Por lo demás, la reciente detección del VHE en lechugas y fresas comercializadas en España añadiría, de confirmarse, nuevos datos a favor de la diseminación del VHE hacia los alimentos a través de las aguas residuales67.
Prevalencias de ARN del VHE comunicadas en España sobre muestras ambientales, muestras procedentes de fauna doméstica o salvaje y alimentos
| Material estudiado | Prevalencia (%) | Genotipo | Autores |
|---|---|---|---|
| Aguas residuales | 2,7 | 1a | Pina et al., 199819 |
| Aguas residuales | 32,6 | 3 | Clemente et al., 200320 |
| Cerdo doméstico | 50 | 3 | |
| Cerdo doméstico | 23,3 | 3 | Fernández-Barredo et al., 200655 |
| Aguas residuales | 100 | 3 | Albiñana et al., 200656 |
| Cerdo doméstico | 14-16 | 3 | Fernández-Barredo et al., 200757 |
| Jabalí | 19.6 | 3 | De Deus et al., 200858 |
| Cerdo doméstico | 46,4 | 3 | De Deus et al., 200859 |
| Aguas residuales | n.e. | 1a,3 | Clemente et al., 200960 |
| Aguas residuales | 30 | - | Rodríguez-Manzano et al., 201061 |
| Ciervo rojo | 13,6 | 3 | Boadella et al., 201062 |
| Cerdo doméstico | 18,8 | 3 | Jiménez de Oya et al., 201163 |
| Cerdo doméstico | 11,5 | - | Casas et al., 201164 |
| Mejillón | 3 | - | Díez-Valcarce et al., 201265 |
| Embutido | 6 | - | Di Bartolo et al., 201266 |
n.e.: no especificado.
Es además de gran interés que el VHE fuese detectado hace 2 años en productos curados procedentes del ganado porcino y listos para el consumo que se recogieron para estudio en algunos puntos de venta al público66. La detección del genoma viral no supone necesariamente la presencia de virus infeccioso, pero abre la posibilidad de que unos productos muy tradicionales en los hábitos de alimentación españoles puedan ofrecer una explicación para los muchos casos de hepatitis E cuyos pacientes carecen de otros factores de exposición mencionables. Habida cuenta de la variedad de tales productos, y de las diferentes formas de curación que se utilizan en unas y otras regiones, tal vez pueda llegar a encontrarse ahí una explicación para las posibles diferencias regionales observadas en cuanto a la frecuencia de la enfermedad.
En conclusión, el VHE de genotipo 3 es un agente zoonótico que circula en España tanto entre el ganado porcino como entre algunas especies de mamíferos salvajes. Este virus sería responsable de alrededor de un 10% de los casos de hepatitis aguda que quedan sin filiar tras los estudios de diagnóstico habituales, y los casos que produce se sumarían a los debidos al genotipo 1 que se importan regularmente de Asia y África. La importación de casos de Latinoamérica es dudosa en tanto no se aporten nuevos datos. La infección por VHE parece ser muy poco común entre los niños españoles, es característica de los varones adultos de más de 40 años de edad, está causada por cepas del subgenotipo 3f, y podría ser especialmente frecuente en las regiones aledañas a la cordillera cantábrica, cuestión que requiere confirmación mediante estudios prospectivos específicos. Las circunstancias de la transmisión de esas cepas a los seres humanos son aún desconocidas, aunque el contacto profesional con los reservorios principales y el consumo de productos derivados del cerdo y de mariscos bivalvos tal vez desempeñen un papel principal. Aunque la mayoría de las infecciones son asintomáticas o producen cuadros de hepatitis aguda de buen pronóstico, el hallazgo de casos de presentación fulminante en pacientes aquejados de hepatopatía crónica y de infecciones persistentes en pacientes inmunodeprimidos e inmunocompetentes aconseja establecer y mantener actividades de vigilancia epidemiológica e investigaciones destinadas a aclarar mejor sus modos de transmisión. Por todo ello, la inclusión del diagnóstico etiológico de la hepatitis E en el estudio rutinario de las hepatopatías agudas de los adultos, y de las alteraciones crónicas de la función hepática en los pacientes inmunodeprimidos, parece muy justificada y recomendable.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.