La hepatitisC es una enfermedad viral hepática causada por un hepacivirus de la familia Flaviviridae, el cual posee un genoma de molécula única de ARN altamente variable. Codifica 10proteínas necesarias para infectar las células y multiplicarse dentro de ellas. Su replicación se da únicamente en los hepatocitos. Debido a su gran variabilidad genómica y a la ausencia de síntomas de la enfermedad, se dificulta realizar un tratamiento temprano y acertado. En este trabajo se analiza el mecanismo molecular mediante el cual el virus infecta los hepatocitos y desarrolla la enfermedad. Particularmente, analizamos las alternativas terapéuticas, discutiendo la posibilidad de mejorar el tratamiento con el uso de nuevas vacunas específicas. Destacamos el uso de nuevas terapias basadas en ácidos nucleicos, principalmente vectores de ADN. Durante los próximos años, una vez que este tipo de tratamiento sea evaluado adecuadamente en ensayos clínicos y se equilibren los costos, constituirá una alternativa a los métodos convencionales muy beneficiosa.
Hepatitis C is a contagious liver disease caused by hepacivirus of the Flaviviridae family. It has a RNA genome, a unique highly variable molecule. It encodes ten proteins which are necessary to infect cells and multiply. Replication occurs only in hepatocytes. Because of its wide genomic variability and the absence of symptoms, it is difficult to make an early diagnosis and successful treatment. In this review we analyze the molecular mechanism by which the virus infects the hepatocytes and causes the disease. We focused the analysis on different therapies, with the possibility of improving treatment with the use of new specific vaccines. We highlight the use of new therapies based on nucleic acids, mainly DNA vectors. In the near future, once this treatment is adequately evaluated in clinical trials, and the costs are calculated, it could be a very beneficial alternative to conventional methods.
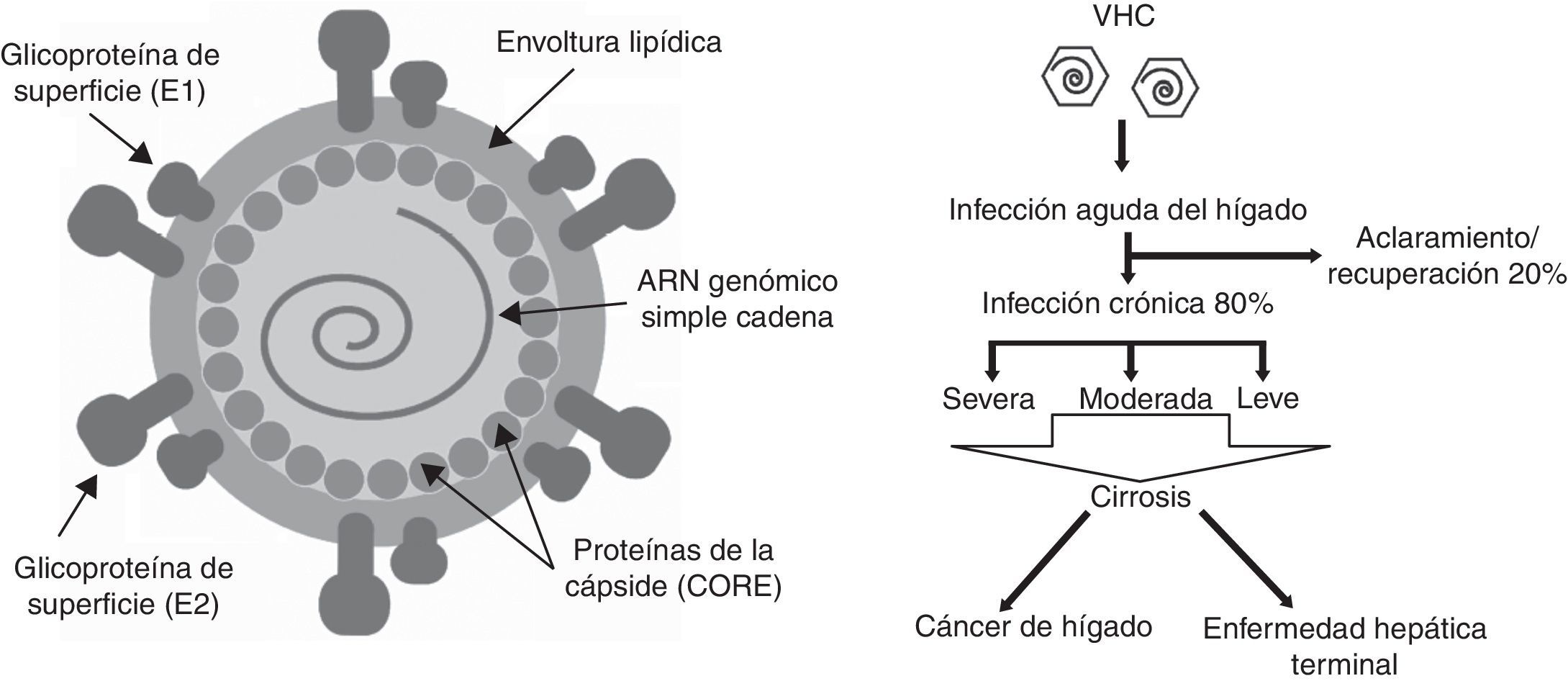
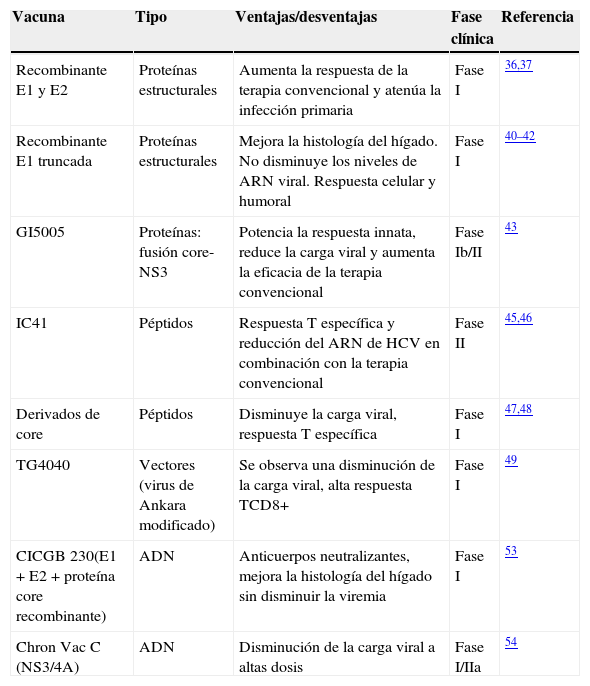
La hepatitisC es una enfermedad viral contagiosa que afecta el hígado. El virus de la hepatitisC (VHC) fue descubierto en el año 1989 por Choo et al.1 como un nuevo virus productor de hepatitis noA y noB. Se la considera la principal causa de infección postransfusión. Las complicaciones a largo plazo incluyen infección crónica (80% de los infectados), cirrosis, insuficiencia hepática, carcinoma hepatocelular y muerte en el 30% los casos (fig. 1)2,3.
Estructura del virus de la hepatitisC e infección. A)Estructura de la partícula del virus de la hepatitisC: la proteína core del VHC interactúa con el ARN genómico viral para formar una nucleocápside. En la membrana se encuentran las glicoproteínas E1 y E2, asociadas con la envoltura por medio de lípidos generados por el huésped. B)Evolución de la infección por VHC en el organismo. En el 80% de los casos la infección progresa a crónica.
Modificado de Sharma2.
El VHC es transmitido principalmente por contacto con sangre infectada y rara vez por transmisión sexual o vertical, de madre a hijo (<6%). En este último caso el porcentaje aumenta en mujeres con alta viremia o cuando coexiste con infección por el virus de la inmunodeficiencia humana (VIH). Debido al uso de la misma vía de transmisión, la coinfección por VHC y VIH es muy frecuente4. Tanto la infección aguda como la crónica cursan de forma asintomática o con síntomas inespecíficos (fatiga, náuseas, anorexia, mialgias, artralgias, debilidad y pérdida de conocimiento). Esta es la principal razón por la cual se dificulta realizar un tratamiento temprano, y con frecuencia se la llama «enfermedad silenciosa»2.
El VHC es un hepacivirus de la familia Flaviviridae. Su genoma consiste en una cadena simple de ARN con polaridad positiva de aproximadamente 9.600 nucleótidos, que contiene un único y largo marco de lectura (ORF), el cual codifica 10proteínas. La heterogeneidad genética se puede clasificar en 4niveles, dando lugar a tipos, subtipos, aislados y cuasiespecies. El grado de homología intergenómica da lugar al genotipo, en el cual, si existe homología del genoma entre el 66-69%, se llama tipo (indicado con un número arábigo); dentro de un mismo tipo, si la homología es del 77-80%, se clasifica en subtipo (indicado con la letra después del genotipo); si dentro de un mismo subtipo existe una homología del 81-90%, se denominan aislados. El grado de homología intragenomas del 91-99% da lugar a cuasiespecies, resultantes de la acumulación de las mutaciones durante la replicación viral dentro del huésped (tabla 1)5. Hay 6genotipos de VHC (del 1 al 6), muchos subtipos (a, b, c, etc.) y aproximadamente 100cadenas diferentes, basándose en la heterogeneidad de secuencias del genoma del virus. Una alta tasa de error de la polimerasa, un ciclo corto de replicación y un genoma pequeño son factores que contribuyen a la generación de estas variantes del virus, las cuales difieren en sus propiedades biológicas: virulencia, tropismo celular y capacidad de evadir el sistema inmune6.
Variabilidad genética del VHC. Clasificación según el porcentaje de homología
| % de homología | Símbolo | Origen | |
|---|---|---|---|
| Genotipo | 66-69 | Número (1-6) | Heterogeneidad del virus |
| Subtipo | 77-80 | Letra minúscula | Virus relacionados dentro del mismo genotipo |
| Aislado | 81-90 | – | Especies del mismo subtipo en distintos individuos |
| Cuasiespecies | 91-99 | – | Mutaciones en el individuo durante la replicación viral |
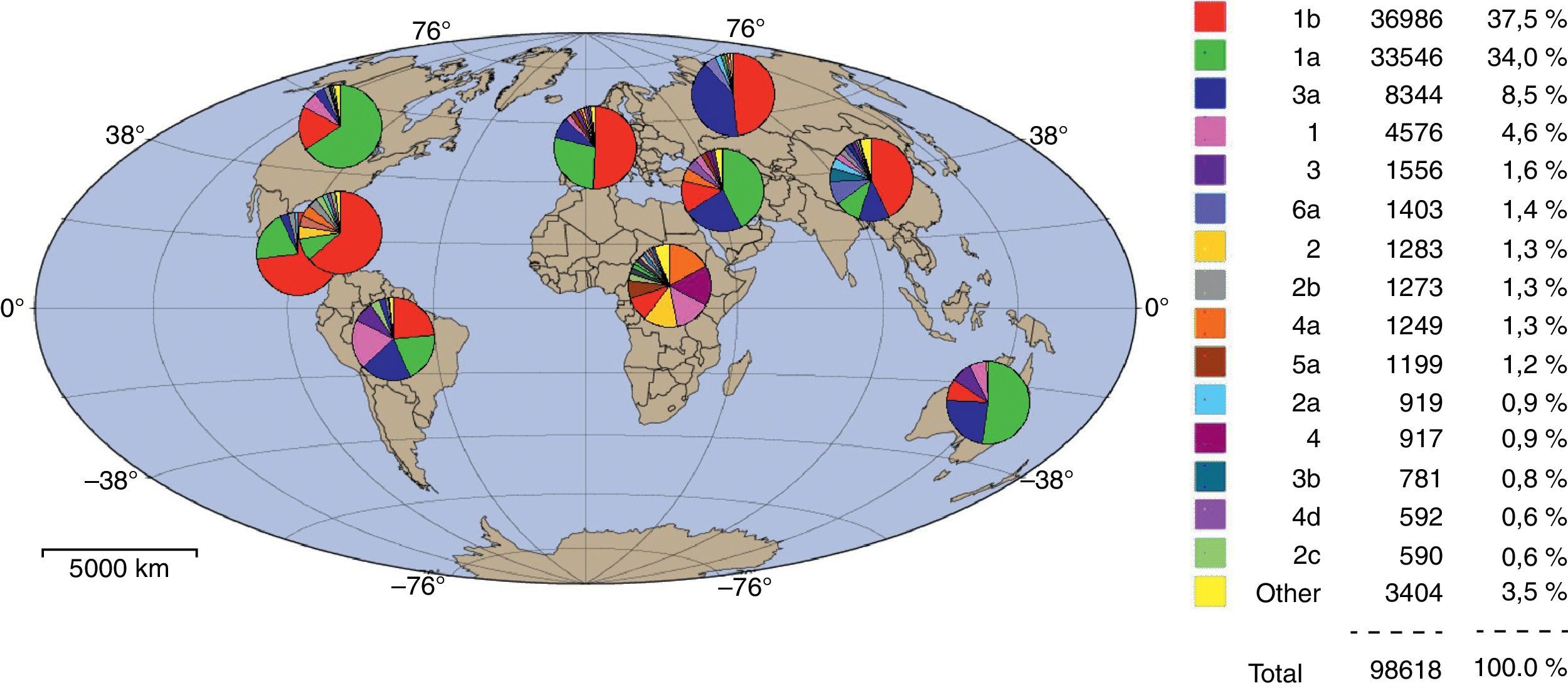
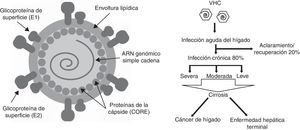
La frecuencia de los diversos genotipos varía de un país a otro (fig. 2). Los genotipos 1, 2 y 3 tienen distribución mundial, pero su prevalencia relativa varía de un área geográfica a otra. El genotipo1a se localiza predominantemente en el norte de Europa y América del Norte, y el 1b predomina en el sur y este de Europa y Japón. El genotipo2 es menos común que el genotipo1, y se encuentra más frecuentemente en Europa que en América del Norte. El genotipo3 es endémico en el sureste de Asia. El genotipo4 es característico del este medio de Egipto y el centro de África. El genotipo5 es casi exclusivo del sur de África. El genotipo6 está distribuido principalmente en Asia. La variabilidad genética viral genera diferentes respuestas frente a la terapia3,7.
Distribución geográfica mundial de los diferentes genotipos del VHC. Se observa la distribución geográfica en las distintas regiones de las secuencias con diferentes genotipos del VHC. Puede apreciarse el predominio del genotipo 1b en el sur y este de Europa y en Japón, mientras que el genotipo 1a se ubica en el norte de Europa y América. A la derecha de la figura se muestra el porcentaje total de cada genotipo; los genotipos 1a y 1b abarcan más del 70% del total.
De http://VHC.lanl.gov.
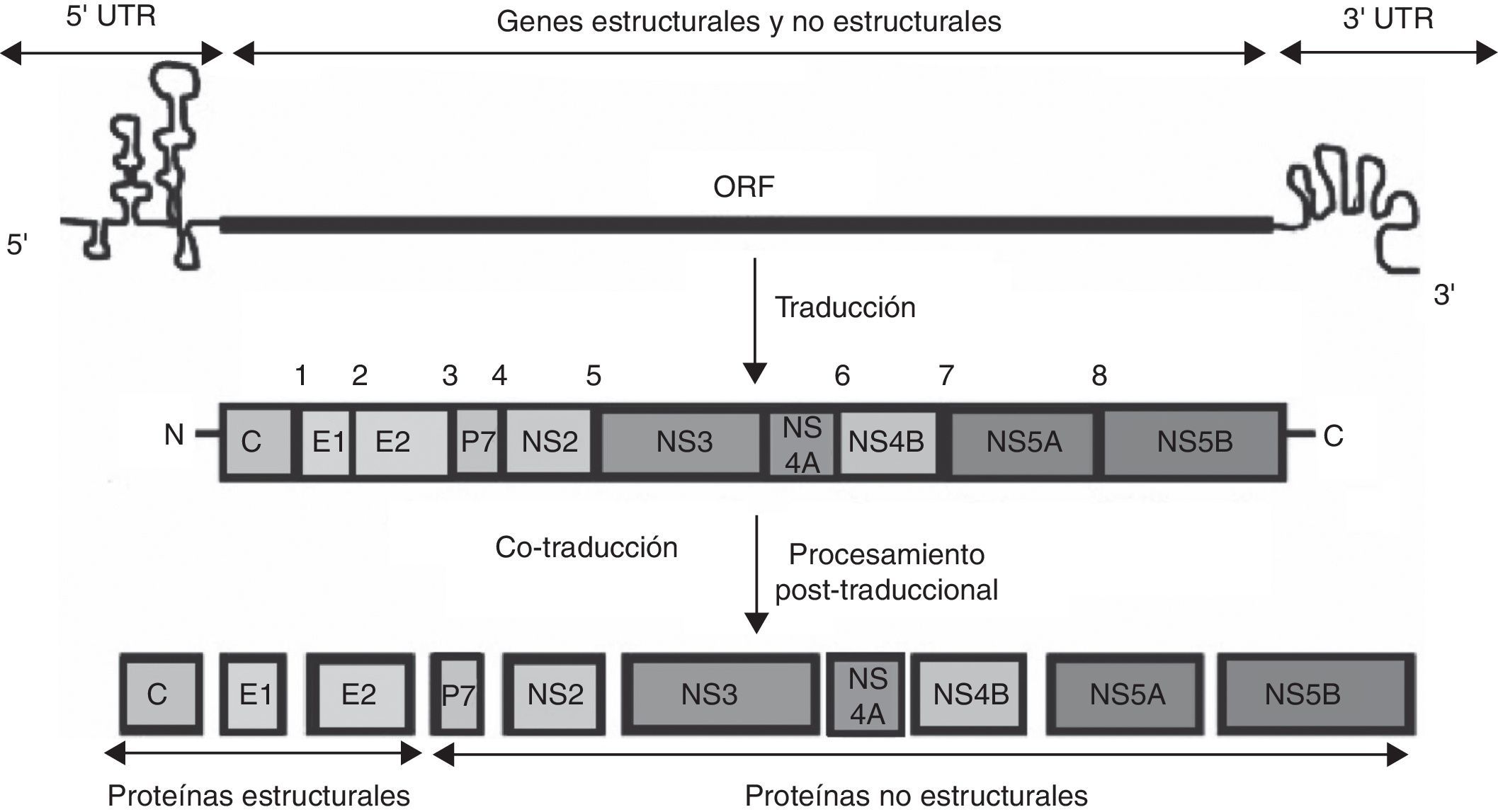
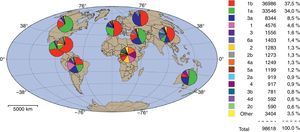
El genoma del VHC está formado por una cadena simple de ARN que codifica solo una poliproteína de 3.011aminoácidos. El proceso de traducción se lleva a cabo mediante un mecanismo independiente del CAP (7-metil guanosina trifosfato) a través de un sitio interno de entrada ribosomal (IRES). La proteína generada es posteriormente procesada y genera 10proteínas funcionales para la replicación y producción viral2. La peptidasa del huésped es responsable de clivar en los sitios1, 2, 3 y 4 (fig. 3). La proteína viral NS2 corta en el sitio 5, y la proteasa NS3 es responsable del clivaje del resto de las proteínas3.
Representación esquemática del genoma del VHC. El ARN viral consiste en una región 5’ no traducida (UTR) que contiene el sitio de entrada interno al ribosoma (IRES), seguido por la región codificante para genes estructurales y no estructurales y el 3’ UTR. VHC se traduce como una poliproteína que se procesa proteolíticamente por proteasas virales y del huésped. Las proteínas estructurales se encuentran en el extremo amino terminal, mientras que las proteínas no estructurales se ubican en el extremo C-terminal. La proteína p7 (canal de iones o viroporina) se encuentra en la unión de las proteínas estructurales y no estructurales. Los números indican los sitios de clivaje postraducción: del 1 al 4 son clivados por la peptidasa del huésped, el 5 por la auto proteasa NS2 y del 6 al 8 por la proteasa/helicasa NS3/4A.
Modificado de Sharma2.
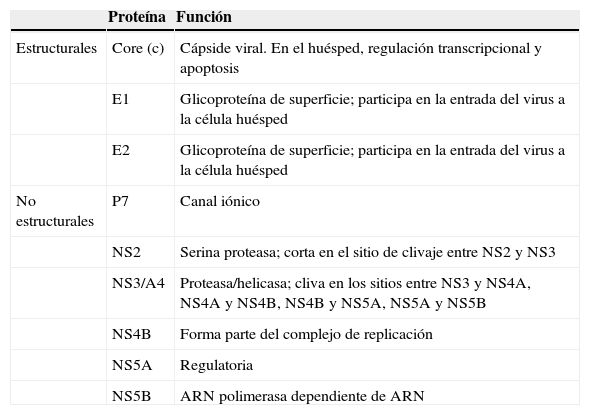
Las proteínas se clasifican en estructurales y no estructurales (tabla 2). Entre las estructurales se encuentran la proteína core (C), que forma la cápside viral, y 2glicoproteínas de superficie, E1 y E2. Dentro de las proteínas no estructurales se encuentran un canal iónico (p7), una autoproteasa (NS2), una proteasa/helicasa (NS3/4A), un posible organizador del complejo de replicación (NS4B), una proteína regulatoria pleiotrópica (NS5A) y una ARN polimerasa dependiente de ARN (NS5B). Adicionalmente puede producirse una undécima proteína (ARFPs) de función desconocida, codificada por un marco de lectura alternativo (+1) del genoma viral. Esta secuencia se superpone con la secuencia codificante de la proteína core7.
Función de las proteínas del VHC. Las proteínas se clasifican en estructurales y no estructurales, cada una posee una función específica en el ciclo de vida del virus
| Proteína | Función | |
|---|---|---|
| Estructurales | Core (c) | Cápside viral. En el huésped, regulación transcripcional y apoptosis |
| E1 | Glicoproteína de superficie; participa en la entrada del virus a la célula huésped | |
| E2 | Glicoproteína de superficie; participa en la entrada del virus a la célula huésped | |
| No estructurales | P7 | Canal iónico |
| NS2 | Serina proteasa; corta en el sitio de clivaje entre NS2 y NS3 | |
| NS3/A4 | Proteasa/helicasa; cliva en los sitios entre NS3 y NS4A, NS4A y NS4B, NS4B y NS5A, NS5A y NS5B | |
| NS4B | Forma parte del complejo de replicación | |
| NS5A | Regulatoria | |
| NS5B | ARN polimerasa dependiente de ARN |
La proteína core forma la cápside viral altamente conservada. Adicionalmente al rol del ensamblaje de la partícula viral, esta muestra múltiples funciones biológicas en la célula huésped, incluyendo la regulación transcripcional de genes, apoptosis, alteración de las señales del interferón (INF), transformación celular e interferencia en el metabolismo lipídico. Estudios previos sugieren que muchos de estos efectos biológicos de la proteína core proveen ventajas de supervivencia al virus3.
Las proteínas E1 y E2 son componentes estructurales del virus, y ambas son requeridas para la entrada a la célula huésped vía unión a su receptor2. E2 posee una región hipervariable, lo que crea problemas para generar un anticuerpo neutralizante efectivo. Asimismo, se demostró que E2 puede interactuar con la proteína celular PKR (proteína quinasa activada por ARN), una molécula de señalización clave en la vía antiviral de producción de INF3.
Por su parte, la proteína p7 funciona como un canal de iones que se inserta en la membrana celular del huésped. Se demostró que una mutación en esta proteína evita la infección, lo que indica que cumple un rol esencial en el ciclo de vida del virus8.
La proteína NS2 es una serina proteasa integral de membrana, es fosforilada por la proteína quinasa CK2, y está involucrada en la modulación de la apoptosis celular y transcripción9.
La proteína no estructural NS3/4A posee múltiples funciones, está implicada en la modulación de la actividad de la célula huésped e interfiere en la respuesta inmune innata. Adicionalmente, NS3 activa a la caspasa8, que desencadena el proceso de apoptosis10–12.
NS5A es una proteína asociada a la membrana, posee una estructura que le permite interactuar con otras proteínas y ARN virales, es fosforilada por una serina quinasa celular y tiene la capacidad de modular la transformación celular, la regulación transcripcional y la apoptosis. También interactúa con otros factores celulares para suprimir la eficacia antiviral del INF. Finalmente, NS5B tiene la estructura típica de una polimerasa y es la responsable de la replicación viral de ARN que involucra múltiples proteínas3.
Respuesta inmunitaria frente al virus de la hepatitis CUna vez que el virus penetra en el organismo se dirige hacia los hepatocitos, donde puede desarrollarse. La entrada del VHC a los hepatocitos depende de una serie compleja de interacciones con sus células diana, a través de proteínas de superficie celular, entre las que destacamos al receptor LDL, las proteínas CD-81 y SR-B1, y el par claudina-ocludina. Se ha demostrado que para reducir la entrada del VHC a los hepatocitos es necesario el uso combinado de anticuerpos que bloquean la unión de VHC a CD-81, SR-B1 y claudina113. Estos resultados ponen de manifiesto la complejidad del proceso de neutralización del VHC y la necesidad de una estrategia terapéutica combinada para lograr este objetivo de manera eficaz.
Otra estrategia de neutralización estudiada es el uso de anticuerpos contra las glicoproteínas E1 y E2, terapia que puede llegar a generar la resolución de la enfermedad14,15.
Dentro de los primeros minutos posteriores a la activación del sistema inmune innato se liberan una gran variedad de moléculas, citoquinas (INF-α, INF-γ), interleucina 12 (IL-12) y factor de necrosis tumoral alfa (TNF-α), que activan y atraen a otras células, incluyendo las células del sistema inmune adaptativo. La eficiencia de la activación de las células natural killer (NK) puede ser un factor crítico para determinar si el virus se elimina o persiste. Un estudio dirigido por Salim Khakoo y Mary Carrington16 proporcionó la primera evidencia de que ciertos receptores inhibidores de NK influyen en la posibilidad de eliminar la hepatitisC aguda.
La eliminación de la primera célula infectada es la manera de limitar el daño causado por el VHC y representa la respuesta inmune innata. El virus interfiere con la principal vía de señalización usada por los interferonesα y β para transmitir el mensaje dentro de una célula infectada. Los interferones se encuentran entre las citoquinas más potentes y actúan a través de la vía de señalización JAK-STAT. Esta vía se encuentra en todos (o la mayoría) de los tipos celulares. La proteína core del VHC inhibe la inducción de genes estimulados por INF-α y β (ISG)17,18. Esta característica del virus contribuye a la resistencia observada contra la terapia con INF-α.
Cuando la respuesta inmune innata no consigue la eliminación del virus, las células T CD4+ toman el control. Estas ayudan a otras células, como a las célulasB (productoras de anticuerpos) y célulasT CD8+ (atacan a las células infectadas) a erradicar el virus. Una fuerte respuesta de célulasT CD8+ citotóxicas (CTL) está relacionada con la erradicación del virus. Esto fue evidenciado en un estudio hecho en chimpancés, donde los que mostraron una vigorosa respuesta CTL fueron los únicos capaces de resolver la enfermedad19. Estudios en humanos confirman esta relación inversa entre la persistencia de la enfermedad y el grado de respuesta CTL20. En los pacientes con infección crónica parece ser que los epítopos mutados no pueden ser reconocidos por las célulasT CD8+, razón por la cual la enfermedad no puede ser contrarrestada.
La respuesta inmune mediada por anticuerpos es poco clara, en oposición a lo que ocurre con el virus de la hepatitisB, donde los anticuerpos aseguran la neutralización. El rol de los anticuerpos en la protección de la infección frente al VHC es complejo y determinados anticuerpos consiguen el control de la infección; sin embargo, para llegar a la neutralización in vitro es necesario el uso combinado de múltiples anticuerpos.
El primer anticuerpo detectado frente a la exposición al VHC es anti-NS3 y anti-core, y posteriormente aparecen anticuerpos contra NS4 y contra las proteínas de superficie E1 y E2. Tanto en humanos como en chimpancés la supresión o eliminación del VHC viene acompañada de una reducción en los anticuerpos específicos. Asimismo, se determinó que los anticuerpos anti-E2 y anti-E1 no se relacionan con la neutralización del virus, y más aún, se encontró la presencia de anti-E2 en todos los pacientes y chimpancés virémicos21.
Mientras que los anticuerpos parecen ejercer una presión selectiva sobre el VHC, la capacidad de terminar la infección sigue siendo incierta, debido a la existencia de diferentes cepas y genotipos.
Terapia convencional contra el virus de la hepatitis CEl primer tratamiento que mostró efectividad contra el VHC involucra la administración sistemática de INF-α. A través de los años, el tratamiento para la hepatitisC fue desarrollando modificaciones con el uso de los interferones pegilados. Estos son más estables y poseen una larga vida biológica. Se sabe que el INF activa varios mecanismos antivirales directos e indirectos, pero no se conoce el mecanismo molecular in vivo. En combinación con esta terapia, se administra ribavirina, análogo de purina, con un amplio espectro de actividad antiviral. La administración de ribavirina, en combinación con INF pegiladoα para pacientes infectados con VHC, resulta en un incremento del rango de respuesta viral persistente (RVP). El mecanismo, o vías involucradas, que lleva a efectos anti-VHC no se conocen completamente2.
Hay varios factores que influyen en la obtención de una RVP, y dentro de los factores propios del huésped podemos destacar: edad, sexo, raza, índice de masa corporal (IMC), resistencia a la insulina, presencia de esteatosis hepática, coinfección con otros virus, etc. Asimismo, influyen los antecedentes clínicos de los pacientes: personas con VHC crónica y anemia, insuficiencia renal, hepatitis autoinmune, cirrosis descompensada, embarazo, enfermedad cardiopulmonar severa, depresión no controlada o hipotiroidismo no tratado, no son buenas candidatas para el tratamiento4. La presencia de polimorfismos de nucleótidos (single nucleotide polymorphism [SNP]) localizados en el gen IL28B del cromosoma 19 (rs12979860) son altamente predictores del aclaramiento o eliminación del virus de la hepatitisC. Se ha establecido que, para el genotipo1 del VHC, la homocigosis para el aleloC se asocia con una mayor respuesta al tratamiento en comparación con los heterocigotos C/T o los homocigotos T/T. La frecuencia del alelo difiere según los antecedentes étnicos de los pacientes, y es más común en individuos con ancestros asiáticos>europeos>hispanos>africanos22. Asimismo, se encontró que el polimorfismo es menos relevante en el caso de los genotipos2 y 3 del virus; en contraste, el genotipo4 se comporta de manera similar al 123.
Los factores del propio VHC relacionados con una RVP son la carga viral inicial y el genotipo24. Los genotipos pueden ser, en parte, predictores independientes de la respuesta a la terapia con INF, y es más probable que los pacientes infectados con genotipos2 y 3 tengan una respuesta favorable al tratamiento que los infectados por el genotipo 1a y 1b4,25.
El tratamiento con INF pegilado y ribavirina (INF+RBV) está asociado con numerosos efectos adversos. Los más comunes son: síndrome pseudogripal, manifestaciones psiquiátricas, reacciones autoinmunes y toxicidad hematológica. Aunque los efectos adversos pueden ser superados exitosamente en muchos casos, aproximadamente del 20 al 40% de los pacientes requieren que la dosis de INF pegilado o ribavirina sea reducida o temporalmente interrumpida26,27. A pesar de sus efectos adversos es la terapia actualmente más utilizada; en pacientes con hepatitisC crónica logra recuperar la rigidez hepática normal, siendo más efectiva en pacientes que logran una RVP28.
En los últimos años se ha evaluado la posibilidad de utilizar, para el tratamiento, antivirales de acción directa (DAA), principalmente inhibidores de proteasas indispensables para el ciclo de vida del virus. Particularmente se evaluaron inhibidores de proteasas NS3/4; 2 de ellos, boceprevir y telaprevir, han sido recientemente aprobados por la Food and Drug Administration (FDA) y la Agencia Europea del Medicamento y son actualmente utilizados25. Las nuevas terapias combinan el tratamiento convencional (INF+RBV) con el uso de DAA; el objetivo es aumentar la efectividad y poder reducir los tiempos de tratamiento para reducir al mínimo los efectos adversos producidos. Los tratamientos con inhibidores de proteasas de primera generación son engorrosos para los pacientes y requieren la toma de varios comprimidos al día29. Actualmente están en fase de experimentación nuevos inhibidores de proteasas de segunda generación (la mayoría moléculas macrocíclicas) que tratan de solucionar estos aspectos negativos y minimizar los efectos adversos. Se ha demostrado una mayor eficacia en el tratamiento contra el genotipo1 del VHC, aunque todavía tienen una eficacia limitada contra otros genotipos30. Además de los inhibidores de proteasas, están en estudio otros DAA, inhibidores de NS5A e inhibidores de la ARN polimerasa (nucleósidos y no nucleósidos) en varios estadios de experimentación, y se espera que puedan ser utilizados como fármacos más eficientes en futuros tratamientos31.
Terapias innovadoras: mayor eficiencia en la erradicación del virusEl desarrollo de una vacuna efectiva contra el VHC representa un auténtico desafío debido a la gran variabilidad genética del virus. Sumado a esto, se sabe que este virus tiene la capacidad de inhibir la respuesta inmune innata y atenuar la respuesta de célulasT y B32. Actualmente se están realizando numerosos ensayos clínicos de fase1 y fase2, lo que representa un futuro prometedor en vacunas terapéuticas y profilácticas. En la tabla 3 se resumen las principales características de las vacunas en ensayos clínicos que se discutirán a continuación.
Vacunas en fase de experimentación clínica. Existen diferentes opciones de vacunas terapéuticas contra el VHC en experimentación clínica, desde vacunas de proteínas y péptidos, hasta vacunas de vectores como las de ADN
| Vacuna | Tipo | Ventajas/desventajas | Fase clínica | Referencia |
|---|---|---|---|---|
| Recombinante E1 y E2 | Proteínas estructurales | Aumenta la respuesta de la terapia convencional y atenúa la infección primaria | Fase I | 36,37 |
| Recombinante E1 truncada | Proteínas estructurales | Mejora la histología del hígado. No disminuye los niveles de ARN viral. Respuesta celular y humoral | Fase I | 40–42 |
| GI5005 | Proteínas: fusión core-NS3 | Potencia la respuesta innata, reduce la carga viral y aumenta la eficacia de la terapia convencional | Fase Ib/II | 43 |
| IC41 | Péptidos | Respuesta T específica y reducción del ARN de HCV en combinación con la terapia convencional | Fase II | 45,46 |
| Derivados de core | Péptidos | Disminuye la carga viral, respuesta T específica | Fase I | 47,48 |
| TG4040 | Vectores (virus de Ankara modificado) | Se observa una disminución de la carga viral, alta respuesta TCD8+ | Fase I | 49 |
| CICGB 230(E1+E2+proteína core recombinante) | ADN | Anticuerpos neutralizantes, mejora la histología del hígado sin disminuir la viremia | Fase I | 53 |
| Chron Vac C (NS3/4A) | ADN | Disminución de la carga viral a altas dosis | Fase I/IIa | 54 |
Debido a que la composición proteica de la cubierta del VHC varía de un virus a otro, se dificulta el desarrollo de una vacuna específica, pero la existencia de anticuerpos contra proteínas de la envoltura viral permite atenuar la infección primaria y mejorar la respuesta a la terapia convencional33. Se ha observado que las proteínas de superficie E1 y E2 generan protección contra VHC en chimpancés32,34,35. Este resultado es alentador y ha incentivado la realización de estudios en humanos.
Existe una vacuna profiláctica que consiste en un heterodímero proteico recombinante gpE1/gpE2 con el adyuvante MF59 junto con un oligonucleótido CpG36,37. Esta vacuna se evaluó en un estudio de fase1 en 60individuos sanos, los cuales desarrollaron sin excepción anticuerpos anti-VHC y proliferación de linfocitosT. La inducción de anticuerpos y linfocitosT específicos en todos los pacientes fue independiente de la dosis administrada, y la vacuna fue adecuadamente tolerada38. Esta vacuna es utilizada junto con INF pegilado y ribavirina como una terapia en los pacientes que no responden a la terapia convencional39.
Otra vacuna que posee como blanco las proteínas de cubierta de VHC es la de la proteína E1 recombinante truncada en el extremo C-terminal (en el aminoácido135) en adyuvante de alumbre. Existen 2trabajos en los cuales se tomaron 20individuos sanos y 34 con infección crónica sin tratamiento previo. Los resultados mostraron, en algunos individuos, una mejora en la histología del hígado sin disminuir los niveles de ARN de VHC. La vacuna indujo anticuerpos y linfocitosT específicos40,41. Dicho estudio progresa en el seguimiento de 122pacientes que recibieron inyecciones durante 3años, en el cual se observa inducción de la respuesta inmunológica celular y humoral a pesar de no prevenir el daño hepático42.
Vacunas de proteínasComo vacuna terapéutica se utilizan células de la levadura Saccharomyces cerevisiae recombinante, muerta por calor, que expresa la proteína de fusión core NS3 (GI5005). Como respuesta a esta terapia se observa un aumento de las células dendríticas y de la respuesta innata y celular específica39. Se evaluó en un estudio clínico en fase 1b a GI5005 como monoterapia y se observó que los individuos tratados presentaban una reducción de la carga viral, ausente en los que recibieron placebo43. En un ensayo en fase2 GI5005 se combinó con la terapia estándar en 66pacientes con VHC-1 crónica. Esta terapia combinada es significativamente más efectiva que la terapia convencional43.
Ensayos preclínicos realizados en ratones mostraron que las proteínas core de VHC truncadas estimulan respuesta de célulasB y T más potentes que la proteína completa. Otros estudios apoyan esta idea debido a que la proteína core truncada es capaz de penetrar en el núcleo. El diseño de una vacuna basada en proteínas core truncadas es posible y prometedor44. Sin embargo, estos resultados deben ser cuidadosamente analizados y se deberán realizar primero estudios en primates para evaluar la inducción de una respuesta adecuada.
Vacunas de péptidosIC41Consiste en 5péptidos sintéticos de core, NS3 y NS4 con un adyuvante de poli-L-arginina para aumentar la respuesta del INF-γ conservado en los genotipos1 y 233,39. En estudios de fase2 la vacuna fue tolerada y un gran número de pacientes desarrollaron respuestas Th1/Tc1 (INF-γ) específicas para VHC y una baja proliferación de célulasT específicas45. Asimismo, se observó que un tercio de los pacientes tratados presentaron una respuesta sostenida de célulasT que se extendió hasta 6meses luego de la última vacunación. Esta terapia combinada con INF+RBV mostró un alto nivel de eliminación del virus, y en aquellos pacientes que desarrollaron RVP se encontró una fuerte respuesta de linfocitosT específicos46.
En el año 2009 se reportó un estudio de fase 1 en el cual se utiliza una vacuna de péptido core la cual fue bien tolerada e indujo la actividad de CD8+ péptido específica y respuesta citotóxica en 15 de 25 pacientes47. En un estudio realizado en Japón con vacunas peptídicas (cuatro péptidos A24 CD8+) se trató a 12 pacientes con VHC-1b que no respondieron al tratamiento convencional. La mayoría desarrolló respuestas T específicas, en algunos individuos se detectó una disminución dependiente de la dosis de los niveles de alanina transaminasa sérica y ARN del VHC48.
Vacunas de vectoresEl uso de vectores virales mostró ser un potente inductor de la respuesta de célulasT en chimpancés, por lo que representan una opción terapéutica interesante.
Virus de Ankara modificadoTG4040 es una vacuna terapéutica que utiliza el virus de Ankara modificado (MVA), una cepa altamente atenuada de poxvirus que codifica las proteínas NS3/4/5B. Esta vacuna se evaluó en un ensayo con 15pacientes, y en 6 de estos disminuyó la carga viral, en asociación a una respuesta significativa de célulasT CD8+49.
En ensayos preclínicos se evaluó MVA recombinante que codifica NS3/4/5B en ratones, y se observó una fuerte y duradera respuesta tanto de célulasT CD8+ como CD4+50. En otro estudio se vacunó a chimpancés con MVA recombinante que codifica core E1-E2 y NS3 de VHC, induciendo fuertes respuestas de célulasT CD8+ y de citoquinas Th1/Th2, y desarrollo de anticuerpos específicos. Sin embargo, no presentaron protección contra la infección crónica51.
ADNLas vacunas de ADN están compuestas por plásmidos bacterianos que codifican el antígeno de interés bajo el control de promotores eucarióticos. Presentan una serie de ventajas sobre las vacunas convencionales o de proteínas recombinantes, entre las que destacan rápido diseño, fácil manipulación y aislamiento, posible producción a gran escala, alta seguridad, ausencia de problemas de empaquetamiento (como sí poseen las proteínas) y relativo bajo costo. La efectividad no es elevada, pero se están estudiando nuevas formas de administración con el fin de mejorarla, y no se han registrado grandes efectos adversos en humanos52.
En la actualidad se está evaluando la utilización de 2vacunas terapéuticas basadas en ADN para lograr la erradicación del VHC: CICGB-230 y ChronVac-C. La primera contiene un plásmido que expresa los antígenos estructurales y la proteína core recombinante. Se evaluó en individuos que no respondieron al tratamiento convencional, y se observó la presencia de anticuerpos neutralizantes y una débil respuesta de célulasT específicas para core. A pesar de que no disminuyó la viremia, la histología del hígado mejoró notablemente53. La segunda vacuna consta de un plásmido que expresa los antígenos NS3/4A y está siendo evaluada en un estudio de fase 1/2a en pacientes sin tratamiento previo. La vacuna no presentó efectos adversos y el 67% de los pacientes que recibieron las dosis más altas mostraron una disminución de la carga viral54. En un estudio reciente se probó la administración de esta vacuna mediante electroporación in vivo en pacientes con infección crónica por el genotipo1 del VHC55. Este método de administración genera un aumento de la captación y expresión del ADN y una respuesta inflamatoria local, y asimismo se observó una fuerte respuesta de célulasT. En pacientes en tratamiento con INF+RBV produjo la eliminación del virus. Aunque estos resultados aún son preliminares, ya que el número de casos analizados es bajo y las condiciones muy variables, son muy alentadores.
Además de las vacunas de vectores en fase de experimentación clínica, vale la pena mencionar 2estrategias aún en ensayos preclínicos. Una de ellas utiliza adenovirus recombinantes para expresar las proteínas estructurales y no estructurales. Poseen la ventaja frente a péptidos sintéticos de poder expresar cualquier proteína viral y no tener limitaciones por clase de molécula HLA56,57. Se han realizado ensayos en ratones y en chimpancés con adenovirus que expresan NS3-NS5B, y en ambos casos se obtuvo una fuerte respuesta de célulasT CD8+58-60. Los vectores de adenovirus que codifican proteínas core y NS3 de VHC son útiles para estimular la respuesta celular inmune específica de protección39.
Por otro lado, se están estudiando las partículas tipo virus (VLP’). Son partículas retrovirales que poseen la envoltura nuclear de un virus heterólogo, en este caso E1 y E2 de VHC, y albergan un genoma defectuoso. Inducen una neutralización efectiva de los anticuerpos, al igual que el virus VHC34. Una vacuna basada en VLP’ haría posible la distribución de anticuerpos neutralizantes y epítopos de célulasT específicas para core recreando los viriones antigénicos maduros39. Es una propuesta alentadora, ya que se ha observado una respuesta exitosa para el virus de la hepatitisB y el virus del papiloma humano61,62. Esta estrategia fue analizada en ratones y en chimpancés, donde indujo la respuesta celular y humoral para proteínas estructurales del VHC y maduración de células dendríticas63–66.
DiscusiónVacunas: ¿profilaxis o alternativas terapéuticas?A pesar de los avances en el conocimiento del VHC, sobre la estructura, el genoma, el ciclo de vida, así como los distintos estudios desarrollados sobre las diferentes etapas de la enfermedad, aún no se ha conseguido una terapia efectiva en todos los casos. El genotipo y la replicación viral son los principales factores a la hora de estimar la RVP para determinar qué tipo de tratamiento se llevará a cabo. Los objetivos del tratamiento contra la hepatitisC crónica son la erradicación del virus y la interrupción de la progresión de la enfermedad del hígado. La terapia convencional (INF+RBV) es la más utilizada, a pesar de tener muchos efectos adversos y ser económicamente muy costosa. Esta ha sido ampliamente mejorada con el uso de DAA, ya que se obtienen mayores respuestas. La tendencia de los tratamientos es evaluar los casos individualmente, analizando factores genéticos del huésped (IL28B) y ajustando los tiempos del tratamiento para cada caso en particular con el objetivo de minimizar los efectos adversos. Hasta el momento no se ha encontrado una mejor opción que pueda utilizarse en la mayoría de los casos.
En los estudios realizados en los últimos años se ha demostrado que las vacunas son buenas alternativas terapéuticas, aunque todavía no se ha llegado a obtener una vacuna preventiva frente al VHC. Las vacunas de proteínas son muy efectivas, incluso en pacientes que no muestran respuesta a la terapia convencional. Estas inducen la inmunidad de célulasT específicas a través de la presentación directa del antígeno al receptor de célulasT vía moléculas HLA. Su limitación radica en la alta variabilidad existente en la población de HLA, por lo que la eficiencia estaría restringida solo a un grupo de pacientes. Las vacunas de vectores como el adenovirus plantean una solución a estos inconvenientes de las vacunas de proteínas, pero aún están en estadios preclínicos. Las vacunas de ADN poseen ventajas sobre las de proteínas y menor cantidad de efectos adversos. Actualmente tienen baja efectividad, aunque existe la posibilidad de aumentar su eficacia con el desarrollo de técnicas alternativas de administración, como la electroporación, que mejoren la captación y la expresión del ADN.
Actualmente el uso de vacunas mejora los tratamientos, aumentando la respuesta y disminuyendo los efectos adversos. Se espera que cada región pueda desarrollar un tratamiento particular teniendo en cuenta la prevalencia geográfica de distribución del virus, los factores genéticos de la población y las alternativas terapéuticas (INF+RBV, DAA, vacunas, etc.). El objetivo es obtener un tratamiento combinado que genere la máxima efectividad de respuesta con los mínimos efectos adversos.
El desarrollo de nuevos estudios sobre estas y sobre nuevas terapias, de la mano de campañas efectivas de prevención, podrá disminuir de manera sustancial los casos graves de enfermedad por el VHC. Asimismo se genera la expectativa de llegar a obtener una vacuna profiláctica en los próximos años.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.