Caso clínico
Mujer de 43 años de edad que acudió a urgencias por presentar un cuadro de fiebre de 24 h de evolución, náuseas y diarrea. No presentaba dolor abdominal ni síndrome miccional, aunque sí refería prurito vaginal desde hacía una semana. En la exploración física la paciente se hallaba consciente, orientada, taquipneica y taquicárdica. En la auscultación el murmullo vesicular estaba conservado sin apreciarse ruidos patológicos ni soplos cardíacos. La temperatura era de 40 °C y la presión arterial de 60/30 mmHg. Presentaba signos de mala perfusión con cianosis acra y frialdad, apreciándose un área de celulitis con eritema y edema intenso en vulva, periné e hipogastrio.
En la analítica destacaron: leucocitos 3.100/μl (91,3% N, 2,2% L, 3,4% M, 3,1% E), plaquetas 111.000/μl, Hb 10,5 g/dl, Hto 32,8%, fibrinógeno 182 mg/dl, tiempo de protrombina 35%, INR 3,6, pH 7,16, pO2 69 mmHg, pCO2 52,9 mmHg y HCO3 14 mmol/l. En la radiografía de tórax presentaba infiltrado intersticial bilateral. Se realizó una tomografía computarizada en la que se evidenció líquido libre en la cavidad pélvica. Posteriormente se efectuó una laparotomía exploradora que mostró edema pélvico como único hallazgo de interés. Se desbridó quirúrgicamente la zona de celulitis practicándose varias incisiones pubicoinguinales bilaterales, sin observarse crepitación ni zonas necróticas. Tras la recogida de muestras del área perineal y hemocultivos se instauró tratamiento antibiótico empírico por vía intravenosa con cefotaxima (2 g/8 h) más gentamicina (5 mg/kg/día). No se recogieron muestras de urocultivo ni de exudado vaginal. La paciente ingresó en la unidad de cuidados intensivos en el postoperatorio inmediato.
Evolución
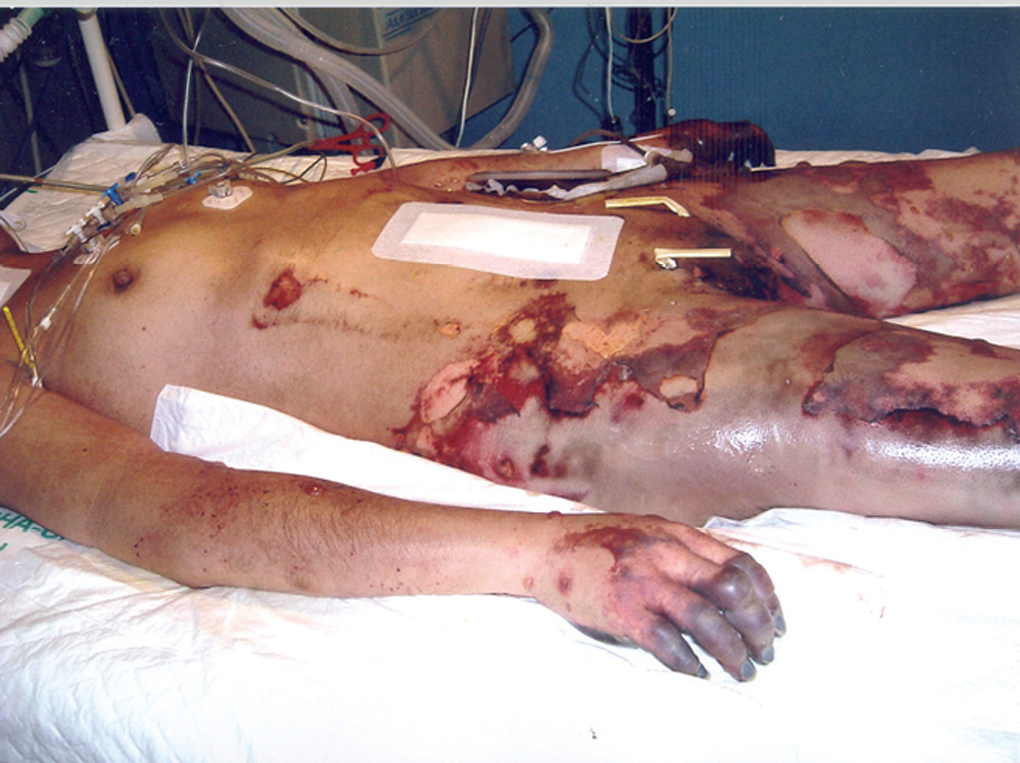
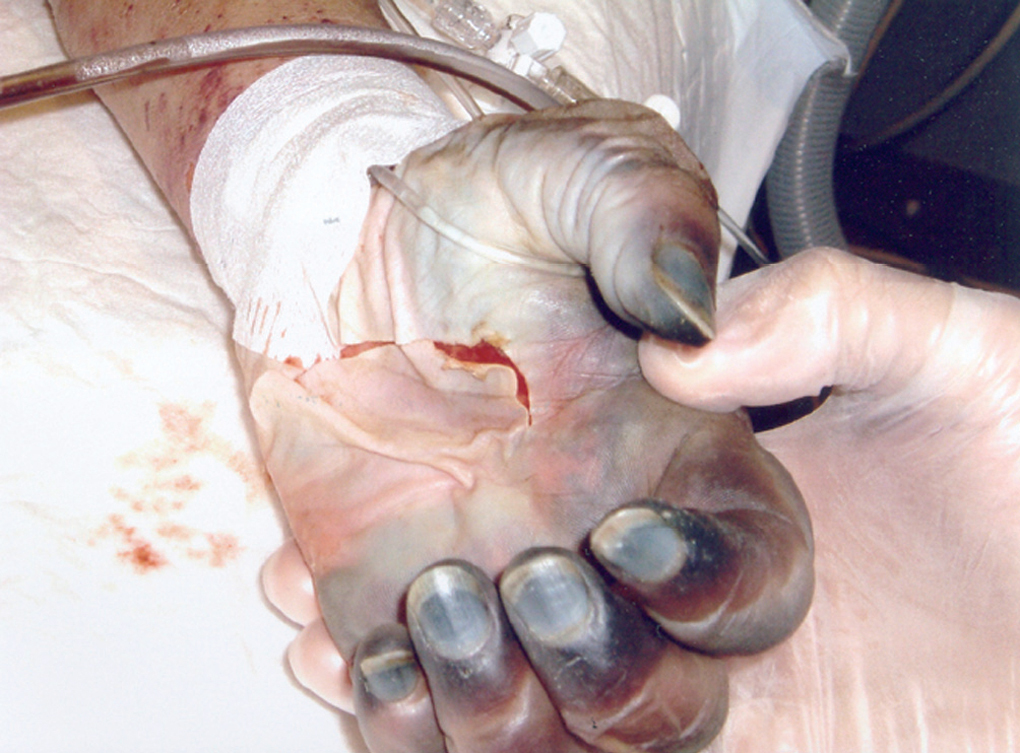
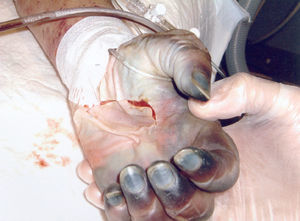
Las lesiones cutáneas evolucionaron rápidamente, extendiéndose por todo el abdomen, tórax, miembros superiores y zonas proximales de miembros inferiores (fig. 1), con la aparición de flictenas hemorrágicas, petequias confluyentes, cianosis y finalmente necrosis en partes acras (fig. 2). La paciente desarrolló fracaso renal con oliguria, incremento de la acidosis metabólica, distrés respiratorio y coagulopatía de consumo. Ante la persistencia de fracaso renal agudo anúrico se decidió iniciar tratamiento con hemodiafiltración venovenosa.
Figura 1. Presencia de lesiones eritematosas y descamativas en abdomen, tórax, miembros superiores y zonas proximales de miembros inferiores.
Figura 2. Aparición de cianosis distal en miembros superiores.
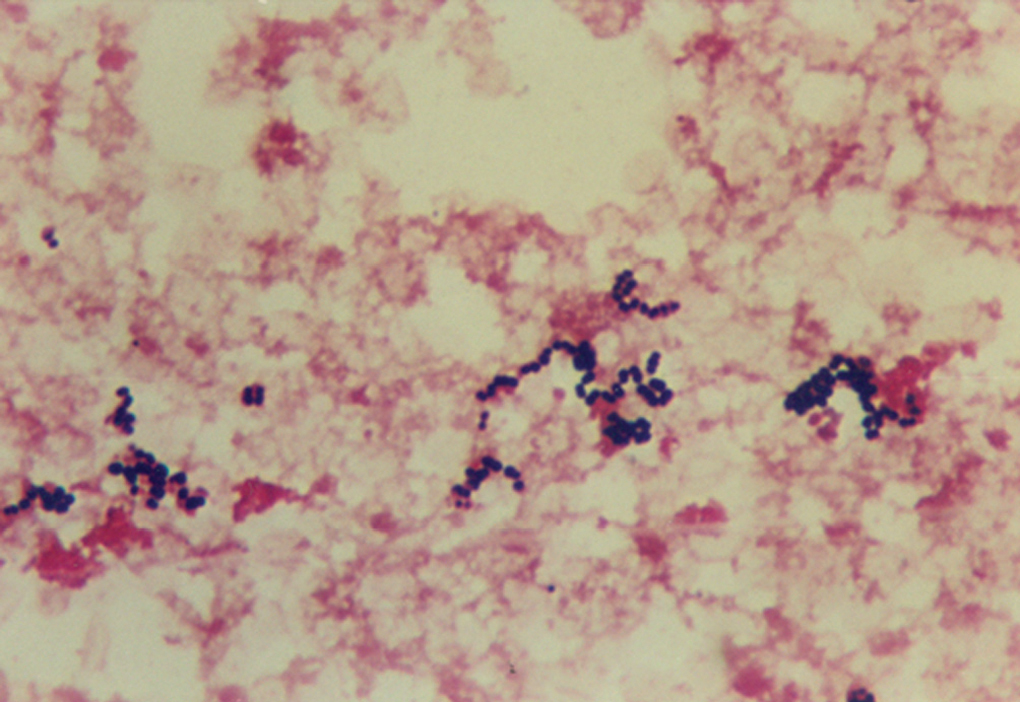
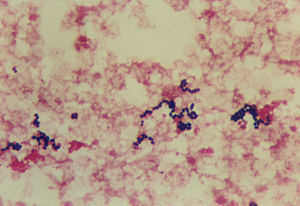
En la tinción de Gram de las muestras obtenidas de la lesión perineal se observaron cocos grampositivos en parejas y cadenas (fig. 3). En el cultivo crecieron colonias betahemolíticas del grupo A de Lancefield que fueron identificadas como Streptococcus pyogenes mediante el sistema comercial API 20Strep (BioMérieux). El estudio de susceptibilidad de la cepa se efectuó mediante las técnicas de difusión con discos y microdilución en caldo, resultando sensible a penicilina, amoxicilina-ácido clavulánico, cefotaxima, eritromicina, clindamicina, vancomicina, imipenem, levofloxacino, tetraciclina y rifampicina. En el hemocultivo se aisló el mismo microorganismo con idéntico patrón de sensibilidad. A pesar de cambiar el tratamiento a clindamicina (900 mg/8 h) más teicoplanina (12 mg/kg/día), al considerar la posibilidad de sobreinfección por Staphylococcus aureus, persistió la mala evolución con mayor deterioro hemodinámico, intensa coagulopatía y fallo multiorgánico, falleciendo la enferma a los 25 días del ingreso.
Figura 3. Tinción de Gram del hemocultivo en la que se observan cocos grampositivos en parejas y cadenas.
La cepa fue analizada en el laboratorio de S. pyogenes del Servicio de Bacteriología del Centro Nacional de Microbiología del Instituto de Salud Carlos III, donde se identificó como S. pyogenes serotipo M1, T1, productora de las exotoxinas pirogénicas estreptocócicas A, B, F, G y H. Otros genes de virulencia detectados fueron el ssa y el smez.
Diagnóstico
Síndrome de shock tóxico (SST) estreptocócico por S. pyogenes.
Comentario
S. pyogenes puede producir infecciones localizadas como faringoamigdalitis, sinusitis, otitis media, linfadenitis e impétigo, pero también infecciones invasivas que incluyen fascitis necrosante, sepsis y SST estreptocócico 1,2. El SST estreptocócico consiste en la aparición brusca de shock y fallo orgánico en el curso de una infección estreptocócica. Los criterios diagnósticos que lo definen inequívocamente son el aislamiento de estreptococo del grupo A en una localización normalmente estéril junto con hipotensión (presión arterial sistólica ≤ 90 mm Hg) y dos o más de los siguientes signos: insuficiencia renal (creatinina ≥ 2 mg/dl), coagulopatía (plaquetas ≤ 100.000/μl o coagulación intravascular diseminada), afectación hepática (ALT, AST o bilirrubina total ≥ 2 veces los niveles normales), síndrome de distrés respiratorio del adulto, exantema eritematoso macular con o sin descamación y necrosis de tejidos blandos 3. En nuestro paciente se aisló S. pyogenes en sangre y tejidos blandos y presentó todos los signos mencionados que definen el SST.
Los mecanismos patogénicos responsables del SST estreptocócico se han relacionado con exotoxinas pirogénicas estreptocócicas. Los estreptococos del grupo A (especialmente los serotipos M1, M3 y M18) producen estas exotoxinas que estimulan la activación y proliferación de macrófagos y linfocitos T, con la consiguiente liberación de citocinas causantes de daño tisular y shock 1,4. La cepa aislada en el caso que presentamos correspondió al serotipo M1 y se detectaron los genes de virulencia codificantes de las exotoxinas pirogénicas A, B, F, G y H, y del superantígeno estreptocócico (ssa).
El tratamiento del SST estreptocócico se basa en el desbridamiento quirúrgico extenso de las lesiones cutáneas junto con la terapia antimicrobiana adecuada. La asociación de penicilina y clindamicina constituye la pauta antibiótica recomendada 5. En infecciones severas y profundas por S. pyogenes, penicilina puede resultar ineficaz debido a la falta de expresión de las PBP durante la fase de crecimiento estacionario bacteriano. Por esta razón se recomienda asociar clindamicina que, además, impide la producción bacteriana de exotoxinas y proteína M. El pronóstico es muy desfavorable a pesar del tratamiento 6 aunque se ha observado una menor mortalidad al administrar gammaglobulina intravenosa como terapia coadyuvante debido a su capacidad para inactivar las toxinas circulantes 7.
Agradecimientos
Queremos agradecer al Dr. Sáez-Nieto del Servicio de Bacteriología del Centro Nacional de Microbiología su colaboración en el estudio de la cepa.
Correspondencia: Dr. Rafael Carranza-González.
Laboratorio de Microbiología. Hospital General La Mancha Centro.
Avda. de la Constitución, 3. 13600. Alcázar de San Juan. Ciudad Real. España.
Correo electrónico: rcarranza@sescam.jccm.es
Manuscrito recibido el 26-4-2005; aceptado el 22-6-2005.