Estimar la prevalencia de infección por el virus de la hepatitis C (VHC) en Navarra, distinguiendo entre infecciones diagnosticadas y no diagnosticadas.
MétodosSe estudiaron pacientes con cirugía programada no relacionada con la infección por VHC, a los que se les realizó de forma sistemática la determinación de anticuerpos del VHC entre enero de 2014 y septiembre de 2016. En los pacientes con enzimoinmunoanálisis positivo se confirmó el diagnóstico mediante inmunoblot y/o determinación de ARN-VHC. También se comprobó la existencia de resultados positivos previos. La prevalencia se estandarizó por sexo y edad a la población de Navarra.
ResultadosSe analizaron 7.378 pacientes, 50% mujeres, con una mediana de edad de 46 años. En 69 se detectaron anticuerpos del VHC, lo que supone una prevalencia poblacional estimada de 0,83% (intervalo de confianza del 95%: 0,64-1,05), mayor en hombres (1,11%) que en mujeres (0,56%; p=0,0102). Entre los que resultaron anti-VHC positivos, 67 (97%) habían tenido alguna prueba positiva previa. La prevalencia poblacional de diagnóstico previo de anti-VHC fue del 0,80%, y la de nuevos diagnósticos, del 0,03%. El 78% de los pacientes con anti-VHC positivo habían presentado alguna determinación de ARN-VHC detectable. Se estima que el 0,65% de la población había tenido ARN-VHC detectable y el 0,51% lo seguía teniendo en el momento del estudio.
ConclusiónEstos resultados revisan a la baja las estimaciones previas de prevalencia de infección por VHC. Una proporción mínima de las personas con anti-VHC permanecen sin diagnosticar, y solo una parte mantienen infección activa.
To estimate the prevalence of hepatitis C virus (HCV) infection in Navarra, Spain, as well as to distinguish between diagnosed and undiagnosed infections.
MethodsA study was conducted on patients scheduled for surgery unrelated to HCV infection. They were all tested for HCV antibodies, under a routine scheme, from January 2014 to September 2016. Patients with a positive result by enzyme immunoassay were confirmed using immunoblot and/or HCV-RNA. Previous laboratory results were also taken into account. The prevalence was adjusted to the sex and age structure of the Navarra population.
ResultsThe study included a total of 7,378 patients with a median age 46 years, of whom 50% women. HCV antibodies were detected in 69 patients, which is a prevalence in the population of 0.83% (95% confidence interval: 0.64-1.05), and was higher in men (1.11%) than in women (0.56%; P=.0102). Among the HCV positive patients, 67 (97%) had had another previous positive result. Population prevalence of previous positive HCV was 0.80%, and was 0.03% for a new diagnosis. Of the HCV positive patients, 78% had detectable HCV-RNA. It was estimated that 0.65% of the population had had detectable HCV-RNA, and 0.51% continued to have it when recruited into the study.
ConclusionPrevious estimates of prevalence of HCV infection should be revised downwards. Only a small proportion of HCV positive patients remain undiagnosed, and only a small part have active infection.
Numerosos estudios han puesto de manifiesto la elevada prevalencia de anticuerpos frente al virus de la hepatitis C (VHC) en distintos grupos de población en España, donde la mayoría de las infecciones se habrían producido en las décadas de 1980 y 19901. Sin tratamiento, un 55-85% de las personas infectadas habrán desarrollado una infección crónica2–4. Todo ello explica que el VHC sea una causa importante de carga de enfermedad en España5.
La introducción de los nuevos fármacos antivirales de acción directa frente al VHC ha aumentado el interés por disponer de estimaciones actualizadas de la extensión real de esta infección en la población3,4. La información sobre vigilancia epidemiológica de la infección por el VHC es escasa y no permite conocer bien su prevalencia actual3,6. Algunas encuestas seroepidemiológicas han aportado estimaciones, pero son estudios costosos y difíciles de repetir, con el paso de los años han podido quedar parcialmente desactualizados, y habitualmente no permiten distinguir entre infecciones diagnosticadas y no diagnosticadas7–11. También se han realizado numerosos estudios de prevalencia en poblaciones de alto riesgo, que son de gran utilidad para dirigir intervenciones específicas es estos colectivos, pero de sus resultados no es fácil extraer datos extrapolables a la población general1.
El presente estudio tiene como objetivo estimar la prevalencia total de infección por el VHC en la población de Navarra, distinguiendo entre las infecciones previamente diagnosticadas y las no diagnosticadas. También se estimó la prevalencia de infecciones activas.
MetodologíaSe realizó un estudio transversal de prevalencia en la población residente en Navarra cubierta por la red asistencial pública (el 97% de la población total), utilizando bases de datos asistenciales y de Microbiología.
En 2014 y 2015 se realizaron una media anual de 3,5 determinaciones de anticuerpos del VHC por cada 100 habitantes en Navarra. Una parte de estas determinaciones se realiza en personas con algún grado de sospecha de infección por el VHC, y otra parte se realiza dentro de protocolos o rutinas de cribado sistemático, sin tener en cuenta los resultados de analíticas previas. En este segundo grupo se incluyeron los donantes de sangre y órganos, las mujeres embarazadas, las parejas en programas de reproducción asistida y los pacientes que iban a ser sometidos a cirugía programada con alta probabilidad de sangrado. De todos estos grupos se eligió para el presente estudio a los pacientes que iban a ser sometidos a intervenciones programadas en los servicios de Cirugía Maxilofacial, Cirugía Plástica, Otorrinolaringología, Oftalmología y Cirugía Cardiaca, por considerarlos los más representativos de la población general y menos sesgados con respecto a su posibilidad de infección por el VHC.
En el estudio prequirúrgico de estos pacientes se solicitaba de forma sistemática, junto con otras determinaciones, la serología de anticuerpos del VHC (anti-VHC) mediante enzimoinmunoanálisis (EIA) de micropartículas (ARCHITECT Anti-HCV, Abbott Laboratories, Wiesbaden, Alemania), sin tener en cuenta posibles resultados serológicos previos.
En los pacientes con anti-VHC positivos en EIA se realizó la confirmación por inmunoblot (INNO-LIA HCV Score INNOGENETICS, Fujirebio, Gante, Bélgica), y/o la determinación de ARN-VHC (RT-PCR) cuantitativa (Cobas HCV, Roche Diagnostics, Mannheim, Alemania).
Para el presente estudio se consideraron todos los pacientes residentes en Navarra a los que se les habían solicitado determinaciones prequirúrgicas en los servicios mencionados entre enero de 2014 y septiembre de 2016, tomados de las bases de datos de Microbiología. Cada paciente se incluyó solo una vez, priorizando el último resultado válido.
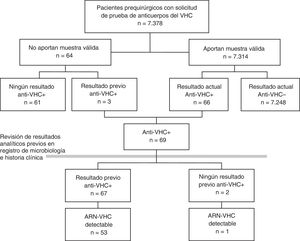
En todos los pacientes se comprobó la existencia de resultados positivos para el VHC en la historia clínica y en los registros de Microbiología.
Definiciones- -
Infección por VHC: paciente con resultado de anticuerpos anti-VHC positivos por EIA, y con inmunoblot positivo y/o con ARN-VHC detectable actual o previo. En las infecciones por VHC se distinguieron 2 grupos: las infecciones diagnosticadas y los nuevos diagnósticos.
- -
Infección por VHC conocida o diagnosticada: paciente con infección por VHC en el que constaba algún resultado previo positivo para el VHC documentado en los registros de Microbiología o en la historia clínica. En esta categoría se incluyeron también los pacientes que no aportaron muestra de suero válida en la analítica prequirúrgica, pero que tenían un resultado previo documentado de infección por VHC confirmada. Estos pacientes se consideraron indicadores de las infecciones conocidas en la población.
- -
Nuevos diagnósticos de infección por el VHC: pacientes con infección por el VHC confirmada en la analítica prequirúrgica, en los que no se encontró constancia de un resultado previo positivo. Estos pacientes se consideraron indicadores de las infecciones no diagnosticadas en la población.
- -
Infección activa por VHC actual o previa: pacientes con infección confirmada por el VHC que tenían niveles detectables de ARN-VHC en el momento de la selección o en alguna determinación previa a esta.
- -
Infección activa por VHC en el momento de la selección: pacientes con infección confirmada por el VHC que tenían niveles detectables de ARN-VHC en el momento de la selección.
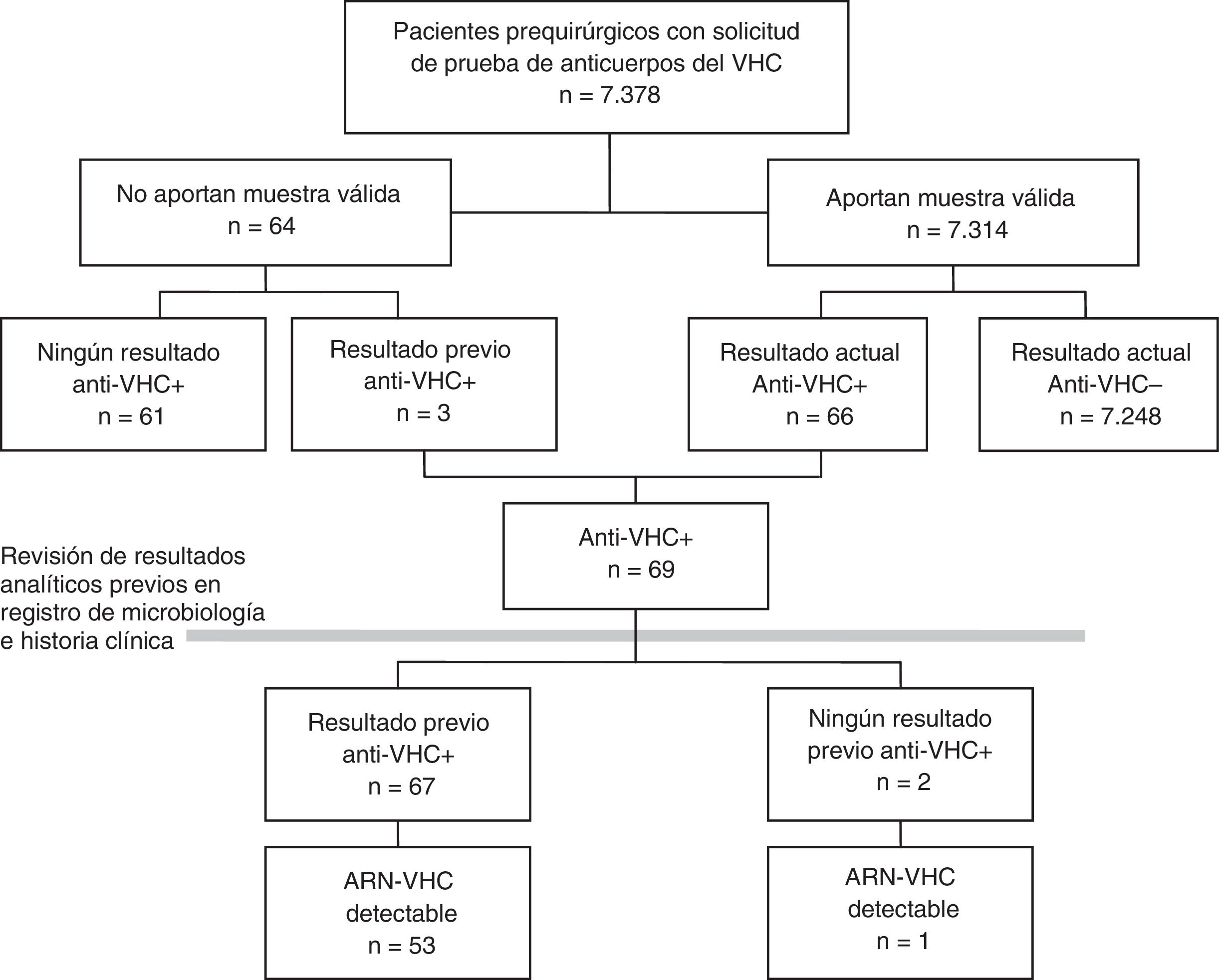
En un primer paso se calculó la prevalencia de cada indicador sobre la población total incluida en el estudio prequirúrgico. Unos pocos pacientes a los que se les solicitó el estudio prequirúrgico no aportaron ninguna muestra válida. Para minimizar el posible sesgo de no participación, estos pacientes también se incluyeron en el estudio, tomando los resultados de sus pruebas previas documentadas para VHC (fig. 1). Además se realizó un análisis de sensibilidad estimando la prevalencia solo con los pacientes con resultado válido en la analítica prequirúrgica.
En una segunda parte se pasó a estimar la prevalencia poblacional a partir de la población prequirúrgica. Como la distribución por edad y sexo de los pacientes incluidos en el estudio podría no corresponderse con la de la población general, se estandarizaron las tasas por el método directo, tomando como población de referencia la residente en Navarra con cobertura asistencial por el Servicio Navarro de Salud a 1 de enero de 2016.
Para la comparación de proporciones se utilizaron la prueba de chi-cuadrado y la prueba exacta de Fisher. Para las estimaciones de la prevalencia se obtuvieron los intervalos de confianza (IC) al 95% por el método mid-p test.
ResultadosEntre enero de 2014 y septiembre de 2016 se solicitó serología del VHC a 7.378 pacientes prequirúrgicos. Se obtuvo una muestra de suero válida en 7.314 (99,1%), de 62 no se recibió muestra en el laboratorio y de 2 la muestra no fue válida (fig. 1). El 42% de los pacientes eran de Otorrinolaringología, el 31% de Cirugía Maxilofacial, el 16% de Cirugía Plástica, el 6% de Oftalmología y el 6% de Cirugía Cardiaca. El 50% eran mujeres, y la mediana de edad fue de 46 años (rango intercuartil 33-61, rango 1-100 años).
Prevalencia de infección por el virus de la hepatitis C en pacientes prequirúrgicosDe los 7.314 pacientes prequirúrgicos con analítica válida, 89 fueron positivos en un primer EIA, y de ellos, 23 se descartaron y 66 fueron positivos a anti-VHC mediante una prueba confirmatoria (0,90%). Entre los 64 pacientes que no aportaron una muestra válida, 3 (4,69%) tenían anti-VHC positivos previos, lo que supone una prevalencia mayor que la de los analizados (p=0,0217), por lo que se optó por incluirlos en el estudio de prevalencia (fig. 1).
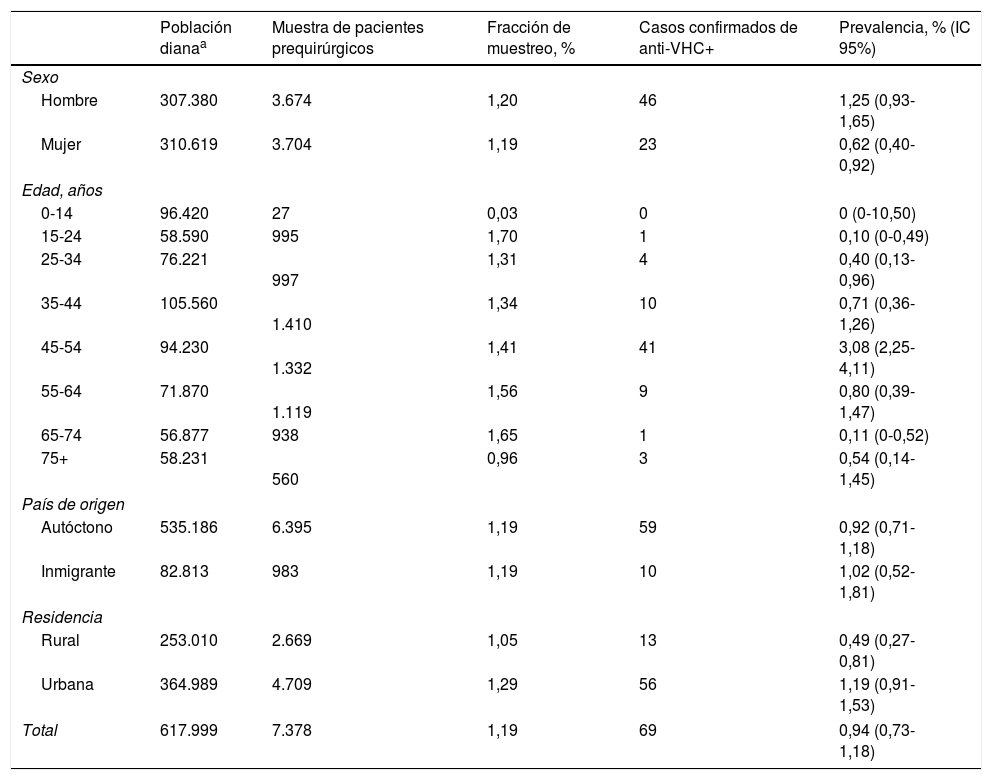
La muestra analizada supuso el 1,19% de toda la población cubierta por el Servicio Navarro de Salud. La fracción de muestreo fue de solo un 0,03% de los niños menores de 15 años, y del 0,96% en personas de 75 y más años. En el resto de los grupos de edad osciló entre el 1,31 y el 1,70%. La fracción de muestreo fue similar en población autóctona e inmigrante, y algo mayor en la población urbana que en la rural (tabla 1).
Fracción de muestreo de la muestra de pacientes prequirúrgicos con respecto a la población cubierta por el Servicio Navarro de Salud, y estimación de la prevalencia de anticuerpos positivos para el virus de la hepatitis C en los pacientes prequirúrgicos por sexo, grupos de edad, país de origen y residencia
| Población dianaa | Muestra de pacientes prequirúrgicos | Fracción de muestreo, % | Casos confirmados de anti-VHC+ | Prevalencia, % (IC 95%) | |
|---|---|---|---|---|---|
| Sexo | |||||
| Hombre | 307.380 | 3.674 | 1,20 | 46 | 1,25 (0,93-1,65) |
| Mujer | 310.619 | 3.704 | 1,19 | 23 | 0,62 (0,40-0,92) |
| Edad, años | |||||
| 0-14 | 96.420 | 27 | 0,03 | 0 | 0 (0-10,50) |
| 15-24 | 58.590 | 995 | 1,70 | 1 | 0,10 (0-0,49) |
| 25-34 | 76.221 | 997 | 1,31 | 4 | 0,40 (0,13-0,96) |
| 35-44 | 105.560 | 1.410 | 1,34 | 10 | 0,71 (0,36-1,26) |
| 45-54 | 94.230 | 1.332 | 1,41 | 41 | 3,08 (2,25-4,11) |
| 55-64 | 71.870 | 1.119 | 1,56 | 9 | 0,80 (0,39-1,47) |
| 65-74 | 56.877 | 938 | 1,65 | 1 | 0,11 (0-0,52) |
| 75+ | 58.231 | 560 | 0,96 | 3 | 0,54 (0,14-1,45) |
| País de origen | |||||
| Autóctono | 535.186 | 6.395 | 1,19 | 59 | 0,92 (0,71-1,18) |
| Inmigrante | 82.813 | 983 | 1,19 | 10 | 1,02 (0,52-1,81) |
| Residencia | |||||
| Rural | 253.010 | 2.669 | 1,05 | 13 | 0,49 (0,27-0,81) |
| Urbana | 364.989 | 4.709 | 1,29 | 56 | 1,19 (0,91-1,53) |
| Total | 617.999 | 7.378 | 1,19 | 69 | 0,94 (0,73-1,18) |
Anti-VHC: anticuerpos frente al virus de la hepatitis C; IC 95%: intervalo de confianza al 95%.
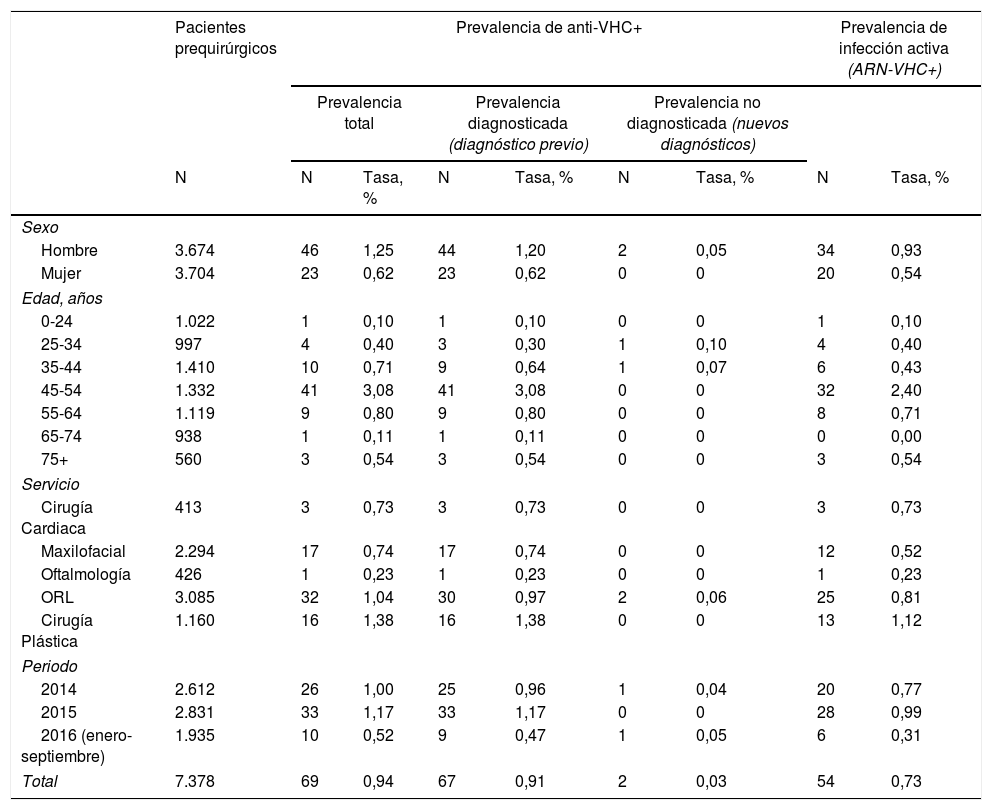
En el total de pacientes prequirúrgicos, la prevalencia de anti-VHC fue del 0,94%. Fue mayor en hombres (1,25%) que en mujeres (0,62%; p=0,0049). La mayor prevalencia se observó en el grupo de 45 a 54 años (3,08%; p<0,0001). No se detectaron diferencias estadísticamente significativas entre los servicios quirúrgicos de selección (p=0,1847) (tabla 2).
Prevalencia de anticuerpos positivos para el virus de la hepatitis C en los pacientes prequirúrgicos, diferenciando entre prevalencia de infección diagnosticada y no diagnosticada, e infección activa con detección positiva de ARN del virus de la hepatitis C
| Pacientes prequirúrgicos | Prevalencia de anti-VHC+ | Prevalencia de infección activa (ARN-VHC+) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Prevalencia total | Prevalencia diagnosticada (diagnóstico previo) | Prevalencia no diagnosticada (nuevos diagnósticos) | |||||||
| N | N | Tasa, % | N | Tasa, % | N | Tasa, % | N | Tasa, % | |
| Sexo | |||||||||
| Hombre | 3.674 | 46 | 1,25 | 44 | 1,20 | 2 | 0,05 | 34 | 0,93 |
| Mujer | 3.704 | 23 | 0,62 | 23 | 0,62 | 0 | 0 | 20 | 0,54 |
| Edad, años | |||||||||
| 0-24 | 1.022 | 1 | 0,10 | 1 | 0,10 | 0 | 0 | 1 | 0,10 |
| 25-34 | 997 | 4 | 0,40 | 3 | 0,30 | 1 | 0,10 | 4 | 0,40 |
| 35-44 | 1.410 | 10 | 0,71 | 9 | 0,64 | 1 | 0,07 | 6 | 0,43 |
| 45-54 | 1.332 | 41 | 3,08 | 41 | 3,08 | 0 | 0 | 32 | 2,40 |
| 55-64 | 1.119 | 9 | 0,80 | 9 | 0,80 | 0 | 0 | 8 | 0,71 |
| 65-74 | 938 | 1 | 0,11 | 1 | 0,11 | 0 | 0 | 0 | 0,00 |
| 75+ | 560 | 3 | 0,54 | 3 | 0,54 | 0 | 0 | 3 | 0,54 |
| Servicio | |||||||||
| Cirugía Cardiaca | 413 | 3 | 0,73 | 3 | 0,73 | 0 | 0 | 3 | 0,73 |
| Maxilofacial | 2.294 | 17 | 0,74 | 17 | 0,74 | 0 | 0 | 12 | 0,52 |
| Oftalmología | 426 | 1 | 0,23 | 1 | 0,23 | 0 | 0 | 1 | 0,23 |
| ORL | 3.085 | 32 | 1,04 | 30 | 0,97 | 2 | 0,06 | 25 | 0,81 |
| Cirugía Plástica | 1.160 | 16 | 1,38 | 16 | 1,38 | 0 | 0 | 13 | 1,12 |
| Periodo | |||||||||
| 2014 | 2.612 | 26 | 1,00 | 25 | 0,96 | 1 | 0,04 | 20 | 0,77 |
| 2015 | 2.831 | 33 | 1,17 | 33 | 1,17 | 0 | 0 | 28 | 0,99 |
| 2016 (enero-septiembre) | 1.935 | 10 | 0,52 | 9 | 0,47 | 1 | 0,05 | 6 | 0,31 |
| Total | 7.378 | 69 | 0,94 | 67 | 0,91 | 2 | 0,03 | 54 | 0,73 |
Anti-VHC: anticuerpos frente al virus de la hepatitis C; ARN-VHC+: detección positiva de ARN del virus de la hepatitis C, indicativa de infección activa; ORL: Otorrinolaringología.
De los 69 pacientes con anti-VHC positivos, 67 (97%) tenían alguna prueba positiva previa. Esta proporción no difirió entre hombres (96%) y mujeres (100%; p=0,5490). Estos datos suponen una prevalencia de infecciones conocidas del 0,91%, que fue mayor en hombres (1,20%) que en mujeres (0,62%; p=0,0090), y en el grupo de 45 a 54 años (3,08%; p<0,0001) con respecto a los otros grupos de edad.
Los 2 pacientes que tuvieron un resultado anti-VHC positivo por primera vez suponen una prevalencia de seropositividad no diagnosticada del 0,03%, sin diferencias significativas entre sexos (p=0,2479) ni entre grupos de edad (tabla 2).
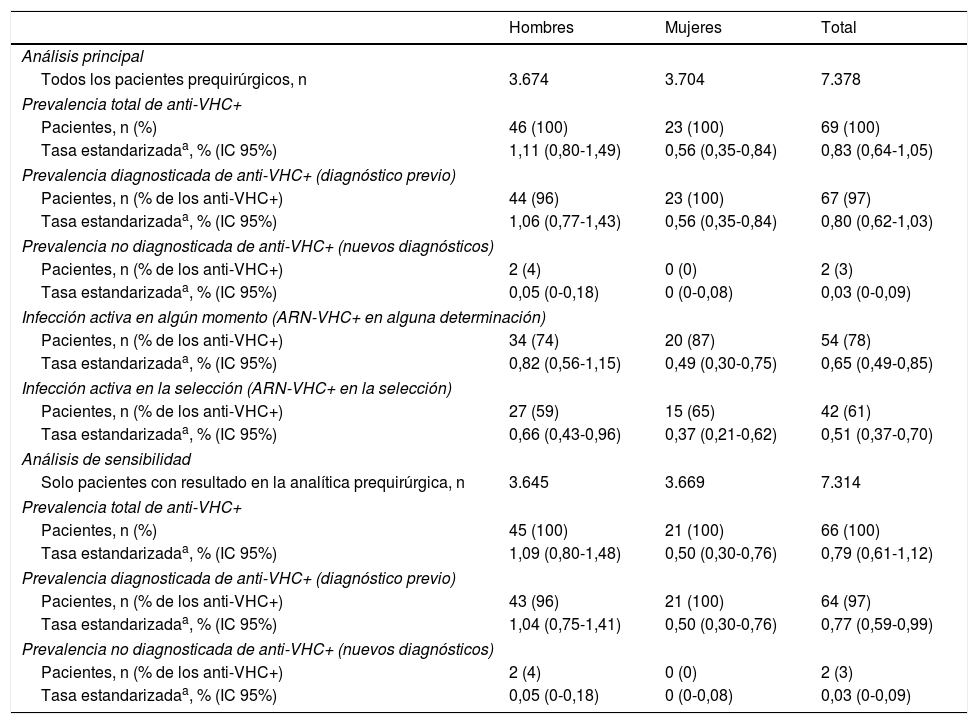
Estimaciones de la prevalencia de infección por el VHC en la poblaciónCon el fin de estimar la prevalencia de anticuerpos del VHC en la población, las tasas obtenidas de los 7.378 pacientes incluidos en el estudio se estandarizaron por sexo y edad según la estructura de la población de Navarra. La tasa de prevalencia estimada para el conjunto de la población fue del 0,83% (IC 95% 0,64-1,05), y fue mayor en hombres que en mujeres: 1,11 y 0,56%, respectivamente (p=0,0102) (tabla 3).
Estimaciones de la prevalencia de anticuerpos y de ARN del virus de la hepatitis C para la población de Navarra a partir de la muestra de pacientes prequirúrgicos
| Hombres | Mujeres | Total | |
|---|---|---|---|
| Análisis principal | |||
| Todos los pacientes prequirúrgicos, n | 3.674 | 3.704 | 7.378 |
| Prevalencia total de anti-VHC+ | |||
| Pacientes, n (%) | 46 (100) | 23 (100) | 69 (100) |
| Tasa estandarizadaa, % (IC 95%) | 1,11 (0,80-1,49) | 0,56 (0,35-0,84) | 0,83 (0,64-1,05) |
| Prevalencia diagnosticada de anti-VHC+ (diagnóstico previo) | |||
| Pacientes, n (% de los anti-VHC+) | 44 (96) | 23 (100) | 67 (97) |
| Tasa estandarizadaa, % (IC 95%) | 1,06 (0,77-1,43) | 0,56 (0,35-0,84) | 0,80 (0,62-1,03) |
| Prevalencia no diagnosticada de anti-VHC+ (nuevos diagnósticos) | |||
| Pacientes, n (% de los anti-VHC+) | 2 (4) | 0 (0) | 2 (3) |
| Tasa estandarizadaa, % (IC 95%) | 0,05 (0-0,18) | 0 (0-0,08) | 0,03 (0-0,09) |
| Infección activa en algún momento (ARN-VHC+ en alguna determinación) | |||
| Pacientes, n (% de los anti-VHC+) | 34 (74) | 20 (87) | 54 (78) |
| Tasa estandarizadaa, % (IC 95%) | 0,82 (0,56-1,15) | 0,49 (0,30-0,75) | 0,65 (0,49-0,85) |
| Infección activa en la selección (ARN-VHC+ en la selección) | |||
| Pacientes, n (% de los anti-VHC+) | 27 (59) | 15 (65) | 42 (61) |
| Tasa estandarizadaa, % (IC 95%) | 0,66 (0,43-0,96) | 0,37 (0,21-0,62) | 0,51 (0,37-0,70) |
| Análisis de sensibilidad | |||
| Solo pacientes con resultado en la analítica prequirúrgica, n | 3.645 | 3.669 | 7.314 |
| Prevalencia total de anti-VHC+ | |||
| Pacientes, n (%) | 45 (100) | 21 (100) | 66 (100) |
| Tasa estandarizadaa, % (IC 95%) | 1,09 (0,80-1,48) | 0,50 (0,30-0,76) | 0,79 (0,61-1,12) |
| Prevalencia diagnosticada de anti-VHC+ (diagnóstico previo) | |||
| Pacientes, n (% de los anti-VHC+) | 43 (96) | 21 (100) | 64 (97) |
| Tasa estandarizadaa, % (IC 95%) | 1,04 (0,75-1,41) | 0,50 (0,30-0,76) | 0,77 (0,59-0,99) |
| Prevalencia no diagnosticada de anti-VHC+ (nuevos diagnósticos) | |||
| Pacientes, n (% de los anti-VHC+) | 2 (4) | 0 (0) | 2 (3) |
| Tasa estandarizadaa, % (IC 95%) | 0,05 (0-0,18) | 0 (0-0,08) | 0,03 (0-0,09) |
Anti-VHC: anticuerpos frente al virus de la hepatitis C; ARN-VHC+: detección positiva de ARN del virus de la hepatitis C, indicativa de infección activa; IC 95%: intervalo de confianza al 95%.
Los 67 pacientes que tenían alguna prueba positiva previa permitieron obtener una estimación de prevalencia poblacional de infección conocida del 0,80%, mayor en hombres (1,06%) que en mujeres (0,56%; p=0,0188). Los 2 pacientes que tuvieron un resultado positivo al VHC por primera vez suponen una prevalencia poblacional de infección no diagnosticada en la población del 0,03%, sin diferencias entre sexos (tabla 3). Considerando solo la población mayor de 15 años, la prevalencia se elevó a 0,97% (IC 95% 0,76-1,22).
El análisis de sensibilidad incluyendo solo los pacientes con resultado válido en la analítica prequirúrgica proporcionó estimaciones de la prevalencia ligeramente inferiores (tabla 3).
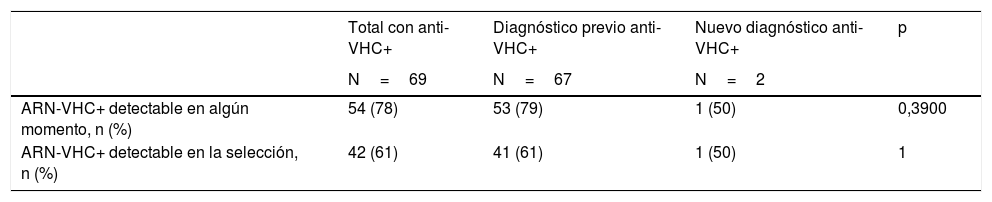
Estimación de la prevalencia de infección activaDe los 69 pacientes con anti-VHC positivos, 54 (78%) habían tenido alguna determinación de ARN-VHC detectable, lo que supone una prevalencia de infección activa (en alguna determinación actual o previa) en la población de 0,65% (IC 95% 0,49-0,85). Esta tasa fue del 0,82% en hombres y del 0,49% en mujeres (p=0,0774). En el momento de la analítica prequirúrgica solo 42 pacientes mantenían ARN-VHC detectable, lo que supone el 61% de los que tenían anti-VHC positivos y una prevalencia de infección activa poblacional en el momento del estudio del 0,51% (IC 95% 0,37-0,70) (tabla 3). Los 12 pacientes restantes habían negativizado el ARN-VHC en el momento del estudio prequirúrgico, tras haber seguido previamente algún tratamiento antiviral.
Entre los pacientes que habían tenido un diagnóstico de anti-VHC previo estos porcentajes fueron del 79 y el 61%, respectivamente. Por otra parte, solo uno de los 2 pacientes diagnosticados con anti-VHC por primera vez con motivo del estudio prequirúrgico presentó niveles detectables de ARN-VHC (tabla 4).
Resultados de la determinación de ARN del virus de la hepatitis C entre los pacientes con detección de anticuerpos positiva actual o previa
| Total con anti-VHC+ | Diagnóstico previo anti-VHC+ | Nuevo diagnóstico anti-VHC+ | p | |
|---|---|---|---|---|
| N=69 | N=67 | N=2 | ||
| ARN-VHC+ detectable en algún momento, n (%) | 54 (78) | 53 (79) | 1 (50) | 0,3900 |
| ARN-VHC+ detectable en la selección, n (%) | 42 (61) | 41 (61) | 1 (50) | 1 |
Anti-VHC: anticuerpos frente al virus de la hepatitis C; ARN-VHC+: detección positiva de ARN del virus de la hepatitis C, indicativa de infección activa.
Los resultados estiman una prevalencia de anti-VHC del 0,83% en la población de Navarra en el periodo 2014-2016. El 97% de las personas con anti-VHC positivos tenían un diagnóstico previo conocido, y solo el 3% tuvo un resultado anti-VHC positivo por primera vez, lo que indica una proporción muy baja de infecciones no diagnosticadas en la población. Esta prevalencia es notablemente menor que la última estimación oficial publicada para población adulta española (1,7%)3,12. La proporción de infecciones por VHC no diagnosticadas que estimamos es también muy inferior al 60% que se había propuesto para España13. La validez de las estimaciones que obtenemos queda reforzada por la buena representatividad de la muestra por sexo, edad y país de origen con respecto a la población diana, y por coincidir la estimación de prevalencia de infecciones diagnosticadas (0,80%) con la calculada a partir del registro de Microbiología del Servicio Navarro de Salud a enero de 2015 (datos no publicados). Según esta misma fuente, en los últimos años se realizan en Navarra un promedio de 3,5 serologías de VHC por cada 100 habitantes, lo que podría explicar la baja proporción de infecciones no diagnosticadas.
La discrepancia entre nuestro estudio y otras fuentes puede tener algunas explicaciones que pasamos a detallar. Hasta la fecha, se estimaba una prevalencia de anti-VHC en España entre el 1,6 y el 2,6%1, con base en estudios mayormente realizados antes del año 2000, por lo que podían estar muy desactualizados, y muchos de ellos se basaron en un único EIA sin prueba de confirmación, lo que podría dar lugar a algún resultado falso positivo en poblaciones con prevalencia no muy alta.
Domínguez et al. publicaron resultados de una encuesta poblacional en Cataluña realizada en 1996, según la cual, más de la mitad de las infecciones se concentraban en personas nacidas antes de 19417, lo que hace suponer que parte de ellas habrán fallecido. La mayor parte de las infecciones por el VHC en España ocurrieron en la década de 1980 y principios de 1990, ya que desde entonces se fueron extendiendo medidas para controlar la transmisión3. Con el progresivo envejecimiento de las cohortes de personas con infección por el VHC, la prevalencia habrá descendido al superar los fallecimientos a las nuevas infecciones14.
La encuesta seroepidemiológica realizada en la Comunidad de Madrid en 2008-2009 encontró una seroprevalencia de anti-VHC en la población de 16-80 años del 1,8%8. Las diferencias epidemiológicas entre regiones, los distintos periodos de estudio y el que esta encuesta se hubiese basado en un EIA sin prueba de confirmación pueden explicar la diferencia con respecto a la prevalencia del 0,97% que encontramos en Navarra para mayores de 15 años. Otra encuesta seroepidemiológica realizada en el País Vasco en 2009 en población de 2 a 59 años, esta vez incluyendo solo resultados de anti-VHC confirmados, encontró una prevalencia del 0,7%15, similar a la que encontramos en Navarra en ese rango de edad. En trabajadores sanos de Madrid y Murcia analizados entre 2007 y 2010 se encontró una seroprevalencia de anti-VHC del 0,6%, que aunque es algo menor que nuestra estimación, la diferencia es explicable por el sesgo del trabajador sano16.
En España apenas se había estudiado anteriormente la proporción de infecciones por el VHC sin diagnosticar, y en ausencia de datos, se asumió que podrían ser tantas como las diagnosticadas4. En contraste con ello, la encuesta del País Vasco encontró que de 4 casos positivos, en 3 constaba el antecedente de infección por el VHC, lo que rebaja la proporción de infecciones no diagnosticadas al 25%15. Nuestros resultados van más lejos, y muestran que solo una pequeña proporción del total de infecciones queda actualmente sin diagnosticar, lo cual es coherente, puesto que la mayoría de las personas infectadas llevan más de 25 años de evolución.
Coincidiendo con estudios previos encontramos una mayor prevalencia de anti-VHC en hombres que en mujeres1,8, y en el grupo de 45 a 54 años (cohortes de nacimiento de 1960 a 1969)14, mientras que la prevalencia se redujo considerablemente en las cohortes de nacimiento más jóvenes8. Estos patrones epidemiológicos se explican por los mecanismos de transmisión del VHC que han predominado en España. Por estudios del VIH sabemos que la transmisión en usuarios de drogas inyectadas afectó más a los hombres y a las cohortes nacidas entre 1950 y 197017. La transmisión por mecanismos iatrogénicos, que incluye transfusiones, hemoderivados y la utilización de materiales no desechables o inadecuadamente esterilizados, se fue controlando desde finales de la década de 1980, y su patrón de afectación tendrá poca diferencia entre sexos y una tendencia creciente con la edad. A diferencia de otros países, no encontramos argumentos que hagan sospechar de la reactivación de estos mecanismos de transmisión en los últimos años, ni de la existencia de grandes bolsas de personas infectadas no diagnosticadas18–20.
El interés asistencial y epidemiológico de la infección por VHC se centra en las personas con infección activa, que son las potenciales transmisoras y candidatas al tratamiento antiviral. El 78% de las personas con anti-VHC positivos habían presentado en algún momento carga viral detectable, aunque en la determinación prequirúrgica esta proporción descendió al 61%, mayormente tras tratamiento antiviral.
La similitud de las estimaciones para los mismos grupos de edad que obtenemos en Navarra con las de la encuesta del País Vasco apoya el que estas estimaciones podrían ser orientativas también para otras comunidades autónomas. No obstante, la información epidemiológica de la infección por VIH, con mecanismos de comunes de transmisión, muestra una amplia variabilidad entre comunidades autónomas, entre las cuales, Navarra ocupa lugares intermedios con tasas próximas a la media estatal21.
El presente estudio presenta algunas limitaciones. La población estudiada puede no ser representativa de la población general con respecto al VHC. Aunque la población diana fue la cubierta por el Servicio Navarro de Salud, puede haber un sesgo por el posible uso de la sanidad privada. El cribado serológico se aplicó de forma rutinaria, independientemente de los antecedentes de riesgo y de los resultados de pruebas previas. La población seleccionada incluyó un 1,19% de la población total con una distribución similar por sexos y país de origen, y un amplio rango de edades. La población rural estuvo menos representada en la muestra y tuvo una prevalencia menor que la urbana, lo que podría sesgar las estimaciones ligeramente al alza. La menor representación de niños y de personas muy mayores se controló en el análisis mediante la estandarizaron por edad. Los tipos de cirugía seleccionados no hacen sospechar desviaciones importantes en la prevalencia de anti-VHC, y la inclusión de 5 servicios habrá atenuado posibles sesgos inherentes a un único servicio, si bien, no se observaron diferencias en la prevalencia entre servicios. Las encuestas de seroprevalencia poblacionales suelen incluir personas a las que se les ha solicitado una analítica de sangre, lo cual no es muy diferente del criterio que utilizamos en el presente estudio. Otras poblaciones, como donantes de sangre o embarazadas, hubieran tenido desviaciones mucho más importantes respecto a la población general, los primeros por el cuestionario previo que excluye a personas con riesgo conocido, y las segundas porque solo representan a mujeres jóvenes, que es un grupo con una prevalencia de VHC especialmente baja.
La selección se prolongó 2 años y 9 meses, en los cuales se han introducido los nuevos tratamientos antivirales, lo que puede haber influido en la prevalencia de infecciones activas en el momento de la selección, pero no en la prevalencia de infecciones activas en determinaciones previas ni de anti-VHC positivos. En 64 pacientes no se pudo disponer de una muestra de suero válida prequirúrgica, y su prevalencia de positividad conocida fue más alta que la del resto. Tampoco podemos descartar que algún otro de los no analizados tuviese infección no diagnosticada por VHC. Para controlar posibles sesgos se incluyeron estos pacientes en el análisis principal, y también realizamos análisis de sensibilidad excluyéndolos, comprobando que se modificaban poco las estimaciones.
Los nuevos antivirales de acción directa es previsible que reduzcan de forma rápida la prevalencia de ARN-VHC, al conseguir una remisión virológica sostenida en la gran mayoría de los tratados22. En el momento de la selección, 12 pacientes de nuestro estudio ya habían negativizado valores previos positivos de ARN-VHC tras seguir un tratamiento antiviral, lo que muestra que los resultados de estudios de prevalencia van a estar cada vez más influidos por el impacto de los tratamientos.
Estos resultados muestran una prevalencia de infección por VHC menor que la estimada en estudios previos, y hace recomendable revisar a la baja las estimaciones previas de prevalencia de infección por el VHC en nuestro medio. El bajo porcentaje de infecciones no diagnosticadas no parece justificar la necesidad de aumentar el ritmo actual de cribado de la infección por VHC en poblaciones sin síntomas, sin elevación de transaminasas, ni exposiciones de riesgo conocidas; pero, por el contrario, no debería omitirse la determinación de anti-VHC cuando concurra alguna de estas circunstancias. Solo una proporción decreciente de las personas infectadas mantiene infección activa, que son las potencialmente transmisoras y candidatas a tratamiento antiviral. El envejecimiento de la población infectada y la rápida extensión de los nuevos tratamientos antivirales está cambiando la situación epidemiológica de la infección por el VHC en España.
FinanciaciónEste estudio forma parte del proyecto EIPT-VIH, financiado por el Ministerio de Sanidad, Servicios Sociales e Igualdad a través del Plan Estratégico Nacional de la Hepatitis C.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.