Introducción
Pseudomonas aeruginosa es uno de los principales agentes asociados a infección nosocomial y en muchos casos presenta importantes resistencias a los antibióticos, por lo que las fluoroquinolonas son uno de los grupos de fármacos de elección en el tratamiento de las infecciones por este microorganismo, sobre todo cuando se realizan tratamientos por vía oral 1.
Recientemente se ha definido la concentración preventiva de mutantes (CPM) como un parámetro útil para caracterizar las subpoblaciones más resistentes a los antibióticos y pretendemos utilizar este nuevo parámetro para comparar la actividad de varias fluoroquinolonas frente a aislados clínicos de P. aeruginosa productoras de infecciones nosocomiales en nuestro medio 2.
Métodos
Cepas y pacientes
Se estudiaron 34 cepas genéticamente distintas de P. aeruginosa sensibles a ciprofloxacino mediante los criterios establecidos por el Clinical and Laboratory Standards Institute (CLSI) 3 aisladas de 33 pacientes con infección nosocomial en el Hospital General Universitario de Elche. La selección de las cepas se realizó tras un seguimiento de todas las infecciones causadas por P. aeruginosa procedentes tanto de áreas médicas y quirúrgicas como de unidades de cuidados intensivos (UCI) y reanimación desde noviembre de 2002 hasta mayo de 2003. De cada paciente se cumplimentó una ficha con datos epidemiológicos y clínicos de interés, especificándose los tratamientos recibidos durante el ingreso hospitalario.
De las cepas estudiadas, 18 provenían de pacientes que no habían recibido previamente tratamiento con fluoroquinolonas, mientras que 16 provenían de pacientes con tratamientos previos con estos compuestos.
Antibióticos
Ciprofloxacino (Bayer), levofloxacino (Hoechst), gatifloxacino (Bristol-Myers Squibb), moxifloxacino (Bayer) y ofloxacino (Sigma).
Determinación de la concentración inhibitoria mínima (CIM)
Se realizó mediante los criterios establecidos por el CLSI a los 5 antibióticos estudiados.
Ajuste del inóculo a 10 10 UFC
Tras cultivar la cepa en agar sangre durante 24 h a 37 °C, se inocularon cuatro asas de 1 μl (Soria Melguizo, España) con colonias en un tubo con 5 ml de Mueller-Hinton y se agitó en un vórtex. Estos tubos se mantuvieron en agitación en un Rotatest Shaker (Luckham, Gran Bretaña) a 15 rpm durante 24 h a 37 °C. Después, se centrifugaron los cultivos a 3.000 rpm durante 10 min y se retiró el sobrenadante. Todo el sedimiento se resuspendió con buffer salino fosfato (PBS) hasta un volumen final de 1 μl y se realizó una cuantificación de este inóculo mediante diluciones seriadas y cultivo en agar sangre. El análisis de 5 cepas por triplicado mostró que todas ellas tenían un inóculo del orden de 10 13 UFC/ml, por lo que la inoculación con un replicador de Steer (deposita en placa entre 1 y 2 μl) hace que el inóculo final sea del orden de 10 10 UFC.
Determinación de la concentración preventiva de mutantes 2,4
Tras ajustar el inóculo a 10 10 UFC, se utilizó el replicador de Steer para sembrar placas de agar Mueller-Hinton con concentraciones comprendidas entre 30 y 0,1 mg/l (30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9,5, 9, 8,5, 8, 7,5, 7, 6,5, 6, 5,5, 5, 4,5, 4, 3,8, 3,6, 3,4, 3,2, 3, 2,8, 2,6, 2,4, 2,2, 2, 1,8, 1,6, 1,4, 1,2, 1, 0,8, 0,6, 0,4, 0,2 y 0,1) de los antibióticos estudiados.
Cepa de referencia
En todos los estudios in vitro se ha incluido la cepa P. aeruginosa ATCC 27853.
Electroforesis en campo pulsante
Con objeto de confirmar que las cepas eran genéticamente distintas, hemos realizado el análisis mediante electroforesis en gel de campos pulsantes (PFGE) de todas las cepas estudiadas. Se ha realizado siguiendo el método descrito por Pfaller et al 5. La digestión del ADN se realizó con 15 U de SpeI. La electroforesis se realizó en geles de agarosa PFGE al 1% en tampón TBE 0,5x (CHEF-DR III de Bio-Rad) a 14 °C. El voltaje se mantuvo a 6 V/cm, ángulo 120° y los pulsos oscilaron de 5 a 15 s durante 10 h, seguidos de pulsos de 15-45 s durante otras 10 h más. Tras la electroforesis los geles fueron teñidos con bromuro de etidio (0,5 μg/ml), visualizados con transiluminador de luz ultravioleta y fotografiados. Se realizó análisis visual de los perfiles electroforéticos. La interpretación de los patrones de bandas obtenidos se realizó siguiendo los criterios establecidos por Tenover et al 6.
Parámetros farmacocinéticos
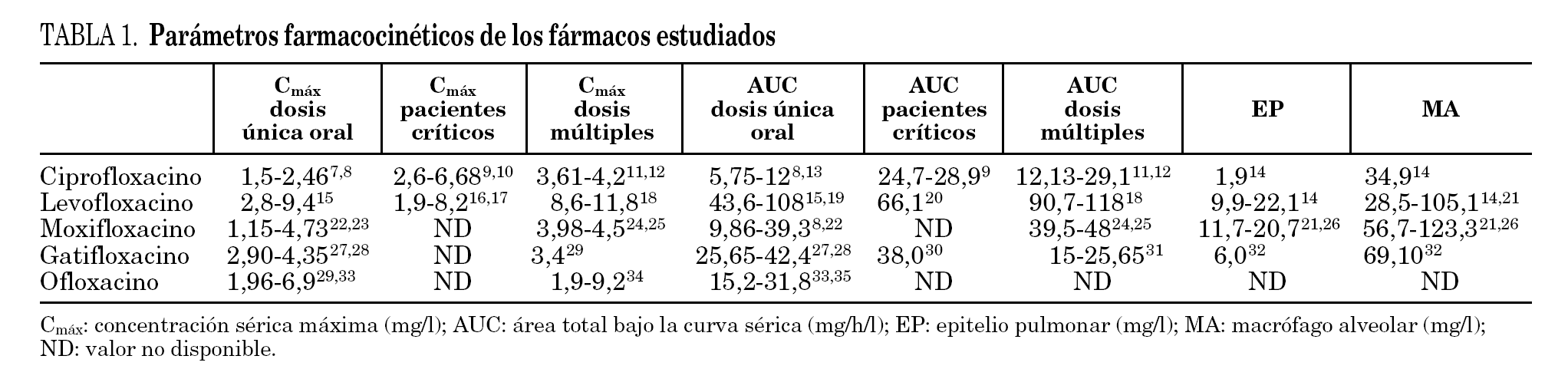
Los valores de los parámetros utilizados se detallan en la tabla 1 7-35.
Análisis estadístico
Se utilizó la prueba U de Mann-Whitney para comprobar si los valores de CPM de los 2 grupos de cepas pertenecían a una misma distribución o a distribuciones distintas.
Resultados
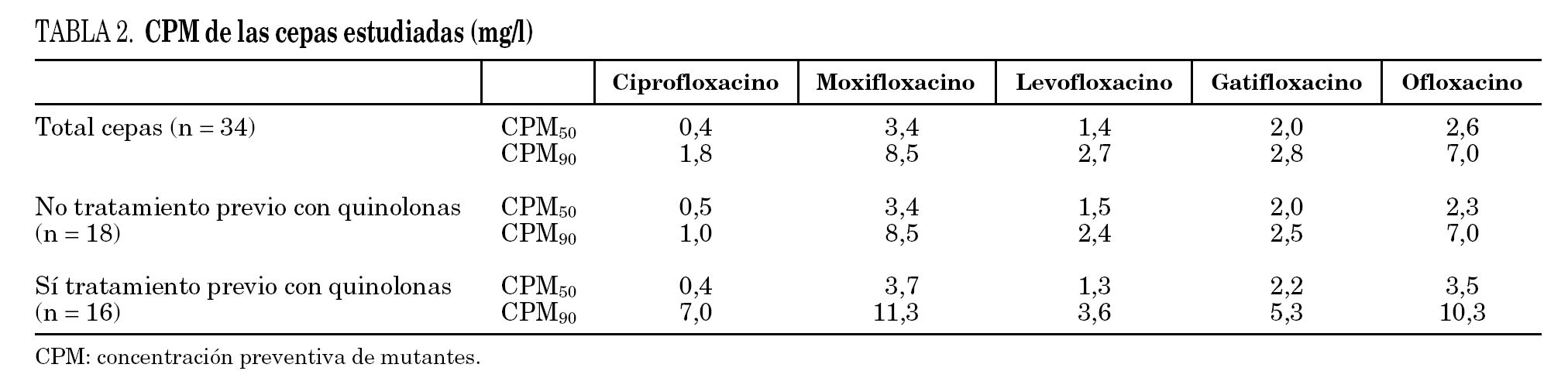
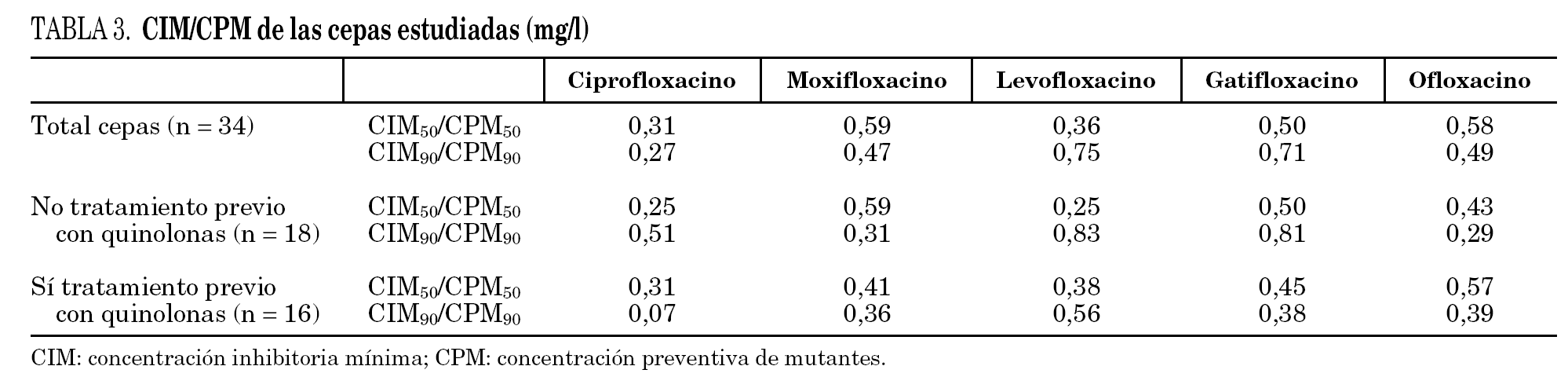
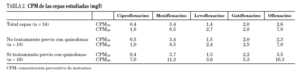
Los datos globales muestran que la fluoroquinolona que presenta menores valores de CPM es ciprofloxacino, seguida de levofloxacino; por el contrario, moxifloxacino es la que presenta valores más elevados. Al comparar los datos de pacientes previamente tratados respecto a los que no habían recibido fluoroquinolonas observamos que las cepas que provienen de los primeros presentan mayores valores de CPM a todos los compuestos estudiados, aunque estas diferencias no resultaron estadísticamente significativas (tabla 2). Si estudiamos el cociente CIM/CPM, aunque ciprofloxacino es la que presenta menores valores absolutos, se observa que su cociente es menor, reflejo de mayor separación entre ambos valores (CIM90/CPM90 de ciprofloxacino es 0,27, mientras que el cociente medio del resto de las fluoroquinolonas es 0,6). Al comparar las cepas de los enfermos tratados y no tratados, observamos que los primeros, generalmente, presentan cocientes menores, reflejo de una mayor diferencia entre los valores de CIM y CPM (la media de los cocientes CIM90/CPM90 de enfermos no tratados es 0,55, mientras que la media de los enfermos tratados es 0,35). Los datos se detallan en la tabla 3.
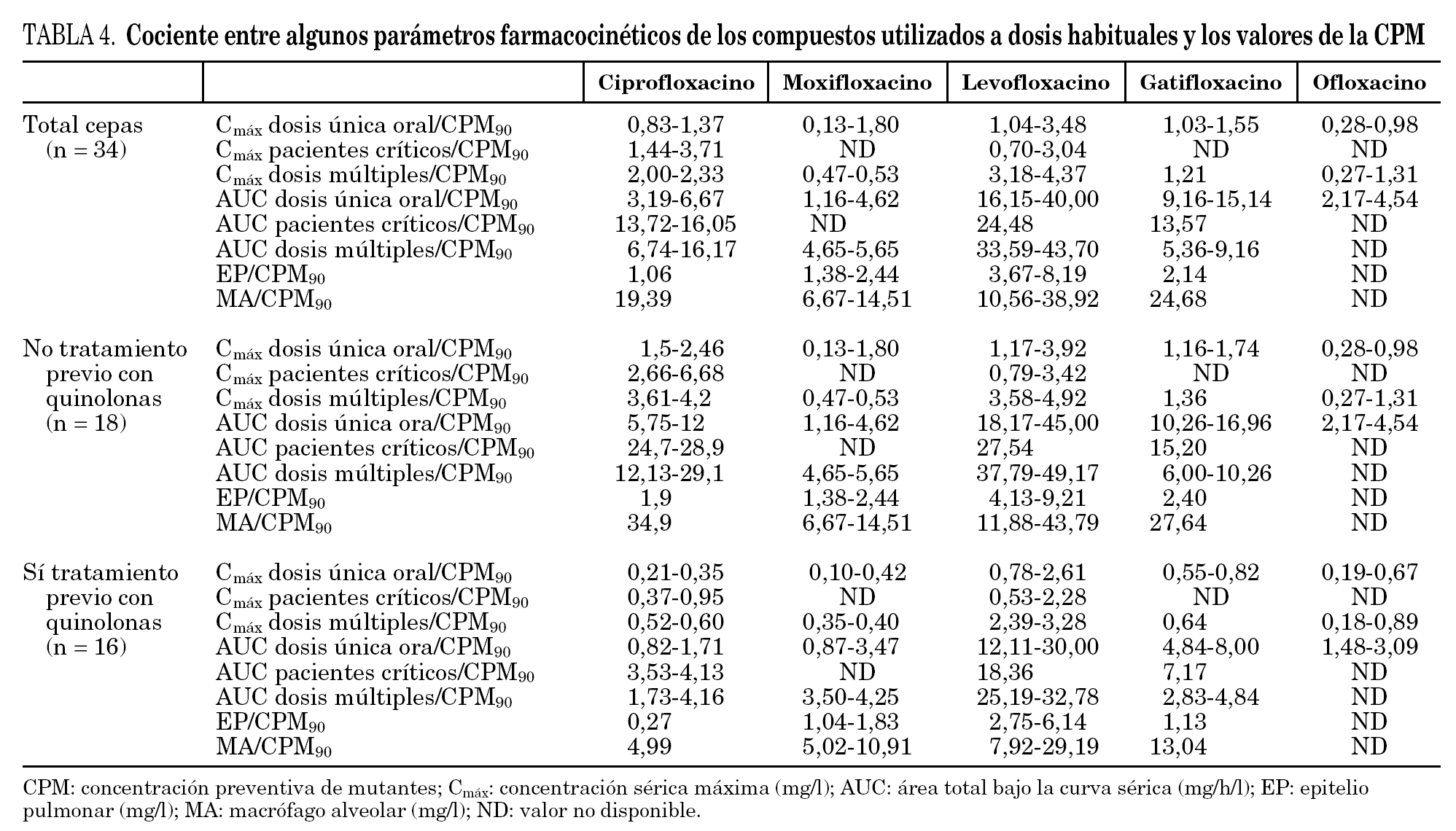
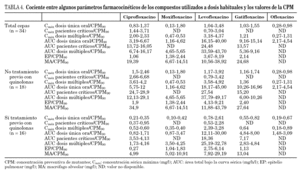
A la hora de relacionar nuestros datos con los parámetros farmacocinéticos de los distintos fármacos descritos en la literatura especializada hay que tener en cuenta que éstos están en función de varias variables como la dosis administrada, el tipo de enfermos y la vía de administración. En general, el análisis de los cocientes entre la CPM90 y los distintos parámetros farmacocinéticos muestra que levofloxacino, debido a la mayor concentración que alcanza a nivel sérico y pulmonar, presenta los valores más elevados (tabla 4).
Discusión
En el éxito del tratamiento antibiótico influyen muchos parámetros característicos del paciente, del microorganismo y del antibiótico. La relación entre la concentración que el antibiótico pueda alcanzar en el lugar de la infección y la sensibilidad in vitro del microorganismo puede ser uno de los parámetros más importantes para predecir la eficacia clínica de un determinado tratamiento 36.
Sin embargo no existen criterios establecidos sobre los valores que predicen una adecuada respuesta clínica; así, Drusano et al 37 estudian enfermos con neumonía y sugieren que el cociente entre el área bajo la curva sérica (AUC) y la CIM debe ser mayor de 87, mientras que otros autores elevan este parámetro a 100 o incluso a 125 38. También se ha comunicado que la probabilidad de curación es alta cuando la Cmáx/CIM es al menos de 8 a 10 39,40.
Estos cocientes también se han utilizado para calcular la probabilidad de generación de mutantes resistentes, así aislamientos del tracto respiratorio expuestos a ciprofloxacino con AUC24/CIM ≤110 presentan más riesgo de generación de resistencia 41.
Sin embargo, hay que tener en cuenta que estos parámetros están calculados para valores de CIM, que detecta la sensibilidad antibiótica de la población bacteriana mayoritaria, no teniendo en cuenta la presencia de poblaciones minoritarias de microorganismos que presentan una frecuencia de mutación elevada; se ha descrito cepas de P. aeruginosa que presentan una frecuencia de mutación de hasta 1.000 veces superior a las cepas normales y que pueden no ser detectados por los métodos clásicos debido a que presentan modificación del fitness42.
La limitación de los métodos clásicos en la detección de estos microorganismos puede ayudar a explicar los fracasos terapéuticos que se producen en algunas ocasiones a pesar de que las cepas aparezcan como sensibles por métodos clásicos 43, la aparición de cepas resistentes tras tratamientos inadecuados 44, la asociación entre el uso de ciprofloxacino y la aparición de cepas resistentes en unidades de alto riesgo 45, la relación entre el uso de fluoroquinolonas y el porcentaje de resistencia a estos compuestos, tanto a nivel hospitalario 46 como en unidades de alto riesgo 47.
Con objeto de aportar datos a este problema, aplicamos una técnica microbiológica, la concentración preventiva de mutantes, que detecta estas subpoblaciones y relacionamos sus valores con varios marcadores farmacocinéticos que reflejan la concentración de los fármacos en el organismo; el estudio se realiza en cepas genéticamente diferentes mediante PFGE. Observamos que existen diferencias entre microorganismos de pacientes tratados o no previamente con fluoroquinolonas, a pesar de que los valores de la CIM sean sensibles aplicando los criterios del CLSI 3.
Además, el análisis comparativo de los fármacos estudiados mediante esta metodología muestra que ciprofloxacino y levofloxacino son los fármacos más activos.
Debido a que la incorrecta elección del tratamiento antibiótico y la tardanza en la elección del tratamiento adecuado se asocian con un mayor porcentaje de mortalidad 48, se deben realizar más estudios para clarificar la utilidad de la CPM a la hora de decidir la terapia de las infecciones graves por este patógeno. Nuestro estudio, realizado en cepas genéticamente distintas sugiere que existe riesgo al administrar fluoroquinolonas en el tratamiento de infecciones graves si el enfermo ha sido previamente tratado con estos compuestos, aunque la cepa siga siendo sensible in vitro mediante los métodos clásicos 49,50.
La presencia de subpoblaciones minoritarias con sensibilidad disminuida a estos compuestos puede deberse a que las fluoroquinolonas pueden seleccionar microorganismos que tengan sobreexpresión de los sistemas de bomba de flujo Mex-Opr. Estos mutantes se han descrito en un elevado porcentaje de aislamientos clínicos de P. aeruginosa (14-75%) y suelen estar con más frecuencia en las cepas sometidas a regímenes de tratamientos subóptimos 51.
Nuestros resultados podrían ayudar a explicar que uno de los factores de riesgo para la infección por P. aeruginosa multirresistente en pacientes de UCI sea el uso de ciprofloxacino 45 o que las neumonías causadas por P. aeruginosa resistentes a fluoroquinolonas se asocien frecuentemente a tratamientos previos con levofloxacino 52 y cuestiona la idoneidad de administrar tratamientos con estos compuestos en infecciones graves si el enfermo ha sido previamente tratado con ellos, aunque el microorganismo sea sensible a las fluoroquinolonas por los métodos clásicos.
Agradecimientos
Este trabajo ha sido financiado en parte por una «Ayuda SEIMC» concedida por dicha sociedad a la cual estamos agradecidos. También quisiéramos agradecer al Dr. Jordi Vila por su colaboración en el aprendizaje y puesta a punto de la técnica PFGE.
Correspondencia:
Dr. J.C. Rodríguez.
Servicio de Microbiología.
Hospital General Universitario de Elche.
Camí de L'Almassara, 11. 03203 Elche. Alicante. España.
Correo electrónico: micro_elx@gva.es
Manuscrito recibido el 22-8-2005; aceptado el 5-6-2006.