El posaconazol y la caspofungina representan nuevas opciones terapéuticas para el tratamiento de infecciones fúngicas. Este trabajo establece la actividad de posaconazol y caspofungina frente a levaduras causantes de infección fúngica diseminada, y, además, evalúa la utilidad del sistema E-test para la estimación de las concentraciones mínimas inhibitorias (CMI) con respecto a estos antifúngicos.
Para ello, se consideran 53 cepas de levaduras responsables de infección fúngica invasiva y se determinan los valores de CMI50 y CMI90 mediante el método de referencia CLSI-M27A2. En segundo lugar, se compara el sistema E-test con el método de referencia. Los resultados para las CMI50/90 (en μg/ml) son los siguientes: posaconazol: 0,25/1, y CAS: 0,06/4. La concordancia global es de 63,9% para el posaconazol y la de 80,2% para la caspofungina.
No se han detectado cepas con CMI altas frente a posaconazol y caspofungina. Aunque con limitaciones, el E-test es un sistema sencillo y lo suficientemente fiable para la obtención de CMI frente a posaconazol y caspofungina para levaduras.
Posaconazole (POS) and caspofungin (CAS) are new therapeutic options for treating fungal infection. This study establishes the activity of POS and CAS against yeast causing invasive fungal infections. In addition, the utility of the E-test system for estimating the minimum inhibitory concentrations (MICs) related to these antifungal drugs has been assessed.
The study includes 53 yeast isolates causing invasive fungal infection. MIC50 and MIC90 values were determined by the M27-A2 reference method. MIC values obtainedwith the reference method were then compared with those obtained with E-testing.
The results were MIC50/90 (μg/mL) POS: 0.25/1, CAS: 0.06/4. Overall agreement with E-test: POS: 63.9%, CAS: 80.2%. None of the yeast isolates studied showed high MIC values for POS and CAS. Although it has some limitations, the E-test is a simple and fairly reliable system for determining the MICs of POS and CAS for yeast.
Las infecciones fúngicas invasivas, tanto las adquiridas en la comunidad como las nosocomiales, son cada vez más frecuentes debido, por un lado, al aumento de pacientes inmunodeprimidos, prematuros, posquirúrgicos y con otros factores predisponentes para la adquisición de una micosis profunda1; por otro lado, la incorporación en el campo terapéutico de nuevos antifúngicos como el posaconazol y la caspofungina hace necesaria la realización de estudios concretos de sensibilidad, así como de evolución temporal de los patrones de sensibilidad en las cepas causantes de infecciones fúngicas2,3.
En el estudio de sensibilidad antifúngica para levaduras, el método estandarizado es difícilmente adaptable a la sistemática de los laboratorios de microbiología clínica debido a su complejidad. En este sentido, por su sencillez, el sistema E-test podría constituir una alternativa al método de referencia. Por otro lado, actualmente todavía no se han definido puntos de corte para la interpretación clínica de los valores de concentración mínima inhibitoria (CMI) con respecto al posaconazol y la caspofungina en levaduras, y sólo se dispone de valores arbitrarios propuestos por diversos autores4.
Este trabajo establece, en primer lugar, la actividad de estos nuevos fármacos frente a aislamientos de levaduras causantes de infecciones diseminadas (fungemias y meningitis fúngicas); en segundo lugar, se contrasta la validez del sistema E-test (AB-Biodisk, Solna, Suecia) como método alternativo para determinar la CMI del posaconazol y de la caspofungina en estos aislamientos.
Material y métodosSe incluyeron en el estudio 53 cepas de levaduras aisladas en muestras de sangre y líquido cefalorraquídeo correspondientes a todos los episodios de infección fúngica diseminada producida por levaduras acaecidos en los años 2002 y 2003 en el Complejo Hospitalario Universitario Juan Canalejo de A Coruña. La distribución de especies fue la siguiente: 21 Candida albicans, 12 Candida parapsilosis, 4 Candida tropicalis, 3 Candida glabrata, 3 Candida guilliermondii, 2 Candida krusei, 3 Rhodotorula spp., 3 Cryptococcus neoformans, 1 Candida dubliniensis y 1 Candida rugosa. Todas ellas se identificaron mediante métodos convencionales (Api 32C, bioMérieux, Francia). Para todas ellas se calcularon los valores de CMI para posaconazol y caspofungina mediante el método de referencia basado en microdilución (documento CLSI M27A2)5 con lectura final a las 48 h de la incubación.
En la segunda parte del estudio, además de las 53 cepas antes mencionadas, se añadieron 8 cepas más con CMI elevadas para otros azoles, con objeto de ampliar el rango de CMI, proporcionando así mayor validez al estudio de comparación de métodos. Las cepas añadidas (5 C. krusei, 2 C. albicans y 1 C. glabrata) presentaban CMI para fluconazol, que oscilaban entre más de 256 y 16 μg/ml. Se determinaron los valores de CMI mediante el sistema de difusión en placa E-test siguiendo las recomendaciones del fabricante (RPMI 1640 medium y lectura a las 24 h de la incubación).
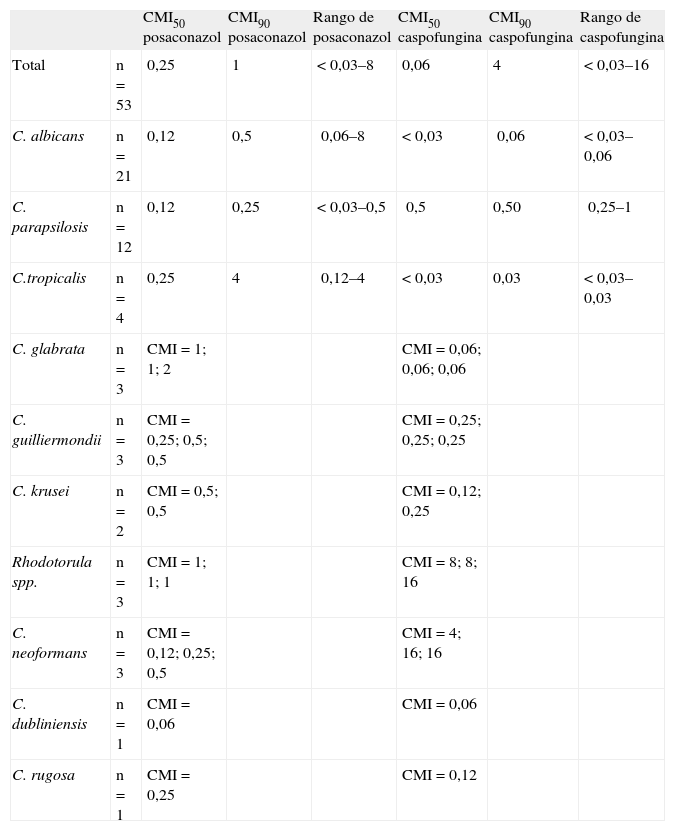
ResultadosLos valores de CMIso y CMI90, así como el rango de CMI del total de cepas productoras de infección fúngica invasiva, aparecen detalladas en la tabla 1. En cuanto a los aislamientos resistentes a fluconazol (n = 6), las CMI frente a posaconazol oscilaron entre 0,5 y 8 μg/ml. Se compararon por pares los valores de CMI obtenidos mediante el método de referencia para posaconazol y caspofungina con los obtenidos a través del método E-test, definiendo como CMI concordantes a las que no se diferencian en más de dos diluciones dobles. De esta manera, se calcularon los porcentajes de concordancia entre ambos métodos en cada caso.
Valores de CMI50, CMIW en μg/ml para posaconazol y caspofungina, y rangos obtenidos
| CMI50 posaconazol | CMI90 posaconazol | Rango de posaconazol | CMI50 caspofungina | CMI90 caspofungina | Rango de caspofungina | ||
| Total | n = 53 | 0,25 | 1 | < 0,03–8 | 0,06 | 4 | < 0,03–16 |
| C. albicans | n = 21 | 0,12 | 0,5 | 0,06–8 | < 0,03 | 0,06 | < 0,03–0,06 |
| C. parapsilosis | n = 12 | 0,12 | 0,25 | < 0,03–0,5 | 0,5 | 0,50 | 0,25–1 |
| C.tropicalis | n = 4 | 0,25 | 4 | 0,12–4 | < 0,03 | 0,03 | < 0,03–0,03 |
| C. glabrata | n = 3 | CMI = 1; 1; 2 | CMI = 0,06; 0,06; 0,06 | ||||
| C. guilliermondii | n = 3 | CMI = 0,25; 0,5; 0,5 | CMI = 0,25; 0,25; 0,25 | ||||
| C. krusei | n = 2 | CMI = 0,5; 0,5 | CMI = 0,12; 0,25 | ||||
| Rhodotorula spp. | n = 3 | CMI = 1; 1; 1 | CMI = 8; 8; 16 | ||||
| C. neoformans | n = 3 | CMI = 0,12; 0,25; 0,5 | CMI = 4; 16; 16 | ||||
| C. dubliniensis | n = 1 | CMI = 0,06 | CMI = 0,06 | ||||
| C. rugosa | n = 1 | CMI = 0,25 | CMI = 0,12 | ||||
Sólo se calcularon estos valores para especies con una representación en el estudio igual o mayor a 4. Para el resto de las especies se muestran los valores de CMI obtenidos.
En el caso de posaconazol, la concordancia global alcanzó el 63,9%. Entre las cepas no concordantes (n = 22) sólo cinco se diferenciaban en más de cuatro diluciones. Unicamente en estas cepas se produciría un error de interpretación clínica en caso de adoptar el punto de corte arbitrario para posaconazol de 1 μg/ml. Porcentajes similares de concordancia se obtuvieron considerando por separado C. albicans (60,8%; n = 23) y aislamientos de levaduras con algún grado de resistencia para fluconazol (64,2%; n = 14).
Con respecto a la caspofungina, el 80,2% de las cepas presentaron CMI concordantes entre ambos métodos. Ningún resultado discrepante (n = 12) sobrepasó las cuatro diluciones dobles de diferencia. El sistema E-test en todos los casos de discrepancia proporciona valores de CMI superiores al método de referencia.
Efectuado el estudio de correlación, previa conversión logarítmica de los valores de CMI, entre ambos métodos se obtuvieron los siguientes resultados: índice de correlación para posaconazol de 0,57 e índice de correlación para caspofungina de 0,77.
Los valores de CMI50 y CMI90 para posaconazol son lo suficientemente bajos como para establecer que en nuestro medio no existen cepas con sensibilidad disminuida a este fármaco, al menos en las productoras de fungemias y meningitis fúngica. Otros estudios recientes reproducen estos resultados6,7. No obstante, se observa una ligera elevación en las CMI para posaconazol entre las cepas no sensibles a fluconazol. Dicho aumento, aunque no es estadísticamente significativo, permite intuir la posibilidad de la aparición de resistencias cruzadas entre antifúngicos azólicos descrita anteriormente para el voriconazol8. Los valores de CMIso y CMI90para la caspofungina son altos debido a la presencia de cepas de levaduras con resistencia intrínseca a las equinocandinas como Rhodotorula spp. y C. neoformans, así como al hecho de que C. parapsilosis presenta sistemáticamente CMI más altas frente a este antifúngico. Si restringimos el estudio a las cepas pertenecientes al género Candida, a excepción de C. parapsilosis, no encontramos ningún aislamiento con CMI elevada para la caspofungina.
En cuanto a la evaluación del sistema E-test con respecto al posaconazol, cabe destacar que los casos de discrepancia más graves, es decir, los que originarían una incorrecta interpretación clínica en caso de establecer en 1 μg/ml el punto de corte, corresponden únicamente al 8% de las cepas.
Se trata de cepas de C. albicans, en las que el efecto de trailing (efecto de cola de crecimiento por encima de los valores de CMI) dificulta la determinación precisa del punto de corte en los paneles de microdilución. También se producen en levaduras de crecimiento lento en las que la lectura de las placas con tiras E-test tuvo que retrasarse has ta las 48 h de la incubación. Casi en la totalidad de las discrepancias el sistema E-test infravaloró los valores de CMI con respecto al método de referencia.
Para la caspofungina se obtuvieron menos resultados discrepantes, así como una ausencia de discrepancias con un número alto de diluciones de diferencia. Esta circunstancia disminuye la posibilidad de cometer un error grave en caso de existir un punto de corte de interpretación clínica de los valores de CMI. En todos los casos de discrepancia la CMI obtenida mediante E-test fue superior a la obtenida mediante microdilución, de modo que la utilización de E-test disminuiría el riesgo de no detección de cepas con CMI elevadas, aunque podría sobreestimar falsamente el número de aislamientos que pueden no responder al tratamiento antifúngico.
Los resultados de concordancia obtenidos se asemejan a los ya publicados anteriormente tanto para el posaconazol4,9 como para la caspofungina10.
La existencia de cepas en las que las diferencias de CMI son muy elevadas hace que la correlación entre métodos no sea buena.
Prolongando la lectura de E-test hasta las 48 h y comparando las CMI con las obtenidas mediante el método de referencia, los valores de concordancia resultantes fueron del 72,1% para el posaconazol y del 77,0% para el caspofungina. Estos datos sugieren que la lectura del E-test a las 48 h en lugar de a las 24 h de incubación, de forma sistemática, no aumenta la concordancia con el método de referencia, además de retrasar los resultados 24 h.
En conclusión, el E-test es un método válido, fácil de realizar y rápido para la determinación de CMI de levaduras frente a posaconazol y caspofungina. A pesar de que los porcentajes de concordancia no son muy elevados, presumiblemente sólo en una pequeña parte de las cepas estudiadas las discrepancias desencadenarían un error grave en la interpretación clínica del antifungigrama.
AgradecimientosExpresamos nuestro agradecimiento a Schering-Plough por el suministro de tiras E-test de posaconazol.