Se ha demostrado que la detección del ADN del virus del papiloma humano (VPH) es más útil que la citología en la prevención del cáncer cervical especialmente si se identifican los genotipos 16 y 18. Cobas 4800 es un sistema automatizado de PCR a tiempo real que detecta separadamente los genotipos 16 y 18, además de otros 12 genotipos de alto riesgo (AR-VPH)
ObjetivosEvaluar la detección de AR-VPH con cobas 4800, especialmente los genotipos 16 y 18 y comparar estos resultados con los obtenidos mediante captura de híbridos (HC2). También se evalúa la sensibilidad clínica del cobas 4800 para detectar lesiones >CIN2.
Materiales y métodosSe han estudiado 412 muestras cervicales con cobas 4800 y HC2 utilizándose como técnica de referencia una PCR convencional (LA). También se han recogido los resultados citológicos e histológicos de las pacientes
ResultadosEn 376/412 muestras los resultados fueron concordantes (kappa 0,85). En la mayoría de las muestras con resultado positivo por HC2 y negativo por cobas 4800 se detectaron genotipos de bajo riesgo con LA. La sensibilidad y especificidad para la detección de lesiones > CIN2 fueron 92,5 y 44% con cobas 4800 y 88 y 51% con HC2.
ConclusiónHay una gran concordancia entre los resultados obtenidos por ambas técnicas. Sin embargo, la CH2 es más inespecífica por tener reactividad cruzada con genotipos de bajo riesgo oncogénico, especialmente el 53. Cobas 4800 presenta la ventaja de identificar los genotipos 16 y 18, además de ser totalmente automatizada y no tener reactividad cruzada con otros genotipos
It has recently been confirmed that detection of DNA of human papilloma virus (HPV) is more useful than cytology in the screening for cervical cancer, especially if genotypes 16 and 18 are identified. Cobas 4800 is an automated system that detects 14 high risk HPV genotypes: genotypes 16 and 18 separately and 12 other high-risk genotypes pooled.
ObjectivesThe aim of this study is to compare the performance of the cobas 4800 HPV test against the hybrid capture 2 (HC2) and particularly in women in whom >CIN2 lesions are detected.
Patients and methodsAliquots from 412 cervical specimens have been studied with three different assays, real time PCR (cobas 4800), Linear Array HPV test, and HC2. Cytological and histological results were also available.
ResultsThere was good agreement between the cobas 4800 and HC2 results in 376 of the 412 women (kappa 0.85). Where there was not good agreement, low-risk HPV genotypes were detected by linear array in the majority of samples positive by HC2 and negative by the cobas 4800. Sensitivity and specificity for detecting >CIN2 lesions were 92.5 and 44%, respectively, by cobas 4800, and 88 and 51% by hybrid capture.
ConclusionsIn this evaluation the cobas 4800 HPV test was shown to have a similar performance to the HC2 test. However HC2 was less specific due to cross reactivity with low risk genotypes, mainly genotype 53. Cobas 4800 is very reliable in the detection of high-risk genotypes, with the advantage of simultaneously providing information regarding genotype16 and 18 infections.
El virus del papiloma humano (VPH) pertenece a la familia Papovaviridae. Incluye más de 100 genotipos de los que aproximadamente 40 infectan el área genital masculina y femenina. Por su capacidad oncogénica han sido clasificados como de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) (AR-HPV), de probable alto riesgo (pAR-HPV) (26, 53, 66, 68, 73, 82) y el resto de genotipos, como de bajo riesgo de producir cáncer cervical (BR-HPV)1. Está comprobado que la infección persistente por este virus es la causa del cáncer cervical en mujeres2 y del carcinoma escamoso anal en hombres3 además de producir otras lesiones benignas como las verrugas genitales. La infección por el VPH es la enfermedad de transmisión sexual más frecuente en todo el mundo. Sin embargo, a pesar de que muchas mujeres en edad sexualmente activa se infectan por este virus, solo un 10-12% de ellas desarrollaran una infección persistente con un riesgo elevado de progresión a neoplasia intraepitelial cervical de grado 3 (CIN3) o cáncer4. Para el cribado de cáncer cervical, se ha utilizado tradicionalmente la citología o prueba de Papanicolaou. Aunque la citología cervical ha contribuido enormemente a la reducción de la morbimortalidad del cáncer cervical, su sensibilidad para detectar lesiones precursoras de cáncer es muy baja, aproximadamente del 55,4%. En comparación, la prueba de detección del ADN de los genotipos AR-VPH en muestras cervicales tiene una sensibilidad de hasta el 96,6% para detectar lesiones precancerosas aunque es menos específica que la citología5. La Sociedad Española de Ginecología y Obstetricia propone esta prueba para el cribado en mujeres mayores de 30 años y en cohortes vacunadas6. Sin embargo, el verdadero valor de la prueba de detección del ADN de los AR-VPH es su altísimo valor predictivo negativo cercano al 100% que permite espaciar los cribados con la seguridad de no desarrollar CIN3 en, por lo menos, 3 años y algunos autores aseguran que hasta 5 años7,8. También hay que considerar que no todos los tipos de VPH son igual de oncogénicos. Los genotipos 16 y 18 se encuentran en el 70% de lesiones CIN39 y en el 75% de los casos de cáncer cervical10. Está comprobado que el riesgo de desarrollar CIN3 en las mujeres infectadas por estos genotipos es bastante mayor que en las infectadas por otros genotipos distintos. Recientemente se ha propuesto un seguimiento distinto de las pacientes mayores de 30 años infectadas con estos genotipos aunque la citología sea normal o células atípicas de significado incierto (ASCUS)6,11. Por lo tanto, es muy importante que las pruebas de detección del ADN de AR-VPH detecten separadamente los genotipos 16 y 18 para hacer un seguimiento exhaustivo a estas pacientes.
El sistema cobas 4800 (Roche Diagnostics, Mannheim, Germany) está compuesto por el automático cobas X, el termociclador cobas Z y el software necesario para la realización de una PCR a tiempo real con primers de la región L1 del VPH. Los resultados aparecen en pantalla diferenciados en cuatro canales: genotipo 16, genotipo 18, otros AR-VPH (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 66) y beta-globina que se usa como control interno en cada muestra.
ObjetivosEvaluar la detección de AR-VPH en muestras cervicales con el sistema totalmente automatizado cobas 4800, especialmente los genotipos 16 y 18 y comparar estos resultados con los obtenidos mediante captura de híbridos (HC2). El segundo objetivo es valorar la sensibilidad clínica del cobas 4800 para detectar lesiones > CIN2 puesto que estas pacientes constituyen el objetivo de las campañas de prevención.
Pacientes y métodosSe han estudiado 430 muestras cervicales pertenecientes a 430 pacientes inmunocompetentes atendidas en la consulta de Ginecología del Hospital Ramón y Cajal para un cribado oportunista de cáncer cervical. La edad media de las pacientes fue de 45 años (rango 16-78 años). Ninguna de ellas había sido vacunada para prevenir la infección por el VPH. Las muestras se recogieron en viales de citología líquida (Preservcyt, Cytyc Corporation, Boxborough, MA) y se almacenaron dos meses a 4°C hasta su estudio con las dos técnicas, cobas 4800 y HC2 (HPV Hybrid Capture Test, Digene, Gaithersburg, USA). El cobas 4800 es un sistema totalmente automatizado de PCR a tiempo real que detecta por separado los genotipos de AR-VPH 16 y 18 además de otros 10 genotipos de alto riesgo (31, 33, 35, 39, 45, 51, 52, 56, 58, 59) y dos de «probable alto riesgo» (66 y 68).
En las muestras con resultados discordantes, se ha utilizado como técnica de referencia una PCR convencional semiautomatizada con extracción automatizada12 (Linear Array, Roche Diagnostics, Mannheim, Germany). También se han estudiado los resultados citológicos e histológicos de las pacientes con tinción de Papanicolaou. Se ha utilizado la misma muestra para citología y para la realización de las tres técnicas mencionadas anteriormente.
Para el estudio estadístico se ha utilizado el paquete informático SPSS 12.0 y para medir la concordancia entre los resultados se ha calculado el índice kappa.
ResultadosDieciocho muestras fueron inválidas mediante el sistema cobas 4800, probablemente debido a escaso volumen, presencia de coágulos o fallo de detección del control interno de beta-globina. Por lo tanto, el estudio se ha realizado con 412 muestras. Los resultados cito/histológicos de las 412 pacientes estudiadas fueron las siguientes: 197 normal, 28 ASCUS, 133 CIN1, 17 CIN2 y 37 CIN3.
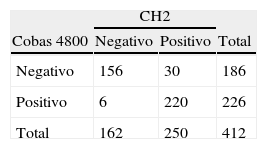
En 376/412 (91%) se obtuvieron resultados concordantes mediante las dos técnicas, cobas 4800 y HC2 (tabla 1). El índice kappa fue de 0,85. Entre las 36 muestras con discordancia en los resultados (tabla 2), 30 fueron negativas por cobas 4800 y positivas por CH2. Al analizarlas con LA, se detectaron 25 genotipos de BR-VPH, uno de AR-VPH y 4 fueron negativas. En las 6 restantes con resultados HC2 negativos y cobas 4800 positivos, se detectaron genotipos BR-VPH en dos de ellas, genotipos AR-VPH en una y 3 fueron negativas. Todos los genotipos 16 y 18 presentes en las muestras fueron identificados correctamente por cobas 4800. El genotipo 16 se detectó en 84 muestras, (30 con resultados histológicos > CIN2 y 54 con < CIN2) y el genotipo 18 estaba presente en 6 muestras (una con resultado histológico > CIN2 y 5 con < CIN2).
Grado de acuerdo entre las técnicas cobas 4800 y HC2*
| CH2 | |||
| Cobas 4800 | Negativo | Positivo | Total |
| Negativo | 156 | 30 | 186 |
| Positivo | 6 | 220 | 226 |
| Total | 162 | 250 | 412 |
Resultados del Linear Array para muestras con resultados discordantes
| Negativo | BR-VPH | AR-VPH | Total | |
| Cobas 4800 negativo, HC2 positivo | 4 | 25; 12 genotipos 53, 4 genotipos 70 y otros 14 genotipos diferentes | 1; genotipo 58 | 30 |
| Cobas 4800 positivo, HC2 negativo | 3 | 2; genotipos 6 y 62 | 1; genotipo 45 | 6 |
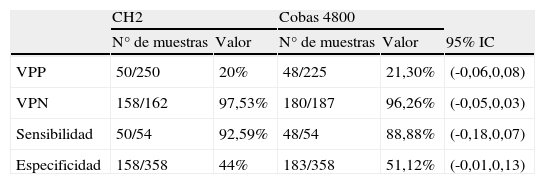
Para la evaluación clínica se han estudiado 54 pacientes con resultados histológicos > CIN2. Se encontraron resultados concordantes en 52/54 muestras (48/54 resultaron positivas y 4/54 resultaron negativas por las dos técnicas). Los genotipos presentes en las 2 muestras con resultados discordantes fueron el 84 y 58. Los valores predictivos positivos (VPP) y valores predictivos negativos (VPN) son 20,0 y 97,5% para la CH2 y 21,3 y 96,2% para el cobas 4800. La sensibilidad fue del 92,5 y del 88% y la especificidad del 44 y 51% respectivamente para la CH2 y cobas 4800 (tabla 3).
Sensibilidad, especificidad y valores predictivos de cobas 4800 y CH2
| CH2 | Cobas 4800 | ||||
| N° de muestras | Valor | N° de muestras | Valor | 95% IC | |
| VPP | 50/250 | 20% | 48/225 | 21,30% | (-0,06,0,08) |
| VPN | 158/162 | 97,53% | 180/187 | 96,26% | (-0,05,0,03) |
| Sensibilidad | 50/54 | 92,59% | 48/54 | 88,88% | (-0,18,0,07) |
| Especificidad | 158/358 | 44% | 183/358 | 51,12% | (-0,01,0,13) |
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Castle et al13 han encontrado una buena correlación entre el sistema comercializado recientemente, cobas 4800 y LA, técnica de PCR utilizada frecuentemente para la detección de AR-VPH en muestras cervicales. Hasta el momento no hay estudios publicados que comparen la detección de AR-VPH con cobas 4800 y HC2. Los datos de nuestro estudio muestran que hay una gran concordancia entre los resultados obtenidos por ambas técnicas (kappa 0,85). Las muestras que presentaban resultados discordantes fueron repetidas con ambas técnicas y los resultados no variaron por lo que se descarta error en la realización de alguno de los pasos críticos de las pruebas utilizadas en el estudio. Algunos de los resultados discordantes se deben a resultados falsos positivos con la CH2 que se ha mostrado más inespecífica por tener reactividad cruzada con algunos genotipos de «bajo riesgo» o de «probable alto riesgo» (tabla 2). Otros autores14 también han confirmado la baja especificidad de la CH2 porque puede reaccionar con genotipos no incluidos en la prueba e incluso con otros ácidos nucleicos distintos al ADN del VPH. Estos genotipos se encuentran muy frecuentemente en las lesiones histológicas < CIN2 pero están ausentes en las lesiones precursoras de cáncer y no es conveniente detectarlos en el cribado de cáncer cervical. En nuestro estudio, el genotipo 53 fue el más prevalente en las muestras con resultados discordantes (cobas 4800 negativas, CH2 positivas) y se encontró siempre en mujeres con resultados histológicos < CIN2. Por otra parte, debido a que no se realizó comprobación con un gel de agarosa, no se puede descartar que algún resultado discordante (3 muestras, tabla 2) sea un «falso positivo» del cobas 4800.
En cuanto a la evaluación clínica, los VPP, VPN, sensibilidad y especificidad son similares con las dos pruebas utilizadas, cobas 4800 y CH2. Es importante tener en cuenta que la identificación y tratamiento de las pacientes con lesiones cervicales > CIN2 es el objetivo principal de las campañas de cribado para la prevención del cáncer cervical. Numerosos artículos confirman que la detección de los genotipos AR-VPH en muestras cervicales es una prueba más sensible que la citología, aunque menos específica, para la detección de las lesiones precancerosas (> CIN2). Esta prueba se utiliza por ahora como complemento a la citología en el cribado primario en mujeres mayores de 30 años, en mujeres posmenopáusicas con resultados citológicos de CIN1, y como prueba de selección en mujeres con citología de ASCUS11,15. Sin embargo, la Agencia Internacional para Estudio del Cáncer ha propuesto que se utilice la detección de genotipos AR-VPH como prueba inicial en el cribado primario de cáncer cervical16. Cuando se utilizan ambas pruebas, la citología y la detección de AR-VPH, hay un importante número de mujeres con resultados citológicos negativos y detección de ADN de AR-VPH positivo. Está comprobado desde hace varios años que el grupo de mujeres infectadas con los genotipos 16 y 18 tiene un riesgo muy importante de presentar lesiones > CIN2, 20% y 17% respectivamente frente al 1-2% si están infectadas con otros AR-VPH17. Recientemente se ha confirmado la sospecha de que los cánceres cervicales invasivos ocasionados por los genotipos 16 y 18 se presentan en mujeres más jóvenes que los producidos por otros genotipos18. Por esto es imprescindible utilizar una prueba de detección de ADN de AR-VPH que identifique separadamente los genotipos 16 y18 con el objetivo de hacer un seguimiento colposcópico a las pacientes infectadas por los genotipos 16 y 18 a diferencia de las que presentan infección por otros genotipos AR-VPH, cualesquiera que sean, que según un reciente protocolo de la Sociedad Española de Ginecología y Obstetricia6, deben ser controladas al año. El sistema cobas 4800 presenta principalmente la ventaja de identificar separadamente estos genotipos, además de otras como la facilidad del flujo de trabajo del laboratorio, la total automatización de la prueba, la posibilidad de utilizar viales primarios de citología líquida, inclusión de un número elevado de muestras y la ausencia de reactividad cruzada con genotipos no carcinogénicos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.