La detección precoz del cáncer de cérvix requiere la implementación de programas de cribado del virus del papiloma humano (VPH). Sin embargo, existen discrepancias en la optimización de esas estrategias. Se evalúa el rendimiento de 10 protocolos basados en técnicas moleculares, citológicas o combinadas en cribado primario.
Material y métodosSe diseña un estudio ciego, prospectivo e intervencionista en 1.977 mujeres de 35 años. La determinación molecular se realizó por la plataforma Cobas 4800HPV. Los análisis citológicos se realizaron en las mismas muestras sin conocimiento del resultado molecular. Todas las mujeres en las que se detectaba VPH-16/VPH-18 o presentaban alteración citológica y detección de otros genotipos de alto riesgo (VPHar) eran derivadas a colposcopia.
ResultadosEl ensayo molecular detectó presencia de VPHar en el 12,5% de las mujeres, mientras solo el 8,1% de las citologías fueron patológicas. El 19,5% de las pacientes derivadas a colposcopia revelaron lesiones de alto grado, estando VPH-16 presente en el 65,3% de ellas. En 6 de esas ocasiones (VPH-16 siempre presente) la citología había sido informada como normal. El seguimiento al año de las mujeres con citología normal y detección de VPHar identificó una lesión HSIL/CIN2+(asociada a VPH-33). En el estudio comparativo con otras estrategias el protocolo denominado CRYGEN 16/18 rindió el mejor equilibrio de sensibilidad y especificidad con la menor derivación a colposcopia.
ConclusionesLa realización de detección molecular de VPH con genotipado parcial en primera línea, al menos VPH-16, con derivación directa a colposcopia, aumenta la tasa de detección de lesiones HSIL/CIN2+.
The early detection of cervical cancer requires the implementation of molecular screening programs for human papillomavirus (HPV). However, there are discrepancies in the optimization of screening protocols. The performance of 10 primary screening strategies based on molecular, cytological or combined techniques is now evaluated.
Material and methodsA blind, prospective, and interventional study was designed in 1977 35-year-old women. The molecular determination was carried out by the Cobas 4800 HPV platform. Cytological analysis was performed on the same samples without knowledge of the result of the molecular assay. All women in whom HPV-16/HPV-18 was detected or presented cytological alteration together with detection of other high-risk genotypes (HPVhr) were referred to colposcopy.
ResultsThe molecular assay detected the presence of HPVhr genotypes in 12.5% of the women, while only 8.1% of the cytologies were pathological. Among the patients referred to colposcopy, in 19.5% high-grade lesions were observed, being HPV-16 present in 65.3% of them. In six of these high-grade lesions (associated with HPV-16 in all cases), cytology was reported as normal. The follow-up one year later, of women with normal cytology and HPVhr detection a HSIL/CIN2+ lesion was detected (associated to HPV-33). In the comparative study with other strategies, the protocol called CRYGEN 16/18 yielded the best balance of sensitivity and specificity with the least referral to colposcopy.
ConclusionsPerforming molecular detection of HPVhr with partial first-line genotyping of at least HPV-16, with direct referral to colposcopy, increases the detection rate of HSIL/CIN2+ lesions.
Desde hace varios años la Organización Mundial de la Salud (OMS) viene recomendando la implementación de programas de detección para varios tipos de cánceres, como el cáncer de mama, el colorrectal y el cervical. En 2013 la OMS identificó el cáncer de cuello uterino como una intervención prioritaria en su Global Action Plan for the Prevention and Control1. El cáncer de cérvix (CC) está causado por la infección persistente de los denominados genotipos de alto riesgo del virus del papiloma humano (VPHar). Cuatro grandes estudios de cohortes aleatorizados indican que el cribado basado en la prueba molecular para la detección del VPH proporciona un 60-70% más de protección contra el CC que el cribado citológico, permitiendo además ampliar los intervalos de cribado con seguridad2. Por esta razón las directrices estadounidenses, australianas y europeas3 recomiendan la implementación de la detección molecular del VPH para el cribado de CC uterino4. En 2019 el Ministerio de Sanidad español modificó la cartera de servicios relacionados con el cribado de CC incorporando la detección molecular como estrategia en primera línea (https://www.boe.es/boe/dias/2019/04/27/pdfs/BOE-A-2019-6277.pdf).
Aunque las pruebas de VPH generalmente detectan un conjunto de 14 genotipos de VPHar, se reconoce que solo 2 de estos genotipos, los genotipos VPH-16 y VPH-18 son responsables del 70% de los CC uterinos5. Las pruebas de VPHar6 con detección separada de VPH-16 y VPH-18 resultarían ser una estrategia más sensible y eficiente para la detección del CC uterino que los métodos basados únicamente en la citología2. El presente estudio, multicéntrico, prospectivo, ciego y de intervención pretende evidenciar las ventajas de un nuevo protocolo para el cribado del CC en España basado en la detección molecular del VPH con genotipado para VPH-16/18 en primera línea en sustitución de la citología y comparar su rendimiento frente a otras estrategias de cribado.
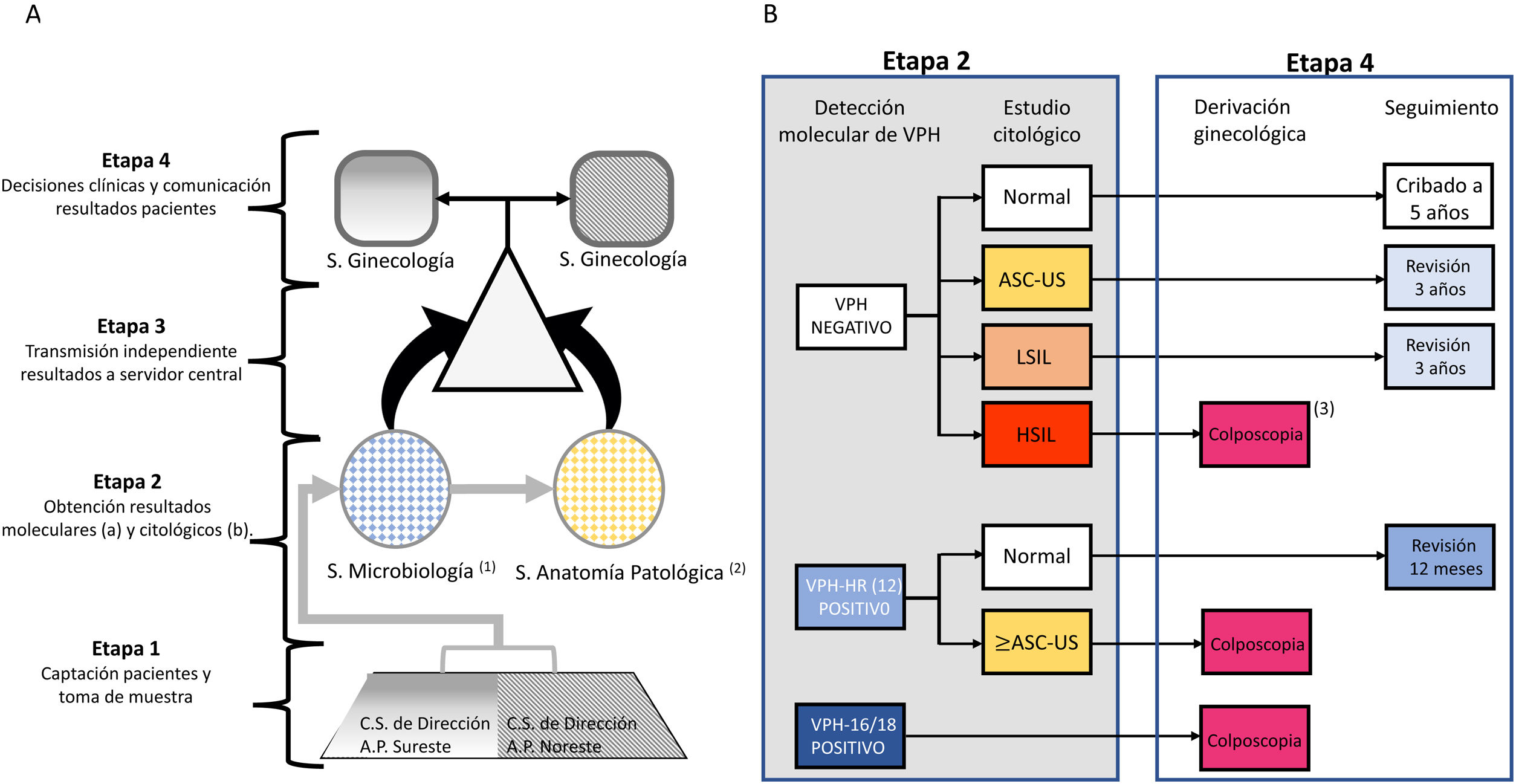
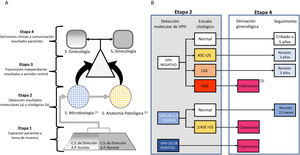
Material y métodosFlujo de trabajo y población de estudioDe acuerdo al censo extraído de la base de datos oficial CIBELES, de la Comunidad de Madrid, la población diana de mujeres de 35 años residentes en 2 áreas sanitarias de la Comunidad de Madrid en el periodo de estudio era de 11.864 mujeres. La selección de este grupo etario estaba condicionada por ser el primer grupo de edad al que se recomendaba el cribado primario mediante detección molecular de VPH en la mayoría de las guías internacionales. A todas las mujeres se las invitó a participar mediante una carta acompañada de un folleto informativo sobre la infección por VPH, siendo posteriormente contactadas telefónicamente para su citación. A aquellas que decidieron participar, previa firma de un consentimiento informado, se les efectuó una toma única para detección molecular del VPH y estudio citológico correspondiente, recolectada por matronas utilizando un cepillo cervical de Rovers Medical Devices BV. La muestra se colocó en medio fijador líquido Thinprep (Hologic, Bedford, MA) para su conservación, transporte y análisis. Las muestras encriptadas se enviaron al Servicio de Microbiología del Hospital Ramón y Cajal. Finalizado el estudio para la detección molecular del virus, las muestras fueron derivadas al servicio de Anatomía Patológica del Hospital Clínico de Madrid. Ambos laboratorios enviaron independientemente los resultados a un servidor central sin posibilidad de conocer los resultados obtenidos por cada laboratorio. Los servicios de ginecología del Hospital Clínico y el Hospital Infanta Leonor comunicaban a las participantes los resultados y las decisiones clínicas de actuación inmediata o seguimiento programado de los casos positivos. El flujo de trabajo se presenta en la figura 1A. El estudio se realizó entre junio de 2017 y septiembre de 2018. El protocolo de referencia en este estudio, CRYGEN 16/18, es una estrategia de cribado basada en la detección molecular con genotipado parcial de VPH en primera línea. El protocolo propone remitir a colposcopia a todas las mujeres con: 1) VPH-16 y/o VPH-18 positivo independientemente del resultado citológico; 2) VPHar negativo con citología HSIL; 3) VPHar no 16/18 positivo con citología≥atypical squamous cells of undetermined significance (ASCUS). Si en estas últimas la citología era normal se les indica un control al año (fig. 1B).
A) Flujograma de trabajo propuesto. B) Algoritmo del protocolo de referencia en este estudio, CRYGEN 16/18 para el cribado primario de VPH en cáncer de cérvix.
a El análisis molecular se realizó en el Servicio de Microbiología del Hospital Ramón y Cajal.
b El estudio citológico se realizó en el Servicio de Anatomía Patológica del Hospital Clínico San Carlos.
c El análisis de las biopsias de las pacientes derivadas a colposcopia se realizó en los servicios de anatomía patológica del Hospital Clínico San Carlos y del Hospital Infanta Leonor.
El protocolo fue aprobado por los comités de ética de los hospitales Clínico San Carlos y Ramón y Cajal.
Detección molecular de virus del papiloma humano y estudio citológico de las muestras biológicas. Descripción de otras estrategiasLa presencia de ADN viral se evaluó mediante la prueba Roche Cobas 4800 HPV test® (Roche Molecular Diagnostics), siguiendo las recomendaciones del fabricante. Este es un método molecular cualitativo para la detección de 14 genotipos de VPHar, permitiendo diferenciar específicamente los genotipos VPH-16 y VPH-18 del resto de otros 12 genotipos VPHar (VPH-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 y -68) que son detectados, pero no diferenciados. Realizado el estudio molecular las muestras se almacenaron a 4°C hasta su uso para estudio citológico en el medio Thinprep®. La lectura fue realizada utilizando la nomenclatura de Bethesda 20017. La presencia de≥ASCUS se consideró patológica. En una fase posterior, las biopsias, realizadas a las pacientes derivadas a colposcopia, se estudiaron en los servicios de anatomía patológica de los hospitales Clínico San Carlos e Infanta Leonor. Tras la fijación con formalina e inclusión en parafina se cortaron secciones de 4μm y tiñeron con hematoxilina y eosina para su estudio utilizando la terminología CIN de Richart y la terminología LAST8 (fig. 1). Finalmente, para el seguimiento de las mujeres con detección de alguno de los 12 genotipos de alto riesgo de VPH (no-16/ no-18), con citología normal, se las invitó a repetir la prueba molecular a los 12 meses, siguiendo el mismo esquema de la primera cita. De la misma manera mujeres con prueba de VPH negativa y ASCUS fueron remitidas a seguimiento a los 3 años. En aquellas mujeres que presentaran VPHar (no VPH-16, no VPH-18) después de un año y lesiones de alto grado se identificaría el genotipo usando el sistema de Linear CLART HPV (Genomica, SAU, Madrid, España).
El diseño de este protocolo permite realizar a posteriori un análisis comparativo de la eficacia y optimización de recursos de la estrategia CRYGEN 16/18 respecto a otras 9 estrategias basadas en citología (2 algoritmos), co-test (3 algoritmos) o diagnóstico molecular (4 algoritmos) en el cribado de primera línea (ver una descripción detallada más adelante). Estrategia A. Citología como cribado primario: 1) derivación a colposcopia de toda citología patológica (≥ASC-US); 2) derivación a colposcopia de citología patológica≥LSIL o bien ASC-US+detección molecular refleja de VPHar positiva. Estrategia B. Agrupa las estrategias basadas en co-test: 3) derivación a colposcopia de cualquier citología patológica (≥ASC-US) o detección molecular de VPHar positiva; 4) derivación a colposcopia de cualquier citología patológica (≥ASC-US) y detección molecular de VPHar positiva; 5) derivación a colposcopia de cualquier citología patológica (≥LSIL) o detección molecular de VPH positiva para genotipos de alto riesgo VPH-16/VPH-18 o ASC-US+detección molecular refleja de VPH positiva. Estrategia C. Estrategias basadas en la detección molecular como cribado primario: 6) derivación a colposcopia ante cualquier detección molecular de VPH; 7) derivación a colposcopia ante cualquier detección molecular de VPH con citología patológica refleja (≥ASC-US); 8) derivación a colposcopia ante la detección molecular solo de los genotipos VPH-16/VPH-18: y 9) derivación a colposcopia ante la detección molecular solo de los genotipos VPH-16/VPH-18 o detección molecular de otros genotipos de alto riesgo con citología patológica refleja (>LSIL).
Las variables analizadas en el estudio comparativo fueron, además de los valores de sensibilidad, especificidad, valor predictivo positivo y negativo, el número de pacientes derivadas a colposcopias, número de lesiones de alto grado (HSIL) detectadas, o el número de citologías o detecciones moleculares evitadas de cada algoritmo analizado.
Análisis estadísticoDado el carácter categórico de las variables, su descripción se realiza mediante el recuento de las frecuencias y su conversión en porcentajes en función del n válido de cada variable. Para el cruce entre 2 variables categóricas se utilizó la prueba de independencia Chi cuadrado. La prueba citada se utiliza junto con la «V» de Cramer como medida de la asociación entre las variables, cuyo valor al cuadrado es equivalente al tamaño del efecto expresado en la escala clásica R2. Asimismo, la regresión logística binaria se ha utilizado como método de mejor ajuste para estimar las OR. Para todos los análisis se ha utilizado el programa SPSS versión 21.
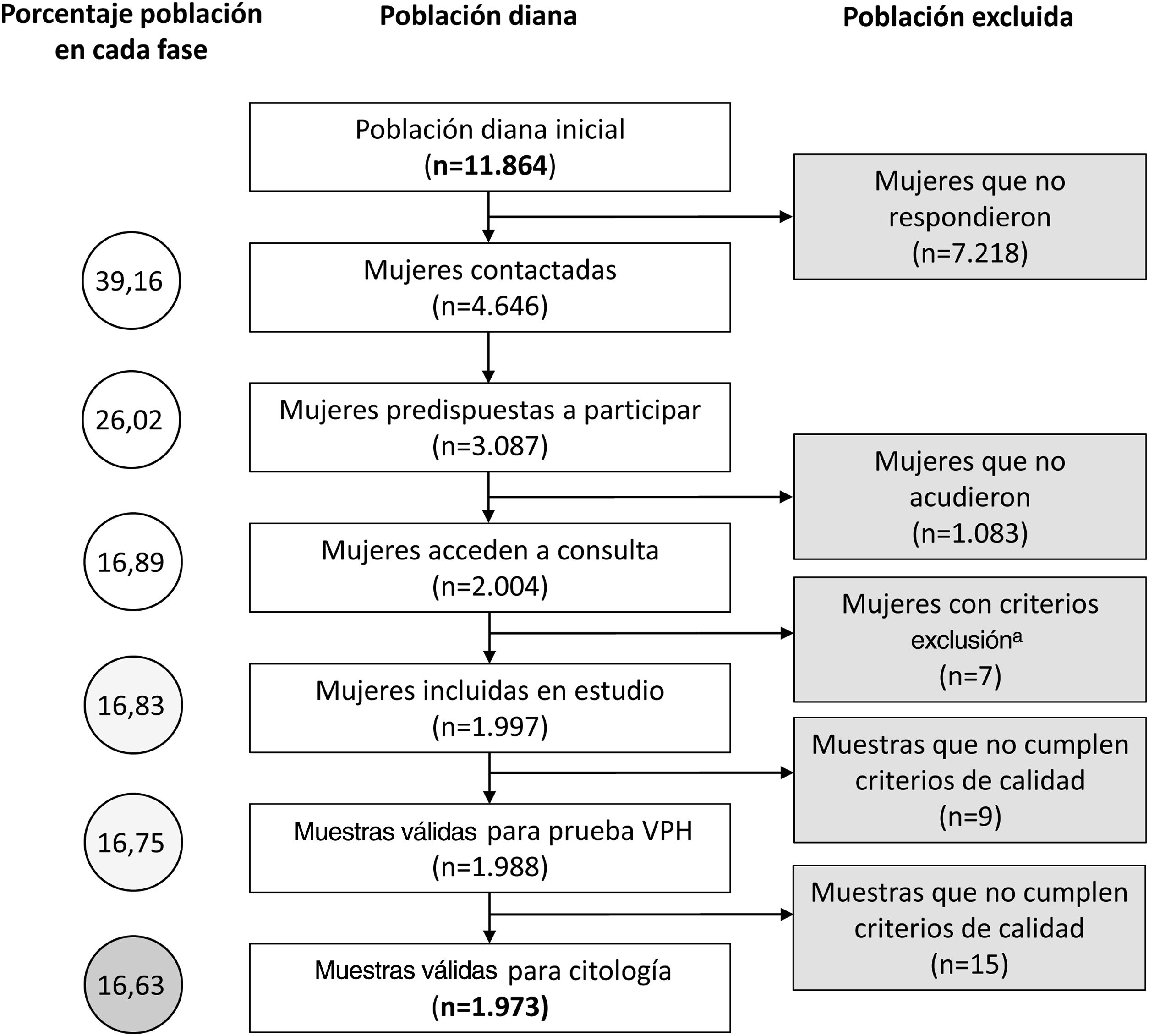
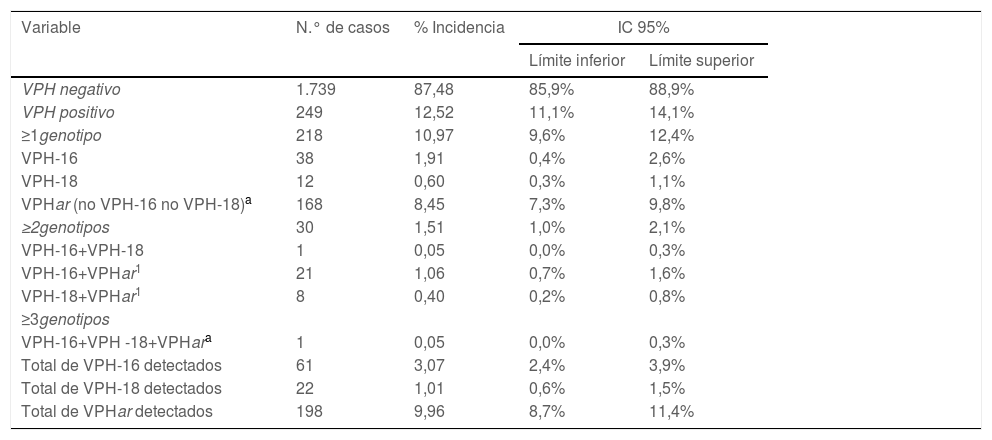
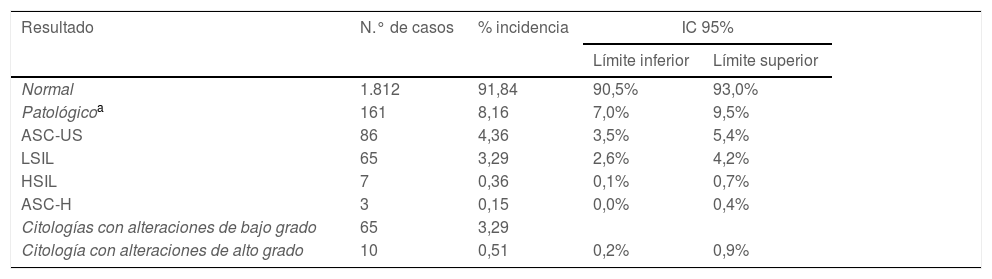
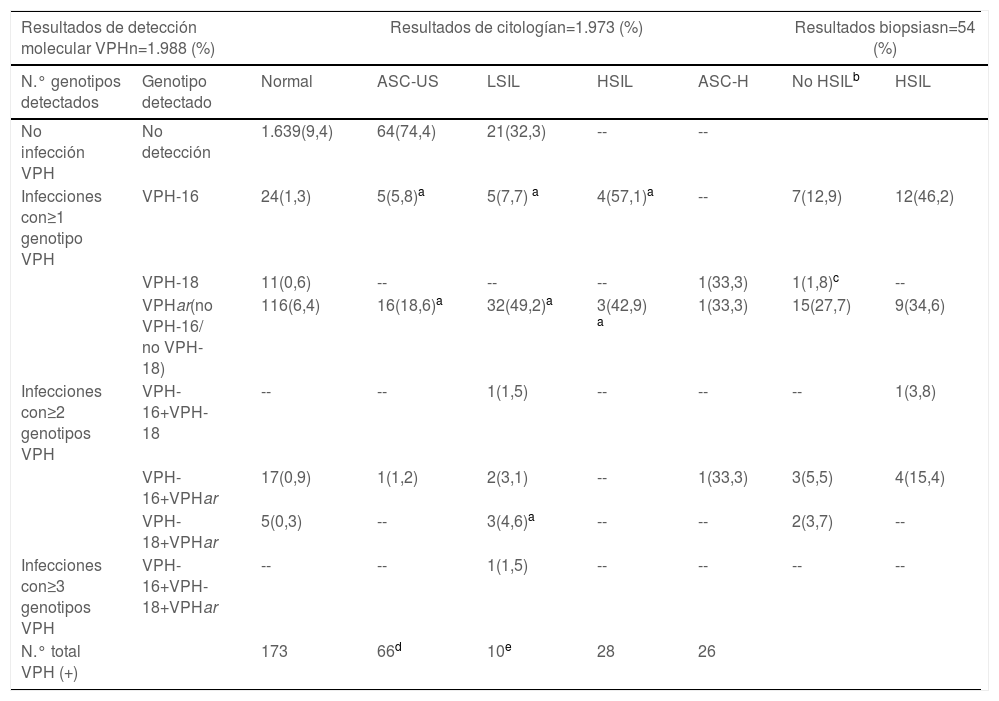
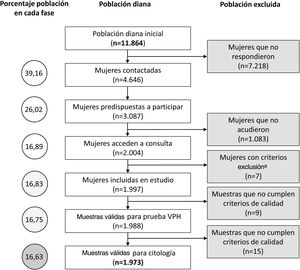
ResultadosDetección molecular de virus del papiloma humano y estudio citológico. Correlación entre ambas aproximacionesEl tamaño poblacional inicial eran 11.864 mujeres, pero solamente el estudio pudo completarse en el 16,6%. En la figura 2 se describen las diferentes etapas del proceso en las que se fue perdiendo población. De las 1.988 muestras válidas en 249 (12,5%) se detectó señal de amplificación positiva para algún genotipo VPHar (IC 11,1-14,1%). Se detectó el genotipo VPH-16 en 61 muestras (3,1%), siendo en 38 de los casos el único genotipo detectado (1,9%). VPH-18 se identificó en 22 muestras (1,1%), siendo agente único en 12 ocasiones (0,60%). La distribución de los casos en que se detectó VPHar, así como si eran mono o coinfecciones, se muestran en la tabla 1. De las 1.973 muestras finalmente incluidas en estudio citológico 161 (8,1%, IC: 7-9,5%) se notificaron como anormales. Se informaron de HSIL en 7 casos (0,36%) y ASC-H en 3 (0,15%). La distribución de resultados de la lectura citológica se expone en la tabla 2.
Detección molecular de los genotipos de VPH de alto riesgo detectados (n=1.988)
| Variable | N.° de casos | % Incidencia | IC 95% | |
|---|---|---|---|---|
| Límite inferior | Límite superior | |||
| VPH negativo | 1.739 | 87,48 | 85,9% | 88,9% |
| VPH positivo | 249 | 12,52 | 11,1% | 14,1% |
| ≥1genotipo | 218 | 10,97 | 9,6% | 12,4% |
| VPH-16 | 38 | 1,91 | 0,4% | 2,6% |
| VPH-18 | 12 | 0,60 | 0,3% | 1,1% |
| VPHar (no VPH-16 no VPH-18)a | 168 | 8,45 | 7,3% | 9,8% |
| ≥2genotipos | 30 | 1,51 | 1,0% | 2,1% |
| VPH-16+VPH-18 | 1 | 0,05 | 0,0% | 0,3% |
| VPH-16+VPHar1 | 21 | 1,06 | 0,7% | 1,6% |
| VPH-18+VPHar1 | 8 | 0,40 | 0,2% | 0,8% |
| ≥3genotipos | ||||
| VPH-16+VPH -18+VPHara | 1 | 0,05 | 0,0% | 0,3% |
| Total de VPH-16 detectados | 61 | 3,07 | 2,4% | 3,9% |
| Total de VPH-18 detectados | 22 | 1,01 | 0,6% | 1,5% |
| Total de VPHar detectados | 198 | 9,96 | 8,7% | 11,4% |
IC: intervalo de confianza; VPH: virus del papiloma humano.
Evaluación citológica de las muestras incluidas en el estudio (n=1.973)
| Resultado | N.° de casos | % incidencia | IC 95% | |
|---|---|---|---|---|
| Límite inferior | Límite superior | |||
| Normal | 1.812 | 91,84 | 90,5% | 93,0% |
| Patológicoa | 161 | 8,16 | 7,0% | 9,5% |
| ASC-US | 86 | 4,36 | 3,5% | 5,4% |
| LSIL | 65 | 3,29 | 2,6% | 4,2% |
| HSIL | 7 | 0,36 | 0,1% | 0,7% |
| ASC-H | 3 | 0,15 | 0,0% | 0,4% |
| Citologías con alteraciones de bajo grado | 65 | 3,29 | ||
| Citología con alteraciones de alto grado | 10 | 0,51 | 0,2% | 0,9% |
ASC-H: células escamosas que no descarta alto grado; HSIL: lesión escamosa intraepitelial de alto grado; IC: intervalo de confianza; LSIL: lesión escamosa intraepitelial de bajo grado.
En el estudio de correlación entre el resultado positivo/negativo de la prueba del VPH y el resultado citológico normal/patológico se observó una relación significativa (p<0,001) entre la detección del VPH-16 y la citología patológica. Los valores de OR en una regresión logística univariable revelan que el riesgo de presentar una citología de alto grado es 57 veces más probable si el estudio molecular detecta la presencia de VPH-16. Contrariamente, no se observó ninguna asociación estadísticamente significativa entre citología alterada y presencia de cualquier otro genotipo (incluyendo VPH-18) (ver en el material suplementario las tablas 1 y 2).
Después de cruzar los resultados obtenidos de las pruebas moleculares y los estudios citológicos, 133 mujeres cumplían criterios para ser derivadas a colposcopia, siguiendo nuestro algoritmo (81 mujeres por detección de VPH-16 y/o VPH-18 y 52 mujeres por detección de VPHar con alteraciones citológicas [≥ASC-US]). No hubo ningún informe de citología de alto grado con VPH negativo (tabla 3). De las 133 colposcopias realizadas, en 54 pacientes (40,6% de las derivadas) se observó alteración en algún grado. Estas lesiones fueron 26 lesiones HSIL/CIN2+y 28 LSIL. Hubo un caso clasificado como hiperplasia micropapilar. En las 26 lesiones HSIL/CIN2+ el VPH-16 estuvo implicado en 17 ocasiones, representando el 65,4%. Las 9 lesiones de alto grado restantes estaban relacionadas con citología alterada y detección de otros genotipos de VPHar (tabla 3). Un hallazgo destacable es que 6 de esas 26 pacientes con lesiones HSIL/CIN2+ fueron derivadas a colposcopia al tener detección molecular VPH-16, si bien el informe citológico fue normal. Esto revela que el 23% de las lesiones de alto grado podrían no haber sido detectadas si se plantea el cribado citológico en primera línea, o la citología como triaje de las detecciones moleculares de VPH-16. Además, 12 de las 26 lesiones de alto grado tenían citología informada como ASC-US o LSIL, que fueron derivadas a colposcopia por haberse detectado genotipos VPHar (ver en el material suplementario la tabla 3).
Correlación de la detección molecular de VPH con genotipado parcial, con los resultados observados por citología alterada diferenciando entre los diferentes grados de lesiones y los resultados de las biopsias de pacientes derivados a colposcopia
| Resultados de detección molecular VPHn=1.988 (%) | Resultados de citologían=1.973 (%) | Resultados biopsiasn=54 (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| N.° genotipos detectados | Genotipo detectado | Normal | ASC-US | LSIL | HSIL | ASC-H | No HSILb | HSIL |
| No infección VPH | No detección | 1.639(9,4) | 64(74,4) | 21(32,3) | -- | -- | ||
| Infecciones con≥1 genotipo VPH | VPH-16 | 24(1,3) | 5(5,8)a | 5(7,7) a | 4(57,1)a | -- | 7(12,9) | 12(46,2) |
| VPH-18 | 11(0,6) | -- | -- | -- | 1(33,3) | 1(1,8)c | -- | |
| VPHar(no VPH-16/ no VPH-18) | 116(6,4) | 16(18,6)a | 32(49,2)a | 3(42,9) a | 1(33,3) | 15(27,7) | 9(34,6) | |
| Infecciones con≥2 genotipos VPH | VPH-16+VPH-18 | -- | -- | 1(1,5) | -- | -- | -- | 1(3,8) |
| VPH-16+VPHar | 17(0,9) | 1(1,2) | 2(3,1) | -- | 1(33,3) | 3(5,5) | 4(15,4) | |
| VPH-18+VPHar | 5(0,3) | -- | 3(4,6)a | -- | -- | 2(3,7) | -- | |
| Infecciones con≥3 genotipos VPH | VPH-16+VPH-18+VPHar | -- | -- | 1(1,5) | -- | -- | -- | -- |
| N.° total VPH (+) | 173 | 66d | 10e | 28 | 26 | |||
VPHar: virus papiloma humano de alto riesgo.
A las 116 mujeres con detección molecular de alguno de los 12 genotipos VPHar no VPH-16/18 con citología normal se les indicó repetir el estudio molecular y citológico a los 12 meses. Acudieron 83 mujeres (72%), lo que supone una pérdida de seguimiento del 28%. En 37/83 mujeres se seguía detectando PCR positiva para alguno de los 12 genotipos de VPHar (44,5%). El estudio citológico fue realizado en las 37 pacientes que mantenían PCR positiva: 22 de ellas presentaron citología normal (59,4%), en 14 (38%) se informaron alteraciones de bajo grado (ASCUS y LSIL) y en un caso (mujer gestante) se detectó lesión de alto grado (HSIL), siendo el genotipo implicado VPH-33. Para completar el estudio las 37 mujeres fueron derivadas a colposcopia. En 33/37 casos (89,1%) la colposcopia fue normal. En 3 casos se confirmó en biopsia dirigida el diagnóstico de LSIL/CIN1 y también el único caso de HSIL/CIN2+.
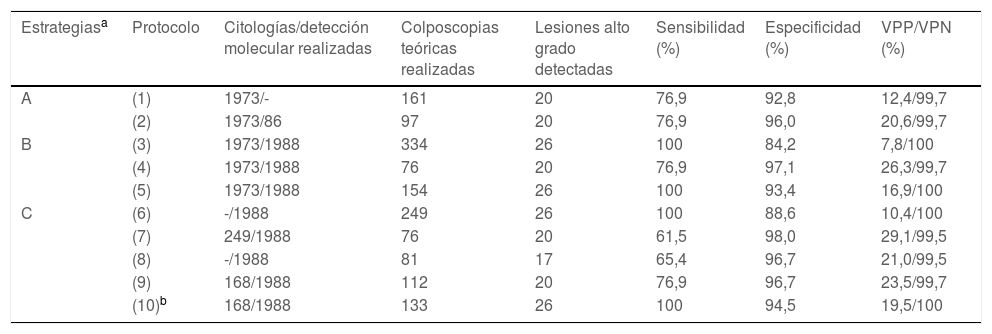
Análisis comparativo de la estrategia CRYGEN 16/18 con otras 9 estrategiasAcorde con los criterios descritos en material y métodos, de los 9 protocolos comparados con CRYGEN 16/18 sólo 3 resultaron ser no inferiores al detectar las 26 lesiones de alto grado diagnosticadas por este. Estos protocolos corresponden a estrategias de co-test (protocolo 3 y 5) y otro a cribado molecular en primera línea (protocolo 6) (tabla 4 para una descripción más detallada). Sin embargo, esos 3 protocolos lo harían con una mayor tasa de derivación a colposcopia o una mayor realización de citologías. Los protocolos basados en citología como cribado primario perderían el 23% de las lesiones de alto grado.
Análisis comparativo de las diferentes estrategias de cribado poblacional usadas para el cáncer de cérvix
| Estrategiasa | Protocolo | Citologías/detección molecular realizadas | Colposcopias teóricas realizadas | Lesiones alto grado detectadas | Sensibilidad (%) | Especificidad (%) | VPP/VPN (%) |
|---|---|---|---|---|---|---|---|
| A | (1) | 1973/- | 161 | 20 | 76,9 | 92,8 | 12,4/99,7 |
| (2) | 1973/86 | 97 | 20 | 76,9 | 96,0 | 20,6/99,7 | |
| B | (3) | 1973/1988 | 334 | 26 | 100 | 84,2 | 7,8/100 |
| (4) | 1973/1988 | 76 | 20 | 76,9 | 97,1 | 26,3/99,7 | |
| (5) | 1973/1988 | 154 | 26 | 100 | 93,4 | 16,9/100 | |
| C | (6) | -/1988 | 249 | 26 | 100 | 88,6 | 10,4/100 |
| (7) | 249/1988 | 76 | 20 | 61,5 | 98,0 | 29,1/99,5 | |
| (8) | -/1988 | 81 | 17 | 65,4 | 96,7 | 21,0/99,5 | |
| (9) | 168/1988 | 112 | 20 | 76,9 | 96,7 | 23,5/99,7 | |
| (10)b | 168/1988 | 133 | 26 | 100 | 94,5 | 19,5/100 |
El símbolo (–) indica «no pertinente», al no contemplarse en la estrategia.
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Estrategia A: agrupa las estrategias basadas en citología como cribado primario. Estrategia B: agrupa las estrategias basadas en co-test (detección simultánea e independiente de citología y detección molecular). Estrategia C: estrategias basadas en la detección molecular como cribado primario (ver apartado de material y métodos donde se detalla la descripción de cada algoritmo).
La OMS9 y la Guía europea sobre el cribado del cáncer cervical3 hace ya más de 5 años proponen la aproximación molecular como la estrategia primaria para la detección precoz de células precancerosas. Sin embargo, a pesar de estas recomendaciones basadas en la evidencia existe una implementación muy variable entre los estados miembros de la Unión Europea. El algoritmo CRYGEN 16/18ha permitido, con algunas limitaciones, comparar entre distintas estrategias de cribado poblacional propuestas o implementadas en países de nuestro entorno como Holanda, Alemania o Finlandia que han implementado los diferentes modelos que se comparan en este trabajo10.
En este estudio solo el 16,63% de la población diana completó el protocolo de cribado propuesto; además, en el seguimiento al año se observó una pérdida del 28% de la población. Estos datos revelan algunas de las dificultades sociales para una correcta implementación de estos programas de cribado. Dentro de esta población la prevalencia de infección por VPHar en mujeres de 35 años fue del 12,5%, similar a la encontrada en el estudio ATHENA (11,6%)11, el estudio CLEOPATRE (12,8% en Madrid y 12,2% a nivel nacional)12 y en el estudio poblacional realizado en las Islas Canarias (11,1%)13. Al comparar la prevalencia por genotipos se observaron prevalencias similares para VPH-16/VPH-18, 3,3% en ATHENA, 2,9-0,5% en CLEOPATRA y 3,2-1,1% en CRYGEN 16/18 respectivamente. Sin embargo, en este estudio al realizar un estudio no solo epidemiológico, sino también de intervención, se observó que la detección de VPH-16 aumentó en 57 veces el riesgo de presentar una citología con lesiones de alto grado. Si bien no se encontró una asociación tan fuerte entre otros genotipos, esto fue debido a la no discriminación del sistema de cribado entre los otros 12 genotipos de VPHar, por lo que no se puede excluir que otro genotipo pudiera tener una asociación también significativa con las lesiones de alto grado.
Por otra parte, los resultados citológicos detectaron solo un 8,1% de citologías patológicas (≥ASC-US), representando las lesiones de alto grado el 0,5% (0,36 HSIL y 0,15% ASC-H) que coinciden con otras series14–16. En ningún caso se observaron lesiones de alto grado con resultado negativo en test molecular. Por el contrario, la incidencia de lesiones de bajo grado representó el 7,7%, similar a los porcentajes referidos por la AEPCC, pero más alto que los encontrados en el programa de cribado de Castilla-León17. Al cruzar los datos citológicos con los moleculares el 83,1% de los resultados fueron negativos para ambas técnicas. Si se comparan las técnicas, teniendo algún resultado positivo, solo en el 30,5% de los casos coincidieron citología patológica con detección de algún genotipo VPHar (similar al 29,7% encontrado en el estudio ATHENA). Sin embargo, entre los valores discrepantes se detectaron 6 casos de infecciones por VPH-16, con informe citológico normal que en la biopsia correspondiente de la derivación a colposcopia resultaron lesiones de alto grado, lo que suponía el 23,07% del total de lesiones HSIL/CIN2+. Este resultado confirma la mayor sensibilidad de las técnicas moleculares para ser implementadas como cribado primario, incluso plantea si el estudio citológico en muestras VPH positivas no debería ser sustituido por otros biomarcadores moleculares.
Entre las 133 pacientes que por protocolo fueron derivadas a colposcopia se detectaron 26 lesiones HSIL/CIN2+, lo que corresponde a una incidencia del 1,30% (26/1.988 mujeres), valores 10 veces superiores a la incidencia media estimada en España (0,13%)18, aunque sin considerar tramo etario alguno. El genotipo VPH-16 se detectó en 17 de las 26 HSIL/CIN2+, lo que corresponde al 65,3% de todas las lesiones de alto grado, corroborando que este genotipo es, con diferencia, el de mayor riesgo, y por tanto todos los protocolos de cribado deberían incluir al menos la identificación específica de este genotipo para aumentar la tasa de detección de lesiones de alto grado. De esta manera se obtendría una mejor estratificación del riesgo. De hecho, el riesgo de VPH-16 fue considerablemente mucho mayor que el conferido por VPH-18, casi irrelevante en nuestra serie (un caso HSIL/CIN2+y asociado a VPH-16). Este hallazgo es coincidente con lo expuesto por Monsonego et al.19.
En los resultados del seguimiento al año de las pacientes con infección por VPHar no 16/18 con citología de cribado normal se detectó una lesión de alto grado histológicamente (2,7%), causado por VPH-33, coincidiendo con otros estudios similares donde las lesiones de alto grado oscilan entre 2,5-3,9%, siendo el VPH-33 el genotipo más frecuentemente identificado20. Los resultados de este seguimiento indican que la estrategia del protocolo propuesto es segura, puesto que solo una paciente de 83 presentaba una lesión de alto grado y no hubo ningún caso de cáncer invasivo.
La estrategia ideal para el cribado de CC sería aquella que asegure la máxima sensibilidad combinada con una mayor especificidad para minimizar los falsos positivos y evitar así derivaciones excesivas y sobretratamientos. Al comparar los distintos protocolos, el protocolo CRYGEN 16/18 resultó el más equilibrado, ya que detecta el mayor número de lesiones HSIL/CIN2+con una tasa razonable de derivaciones a colposcopia, aceptable en nuestro medio, reduciendo ostensiblemente el número de estudios citológicos y obteniendo un cociente de pruebas necesarias por cada lesión diagnosticada muy favorable. Esta eficacia es coincidente con la publicada por otros grupos21, y se trata de una mejora sobre el protocolo propuesto por el Ministerio de Sanidad que no contempla la genotipificación, como confirman nuestros resultados, al perderse el 23% de las lesiones HSIL/CIN2+en la primera ronda por presentar citología de cribado complementaria negativa. La inclusión de una segunda ronda de detección molecular de VPHar al año en los casos de VPHar (no VPH-16, no VPH-18) con citología normal puede ser una estrategia válida asumiendo un posible retraso diagnóstico de lesiones de alto grado (1/27 casos en nuestra serie), si bien se reduce la tasa de derivación a colposcopia22. También resulta más eficiente que las estrategias basadas en cotest23,24. La principal limitación del estudio CRYGEN 16/18 es la no realización de colposcopia sistemática a todas las pacientes, aspecto que sí contempló el estudio ATHENA. Su realización habría permitido cuantificar con precisión la tasa diagnóstica para cada estrategia de las propuestas, así como su sensibilidad, valor predictivo positivo y valor predictivo negativo. Al no realizarla solo se puede afirmar que las estrategias que hayan detectado el mismo número de lesiones HSIL/CIN2+que las encontradas con CRYGEN 16/18 no resultan inferiores, pero no se puede establecer si pudieran resultar superiores.
En conclusión, encontramos argumentos que avalan la implementación de la prueba de detección molecular de VPH con genotipado parcial en primera línea para el cribado del CC por su alta sensibilidad clínica y alto valor predictivo negativo, objetividad, bajos requisitos de entrenamiento, reproducibilidad y alta capacidad de rendimiento. Sin embargo, a la hora de equilibrar adecuadamente la estrategia de cribado poblacional (como establece el Ministerio de Sanidad y prácticamente todas las guías de cribado) es necesario establecer una estratificación del riesgo. En este sentido, el genotipado parcial de, al menos, VPH-16 aumenta el riesgo25, como se infiere de este trabajo. Además, la probabilidad de aclaramiento de la infección debe ser evaluada. Se conoce que el aclaramiento es alto en mujeres jóvenes26 (motivo por el que no se propone el cribado molecular en<35 años), pero que incluso en nuestra serie hasta el 55% de las mujeres con VPHar (no VPH-16, no VPH-18) aclararon el virus en un año, lo que requerirá ajustar progresivamente, acorde a nuevas evidencias esa estratificación del riesgo.
FinaciaciónEl proyecto CRYGEN 16/18, ha sido financiado por la empresa Roche Diagnostics (Barcelona, España). La empresa de diagnóstico financió el material fungible, así como la subvención de personal ajeno a los autores para ejecutar el trabajo. No intervino en el análisis, interpretación o redacción de los datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.