Symtuza® es el primer y único tratamiento del VIH-1 que combina 2 análogos de nucleós(t)idos (emtricita-bina y tenofovir alafenamida) junto con un inhibidor de la proteasa potenciado (darunavir/cobicistat) en un solo comprimido una vez al día. Esta combinación es activa frente a una gran variedad de cepas del VIH y, a su vez, evita la toxicidad renal y ósea asociada con el uso de tenofovir disoproxil fumarato, y aúna eficacia, conveniencia, tolerabilidad y elevada barrera genética. Los estudios farmacocinéticos de sus componentes demuestran un perfil favorable que permite su uso en una gran variedad de pacientes y situaciones clínicas. Aunque, como en toda combinación potenciada, es necesario considerar posibles interacciones con medicación concomitante, el potenciador cobicistat inhibe más selectivamente el citocromo P-450 y no posee ningún efecto inductor, por lo que su perfil de interacciones es más predecible que el de ritonavir.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Darunavir, cobicistat, emtricitabina y tenofovir alafenamida coformulados en el tratamiento de la infección por el VIH», que ha sido patrocinado por Janssen.
Symtuza® is the first and only treatment for HIV-1 that combines 2 nucleos(t)ide analogues (emtricitabine and tenofovir alafenamide) together with a boosted protease inhibitor (darunavir/cobicistat) in a once-daily single tablet regimen (STR). This combination is active against a wide variety of HIV strains and, in turn, avoids bone and renal toxicity associated with the use of tenofovir disoproxil fumarate, combining efficacy, convenience, tolerability and high genetic barrier. Pharmacokinetic studies of its components show a favourable profile, allowing its use in a wide variety of patients and clinical situations. Although, as in any boosted combination, possible interactions with concomitant medication should be borne in mind, cobici-stat inhibits cytochrome P-450 more selectively and has no inducing effect, so it has a more predictable interaction profile than ritonavir. Supplement information: This article is part of a supplement entitled “Co-formulated cobicistat-boosted darunavir, emtricitabine, and tenofovir alafenamide for the treatment of HIV infection”, which is sponsored by Janssen.
Symtuza® es una combinación de dosis fijas para el tratamiento de la infección por el VIH-1 que contiene tenofovir alafenamida (TAF), emtricitabina (FTC) y darunavir potenciado con cobicistat (DRV/c) en forma de comprimido recubierto con película de 22 × 10 mm. Está aprobado para adultos y adolescentes de > 12 años y > 40 kg de peso. La dosis recomendada es un comprimido (DRV/c/FTC/TAF 800/150/200/10 mg) por vía oral una vez al día con alimentos1.
Symtuza® es el primer régimen en un solo comprimido (STR, single tablet regimen) que contiene un inhibidor de la proteasa potenciado (IP/p). La coformulación ha sido posible, sobre todo, gracias a 2 avances importantes: el desarrollo de cobicistat (COBI) como po-tenciador, que respecto a ritonavir (RTV) mejora la solubilidad para combinarlo con otros antirretrovirales (ARV)2,3, y el desarrollo de TAF, que ha permitido disminuir la dosis de fármaco respecto a tenofovir disoproxil fumarato (TDF) y reducir sensiblemente el tamaño del comprimido4.
Darunavir es, hoy día, el IP/p de elección en las distintas guías por su eficacia, barrera genética y tolerabilidad5-7. Como la mayoría de IP, DRV precisa administrarse junto con un potenciador farmacocinético para obtener concentraciones plasmáticas adecuadas durante todo el intervalo de dosificación. Esto conlleva un riesgo de interacciones con otros fármacos que se puedan coadministrar con el tratamiento anti-rretroviral (TAR), pero con las cuales los especialistas responsables de estos pacientes ya tienen amplia experiencia. Hasta hace unos años, este potenciador era RTV, otro IP con un potente efecto inhibidor sobre el citocromo P-450 3A (CYP3A) y la glucoproteína P (P-gp), que a dosis plenas como ARV provocaba importantes efectos secundarios, pero que a dosis bajas mejoraba su tolerabilidad y mantenía el efecto poten-ciador, lo que permitía la administración una vez al día y con menores dosis totales del IP al cual acompañaba. No obstante, incluso a dosis bajas, RTV continuaba teniendo efectos adversos a nivel gastrointestinal y metabólico. Además, al ser un fármaco con actividad frente al VIH-1 utilizado a dosis infraterapéuticas, potencialmente se podrían generar resistencias en la proteasa si RTV no formaba parte de un régimen supresor8. Cobicistat es un nuevo potenciador desarrollado modificando la molécula de RTV, sin actividad antiviral intrínseca. Además, inhibe más selectivamente las distintas isoenzimas de CYP450 y no posee actividad inductora sobre otras isoenzimas o la glucuronida-ción, por lo que el perfil de interacciones es más predecible que con RTV. Por último, por sus características químicas, es más fácil de cofor-mular que RTV2,3. Por todos estos motivos, COBI ha desbancado a RTV como potenciador en todas las combinaciones desarrolladas en los últimos años (con DRV, atazanavir y elvitegravir).
Asimismo, Symtuza® contiene TAF, un profármaco de tenofovir que consigue concentraciones intracelulares terapéuticas con dosis totales mucho más pequeñas, lo que produce menores concentraciones plasmáticas de tenofovir, las cuales reducen el riesgo de efectos adversos a medio o largo plazo, especialmente sobre el riñón y el hueso9,10. De hecho, esta mayor toxicidad de TDF se ha observado especialmente cuando está acompañado de un potenciador, lo que hace aún más relevante el uso de TAF en este STR11. La menor toxicidad manteniendo la eficacia virológica ha hecho que TAF/FTC se haya posicionado como la pareja de inhibidores de la transcriptasa inversa análogos de nucleós(t)idos preferente en las últimas guías del Grupo de Estudio del Sida-SEIMC (GeSIDA), por delante de TDF/FTC5. Además, no requiere la realización de pruebas complementarias antes de su utilización (como la determinación de HLA_B*5701)5 y es activo frente el virus de la hepatitis B (VHB)1. En contrapartida, TAF tiene peor perfil lipídico que TDF aunque el ratio colesterol total:lipoproteína de alta densidad (HDL) no se modifica considerablemente ni tampoco parece que tenga ninguna repercusión en el inicio de medicación hipolipemiante9,10,12.
Por tanto, desde el punto de vista farmacológico, este STR contiene los agentes preferentes de cada una de las familias incluidas en esta combinación y aúna eficacia, conveniencia, tolerabilidad y elevada barrera genética. De esta forma se facilita el cumplimiento y se evita la adherencia selectiva a alguno de los componentes del tratamiento combinado, lo que reduce el riesgo de fracaso virológico y selección de mutaciones de resistencia.
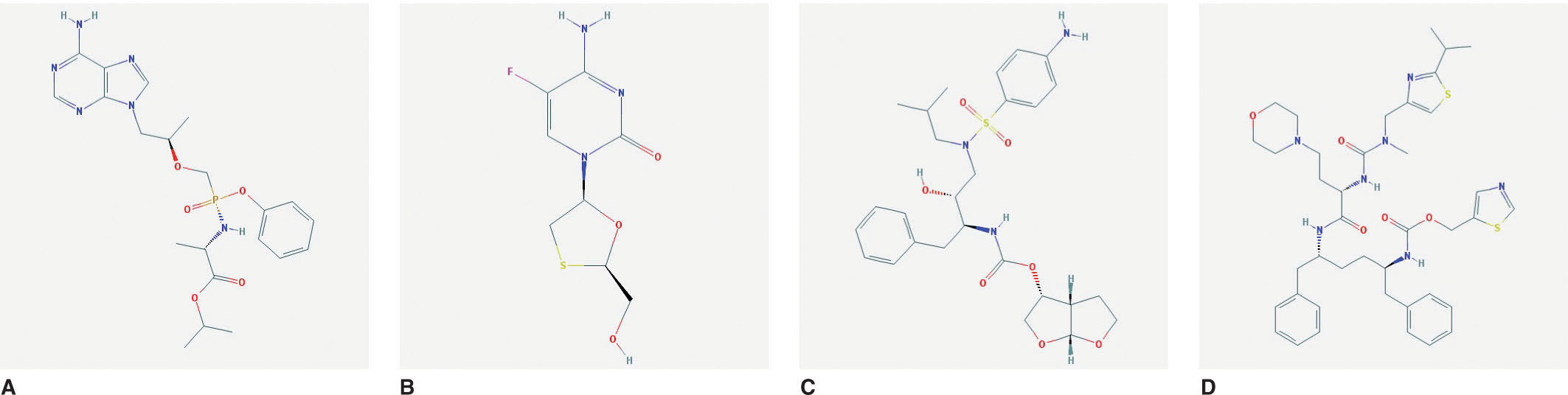
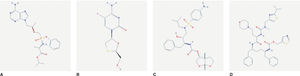
Mecanismo de acciónSymtuza® es una pauta completa de TAR y no se debe administrar con otros ARV. Se describirá el mecanismo de acción de Symtuza®mediante el análisis de los distintos componentes por separado. En la figura 1 A-D se puede observar la estructura molecular de cada componente.
Estructura molecular de los componentes de Symtuza®. A) Tenofovir alafenamida. Fuente: https://pubchem.ncbi.nlm.nih.gov/compound/9574768#section=2D-Structure. B) Emtricitabina. Fuente: https://pubchem.ncbi.nlm.nih.gov/compound/60877#section=2D-Structure. C) Darunavir. Fuente: https://pubchem.ncbi.nlm.nih.gov/compound/213039#section=2D-Structure. D) Cobicistat. Fuente: https://pubchem.ncbi.nlm.nih.gov/compound/25151504#section=2D-Structure.
Tenofovir alafenamida es un profármaco fosfonoamidato de teno-fovir, un inhibidor de la transcriptasa inversa análogo de los nucleó-tidos (análogo de la 2'-desoxiadenosina-monofosfato). Dentro de las células mononucleares de sangre periférica (CMSP) y macrófagos, TAF es hidrolizado a tenofovir, que será fosforilado para generar la molécula activa, tenofovir difosfato, que inhibe la replicación del VIH al incorporarse en el ADN viral por la transcriptasa inversa, lo que provoca la terminación de las cadenas de ADN13. En cambio, TDF se metaboliza a tenofovir en el plasma, lo que se traduce en mayor exposición sistémica. En un estudio farmacocinético en fase II se observaron concentraciones de tenofovir difosfato 6,5 veces superiores a nivel intracelular y concentraciones sistémicas el 90% menores con DRV/COBI/FTC/TAF que con DRV/COBI junto con FTC/TDF14.
La dosis de TAF en Symtuza® es 10 mg al día porque la combinación incluye COBI, que inhibe la P-gp y la proteína de resistencia al cáncer de mama (BCRP), ambas transportadoras de TAF.
EmtricitabinaLa emtricitabina es un inhibidor de la transcriptasa inversa análogo nucleosídico de la 2'-desoxicitidina. La emtricitabina es fosforilada por enzimas celulares que forman trifosfato de emtricitabina, que inhibe la replicación del VIH al incorporarse en el ADN viral por la transcriptasa inversa, lo que provoca la terminación de las cadenas de ADN15.
DarunavirEl darunavir es un inhibidor de la dimerización y de la actividad catalítica de la proteasa del VIH-1. Inhibe la escisión de las polipro-teínas Gag-Pol e impide la formación de partículas virales infecciosas maduras.
Como ya se ha descrito en el artículo anterior, DRV posee una alta afinidad hacia la proteasa del VIH-1, lo que explica que mantenga su actividad incluso ante la existencia de mutaciones de resistencia.
La dosis de DRV en Symtuza® es 800 mg al día, dosis indicada para pacientes que no han seguido este tratamiento previamente y pacientes pretratados sin mutaciones asociadas con DRV. Su biodispo-nibilidad es limitada y la semivida corta, por lo que, para poder ser administrado una vez al día, debe estar acompañado por un poten-ciador que inhiba su metabolismo (COBI en el caso de Symtuza®)1.
CobicistatEl cobicistat se utiliza como potenciador farmacocinético a dosis de 150 mg al día. No posee actividad antiviral (a diferencia de RTV). Su mecanismo de acción es aumentar la exposición de DRV durante todo el intervalo de dosificación gracias al hecho de reducir su metabolización.
COBI inhibe CYP3A, P-gp y, más débilmente, CYP2D6. Además, también inhibe otras proteínas transportadoras, como la multidrug and toxin extrusion protein 1 (MATE1), BCRP o los organic anion transporters 1B1 y 1B3 (OATP1B1 y OATP1B3). En cambio, a diferencia de RTV, COBI no tiene efecto inductor sobre otras isoenzimas de CYP o sobre la glucuronidación2.
En la célula tubular renal, COBI inhibe la secreción tubular de creatinina a través de MATE1 y se observa un aumento de la creati-nina plasmática y un descenso del filtrado glomerular estimado (FGe) durante el primer mes, que se estabiliza posteriormente y desaparece al suspender COBI. Este efecto también se observa con RTV, pero es más marcado con COBI, probablemente porque COBI se acumula, sobre todo, en las células tubulares transportado activamente por el organic cation transporter 2 (OCT2) y, por tanto, presenta mayores concentraciones para inhibir MATE116. Esto no implica empeoramiento de la función renal real (medida, p. ej., con el aclaramiento de iohexol) y existen datos que demuestran su seguridad en pacientes con insuficiencia renal17.
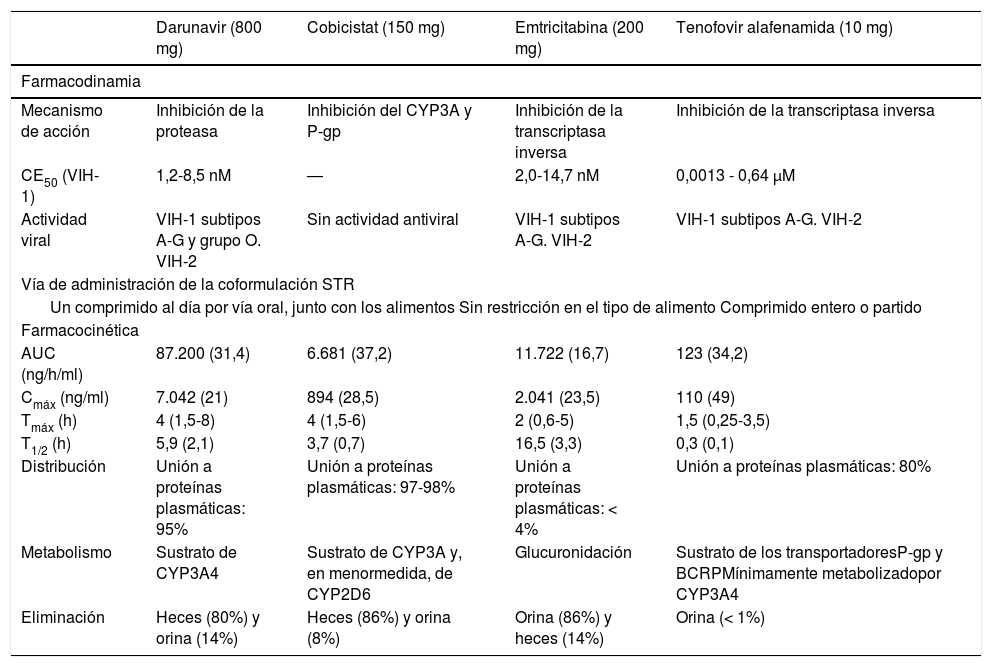
Propiedades farmacocinéticas y farmacodinámicasEn la tabla 1 se resumen las principales características farmacodi-námicas y farmacocinéticas de Symtuza®.
Principales características farmacodinámicas/farmacocinéticas de Symtuza®
| Darunavir (800 mg) | Cobicistat (150 mg) | Emtricitabina (200 mg) | Tenofovir alafenamida (10 mg) | |
|---|---|---|---|---|
| Farmacodinamia | ||||
| Mecanismo de acción | Inhibición de la proteasa | Inhibición del CYP3A y P-gp | Inhibición de la transcriptasa inversa | Inhibición de la transcriptasa inversa |
| CE50 (VIH-1) | 1,2-8,5 nM | — | 2,0-14,7 nM | 0,0013 - 0,64 μM |
| Actividad viral | VIH-1 subtipos A-G y grupo O. VIH-2 | Sin actividad antiviral | VIH-1 subtipos A-G. VIH-2 | VIH-1 subtipos A-G. VIH-2 |
| Vía de administración de la coformulación STR | ||||
| Un comprimido al día por vía oral, junto con los alimentos Sin restricción en el tipo de alimento Comprimido entero o partido | ||||
| Farmacocinética | ||||
| AUC (ng/h/ml) | 87.200 (31,4) | 6.681 (37,2) | 11.722 (16,7) | 123 (34,2) |
| Cmáx (ng/ml) | 7.042 (21) | 894 (28,5) | 2.041 (23,5) | 110 (49) |
| Tmáx (h) | 4 (1,5-8) | 4 (1,5-6) | 2 (0,6-5) | 1,5 (0,25-3,5) |
| T1/2 (h) | 5,9 (2,1) | 3,7 (0,7) | 16,5 (3,3) | 0,3 (0,1) |
| Distribución | Unión a proteínas plasmáticas: 95% | Unión a proteínas plasmáticas: 97-98% | Unión a proteínas plasmáticas: < 4% | Unión a proteínas plasmáticas: 80% |
| Metabolismo | Sustrato de CYP3A4 | Sustrato de CYP3A y, en menormedida, de CYP2D6 | Glucuronidación | Sustrato de los transportadoresP-gp y BCRPMínimamente metabolizadopor CYP3A4 |
| Eliminación | Heces (80%) y orina (14%) | Heces (86%) y orina (8%) | Orina (86%) y heces (14%) | Orina (< 1%) |
La combinación de DRV, FTC y TAF ha demostrado poseer un efecto antiviral aditivo o sinérgico en estudios in vitro de combinación de 2 fármacos. A su vez, no se ha demostrado ningún efecto antagonista entre dichos fármacos.
Darunavir ha demostrado actividad in vitro frente a cepas de laboratorio y cepas clínicas aisladas del VIH-1, y frente a cepas de laboratorio del VIH-2, con una mediana de concentración efectiva media (CE50) que varía entre 1,2 y 8,5 nM (de 0,7 a 5,0 ng/ml). Esta CE50 aumenta una mediana de 5,4 veces en presencia de suero humano. Da-runavir es activo frente al VIH-1 del grupo M (A-G) y el grupo O, con una CE50 que varía entre < 0,1 y 4,3 nM. Estas CE50 están muy por debajo de los límites de la concentración celular tóxica del 50%, que están comprendidos entre 87 y > 100 μM1.
COBI no ha demostrado actividad antiviral frente al VIH-1, VHB o VHC, y no antagoniza con el efecto antiviral de darunavir.
En estudios in vitro, FTC ha demostrado actividad frente a cepas de laboratorio y cepas clínicas aisladas del VIH-1 con valores de CE 50entre 0,0013 y 0,64 μM. Emtricitabina es activa frente a los subtipos A-G del VIH-1 con unas CE50 comprendidas entre 0,007 y 0,075 μM. A su vez, ha demostrado actividad frente al VIH-2 con unas CE50 del rango de 0,007 a 1,5 μM1.
La actividad antiviral de TAF frente a cepas de laboratorio y cepas clínicas aisladas del VIH-1 ha sido estudiada in vitro y se han demostrado unas CE50 de 2,0 a 14,7 nM. Tenofovir alafenamida tiene actividad frente al VIH-1 de los grupos M, N y O, incluyendo los subtipos A-G (CE50 del rango de 0,10 a 12,0 nM). También se ha observado actividad frente al VIH-2 (CE50 entre 0,91 y 2,63 nM)1.
Absorción y eliminaciónLa bioequivalencia de Symtuza® se ha estudiado comparando la administración de un comprimido de dicho fármaco frente a la administración conjunta de DRV (800 mg), COBI (150 mg) y TAF/FTC (200/10 mg) como comprimidos independientes en pacientes sanos18.
La absorción de Symtuza® es rápida y, tras la administración de un comprimido en voluntarios sanos, DRV, COBI, FTC y TAF alcanzaron su concentración máxima (Cmáx) a las 4, 4, 2,5 y 1,5 horas, respectivamente. La media del área bajo la curva (AUC) y la Cmáx fueron, respectivamente: 87.200 ng/h/ml y 7.042 ng/ml en DRV; 6.681 ng/h/ml y 894 ng/ml en COBI; 11.722 ng/h/ml y 2.041 ng/ml en FTC, y 123 ng/h/ml y 110 ng/ml en TAF18.
El hecho de partir el comprimido no afecta a la absorción de los diferentes componentes aunque triturarlo puede disminuir hasta el 20% la concentración de TAF19. La ficha técnica del producto recomienda tomar entero el comprimido de Symtuza® aunque el impacto clínico de esta disminución de las concentraciones plasmáticas de TAF, en caso de triturar el comprimido, es dudoso en el contexto de un TAR triple plenamente activo.
De manera similar a lo ocurrido con la administración de DRV junto con RTV20, el ayuno afecta negativamente a la absorción de DRV y COBI, y disminuye su exposición hasta el 45 y el 29%21, respectivamente, por lo que se recomienda tomar Symtuza® con alimento1. Estudios previos han demostrado que el tipo de alimento ingerido no influye en la absorción de DRV20, por lo que Symtuza® tampoco muestra restricciones a este nivel.
La eliminación de DRV y COBI se produce, principalmente, a través de las heces (80 y 86%) y la orina (14 y 8%). Aproximadamente, el 41,2 y el 7,7% de la dosis de DRV es recuperada intacta en heces y en orina, respectivamente. En cambio, FTC se excreta fundamentalmente por el riñón y el 86% de la dosis se recupera por completo en la orina; tan solo el 14% se excreta por las heces. Tenofovir alafenamida es prácticamente eliminado en su totalidad tras ser metabolizado a tenofovir mediante filtración glomerular y secreción tubular activa. La excreción renal de TAF intacto es una vía secundaria ya que menos del 1% de la dosis se elimina por la orina1.
Tras la administración de Symtuza®, la mediana de la semivida plasmática (T1/2) de sus componentes es 5,5 horas para DRV; 3,6 horas para COBI, y 17,2 horas para FTC. En cambio, TAF tiene una T 1/2muy corta (0,3 horas) y es rápidamente metabolizado al metabolito tenofovir, con mayor T1/2, de unas 32 horas. Cabe destacar que el me-tabolito activo tenofovir difosfato tiene una semivida de 150-180 horas en CMSP1.
Distribución y metabolismoDarunavir y COBI se unen en una alta proporción (95 y 97-98%, respectivamente) a proteínas plasmáticas. Darunavir se une preferentemente a la glucoproteína ácida a1. En cambio, FTC y tenofovir presentan baja unión a proteínas plasmáticas en los estudios in vitro (< 4 y < 0,7%, respectivamente). Cabe destacar que TAF se une ex vivo en el 80% a las proteínas plasmáticas en las muestras obtenidas en estudios con seres humanos1.
En experimentos in vitro, DRV experimenta, sobre todo, un metabolismo oxidativo, principalmente mediante el sistema CYP hepático y casi en exclusiva por la isoenzima CYP3A4. La mayor parte del fármaco permanece intacto en plasma y se han identificado, al menos, 3 metabolitos oxidativos de DRV, todos ellos con una actividad contra el VIH 10 veces inferior a la de DRV.
El cobicistat es metabolizado mediante oxidación mayormente por CYP3A y, en menor medida, por CYP2D6 y no experimenta glu-curonidación. Tras la administración oral de COBI, el 99% del fármaco se mantiene intacto en plasma y se observan niveles bajos de meta-bolitos en orina y heces, que carecen de actividad inhibidora sobre CYP3A.
Los estudios in vitro indican que FTC no es un inhibidor de las enzimas CYP humanas. Aproximadamente, el 9% de la dosis se transforma en diastereómeros 3'-sulfóxido mediante la oxidación del radical tiólico y el 4% en 2'-O-glucurónido a través de glucuronidación.
Más del 80% de la dosis oral de TAF se metaboliza en el ser humano. Los ensayos in vitro han demostrado que TAF se metaboliza a te-nofovir por medio de la catepsina A en las CMSP y los macrófagos, y por medio de la carboxilesterasa 1, en los hepatocitos. In vivo, TAF se hidroliza en las células para formar tenofovir, que es fosforilado al metabolito activo tenofovir difosfato.
Tenofovir alafenamida es sustrato de los transportadores P-gp y BCRP, y es metabolizado mínimamente por CYP3A4; este hecho implica mayor potencial de interacciones que el uso de TDF1. Pese a que estudios in vitro al parecer muestran un débil efecto inductor de TAF sobre CYP3A4, en estudios in vivo no se ha objetivado efecto inhibidor ni inductor en CYP3A4.
Poblaciones especialesInsuficiencia renal. No hay datos farmacocinéticos de Symtuza® en pacientes con insuficiencia renal moderada (FGe: 30-60 ml/min) o grave (FGe: 15-30 ml/min), pero existen de sus componentes por separado. En el caso de insuficiencia renal moderada, la farmacocinéti-ca de DRV, COBI, FTC y TAF no se vio alterada. No obstante, en pacientes con insuficiencia renal grave, los niveles de FTC fueron 3 veces superiores en comparación con pacientes sanos15; las repercusiones clínicas de este hallazgo son dudosas. En cambio, las concentraciones de COBI y TAF no se vieron alteradas. Con estos datos, al igual que el resto de STR, Symtuza® no está indicado en pacientes con insuficiencia renal grave (FGe: < 30 ml/min).
Insuficiencia hepática. La exposición de DRV, COBI, FTC y TAF en pacientes con insuficiencia hepática leve (Child-Pugh A) o moderada (Child-Pugh B) es comparable a la observada en pacientes sanos1. Sin embargo, las concentraciones de DRV libre al administrar DRV/RTV (600 mg/100 mg 2 veces al día) fueron el 55 y el 100% superiores en pacientes con insuficiencia hepática leve y moderada, respectiva-mente22. No hay datos farmacocinéticos de TAF o FTC en pacientes con insuficiencia hepática; en el caso de FTC, su escaso metabolismo hepático no hace predecir ningún tipo de interacción. Por último, no hay datos de los diferentes componentes de Symtuza® en pacientes con insuficiencia hepática grave (Child-Pugh C), por lo que no se recomienda su uso en este grupo de pacientes.
Edad avanzada. En el análisis farmacocinético poblacional con pacientes con VIH entre 18 y 75 años, la farmacocinética de DRV no fue considerablemente diferente en pacientes con edades > 65 años (aunque se incluyeron tan solo 12 pacientes). No se han identificado diferencias farmacocinéticas de interés clínico por la edad con COBI, FTC ni TAF.
Sexo. Las mujeres infectadas por el VIH-1 mostraron una exposición el 16,8% mayor a DRV que los hombres en el análisis farmacoci-nético poblacional, pero esta diferencia no se consideró relevante1. No se han identificado diferencias farmacocinéticas de interés clínico por el sexo con COBI, FTC ni TAF.
Embarazo. Datos recientes en pacientes embarazadas han demostrado que el AUC de DRV administrado junto al potenciador COBI fue el 56 y el 50% menor durante el segundo y tercer trimestres del embarazo, respectivamente, en comparación con el período comprendido entre las semanas 6 y 12 del posparto. Los valores medios de la concentración mínima (Cmín) de DRV fueron el 90% inferiores durante el segundo y tercer trimestres del embarazo en comparación con el posparto. El AUC de COBI fue el 63 y el 49% menor durante el segundo y tercer trimestres del embarazo, respectivamente, en comparación con el posparto. Por este motivo, no se debe usar la combinación DRV/COBI durante el segundo y tercer trimestres del embarazo. Además, actualmente no está recomendado el uso de TAF/FTC durante el embarazo por la escasez de datos5.
Edad pediátrica. Se dispone de datos farmacocinéticos de los diferentes componentes de Symtuza® por separado. En un estudio de fase II en pacientes pediátricos con edades entre 12 y 18 años, y un peso > 40 kg, a los cuales se les administró DRV (800 mg) junto con RTV (100 mg), se objetivó un AUC de DRV similar a la población adul-ta23. Tenofovir alafenamida y FTC se han estudiado en pacientes pediátricos con edades entre 12 y 18 años y un peso > 35 kg administrados como un comprimido único de TAF/FTC/elvitegravir/COBI (10/200/150/150 mg). En este estudio, los niveles de TAF y FTC fueron similares a los observados en pacientes adultos24. Por este motivo, se considera seguro administrar Symtuza® en pacientes de ≥ 12 años y un peso de ≥ 40 kg.
Sonda nasogástrica. En un estudio de biodisponibilidad en que se comparaba la administración de un comprimido de Symtuza® entero, partido o triturado, el AUC y la Cmáx de los diferentes principios activos fueron comparables cuando se administraba el comprimido entero o cuando se administraba partido, excepto para TAF, donde se observó una disminución del 11% de la Cmáx, que no se consideró clínicamente relevante. La biodisponibilidad se vio afectada cuando se administró el comprimido triturado ya que la Cmáx y el AUC de TAF disminuyeron el 29 y el 19%, respectivamente, y la Cmáx de FTC, en torno al 17%19. La biodisponibilidad de DRV y COBI no se vieron afectadas cuando se administró Symtuza® partido o triturado. Como se ha explicado anteriormente, pese al dudoso impacto clínico que puedan tener estos resultados, la ficha técnica del producto recomienda no triturar el comprimido1.
InteraccionesAl tratarse de un STR potenciado, existe riesgo de interacciones con todos aquellos fármacos que se metabolicen por ciertas vías me-tabólicas o que las induzcan/inhiban. No se han realizado estudios de interacciones farmacológicas con Symtuza® antes de su comercialización y los datos disponibles provienen de estudios con los componentes del STR de forma individual o en combinación1. Constantemente aparece nueva información respecto a las interacciones entre fármacos, por lo que se recomienda consultar páginas web actualizadas (como www.hiv-druginteractions.org o www.interaccionesvih.com), junto con las fichas técnicas de los distintos fármacos.
Tanto DRV como COBI inhiben CYP3A, P-gp y, más débilmente, CYP2D6. Cobicistat también inhibe otras proteínas transportadoras, como MATE1, BCRP, OATP1B1 y OATP1B31. Esto conlleva un aumento de las concentraciones de aquellos fármacos que se metabolicen por estas vías cuando se administran conjuntamente con Symtuza®, con riesgo de aumentar o prolongar su efecto, y, por tanto, la aparición de efectos secundarios. Esto puede ser especialmente grave en aquellos fármacos con estrecho margen terapéutico. Asimismo, DRV y COBI son metabolizados por CYP3A. Cuando se administren inductores potentes de CYP3A (como rifampicina, carbamazepina, azoles o hipérico), puede aumentar de forma importante la eliminación de DRV y COBI, con riesgo de concentraciones plasmáticas infraterapéuticas, fracaso virológico y selección de mutaciones de resistencia. En la tabla 2 aparecen aquellos fármacos que están contraindicados según la ficha técnica de Symtuza®1. En la tabla 3 se describen otras interacciones relevantes de fármacos usados frecuentemente, tanto las que Symtuza® puede provocar al inhibir CYP/transportadores como de las que puede ser víctima por inducción/inhibición de estas vías metabólicas por parte de otros fármacos aunque, para una información más exhaustiva de posibles interacciones, se remite a los lectores a la ficha técnica1 y a las páginas de internet anteriormente citadas.
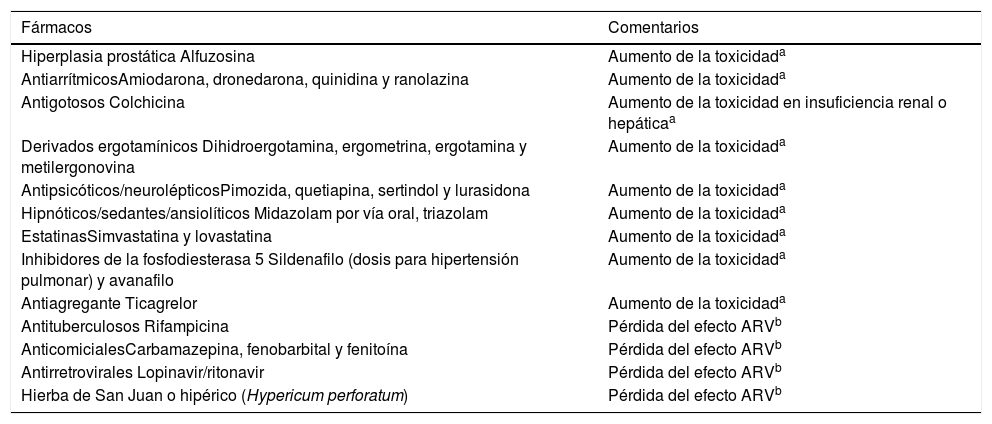
Fármacos cuya administración junto con Symtuza® está contraindicada según la ficha técnica1
| Fármacos | Comentarios |
|---|---|
| Hiperplasia prostática Alfuzosina | Aumento de la toxicidada |
| AntiarrítmicosAmiodarona, dronedarona, quinidina y ranolazina | Aumento de la toxicidada |
| Antigotosos Colchicina | Aumento de la toxicidad en insuficiencia renal o hepáticaa |
| Derivados ergotamínicos Dihidroergotamina, ergometrina, ergotamina y metilergonovina | Aumento de la toxicidada |
| Antipsicóticos/neurolépticosPimozida, quetiapina, sertindol y lurasidona | Aumento de la toxicidada |
| Hipnóticos/sedantes/ansiolíticos Midazolam por vía oral, triazolam | Aumento de la toxicidada |
| EstatinasSimvastatina y lovastatina | Aumento de la toxicidada |
| Inhibidores de la fosfodiesterasa 5 Sildenafilo (dosis para hipertensión pulmonar) y avanafilo | Aumento de la toxicidada |
| Antiagregante Ticagrelor | Aumento de la toxicidada |
| Antituberculosos Rifampicina | Pérdida del efecto ARVb |
| AnticomicialesCarbamazepina, fenobarbital y fenitoína | Pérdida del efecto ARVb |
| Antirretrovirales Lopinavir/ritonavir | Pérdida del efecto ARVb |
| Hierba de San Juan o hipérico (Hypericum perforatum) | Pérdida del efecto ARVb |
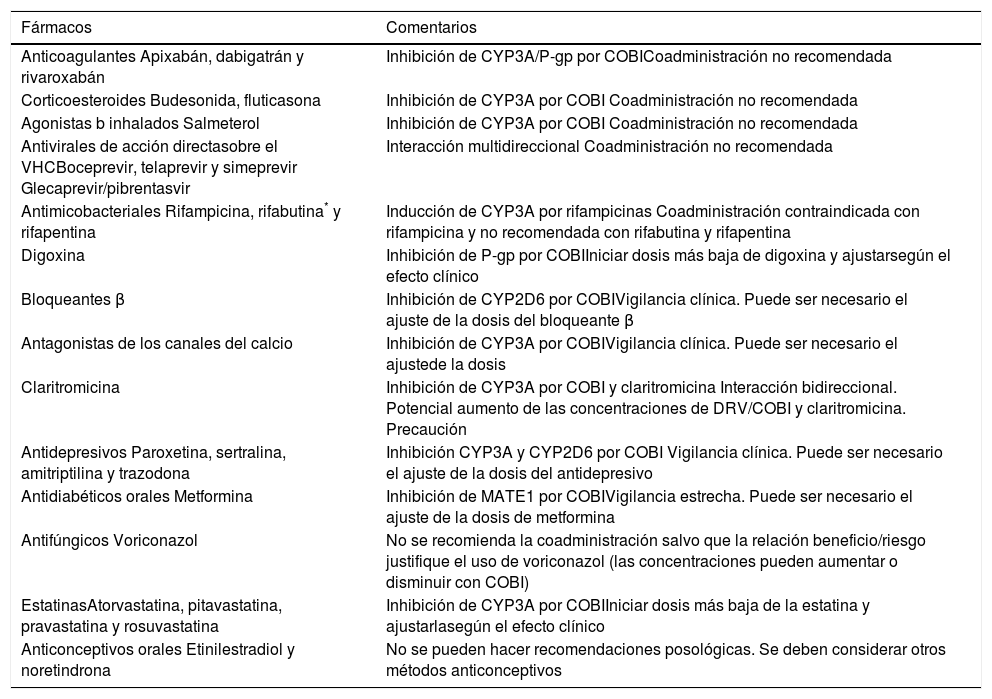
Potenciales interacciones relevantes con Symtuza®1
| Fármacos | Comentarios |
|---|---|
| Anticoagulantes Apixabán, dabigatrán y rivaroxabán | Inhibición de CYP3A/P-gp por COBICoadministración no recomendada |
| Corticoesteroides Budesonida, fluticasona | Inhibición de CYP3A por COBI Coadministración no recomendada |
| Agonistas b inhalados Salmeterol | Inhibición de CYP3A por COBI Coadministración no recomendada |
| Antivirales de acción directasobre el VHCBoceprevir, telaprevir y simeprevir Glecaprevir/pibrentasvir | Interacción multidireccional Coadministración no recomendada |
| Antimicobacteriales Rifampicina, rifabutina* y rifapentina | Inducción de CYP3A por rifampicinas Coadministración contraindicada con rifampicina y no recomendada con rifabutina y rifapentina |
| Digoxina | Inhibición de P-gp por COBIIniciar dosis más baja de digoxina y ajustarsegún el efecto clínico |
| Bloqueantes β | Inhibición de CYP2D6 por COBIVigilancia clínica. Puede ser necesario el ajuste de la dosis del bloqueante β |
| Antagonistas de los canales del calcio | Inhibición de CYP3A por COBIVigilancia clínica. Puede ser necesario el ajustede la dosis |
| Claritromicina | Inhibición de CYP3A por COBI y claritromicina Interacción bidireccional. Potencial aumento de las concentraciones de DRV/COBI y claritromicina. Precaución |
| Antidepresivos Paroxetina, sertralina, amitriptilina y trazodona | Inhibición CYP3A y CYP2D6 por COBI Vigilancia clínica. Puede ser necesario el ajuste de la dosis del antidepresivo |
| Antidiabéticos orales Metformina | Inhibición de MATE1 por COBIVigilancia estrecha. Puede ser necesario el ajuste de la dosis de metformina |
| Antifúngicos Voriconazol | No se recomienda la coadministración salvo que la relación beneficio/riesgo justifique el uso de voriconazol (las concentraciones pueden aumentar o disminuir con COBI) |
| EstatinasAtorvastatina, pitavastatina, pravastatina y rosuvastatina | Inhibición de CYP3A por COBIIniciar dosis más baja de la estatina y ajustarlasegún el efecto clínico |
| Anticonceptivos orales Etinilestradiol y noretindrona | No se pueden hacer recomendaciones posológicas. Se deben considerar otros métodos anticonceptivos |
A pesar de que RTV y COBI actúen de forma similar, como ya se ha explicado anteriormente, existen ciertas diferencias entre ambos, pues COBI es un inhibidor más selectivo. No obstante, en un trabajo reciente se demuestra que la inhibición in vivo de P-gp puede ser mayor con COBI que con RTV y en ese caso provoca interacciones importantes entre COBI y el anticoagulante dabigatrán, pero que podrían ser aplicables a otros sustratos de P-gp25. Cobicistat tampoco tiene efecto inductor (RTV induce CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 o UGT1A1). Ritonavir también activa PXR (pregnane X receptor), que regula la expresión de CYP3A4, por lo que, a pesar de que el efecto final es la inhibición, RTV también podría inducir CYP3A42,26. De otros estudios recientes se puede inferir que RTV es más efectivo que COBI para compensar el efecto de ciertos inductores, como ri-fampicina27 o etravirina28. Todo ello puede implicar interacciones distintas con ciertos fármacos entre COBI y RTV a pesar de que, en la mayoría de casos, las interacciones serán similares dado que la principal vía metabólica es CYP3A4 y, en este caso, el efecto inhibidor de ambos es similar. La tabla 4 muestra algunos ejemplos de estas diferencias. Esto es especialmente importante cuando se decida llevar a cabo un cambio de TAR a Symtuza® en un paciente que esté recibiendo RTV, sobre todo si el paciente recibe otra medicación concomitante de la cual se han tenido que ajustar las dosis por el RTV. En estos casos se recomienda precaución durante las 2 primeras semanas tras el cambio y vigilar la aparición de efectos adversos.
Ejemplos de fármacos utilizados habitualmente con interacciones distintas según el potenciador utilizado (cobicistat o ritonavir)1,26
| Potenciador | Vía implicada | Fármacos implicados |
|---|---|---|
| Ritonavir | Inducción de CYP1A2 | Olanzapina |
| Inducción de CYP2B6 | BupropiónPropofolSertralina | |
| Inducción de CYP2C9 y CYP2C19 | Acenocumarol Glicazida Lamotrigina Valproato | |
| Inducción de CYP2C8 y CYP2C9 | Rosiglitazona | |
| Inducción de la glucuronidación | AtovacuonaGemfibroziloLamotriginaMicofenolatoOlanzapinaPropofolValproato | |
| Cobicistat | Inhibición de MATE1 | Metformina |
| Inhibición de P-gp (mayor que ritonavir) | Dabigatrán |
Emtricitabina tiene un bajo potencial de interacciones mediadas por CYP, transportadores o glucuronidación. Los fármacos que reducen la función renal y aquellos que se eliminan por secreción tubular activa pueden aumentar las concentraciones de FTC aunque la implicación clínica de esta potencial interacción es poco importante1,15.
Al ser TAF un sustrato de la P-gp y BCRP (y de OATP1B1 y OATPB1B3 in vitro), su absorción puede verse afectada por inductores/inhibidores de estos transportadores. Es esperable que fármacos que induzcan la actividad de estos transportadores (como rifampicina, carba-mazepina o fenobarbital) disminuyan la absorción de TAF y reduzcan sus concentraciones plasmáticas, y que los fármacos que inhiban estos transportadores (como COBI, RTV o ciclosporina) aumenten la absorción y las concentraciones plasmáticas de TAF. El ejemplo más claro es que la dosis de TAF varía en función de si se administra con-comitantemente o no con un fármaco potenciador (10 o 25 mg al día, respectivamente)1. Investigaciones recientes sugieren que, a pesar de que las concentraciones sistémicas de TAF puedan reducirse cuando se administran con inductores potentes, como rifampicina, esto no tiene impacto en la eficacia clínica porque las concentraciones intracelulares de tenofovir difosfato, la molécula activa, son incluso más altas que cuando se administra TDF (300 mg)29. No obstante, en el caso de Symtuza® deberá continuar vigilándose o evitándose estos fármacos por las repercusiones que pueden tener estos inductores sobre los otros componentes del STR (básicamente, DRV y COBI).
Otro aspecto relevante, en este caso por la ausencia de interacciones que pueden aparecer con otras familias, tiene relación con aquellos fármacos o preparados con cationes divalentes. Se ha descrito que productos con calcio, hierro o magnesio pueden afectar a la absorción de los inhibidores de la integrasa30. Algunos productos que contienen estas sustancias están claramente identificados o deben comprarse por prescripción médica, pero en otros casos pueden estar formando parte, por ejemplo, de preparados multivitamínicos y el paciente no ser consciente del riesgo de interacciones. No existen, en cambio, interacciones relevantes entre cationes divalentes y Symtuza®1.
Conflicto de interesesEl autor Adrian Curran ha recibido honorarios por asesoría científica de Janssen-Cilag, MSD y ViiV Healthcare, y por conferencias de Janssen-Cilag, MSD y Gilead Sciences.
El autor Jordi Navarro ha recibido honorarios por asesoría científica de AbbVie y ViiV Healthcare, y por conferencias de AbbVie, Gi-lead Sciences, Janssen-Cilag y MSD.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Darunavir, co-bicistat, emtricitabina y tenofovir alafenamida coformulados en el tratamiento de la infección por el VIH», que ha sido patrocinado por Janssen.