Caso clínico
Mujer de 71 años diagnosticada en septiembre de 2003 de leucemia linfoblástica crónica (LLC) estadio 2 (Kanti-Rai). La paciente ingresó un mes antes en el Servicio de Nefrología por síndrome nefrótico con biopsia renal compatible con glomerulonefritis membranosa. En el estudio etiológico se objetivó la presencia de linfocitosis periférica y una banda oligoclonal λ IGG; fue diagnosticada de LLC. En este ingreso se detectó insuficiencia renal (creatinina 2,1 mg/dl con aclaramiento de creatinina de 34 ml/min) y proteinuria en rango nefrótico (> 3 g/día). Se inició tratamiento con prednisona y ciclofosfamida a pesar de lo cual empeoraron la función renal y la proteinuria. Evaluada por servicio de hematología se instauró tratamiento con fludarabina en dosis de 25 mg/kg durante 5 días en ciclos y de forma concomitante se pautó profilaxis primaria con trimetoprima-sulfametoxazol (160/800 mg 3 veces/semana).
A las 24 h de finalizar el segundo ciclo la paciente acudió al hospital con fiebre de 38 °C, tos seca no productiva, disnea de esfuerzo y sibilancias audibles, sin cuadro catarral previo. En la exploración física se detectó una temperatura de 38,3 °C y la frecuencia respiratoria era de 24 resp./min. En la auscultación pulmonar predominaba la existencia de sibilancias diseminadas y crepitantes en la base derecha. El resto de la exploración física era normal.
En el hemograma de ingreso se objetivaron 5,5 x 10 9/l leucocitos con 5,4 x 10 9/l neutrófilos, 9,5 g/dl de hemoglobina y cifra de plaquetas normales. A las 24 h se detectó neutropenia, con 150 neutrófilos totales, pero se recuperó en 48 h, tras la instauración de factor estimulante de granulocitos. La gasometría arterial basal demostró la presencia de hipoxemia moderada (PO2 67 mmHg).
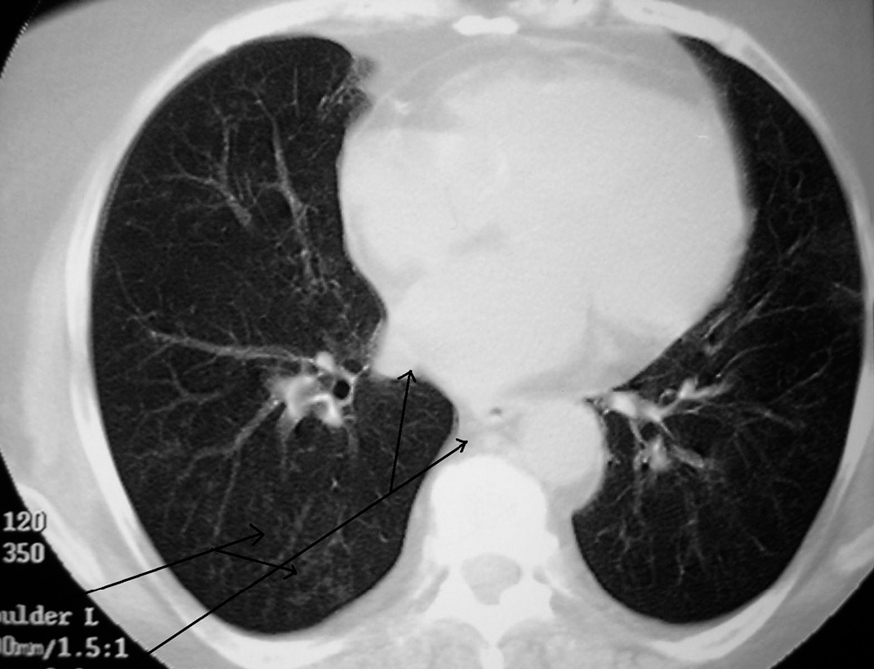
En la radiografía de tórax se observó un nuevo infiltrado inespecífico en la base pulmonar derecha. Para confirmar su existencia y ver la extensión del mismo se realizó una tomografía computarizada pulmonar de alta resolución (TCAR) que demostró la presencia de un infiltrado con patrón reticulonodular en base derecha pulmonar y la presencia de adenopatías mediastínicas (figs. 1 y 2).
Figura 1. TC de tórax que muestra la existencia de un infiltrado reticulonodular en base derecha y adenopatías mediastínicas (flechas).
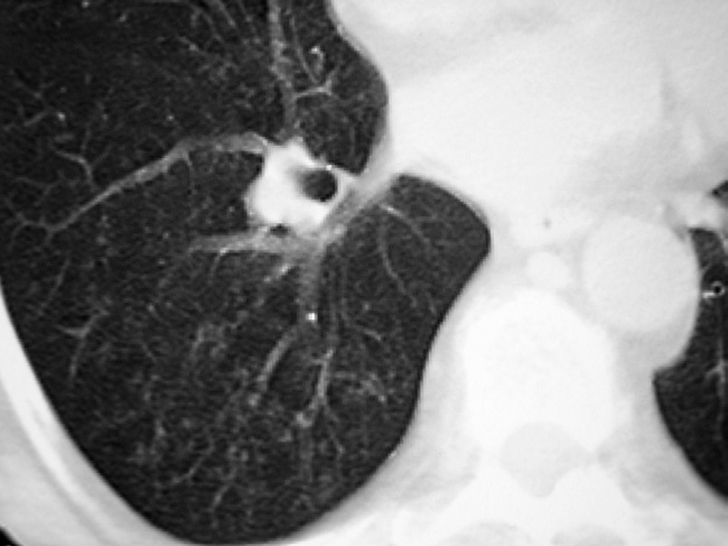
Figura 2. Detalle del patrón reticulonodular.
Evolución
En el segundo día de ingreso, ante los hallazgos radiológicos y la importante inmunosupresión, se realiza una broncoscopia para lavado broncoalveolar (LBA) con fines diagnósticos.
Entre las pruebas microbiológicas que se solicitaron destacamos: dos hemocultivos que fueron estériles; tinción de Gram y cultivo de esputo no valorable por mala calidad de la muestra; antígeno de Legionella pneumophila serogrupo 1 en orina que fue negativo, y antigenemia de citomegalovirus negativa. Se realizó durante el ingreso test de la tuberculina; fue negativo y se procesaron también baciloscopias en esputo en tres muestras consecutivas sin evidencia de micobacterias en la tinción Ziehl-Neelsen y con cultivo en medio de Löwenstein-Jensen negativo a las 6 semanas en las mismas.
La tinción de Gram en el LBA no detectó la presencia de microorganismos y el cultivo bacteriano fue negativo. Se realizó también en el LBA una tinción de plata para Pneumocystis jiroveci, cultivo de virus (adenovirus, influenza, virus respiratorio sincitial y citomegalovirus), baciloscopia y cultivo de micobacterias, así como examen directo y cultivo de hongos. Todos los resultados fueron negativos.
En el tercer día de ingreso se nos informó de que el cultivo viral del exudado nasofaríngeo procesado el primer día del ingreso, confirma la presencia de virus respiratorio sincitial (VRS).
Desde el ingreso y ante los hallazgos en TCAR se inició tratamiento empírico con cotrimoxazol, cefepima y levofloxacino, todos por vía intravenosa. Así mismo, se añadió tratamiento con voriconazol por vía oral. Tras descartar la presencia de P. jiroveci en el LBA, se retiró el tratamiento con cotrimoxazol en dosis terapéutica.
A las 72 h con el resultado del cultivo nasofaríngeo positivo para VRS y con el diagnóstico de probable neumonía por VRS se retiró todo el tratamiento salvo la cefepima, que se mantuvo durante 10 días. Ese mismo día se establecieron medidas de control nosocomial, con aislamiento de contacto y respiratorio de la paciente. Dada la buena situación clínica de la paciente y los riesgos de terapia específica para VRS no se instauró tratamiento antiviral.
La evolución fue excelente sin necesidad de soporte respiratorio y el nuevo cultivo del exudado nasofaríngeo realizado 5 días después fue negativo para VRS. Tras finalizar el tratamiento con cefepima, se realizó TCAR con resolución del infiltrado radiológico.
Comentario
Los análogos de purina son el tratamiento de elección en pacientes con LLC que no responden al tratamiento convencional. Sin embargo este tratamiento implica una depleción grave de los linfocitos CD4 e importante mielosupresión, lo que añade un importante riesgo de complicaciones infecciosas. De ellas las infecciones virales son una de las más frecuentes 1.
El VRS es la causa más común de bronquiolitis e ingreso hospitalario por infección respiratoria en niños menores de 2 años. En adultos sanos el cuadro clínico es el de un catarro que suele ser más prolongado pero sin complicaciones. En pacientes inmunodeprimidos la infección por VRS es una de las causas más comunes y graves de infecciones virales 2.
La mayor parte de los estudios epidemiológicos y de tratamiento de infecciones por VRS en pacientes inmunodeprimidos se han realizado en pacientes con leucemia mieloblástica aguda 3 o sometidos a trasplante de progenitores hematopoyéticos (TPH) 4. Recientemente, se ha publicado un estudio prospectivo de pacientes con trasplante autólogo, en su mayoría con mieloma múltiple como patología de base, con infección por VRS 5. Sin embargo, sólo se han publicado 2 casos de neumonía por VRS en pacientes con LLC tratados con análogos de purina como el nuestro 6,7.
En nuestra paciente hay que destacar la ausencia de cuadro catarral previo, dado que en otros grupos de pacientes inmunodeprimidos 8 se ha documentado que más del 80% de los pacientes que desarrollan neumonía presentaban en los 2 días previos a su desarrollo síntomas catarrales. Esto permite distinguirlo de infecciones por citomegalovirus más prevalentes en estos pacientes 9. También es así en los 2 casos descritos de neumonía por VRS en pacientes con LLC 7,8.
Reseñamos también la positividad en el cultivo del exudado nasofaríngeo de nuestro paciente con la negatividad del cultivo viral del LBA a pesar de la existencia de patología pulmonar en el TCAR y la ausencia de tratamiento específico. En los otros 2 casos descritos en la literatura médica, el VRS era aislado en el LBA. Así, Englund 10 encontró que en pacientes inmunodeprimidos la detección rápida de antígenos del VRS dependía del origen de la muestra, y era mayor en el LBA (89%) que en el aspirado nasofaríngeo (15%).
En el tratamiento de la infección por VRS en pacientes inmunodeprimidos no hay ensayos controlados, prospectivos y aleatorios. Los tratamientos utilizados han sido la ribavirina intravenosa e inhalada, las inmunoglobulinas inespecíficas y aquellas con concentraciones elevadas de anticuerpos anti-VRS, el anticuerpo monoclonal anti-VRS (palivizumab) y la inmunoterapia celular adoptiva con linfocitos. La mayoría de los datos publicados provienen de series de casos de pacientes sometidos a TPH, donde se evalúan los distintos tratamientos. La ribavirina intravenosa es ineficaz para reducir la mortalidad en caso de neumonía asociada a VRS en pacientes con TPH 11 y además su utilización está limitada por la aparición de anemia hemolítica. Con la ribavirina inhalada se han documentado supervivencias en pacientes con neumonía muy dispares, entre 31-100% 9,10, lo que se relaciona con la utilización precoz y la coexistencia o no de insuficiencia respiratoria al inicio del tratamiento. No debemos olvidar el riesgo de teratogenicidad de esta forma de administración para el personal sanitario. La asociación de ribavirina con inmunoglobulinas se ha utilizado en pacientes con TPH. En aquéllos con síntomas limitados al tracto respiratorio superior 12 su utilización permitía que el 71% no tuvieran progresión de la enfermedad. En aquéllos con neumonía en fase precoz 13 la mortalidad era del 33%, que parece inferior a la documentada con la utilización de ribavirina en monoterapia. Boeckh et al 14 en una serie de casos de TPH demuestran un buen resultado con la asociación de ribavirina y palizumab, con una supervivencia al mes en los pacientes con neumonía por VRS del 83%. Sin embargo, en el último año Anaissie et al 6 han observado que los pacientes con cáncer, en su mayoría mielomas sometidos a trasplante autólogo, tienen con frecuencia cultivos nasofaríngeos positivos para VRS (hasta el 37%) y que su presencia no aumenta la morbimortalidad durante la fase peritrasplante, a pesar de no administrar tratamiento antiviral específico.
En nuestro caso se optó por no administrar tratamiento antivírico dada la buena situación de la paciente, los efectos secundarios de la medicación que se iba a utilizar y la falta de datos concluyentes sobre la utilidad de la misma en este grupo de pacientes.
Con todo lo anterior, las infecciones virales han de ser consideradas como causa de infección respiratoria en los pacientes con LLC en tratamiento con análogos de purina y, por tanto, procesar todas las muestras para cultivo viral, aunque a priori el rendimiento de las mismas sea bajo. Antes de instaurar un tratamiento específico se evaluará el grado de inmunosupresión, la gravedad de la infección respiratoria y los efectos secundarios de la pauta elegida. Si se inicia un tratamiento específico anti-VRS, éste debe ser instaurado de forma precoz. En pacientes con infecciones leves y poca inmunosupresión no está claro que la ribavirina inhalada en monoterapia o asociada a inmunoglobulinas o anticuerpos monoclonales mejore la morbimortalidad.
Es de obligado cumplimiento establecer un aislamiento de contacto y respiratorio del paciente con sospecha de infección viral, en espera del resultado de los cultivos para evitar la aparición de brotes nosocomiales.
Correspondencia: Dra. Carmen Díaz-Pedroche.
Unidad de Enfermedades Infecciosas. Hospital 12 de Octubre.
Ctra. de Andalucía, km. 5,400. 28041 Madrid. España.
Correo electrónico: carmendiaz@ya.com
Manuscrito recibido el 21-12-2004; aceptado el 20-01-2005