Esta guía ha sido elaborada por un panel de expertos del Grupo de Estudio de Sida. El documento actualiza las recomendaciones existentes sobre los principales tumores no definitorios de sida que afectan al paciente con infección por el VIH. Se analiza el cáncer de pulmón, el carcinoma hepatocelular, el cáncer de canal anal y otras neoplasias menos frecuentes. Su objetivo es familiarizar a los profesionales que atienden a estos pacientes en la prevención, presentación clínica, diagnóstico y cribado de los mismos. En este documento también se incluyen recomendaciones sobre el uso del tratamiento antirretroviral en estos pacientes. Para la valoración de la fuerza de las recomendaciones y calidad de evidencias se han utilizado los criterios de la Infectious Diseases Society of America modificados.
This consensus document has been prepared by a panel of experts appointed by GeSIDA. This paper reviews the recommendations on the most important non-AIDS defining malignancies that can affect patients living with AIDS. Lung cancer, hepatocellular carcinoma, anal carcinoma and other less frequent malignancies such as breast, prostate, vagina or colon cancers are reviewed. The aim of the recommendations is to make clinicians who attend to this patients aware of how to prevent, diagnose and treat this diseases. The recommendations for the use of antiretroviral therapy when the patient develops a malignancy are also presented. In support of the recommendations we have used the modified criteria of the Infectious Diseases Society of America.
En los últimos años han cobrado especial interés en los pacientes con infección por el VIH los eventos no definitorios de sida, y dentro de ellos los tumores no definitorios de sida (TNDS), que actualmente se asocian a una importante morbimortalidad, siendo ya en la actualidad una de las causas más frecuentes de muerte en esta población1–4. En España, según datos comunicados de la cohorte RIS, se diagnosticaron 54 TNDS entre 5.185 pacientes con un seguimiento de tan solo 2años, lo que supone una incidencia de 4,26 (IC95%: 3,26-5,56) por 1.000 pacientes/año, siendo la incidencia de mortalidad por TNDS de 1,57 (IC95%: 1,02-2,42) por 1.000 personas/año5. Los TNDS más frecuentes son el linfoma de Hodgkin (LH), el cáncer de pulmón (CP), el carcinoma hepatocelular (CHC) y el carcinoma de canal anal (CCA)5,6.
ObjetivoEl objetivo de esta guía es familiarizar a los profesionales que atienden a los pacientes con infección por el VIH con la prevención, la presentación clínica y el diagnóstico de los principales TNDS. No pretende realizar una revisión exhaustiva de todos los TNDS que afectan a estos pacientes, ni tampoco abordar las pautas de tratamiento oncológico específico de las neoplasias, a excepción de indicaciones de tratamiento en el CHC y el CCA. Sí hace especial hincapié en la prevención, el cribado de estas neoplasias y el manejo del tratamiento antirretroviral (TAR). No se ha incluido el LH dado que se ha tratado ya en otra publicación asociado al resto de neoplasias linfoides7.
MetodologíaSe incluye en esta guía información sobre el CP, el CHC, el CCA y otras neoplasias menos prevalentes, y se describen las medidas encaminadas a su prevención y diagnóstico precoz. En el último apartado se realizan consideraciones con respecto al TAR en el paciente con infección por el VIH con un TNDS. Dada la poca información proveniente de ensayos clínicos, se han revisado fundamentalmente los estudios observacionales, las revisiones sistemáticas y las guías nacionales e internacionales. Cada apartado de esta guía ha sido realizado por un redactor y revisado por 2 revisores. El documento final ha sido consensuado por todo el panel. En esta guía la fuerza de la recomendación y la gradación de las pruebas que la sustentan se basan en una modificación de los criterios de la Infectious Diseases Society of America (IDSA)8. Según estos criterios, cada recomendación debe ofrecerse siempre (A), en general (B) u opcionalmente (C), y ello basado en la calidad de los datos obtenidos a partir de uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio (i), de uno o más ensayos no aleatorizados o datos observacionales de cohortes (ii) o de la opinión de expertos (iii).
Epidemiología y factores etiopatogénicos que influyen en el desarrollo de los tumores no definitorios de sida en pacientes con infección por el virus de la inmunodeficiencia humanaTras la generalización del TAR ha mejorado considerablemente la supervivencia y la calidad de vida de los pacientes con infección por el VIH, con una drástica reducción de la morbimortalidad y una importante disminución de las infecciones oportunistas (IO) y de los tumores definitorios de sida (TDS)9-11. En estos últimos años, dentro de las patologías emergentes se han incluido los TNDS, que actualmente se asocian a una importante morbimortalidad en esta población5,6. Los TNDS más frecuentes son el LH, el CP, el CCA y el CHC. La incidencia es significativamente más alta que en la población general en el CCA, el CHC, el CP, el melanoma, orofaringe, leucemia, carcinoma colorrectal, carcinoma renal y LH6,12.
Factores etiopatogénicosLos mecanismos implicados en el desarrollo de los TNDS son múltiples y complejos. Por una parte influye el envejecimiento de la población VIH debido a la mayor esperanza de vida que ha supuesto la generalización del TAR, y por otro, la elevada prevalencia de co-infección por virus potencialmente oncogénicos. Entre ellos destacan el virus del papiloma humano (VPH), el virus de la hepatitis B (VHB), el virus de la hepatitis C (VHC) y el virus de Epstein-Barr (VEB), cuyo control puede ser más deficiente dado el compromiso inmune del paciente con infección por el VIH13, por lo que algunos autores han dividido los TNDS en relacionados o no relacionados con infecciones virales14. Otro factor es la alta prevalencia de hábitos tóxicos (tabaco, drogas ilegales, alcohol…) en muchas de las cohortes de pacientes con infección por el VIH13. Por otra parte, la inmunodeficiencia provocada por la infección por el VIH se considera también en muchos estudios factor patogénico, o al menos factor asociado al desarrollo de muchos TNDS, tal como sucede en otros tipos de inmunodeficiencias15. Por último, dado el incremento de los TNDS en la era del TAR, en algún estudio se ha valorado la posibilidad de que dicho tratamiento fuera responsable del incremento de TNDS en los últimos años13. La evidencia de este hecho no se ha podido demostrar en la mayoría de los trabajos publicados, siendo incluso el TAR protector para muchos de ellos al mejorar la inmunodeficiencia13.
Ideas clave- •
Los TNDS son una patología en aumento.
- •
Los pacientes infectados por el VIH tienen un mayor riesgo para el desarrollo de algunas neoplasias y va a depender de:
- -
La edad.
- -
Co-infección por virus oncogénicos (VPH, VHB, VHC, VEB).
- -
Exposición a tóxicos: alcohol, tabaco.
- -
Inmunodeficiencia.
- -
El CP es la tercera neoplasia más frecuente en los pacientes con infección por el VIH, solamente superada por los TDS16.
El tabaquismo es el principal agente etiológico para el desarrollo de CP, y la prevalencia de fumadores en población infectada por el VIH es mayor que en la población general17. No obstante, se ha demostrado que el propio VIH se comporta como un factor de riesgo independiente para el desarrollo de CP15. Algunos estudios epidemiológicos han encontrado mayor incidencia de CP a edades más precoces en los pacientes con infección por el VIH6,12. Al igual que en población general, existe mayor incidencia entre el sexo masculino. Dentro de las estirpes histológicas, el subgrupo de los no microcíticos es el más frecuente, siendo el adenocarcinoma el tipo más común17.
Las manifestaciones clínicas van a depender de la extensión de la enfermedad en el momento del diagnóstico. Los síntomas y signos más frecuentes son similares a los presentes en la población general (tos, dolor torácico, disnea, hemoptisis y síndrome constitucional).
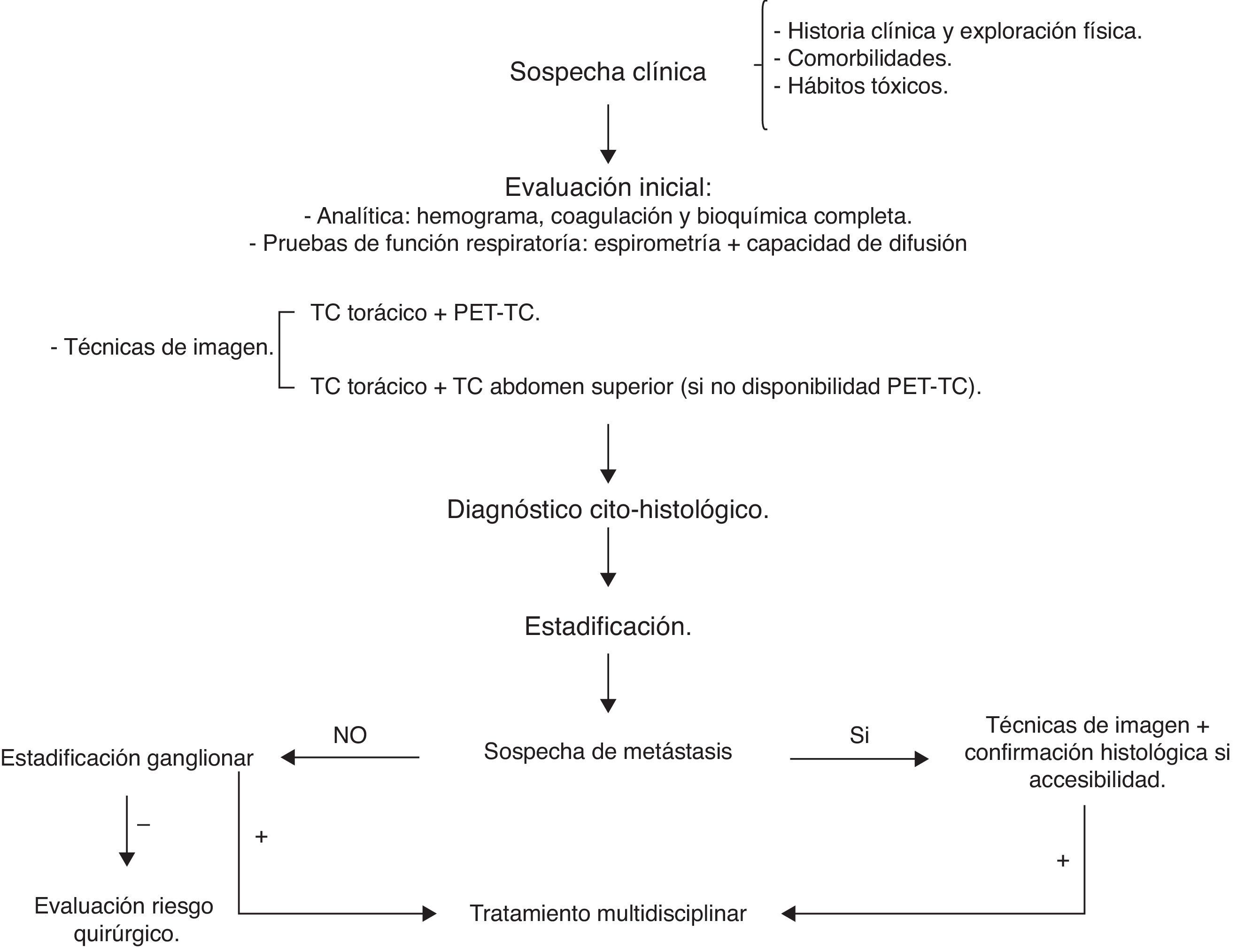
Ante la sospecha de CP debemos realizar estudios complementarios que nos permitan confirmar el diagnóstico, realizar la estadificación de la enfermedad y determinar la actitud terapéutica, en base a lo cual podamos plantear el pronóstico (fig. 1)18. La técnica de imagen inicial será la tomografía computarizada (TC) torácica y, siempre que esté disponible, realizaremos una tomografía por emisión de positrones (PET)-TC. Para llevar a cabo el estudio de extensión, realizaremos un TC de abdomen superior y resonancia nuclear magnética (RMN) o TC craneal, en los casos en los que no podamos realizar un PET-TC. Las pruebas de función pulmonar deberían realizarse a todos los pacientes con riesgo de presentar enfermedades respiratorias, y están especialmente indicadas en los candidatos a un tratamiento curativo19. Para realizar el diagnóstico histológico debemos utilizar la técnica menos invasiva que sea más rentable. Una vez realizado el diagnóstico, estadificaremos la enfermedad según la 7.ª edición de la clasificación TNM y evaluaremos las opciones terapéuticas18,19.
Los pacientes con infección por el VIH tienen peor pronóstico, debido a la presentación en estadios más avanzados al diagnóstico y peor estado general, lo que predispone a menores opciones terapéuticas efectivas y menor supervivencia20. Si la infección por el VIH está controlada y existe una buena situación basal, el tratamiento del CP será el mismo que para la población general, teniendo en cuenta la posibilidad de interacción farmacológica con el TAR.
La principal medida en la prevención del CP es la deshabituación tabáquica, basada en el consejo activo y la terapia sustitutiva con nicotina. Actualmente se ha propuesto el uso de la TC de baja radiación como método de cribado para población de alto riesgo.
Ideas clave y recomendaciones- •
El CP es el TNDS más frecuente en pacientes con infección por el VIH.
- •
El CP en pacientes con infección por el VIH se presenta en edades más tempranas y en estadios más avanzados.
- •
El tratamiento en estos pacientes debe ser similar al de la población general (C-II).
- •
La deshabituación tabáquica es la principal medida de prevención del CP (A-II).
- •
En la actualidad, la TC de baja radiación se propone como método de cribado para el CP en poblaciones de alto riesgo (B-II).
El CHC en el paciente infectado por el VIH es un fenómeno clínico asociado mayoritariamente en nuestro medio a la co-infección por el VHC. Así, en un registro de los casos de CHC diagnosticados en pacientes infectados por el VIH en 26 hospitales españoles hasta diciembre de 2012, de un total de 182 casos, 167 (92%) ocurrieron en pacientes coinfectados por el VHC21. Por el momento no se ha demostrado que la frecuencia de CHC sea mayor en los pacientes coinfectados que en los pacientes monoinfectados por el VHC. Sin embargo, los últimos datos disponibles de CHC en pacientes infectados por el VIH en España han confirmado que se está produciendo un aumento significativo del número de casos en los pacientes coinfectados. Así, en un registro retrospectivo de CHC en pacientes infectados por el VIH de 18 hospitales de Andalucía y la Comunidad Valenciana, de 82 CHC diagnosticados entre 1999 y 2010, 74 (90%) fueron diagnosticados a partir del 200422. De esta forma, la incidencia de CHC en pacientes coinfectados pasó de 0,2 a 2,8 casos por 1.000 personas/año del 2000 al 200922.
La presentación clínica del CHC en el paciente infectado por el VIH no difiere de la forma de presentación en otros escenarios clínicos, oscilando desde el hallazgo incidental de una lesión hepática en una prueba de imagen a la aparición de síntomas. Sin embargo, se ha sugerido que el CHC en los pacientes infectados por el VIH es con más frecuencia sintomático, de presentación múltiple o invasiva, y se diagnostica en estadios más avanzados que en los pacientes sin infección por el VIH23.
El diagnóstico del CHC debe basarse en la radiología y la histología. La presencia de un patrón radiológico de hipercaptación arterial seguido de un «lavado» de contraste es muy específica del CHC, por lo que una lesión mayor de 1cm en la que se documente este patrón en una única prueba de imagen dinámica con contraste en un paciente con cirrosis debe considerarse un CHC sin necesidad de estudios adicionales24. En caso de que ni la TC ni la RNM muestren dicho patrón radiológico típico o el paciente no presente una cirrosis hepática asociada, será necesaria una biopsia del nódulo para confirmar el diagnóstico.
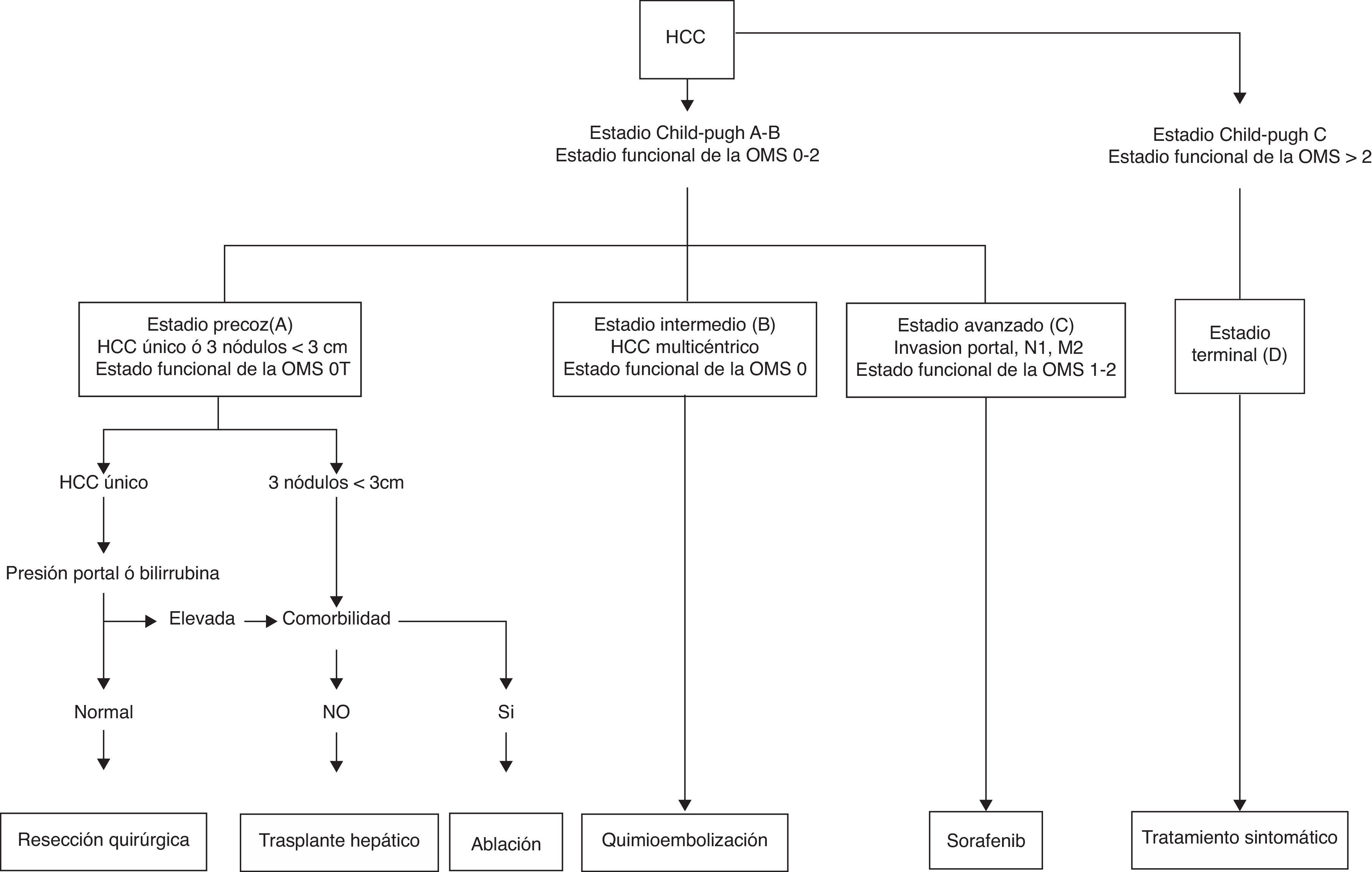
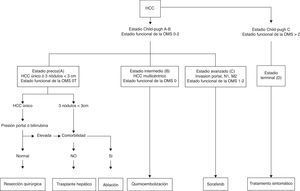
La clasificación Barcelona Clinic Liver Cancer (BCLC) (fig. 2) es probablemente el sistema de estadificación de CHC más difundido, e integra aspectos relacionados con el tamaño del tumor, la presencia de invasión vascular y/o metástasis extrahepáticas, la función hepática y la situación funcional del paciente25. Los pacientes en estadio A o inicial se benefician de tratamientos potencialmente curativos, como la resección hepática, el trasplante y la ablación local con alcohol o por radiofrecuencia. Los pacientes en estadio B o C pueden beneficiarse de tratamientos no curativos, como la quimioembolización transarterial o el sorafenib, respectivamente. Los pacientes en estadio D o terminal no se benefician de ningún tratamiento.
Por el momento, el pronóstico del CHC en los pacientes coinfectados sigue siendo muy pobre, principalmente porque el diagnóstico continúa realizándose en estadios avanzados en los que no hay opciones de tratamiento efectivo.
Hasta el momento, el beneficio de las estrategias de cribado del CHC en los pacientes coinfectados por VIH/VHC no ha sido demostrado. En nuestra opinión, cualquier paciente infectado por el VIH con cirrosis hepática, independientemente de la etiología de la misma, debería iniciar en el momento del diagnóstico de la cirrosis un programa de cribado sistemático de CHC mediante la realización de una ecografía semestral. Los datos actuales desaconsejan el uso de la alfa-fetoproteína con este propósito dada su baja sensibilidad22. La principal medida para prevenir la aparición del CHC es la erradicación del VHC con el tratamiento. Sin embargo, pueden producirse casos de CHC a pesar de la consecución de respuesta viral sostenida (RVS)21, por lo que las medidas de cribado no deben suspenderse si el paciente presenta una hepatopatía crónica establecida.
Ideas clave y recomendaciones- •
La incidencia de CHC está aumentando en los pacientes infectados por el VIH y el VHC.
- •
Se recomienda el cribado de CHC en los pacientes con cirrosis (A-I).
- •
El cribado se basará en la realización de una ecografía semestral (A-II).
- •
No debe suspenderse el cribado en los pacientes coinfectados por el VHC que alcancen RVS con el tratamiento (B-II).
- •
El diagnóstico de CHC podrá establecerse en pacientes con cirrosis ante la presencia de un nódulo >1cm con un patrón radiológico típico en una prueba dinámica con contraste (A-II).
- •
Se usará la clasificación BCLC para decidir la mejor opción de tratamiento (A-II).
La incidencia de carcinoma de canal anal (CCA) en pacientes VIH es superior a la de la población general, llegando a ser en el grupo de hombres que tienen sexo con hombres (HSH) de hasta 144 casos/100.000 personas/año; por ende, es una de las enfermedades no definitorias de sida más frecuentes en la actualidad12. Entre los factores de riesgo implicados en la aparición de displasia anal en pacientes con infección por el VIH destacan la infección crónica por el VPH, el tabaquismo, bajas cifras de linfocitos CD4 y ser HSH26.
Clasificación de la displasia de canal analPara la clasificación citológica de la mucosa anal se emplea la de Bethesda27, que clasifica las citologías en: normal o sin cambios celulares; células escamosas atípicas de significado incierto (ASCUS) o que no pueden excluir lesión intraepitelial de alto grado (ASC-H); lesión intraepitelial escamosa de bajo grado (LSIL), de alto grado (HSIL), y carcinoma escamoso, o en raras ocasiones adenocarcinoma. Igualmente los resultados de las biopsias de la mucosa anal se clasifican como: normal; neoplasia intraepitelial anal de grado i o leve (AIN-I); de grado ii o moderado (AIN-II); de grado iii o grave (AIN-III), o carcinoma invasivo28. Recientemente se está empelando la nomenclatura de Bethesda para las lesiones anogenitales revisada en 2012, incluyendo la P16 para la definición de alto grado. De ahí que se utilicen las siguientes abreviaturas LSIL (AIN I) y HSIL (AINII, AINIII)29.
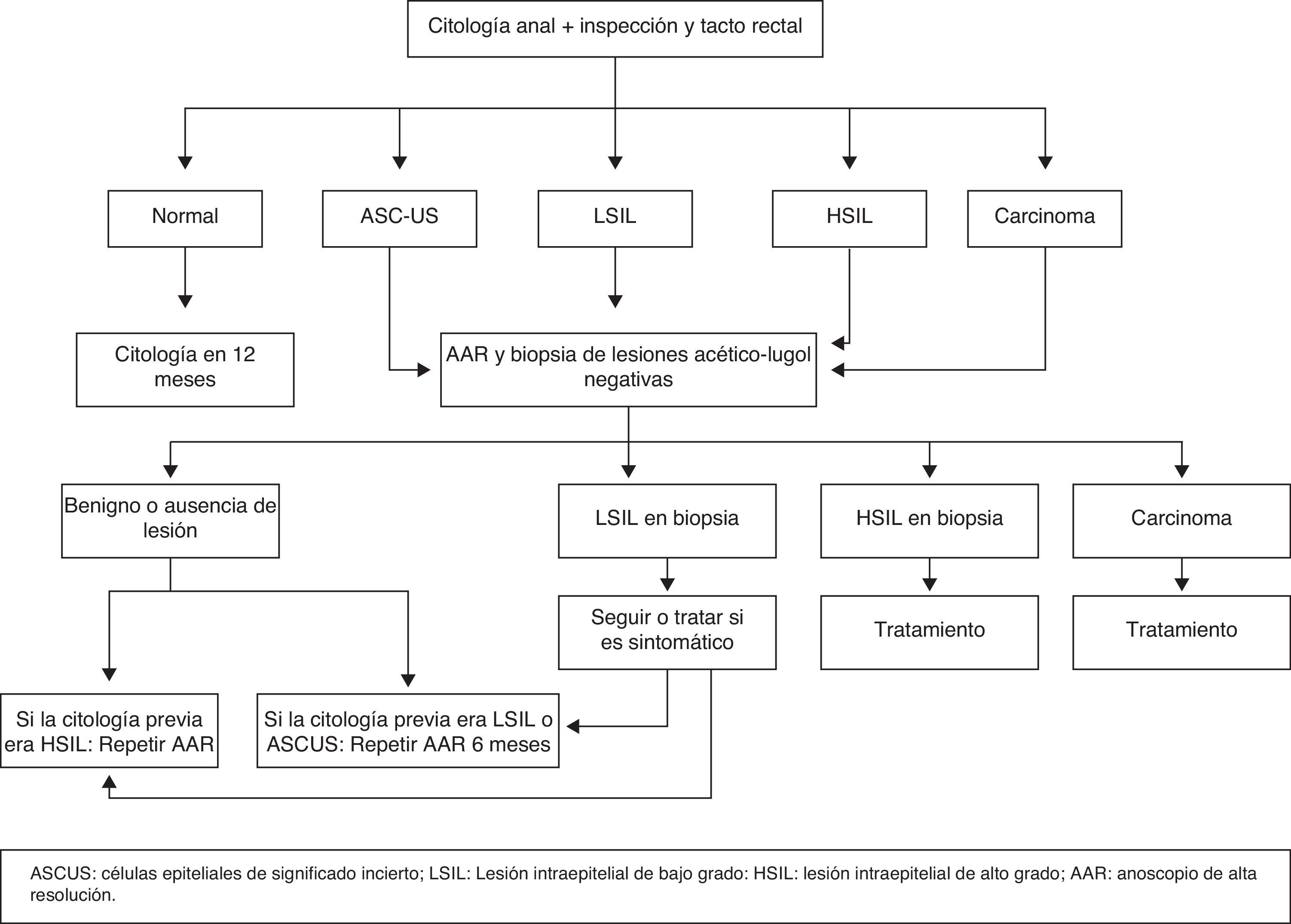
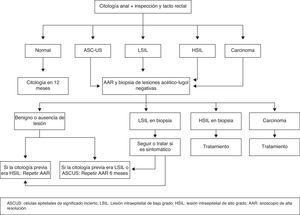
Cribado de carcinoma de canal analLas recomendaciones para el cribado de lesiones escamosas HSIL y/o CCA en pacientes VIH positivos (HSH y mujeres con antecedentes de carcinoma de cérvix o de displasia de alto grado [CIN-II/CIN-III], o condilomas) contemplan la realización anual de citología en medio líquido, previa inspección de la zona perianal, y tacto rectal posterior a la citología. En caso de cualquier grado de displasia (LSIL, HSIL o ASCUS) se recomienda una anoscopia de alta resolución (AAR) con biopsia de todas las lesiones que tras la tinción con ácido acético y lugol cambien de coloración30.
En la figura 3 aparece reflejado el algoritmo de cribado, diagnóstico y seguimiento de las lesiones displásicas de la mucosa anal.
Tratamiento de lesiones de alto gradoAnte el diagnóstico de lesión anal de alto grado está indicado tratamiento y seguimiento de la lesión que evite progresión a carcinoma. De forma general, cualquiera de los tratamientos aplicados a las lesiones de alto grado comparten 2 características: tener eficacia moderada y necesitar re-tratamientos, por una tasa elevada de recidivas. Una vez tratada la lesión de alto grado, debe repetirse la AAR para toma de biopsia antes de 6 meses; en caso de lesión de bajo grado (AIN 1) o normalidad, repetirla en un año.
En el tratamiento de las lesiones de mucosa anal es la coagulación mediante infrarrojos con AAR la más ampliamente empleada, e indicada en el tratamiento de condilomas, y HSIL recurrente y multifocal, contraindicada en caso de cáncer o fotosensibilidad severa; electrocauterización con AAR en HSIL extensa y multifocal, cuyo principal inconveniente es la formación de humo que puede aerosolizar VPH; fulguración con láser de CO2, indicada en pacientes con HSIL y alto riesgo quirúrgico, cuyos resultados en cuanto a tasa de curación, sobre todo en pacientes con lesiones extensas, son peores a los obtenidos con las 2 técnicas previas. En cuanto a los tratamientos médicos tópicos disponibles, del que se tiene mayor experiencia y efectividad es el imiquimod para HSIL multifocal o extensa, o como tratamiento adyuvante31. Por último, la exéresis quirúrgica, que en caso de HSIL como única técnica empleada es controvertida, pero cuando se combina con infrarrojos se han llegado a conseguir tasas de curación de hasta el 78%, con progresión a carcinoma de tan solo el 1,2% de los casos32.
Medidas de prevenciónEl empleo del condón puede reducir la adquisición de infección por VPH y regresión de las lesiones anogenitales como los condilomas; esta protección no es total, debido a que el preservativo deja zonas sin proteger, pero es una medida coste-efectiva, y a diferencia de las vacunas del VPH protege frente a todos los genotipos y frente a otras enfermedades de transmisión sexual33. Otra de las medidas a tener en cuenta a la hora de la prevención de HSIL y cáncer anal incluye la administración de la vacuna cuadrivalente del VPH, pero por el momento no hay ningún ensayo clínico realizado en pacientes VIH en el que se haya demostrado este efecto protector en la mucosa anal.
Ideas clave y recomendaciones- •
El CCA es uno de los TNDS más frecuentes.
- •
El cribado de lesiones premalignas y/o CCA en pacientes con infección por el VIH tiene una buena relación coste-beneficio (B-II).
- •
La citología requiere de marcadores subrogados como la PCR del VPH que aumenten la sensibilidad diagnóstica de dichas lesiones (B-II).
- •
Existen diferentes opciones de tratamiento para LAGM que pueden hacerse ambulatoriamente e incluso aplicarse por el propio paciente (B-II).
- •
El método más rentable para prevenir la aparición de LAGM y/o CCA sería la combinación del uso del condón y vacunación del VPH (B-III).
Los casos de carcinoma de mama publicados en mujeres con infección por el VIH son escasos. No existe un riesgo mayor que en la población general, por lo que la detección precoz se basa, al igual que en el resto de las mujeres, en la realización de mamografías periódicas, medida que en la población general ha demostrado una disminución en la mortalidad. Una vez diagnosticado el cáncer, su tratamiento no difiere del empleado en las mujeres VIH negativas, por lo que debe realizarse cirugía, radioterapia y/o quimioterapia con fines curativos, iniciando TAR de forma precoz12,34.
El carcinoma de próstata no presenta una incidencia aumentada en pacientes con infección por el VIH, y en algunos estudios incluso se ha llegado a observar una asociación inversa entre su presencia y la infección por el VIH. Según Shiels et al.12, la explicación más sencilla de esta aparente disminución es la menor frecuencia de determinación del antígeno prostático específico en los varones con infección por el VIH. Las manifestaciones clínicas y el tratamiento son los mismos que en la población VIH seronegativa12,35.
El riesgo relativo de desarrollar cáncer de colon en la población con infección por el VIH no está establecido, y los resultados en diversas series son contradictorios tanto en lo referente a la incidencia como a la edad de presentación. Las manifestaciones clínicas, técnicas de cribado y tratamiento son iguales que en la población general36.
La neoplasia vulvar y vaginal intraepitelial son precursoras del cáncer de vagina y vulva, y son más frecuentes en las mujeres con infección por el VIH27. La actitud terapéutica y el algoritmo diagnóstico son similares a los que se emplean en la neoplasia de cérvix37,38.
Ideas clave y recomendaciones- •
El cribado, el diagnóstico y el tratamiento del cáncer de mama, del cáncer de próstata y del cáncer de colon en el paciente con infección por VIH son similares a la población general (A-II).
- •
El algoritmo diagnóstico y la actitud terapéutica de la neoplasia vulvar y vaginal intraepitelial son similares a los que se emplean en la neoplasia de cérvix (B-II).
El TAR es un pilar fundamental en el tratamiento de pacientes con infección por el VIH con sarcoma de Kaposi o linfoma no Hodgkin3,4. En análisis de grandes cohortes el tener carga viral (CV) detectable y un recuento bajo de linfocitos CD4+ se asocia a un mayor riesgo de padecer algunos TNDS10,39,40. Todo ello sugiere que recibir TAR, tener la CV del VIH suprimida y mantener un recuento de linfocitos CD4+ elevados tiene un efecto protector no solamente con un menor riesgo de TDS sino también de muchos TNDS, sobre todo los que se asocian a infecciones virales crónicas14. Por otra parte, los pacientes con un TNDS que son sometidos a quimioterapia o radioterapia tienen riesgo de inmunodepresión y de disminución del recuento de los linfocitos CD4+41,42, lo que justificaría el inicio de TAR en pacientes con TNDS que van a iniciar tratamiento con quimioterapia o radioterapia. Como consideración general, los pacientes con TNDS, si no están con TAR, deben empezarlo tan pronto como sea posible.
Al diseñar la pauta de TAR en pacientes con un TNDS que van a ser sometidos a quimioterapia es muy importante considerar el perfil de toxicidad y las posibles interacciones farmacocinéticas (principalmente los fármacos que se metabolizan por la vía del CYP450) con los fármacos antineoplásicos43. Tanto los inhibidores de proteasa potenciados (IP/r) como los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN) afectan al sistema CYP450 del que son sustratos numerosos agentes antineoplásicos, por lo que la interacción con los fármacos antirretrovirales (FARV) puede afectar tanto a la eficacia como al perfil de toxicidad43,44. Se aconseja consultar páginas web sobre interacciones que se actualicen con regularidad para evitar incrementar la toxicidad, disminuir la eficacia y poder optimizar al máximo el TAR.
Entre los FARV, son los IP/r los que presentan interacciones farmacológicas más importantes. Así, se ha descrito una mayor frecuencia de infecciones graves y neutropenia severa en pacientes con infección por el VIH y linfoma tratados con quimioterapia que recibían IP/r en comparación con los que recibían ITINAN45. Por otro lado, algunos IP/r y la rilpivirina alargan el QT, por lo que podrían potenciar este efecto cuando se usan con muchos fármacos anticancerosos44. En un estudio recientemente comunicado los IP/r presentaron mayor toxicidad, más interacciones y menor eficacia virológica que los ITINAN o raltegravir (RAL) en pacientes con infección por el VIH y cáncer46. Por todo ello, los IP/r deben evitarse a ser posible en los pacientes que van a ser sometidos a quimioterapia, y en general evitar aquellos FARV en pacientes que van a recibir agentes quimioterápicos con los cuales se superponen toxicidades. Actualmente el RAL, por sus características farmacológicas, su excelente tolerancia y sus mínimas interacciones debe ser el fármaco de elección siempre que sea posible en pacientes que reciban quimioterapia47.
Profilaxis de infecciones oportunistas en pacientes con infección por el virus de la inmunodeficiencia humana y neoplasiasLa quimioterapia y la radioterapia incrementan el riesgo de infección tanto por la mielosupresión que producen como por la disminución del recuento de linfocitos CD4+ (un 30-50% con respecto al basal), que no se recupera hasta pasados 6-12 meses tras finalizar el tratamiento41,42. A esto se añade la propia infección por el VIH y los fármacos usados para tratar las complicaciones del mismo. Todos estos factores hacen que el paciente con infección por el VIH con cáncer tenga un riesgo añadido de IO48. Se recomienda profilaxis frente a Pneumocystis jirovecii en aquellos pacientes con un recuento de linfocitos CD4+ menor de 200 células/μl, y debería ser considerado en pacientes con recuento más elevado que van a iniciar quimioterapia o radioterapia23. El fármaco de elección es sulfametoxazol-trimetoprim, el cual reduce también el riesgo de otras infecciones, como toxoplasmosis, salmonella o neumonías bacterianas49. El resto de profilaxis se hará siguiendo las recomendaciones actualmente en vigor tanto en población VIH49 como en población general.
Ideas clave y recomendaciones- •
En pacientes con TNDS que no estén con TAR, este ha de empezarse tan pronto como sea posible (A-III).
- •
Se recomienda valorar las posibles interacciones entre los FARV y la terapia antineoplásica (B-I).
- •
El RAL por sus características farmacológicas, su excelente tolerancia y sus mínimas interacciones, debe ser el FAR de elección, siempre que sea posible, en pacientes que reciben quimioterapia (B-II).
- •
Se recomienda profilaxis frente a Pneumocystis jirovecii en pacientes con un recuento de CD4+ menor de 200 células/μl (A-I), y se debe considerar en pacientes con mayor número de CD4+ que vayan a iniciar tratamiento con quimioterapia (B-II).
Con el fin de evitar y/o minimizar los posibles conflictos de intereses, los coordinadores, autores y revisores que forman parte de este panel de expertos han realizado una declaración formal de intereses en la que queda constancia explícita de que ninguno de ellos tiene ningún conflicto de intereses en la realización de este documento.
AgradecimientosAgradecemos sinceramente los comentarios al documento efectuados por los doctores Juan Berenguer, Beatriz Hernández Novoa y José Antonio Pérez Molina.
Coordinadores
Jesús Santos, Hospital Universitario Virgen de la Victoria, Málaga, e Instituto de Investigación Biomédica de Málaga (IBIMA).
Eulalia Valencia, Hospital Universitario La Paz, Madrid.
Redactores
Vicente Estrada, Hospital Clínico Universitario San Carlos, Madrid.
Carmen Hidalgo, Hospital Virgen de las Nieves, Granada.
Nicolás Merchante, Hospital Universitario de Valme, Sevilla.
Miriam Torres, Hospital San Pedro de Alcántara, Cáceres.
Revisores
Julia del Amo, Centro Nacional de Epidemiología. Instituto de Salud Carlos III, Madrid.
José Ángel Arranz, Hospital Gregorio Marañón, Madrid.
Pablo Bachiller, Hospital Río Hortega. Valladolid.
José Ramón Blanco, Hospital San Pedro, Logroño.
Alex Forner, Hospital Clínic, Barcelona, IDIBAPS. Universitat de Barcelona. Centro de Investigación Biomédica en Red en el Área temática de Enfermedades Hepáticas y Digestivas (CIBERehd).
Mar Masía, Hospital General Universitario de Elche, Elche, Alicante.
Antonio Ocampo, Hospital Universitario Xeral, Vigo, Pontevedra.
Francisco Rodríguez-Arrondo, Hospital Universitario Donostia, San Sebastián.
Rafael Rubio, Hospital 12 de Octubre, Madrid.
Julio Sánchez-de Cos, Hospital San Pedro de Alcántara, Cáceres.
M. Jesús Téllez, Hospital Clínico Universitario San Carlos, Madrid.
Pompeyo Viciana, Hospital Universitario, Virgen del Rocío, Sevilla.