En nuestro medio, el uso de nevirapina en la embarazada infectada por el VIH se desaconseja por su potencial hepatotoxicidad. Existen pocos datos sobre dicha toxicidad en el neonato no infectado por el VIH y expuesto a este fármaco durante la gestación. Se pretende determinar el grado de hepatotoxicidad en el recién nacido expuesto a nevirapina y VIH durante la gestación.
MétodosEstudio transversal observacional multicéntrico en una cohorte de recién nacidos hijos de madre VIH positivas no infectados en los que se revisó la primera determinación de alanina aminotransferasa antes de las 6semanas de vida. Se establecieron 2 grupos según hubieran estado expuestos o no a nevirapina durante la gestación. La hepatotoxicidad se clasificó según el AIDS Table for Grading the Severity of Adult and Pediatric Adverse Events (DAIDS).
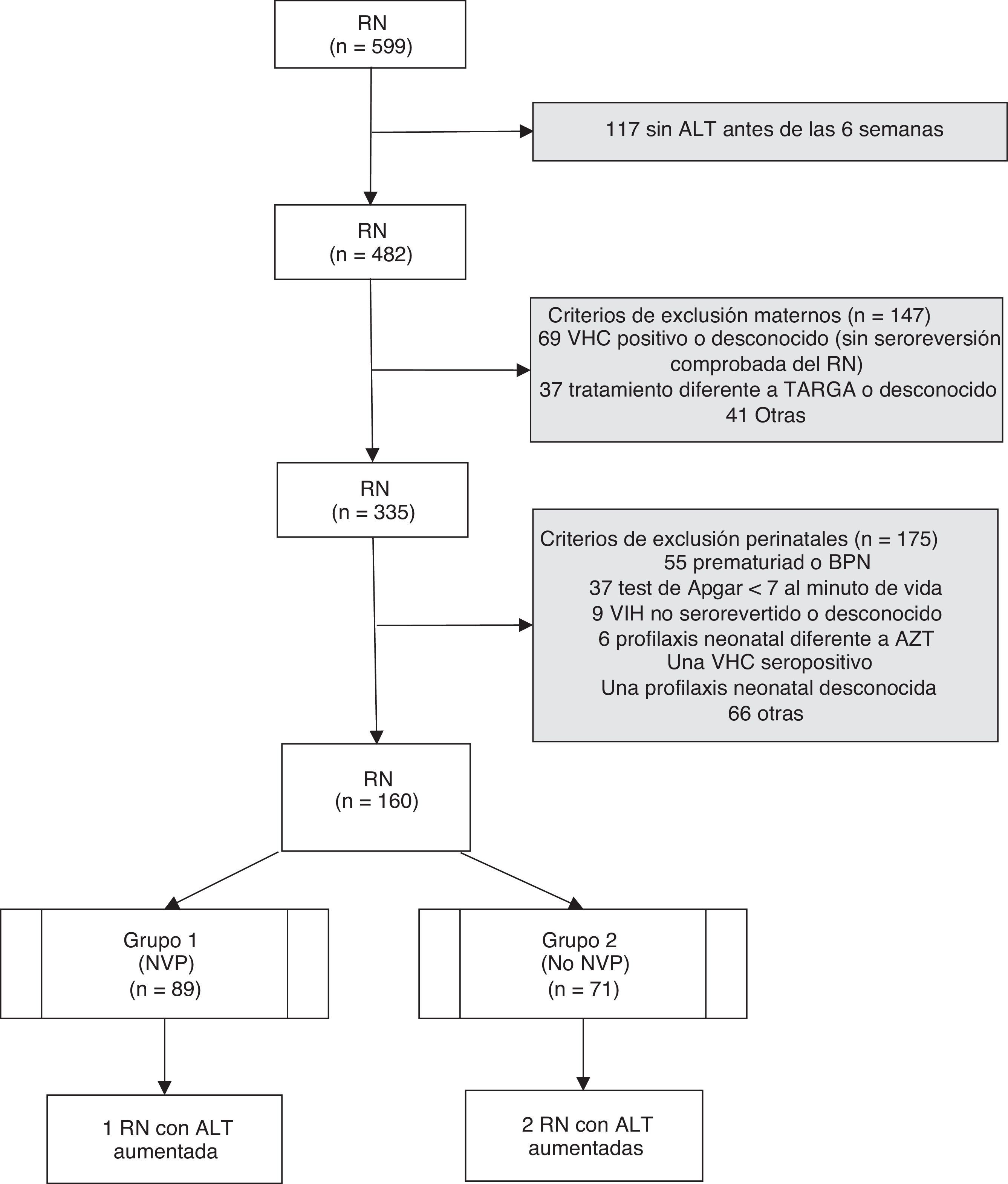
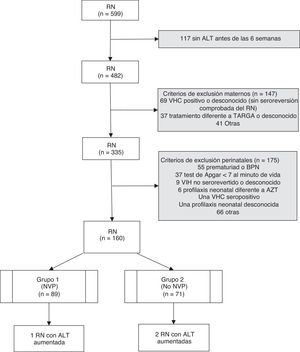
ResultadosSe incluyeron 160 recién nacidos de 159 gestaciones (88 expuestos a tratamientos combinados con nevirapina y 71 a inhibidores de proteasa). No se observó ningún caso de hepatotoxicidad según la Grading Table del DAIDS, pero se registraron 2 casos de ALT superior a los valores de normalidad (2,8%, IC95%: 0,3-9,8) en los no expuestos a nevirapina y uno (1,1%, IC95%: 0,0-6,1) en el grupo expuesto (p=0,585).
ConclusionesLa ausencia de diferencias entre ambos grupos sugiere que los regímenes de tratamiento antirretroviral de gran actividad que incluyen nevirapina durante la gestación no asocian un riesgo aumentado de hepatopatía en el lactante con respecto a otros regímenes.
The use of nevirapine in HIV-infected pregnant women is discouraged due to its potential to cause hepatotoxicity. There is limited information available on the toxicity in non-HIV infected newborn exposed to this drug during pregnancy. The aim of the study is to determine the extent of hepatotoxicity in the newborn exposed to nevirapine and HIV during pregnancy.
MethodsA cross-sectional, observational, multicenter study was conducted on a cohort of healthy infants born to HIV-infected mothers, in whom the first determination of alanine aminotransferase (ALT), before 6weeks of age, was collected. Patients were allocated to 2groups according to exposure to nevirapine during pregnancy. Hepatotoxicity was rated according to the AIDS Table for Grading the Severity of Adult and Pediatric Adverse Events (DAIDS).
ResultsThis study included 160newborns from 159pregnancies (88exposed to nevirapine-based regimens and 71 exposed to protease inhibitors-based therapies). No cases of hepatotoxicity were observed according to the DAIDS Table for Grading. Two cases of ALT above normal values (2.8%; 95%CI: 0.3-9.8%) were observed in patients not exposed to nevirapine, and one case (1.1%; 95%CI: 0.0-6.1%) in the group exposed to nevirapine (P=.585).
ConclusionThe lack of differences between groups suggests that highly active antiretroviral treatment regimens including nevirapine administered during pregnancy do not involve a higher risk of liver disease compared to other treatment combinations.
Nevirapina (NVP) es un inhibidor de la transcriptasa inversa no análogo de nucleósido con actividad frente al virus de la inmunodeficiencia humana tipo1 (VIH-1). Se ha demostrado su eficacia, sola o en combinación con otros fármacos, para la profilaxis de la transmisión vertical (TV) del VIH1,2. NVP ha sido ampliamente utilizada en países de recursos limitados, en los que se calcula que más de un millón de mujeres y sus recién nacidos (RN) han recibido este fármaco como parte del tratamiento para evitar la trasmisión del VIH3. Las Guías de la Organización Mundial de la Salud (OMS) para países de recursos limitados incluyeron hasta 2013 NVP como parte del tratamiento antirretroviral de gran actividad (TARGA) en gestantes, adultos y niños infectados, y tanto las anteriores como las actuales incluyen NVP como profilaxis posnatal de la TV del VIH en el RN. Las Guías de 2010 indicaban la profilaxis con NVP hasta un mes después de interrumpir la lactancia materna, o en niños alimentados con lactancia artificial o tratadas con TARGA hasta las 4-6 semanas de vida (opciónA). La Guía OMS 2013 determina que la profilaxis posnatal puede realizarse con zidovudina (AZT) o NVP durante las primeras 4-6semanas, independientemente del tipo de lactancia4-6. Pautas cortas de tratamiento con NVP en dosis única en el momento del parto, sola o en combinación con AZT o AZT más lamivudina (3TC), han demostrado ser eficaces y reducir la tasa de TV de la infección por VIH1,2,7.
No obstante, la adición de NVP en el parto y al RN en gestantes tratadas con TARGA en países desarrollados no ha demostrado un beneficio adicional en relación con las gestantes y RN que no recibieron NVP8. La utilización de NVP en mujeres no inmunodeprimidas, con recuentos de linfocitos CD4>250/mm3, se ha asociado a hepatotoxicidad, habiéndose registrado casos graves asociados a mortalidad en gestantes9-11. Ello motivó que desde el año 2005 exista una alerta de la FDA12, y posteriormente de otras agencias del medicamento, que contraindica su uso en embarazadas que no lo recibían previamente con cifras de linfocitos CD4+ superiores a 250/mm3. En nuestro medio el uso de NVP como parte del tratamiento antirretroviral o profilaxis de la TV en gestantes infectadas se limita en los últimos años a las embarazadas que ya lo recibían previamente y como parte del tratamiento combinado (AZT, 3TC y NVP) administrado al RN hijo de madre con carga viral (CV) detectable en el parto y elevado riesgo de infección13.
Aun cuando NVP atraviesa la placenta y tiene una semivida y eliminación prolongadas en el RN14, hay poca información en relación con la potencial hepatotoxicidad en el neonato expuesto a la misma, durante el embarazo, el parto y ocasionalmente en el periodo posnatal. Los datos disponibles se basan en los obtenidos de pautas con dosis única de NVP administradas tanto a la madre como al RN, y determina que no existe mayor riesgo de efectos adversos neonatales comparados con el placebo u otras pautas terapéuticas15-19.
El presente trabajo fue diseñado con el fin de determinar el grado de hepatotoxicidad del RN expuesto de forma crónica a NVP gestacional y VIH, mediante la determinación de alanina aminotransferasa sérica (ALT) en hijos de madre con infección por el VIH, no infectados, en 2 hospitales de referencia de Barcelona (España). Datos previos de nuestro grupo16 indicaban que la exposición a NVP prenatal no se asociaba a hepatotoxicidad significativa en los RN no infectados, por lo que el presente estudio pretende validar estos resultados mediante un proyecto multicéntrico con criterios de selección más estrictos.
MétodosEstudio transversal observacional multicéntrico en un conjunto de RN de madres infectadas por el VIH y en tratamiento con TARGA durante el embarazo, en seguimiento en el Hospital Universitari Vall d’Hebron y en el Hospital Universitari Sant Joan de Déu (Barcelona, España) desde enero de 1998 a enero de 2013. Se recopiló la primera determinación de ALT del RN siempre que se hubiera realizado antes de las 6semanas de vida, definiéndose hepatitis como la elevación por encima de 40UI/l según los valores de normalidad de ambos laboratorios. Además, se recogieron otras variables, como la edad gestacional, el sexo, el peso al nacer y el antirretroviral (ARV) administrado al RN para profilaxis de la TV del VIH. De la gestante se recopilaron la edad materna al momento del parto, la etnia, la presencia de criterios diagnósticos de sida del Centers for Disease Control and Prevention20, el consumo de tóxicos, el valor de linfocitos CD4+ y la CV más cercana al parto y el tipo y duración del TARGA realizado durante el embarazo. Los datos maternos se basaron en el número de gestaciones, ya que las madres presentaron características clínicas, inmunológicas y virológicas variables en las diferentes gestaciones. Se separaron los pacientes en 2 grupos: grupo 1, hijos de madres infectadas por el VIH que habían recibido un régimen TARGA que incluía NVP durante el embarazo, y grupo 2, hijos de madres infectadas por el VIH que habían recibido un TARGA que no incluía NVP.
Se excluyeron del estudio los RN que presentaran algunas de las siguientes características: uso de NVP intraparto, cualquier profilaxis ARV neonatal diferente del uso de AZT en monoterapia, cualquier patología perinatal susceptible de afectar la función hepática durante el periodo neonatal (sepsis, pérdida del bienestar fetal, dificultad respiratoria, necesidad de ventilación mecánica o nutrición parenteral, etc.), bajo peso al nacer según la edad gestacional, edad gestacional al nacimiento igual o menor a 35 semanas, RN hijos de madres infectadas por el VIH y/o por los virus de la hepatitis B y/o C en los que no se haya podido descartar la infección por cualquiera de estos virus.
El grado de afectación hepática se definió de acuerdo a los valores de ALT en los criterios del Division of AIDS Table for Grading the Severity of Adult and Pediatric Adverse Events19 en grado 1 (leve): 1,25-2,5 veces el límite superior de la normalidad (× LSN) (50-100UI/l); grado 2 (moderada): 2,6-5,0×LSN (101-200UI/l); grado 3 (grave): 5,1-10,0×LSN (201-400UI/l), y grado 4 (potencialmente mortal): >10,0×LSN (>401UI/l). Cualquier valor entre el LSN y el grado 1 se consideró anormal pero no graduó según las recomendaciones mencionadas en dichos criterios19.
Se calculó la proporción de pacientes con alteraciones hepáticas en cada grupo con su intervalo de confianza al 95% (IC95%). Se utilizaron la prueba de Chi al cuadrado y la U de Mann-Withney para estudiar las asociaciones de las variables. Se definió un punto de corte para la significación estadística (p) de 0,05.
El estudio fue aprobado por el Comité Ético de ambos centros.
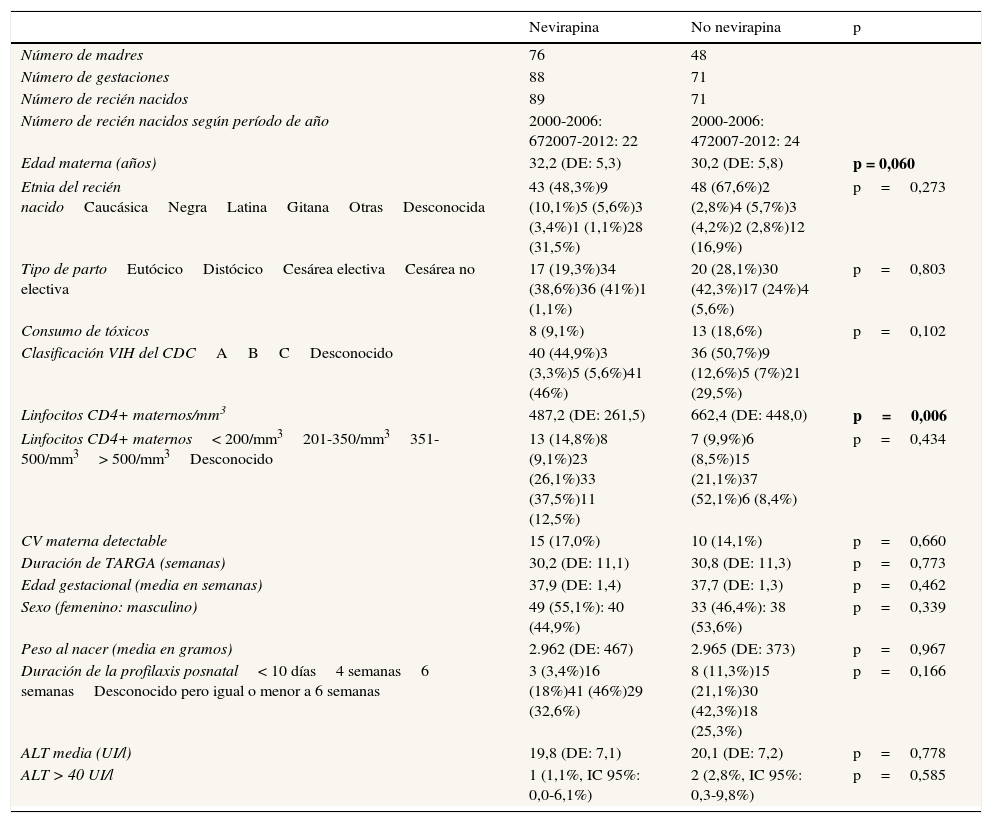
ResultadosSe analizaron un total de 599 RN hijos de madres infectadas por el VIH nacidos durante 15años. Tras aplicar los criterios de exclusión, se seleccionaron 160RN correspondientes a 159 gestaciones (una pareja de gemelos) y a 124 madres. En 88 gestaciones se administró un régimen con NVP para la prevención de la TV del VIH, y en las 71 restantes se administró un TARGA basado en inhibidores de proteasa y sin NVP (fig. 1). Las características de ambos grupos fueron comparables, tal y como se muestra en la tabla 1. En el grupo que recibió NVP, 51 gestaciones (57,9%) recibieron este fármaco antes de la gestación, 33 (37,1%) tras el inicio de la gestación y en 5 (5,6%) no se dispone de datos. En las 71 gestaciones del grupo 2 se administró en algún momento del embarazo nelfinavir: 30 (42,3%), lopinavir/ritonavir 22 (31%), indinavir 7 (9,8%), atazanavir/ritonavir 4 (5,6%), saquinavir 2 (2,8%), y 6 (8,5%) gestantes recibieron otros esquemas. Ningún paciente recibió ritonavir a dosis plenas. Las cifras de linfocitos CD4+ maternos más cercanas al momento del parto, cuando se expresaron en intervalos, no mostraron diferencias significativas entre ambos grupos (p=0,434), pero sí en números absolutos (media 487,2/mm3 en el grupo1 vs 662,4 en el grupo2; p=0,006). Cuando se evaluó el uso de NVP en las gestantes antes y después de las recomendaciones de 2005, se observó que un 59% de los tratamientos durante la gestación incluían NVP antes de esta fecha, suponiendo un 48,3% posteriormente, aunque sin diferencias significativas (p=0,250).
Características de los grupos evaluados
| Nevirapina | No nevirapina | p | |
|---|---|---|---|
| Número de madres | 76 | 48 | |
| Número de gestaciones | 88 | 71 | |
| Número de recién nacidos | 89 | 71 | |
| Número de recién nacidos según período de año | 2000-2006: 672007-2012: 22 | 2000-2006: 472007-2012: 24 | |
| Edad materna (años) | 32,2 (DE: 5,3) | 30,2 (DE: 5,8) | p = 0,060 |
| Etnia del recién nacidoCaucásicaNegraLatinaGitanaOtrasDesconocida | 43 (48,3%)9 (10,1%)5 (5,6%)3 (3,4%)1 (1,1%)28 (31,5%) | 48 (67,6%)2 (2,8%)4 (5,7%)3 (4,2%)2 (2,8%)12 (16,9%) | p=0,273 |
| Tipo de partoEutócicoDistócicoCesárea electivaCesárea no electiva | 17 (19,3%)34 (38,6%)36 (41%)1 (1,1%) | 20 (28,1%)30 (42,3%)17 (24%)4 (5,6%) | p=0,803 |
| Consumo de tóxicos | 8 (9,1%) | 13 (18,6%) | p=0,102 |
| Clasificación VIH del CDCABCDesconocido | 40 (44,9%)3 (3,3%)5 (5,6%)41 (46%) | 36 (50,7%)9 (12,6%)5 (7%)21 (29,5%) | |
| Linfocitos CD4+ maternos/mm3 | 487,2 (DE: 261,5) | 662,4 (DE: 448,0) | p=0,006 |
| Linfocitos CD4+ maternos< 200/mm3201-350/mm3351-500/mm3> 500/mm3Desconocido | 13 (14,8%)8 (9,1%)23 (26,1%)33 (37,5%)11 (12,5%) | 7 (9,9%)6 (8,5%)15 (21,1%)37 (52,1%)6 (8,4%) | p=0,434 |
| CV materna detectable | 15 (17,0%) | 10 (14,1%) | p=0,660 |
| Duración de TARGA (semanas) | 30,2 (DE: 11,1) | 30,8 (DE: 11,3) | p=0,773 |
| Edad gestacional (media en semanas) | 37,9 (DE: 1,4) | 37,7 (DE: 1,3) | p=0,462 |
| Sexo (femenino: masculino) | 49 (55,1%): 40 (44,9%) | 33 (46,4%): 38 (53,6%) | p=0,339 |
| Peso al nacer (media en gramos) | 2.962 (DE: 467) | 2.965 (DE: 373) | p=0,967 |
| Duración de la profilaxis posnatal< 10 días4 semanas6 semanasDesconocido pero igual o menor a 6 semanas | 3 (3,4%)16 (18%)41 (46%)29 (32,6%) | 8 (11,3%)15 (21,1%)30 (42,3%)18 (25,3%) | p=0,166 |
| ALT media (UI/l) | 19,8 (DE: 7,1) | 20,1 (DE: 7,2) | p=0,778 |
| ALT > 40 UI/l | 1 (1,1%, IC 95%: 0,0-6,1%) | 2 (2,8%, IC 95%: 0,3-9,8%) | p=0,585 |
ALT: alanina aminotransferasa; CV: carga viral; DE: desviación estándar; IC95%: intervalo de confianza al 95%; TARGA: tratamiento antirretroviral de gran actividad.
La edad materna en el grupo1 fue mayor (media 32,2años vs 30,2años, con una diferencia marginalmente significativa), y las gestantes del grupo2 se embarazaron más veces en el mismo período de tiempo, aunque de manera no estadísticamente significativa (1,47 vs 1,15 gestaciones por madre en el grupo1, p=0,333).
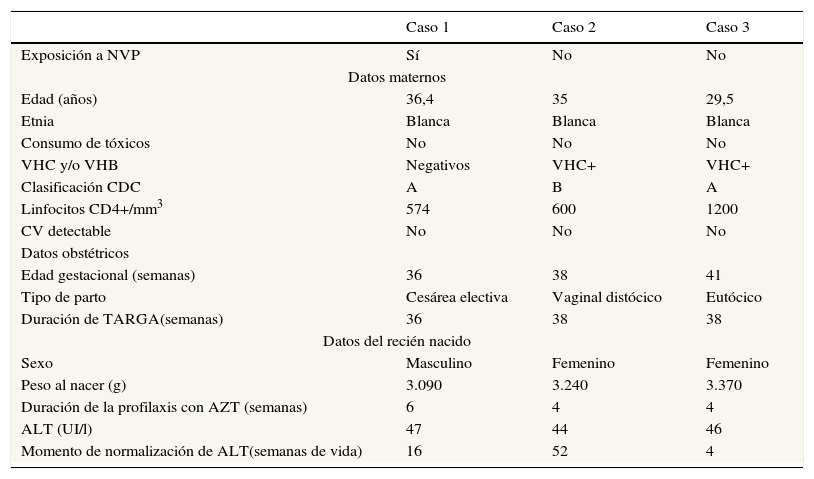
No se observó ningún caso de hepatotoxicidad según la Grading Table del DAIDS, pero se registraron 3 casos de ALT superior a los valores de normalidad (1,9%; IC95%: 0,4-5,4%), 2 de ellos (2,8%; IC95%: 0,3-9,8%) en los no expuestos a NVP y uno (1,1%; IC95%: 0,0-6,1%) en el grupo expuesto (p=0,585) (tabla 2). En todos los casos se normalizaron los valores de ALT de manera espontánea. Tras el estudio etiológico pertinente, el aumento prolongado de ALT en el caso 2 no pudo ser atribuido a otras causas más que a la exposición prenatal a NVP.
Variables de los casos con hepatopatía
| Caso 1 | Caso 2 | Caso 3 | |
|---|---|---|---|
| Exposición a NVP | Sí | No | No |
| Datos maternos | |||
| Edad (años) | 36,4 | 35 | 29,5 |
| Etnia | Blanca | Blanca | Blanca |
| Consumo de tóxicos | No | No | No |
| VHC y/o VHB | Negativos | VHC+ | VHC+ |
| Clasificación CDC | A | B | A |
| Linfocitos CD4+/mm3 | 574 | 600 | 1200 |
| CV detectable | No | No | No |
| Datos obstétricos | |||
| Edad gestacional (semanas) | 36 | 38 | 41 |
| Tipo de parto | Cesárea electiva | Vaginal distócico | Eutócico |
| Duración de TARGA(semanas) | 36 | 38 | 38 |
| Datos del recién nacido | |||
| Sexo | Masculino | Femenino | Femenino |
| Peso al nacer (g) | 3.090 | 3.240 | 3.370 |
| Duración de la profilaxis con AZT (semanas) | 6 | 4 | 4 |
| ALT (UI/l) | 47 | 44 | 46 |
| Momento de normalización de ALT(semanas de vida) | 16 | 52 | 4 |
ALT: alanina aminotransferasa; CV: carga viral; NVP: nevirapina; TARGA: tratamiento antirretroviral de gran actividad; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
El uso de NVP en dosis única a la madre y/o al RN como profilaxis para la TV, sola o junto a AZT, ha sido una estrategia de amplia implementación en países con bajos recursos económicos y su seguridad se ha evaluado en varios trabajos21-24. En lactantes con infección VIH, los datos sobre la administración de NVP como parte del TARGA también sugieren que es un fármaco seguro5,12, pero no se dispone de datos suficientes con respecto a la seguridad en los casos de exposición gestacional prolongada a NVP en RN sanos7,17. La principal preocupación respecto a la seguridad de NVP está relacionada con la hepatotoxicidad asociada al fármaco. El daño hepático se cree que es causado por un mecanismo inmunoalérgico y suele manifestarse precozmente con elevaciones de ALT. Estas elevaciones suelen ser transitorias, pero pueden ser sintomáticas e incluso requerir la suspensión del TARGA11,19,25.
En nuestro estudio se comparan 2 grupos de pacientes expuestos in utero al VIH y a TARGA. Ambas cohortes fueron comparables, excepto en el recuento materno de linfocitos CD4+ previos al parto, cuando se expresan en valores absolutos. Esto se puede interpretar como una predilección por parte del facultativo prescriptor de un tratamiento sin NVP en gestantes con recuentos de linfocitos CD4+ elevados, en línea con las recomendaciones internacionales a partir de 2005 y el descenso en la utilización de NVP durante la gestación en nuestra muestra a partir de esa fecha1. No se detectaron casos de hepatopatía grave en ninguno de los 2 grupos. Los casos identificados de elevación de ALT (3 de 160 pacientes, 1,9%) fueron leves, autolimitados y cursaron de forma asintomática, sin diferencias entre ambos grupos, tal y como apuntaba el estudio previo de nuestro grupo16. El análisis descriptivo de estos 3 casos no refleja ninguna característica distintiva que permita asociar la hepatotoxicidad con alguna de las variables estudiadas (tabla 2), y los valores de ALT se normalizaron en 2 de los casos antes de los 4 meses de vida (4 y 16semanas), mientras que el tercer paciente normalizó los valores al cabo de un año. La baja incidencia de alteraciones hepáticas asociadas a NVP en esta cohorte coincide con los datos aportados en una revisión sistemática realizada por McKoy et al.21, quienes analizan 7 estudios donde se evalúa el riesgo de hepatotoxicidad en los RN sanos hijos de madres infectadas por el VIH2,18,19,22-24,26,27 e incluyen un total de 3.074RN hijos de gestantes expuestas durante la gestación a NVP, de las cuales solo 273 habían sido expuestas a NVP de forma prolongada durante la gestación. Los artículos recogidos en esta revisión no reportaban datos sobre hepatopatía grado1 o 2, y solo registraron escasos casos de hepatopatía grado3 y 4, sin diferencias significativas en función de la duración del tratamiento con NVP durante la gestación (tasas de prevalencia de 0,79% para tratamientos cortos y 1,10% para largos). Tampoco se informa sobre el seguimiento clínico ni de los parámetros de laboratorio en los pacientes incluidos.
Entre las limitaciones de nuestro trabajo destaca el reducido tamaño muestral, que no permite descartar posibles casos infrecuentes de hepatotoxicidad moderada o grave. A pesar de ello, debe tenerse presente que en la literatura actual tan solo dispone de los datos de 273 pacientes con características parecidas incluidos en el metaanálisis de McKoy et al.16,27,28. La exclusión de muchos pacientes de nuestra cohorte por datos incompletos o potenciales factores de confusión ha limitado el número de pacientes incluidos, pero consideramos que refuerza la validez de nuestro trabajo.
En resumen, nuestros datos refuerzan la hipótesis que el uso gestacional de NVP no se asocia a un mayor riesgo de hepatotoxicidad en el RN sano nacido de madre con VIH y sin otros factores de riesgo de daño hepatocelular. Estos son datos tranquilizadores, ya que NVP se sigue utilizando en los regímenes TARGA para embarazadas con infección VIH en países en desarrollo, y actualmente un elevado número de niños se han expuesto a NVP durante la gestación3. En cualquier caso, resulta necesario disponer de datos en cohortes más amplias y valorar la seguridad de NVP en los pacientes con otros factores de riesgo de hepatotoxicidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con el contenido del manuscrito.