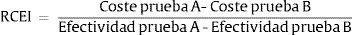La necesidad de reducir el tiempo de diagnóstico microbiológico y la irrupción de nuevas tecnologías relacionadas con la microbiología molecular y la proteómica han favorecido el desarrollo de técnicas rápidas y de realización en el lugar de asistencia al paciente (point-of-care), así como de los denominados laboratorios point-of-care, espacios que concentran la realización de ambas técnicas como respuesta, en parte, a la externalización de los laboratorios convencionales de los hospitales. Su introducción no siempre se ha acompañado de evaluaciones económicas (estudios de coste-efectividad, coste-beneficio y coste-utilidad) y suelen limitarse al precio unitario de la prueba. Este último, influido por el procedimiento de compra, no suele tener un valor de referencia regulado, como en el caso de los medicamentos. Los análisis de coste-efectividad que mayor repercusión han tenido han sido los realizados recientemente con la espectrometría de masas en el diagnóstico de la bacteriemia y el uso de antimicrobianos y pueden servir como modelo de futuros estudios económicos de las pruebas rápidas y point-of-care.
The need to reduce the time it takes to establish a microbiological diagnosis and the emergence of new molecular microbiology and proteomic technologies has fuelled the development of rapid and point-of-care techniques, as well as the so-called point-of-care laboratories. These laboratories are responsible for conducting both techniques partially to response to the outsourcing of the conventional hospital laboratories. Their introduction has not always been accompanied with economic studies that address their cost-effectiveness, cost-benefit and cost-utility, but rather tend to be limited to the unit price of the test. The latter, influenced by the purchase procedure, does not usually have a regulated reference value in the same way that medicines do. The cost-effectiveness studies that have recently been conducted on mass spectrometry in the diagnosis of bacteraemia and the use of antimicrobials have had the greatest clinical impact and may act as a model for future economic studies on rapid and point-of-care tests.
Los procesos diagnósticos que se realizan en los laboratorios y servicios de Microbiología Clínica, al igual que cualquier otra actividad que conlleve una decisión clínica en el manejo del paciente, están siendo continuamente evaluados para valorar su eficiencia diagnóstica y, en menor medida, su relación de coste-efectividad1. Una de las áreas en el diagnóstico microbiológico en la que mayor atención ha suscitado este tipo de estudios ha sido el de las pruebas rápidas, no solo por el hecho en sí de los beneficios que supone el reducir el tiempo de desarrollo de la técnica en el propio proceso diagnóstico, organización del trabajo en el laboratorio y reducción de los tiempos de respuesta, sino también por aquellos derivados del manejo del paciente y su impacto clínico. Por extensión, suelen incluirse en estas evaluaciones las técnicas realizadas en el lugar de asistencia al paciente (o pruebas point-of-care) desarrolladas con la intención de ser ejecutadas fuera del laboratorio pero que, en muchos casos, se realizan en el laboratorio o en los recientemente denominados laboratorios point-of-care2,3. Suelen excluirse de este epígrafe las pruebas de autodiagnóstico, cuya irrupción en el mercado no ha estado exenta de controversias. Estas últimas son técnicas similares a las del point-of-care, pero diseñadas para que las realice el propio paciente o persona interesada en el diagnóstico de un agente infeccioso y están disponibles para su compra en las farmacias o, incluso, con una regulación deficiente, a través de páginas web4,5.
El diagnóstico rápido en Microbiología ha sido evaluado con relativa frecuencia, sobre todo, en las áreas de conocimiento en las que se dispone de nuevas tecnologías y el impacto clínico derivado de su utilización es elevado6,7. Entre ellas destacan el uso de la espectrometría de masas en el diagnóstico de la bacteriemia y de las técnicas moleculares dirigidas a patógenos específicos multirresistentes como Staphylococcus aureus resistente a la meticilina o enterobacterias productoras de carbapenemasas y también a paneles diagnósticos que incluyen diferentes microorganismos asociados a una misma entidad clínica como gastroenteritis, neumonía, infección neurológica o sepsis7-11. En la mayoría de los casos, abordan una evaluación de su rendimiento diagnóstico expresado en valores diagnósticos (sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo o probabilidad pretest) y, de forma ocasional, un análisis de costes o de impacto presupuestario, en los que se valoran fundamentalmente los parámetros económicos (el precio unitario de la prueba multiplicado por el volumen de pruebas empleadas). Más raramente se realizan evaluaciones económicas completas en términos de coste-efectividad, coste-beneficio o coste-utilidad. Otras pruebas rápidas con introducción creciente en Microbiología son las basadas en la inmunocromatografía (lateral-flow) en las que, de nuevo, se han analizado con mayor profusión los valores diagnósticos y en menor medida el impacto económico derivado de su introducción en la clínica3.
En este trabajo revisamos los conceptos generales aplicados a la evaluación del impacto económico de los métodos de diagnóstico rápido en Microbiología Clínica, aparte del precio exclusivo de la prueba, y que trasciende al impacto clínico global y al beneficio del propio paciente. No se incluirán los sistemas de autodiagnóstico, ya que su abordaje requiere consideraciones diferentes a las pruebas rápidas y de point-of-care. La tabla 1 incluye un glosario de términos para facilitar la lectura de este artículo.
Glosario de términos habitualmente utilizados en los estudios de evaluación económica de las pruebas de diagnóstico
| Término | Significado |
|---|---|
| Coste de la prueba | Cantidad total de pruebas consumidas por valor monetario unitario de la prueba |
| Efectividad | Efectos producidos por la aplicación de las pruebas, por ejemplo, reducción del tiempo de diagnóstico, adecuación del tratamiento dirigido… |
| Análisis de costes | Estudio económico en el que se comparan los costes (unidades monetarias) de 2alternativas diferentes, pero no se comparan los resultados. No se considera una evaluación económica |
| Evaluación económica | Estudio económico en el que se comparan tanto los costes como los resultados (efectividad) de 2alternativas diferentes |
| Estudio de coste-efectividad | Evaluación económica en la que se comparan los costes de 2alternativas diferentes frente a la efectividad, expresada en las unidades que se emplean habitualmente en la práctica clínica (días de estancia media, mortalidad, muertes evitadas, etc.) |
| Estudio de coste- beneficio | Evaluación económica en la que se comparan los costes de 2alternativas diferentes frente a la efectividad, pero expresada también en unidades monetarias |
| Estudio de coste-utilidad | Evaluación en la que se mide el beneficio como años de vida ajustados por calidad (AVAC o quality-adjusted life-year [QALY]) |
| Estudio de minimización de costes | Evaluación económica en la que se puede asumir que los resultados de las alternativas comparadas son los mismos y, por tanto, se comparan los costes |
| Razón coste/efectividad incremental | Comparación del coste económico y la diferencia de las intervenciones con relación al estándar de actuación o a la intervención que ha demostrado mayor efectividad |
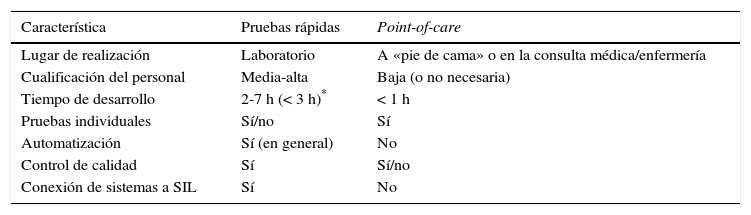
En la tabla 2 se indican las características y diferencias generales que presentan las pruebas rápidas propiamente dichas realizadas en los laboratorios de Microbiología Clínica y las pruebas point-of-care ejecutadas en el lugar de atención al paciente, incluyendo las consultas médicas o de enfermería y la unidad de hospitalización.
Características generales de las pruebas rápidas y las realizadas en el lugar de atención al paciente (point-of-care) aplicadas al diagnóstico microbiológico
| Característica | Pruebas rápidas | Point-of-care |
|---|---|---|
| Lugar de realización | Laboratorio | A «pie de cama» o en la consulta médica/enfermería |
| Cualificación del personal | Media-alta | Baja (o no necesaria) |
| Tiempo de desarrollo | 2-7 h (< 3 h)* | < 1 h |
| Pruebas individuales | Sí/no | Sí |
| Automatización | Sí (en general) | No |
| Control de calidad | Sí | Sí/no |
| Conexión de sistemas a SIL | Sí | No |
SIL: sistema informático del laboratorio.
Las pruebas de diagnóstico rápido en Microbiología se desarrollan habitualmente en el propio laboratorio con un tiempo hasta la obtención del resultado que suele ser inferior al de una jornada laboral típica de 7-8 h, aunque la mayoría suele desarrollarse en 3-5 h. Esta diferencia en 2-3 h es esencial para que en la misma jornada laboral los resultados lleguen al peticionario y tengan trascendencia inmediata, ya que con una duración más larga corren el riesgo, en ausencia de una atención continuada, de que el resultado no sea transmitido al clínico peticionario de forma eficiente y se deje la decisión clínica para el día siguiente.
A diferencia de las pruebas point-of-care, las muestras para diagnóstico rápido requieren un trasporte al laboratorio y, en general, una preparación antes de su procesamiento. El personal puede llegar a requerir un entrenamiento específico y la tecnología suele ser más compleja que la empleada en las técnicas point-of-care. Al realizarse en el propio laboratorio, están incluidas en los sistemas de gestión de calidad y los resultados se integran en los sistemas informáticos de laboratorio. La tendencia actual en las pruebas de diagnóstico rápido es que estén automatizadas y se utilicen para una entidad clínica concreta (por ejemplo, infección respiratoria adquirida en la comunidad, gastroenteritis o meningitis) más que para un problema diagnóstico asociado a un solo patógeno. No obstante, existen ejemplos que abordan un solo problema, como la detección de Clostridium difficile, de Staphylococcus aureus resistente a la meticilina o de enterobacterias productoras de carbapenemasas12.
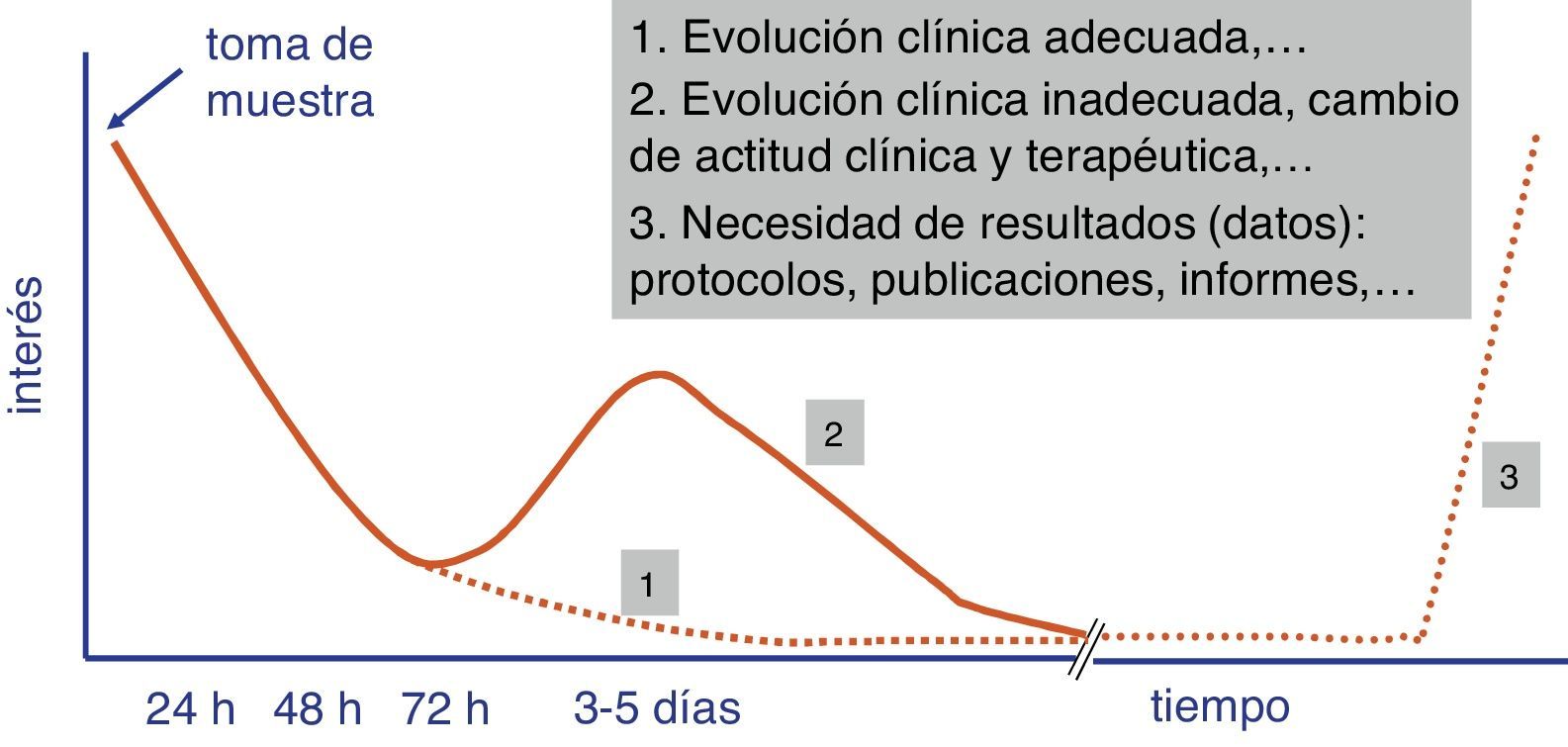
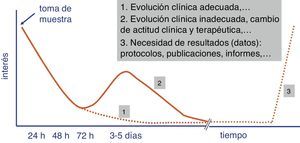
Con independencia del coste económico y de la idoneidad de los valores diagnósticos de las pruebas rápidas, el tiempo de su realización es uno de los parámetros que condicionan el éxito o fracaso de la introducción de estas determinaciones en el proceso diagnóstico del laboratorio de Microbiología. Un desarrollo superior a 4-5 h no asegura un adecuado engarce de las pruebas rápidas en los flujos de trabajo del laboratorio y limita el interés del facultativo que ha solicitado la prueba por el resultado (fig. 1). Este ha de ser siempre lo más cercano a la toma de muestra con el fin de poder adoptar una decisión terapéutica (por ejemplo, instaurar un tratamiento antimicrobiano o modificarlo antes de una segunda dosis), preventiva (aislamiento o no del paciente), clínica (ingreso en planta o en una unidad de cuidados intensivos [UCI]) o incluso diagnóstica (toma de muestras adicionales para otros estudios microbiológicos).
En la valoración de las pruebas rápidas, debe tenerse en cuenta no solo el tiempo específico de su realización sino también los asociados al proceso preanalítico y a la gestión posterior del resultado. Por ello, la tendencia actual de estas pruebas es que se desarrollen en un tiempo inferior a 3-5 h, situación que cumpliría con los objetivos marcados en el párrafo anterior. Igualmente, la posibilidad de que estas determinaciones sustituyan a las determinaciones convencionales es también una de las claves que aseguran su éxito13. En este caso, la ausencia de duplicidad de pruebas, es decir, la sustitución de una prueba por otra, es altamente valorada. También el que sean innecesarios recursos humanos adicionales para su realización, ya que estos son los que suelen añadir mayor coste económico.
Un ejemplo claro de éxito ha sido la introducción de la identificación de bacterias y hongos mediante espectrometría de masas en los servicios y laboratorios de Microbiología. Es una técnica rápida, ha demostrado ser coste-efectiva y su introducción ha relegado las pruebas de identificación basadas en reacciones bioquímicas a un lugar secundario, incluso testimonial14,15. Por el contrario, las técnicas que tiene un desarrollo superior a 5-7 h, aun con claros beneficios clínicos, no han tenido la implantación esperada por las empresas que las han desarrollado y por los facultativos que demandan los estudios microbiológicos. Ejemplo de ello ha sido la técnica que combina la amplificación de secuencias genéticas y detección posterior del producto amplificado por espectrometría de masas (electrospray ionization time of flight mass spectrometry)16. A pesar del interés evidente por la detección de microorganismos de forma directa sobre muestra de sangre sin necesidad de cultivo previo, como con los protocolos con MALDI TOF, su implantación no ha sido la esperada. También ha frenado su introducción en la práctica clínica habitual el alto coste de las determinaciones. Igualmente, a diferencia de lo acontecido con el sistema MALDI TOF, no cubre todos los posibles patógenos (solo está dirigido a los más habituales), por lo que es necesario mantener el proceso convencional, lo que aumenta aún más el coste del diagnóstico1.
Una revisión sistemática de la literatura publicada recientemente de diferentes sistemas moleculares (en algún caso combinados con la proteómica) utilizados en el diagnóstico de sepsis a partir de muestra directa de sangre concluía que estos métodos, a pesar de tener una sensibilidad y especificidad elevadas, no habían sido evaluados en ensayos clínicos aleatorizados que analizasen correctamente los parámetros clínicos (mortalidad, tiempo de ingreso en UCI, etc.) para valorar su efectividad. Por ello, a pesar de evitarse la inoculación de hemocultivos y la espera de su crecimiento, no se podía concluir que tuviesen ventajas en términos de efectividad frente al estándar actual. No obstante, y aunque sustentado en estimaciones no basadas en la evidencia, podrían tener un coste-beneficio favorable17.
Técnicas point-of-careLas técnicas point-of-care en Microbiología suelen tener un tiempo de realización inferior a una hora y se han desarrollado para establecer un diagnóstico microbiológico en el lugar de asistencia al paciente, bien durante su ingreso o en la atención en la consulta médica o de enfermería18. En general, la preparación de la muestra es mínima o inexistente, el personal que la realiza (facultativos o enfermería) no requiere un entrenamiento muy específico y la tecnología empleada es muy sencilla. Suelen responder a un solo problema diagnóstico, en general de un solo patógeno, y no suelen estar automatizadas. Como aspectos negativos, no suelen asociarse a programas de control de calidad, solo a los controles internos, y sus resultados no suelen quedar recogidos en los sistemas informáticos (historia clínica electrónica o sistema informático del laboratorio) (tabla 2)19,20.
Tanto en el caso de las pruebas rápidas como de point-of-care, las exigencias diagnósticas deben ser similares y sus evaluaciones económicas y clínicas deben seguir el mismo modelo7,13. No obstante, en una evaluación económica, las técnicas point-of-care suelen tener mayores ventajas cuando se comparan con las técnicas rápidas, ya que el coste unitario de las pruebas suele ser bajo, no precisan un personal cualificado para su realización y tampoco requieren aparatos sofisticados en el caso de que estos sean necesarios. Por esta razón, suelen ser coste-efectivas cuando se comparan con los métodos convencionales3. Asimismo, la introducción en el mercado de pruebas con igual concepto que van sustituyendo a la inicial suele producirse con menor precio y favorecen una mejor relación de coste-efectividad7.
Laboratorios point-of careEn los últimos años se ha abierto un gran debate que trata de responder a la pregunta de dónde deben realizarse las pruebas point-of-care: en el laboratorio o en el lugar de asistencia al paciente20. Incluso existen trabajos que evalúan las ventajas y desventajas de su realización en el propio laboratorio de Microbiología, sobre todo, con un horizonte de externalización y centralización de sus servicios21,22. La Sociedad Americana de Microbiología recomienda claramente el uso de estas técnicas rápidas, incluso fuera del ámbito geográfico del laboratorio, siempre y cuando la selección de las pruebas, su introducción y valoración estén controladas por los propios microbiólogos23.
Como solución a este debate, pero también promovido por los efectos negativos derivados de la externalización y centralización aludidos que dejan sin posibilidad de realizar pruebas rápidas que no sean point-of-care sencillos a los centros en los que se había producido este proceso, se han comenzado a diseñar espacios específicos de laboratorio (denominados laboratorios point-of-care) dedicados exclusivamente a las pruebas rápidas y a las pruebas point-of-care24. No obstante, este concepto se ha ampliado incluso a servicios y laboratorios de Microbiología consolidados dentro de los hospitales como una herramienta para ofrecer un mejor servicio y para responder a las necesidades y tendencias actuales en el diagnóstico microbiológico3. Estos laboratorios funcionan con un concepto 24 horas, 7 días a la semana, o de atención continuada en relación muy estrecha con los peticionarios de las pruebas diagnósticas, que esperan los resultados para la toma de decisiones y que generalmente comparten con los facultativos responsables de estos laboratorios la información clínica del paciente y la mejor elección de la estrategia diagnóstica1.
Por todo lo anteriormente indicado, los «laboratorios point-of care» realizan tanto técnicas rápidas como técnicas point-of-care en centros que habitualmente carecen de un laboratorio estándar y que derivan muestras a un laboratorio central, manteniendo aquellas técnicas cuyo resultado permite tomar una primera decisión. También se han puesto en marcha en centros consolidados con el objetivo de una atención continuada2,3. Este hecho ha impulsado un mayor interés de las empresas de diagnóstico por la innovación de las pruebas rápidas y su introducción en esta área de trabajo. A pesar de este interés, no existen por el momento trabajos que evalúen de forma global los laboratorios point-of-care con una perspectiva económica, aparte de su eficiencia diagnóstica.
Coste económico de las pruebas rápidas y de point-of-careEn el estudio económico habitual de cualquier prueba de laboratorio, incluyendo las pruebas rápidas, uno de los primeros retos a los que se enfrenta el evaluador es el conocimiento del coste real de cada una de ellas, bien de forma unitaria o ajustada a equipos o kits diagnósticos, en los que se incluyen también los controles necesarios para su desarrollo e interpretación. Esta información no está habitualmente accesible en los catálogos o páginas web de las empresas de diagnóstico y el precio depende del procedimiento de compra seguido por cada institución. Este último puede gestionarse por medio de una compra directa, por compra centralizada, generalmente negociada, o por adquisición a través de concursos con posible licitación de ofertas y opciones de mejora relacionadas con la actividad diagnóstica (renovación y mantenimiento de equipos informáticos, disponibilidad de controles de calidad externos a los propios equipos utilizados, procesos de certificación y acreditación, adecuación de espacios, arrendamiento de aparatos necesarios para el diagnóstico, etc.). Los concursos con opciones de mejora, en la mayoría de las ocasiones, obligan al proveedor a elevar el coste.
En otros casos, el precio se incrementa cuando el pago al proveedor se realiza con plazos elevados de tiempo que condicionan la repercusión en cada una de las pruebas de los costes financieros necesarios para el normal funcionamiento del proveedor. La ausencia de un procedimiento uniforme de compra entre centros hace que no exista un precio de referencia de cada prueba, como sucede con la compra de medicamentos, para los que el precio está regulado por el propio Ministerio de Sanidad, Servicios Sociales e Igualdad25.
También, en muchas ocasiones, se analiza exclusivamente el coste basado en el precio de compra, que puede alejarse del coste real una vez que se ajusta al número final de resultados emitidos por el laboratorio, ya que no se tienen en cuenta las posibles repeticiones o las pruebas consumidas por los controles y ejercicios de calidad internos e interlaboratorios en los sistemas de acreditación y certificación.
Cuando se realiza un análisis de costes, solo se contempla el coste económico de la prueba, es decir, su valor unitario multiplicado por el número de pruebas que se realizan en el periodo de tiempo definido para el análisis. Sin embargo, una evaluación económica completa, como el análisis de minimización de costes (tabla 1) nos permite comparar 2opciones diagnósticas diferentes y asumir resultados en salud (efectividad) idénticos para ambas, de forma que el resultado final hace referencia a los costes, entre los que se incluyen los directos asociados a la prueba (de personal técnico y facultativo) y los indirectos como la luz, climatización, etc.
Evaluación de pruebas rápidas: coste-efectividad, coste-beneficio y coste-utilidadLa evaluación económica de las pruebas de diagnóstico de laboratorio en el contexto actual de crecimiento del gasto sanitario se ha convertido en una necesidad de gestión para seleccionar aquellas con resultados más eficientes. El análisis de coste-efectividad es la herramienta más generalizada, ya que los resultados en salud pueden expresarse en términos de resultados, como las muertes evitadas, la reducción de la estancia hospitalaria o el ajuste del tratamiento antibiótico. Permite determinar qué intervención resulta prioritaria para maximizar el beneficio producido con los recursos económicos disponibles.
Otras estrategias de evaluación empleadas son las de coste-beneficio (tabla 1). Su característica principal es que traducen el beneficio en salud en unidades monetarias, con lo que el término de comparación es similar en todos los casos. Esta situación permite, además, un análisis de la ganancia monetaria neta o razón de coste-beneficio26.
En el análisis de coste-efectividad se tiene en cuenta de forma numérica cuál es la relación entre los costes (medidos en unidades monetarias) de una intervención específica (por ejemplo, el coste en sí de la prueba rápida o de point-of-care) y sus consecuencias (medidas en las mismas unidades que se emplean en la práctica clínica). El valor relativo de la intervención se expresa normalmente como un cociente, en el que el denominador es una ganancia en un indicador de salud o de gestión y el numerador es el coste asociado con el aumento de la salud. Este cociente se denomina coste-efectividad medio. En el caso de las pruebas de diagnóstico rápido y de point-of-care, el denominador puede evaluarse desde 2perspectivas diferentes. La primera sería un abordaje desde el prisma del laboratorio en el que la reducción del tiempo de emisión de los resultados, el aumento de la capacidad de trabajo o la disponibilidad de tiempo del técnico podrían ser los indicadores. La segunda estaría más relacionada con las consecuencias positivas para el paciente derivadas de la intervención como resultado de la información de la prueba rápida del laboratorio o de point-of-care e incluiría, por ejemplo, la reducción del tiempo de ingreso, tiempo sin tratamiento efectivo o el tiempo en que se tarda en instaurar un tratamiento adecuado, cambio de tratamiento empírico a dirigido, reducción de la mortalidad, etc.
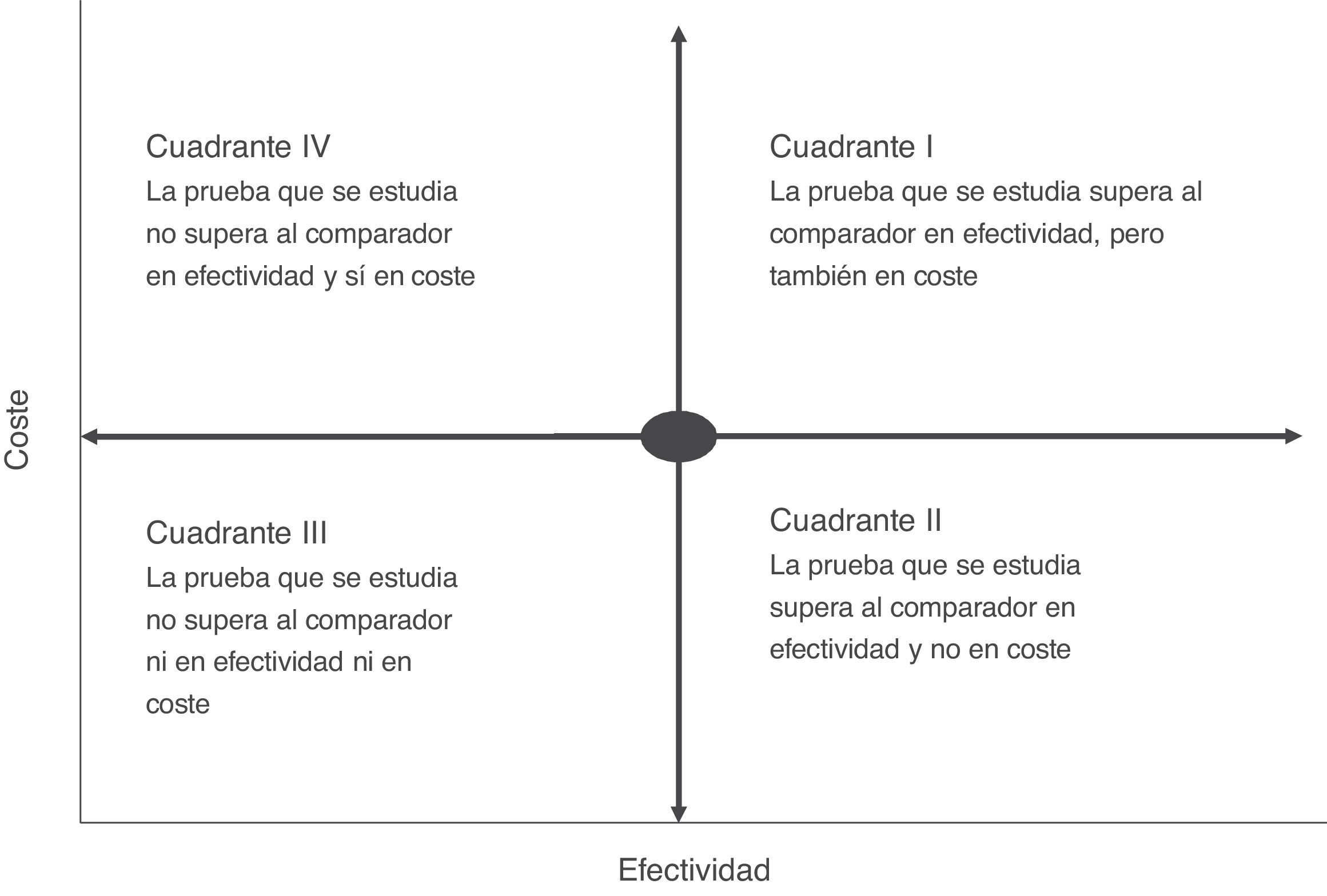
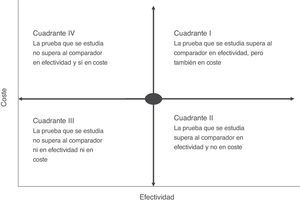
El análisis de coste-efectividad suele visualizarse en una matriz denominada plano de coste-efectividad, que recoge simultáneamente la efectividad y el coste económico de las pruebas (fig. 2). En una prueba rápida o de point-of-care en la que, por ejemplo, se ha medido el coste y su repercusión —como la estancia media del paciente— podríamos tener diferentes escenarios en los que la situación más ventajosa sería la de las intervenciones más efectivas y menos costosas (pruebas de bajo coste y alto impacto en la reducción del tiempo de ingreso) (cuadrante II, fig. 2). Por el contrario, la más desfavorable sería una situación en la que las pruebas rápidas son de elevado coste con poca repercusión en la estancia (cuadrante IV, fig. 2). Habitualmente, en una evaluación de coste-efectividad el resultado suele colocarse en cuadrantes de mayor coste y alta efectividad (cuadrante I, fig. 2). En este caso, la elección de la prueba dependerá del grado de aceptación del incremento del coste y la ponderación de su efectividad en el contexto global del manejo del paciente. En la mayoría de las ocasiones, esta efectividad no debe calcularse con la valoración de un solo indicador, ya que puede inducir a rechazar una prueba porque el coste de la intervención es elevado y la efectividad a priori poco importante. Ejemplo de ello serían las intervenciones que reducen el tiempo de estancia y que tendrían una importante repercusión en la calidad percibida por el paciente o en la posible disminución de los efectos adversos asociados a la propia estancia hospitalaria. En este sentido, la introducción de la espectrometría de masas en la identificación de microorganismos a partir de los frascos de hemocultivos crecidos en el diagnóstico de la bacteriemia ha demostrado ser claramente efectiva cuando se mide la estancia del paciente, pero requiere una inversión inicial importante por los costes del propio sistema MALDI TOF, lo que en algunas instituciones ha frenado su introducción15. Sin embargo, si añadimos que una reducción del tiempo de ingreso también reduce la posibilidad de adquirir una infección nosocomial, la intervención tendría mayor peso en su efectividad, sobre todo, en países con una elevada incidencia de infecciones por bacterias multirresistentes. El reto en este caso sería poder calcular cuántas infecciones pueden evitarse con la reducción del tiempo de ingreso, ya que el coste unitario de este tipo de infecciones y su impacto en el sistema sanitario está claramente medido en diferentes estudios27-29.
Para poder comparar varias intervenciones entre sí, estas se suelen ordenar en función del denominado valor de coste-efectividad incremental. Es decir, el valor calculado se refiere y se compara con las intervenciones que se miden de igual forma, con el denominado estándar de actuación o simplemente con la actuación (en este caso, una prueba rápida o de point-of-care) que ha demostrado hasta ese momento mayor efectividad. También, alineado con el movimiento actual de «qué no hacer», en algunas ocasiones se podrían comparar con la no intervención (http://www.choosingwisely.org/). El coste-efectividad incremental se refiere, por tanto, al coste adicional por unidad de beneficio, también adicional. Si tenemos en cuenta 2intervenciones (A y B), este valor se calcularía con la siguiente fórmula:
RCEI: Razón coste-efectividad incremental
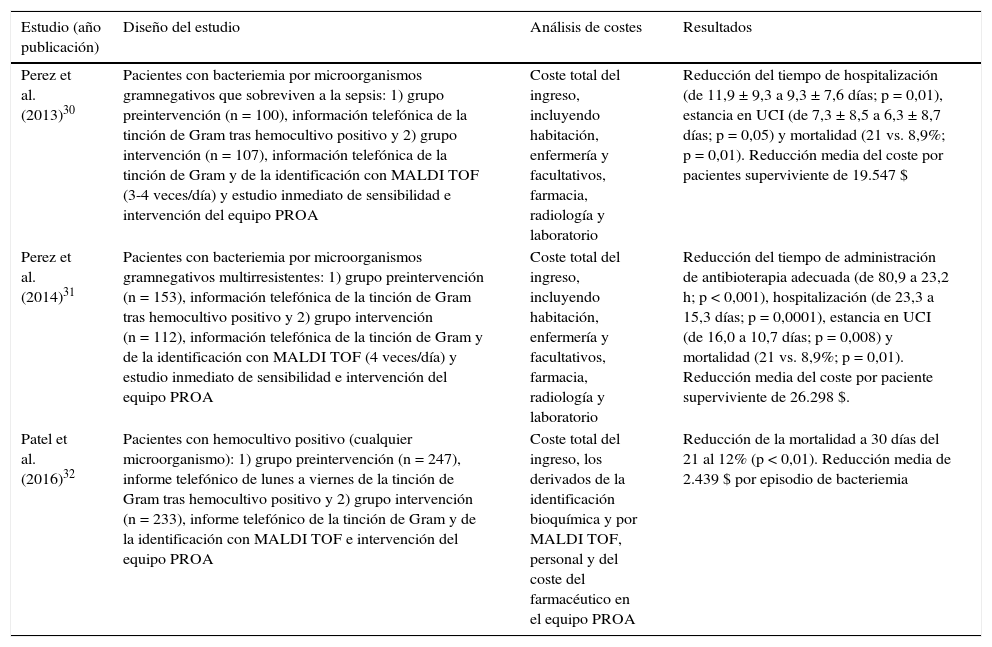
Recientemente se han publicado diferentes trabajos que analizan el impacto económico relacionado con el uso del MALDI TOF como técnica rápida de identificación de los microorganismos a partir de frascos de hemocultivos crecidos30-32. Su interés estriba en el análisis que supone la mejora del uso de los antimicrobianos relacionados con los denominados «programas de optimización de uso de antimicrobianos» (PROA) que derivan de una información más rápida con el uso del sistema MALDI TOF en comparación con los métodos convencionales, basados en pruebas bioquímicas tradicionales. Como medida de los resultados se analiza la mortalidad y la duración de ingreso33,34. En la tabla 3 se resumen algunos de estos trabajos, su diseño, resultados observados y cuantificación económica. Aunque con métodos diferentes en el cálculo de los costes en cada uno de los trabajos, sobre todo en la consideración de los costes indirectos, en todos ellos se concluye que hay una ventaja económica de la intervención tras la información rápida con el sistema MALDI TOF30-32.
Análisis de impacto clínico y económico relacionado con el uso de técnicas rápidas de identificación de espectrometría de masas (MALDI TOF) combinada con acciones de mejora de utilización de antimicrobianos en el diagnóstico de la bacteriemia
| Estudio (año publicación) | Diseño del estudio | Análisis de costes | Resultados |
|---|---|---|---|
| Perez et al. (2013)30 | Pacientes con bacteriemia por microorganismos gramnegativos que sobreviven a la sepsis: 1) grupo preintervención (n = 100), información telefónica de la tinción de Gram tras hemocultivo positivo y 2) grupo intervención (n = 107), información telefónica de la tinción de Gram y de la identificación con MALDI TOF (3-4 veces/día) y estudio inmediato de sensibilidad e intervención del equipo PROA | Coste total del ingreso, incluyendo habitación, enfermería y facultativos, farmacia, radiología y laboratorio | Reducción del tiempo de hospitalización (de 11,9 ± 9,3 a 9,3 ± 7,6 días; p = 0,01), estancia en UCI (de 7,3 ± 8,5 a 6,3 ± 8,7 días; p = 0,05) y mortalidad (21 vs. 8,9%; p = 0,01). Reducción media del coste por pacientes superviviente de 19.547 $ |
| Perez et al. (2014)31 | Pacientes con bacteriemia por microorganismos gramnegativos multirresistentes: 1) grupo preintervención (n = 153), información telefónica de la tinción de Gram tras hemocultivo positivo y 2) grupo intervención (n = 112), información telefónica de la tinción de Gram y de la identificación con MALDI TOF (4 veces/día) y estudio inmediato de sensibilidad e intervención del equipo PROA | Coste total del ingreso, incluyendo habitación, enfermería y facultativos, farmacia, radiología y laboratorio | Reducción del tiempo de administración de antibioterapia adecuada (de 80,9 a 23,2 h; p < 0,001), hospitalización (de 23,3 a 15,3 días; p = 0,0001), estancia en UCI (de 16,0 a 10,7 días; p = 0,008) y mortalidad (21 vs. 8,9%; p = 0,01). Reducción media del coste por paciente superviviente de 26.298 $. |
| Patel et al. (2016)32 | Pacientes con hemocultivo positivo (cualquier microorganismo): 1) grupo preintervención (n = 247), informe telefónico de lunes a viernes de la tinción de Gram tras hemocultivo positivo y 2) grupo intervención (n = 233), informe telefónico de la tinción de Gram y de la identificación con MALDI TOF e intervención del equipo PROA | Coste total del ingreso, los derivados de la identificación bioquímica y por MALDI TOF, personal y del coste del farmacéutico en el equipo PROA | Reducción de la mortalidad a 30 días del 21 al 12% (p < 0,01). Reducción media de 2.439 $ por episodio de bacteriemia |
PROA: programa de optimización de uso de antimicrobianos; UCI: Unidad de Cuidados Intensivos.
En general y en relación con las pruebas rápidas y de point-of-care, en muy pocos casos el análisis económico se ha hecho con una visión de coste-utilidad. Está evaluación suele medir los años de vida ajustados por calidad (AVAC), en inglés quality-adjusted life-year (QALY), o años de vida ganados en salud, en la que también es necesario establecer un estándar económico que evalúe la utilidad de la intervención35. En la mayoría de los países no existe un umbral definido para considerar adecuada, en términos de coste-utilidad, una tecnología sanitaria y suele tomarse por consenso un valor de 30.000 €/AVAC (o 20.000 £/AVAC), definido por el National Institute for Health and Clinical Excellence (NICE) de Gran Bretaña36. En España, el Real Decreto-ley 9/2011 estableció la creación de los comités de coste-efectividad de los medicamentos y productos sanitarios, que se tradujo finalmente en la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud sustentadas en el propio Ministerio de Sanidad y en las agencias de ámbito autonómico creadas con este fin37,38. Su objetivo primordial es emitir informes técnicos de evaluación de las tecnologías sanitarias mediante la revisión sistemática de la literatura científica para conocer su eficacia, efectividad y seguridad. Asimismo, a través de una contextualización, valoran su impacto en el sistema sanitario y tienen en cuenta los aspectos legales, éticos, económicos, sociales u organizativos (http://www.redets.msssi.gob.es/home.htm). En la mayoría de los casos los informes se han traducido en guías de práctica clínica. Es de resaltar que, desde su creación, las evaluaciones de las actuaciones no han estado relacionadas con las enfermedades infecciosas y la Microbiología Clínica, por lo que no se han realizado evaluaciones de técnicas rápidas y de point-of-care relacionadas con esta área.
Recientemente, el NICE ha publicado de forma simultánea una revisión sistemática y un metaanálisis para establecer una estimación de costes y un análisis de coste-utilidad (medido en AVAC) del diagnóstico sobre muestra directa (sangre) de la bacteriemia y la fungemia de 3sistemas comerciales (2 de ellos basados en técnicas moleculares de amplificación por PCR en tiempo real y un tercero en una técnica molecular también de PCR en tiempo real acoplada posteriormente con la espectrometría de masas del producto amplificado) en comparación con el diagnóstico convencional, en el que se incluía tanto la identificación mediante pruebas bioquímicas como con el sistema MALDI TOF a partir de frascos de hemocultivos crecidos17. Empleando 2modelos diferentes de análisis, ninguno de los sistemas mostró utilidad clínica o coste-efectividad favorable basándose en las evidencias publicadas. Sin embargo, de todos los sistemas, el que combina la amplificación molecular con la espectrometría de masas fue el que mostró un mayor beneficio incremental neto cuando se ajustó a años de vida ganados en salud con un coste inferior a 20.000 £/AVAC).
De la evaluación de los valores diagnósticos a la evaluación clínica y económica: ¿hacia un nuevo escenario?El 7 de marzo y el 5 de abril de 2017, el Consejo y el Parlamento europeos aprobaron el nuevo Reglamento europeo 2017/74639 que regula las normas de introducción en el mercado, la comercialización y puesta en servicio de los productos sanitarios para el diagnóstico in vitro de uso humano y accesorios de dichos productos en la Unión Europea. Este reglamento, que revisa y deroga normas anteriores, se publicó en el Diario Oficial de la Unión Europea y entró en vigor el 26 de mayo de 2017 en todo su territorio, sin necesidad de transposición legislativa en los ordenamientos nacionales por los estados miembros. Se evita con ello la disparidad de criterios en su transposición en cada uno de los estados de la Unión y condiciona una aplicación similar en todos ellos. No obstante, se dejó un periodo transitorio de implantación paulatina de 5años hasta su efectividad plena a partir del 26 de mayo de 2022. Este reglamento incide en los aspectos previos a su comercialización y marcado CE y también a la poscomercialización. Afecta a todos los productos de diagnóstico in vitro incluyendo los de diagnóstico rápido, de point-of-care y autodiagnóstico y establece que el proceso sea mucho más técnico, con el fin de asegurar resultados precisos y fiables que se adapten al beneficio clínico derivado de su utilización (cribado, monitorización o diagnóstico).
Según el Reglamento 2017/746, para que los productos sanitarios puedan comercializarse en la Unión Europea es necesario documentar, mediante diferentes estudios o ensayos: a) su validez científica, b) el funcionamiento analítico y c) el funcionamiento clínico. El primero, validez científica, exige establecer el fundamento de la técnica mediante una relación demostrada entre el parámetro (o analito en estudio) y el estado clínico o fisiológico objeto de estudio. El funcionamiento analítico incide en la capacidad del producto para detectar o medir correctamente el parámetro (o analito) concreto que se cuantifica y expresa en términos de sensibilidad y especificidad analíticas, veracidad (sesgo), precisión (repetibilidad y reproducibilidad), exactitud (resultante de la veracidad y la precisión), límites de detección y cuantificación, rango de medida, linealidad, valor de corte, incluida la determinación de los criterios apropiados de recogida y manipulación de muestras y de control de las interferencias endógenas y exógenas pertinentes conocidas y de las reacciones cruzadas. Por último, el funcionamiento clínico mide la capacidad de un producto para producir resultados correlacionados con una situación clínica o con un proceso o estado fisiológico o patológico concreto en función de la población de referencia y del usuario previsto. El funcionamiento clínico debe medirse en términos de sensibilidad y especificidad diagnósticas, valor predictivo positivo y negativo, cociente de verosimilitud y valores previstos en poblaciones sanas y enfermas.
Este reglamento legisla la necesidad de realizar estudios (ensayos) con un plan definido que incluya la justificación, los objetivos, el diseño, la metodología, la supervisión, las consideraciones estadísticas, la organización y su desarrollo con el fin de demostrar o confirmar la validez científica, el funcionamiento analítico y, en su caso, el funcionamiento clínico del producto de diagnóstico in vitro. Estos ensayos deben realizarse bajo la responsabilidad de un promotor, que puede ser tanto el fabricante como otra persona física. Deben, asimismo, ser autorizados por los respectivos comités clínicos (o comités éticos) y adaptarse a las normativas de buena práctica clínica de confidencialidad de los datos. Como excepción en la autorización de los comités clínicos, estarán los estudios para los que se utilicen muestras remanentes o sobrantes. El fabricante debe, además, asegurar su actualización conforme se produzca el avance en el conocimiento y en la práctica médica. El reglamento también recoge la información que debe ofrecerse junto con el producto comercializado.
Pese al detallado proceso normativo que marca el Reglamento 2017/746 para los productos sanitarios de diagnóstico in vitro, no legisla sobre la necesidad de realizar estudios económicos o de coste-efectividad derivados de su implantación, por lo que deberán ser los estados miembros de la Unión Europea los que marquen los criterios de su realización. En España, el Ministerio de Sanidad, a través de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud (http://www.redets.msssi.gob.es/home.htm) o la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) (https://www.aemps.gob.es/productosSanitarios/inVitro/home.htm), debe asumir esta responsabilidad. No obstante, la regulación de los ensayos de funcionamiento clínico favorecerá la obtención de datos que faciliten los estudios de evaluación económica.
ConclusionesLas pruebas rápidas de diagnóstico realizadas en el laboratorio de microbiología o en el lugar de atención al paciente, así como en los denominados laboratorios point-of-care, han tenido un amplio desarrollo en los últimos años. Sin embargo, su introducción no siempre ha tenido la implantación esperada, ya que con frecuencia se valora exclusivamente el precio de la prueba y, en su caso, el de los equipos diagnósticos necesarios para su desarrollo y no el impacto clínico global. Los estudios más habituales en las valoraciones económicas que también tienen en cuenta el impacto clínico incluyen los análisis de coste-efectividad, coste-beneficio y coste-utilidad. El nuevo reglamento europeo que regula la autorización de la comercialización de los productos sanitarios para el diagnóstico in vitro y que también incluye las pruebas rápidas y de desarrollo en el lugar de atención al paciente de uso humano, puede favorecer la obtención de datos que faciliten su evaluación económica. Los estudios publicados recientemente con la espectrometría de masas en el diagnóstico de la bacteriemia y su repercusión clínica y económica pueden servir de ejemplo para estos estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses