Streptococcus pneumoniae es una causa importante de morbimortalidad. Los niños con ciertas patologías de base tienen más riesgo de presentar una enfermedad neumocócica, incluida la enfermedad neumocócica invasiva (ENI). El objetivo de este estudio es estimar las tasas de hospitalización por ENI en niños con condiciones de riesgo en Cataluña y describir sus características.
Material y métodoEstudio longitudinal retrospectivo de la incidencia de ingresos hospitalarios por ENI entre 2005 y 2012, en los niños menores de 16 años asignados a los centros de atención primaria del Institut Català de la Salut, con condiciones de riesgo para enfermedad neumocócica invasiva. La información se recogió a partir de la historia clínica electrónica de los equipos de atención primaria y del Conjunto Mínimo Básico de Datos de hospitalización de agudos.
ResultadosLa tasa global de hospitalizaciones por ENI en niños con enfermedad de base fue de 43,1 casos por 100.000 personas-año (IC del 95%: 32,2-57,7). La tasa más alta se observó en los niños<2 años (107,8 por 100.000 personas-año; IC del 95%: 69-168,3) y en aquellos con trastornos neuromusculares y/o fístula de líquido cefalorraquídeo (141,6 por 100.000 personas-año) y síndrome de Down (133,5 por 100.000 personas-año).
ConclusionesLa tasa de ingresos por ENI en población pediátrica con condiciones de riesgo en Cataluña es similar a la observada en otras series y superior a la descrita en población general. Es necesario implementar estrategias de vacunación dirigidas específicamente a estos grupos de alto riesgo.
Streptococcus pneumoniae is a significant cause of morbidity and mortality. Children with certain conditions are at risk of developing pneumococcal disease, including invasive pneumococcal disease (IPD). The aim of this study is to estimate admission rates for IPD in children with risk conditions in Catalonia, and to describe their characteristics.
Material and methodRetrospective longitudinal study of admission rates due to IPD between 2005 and 2012 in children younger than 16 years referred by Primary Care Centres of the Catalan Institute of Health, with risk conditions for invasive pneumococcal disease. Information was obtained from electronic medical records in the Primary Care Centres and from the Minimum Basic Data Set (MBDS) of acute hospital admissions.
ResultsThe overall IPD hospital admission rate in children with underlying conditions was 43.1 cases per 100,000 persons-year (95% CI: 32.2-57.7). The rate was higher in children <2 years old (107.8 per 100,000 persons-year; 95% CI: 69-168.3), and in those with neuromuscular disease and/or cerebrospinal fluid leak (141.6 per 100,000 persons-year), and Down's syndrome (133.5 per 100,000 persons-year).
ConclusionsThe hospital admission rate due to IPD in children with risk conditions in Catalonia is similar to that observed in other series, and higher than that described in the general population. It is necessary to implement immunisation strategies aimed directly at these risk groups.
Streptococcus pneumoniae (S. pneumoniae) es una causa importante de morbimortalidad. A nivel mundial, se ha estimado que se producen 1,6 millones de muertes anuales por enfermedad neumocócica1, de las cuales 541.000 se dan en niños menores de 5 años, 6.800 de ellas en la Región Europa de la Organización Mundial de la Salud2.
Entre las patologías más graves que causa el neumococo cabe mencionar la enfermedad neumocócica invasiva (ENI), que se define con la presencia de S. pneumoniae en muestras habitualmente estériles, e incluye la meningitis, la bacteriemia, la endocarditis, la peritonitis, la artritis o la osteomielitis neumocócicas.
La vacunación antineumocócica ha sido clave en la disminución de la morbilidad por esta infección, en especial por ENI3: En EE. UU., la incidencia de ENI en niños menores de 5 años ha disminuido desde 76,4 casos por 100.000 en 1997 a 21,2 en 2005 y a 10 en 20134. Estudios realizados en distintos países europeos muestran también esta disminución en la incidencia de ENI en niños y en concreto de la causada por serotipos incluidos en la vacuna conjugada 7-valente5-7. Esta disminución también se ha observado tras la comercialización de la vacuna 13-valente8,9. En España algunos estudios también han demostrado una disminución de la incidencia de ENI tras la introducción de la vacuna 7-valente10 y 13-valente11,12. En Cataluña, y desde 200113,14, el programa oficial de vacunaciones ha financiado la vacuna antineumocócica conjugada solo a los niños con ciertas patologías crónicas de base y la vacuna polisacárida 23-valente a los niños con estas patologías mayores de 2 años de edad.
Está descrito que los niños con ciertas enfermedades de base tienen un mayor riesgo de ENI. En un estudio de van Hoek et al.15, realizado en Inglaterra, los niños de 2-15 años con condiciones de riesgo, especialmente hepatopatías crónicas, inmunosupresión y enfermedades respiratorias crónicas, tenían un mayor riesgo de hospitalización por ENI (odds ratio [OR]: 11,7; intervalo de confianza del 95% [IC del 95%]: 10,2-13,3) y de muerte por esta causa (OR: 2,4; IC del 95%: 1,2-5,1). Hjuler et al.16, en un estudio llevado a cabo en Dinamarca en niños de 0 a 17 años, observaron que los niños con patologías crónicas de base tenían un riesgo 2,4 veces mayor de presentar ENI que los niños que no las presentaban. Tras agrupar los riesgos relativos de las patologías «de riesgo» y «de alto riesgo» observados por Pelton et al.17, los niños menores de 5 años con condiciones de riesgo tenían unas tasas de ENI 2,1 veces mayores que los niños sin ellas, y eran 5,4 veces mayores para los niños de 5 a 17 años.
El objetivo de este estudio es estimar las tasas de hospitalización por ENI en niños con condiciones de riesgo en Cataluña durante el periodo 2005-2012 y describir las características sociodemográficas, vacunales y médicas de estos niños.
Material y métodoDiseño y ámbito del estudioEstudio longitudinal retrospectivo de la incidencia de los ingresos hospitalarios por ENI entre 2005 y 2012 en pacientes pediátricos con condiciones de riesgo para enfermedad neumocócica.
Población y criterios de selecciónSe seleccionó para su inclusión en el estudio a todos los pacientes pediátricos asignados a Centros de Atención Primaria del Institut Català de la Salut (ICS), que al finalizar el periodo de estudio fueran menores de 16 años, que hubieran requerido uno o más ingresos hospitalarios por ENI entre 2005 y 2012, y que presentaran una o más condiciones de riesgo de ENI para las que en Cataluña se financia la vacuna antineumocócica13.
Fuente de datosLos datos referentes a la población en estudio, así como sus características sociodemográficas, médicas y vacunales se han obtenido a partir del Sistema de Información para el Desarrollo de la Investigación en Atención Primaria18. Los datos referentes a los ingresos por ENI se han obtenido a partir del conjunto mínimo básico de datos en hospitales de agudos (CMBD-HA).
Variables estudiadasSe obtuvo información sobre las siguientes variables:
- –
Variables demográficas: género, edad (categorizada en los siguientes estratos:<2años, 2-5 años, y 6-15 años) y nacionalidad.
- –
Variables médicas: tipo y número de condiciones de riesgo (categorizadas a partir de los diagnósticos CIE-10 en los siguientes grupos: patología respiratoria crónica (excluyendo el asma); cardiopatía; inmunosupresión (tratamiento con corticoides o fármacos inmunosupresores, trastorno inmunológico o neoplasia); trastorno neuromuscular y/o fístula de líquido cefalorraquídeo; diabetes mellitus; síndrome de Down; nefropatía; hepatopatía, y trastorno hemático (hemoglobinopatía, anemia de células falciformes, asplenia anatómica o funcional). Entre los trastornos respiratorios crónicos se ha excluido el asma porque no se incluye en las indicaciones de vacunación antineumocócica infantil financiadas por el sistema público de salud en Cataluña13.
- –
Variables relacionadas con la vacunación antineumocócica: pauta adecuada o inadecuada de vacunación antineumocócica (según la edad).
- –
Variables relacionadas con el ingreso: ingreso por ENI; tipo de ENI (meningitis, bacteriemia, endocarditis, peritonitis, artritis u osteomielitis neumocócicas) y días de estancia hospitalaria. Se consideró como meningitis neumocócica (o meningitis asociada a infección neumocócica) los códigos CIE-9: 320.9+041.2, 322.9+041.2 o 320.1; como bacteriemia neumocócica (o bacteriemia asociada a infección neumocócica) los códigos CIE-9: 790.7+ 041.2, 77.83+041.2, 038.9+041.2 o 038.2; como endocarditis neumocócica (o endocarditis asociada a infección neumocócica) los códigos CIE-9: 421.x+041.2; como peritonitis neumocócica (o peritonitis asociada a infección neumocócica) los códigos CIE09: 567.0+041.2, 567.9+041.2 o 567.1; como artritis neumocócica (o artritis asociada a infección neumocócica) los códigos 711.0+041.2, y como osteomielitis neumocócica (u osteomielitis asociada a infección neumocócica) los códigos CIE-9: 730.0x+041.2 o 730.2x+041.2.
La información a la que se tuvo acceso era anónima y no contenía datos identificativos de los pacientes, lo que preservó en todo momento la confidencialidad de la misma. El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del Instituto de Investigación en Atención Primaria Jordi Gol, con el código P15/079.
Análisis estadísticoSe realizó un análisis descriptivo univariado de las variables en estudio. Las variables cualitativas se definieron para cada categoría con el número absoluto y el porcentaje. Las variables cuantitativas se sometieron a pruebas de normalidad (gráficos P-P y Q-Q, prueba de Kolmogorov-Smirnov); las que presentaron una distribución normal se describieron con la media ± desviación estándar, y aquellas que no cumplieron criterios de normalidad con la mediana y el rango intercuartílico (RIC).
Para calcular las tasas, se han utilizado como denominador las personas-año de seguimiento de la población del estudio (desde el 1 de enero del 2005 o la fecha de nacimiento hasta el 31 de diciembre del 2012), y como numerador todos los episodios de ENI en dicha población (los pacientes seguían a riesgo después de episodio de ENI). Las tasas se han expresado como episodios de ENI por 100.000 personas-año. Para cada tasa se calculó el correspondiente IC del 95% con el método de Wilson.
Los análisis estadísticos se realizaron con el paquete de programas estadísticos SPSS versión 18; para calcular la distribución de personas-años de seguimiento por grupos de edad se definió un modelo de Lexis19 con el paquete EPI20 del programa R21.
ResultadosEl total de niños menores de 16 años registrados en la base de datos de Atención Primaria fue de 904.682, de los cuales se seleccionaron 16.405 (1,8%) con condiciones de riesgo para ENI. De estos, 40 (0,2%) tuvieron al menos un episodio de ENI entre 2005 y 2012.
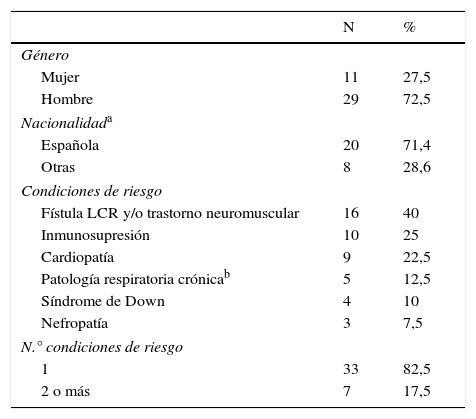
Análisis descriptivoDe los 40 sujetos con algún episodio de ENI, 11 (27,5%) eran niñas y 20 (71,4%) eran de nacionalidad española (tabla 1).
Niños con condiciones de riesgo y con uno o más ingresos hospitalarios por enfermedad neumocócica invasiva (ENI), 2005-2012 (n=40)
| N | % | |
|---|---|---|
| Género | ||
| Mujer | 11 | 27,5 |
| Hombre | 29 | 72,5 |
| Nacionalidada | ||
| Española | 20 | 71,4 |
| Otras | 8 | 28,6 |
| Condiciones de riesgo | ||
| Fístula LCR y/o trastorno neuromuscular | 16 | 40 |
| Inmunosupresión | 10 | 25 |
| Cardiopatía | 9 | 22,5 |
| Patología respiratoria crónicab | 5 | 12,5 |
| Síndrome de Down | 4 | 10 |
| Nefropatía | 3 | 7,5 |
| N.° condiciones de riesgo | ||
| 1 | 33 | 82,5 |
| 2 o más | 7 | 17,5 |
El 82,5% de los niños con ENI (n=33) presentaban solo una de las condiciones de riesgo consideradas en estudio. La condición de riesgo más frecuente fue la patología neuromuscular y/o fístula de líquido cefalorraquídeo (16 niños, 40%), seguida por la inmunosupresión (10 niños, 25%) y la cardiopatía (9 niños, 22,5%).
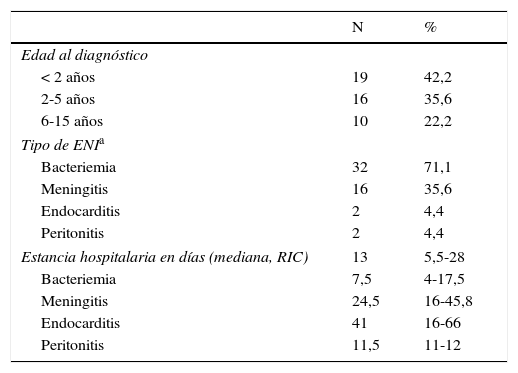
En los niños estudiados se diagnosticaron 45 episodios de ENI (tabla 2). La mediana de la edad en el momento del diagnóstico fue de 2,6 años (RIC=1,2-5,8). En 32 ingresos (71,1%) había un diagnóstico de bacteriemia neumocócica, en 16 (35,6%) un diagnóstico de meningitis neumocócica, en 2 (4,4%) de endocarditis neumocócica, y en 2, de peritonitis neumocócica. No hubo ningún episodio de artritis neumocócica ni de osteomielitis neumocócica. El 46,7% de los episodios de ENI (n=21) se produjeron en niños que habían recibido previamente alguna dosis de vacuna antineumocócica, pero solo 7 (15,6%) se dieron en niños que habían recibido una pauta vacunal completa de vacuna antineumocócica antes del ingreso por ENI, según las vacunas disponibles en aquel momento y las recomendaciones de vacunación establecidas por el Departament de Salut de Cataluña. La mediana de la estancia hospitalaria fue de 13 días (RIC 5,5-28 días). No se produjo ninguna muerte por ENI en los pacientes hospitalizados durante el periodo estudiado.
Ingresos hospitalarios por enfermedad neumocócica invasiva (ENI) en niños con condiciones de riesgo, 2005-2012 (n=45)
| N | % | |
|---|---|---|
| Edad al diagnóstico | ||
| < 2 años | 19 | 42,2 |
| 2-5 años | 16 | 35,6 |
| 6-15 años | 10 | 22,2 |
| Tipo de ENIa | ||
| Bacteriemia | 32 | 71,1 |
| Meningitis | 16 | 35,6 |
| Endocarditis | 2 | 4,4 |
| Peritonitis | 2 | 4,4 |
| Estancia hospitalaria en días (mediana, RIC) | 13 | 5,5-28 |
| Bacteriemia | 7,5 | 4-17,5 |
| Meningitis | 24,5 | 16-45,8 |
| Endocarditis | 41 | 16-66 |
| Peritonitis | 11,5 | 11-12 |
En 4 ingresos se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y meningitis neumocócica, en 2 ingresos se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y peritonitis neumocócica, y en un ingreso se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y endocarditis neumocócica.
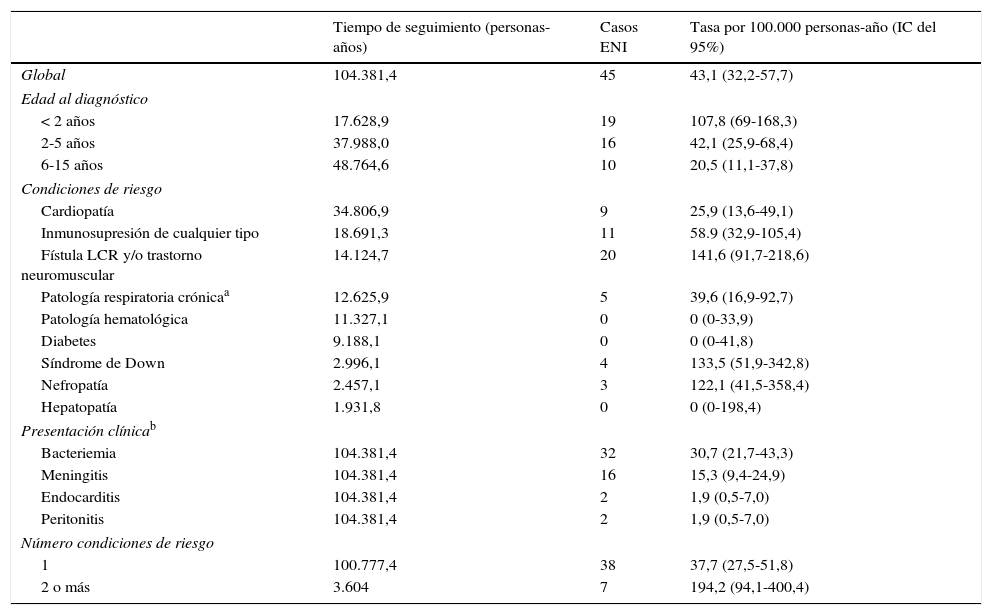
La tasa global anual de hospitalización por ENI en el periodo de estudio fue de 43,1 casos por 100.000 personas-año (IC del 95%=32,2-57,7). Por grupos de edad, las tasas presentan una tendencia decreciente a medida que aumenta la edad (tabla 3), siendo los niños menores de 2 años los que presentan las tasas más elevadas (107,8 por 100.000 personas-año; IC del 95%= 69-168,3). Según las condiciones de riesgo de los niños estudiados, las tasas más elevadas fueron en niños con patología neuromuscular y/o fístula de líquido cefalorraquídeo, con 141,6 casos de ENI por 100.000 personas-año (IC del 95%:91,7-218,6), seguido de los niños con síndrome de Down (133,5 por 100.000 personas-año, IC del 95%:51,9-342,8).
Tasas de enfermedad neumocócica invasiva (ENI) en niños con condiciones de riesgo según edad, condiciones de riesgo y presentación clínica (2005-2012)
| Tiempo de seguimiento (personas-años) | Casos ENI | Tasa por 100.000 personas-año (IC del 95%) | |
|---|---|---|---|
| Global | 104.381,4 | 45 | 43,1 (32,2-57,7) |
| Edad al diagnóstico | |||
| < 2 años | 17.628,9 | 19 | 107,8 (69-168,3) |
| 2-5 años | 37.988,0 | 16 | 42,1 (25,9-68,4) |
| 6-15 años | 48.764,6 | 10 | 20,5 (11,1-37,8) |
| Condiciones de riesgo | |||
| Cardiopatía | 34.806,9 | 9 | 25,9 (13,6-49,1) |
| Inmunosupresión de cualquier tipo | 18.691,3 | 11 | 58.9 (32,9-105,4) |
| Fístula LCR y/o trastorno neuromuscular | 14.124,7 | 20 | 141,6 (91,7-218,6) |
| Patología respiratoria crónicaa | 12.625,9 | 5 | 39,6 (16,9-92,7) |
| Patología hematológica | 11.327,1 | 0 | 0 (0-33,9) |
| Diabetes | 9.188,1 | 0 | 0 (0-41,8) |
| Síndrome de Down | 2.996,1 | 4 | 133,5 (51,9-342,8) |
| Nefropatía | 2.457,1 | 3 | 122,1 (41,5-358,4) |
| Hepatopatía | 1.931,8 | 0 | 0 (0-198,4) |
| Presentación clínicab | |||
| Bacteriemia | 104.381,4 | 32 | 30,7 (21,7-43,3) |
| Meningitis | 104.381,4 | 16 | 15,3 (9,4-24,9) |
| Endocarditis | 104.381,4 | 2 | 1,9 (0,5-7,0) |
| Peritonitis | 104.381,4 | 2 | 1,9 (0,5-7,0) |
| Número condiciones de riesgo | |||
| 1 | 100.777,4 | 38 | 37,7 (27,5-51,8) |
| 2 o más | 3.604 | 7 | 194,2 (94,1-400,4) |
IC del 95%: intervalo de confianza del 95%.
En 4 ingresos se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y meningitis neumocócica, en 2 ingresos se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y peritonitis neumocócica, y en un ingreso se codificaron simultáneamente los diagnósticos de bacteriemia neumocócica y endocarditis neumocócica.
La tasa de hospitalización por ENI en los niños que presentaban más de una condición de riesgo fue 5,2 veces mayor que en los que solo tenían una condición.
DiscusiónLa tasa global de ENI en niños con condiciones de riesgo obtenida en el presente estudio (43,1 casos por 100.000 personas-año) es similar a la descrita por van Hoek et al.15, que observaron tasas de ENI de 46 por 100.000 en niños de 2-15 años con condiciones de riesgo, y algo superiores a las de Pelton et al.17, que obtienen tasas de 15,5 por 100.000 en niños con condiciones de riesgo menores de 5 años, y de 6 casos por 100.000 en niños de 5-17 años. Las posibles diferencias en la metodología (caracterización de las patologías incluidas en cada uno de los grupos de riesgo) pueden explicar las diferencias en las tasas detectadas, así como la influencia de los programas de vacunación sistemática infantil. La vacuna antineumocócica conjugada no es sistemática en Cataluña, por lo que las coberturas vacunales alcanzadas a nivel poblacional son bajas, insuficientes para generar inmunidad de grupo y tener impacto sobre la incidencia de la enfermedad en el colectivo de niños con condiciones de riesgo, como los incluidos en este estudio. Por el contrario, los estudios de Pelton et al.17 y van Hoek et al.15 se realizaron en países con programas de vacunación antineumocócica sistemática infantil.
Tanto la condición de riesgo más frecuente entre los niños del estudio ingresados por ENI como la tasa de ENI más alta se dio en los niños con patología neuromuscular y/o fístula de líquido cefalorraquídeo. Estos resultados difieren de los descritos por Pelton et al.17, cuyas tasas más elevadas se observaron en los niños con patologías o tratamientos inmunosupresores (en los menores de 5 años) y en los que presentaban «enfermedades leucocitarias» (en los de 5-17 años). Van Hoek et al.15 describen las tasas de ENI más altas en niños con asplenia y con hepatopatías crónicas. El pequeño tamaño muestral en algunos de los grupos, así como las posibles diferencias existentes en las patologías incluidas en cada uno, podrían explicar estas variaciones.
Según datos de estudios llevados a cabo con población pediátrica en general, en EE. UU. la tasa de ENI en 2007 en menores de 5 años fue de 23,6 por 100.000 personas-año y en 5-17 años de 2,4 por 100.000 personas-año3. En Europa, según datos del European Centre for Disease Prevention and Control, la tasa de ENI en 2011 fue de 10,9 por 100.000 personas-año en menores de 1 año, 5,8 por 100.000 personas-año en niños de 1 a 4 años, y 1,5 por 100.000 personas-año en niños 5 a 14 años22. En estudios realizados en España, en población pediátrica general, también se observan diferencias importantes con nuestro trabajo, en poblaciones de Madrid23, en Castilla y León24, en Gran Canaria25, en la Comunidad Valenciana11 y en Cataluña26,27, con cifras que oscilan entre 4,6 y 16,6 por 100.000 personas-año. Es lógico que estas tasas sean inferiores a las del presente estudio, ya que se trata de población pediátrica general, en que solo un mínimo porcentaje de niños tiene condiciones de riesgo.
Al igual que en otros trabajos publicados, la infección más frecuente en nuestro estudio ha sido la bacteriemia3,17,22.
Los datos de este estudio no incluyen información sobre los serotipos causantes de ENI, ya que se trata de un estudio retrospectivo basado en información del CMBD. Tampoco permiten calcular con precisión en la población de estudio (n=16.405 niños) la cobertura de vacunación antineumocócica, debido a que la pauta y el número de dosis indicadas en cada caso dependen no solo de la edad del niño, sino también del momento en que se diagnosticó la condición de riesgo, del tipo de vacuna administrada y de las pautas de adaptación entre la vacuna 7-valente y la 10 o la 13-valentes. Estas limitaciones nos han impedido poder analizar los posibles fallos vacunales en la población de estudio. En un artículo anterior relacionado con esta misma investigación28, se determinó que, entre la población de estudio, el 47,7% de los niños con condiciones de riesgo en Cataluña habían recibido al menos alguna dosis de cualquiera de las vacunas antineumocócicas disponibles, porcentaje similar (46,7%) al obtenido en el grupo de los niños que habían sido hospitalizados por ENI. Nuestro estudio solo incluye a los niños asignados a los EAP del ICS, por lo que no se dispone de información de los niños que son atendidos exclusivamente por otros proveedores de salud o bien en el ámbito privado. Sin embargo, se estima que el ICS da cobertura al 78% de la población catalana (5,8 millones de ciudadanos) y que el 70% se visita por su EAP al menos una vez al año y el 85% al menos una vez en 3 años29. Por ello, creemos que los niños incluidos en el estudio constituyen una muestra muy amplia, mayor que la de cualquier otro estudio publicado hasta ahora sobre este tema en nuestro medio y que probablemente los resultados obtenidos son representativos de la situación real de los niños con condiciones de riesgo de Cataluña.
Como en todo estudio que utiliza como fuente de información la historia clínica informatizada, se deben tener en cuenta los posibles errores de registro (p. ej., en los antecedentes vacunales), aunque desde hace años se está realizando un constante trabajo a todos los niveles para obtener una información lo más depurada y correcta posible30.
En conclusión, el presente estudio muestra que la tasa de ingresos por ENI en población pediátrica con condiciones de riesgo en Cataluña es relativamente elevada y señala la necesidad de llevar a cabo estrategias de vacunación dirigidas específicamente a esta población, especialmente en los niños más pequeños, en aquellos con trastorno neuromuscular y/o fístula de líquido cefalorraquídeo, síndrome de Down y nefropatía, así como en los que presentan más de una condición de riesgo.
Conflicto de interesesLa Dra. Magda Campins ha sido ponente de simposios esponsorizados por Pfizer y ha formado parte de comités de expertos de este mismo laboratorio.
Los autores desean expresar su agradecimiento al Sistema d’Informació per al Desenvolupament de la Investigació en Atenció Primària (SIDIAP), especialmente a los doctores Leonardo Méndez y Ermengol Coma, por su valiosa colaboración en el proyecto.
Este trabajo ha sido realizado en el marco del Programa de Doctorado en Ciencias de la Salud de la Universidad Autónoma de Barcelona.