El objetivo es analizar la incidencia, el manejo y el coste asociado a los efectos adversos (EA) hematológicos y dermatológicos en pacientes con hepatitisC crónica en tratamiento con telaprevir (TVR) o boceprevir (BOC).
MétodoEstudio observacional y prospectivo de una cohorte de pacientes que iniciaron tratamiento con TVR o BOC asociado a peg-interferón-alfa y ribavirina con un seguimiento de 12semanas.
ResultadosSe incluyeron 53 pacientes (TVR n=36; BOC n=17). Los EA más frecuentes fueron trombocitopenia (83% TVR vs. 88% BOC), seguida de neutropenia (89% TVR vs. 82% BOC). El 32% de los pacientes manifestaron EA dermatológicos. En 11 pacientes fue necesaria la suspensión del tratamiento (todos ellos tratados con TVR), siendo el motivo principal la toxicidad (64%). El 66% de los pacientes precisaron algún fármaco para el tratamiento de los EA, siendo la eritropoyetina el fármaco más empleado. En 8 pacientes fue necesaria asistencia de urgencia y 2 fueron hospitalizados debido a los EA. El coste total de los recursos adicionales fue de 32.522€ (625 [DE=876]€/paciente) (TVR 759 [DE=1.022]€/paciente vs. BOC 349 [DE=327]€/paciente]; p>0,05). Los pacientes con toxicidad gradosiii-iv consumieron mayor número de recursos adicionales con mayor coste en comparación con los pacientes con toxicidad gradosi-ii (849 [DE=1.143]€/paciente vs. 387 [DE=397]€/paciente; p=0,053).
ConclusiónLa incorporación de los nuevos inhibidores de proteasa al tratamiento convencional conlleva una mayor incidencia de EA hematológicos que la descrita en los ensayos clínicos. Esta elevada incidencia de EA hace necesaria la utilización de recursos adicionales que incrementan el coste total de la terapia.
The aim of the study was to analyze the incidence, management and cost associated to hematological and dermatological adverse effects (AE) in chronic hepatitis C patients on triple therapy (TT) with telaprevir (TVR) or boceprevir (BOC).
MethodsAn analysis was made on the data recorded on patients who started treatment with TVR or BOC associated with peginterferon alfa and ribavirin in a 12-week follow-up period.
ResultsFifty-three patients were included (TVR n=36; BOC n=17). Thrombocytopenia (83% TVR vs. 88% BOC) followed by neutropenia (89% TVR vs. 82% BOC) were the most common AE. Dermatological AE were observed in 32% of patients. Eleven patients required treatment discontinuation (all of them received TVR), and toxicity was the main reason for discontinuation (64%). The percentage of patients who required supportive treatment for management of AE was 66%. The most used supportive treatment was erythropoietin. Eight patients required emergency health care, and 2 were hospitalized due to AE. Total cost of additional supportive resources was 32,522€ (625 [SD=876]€/patient) (TVR 759 [SD=1,022]€/patient vs. BOC 349 [SD=327]€/patient; P>.05). Patients with gradeiii-iv toxicity required greater supportive care with higher costs, compared to patients with gradei-ii toxicity (849 [SD=1,143]€/patient vs. 387 [SD=397]€/patient; P=.053).
ConclusionThe addition of new protease inhibitors to conventional treatment leads to a higher incidence of hematological AE in our study, compared to data described in clinical trials. The elevated incidence of AE involves the use of supportive care, increasing total costs of therapy.
En 2008, la Organización Mundial de la Salud estimó que entre el 2 y el 3% de la población mundial estaba infectada por el virus de la hepatitisC (VHC) (entre 130 y 180 millones de personas en todo el mundo)1. Once genotipos diferentes del virus han sido identificados, aunque el 60% de las infecciones por VHC están causadas por los genotipos 1a y 1b2. La infección por el VHC desarrolla progresivamente una fibrosis hepática, que puede evolucionar a cirrosis o hepatocarcinoma, siendo la hepatitisC crónica (HCC) la causa más frecuente de trasplante hepático a nivel mundial1. La terapia estándar (doble terapia) para HCC basada en la combinación de interferón pegilado (pegIFN) y ribavirina (RBV) ha demostrado una eficacia global de entre el 40 y el 60% en los pacientes con genotipo11.
El genotipo de la interleucina IL28B (CC, CT o TT) predice la respuesta al tratamiento y puede resultar útil para seleccionar el esquema de tratamiento. Los pacientes con genotipo CC tienen una tasa de respuesta viral sostenida (RVS) del 70% con doble terapia y del 90% con triple terapia, mientras que los pacientes con genotipo CT o TT consiguen RVS en un 30% con doble terapia y en un 70% con triple terapia3–5.
La introducción en la terapéutica de los nuevos inhibidores de proteasa telaprevir (TVR) y boceprevir (BOC), que administrados junto con la terapia estándar constituyen la denominada triple terapia, ha supuesto un notable aumento en la eficacia del tratamiento en infecciones por el VHC genotipo1. Sin embargo, existen 2 factores que limitan su uso: el perfil de tolerancia/seguridad y el coste. Así, en los ensayos clínicos de registro de la triple terapia6–9 se identificaron efectos adversos (EA) con mayor incidencia y gravedad respecto a la doble terapia, sobre todo hematológicos y dermatológicos. Por otro lado, el coste de 48 semanas de tratamiento es de 31.412€ para la triple terapia con TVR y de 40.343€ para la triple terapia con BOC, en comparación con los 6.797€ de la doble terapia estándar, lo que podría comprometer, dada la incidencia de la infección, la sostenibilidad económica del mismo. Sin embargo, este incremento del coste no considera los costes asociados al tratamiento de los EA, cuya incidencia también se ve aumentada con estos nuevos fármacos.
El objetivo de este estudio es analizar la incidencia, el manejo y los costes asociados a los EA hematológicos y dermatológicos de la triple terapia tras las primeras 12semanas de tratamiento en pacientes infectados por el VHC genotipo1. Se pretende también calcular el impacto asistencial y económico que supone la aparición de EA con respecto a la asistencia sanitaria estándar que reciben estos pacientes.
MétodosEstudio unicéntrico, observacional y retrospectivo de una cohorte de pacientes infectados por el VHC genotipo1, tanto monoinfectados como coinfectados por el VIH, que iniciaron tratamiento con un inhibidor de proteasa (IP: TVR o BOC) asociado a pegIFN (alfa-2a o alfa-2b) y RBV. Se efectuó un seguimiento de 12semanas en cada paciente. Se consideró como semana0 la de inicio del IP, independientemente de que los pacientes hubieran estado en una fase previa de lead-in. Los pacientes se clasificaron como naïve (pacientes que no hubieran recibido tratamiento previo para la infección por el VHC), y entre los que fueron previamente tratados con doble terapia se diferenció entre pacientes recidivantes (presentan carga viral detectable tiempo después de haber finalizado un tratamiento que consiguió cargas virales indetectables), pacientes con respuesta parcial (reducción de 2 log10 de la carga viral en la semana12 de tratamiento, pero no se llega a negativizar el ARN-VHC durante el tratamiento) y pacientes con respuesta nula (reducción menor de 2log10 de la carga viral en la semana12 de tratamiento). Para cada paciente se recogieron las siguientes variables basales: edad, sexo, peso, polimorfismo ILB28 (requerido únicamente en paciente naïve), FibroScan® o grado de fibrosis hepática mediante biopsia, Child-Pugh, fármacos empleados, carga viral basal (CVVHC), transaminasas, hemoglobina (Hb), recuento absoluto de neutrófilos (RAN) y recuento de plaquetas.
Durante las 12semanas de seguimiento se registraron para cada paciente con periodicidad semanal las visitas médicas, la asistencia de urgencia en el ámbito hospitalario, las analíticas y pruebas diagnósticas efectuadas, los EA hematológicos y dermatológicos manifestados, los fármacos y procedimientos adicionales prescritos para el tratamiento de los EA (incluyendo las transfusiones de sangre, concentrados de hematíes y concentrados de plaquetas), así como la suspensión del tratamiento y su causa. Para definir la asistencia sanitaria estándar se analizaron las visitas y analíticas comunes a todos los pacientes por semanas desde el inicio de la triple terapia, asumiendo una variación de más/menos una semana, siempre que no coincidieran 2 visitas o analíticas en semanas consecutivas. Se consideró como asistencia estándar 3 visitas médicas al facultativo especialista en las semanas 0, 4 y 12, 4 analíticas bioquímicas y 4 hemogramas en las semanas 0, 2, 4 y 12, y 3 determinaciones de CVVHC en las semanas 0, 4 y 12.
Para determinar la presencia de toxicidad hematológica (anemia, neutropenia o trombocitopenia) y asignar el grado de toxicidad se consideró el valor más bajo de Hb, RAN y recuento de plaquetas obtenido durante el seguimiento de 12semanas. La severidad del EA se graduó de acuerdo con la clasificación de la Organización Mundial de la Salud (OMS). Los recursos considerados para el manejo de los EA fueron el tratamiento farmacológico adicional, las visitas a urgencias, las visitas adicionales al especialista en HC, visitas a otros especialistas (dermatología, hematología), pruebas analíticas (hemograma, bioquímica, determinación de carga viral), transfusiones, asistencia de urgencia e ingreso hospitalario.
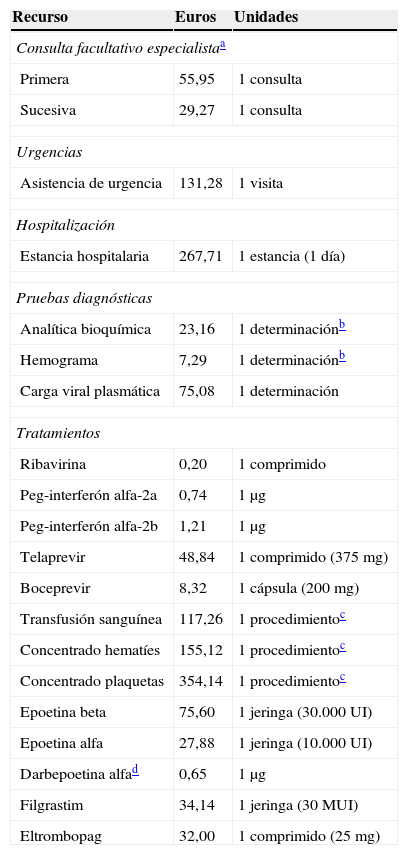
Para determinar el impacto económico derivado de los EA se consideraron los costes sanitarios directos. Para cada paciente, el coste total de su asistencia se calculó multiplicando los recursos utilizados durante las 12semanas por el coste unitario de cada recurso. El coste de los medicamentos se consideró como el precio medio de factura, que se determinó como el precio de venta al laboratorio a fecha diciembre 2012 (PVL) menos el descuento oficial (Real Decreto-Ley 8/2010)10 y, en su caso, los descuentos aplicables por el procedimiento centralizado de compras de la Agencia Valenciana de Salud más el 4% de IVA. El coste de los recursos no farmacológicos utilizados en el manejo de los EA se ha obtenido a partir de la Ley de Tasas del Estado y su desarrollo autonómico (Decreto Legislativo 1/2005 de 25 de febrero11, Ley 9/2011, de 26 de diciembre12), que se recogen en la tabla 1. La perspectiva del análisis es la del financiador en el ámbito de la Comunidad Valenciana, y el horizonte temporal fue de 12semanas.
Coste unitario de los recursos utilizados en el manejo y el tratamiento de los efectos adversos causados por la terapia combinada con PegIFN-RBV-IP
| Recurso | Euros | Unidades |
|---|---|---|
| Consulta facultativo especialistaa | ||
| Primera | 55,95 | 1 consulta |
| Sucesiva | 29,27 | 1 consulta |
| Urgencias | ||
| Asistencia de urgencia | 131,28 | 1 visita |
| Hospitalización | ||
| Estancia hospitalaria | 267,71 | 1 estancia (1 día) |
| Pruebas diagnósticas | ||
| Analítica bioquímica | 23,16 | 1 determinaciónb |
| Hemograma | 7,29 | 1 determinaciónb |
| Carga viral plasmática | 75,08 | 1 determinación |
| Tratamientos | ||
| Ribavirina | 0,20 | 1 comprimido |
| Peg-interferón alfa-2a | 0,74 | 1 μg |
| Peg-interferón alfa-2b | 1,21 | 1 μg |
| Telaprevir | 48,84 | 1 comprimido (375 mg) |
| Boceprevir | 8,32 | 1 cápsula (200 mg) |
| Transfusión sanguínea | 117,26 | 1 procedimientoc |
| Concentrado hematíes | 155,12 | 1 procedimientoc |
| Concentrado plaquetas | 354,14 | 1 procedimientoc |
| Epoetina beta | 75,60 | 1 jeringa (30.000 UI) |
| Epoetina alfa | 27,88 | 1 jeringa (10.000 UI) |
| Darbepoetina alfad | 0,65 | 1 μg |
| Filgrastim | 34,14 | 1 jeringa (30 MUI) |
| Eltrombopag | 32,00 | 1 comprimido (25 mg) |
Para el análisis descriptivo se calcularon las medidas de tendencia central y su variabilidad en el caso de las variables cuantitativas. Los valores medios se presentan con su correspondiente desviación estándar (DE), y las medianas, con la amplitud intercuartil (AIQ). Las variables categóricas se expresan como porcentajes. La relación entre las variables cuantitativas y los diferentes grados de toxicidad se realizó mediante un análisis de la variancia (ANOVA) de una vía con posteriores contrastes de hipótesis mediante el método de Bonferroni para determinar la significación de las diferencias entre las diferentes semanas. Se realizó un análisis multivariante mediante regresión logística para determinar qué parámetros afectaban y en qué medida a la aparición de toxicidad grave (gradosiii y iv). Se consideró un nivel de significación alfa de 0,05. Se utilizó el paquete estadístico Stata/IC 12.0 de StataCorp LP®.
ResultadosSe incluyeron 53 pacientes de 53 (DE=9) años de edad (60% varones), 13 de los cuales presentaban coinfección por el VIH. El 68% (n=36) de los pacientes fueron tratados con TVR, y el 32% (n=17) restante, con BOC. El 70% (n=37; TVR n=28, BOC n=9) de los pacientes se encontraban en seguimiento por el servicio de Medicina Interna, y el 30% restante (n=16; TVR n=8, BOC n=8), por el servicio de Medicina Digestiva. Los pacientes coinfectados fueron tratados mayoritariamente con TVR (12/13). Con respecto al tipo de pegIFN administrado, 41 pacientes recibieron pegIFNα2a y 11 peg-IFNα2b. Las dosis de RBV pautadas al inicio del tratamiento fueron de 800mg/día en pacientes con peso inferior a 65kg (n=6), 1.000mg/día para pesos entre 65 y 80kg (n=26) y 1.200mg al día en pacientes con peso mayor de 80kg (n=21). Las dosis de pegIFNα2a y pegIFNα2b iniciales fueron de 180μg/semana y 1,5μg/kg/semana, respectivamente. Nueve pacientes se clasificaron como naïve, 19 recidivantes, 14 con respuesta parcial y 8 con respuesta nula a los tratamientos anteriores. Entre los pacientes en los que se determinó el polimorfismo de la IL28B (29/53), 9 presentaron polimorfismo CC, 14 CT y 6 TT.
Al inicio de tratamiento, la mediana de CVVHC fue de 650.500 (AIQ: 1.834.550) copias/ml. Los valores medios de AST, ALT y GGT fueron de 60 (DE=41,6) UI/l, 63 (DE=53) UI/l y 128 (DE=139) UI/l, respectivamente. Los valores medios basales de Hb, RAN y plaquetas fueron de 13,75 (DE=1,83) g/dl, 2,64×109/l (DE=1,46×109) y 144×109/l (DE=63×109), respectivamente. Ningún paciente presentaba anemia, neutropenia ni trombocitopenia antes de iniciar el tratamiento. El FibroScan® medio de los pacientes antes de iniciar tratamiento fue de 19,22 (DE=12,3) kPa. Se valoró el Child-Pugh en los 19 pacientes cirróticos incluidos en el estudio, obteniendo en todos los casos nivelA (hepatopatía compensada). No se observaron diferencias estadísticamente significativas entre ambos grupos en la carga viral, AST, ALT, GGT ni en el recuento de plaquetas al inicio del tratamiento. Sin embargo, los pacientes tratados con BOC presentaron niveles de Hb significativamente menores al inicio del tratamiento que los tratados con TVR (12,1 [DE=1,5] g/dl frente a 14,5 [DE=1,5] g/dl; p=0,00001). Del mismo modo, el RAN al inicio del tratamiento en los pacientes tratados con BOC fue menor que en los pacientes tratados con TVR, observándose diferencias estadísticamente significativas (1,55×109/l [DE=0,59×109] frente a 3,11×109/l [DE=1,47×109]; p=0,0002).
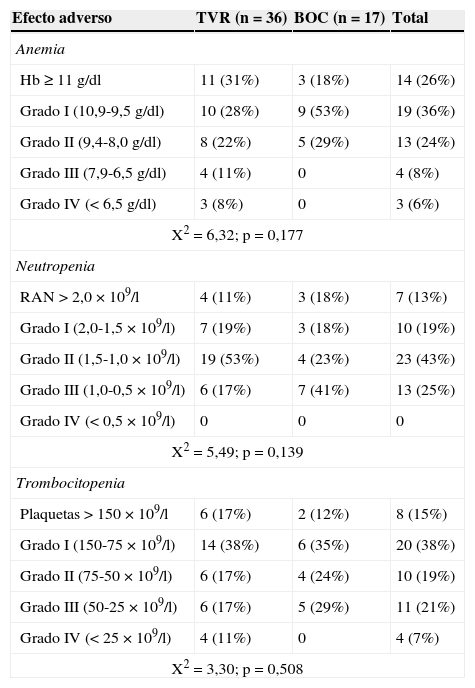
La tabla 2 muestra la incidencia de toxicidad hematológica global, por grado y por fármaco. Destacar que la incidencia global de anemia de cualquier grado fue del 74% (39/53). Los casos de neutropenia gradoiii entre los pacientes tratados con BOC fueron 7 (7/17; 41%), y en los tratados con TVR fueron 6 (6/36; 17%). Entre todos los pacientes estudiados, apareció trombocitopenia de cualquier grado en 45 de los 53 pacientes (85%) durante el período de seguimiento, y 4 de los 45 pacientes (8%) manifestaron trombocitopenia gradoiv, todos ellos pertenecientes al grupo de tratados con TVR.
Incidencia de toxicidad hematológica durante el período de seguimiento del tratamiento antiviral
| Efecto adverso | TVR (n=36) | BOC (n=17) | Total |
|---|---|---|---|
| Anemia | |||
| Hb ≥ 11 g/dl | 11 (31%) | 3 (18%) | 14 (26%) |
| Grado I (10,9-9,5 g/dl) | 10 (28%) | 9 (53%) | 19 (36%) |
| Grado II (9,4-8,0 g/dl) | 8 (22%) | 5 (29%) | 13 (24%) |
| Grado III (7,9-6,5 g/dl) | 4 (11%) | 0 | 4 (8%) |
| Grado IV (<6,5 g/dl) | 3 (8%) | 0 | 3 (6%) |
| X2=6,32; p=0,177 | |||
| Neutropenia | |||
| RAN>2,0×109/l | 4 (11%) | 3 (18%) | 7 (13%) |
| Grado I (2,0-1,5×109/l) | 7 (19%) | 3 (18%) | 10 (19%) |
| Grado II (1,5-1,0×109/l) | 19 (53%) | 4 (23%) | 23 (43%) |
| Grado III (1,0-0,5×109/l) | 6 (17%) | 7 (41%) | 13 (25%) |
| Grado IV (<0,5×109/l) | 0 | 0 | 0 |
| X2=5,49; p=0,139 | |||
| Trombocitopenia | |||
| Plaquetas>150×109/l | 6 (17%) | 2 (12%) | 8 (15%) |
| Grado I (150-75×109/l) | 14 (38%) | 6 (35%) | 20 (38%) |
| Grado II (75-50×109/l) | 6 (17%) | 4 (24%) | 10 (19%) |
| Grado III (50-25×109/l) | 6 (17%) | 5 (29%) | 11 (21%) |
| Grado IV (<25×109/l) | 4 (11%) | 0 | 4 (7%) |
| X2=3,30; p=0,508 | |||
El grado de toxicidad corresponde al del valor más bajo de hemoglobina (Hb), recuento absoluto de neutrófilos (RAN) y recuento de plaquetas obtenido durante el seguimiento de 12 semanas.
Respecto a la toxicidad dermatológica, se observó algún efecto en el 32% (17/53) de los pacientes, 4 de los cuales (24%) alcanzaron toxicidad en gradoiii-iv, lo que obligó a suspender el IP (TVR). La incidencia de toxicidad dermatológica fue del 35% (6/17) en el grupo de tratados con BOC y del 30% (11/36) en los tratados con TVR.
ManejoRespecto al tratamiento combinado para la HCC, en 5 pacientes se redujo la dosis de algún fármaco durante las 4 primeras semanas de tratamiento: 3 de ellos redujeron dosis de RBV y 2 de PegIFNα. Entre las semanas 4 y 12, se redujo la dosis de RBV en 22 pacientes, y en 6 pacientes la de pegIFNα. En el 21% (11/53) de los pacientes se suspendió alguno de los fármacos durante las primeras 12semanas de tratamiento. Dos pacientes precisaron la suspensión de todo el tratamiento antiviral, uno de ellos por toxicidad y otro por fracaso terapéutico. En 9 pacientes se suspendió únicamente el IP y se mantuvo la doble terapia con PegIFN y RBV: uno de ellos suspendió por fracaso terapéutico, otro por decisión propia y los 7 pacientes restantes manifestaron toxicidad al tratamiento y, al haber superado la octava semana de tratamiento con respuesta virológica adecuada, se decidió suspender únicamente el IP (todos ellos en tratamiento con TVR). En resumen, el motivo de suspensión del tratamiento fue la toxicidad en el 72% (n=8) de los casos y el fracaso terapéutico en el 18% (n=2). Un paciente abandonó por decisión propia.
Los recursos comunes que requirieron todos los pacientes fueron: 3 visitas médicas al facultativo especialista en las semanas 0, 4 y 12; 4uatro analíticas bioquímicas y 4 hemogramas en las semanas 0, 2, 4 y 12, y 3 determinaciones de CVVHC en las semanas 0, 4 y 12.
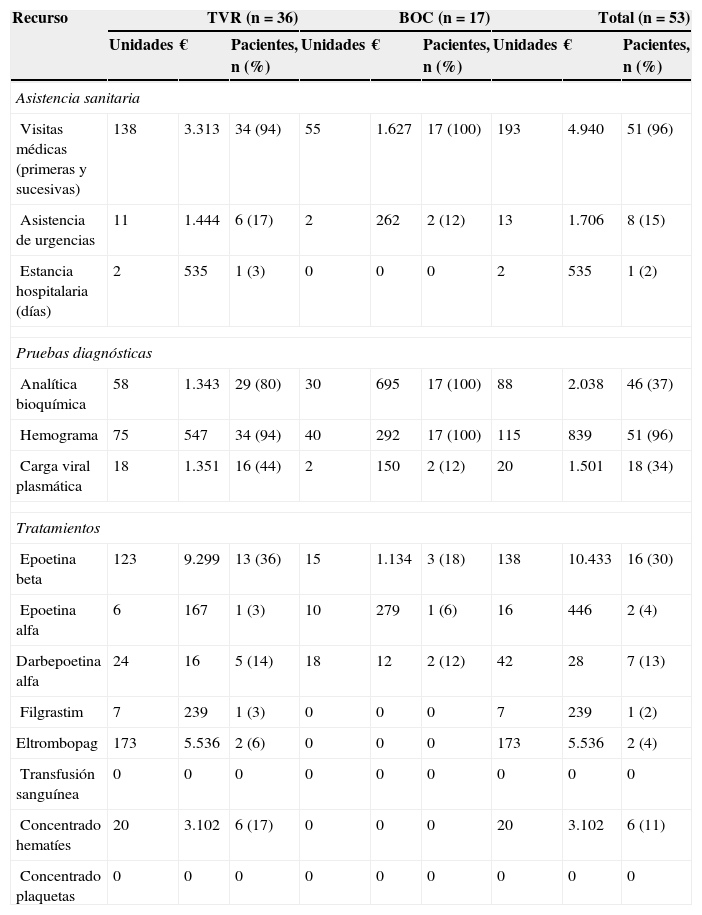
Se realizaron un total de 193 visitas médicas adicionales en 51/53 pacientes, con una mediana de consultas adicionales por paciente de 3 (AIQ: 3) visitas. Entre el grupo de tratados con TVR, 34 pacientes requirieron 138 visitas adicionales, y entre los tratados con BOC todos precisaron alguna visita adicional (55 visitas en 17 pacientes). En total se registraron 13 asistencias de urgencia en 8 pacientes, y un paciente del grupo de TVR precisó un ingreso hospitalario de 2días de duración, en todos los casos debido a la aparición de toxicidad relacionada con el fármaco.
Se efectuaron 88 analíticas bioquímicas adicionales en 46 pacientes, 115 hemogramas en 51 pacientes y 20 determinaciones de CVVHC adicionales en 18 pacientes, observándose diferencias significativas entre el número de CVVHC adicionales en los pacientes con TVR (44%) respecto de los tratados con BOC (12%). La mediana de analíticas (bioquímica+hemograma+CVVHC) adicionales por paciente fue de 4 (AIQ: 2). Los recursos adicionales registrados durante el período de seguimiento y su coste se muestran en la tabla 3.
Recursos adicionales consumidos durante el periodo de seguimiento del tratamiento antiviral
| Recurso | TVR (n = 36) | BOC (n = 17) | Total (n = 53) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Unidades | € | Pacientes, n (%) | Unidades | € | Pacientes, n (%) | Unidades | € | Pacientes, n (%) | |
| Asistencia sanitaria | |||||||||
| Visitas médicas (primeras y sucesivas) | 138 | 3.313 | 34 (94) | 55 | 1.627 | 17 (100) | 193 | 4.940 | 51 (96) |
| Asistencia de urgencias | 11 | 1.444 | 6 (17) | 2 | 262 | 2 (12) | 13 | 1.706 | 8 (15) |
| Estancia hospitalaria (días) | 2 | 535 | 1 (3) | 0 | 0 | 0 | 2 | 535 | 1 (2) |
| Pruebas diagnósticas | |||||||||
| Analítica bioquímica | 58 | 1.343 | 29 (80) | 30 | 695 | 17 (100) | 88 | 2.038 | 46 (37) |
| Hemograma | 75 | 547 | 34 (94) | 40 | 292 | 17 (100) | 115 | 839 | 51 (96) |
| Carga viral plasmática | 18 | 1.351 | 16 (44) | 2 | 150 | 2 (12) | 20 | 1.501 | 18 (34) |
| Tratamientos | |||||||||
| Epoetina beta | 123 | 9.299 | 13 (36) | 15 | 1.134 | 3 (18) | 138 | 10.433 | 16 (30) |
| Epoetina alfa | 6 | 167 | 1 (3) | 10 | 279 | 1 (6) | 16 | 446 | 2 (4) |
| Darbepoetina alfa | 24 | 16 | 5 (14) | 18 | 12 | 2 (12) | 42 | 28 | 7 (13) |
| Filgrastim | 7 | 239 | 1 (3) | 0 | 0 | 0 | 7 | 239 | 1 (2) |
| Eltrombopag | 173 | 5.536 | 2 (6) | 0 | 0 | 0 | 173 | 5.536 | 2 (4) |
| Transfusión sanguínea | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Concentrado hematíes | 20 | 3.102 | 6 (17) | 0 | 0 | 0 | 20 | 3.102 | 6 (11) |
| Concentrado plaquetas | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
La tabla recoge las unidades consumidas de cada recurso, el coste que suponen (€) y los pacientes que han consumido esos recursos.
Con respecto a la utilización de fármacos para el tratamiento de las reacciones adversas, eñ 66% (35/53) de los pacientes precisaron algún fármaco, siendo 24 de ellos del grupo de tratados con TVR y los 11 restantes del grupo de BOC. Del total de 39 pacientes que manifestaron anemia durante el seguimiento, 25 precisaron tratamiento con eritropoyetina (64%): 19 entre los tratados con TVR y 6 entre los tratados con BOC. El tipo de eritropoyetina más utilizado fue la eritropoyetina beta a dosis de 30.000UI subcutánea/semanales (16/25; 64%). Nueve pacientes redujeron inicialmente la dosis de RBV y 5 de ellos lograron controlar la anemia con esta medida, 3 precisaron la administración posterior de eritropoyetina y uno suspendió tratamiento.
Seis pacientes precisaron la administración de un total de 20 concentrados de hematíes. Todos los pacientes pertenecían al grupo de tratados con TVR. Dos pacientes recibieron eltrombopag para el tratamiento de la trombocitopenia, y un paciente filgrastim para el tratamiento de la neutropenia secundaria al tratamiento antiviral. De los 17 pacientes con toxicidad dermatológica, 14 precisaron algún fármaco para el manejo de este EA (antihistamínicos y/o corticoides tópicos/orales). Todos ellos pertenecían al grupo de los tratados con TVR.
CostesEl coste total de los recursos adicionales utilizados para la atención de los pacientes incluidos fue de 32.522€, distribuidos entre 51 pacientes, con un valor medio de 625 (DE=876)€/paciente (rango=46-5.432€/paciente). En pacientes tratados con TVR el valor medio fue de 759 (DE=1.022)€/paciente y con BOC de 349 (DE=327)€/paciente, aunque no se evidenciaron diferencias estadísticamente significativas.
El coste medio de las consultas adicionales a cualquier especialista fue de 141 (DE=116)€/paciente (rango=29-523€/paciente). El 96% de los pacientes precisaron alguna visita adicional.
Las analíticas adicionales supusieron un coste medio de 72 (DE=45)€/paciente, con valores que oscilaron entre 23 y 220€/paciente. El coste medio adicional que supuso la utilización de eritropoyetina en los pacientes que presentaron anemia durante las 12 primeras semanas de tratamiento fue de 588 (DE=440)€/paciente, con valores comprendidos entre 117 y 1.588€/paciente. No se observaron diferencias significativas entre los costes de las visitas, analíticas adicionales y consumo de EPO en los grupos de tratados con TVR y BOC.
La administración de concentrados de hematíes supuso un coste medio de 517 (DE=305)€/paciente (rango=155-931€/paciente). El uso de estimulantes de colonias supuso un coste de 1.813 (DE=1.403)€/paciente (rango=224-2.880€/paciente).
El grupo de pacientes que consumió un mayor número medio de unidades de recursos, con un mayor coste, fueron los que manifestaron toxicidad en gradoiii-iv en comparación con los pacientes que manifestaron toxicidad gradosi-ii (21 [DE=26] unidades de recurso vs. 10 [DE=6] unidades de recurso, respectivamente; p=0,031).
El coste medio de los recursos adicionales en ambos grupos se comporta de manera similar (849 [DE=1.143]€/paciente en gradosiii-iv vs. 387 [DE=397]€/paciente en gradosi-ii), aunque en este caso las diferencias no fueron estadísticamente significativas (p=0,053).
El análisis multivariante no ha encontrado ninguna variable que se asocie significativamente con un mayor riesgo de padecer toxicidad de gradoiii-iv de cualquier tipo, aunque como dato destacado se observa una tendencia de incremento del riesgo en los pacientes coinfectados por el VIH-VHC (OR=14,58; IC95%, 0,4-520,6; p=0,142).
DiscusiónLa incorporación de los nuevos IP al tratamiento de la infección por el VHC ha incrementado la efectividad del tratamiento, de acuerdo con el porcentaje de pacientes que logran RVS6–9,13–17. Sin embargo, la tolerancia a estos esquemas continúa siendo una de las principales complicaciones, con un impacto económico derivado del manejo de los EA que todavía no está bien establecido.
Al comparar los resultados obtenidos en nuestro estudio con los existentes en los ensayos clínicos (EC), se observan algunas discrepancias6–9. En líneas generales, la incidencia de EA fue superior en nuestro estudio, de 12semanas de seguimiento, con respecto a los EC, de 48semanas de duración. En nuestra muestra, el 69% de los pacientes en tratamiento con TVR y el 82% de los tratados con BOC presentaron anemia en cualquier grado, mientras que la incidencia de este EA recogida en los EC es del 36 y del 45-50%, respectivamente. Se observa la misma tendencia con la aparición de neutropenia y de trombocitopenia en cualquier grado. Sin embargo, en el caso de la toxicidad dermatológica la incidencia observada en nuestros pacientes fue diferente a la obtenida en los EC, en los que el 56% de los pacientes tratados con TVR y el 18-22% de los tratados con BOC presentó rash cutáneo, frente al 30 y al 35%, respectivamente, en nuestro estudio.
Las discrepancias observadas pueden deberse a distintos motivos, entre ellos la existencia de distintos criterios de selección de pacientes, que difieren en los EC y en la práctica clínica habitual. Además, nuestra cohorte de pacientes incluye coinfectados por el VHC y el VIH, no incluidos generalmente en los EC. También cabe destacar que el objetivo que se persigue en la práctica clínica habitual es mantener el tratamiento antiviral, siempre que esté siendo efectivo, tratando de evitar la suspensión del mismo. Esto conlleva la utilización de otros fármacos y la realización de pruebas diagnósticas y visitas adicionales, que repercuten en un consumo adicional de recursos. En el caso de la toxicidad dermatológica, se sospecha que la causa de la discrepancia es el bajo registro de los EA en la historia clínica.
El objetivo del trabajo no es comparar ambos IP, y no está diseñado a tal efecto ya que, en nuestro periodo de seguimiento, el porcentaje de dosis administrada es diferente en ambos grupos, como consecuencia de presentar distintos esquemas de tratamiento: en las 12semanas de seguimiento se ha administrado el 100% de la dosis de TVR y solo el 25% (12 de las 48 semanas) de la dosis total de BOC. Este hecho es una limitación importante del estudio, puesto que la frecuencia de EA asociados al régimen que incluye BOC, así como los costes inherentes a su manejo, podrían estar subestimados.
La anemia es el EA que produce un mayor consumo de recursos derivado de su manejo: de los 39 pacientes que manifestaron anemia en cualquier grado, 31 precisaron la administración de factores estimulantes de la eritropoyesis o de concentrados de hematíes, mientras que solamente un paciente con neutropenia y 2 con trombocitopenia precisaron recursos farmacológicos para el tratamiento de los EA. El manejo de los EA conlleva un coste adicional medio de 625€/paciente, que supone un incremento del 2,5 y del 6,2% del coste del tratamiento a 12 semanas para TVR y BOC, respectivamente.
Los niveles más bajos de Hb al inicio del tratamiento en los pacientes tratados con BOC pueden condicionar la mayor tasa de anemia observada en estos pacientes. Otro factor que puede determinar las diferencias observadas en el manejo de los EA es la propia variabilidad de la práctica clínica de diferentes facultativos y servicios clínicos.
No se ha encontrado ningún factor asociado a un mayor riesgo de padecer EA de gradosiii-iv. No obstante, sería interesante diseñar estudios específicos que permitieran identificar los factores predictores de la aparición de estos EA.
En conclusión, la incorporación de los nuevos inhibidores de proteasa al tratamiento de la HCC conlleva una incidencia de EA hematológicos asociados a la triple terapia mayor a la descrita en los EC. Esta elevada incidencia de EA hace necesaria la utilización de recursos adicionales que incrementan el coste que la triple terapia supone para el sistema sanitario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.