Bartonella henselae (B. henselae) es un cocobacilo gramnegativo perteneciente al orden Rhizobiales de las alfa-proteobacterias y constituye el agente etiológico de la enfermedad por arañazo de gato. En el huésped inmunodeprimido puede producir cuadros más graves de proliferación vascular patológica, en ocasiones acompañados de afectación visceral diseminada (angiomatosis bacilar y peliosis hepática)1. En receptores de trasplante de órgano sólido (TOS) la infección diseminada por B. henselae supone una complicación poco habitual2–4.
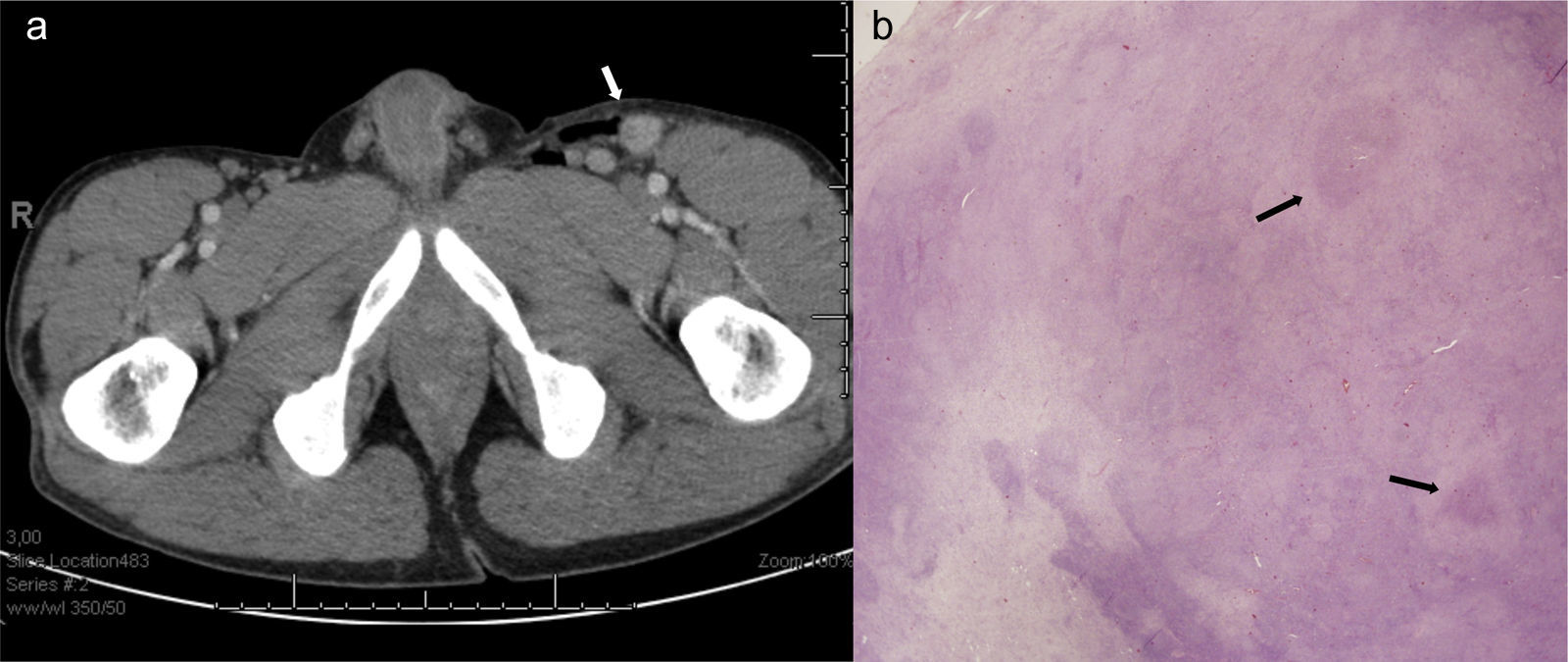
Presentamos el caso de un varón de 41 años con diabetes tipo 1 de larga evolución con complicaciones microvasculares asociadas (nefropatía, neuropatía y retinopatía) que recibió un trasplante simultáneo de páncreas y riñón 7 años atrás. Como complicación precoz desarrolló un rechazo agudo humoral que fue tratado con bolos de esteroides, plasmaféresis y gammaglobulina policlonal. Desde ese momento ambos injertos presentaban buena función (creatinina basal de 1,1mg/dL; hemoglobina glucosilada [HbA1c] de 5,2%) y se mantenía en tratamiento inmunosupresor con tacrolimus (2mg/12h) y micofenolato de mofetilo (dosis diaria total de 540mg). Consulta por un cuadro de fiebre, astenia, hiporexia, pérdida ponderal y artromialgias de aproximadamente 3 semanas de evolución. Diez días después del inicio de esta sintomatología había percibido la aparición de una tumoración dolorosa en la raíz del miembro inferior izquierdo, que aumentó progresivamente de tamaño hasta medir unos 2cm de diámetro. En la exploración física destacaba una temperatura axilar de 38°C. A nivel abdominal se palpaba una hepatomegalia a 2cm del reborde costal y el injerto renal en la fosa ilíaca izquierda, así como adenopatías inguinales bilaterales de predominio en región inguinal izquierda, además de la tumoración referida con leve eritema en la piel supradyacente. Analíticamente presentaba una leve alteración de las pruebas hepáticas que no estaba presente en el mes previo (glutamato-piruvato transaminasa [GPT] 96 UI/l, glutamato-oxalacetato transaminasa [GOT] 74 UI/l, gamma-glutamil transpeptidasa [GGT] 111 UI/l, fosfatasa alcalina 69 UI/l). El hemograma y los niveles de lactato deshidrogenasa y de proteína C reactiva eran normales. Considerando la posibilidad de un síndrome linfoproliferativo postrasplante (SLPT) se solicitó una carga viral de virus de Epstein Barr que fue negativa, al igual que la serología frente al virus de la inmunodeficiencia humana (VIH). Se realizó una tomografía computarizada toracoabdominopélvica que reveló una discreta hepatomegalia sin lesiones focales, un bazo de 14mm y múltiples adenopatías aumentadas de tamaño en mesenterio superior, hilio hepático, y regiones retroperitoneal, periaórtica, ilíaca, inguinal y femoral izquierdas, con cortical engrosada y realzada (fig. 1a). Ante estos hallazgos se realizó una biopsia escisional de la adenopatía femoral en la que se observaron múltiples granulomas epitelioides con abscesificación central que distorsionaban parcialmente la arquitectura del ganglio (fig. 1b). La inmunohistoquímica demostró poblaciones B y T de apariencia habitual. Descartada así la posibilidad de SLPT, el paciente fue reinterrogado acerca de factores de riesgo epidemiológicos, revelando que convivía desde hacía un mes con 2 gatos que había recogido de la calle y que con frecuencia le arañaban y mordían. La serología frente a B. henselae resultó positiva (título de IgM de 1/128 con IgG negativa), en tanto que la reacción en cadena de polimerasa (PCR) sobre la muestra obtenida de la biopsia ganglionar identificó igualmente B. henselae (amplificación del gen ribC de la riboflavina sintasa [585-588 pb]). Asumiendo como definitivo el diagnóstico de enfermedad por arañazo de gato diseminada2 se inició tratamiento con azitromicina (500mg/24h) durante 3 meses. La evolución fue favorable, con remisión de la fiebre durante el ingreso, desaparición de la adenopatía inguinal durante el primer mes, y normalización de la bioquímica hepática y de la hepatomegalia 10 semanas después del inicio del tratamiento. Al cabo de 8 meses de seguimiento aún no se habían observado recaídas.
a) Tomografía computarizada abdominopélvica con presencia de adenopatías en la región inguinal izquierda (flecha blanca). b) Imagen histológica de la biopsia de una de las adenopatías femorales con arquitectura parcialmente distorsionada por la presencia de varios granulomas epitelioides con abscesificación central (flechas negras) (hematoxilina-eosina; ampliación 1,5x).
Una revisión de la literatura recogida en la base de datos PubMed (términos MeSH: «Bartonella», «cat-scratch disease» y «transplantation») puso de manifiesto un total de 35 casos de infección por B. henselae en receptores de TOS comunicados hasta la fecha, incluyendo el presente2–4. El tipo de trasplante más frecuentemente implicado fue el renal (25 casos) seguido del hepático (7 casos). En esta población específica la infección tiende a presentarse como enfermedad diseminada (71,4% de los casos) frente al clásico cuadro autolimitado de fiebre y adenopatías regionales propio del inmunocompetente5. Si bien la afectación hepatoesplénica es la más comúnmente descrita en la literatura, se han comunicado otras presentaciones más excepcionales tales como endocarditis, osteomielitis, encefalopatía o coriorretinitis2–4. En huéspedes inmunocompetentes la enfermedad por arañazo de gato afecta fundamentalmente a niños y adolescentes; sin embargo, la mediana de edad en receptores de TOS fue de 34 años (rango intercuartílico: 13-51 años)2–4. Además de poner de manifiesto el impacto de la inmunosupresión sobre el riesgo de desarrollar la infección, esta diferencia de edad podría estar justificada por la menor representación de los grupos etarios por debajo de 18 años entre la población general de receptores de TOS6. Puesto que tanto el gato como posiblemente su pulga (Ctenocephalides felis) pueden transmitir B. henselae, el factor de riesgo más importante es el contacto con estos animales, antecedente descrito de forma expresa en el 88% de los casos recogidos en la literatura2–4. Si bien no existe una contraindicación expresa para que los receptores de TOS convivan con mascotas domésticas, se debe insistir a estos pacientes que eviten las mordeduras y arañazos y que extremen las medidas de higiene de manos, además de asegurar la correcta erradicación de ectoparásitos en los gatos7. La alteración de la inmunidad mediada por células asociada al TOS facilita la diseminación de la infección tras el contacto con B. henselae, aunque no observamos en los casos revisados una asociación evidente entre el régimen de inmunosupresión empleado y la gravedad de la enfermedad (localizada o diseminada); de hecho, nuestro paciente estaba recibiendo un régimen libre de esteroides en el momento en el que desarrolló la infección. Tampoco encontramos diferencias significativas en el tiempo transcurrido entre la realización del trasplante y el diagnóstico, si bien los casos de enfermedad diseminada tuvieron lugar de forma más precoz respecto a las formas localizadas (medianas de 33 y 54 meses, respectivamente), reflejando tal vez una mayor carga de inmunosupresión2–4. La serología puede ser de utilidad en el diagnóstico en estos pacientes (el 93% de los casos revisados tuvieron títulos significativos frente a B. henselae). No obstante, un resultado negativo no permite la exclusión de esta entidad, por lo que el examen histopatológico (con tinción de Warthin-Starry) y la realización de PCR sobre la muestra tisular incrementan las posibilidades de alcanzar el diagnóstico definitivo. La histología suele mostrar hallazgos comparables a los descritos en inmunocompetentes (inflamación granulomatosa supurativa o abscesificada), a diferencia del paciente con infección por VIH en el que predomina el patrón angioproliferativo de angiomatosis-peliosis2,8. En ausencia de guías específicas para el abordaje terapéutico de la infección por B. henselae en receptores de TOS, parece prudente la administración de tratamiento en todos los casos (incluidos los de enfermedad localizada) en vista del riesgo de diseminación y recidiva. Los macrólidos son los agentes de elección, siendo preciso considerar su potencial interacción con los inhibidores de la calcineurina; en caso de intolerancia puede recurrirse a la doxiciclina2. En la enfermedad diseminada se ha propuesto el uso de pautas combinadas. Respecto a su duración, es razonable aplicar las pautas recomendadas en pacientes con infección por VIH, recurriendo a cursos de 3-4 meses en presencia de enfermedad diseminada (mediana de 12 semanas en los casos revisados), ya que la respuesta al fármaco en estas formas puede ser más lenta y el riesgo de recaídas, mayor9. En pacientes con enfermedad localizada el tratamiento debe prolongarse al menos durante un mes, pues se han descrito recidivas tras cursos más cortos10. La tasa de curación entre los 35 casos revisados fue el 88,2%2–4.
El presente caso ilustra la importancia de contemplar la infección diseminada por B. henselae dentro del diagnóstico diferencial de los cuadros de fiebre y linfadenopatías en receptores de TOS, así como la necesidad de interrogar de forma expresa al paciente acerca de la concurrencia de factores de riesgo epidemiológicos que orienten hacia esta entidad (contacto habitual con gatos). El retraso en la normalización del perfil hepático, que tuvo lugar transcurridas más de 8 semanas desde el inicio de la azitromicina, parece apoyar la recomendación de prolongar el tratamiento hasta 3 meses en pacientes trasplantados.
Los autores agradecen la colaboración de la Dra. Jennifer Vila en la descripción de los procedimientos microbiológicos y del Dr. Manuel Lizasoain en la revisión crítica del manuscrito.