Desde que en abril de 2009 se tuviera conocimiento de la infección humana por un nuevo virus de la gripe AH1N1 de origen porcino, éste se ha extendido de forma pandémica por los 5 continentes. En el hemisferio sur se ha producido la primera onda pandémica en coincidencia con el invierno austral. En el hemisferio norte se ha mantenido la transmisión sin alcanzar los umbrales epidémicos hasta las primeras semanas de octubre, cuando en algunos países, entre ellos España, las tasas de incidencia han empezado a sobrepasar estos umbrales epidémicos. En este trabajo se revisan las características diferenciales de este nuevo virus en cuanto a patogenia, clínica y epidemiología y cuáles son los principales procedimientos de diagnóstico, profilaxis y tratamiento de los que disponemos, información que consideramos relevante para minimizar en lo posible el impacto que esta nueva pandemia pueda tener en nuestro entorno.
Since human infection by a novel influenza virus A H1N1 of swine origin was reported in April 2009, the virus has spread worldwide causing a pandemic. In the Southern Hemisphere, the first pandemic wave has taken place, coinciding with Austral Winter. In the Northern Hemisphere, transmission has been sustained under the basal level of epidemic until the first weeks of October, when incidence rates have risen up to the pidemic level in some countries, including Spain. This work reviews the differential characteristics of this novel virus in terms of pathogenicity, clinical syndrome and epidemiology, as well as the diagnostic, prophylactic and therapeutic procedures available; information we consider relevant to minimize the impact of this new pandemic in our area.
El 21 de abril de 2009, los Centros para el Control y Prevención de las Enfermedades (CDC) alertaron de la existencia de 2 casos confirmados de gripe asociados a un nuevo virus en Estados Unidos, en 2 niños residentes del condado de San Diego, California, en la frontera con México1. Desde marzo de 2009, se habían detectado en México brotes de enfermedad respiratoria y un aumento en las notificaciones de pacientes con síndromes gripales en varias zonas del país. El Ministerio de Salud de México comunicó el 23 de abril a la Organización Panamericana de la Salud (OPS) varios casos confirmados de enfermedad respiratoria grave debida a infecciones por virus de la gripe tipo A (H1N1) de origen porcino (S-OIV, swine-origin influenza virus). La secuenciación genética del virus reveló que los pacientes estaban infectados con la misma cepa identificada en los 2 niños diagnosticados en California2.
El 25 de abril, la OMS calificó este brote epidémico por un nuevo virus de gripe AH1N1 (A[H1N1]v, denominación adoptada por el ECDC), como urgencia de salud pública de importancia internacional. Dos días después, el 27 de abril, la OMS elevó el nivel de alerta pandémica a la fase 4, tras verificar una transmisión interhumana capaz de causar brotes a nivel comunitario, y posteriormente, el día 29 de abril lo elevó a fase 5, después de verificar la difusión interhumana del virus en al menos 2 países de una región de la OMS.
Finalmente, el 11 de junio, la OMS estableció la fase 6 de alerta pandémica tras constatar la existencia de transmisión elevada y sostenida del virus en el mundo, si bien se informó que la situación de pandemia declarada por la OMS implica diseminación y no mayor gravedad. Desde entonces, en todo el hemisferio norte se han notificado casos de forma continua en diferentes países, sin alcanzar hasta octubre niveles epidémicos3.
Mientras tanto, en el hemisferio sur, la onda pandémica de gripe ha transcurrido de mayo a octubre, con un pico estacional entre los meses de junio y julio. La duración de la temporada de gripe, donde el A(H1N1)v ha sido la cepa predominante, ha sido similar o ligeramente superior a una temporada habitual de gripe, en la que los primeros casos se notificaron anticipadamente4–6. Las tasas de ataque clínico comunicadas por Chile y Argentina estuvieron en torno al 2% de la población en cada uno de estos países. La gran mayoría de los casos presentaron una forma clínica leve, y el grupo de edad más afectado fue el de los niños de 5 a 14 años, seguidos de los niños menores de 5 años y del grupo de 15 a 59 años, patrón similar al de la gripe estacional4,6.
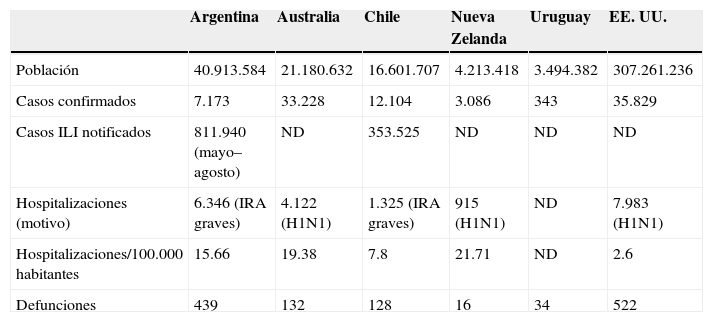
En general, las tasas de enfermedad grave, hospitalización y muerte atribuidas al A(H1N1)v en países del hemisferio sur son similares a las observadas en el hemisferio norte. En ambos hemisferios, la distribución de los casos graves de infección por el A(H1N1)v por grupos de edad difiere de lo que suele observarse durante las epidemias de gripe estacional. Las tasas de hospitalización por gripe estacional son más altas entre niños menores de 2 años y personas de 65 años o más. Por el contrario, la mayoría de los casos graves de infección por A(H1N1)v se han presentado en personas jóvenes y adultos menores de 60 años, con edades medias entre los 35 y 45 años. Entre el 15 y el 20% de los pacientes hospitalizados por gripe en Australia (el 80% de 30 a 59 años) y el 33% en Nueva Zelanda, ingresaron en UCI. En Chile, el 48% de los casos graves presentó algún tipo de comorbilidad (obesidad, diabetes, etc.). En Australia, el 4% de los casos hospitalizados fueron mujeres embarazadas. En una alta proporción de casos (el 47–60% en diferentes países) existían factores de riesgo conocidos para las complicaciones graves de la gripe, como enfermedad pulmonar crónica o enfermedad cardiovascular. Del mismo modo, la mayoría de estos países también han confirmado un mayor riesgo de complicaciones en mujeres embarazadas infectadas con el A(H1N1)v4–7. En la tabla 1 se muestran los datos epidemiológicos más relevantes hasta la fecha.
Datos epidemiológicos más relevantes de la infección humana por virus de la gripe A(H1N1)
| Argentina | Australia | Chile | Nueva Zelanda | Uruguay | EE. UU. | |
| Población | 40.913.584 | 21.180.632 | 16.601.707 | 4.213.418 | 3.494.382 | 307.261.236 |
| Casos confirmados | 7.173 | 33.228 | 12.104 | 3.086 | 343 | 35.829 |
| Casos ILI notificados | 811.940 (mayo–agosto) | ND | 353.525 | ND | ND | ND |
| Hospitalizaciones (motivo) | 6.346 (IRA graves) | 4.122 (H1N1) | 1.325 (IRA graves) | 915 (H1N1) | ND | 7.983 (H1N1) |
| Hospitalizaciones/100.000 habitantes | 15.66 | 19.38 | 7.8 | 21.71 | ND | 2.6 |
| Defunciones | 439 | 132 | 128 | 16 | 34 | 522 |
ILI: influenza-like illness ‘síndrome gripal’; IRA: infección respiratoria aguda; ND: no determinado.
Fuente: Assessment of the 2009 Influenza A (H1N1) Pandemic on Selected Countries in the Southern Hemisphere: Argentina, Australia, Chile, New Zealand and Uruguay. Department of Health and Human Services in collaboration with other US Government (USG) Departments for the White House National Security Council. August 26, 2009.
http://www.flu.gov/professional/global/ [consultado 22 de octubre de 2009]
En España, los 3 primeros casos de infección por el A(H1N1)v, con confirmación diagnóstica en el Centro Nacional de Microbiología (Instituto de Salud Carlos III), se notificaron el 26 de abril en jóvenes con antecedentes recientes de viaje a México. Durante estos primeros días del brote, se pusieron en marcha planes de actuación y contingencia basados en la vigilancia epidemiológica y la adopción de medidas de control de brotes a través de sistemas de alerta precoz y respuesta rápida, con protocolos que integraron las actividades de los servicios de salud pública y asistenciales y el apoyo de los laboratorios de referencia para la gripe. Tras la declaración de fase 6 de alerta pandémica por parte de la OMS, ya no resultaba factible detener la propagación del virus. Por esto, las estrategias de vigilancia epidemiológica se han orientado a definir escenarios que ayuden a los sistemas sanitarios a dar una respuesta a esta urgencia, tanto en la planificación de servicios asistenciales, para reducir la transmisión y el número total de personas afectadas, como en la identificación y protección de los grupos de población más vulnerables. A fecha 24 de septiembre de 2009, se había registrado un total de 305 casos graves de infección por el A(H1N1)v en nuestro país, de los que 137 ingresaron en UCI. Hasta el 23 de septiembre, se habían notificado al Ministerio de Sanidad y Política Social 36 casos de personas fallecidas en España a causa de la infección por este virus. De ellos, 19 eran mujeres (52,8%). La edad media de los casos fallecidos es de 41,64 años, con una mediana de 35,5 años y un rango de 10 a 85 años8.
Características virológicas y patogénicasEl A(H1N1)v deriva de diferentes linajes que han circulado en cerdos en el último tercio del siglo xx. Se trataría de un ejemplo más del papel que se sabe que desempeña este mamífero como mediador en el reagrupamiento genético de virus de la gripe A que posteriormente acaba afectando a humanos.
El análisis filogenético de los diferentes fragmentos genómicos del A(H1N1)v muestra un cuádruple origen. En una fase final parece haberse producido una modificación del virus porcino AH1N1 “trirreasortante” (linaje clásico porcino norteamericano, linaje aviar norteamericano y linaje humano H3N2) que había emergido en Norteamérica en la década de 1990, y que ha sustituido los segmentos correspondientes a los genes de la proteína matriz y de la neuraminidasa por los del virus porcino AH1N1 de linaje euroasiático9,10. Desde 1995 se han comunicado casos esporádicos de infección en humanos por el virus porcino americano “trirreasortante”11. Se desconoce cómo ha podido influir la adquisición de los 2 fragmentos genómicos de la variante euroasiática en su mayor capacidad de transmisión entre humanos.
Probablemente la transmisión inicial a humanos del A(H1N1)v ha sucedido varios meses antes del inicio del brote y el reagrupamiento genético entre los diferentes linajes porcinos ha tenido lugar años antes de su aparición en humanos. Este múltiple ancestro genético va, en gran medida, en contra de las hipótesis de un origen artificial del virus12.
Por otro lado, la información disponible después de la primera onda pandémica en el hemisferio sur, indica que el A(H1N1)v permanece estable antigénicamente hasta la fecha. Estudios in vitro llevados a cabo en ratones, hurones y primates muestran que la cepa de referencia del actual virus (A/California/04/2009 [H1N1]) replica en éstos más eficientemente y causa lesiones patológicas en el pulmón más graves en los 3 modelos animales que distintas cepas del AH1N1 humano estacional13,14.
Son muy dispares las informaciones sobre el potencial papel protector frente a la infección por el nuevo virus que pueda desempeñar, por un lado, la vacunación estacional previa, y por otro, la exposición a otros AH1N1 que han afectado a humanos en el pasado. En un estudio realizado en EE. UU. con serotecas de donantes anónimos nacidos entre 1880 y 2004 se demostró que hasta el 11% de las personas mostraban anticuerpos (Ac) neutralizantes frente al A(H1N1)v. Mientras que sólo el 4% de los nacidos después de 1980 presentaron títulos de Ac neutralizantes superiores o iguales a 40, este porcentaje ascendió al 63% en el grupo de mayores de 60 años (el 34% de éstos con títulos neutralizantes superiores o iguales a 80)15. Sin embargo, en regiones de China donde la vacunación frente a gripe estacional es poco común, el porcentaje de individuos con Ac neutralizantes es mucho menor, de sólo el 0,3%, por lo que los autores indican que puede ser la vacunación frente a gripe estacional, más que la exposición a un antiguo virus estacional similar al pandémico actual, lo que ha generado protección parcial frente a este nuevo virus16. De una u otra forma, se podría explicar la menor tasa de infección en la pandemia actual en mayores de 60 años.
También se ha especulado sobre el papel que pueda desempeñar la inmunidad celular, que no es cuantificable con las técnicas de neutralización, en la defensa frente a la infección. Se ha comprobado que la mayoría de los epítopes restringidos al complejo mayor de histocompatibilidad de clase i y ii de la nucleoproteína y de la proteína matriz, y algunos de la hemaglutinina del A(H1N1)v, están totalmente conservados con respecto a los de las cepas estacionales, y, por tanto, exposiciones anteriores al virus por vacunación o infección natural podrían activar la respuesta inmunitaria celular, aumentar la respuesta de linfocitos T CD8+ y de células T colaboradoras Th1. En consecuencia, la carencia o los defectos en las moléculas del complejo mayor de histocompatibilidad podrían explicar la variabilidad entre pacientes en la respuesta ante la infección gripal y la mayor o menor gravedad de ésta17.
Mecanismos de transmisiónEl mecanismo de transmisión del A(H1N1)v es el mismo que el de la gripe estacional. Se transmite con cierta facilidad por vía aérea, forma de diseminación que predomina en los grupos de personas hacinadas en espacios cerrados, por medio de las gotas que se expulsan al toser o estornudar, fundamentalmente por gotas de Flügge, que son partículas diminutas de hasta 10μm, que pueden permanecer hasta 30min en el aire en suspensión antes de depositarse sobre superficies, y ocasionalmente mediante núcleos goticulares de Wells, de menor tamaño, hasta 5μm, que tienden a dispersarse más en el ambiente sin depositarse, y aunque la carga viral en ellas es menor, son las que más pueden penetrar en el tracto respiratorio inferior. También puede transmitirse por contacto directo al tocar objetos contaminados con secreciones de una persona infectada.
El virus puede persistir durante horas, en particular en un medio frío y con poca humedad. Se considera que el período de transmisibilidad va desde un día antes del inicio de síntomas hasta 7 días tras el inicio de éstos (10 días en niños), o al menos 24h después de que los síntomas acaben, si duran más de 7 días18.
Aspectos clínicosAún existen muy pocos estudios que hayan evaluado con cierto detalle los aspectos clínicos de la infección por el A(H1N1)v, y los que hay son series descriptivas de casos seleccionados que incluyen pacientes hospitalizados19 o ingresados en UCI20–24. Además, se dispone de estudios con datos clínicos menos detallados de los sistemas de declaración epidemiológica de casos y de brotes en instituciones cerradas5,8,25.
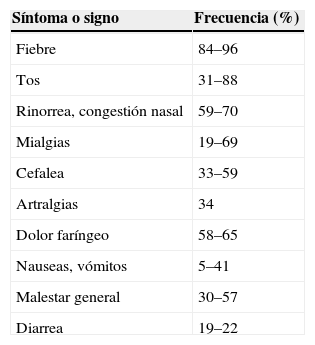
Hasta el momento, los grupos de edad más afectados han sido los adultos jóvenes y los niños. El A(H1N1)v puede causar todo el espectro de infección típico de los virus gripales, desde cuadros de vías respiratorias superiores con escasa repercusión general (febrícula), y cuadros gripales típicos, con fiebre elevada, malestar intenso, tos y artromialgias, hasta neumonías, con o sin desarrollo de insuficiencia respiratoria. La frecuencia de síntomas de casos no seleccionados se muestra en la tabla 2. En cuanto a los datos analíticos, son frecuentes la leucocitopenia leve, la elevación de la CPK y las aminotransferasas, y en casos de neumonía, la elevación de la LDH.
Frecuencia de síntomas y signos en casos de infección por virus influenza A(H1N1)6–8
| Síntoma o signo | Frecuencia (%) |
| Fiebre | 84–96 |
| Tos | 31–88 |
| Rinorrea, congestión nasal | 59–70 |
| Mialgias | 19–69 |
| Cefalea | 33–59 |
| Artralgias | 34 |
| Dolor faríngeo | 58–65 |
| Nauseas, vómitos | 5–41 |
| Malestar general | 30–57 |
| Diarrea | 19–22 |
Los datos acerca de la proporción de pacientes que requieren ingreso hospitalario deben interpretarse con precaución, dado que los criterios de ingreso pueden ser heterogéneos y el denominador depende mucho de la sensibilidad del sistema de detección de casos; se han estimado cifras del 2 al 7% del total de pacientes con infección4,25. El 73% de los pacientes que precisaron ingreso hospitalario en un estudio realizado en EE. UU. tenía alguna enfermedad de base, sobre todo diabetes mellitus, asma, enfermedad pulmonar obstructiva crónica, enfermedades cardiovasculares crónicas, inmunodepresión, enfermedad renal crónica o embarazo19.
De los pacientes que ingresan, el 6–25% precisa ingreso en UCI, habitualmente por insuficiencia respiratoria3,19,23. Entre los pacientes que requieren ingreso en UCI, el 55–84% tiene enfermedades de base o son mujeres embarazadas4,19,22,23,26. Datos preliminares indican que las mujeres embarazadas tienen un aumento del riesgo de complicaciones27. La obesidad mórbida también parece ser un factor predisponente para el desarrollo de insuficiencia respiratoria grave20,22,23,26. La mortalidad de los pacientes hospitalizados está en torno al 6–7%6,19 y la de los que requieren ingreso en UCI, alrededor del 18–41%19,22–24,26. Se han asociado con mayor mortalidad el desarrollo de insuficiencia renal, una mayor gravedad al ingreso, la insuficiencia respiratoria grave y el retraso en el inicio del tratamiento antiviral19,21,23.
La complicación principal de la infección es la neumonía19,20–24,26–28. La frecuencia de neumonía se ha estimado en el 0,4% en Alemania25 La forma predominante de presentación es la de neumonía viral primaria, con infiltrado radiológico intersticial bilateral o parcheado, aunque se han descrito neumonías con infiltrado lobular. En los casos graves, la neumonía tiene frecuentemente un curso rápidamente progresivo, con desarrollo de insuficiencia respiratoria grave en pocos días22–24,26, por lo que es necesario evaluar a los pacientes con síndrome gripal para la presencia de datos indicativos de insuficiencia respiratoria (disnea, taquipnea, cianosis). Aunque las primeras series han mostrado una baja frecuencia de coinfección bacteriana, un estudio de autopsias realizado en EE. UU. la encontró en 22 de 77 casos letales, incluyendo 10 casos de coinfección por Streptococcus pneumoniae y 7 por Staphylococcus aureus, entre otros patógenos respiratorios28.
Las complicaciones neurológicas son conocidas en la gripe estacional. Se han descrito complicaciones neurológicas de la infección por A(H1N1)v en 4 niños, en forma de cuadros convulsivos con o sin encefalopatía acompañante, sin secuelas29.
DiagnósticoEn la fase actual de pandemia, el diagnóstico virológico se centra en 2 objetivos fundamentales: asistencialmente, en el estudio de los casos graves que requieren hospitalización y de otros grupos de riesgos especiales, y, en la vertiente epidemiológica, en el estudio de brotes y en la vigilancia centinela, para identificar los cambios genéticos, antigénicos o funcionales que puedan emerger en el virus.
La técnica recomendada para el diagnóstico rápido y específico es la reacción en cadena de la polimerasa (PCR) en tiempo real, comercializada a partir del protocolo desarrollado por los CDC, que utiliza cebadores y sondas específicos para detectar un fragmento del gen de la hemaglutinina y de la proteína M2 de A(H1N1)v. Por su probado buen funcionamiento y por incluir controles internos para la interpretación de los resultados30, los resultados negativos permiten descartar la presencia de A(H1N1)v con un alto grado de fiabilidad (hasta en más del 98% de los casos), siempre que la muestra sea adecuada. Actualmente, son muchas las casas comerciales que disponen de kits diagnósticos aprobados por la Food and Drug Administration (FDA) o con marcado CE, con suficiente garantía para efectuar el diagnóstico por PCR en tiempo real.
Los estudios de secuenciación para análisis filogenético y detección de resistencias a antivirales deben realizarse sólo en laboratorios de referencia.
El diagnóstico por aislamiento en cultivo celular, aunque también es muy sensible y específico, precisa de mayor dotación técnica, y los resultados no se obtienen antes de 48–72h (en caso de utilizar técnicas rápidas de cultivo, como shell-vial), por lo que también se reserva para laboratorios de referencia.
Existe mucha controversia en cuanto a la utilización para el diagnóstico de técnicas rápidas de detección de antígeno, como las inmunocromatográficas, que ofrecen una buena especificidad (en general superior al 90%), pero con datos de sensibilidad para el diagnóstico de gripe por el A(H1N1)v muy deficitarios, en general inferiores al 50% (entre el 12 y el 67%, según los estudios), menores que para la gripe estacional. Los valores de sensibilidad pueden variar, además, dependiendo de la firma comercial, el tipo de muestra, el período de recogida de la muestra, la edad del paciente, etc. No diferencian entre subtipos de gripe A31,32, por tanto ante el uso de estas técnicas se debe ser consciente de sus limitaciones.
La muestra más adecuada para el diagnóstico es el aspirado nasofaríngeo o exudado nasofaríngeo; no obstante, también es útil la combinación de nasal profundo más orofaríngeo tomado con escobillón, e incluyendo ambas muestras en un mismo tubo con medio de transporte de virus. Se recomienda que la torunda no sea de alginato cálcico, ni el vástago de madera. El lavado broncoalveolar y, ocasionalmente, el esputo, también pueden ser aceptables. En cualquier caso, la muestra debe recogerse preferiblemente en las primeras 48h tras el inicio del proceso. Si no se va a procesar inmediatamente, debe conservarse un máximo de 48h refrigeradas a 4°C o a temperaturas inferiores a −70°C si la demora es mayor. El transporte y procesamiento de la muestra se debe hacer cumpliendo las condiciones exigidas de bioseguridad33.
El diagnóstico serológico tiene poca utilidad en las fases iniciales de la enfermedad, ya que se ha de hacer de forma retrospectiva, por precisar suero de fase aguda y convaleciente para demostrar seroconversión o seroincremento; por otro lado, no permite diferenciar fácilmente entre subtipos. Su interés fundamental es para estudios de investigación epidemiológica.
TratamientoEl A(H1N1)v es resistente a amantadina y rimantadina, pero sensible (por el momento) a los inhibidores de la neuraminidasa como oseltamivir y zanamivir, aunque se han descrito cepas resistentes, principalmente en inmunodeprimidos y en personas que recibieron profilaxis34,35. No existen estudios controlados sobre la eficacia de estos agentes frente a este virus. Un metaanálisis reciente de estudios realizados con casos de gripe estacional indica que el tratamiento en personas sanas se limita a acortar la duración de la fiebre en algo menos de un día de media36; hay escasos datos para valorar adecuadamente si es capaz de reducir la frecuencia de complicaciones en personas de riesgo. Aplicando estos conocimientos y la experiencia de los primeros meses de pandemia, se aconseja el tratamiento exclusivamente sintomático para los casos leves en personas sin factores de riesgo de complicaciones. En los pacientes con factores de riesgo e infección demostrada o probable (pendiente de los resultados microbiológicos), es prudente recomendar el tratamiento con oseltamivir (75mg cada 12h por vía oral, o cada 24h en pacientes con aclaración de creatinina por debajo de 30ml/min) o zanamivir (2 inhalaciones de 5mg cada 12h). El tratamiento es más eficaz cuando se comienza en las primeras 48h y la duración aconsejada es de 5 días. En embarazadas, la situación es la siguiente: no existen estudios que hayan demostrado su seguridad; por otra parte, no se han comunicado efectos adversos para el feto desde su comercialización, ni en estudios en animales. Por tanto, parece razonable ofrecer el tratamiento a todas las embarazadas con gripe por el A(H1N1)v, e informarlas adecuadamente. En estos casos, el fármaco recomendado es oseltamivir37.
En los pacientes con neumonía viral primaria, dado que el retraso del tratamiento se ha asociado con mayor riesgo de muerte, se recomienda oseltamivir asociado a un fármaco activo frente a las bacterias patógenas respiratorias habituales en caso de no poder descartarse razonablemente infección bacteriana concomitante38. Aunque no existe evidencia de su necesidad, algunos expertos han recomendado doblar la dosis de oseltamivir en pacientes con neumonía grave con obesidad mórbida o diarrea39. Los criterios de ingreso orientativos se muestran en la tabla 3. Asimismo, se han realizado recomendaciones específicas para el tratamiento de la insuficiencia respiratoria grave en UCI.
Criterios orientativos de ingreso hospitalario en pacientes con neumonía confirmada o probable por virus A(H1N1)18
|
CURB-65: confusion-blood urea nitrogen-respiratory rate-blood pressure-age ≥65 (British Thoracic Society); PaO2: presión parcial de oxígeno; PSI: pneumonia severity index (American Thoracic Society).
En previsión de una pandemia, se prepararon y autorizaron con antelación unas vacunas (llamadas vacunas modelo) con virus de la gripe A H5N1. Una vez identificada la variante del virus causante de la pandemia actual, las vacunas modelo se han transformado en vacunas pandémicas, y se reemplaza la cepa del virus H5N1 por la cepa A(H1N1)v. Esto ha permitido un procedimiento más rápido de evaluación. Esta estrategia se apoya en la experiencia de décadas con la vacuna frente a la gripe estacional en la que se ha visto que la inserción de una nueva cepa de virus en la vacuna no afectaba de forma sustancial su perfil de seguridad y eficacia.
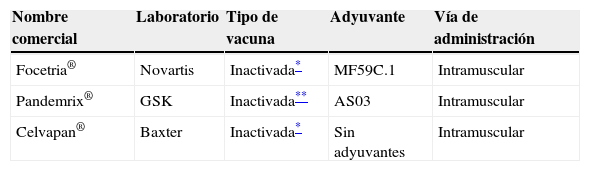
Siguiendo este procedimiento, la Agencia Europea de Medicamentos (EMEA) ha aprobado la comercialización de 3 vacunas frente al A(H1N1)v: Focetria® (Novartis) y Pandemrix® (GlaxoSmithKline), obtenidas tras cultivo en huevos embrionados, con adyuvante para potenciar su poder inmunógeno40 y Celvapan® (Baxter) que se obtiene a partir de cultivo en células Vero41 (tabla 4).
Vacunas monovalentes de gripe por virus A(H1N1) aprobadas para su uso en la Unión Europea, octubre 2009
La EMEA emite una opinión técnica que se basa en criterios de calidad, eficacia y seguridad. En el caso de las vacunas para la gripe por el A(H1N1)v siguen los mismos criterios y su recomendación se basa en 2 tipos de datos: por un lado, los datos revisados para la autorización de las vacunas modelo originales con la cepa del virus H5N1 (estos datos comprendían los resultados de estudios en unas 6.000 personas, incluyendo adultos, ancianos y niños), y por otro lado, los datos de la sustitución de la cepa del virus H5N1 por la cepa de virus A(H1N1)v, que incluyen los métodos utilizados para producir y controlar la vacuna final.
Se están llevando a cabo ensayos clínicos adicionales en adultos y niños con las vacunas preparadas con la cepa del A(H1N1)v y sus resultados se evalúan de una forma continuada. El análisis de los primeros datos muestra que la respuesta inmunitaria, la seguridad y las condiciones de calidad de las vacunas son favorables42,43. A partir de octubre y noviembre de 2009, se esperan los resultados de los ensayos actualmente en marcha.
El Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) ha extrapolado los datos obtenidos en los ensayos realizados con las vacunas modelo H5N1, para establecer condiciones de uso en niños a partir de 6 meses de edad y en embarazadas (de acuerdo con las recomendaciones oficiales nacionales).
Aunque actualmente el CHMP recomienda 2 dosis de estas vacunas y así queda recogido en las fichas técnicas, los estudios en marcha indican que en algunos casos podría ser suficiente con una sola dosis42,43. Las últimas recomendaciones de los CDC en cuanto a dosis de vacunas son de una dosis para los mayores de 9 años y de 2 dosis para los niños de entre 6 meses y 9 años separadas 4 semanas44,45.
Como con otros medicamentos, las reacciones adversas menos frecuentes sólo se observan tras la utilización del medicamento en poblaciones grandes. Por esto, las compañías están obligadas a realizar estudios adicionales de seguridad de acuerdo con el plan aprobado por el CHMP. Las agencias de medicamentos seguirán evaluando de forma continuada la relación beneficio-riesgo de estas vacunas, teniendo en cuenta la gravedad y extensión de la pandemia.
En función de la disponibilidad de vacuna se definieron unos grupos prioritarios de vacunación que se ampliarían según se dispusiera de mayor cantidad de vacuna46. En la Unión Europea, estos grupos prioritarios son los siguientes: a) todas las personas a partir de 6 meses de edad con enfermedades crónicas (por ejemplo, enfermedades crónicas respiratorias, enfermedades cardiovasculares e inmunodeficiencia congénita o adquirida); se comienza con aquéllos con síntomas más graves; b) mujeres embarazadas, y c) trabajadores sanitarios y de servicios públicos esenciales.
Cada Estado miembro desarrollará una estrategia de vacunación que identifique todos aquellos grupos de población donde se recomienda la vacuna frente al A(H1N1)v. Sin embargo, mientras la vacuna no esté disponible para todos los grupos de población, se deberá comenzar por los grupos definidos anteriormente. La información actualizada sobre recomendaciones oficiales en España se puede consultar en http://www.msc.es/servCiudadanos/alertas/informacionAEMPS.htm.
PerspectivasCon los datos existentes hasta la fecha, las tasas de infección, así como la morbimortalidad asociada a la infección por el A(H1N1)v, son bastante similares a las de la gripe estacional, si exceptuamos la mayor incidencia de casos graves en adultos jóvenes. Esto permite ser relativamente optimistas de cara a la futura evolución de la pandemia. No obstante, este futuro es imprevisible, ya que cambios genéticos en el virus, por mutaciones o por intercambio con otros virus gripales circulantes, podrían modificar esta evolución hacia una mayor o menor gravedad del proceso o a una disminución de la susceptibilidad a antivíricos. Por eso es importante que los sistemas de vigilancia epidemiológica y virológica permanezcan activos, para anticipar la adopción de medidas de salud pública que permitan controlar o minimizar las posibles repercusiones. La investigación y desarrollo de nuevos antivirales activos frente al virus de la gripe, así como el diseño de nuevos formatos en la obtención de vacunas, se hacen necesarios para afrontar con garantías los retos a los que nos someta la gripe en los años venideros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónJesús Rodríguez Baño y Jordi Carratalá reciben financiación para la investigación del Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III-FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008)