Etiología
Aspectos virológicos
Los hantavirus son un grupo de virus que, debido a sus características morfológicas, genómicas y proteicas, están integrados en la familia Bunyaviridae. Sin embargo, al carecer de reacciones serológicas cruzadas con el resto de los miembros de la familia, y presentar una secuencia genómica 39 -terminal única y una estrategia de replicación propia, constituyen un género diferenciado dentro de la familia. Además, mientras que los bunyavirus se transmiten al hombre por artrópodos, los hantavirus lo hacen mediante inhalación de aerosoles originados a partir de las excretas de roedores infectados 1. De hecho, y en un sentido estrictamente epidemiológico, se utiliza el término "robovirus" (rodent-borne virus) para referirnos a los hantavirus en contraposición con el de "arbovirus" (arthropod-borne virus) que incluiría al resto de los bunyavirus.
Al microscopio electrónico muestran una morfología esférica u oval, con un diámetro medio que oscila entre 90 y 120 nm. Estructuralmente son virus envueltos y exhiben en su superficie proyecciones compuestas por dos glucoproteínas (G1 y G2). Su genoma está constituido por una molécula de ARN monocatenario, con polaridad negativa, trisegmentada que codifica cuatro proteínas estructurales. Los segmentos, denominados S (small o pequeño), M (medium o mediano) y L (large o grande), codifican la proteína de la nucleocápside (nucleoproteína), las glucoproteínas G1 y G2, y la ARN polimerasa, respectivamente. La nucleoproteína y las glucoproteínas inducen la producción de anticuerpos protectores. La nucleoproteína constituye el antígeno más importante de los hantavirus, es responsable de las reacciones cruzadas entre los distintos virus (anticuerpos específicos de género) y tiene capacidad para fijar el complemento. Las glucoproteínas son antígenos específicos de tipo, poseen capacidad hemaglutinante e inducen la formación de anticuerpos neutralizantes 1. Los hantavirus se replican en el citoplasma de la célula huésped y las glucoproteínas se dirigen al complejo de Golgi, donde la mayoría de los hantavirus adquieren su envoltura por gemación, si bien algunos virus americanos pueden hacerlo a partir de la membrana citoplasmática 2. Durante el cultivo celular aparecen unas inclusiones citoplasmáticas granulares o filamentosas, pero no se observa efecto citopático. Estos virus se inactivan por calentamiento (56 °C durante 30 min), a pH ácido, con detergentes y solventes lipídicos, por luz ultravioleta y con altas concentraciones salinas.
Clasificación
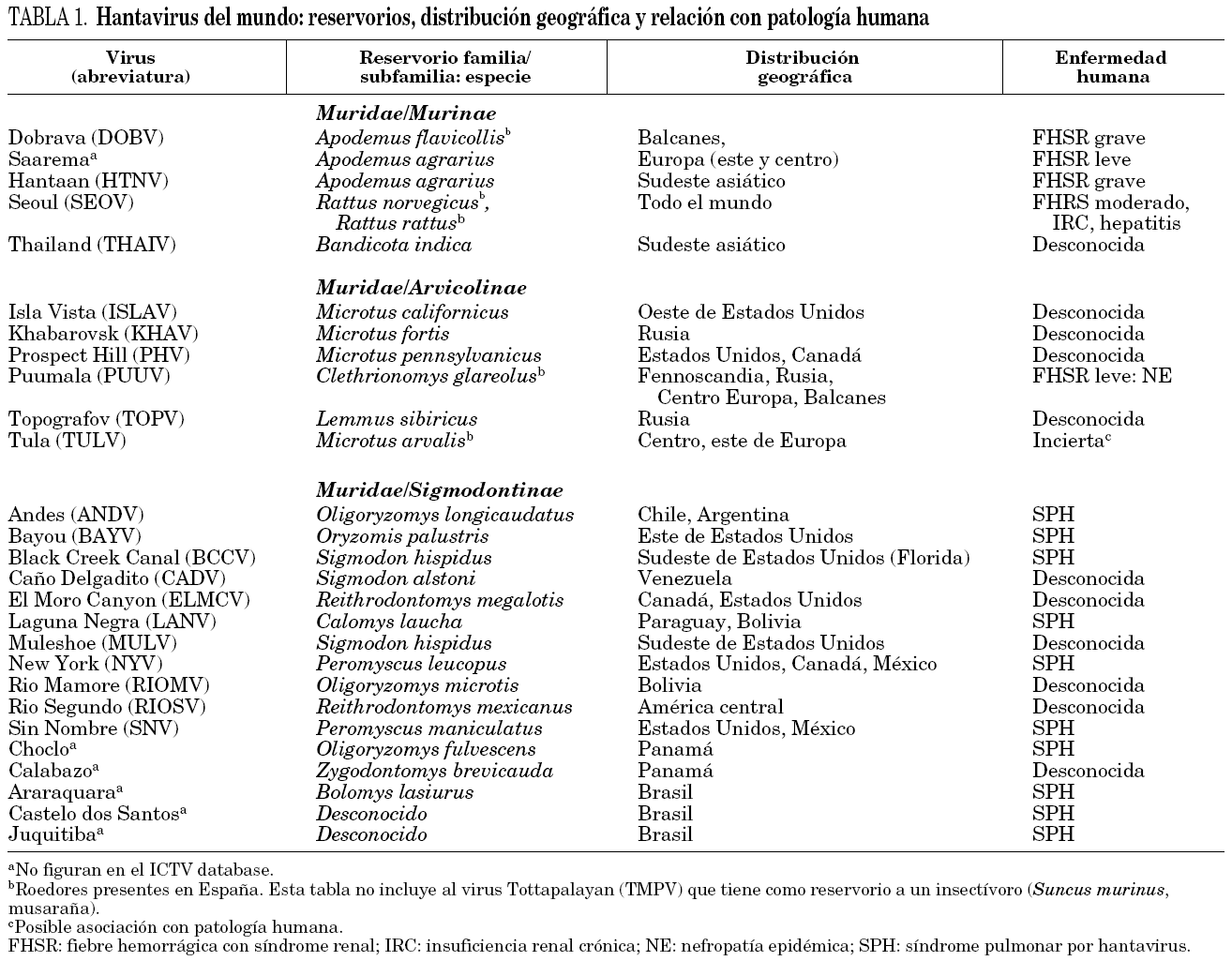
La taxonomía de los hantavirus es compleja y algunos están pendientes de su clasificación definitiva. Para que un nuevo aislamiento se considere una especie dentro del género, debe presentar diferencias de al menos cuatro veces el título de anticuerpos con las especies previamente identificadas mediante la técnica de seroneutralización, así como diferencias en la secuencia de aminoácidos de las nucleoproteína, G1 y G2 de al menos el 7%. El Comité Internacional de Taxonomía de Virus (International Committee on Taxonomy of Viruses, ICTV) 3 también establece como criterios taxonómicos la especie de roedor que actúa como reservorio principal y la ausencia de reordenamiento de segmentos genómicos con otras especies de hantavirus. La aplicación de todos estos criterios en conjunto puede resultar inviable en ciertos casos. Así, en la última década y debido a la utilización de métodos moleculares, se han identificado un importante número de virus que aún no han podido ser cultivados, y por tanto carecen de caracterización serológica. Igualmente, existen aislamientos realizados a partir de pacientes y para los cuales aún no se ha podido determinar el roedor que actúa como reservorio. En la tabla 1 se indican los reservorios, la distribución geográfica y la capacidad patógena de los 22 virus reconocidos como especies dentro del género Hantavirus por el ICTV, así como de otros pendientes de su inclusión definitiva.
Epidemiología
Los hantavirus tienen su reservorio fundamental en los roedores. Las distintas especies de roedores que se han identificado hasta la fecha como sus hospedadores naturales pertenecen, dentro de la familia Muridae, a tres subfamilias: Murinae (ratas y ratones del Viejo Mundo), Arvicolinae (topillos) y Sigmodontinae (ratas y ratones del Nuevo Mundo). Los estudios filogenéticos realizados en hantavirus y sus reservorios muestran una clara asociación entre cada virus y su hospedador, indicando que ambos han coevolucionado durante millones de años 4. En líneas generales, cada hantavirus es mantenido en la naturaleza por una única especie de roedor y viceversa, sin embargo, existen excepciones en ambos sentidos.
Los roedores infectados por hantavirus eliminan virus por saliva, orina y heces. La transmisión viral entre roedores se realiza vía respiratoria o por contacto directo con la saliva, que contamina alimentos compartidos o se inocula mediante mordedura durante enfrentamientos. Tras el contacto con el virus, el roedor sufrirá una infección persistente y asintomática, y eliminará el virus un tiempo variable según la especie. Una vez en el exterior, el virus puede llegar a permanecer viable en las excretas desecadas durante un tiempo aproximado de 2 semanas 5.
Los seres humanos adquieren la infección principalmente mediante la inhalación de aerosoles originados a partir de las excretas de roedores infectados, pero también puede transmitirse a través de la mordedura de un roedor y por contacto directo de piel lesionada con excretas de roedores. Aunque se ha sugerido la transmisión congénita 6 y la transmisión persona a persona para el virus Andes 7, estudios posteriores no han podido confirmar ninguna de estas vías 8,9.
Generalmente la aparición de enfermedad por hantavirus se atribuye a entornos rurales, pero algunas formas, producidas por el virus Seoul, se dan en ciudades. También se ha descrito en el caso de este virus, su implicación en una serie de brotes epidémicos surgidos en distintos laboratorios del mundo que trabajan con roedores 6.
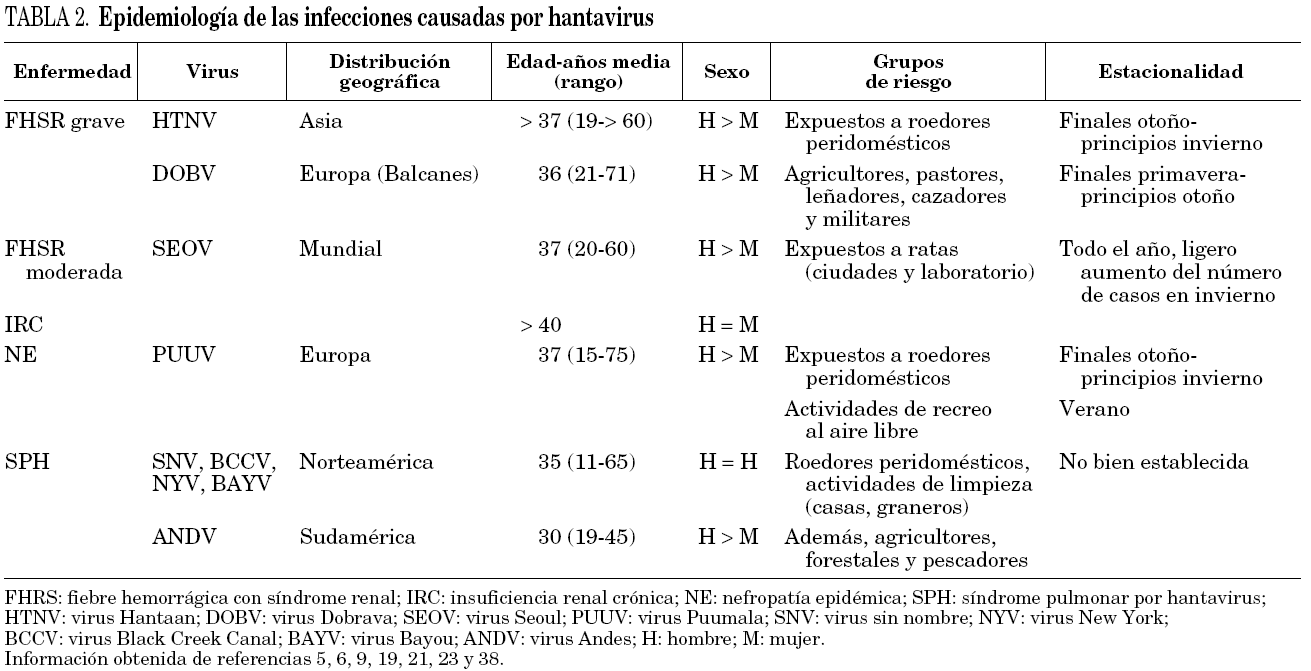
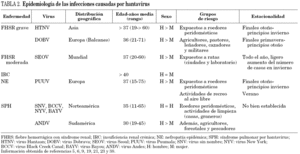
Como consecuencia de la fuerte asociación entre virus y roedores, la enfermedad humana presenta una estacionalidad (tabla 2). La incidencia de estas infecciones depende de las densidades de población de roedores, influida a su vez tanto por la ecología y biología de los hospedadores como por factores ambientales, y de las actividades humanas laborales o lúdicas. Se han identificado como actividades de riesgo a las labores de limpieza, tanto en corrales y establos como en casas y locales cerrados durante cierto tiempo, y a labores agrícolas como arar a mano o cortar leña 10. Además, deberían considerarse como actividades lúdicas de riesgo a la caza, el senderismo, la acampada al aire libre y el tener roedores silvestres como mascotas.
Los hantavirus presentan una distribución mundial, pero la localización de cada especie, y por tanto del cuadro clínico, se encuentra circunscrita a la del roedor que le sirve como reservorio. Se estima que más de 150.000 casos de infección por hantavirus son diagnosticadas al año en todo el mundo. Actualmente se reconocen tres focos endémicos. En el primero, localizado en el sudeste asiático, circulan los virus Hantaan (HTNV) y Seoul (SEOV) que causan, respectivamente, formas graves y moderadas de la fiebre hemorrágica con síndrome renal (FHSR). El segundo abarca el sureste, norte y centro de Europa. El virus más extendido por Europa es el virus Puumala (PUUV) que causa la nefropatía epidémica, la forma más leve de FHSR. El virus Dobrava (DOBV) se encuentra distribuido por el centro, este y sureste de Europa. Es responsable de las formas graves de FHSR que se diagnostican sobre todo en la zona de los Balcanes, aunque también puede ocasionar cuadros parecidos a la nefropatía epidémica en países del este europeo. Éstos estarían causados presumiblemente por el virus Saarema 5, un subtipo de DOBV cuyo reservorio es A. agrarius. El tercer foco endémico comprende prácticamente todo el continente americano. La patología causada por estos virus se caracteriza por una grave alteración cardiopulmonar (síndrome pulmonar por hantavirus, SPH) y se han identificado, hasta la fecha, al menos diez especies como responsables de esta enfermedad (tabla 1).
Patogenia
Aunque aún quedan muchos aspectos por conocer, los datos disponibles hasta el momento parecen indicar que el principal mecanismo patogénico en ambas enfermedades tiene una base inmunopatológica. Los hantavirus patógenos entran en las células mediante integrinas b3, que están presentes en plaquetas, células endoteliales y macrófagos 11. Estudios inmunohistoquímicos revelan la presencia del antígeno viral en el endotelio vascular de todo el cuerpo y, en el caso de la FHSR, en el epitelio de los túbulos renales 12,13. Un factor común para muchos de los síntomas que ocurren en ambos síndromes es el aumento de la permeabilidad capilar, lo que explica la tendencia hemorrágica y el dolor abdominal debidos al edema retroperitoneal en la FHSR, así como la extravasación de líquidos al espacio alveolar y el edema pulmonar que ocurre en el SPH. Los hantavirus no causan efectos citopáticos in vitro y la replicación viral no podría por sí sola explicar el daño capilar. El daño celular puede ser motivado por la respuesta inmunitaria celular. Se ha demostrado la presencia de linfocitos T CD8+ junto con monocitos/macrófagos en riñones de pacientes de nefropatía epidémica 14 y en asociación con células endoteliales de pulmón positivas para hantavirus americanos 15. Estas células elaborarían una serie de mediadores inmunitarios e inflamatorios, como el factor de necrosis tumoral alfa (TNF-a) o el óxido nítrico, que contribuirían al daño vascular.
La biopsia típica de la nefropatía epidémica muestra una nefritis tubulointersticial aguda con lesiones glomerulares moderadas 16. Se ha evidenciado un aumento de expresión de TNF-a, factor de crecimiento plaquetario y moléculas de adhesión endotelial en el área peritubular de la nefrona distal 14. La alteración renal se caracteriza por una marcada disminución del filtrado glomerular y una elevada proteinuria debida tanto al aumento de la permeabilidad glomerular como a la disfunción tubular.
Además parecen existir evidencias de susceptibilidad genética que condicionan, al menos para el virus PUUV, la gravedad del cuadro clínico. Así, los pacientes con antígeno de histocompatibilidad (HLA)-B8 y DR3 padecen infecciones más graves que los pacientes con HLA-B27 17.
Manifestaciones clínicas
Clásicamente los cuadros clínicos provocados por hantavirus se han englobado bajo los términos de FHSR, para el caso de los virus euroasiáticos, y de SPH para los americanos. La FHSR se caracteriza por una insuficiencia renal que puede acompañarse de fenómenos hemorrágicos de distinta consideración. Sin embargo, menos de un 30% de los cuadros de FHSR presentan hemorragias y estas se han podido constatar, junto a signos de disfunción renal, en algunas infecciones producidas por hantavirus del Nuevo Mundo 9. Por otro lado, aunque la insuficiencia respiratoria aguda y grave es típica del SPH, la afectación pulmonar puede llegar a ser la manifestación más importante en algunos casos de FHSR 18.
Infecciones causadas por los virus Hantaan y Dobrava: fiebre hemorrágica con síndrome renal grave
Las formas más graves de FHSR están causadas por el HTNV en Asia y el DOBV en Europa. En ambos casos, el índice de mortalidad puede superar el 10% 19. Tras un período de incubación que oscila entre 2 y 3 semanas, las manifestaciones clínicas pueden diferenciarse en cinco fases sucesivas 20. La fase febril se caracteriza por la presencia de fiebre elevada, cefalea y dolores en abdomen y espalda. Los pacientes pueden presentar visión borrosa y signos de hemorragia como inyección conjuntival o petequias en paladar blando y torso. Estos síntomas se prolongan aproximadamente de 3 a 7 días para dar paso a la fase hipotensiva. En este período, que dura de varias horas a 2 días, los enfermos presentan taquicardia, piel húmeda y fría, disminución de conciencia e incluso confusión. Las hemorragias capilares son el signo clínico más destacable y, en los casos más graves, el paciente puede desarrollar un grave shock hipovolémico. Los datos de laboratorio más destacables son la elevación del hematócrito, leucocitosis con desviación izquierda, trombocitopenia y proteinuria, acompañada de una discreta hematuria. La fase oligúrica, de 3 a 7 días de duración, se asocia a la presencia de náuseas, vómitos, insuficiencia renal aguda e hipertensión. En la analítica destacan una proteinuria importante y un aumento de urea y creatinina en sangre. Pueden aparecer complicaciones graves como hemorragias sistémicas y edema agudo del pulmón. En esta fase se producen en el 50% de los fallecimientos. El inicio de la recuperación del paciente daría paso a la fase diurética. Durante los días a semanas que puede durar este período el enfermo presenta poliuria y recobra el equilibrio hidroelectrolítico, aunque pueden aparecer complicaciones por infecciones secundarias. La fase de convalecencia tiene lugar durante los 2 o 3 meses siguientes y generalmente se asocia con una completa recuperación de la función renal en la mayoría de los casos.
Infecciones causadas por el virus Seoul: fiebre hemorrágica con síndrome renal moderado
Las formas moderadas de FHSR se deben a la infección por el SEOV. En estos casos se produce el solapamiento de estas cinco fases clínicas, por lo que resulta difícil su distinción. Con un índice de mortalidad del 1%, la infección por el SEOV se caracteriza por menor grado de insuficiencia renal y hemorragia y un predominio de hepatomegalia y disfunción hepática 6,21. Las alteraciones analíticas incluyen linfocitosis, trombocitopenia, aumento de transaminasas, hematuria microscópica, proteinuria y glucosuria transitoria. Las infecciones por el SEOV, hasta la fecha y a pesar de su amplia distribución mundial, sólo se han descrito en diversas ciudades asiáticas y en epidemias de laboratorio ocurridas en Europa y Asia. Sin embargo, en varios países se han diagnosticado casos de hepatitis aguda causados por este virus, por lo que se ha recomendado su inclusión en el diagnóstico diferencial de estos cuadros 6,22. Asimismo, se ha sugerido su implicación en hipertensión arterial y en insuficiencia renal crónica 23.
Infecciones causadas por el virus Puumala: nefropatía epidémica o fiebre hemorrágica con síndrome renal leve
La nefropatía epidémica es la infección por hantavirus más frecuente en Europa y representa la forma más leve de FHSR. Las manifestaciones renales predominan claramente sobre las hemorrágicas y la mortalidad es baja, oscilando del 0 al 0,4% 5 según el país. Se manifiesta característicamente por la tríada de fiebre, dolor abdominal, de espalda o de cabeza, y signos de disfunción renal. Sin embargo, el elevado porcentaje (hasta el 90%) de casos que cursan como cuadros leves y moderados, junto a la posible aparición de formas atípicas con mayor afectación de otros órganos que sobre el riñón 18,24, dificulta el diagnóstico. Uno de los síntomas más característicos de la fase inicial es la presencia, hasta en un tercio de los pacientes, de visión borrosa o miopía transitoria 5,24. Las manifestaciones hemorrágicas son escasas y la insuficiencia renal aguda es leve, siendo infrecuente la aparición de oliguria, anuria y desequilibrio hidroelectrolítico importante. La analítica muestra leucocitosis y trombocitopenia, elevación de creatinina y urea en suero, proteinuria y microhematuria. La recuperación clínica es generalmente completa, pero se ha observado el desarrollo de hipertensión arterial residual en algunos pacientes 25.
Síndrome pulmonar por hantavirus: virus sin nombre y otros virus del Nuevo Mundo
Al igual que en la FHSR, en los cuadros graves de SPH pueden distinguirse varias fases evolutivas 26. Tras un período de incubación de 4 a 30 días, comienza la fase febril o prodrómica. Durante 3-4 días los pacientes presentan fiebre, mialgia, dolor de cabeza y espalda, que pueden acompañarse de diarrea, náuseas y vómitos. La fase cardiogénica o de shock se inicia con la rápida aparición de tos, respiración entrecortada y vértigos. En aproximadamente 2 h el paciente desarrolla un edema pulmonar progresivo, con hipoxia, hipotensión grave y oliguria en los casos más graves, que frecuentemente "conduce" a shock por depresión miocárdica y arritmias cardíacas. La radiología demuestra infiltrados pulmonares intersticiales solos o acompañados de infiltrados alveolares en ambos campos pulmonares. No existen alteraciones hemorrágicas, salvo microhematuria. Es característico un recuento de neutrófilos elevado con precursores mieloides y neutrófilos atípicos, trombocitopenia, elevación del hematócrito y del tiempo de tromboplastina. Es frecuente la aparición de acidosis metabólica, la alteración de la función renal es mínima y los valores de creatinina no superan los 2,5 mg/dl. Durante esta fase, aproximadamente el 42-52% de los pacientes fallecen a consecuencia del shock cardiogénico. Una vez que se instaura la diuresis (fase diurética) se produce una rápida mejoría clínica. Tras un período de convalecencia, que puede prolongarse varios meses, los enfermos se curan sin secuelas.
Diagnóstico
El diagnóstico de las infecciones por hantavirus se realiza fundamentalmente mediante serología: presencia de inmunoglobulinas específicas del tipo M (IgM) y/o seroconversión para las IgG. Los métodos más empleados son la inmunofluorescencia indirecta y el análisis de inmunoabsorción ligado a enzimas (IFI y ELISA). Actualmente, y por razones de seguridad (en la IFI se utilizan células VERO E6 infectadas con hantavirus como antígeno), se prefiere el uso del ELISA utilizando la nucleoproteína recombinante como antígeno. Aunque ambas técnicas poseen una rentabilidad similar, en el caso de la IgM, la sensibilidad y la especificidad del ELISA son superiores. La IgM, detectada por ELISA, es positiva desde el primer día del inicio de la enfermedad, y se mantiene durante al menos 2 meses. Los anticuerpos del tipo IgG comienzan a detectarse durante la primera semana del inicio de la enfermedad y pueden persistir durante años 27. Como técnica de confirmación se recomienda el Western blot utilizando, al igual que en caso anterior, la nucleoproteína recombinante 28. Todas estas técnicas son capaces de detectar reacciones cruzadas entre los distintos hantavirus, siendo esta reactividad mayor o menor, incluso ausente, en función de los distintos serotipos que se incluyan como antígenos en la prueba diagnóstica. Así, y en Europa, el diagnóstico serológico de la FHSR debería incluir como antígenos a los PUUV y Dobrava o, en su defecto, Seoul. La técnica de seroneutralización es el único método serológico que permite determinar de forma definitiva las distintas especies de hantavirus. Sin embargo, y debido a su laboriosidad, el gran tiempo requerido para su realización, además de la necesidad de un laboratorio de bioseguridad tipo 3, su utilización se ve limitada a un pequeño número de laboratorios, y siempre en el ámbito de la investigación.
La detección viral en tejidos o fluidos corporales pueden realizarse por métodos moleculares e inmunológicos. La reacción en cadena de la polimerasa-transcriptasa inversa (RT-PCR) se ha utilizado con éxito en la detección del genoma en distintas muestras de pacientes, sobre todo en células mononucleares sanguíneas o suero, así como en tejidos procedentes de necropsias 29. La RT-PCR permite identificar el genotipo viral mediante la secuenciación del material amplificado, pero a pesar de su gran sensibilidad y debido a la corta duración de la viremia durante la fase aguda de la enfermedad (máximo 10 días posteriores al inicio de la enfermedad), detecta el ARN viral en menos de dos tercios de los enfermos con FHSR europeos 5. Las técnicas inmunohistoquímicas, aplicadas a biopsias y necropsias, permiten la detección de antígenos virales y han sido especialmente útiles como diagnóstico de confirmación en casos de defunciones por el SPH 30.
El aislamiento primario a partir muestras clínicas se realiza usando células VERO E6, pero el difícil crecimiento de estos virus hace que sea un método lento y de escasa rentabilidad. El seguimiento de la multiplicación viral debe realizarse mediante inmunofluorescencia o RT-PCR porque los hantavirus no producen efecto citopático. El manejo de tejidos de pacientes, así como el cultivo viral, deben realizarse en un laboratorio con un nivel de bioseguridad 3. Por todo esto, el aislamiento por cultivo no es un método que se utilice de rutina en los laboratorios clínicos.
Tratamiento
El tratamiento de las infecciones por hantavirus se fundamenta en la adopción de medidas de soporte dirigidas a evitar las complicaciones potencialmente mortales. Ante una forma grave de FHSR o de SPH, el paciente debe ser ingresado en una unidad de cuidados intensivos. Allí se vigilará la aparición de hipotensión y shock así como un posible fracaso renal y hemorragia en el caso del FHSR, o hipoxia, insuficiencia respiratoria, acidosis láctica y arritmias cardíacas en un enfermo con SPH. En los casos graves se puede requerir hemodiálisis, oxigenoterapia o ventilación asistida, y el empleo de expansores del plasma, agentes vasopresores o inotrópicos para combatir la hipotensión y el shock.
El fármaco antiviral más utilizado en las infecciones por hantavirus es la ribavirina. Estudios controlados desarrollados para evaluar su utilidad en el tratamiento de las infecciones producidas por los HTNV y Sin Nombre, parecen indicar que la administración intravenosa de este fármaco en fases tempranas de la enfermedad reduce la mortalidad, así como la gravedad de los síntomas en el caso de la FHSR, pero no aporta ventajas apreciables en el caso del SPH 31.
Datos publicados recientemente sugieren la posibilidad de utilizar la inmunoterapia pasiva en el tratamiento de ambos síndromes 32,33. Otras opciones como la administración de corticoides, de inhibidores de las citocinas y de la síntesis de óxido nítrico deben ser evaluadas.
Prevención
Las principales medidas de prevención son conductuales y están dirigidas a evitar el contacto con roedores. En los centros de experimentación animal, sólo deben introducirse lotes de animales que dispongan del correspondiente certificado de sanidad. Es aconsejable que los trabajadores se protejan con mascarillas, guantes y batas, y la esterilización o incineración del material utilizado. En las ciudades es muy importante que las autoridades sanitarias locales coordinen campañas periódicas de desratización con el fin de controlar las poblaciones de roedores. Por lo que respecta al ambiente rural, y ante la imposibilidad de eliminar o controlar las poblaciones de roedores, es fundamental prevenir el acceso de los roedores a las viviendas mediante el cierre de grietas y orificios, y poner los alimentos fuera de su alcance tanto en el interior como alrededor de éstas. Igualmente deben tomarse una serie de precauciones durante los trabajos de limpieza de lugares cerrados con evidencia de presencia de roedores. Tras una buena ventilación de la habitación, se deben rociar las zonas expuestas con lejía al 10%, evitando en todo momento la formación de aerosoles.
Hasta el momento no se cuenta con una vacuna efectiva contra la infección por hantavirus. En el sureste asiático se está utilizando una vacuna inactivada con el HTNV; sin embargo, la respuesta inmunitaria que se produce tras su administración es poco intensa y de corta duración. Además, se ha ensayado en humanos, sin buenos resultados, una vacuna recombinante del virus de la vacuna con los segmentos S y M del HTNV. En los últimos años, las investigaciones se dirigen al desarrollo de vacunas de ácido nucleico y de vacunas basadas en proteínas de fusión utilizando la proteína del core del virus de la hepatitis B como proteína transportadora 34.
Arenavirus
Los arenavirus son virus envueltos de morfología esférica o pleomórfica, con un diámetro que oscila entre 50 a 300 nm. Al microscopio electrónico, presentan un aspecto "arenoso" debido a la presencia de ribosomas que derivan de la célula huésped. Su genoma consiste en dos moléculas de ARN monocatenario ambisentido. El segmento L codifica la polimerasa viral y una proteína fijadora de cinc y el segmento S codifica tres proteínas estructurales: la nucleoproteína y las G1 y G2 de la envuelta 35.
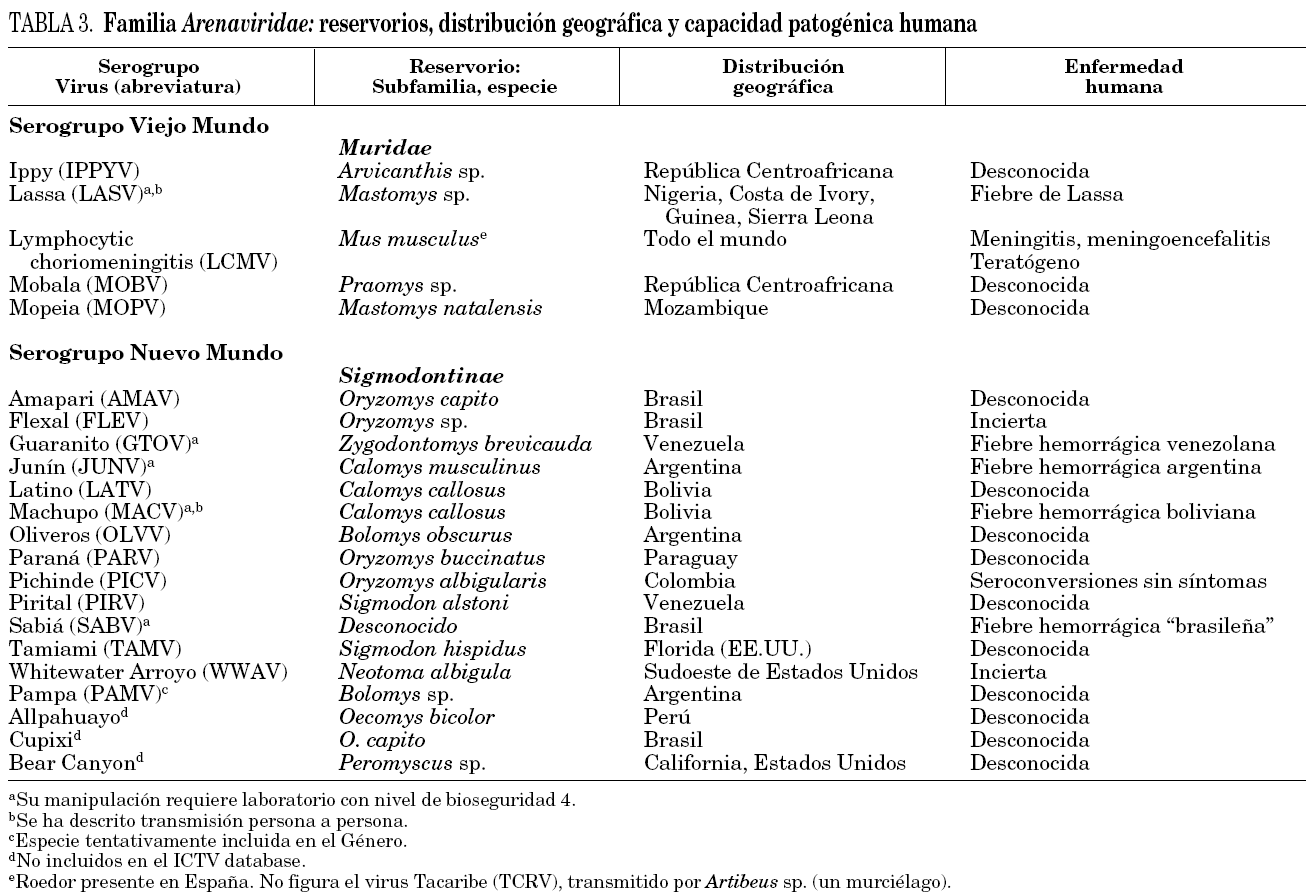
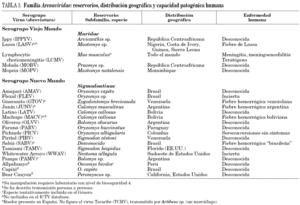
La familia Arenaviridae comprende un único género (Arenavirus) con más de 20 virus clasificados en dos grupos (tabla 3). El serocomplejo Tacaribe (grupo del Nuevo Mundo) incluye virus autóctonos del continente americano. El serocomplejo Lassa-coriomeningitis linfocitaria (grupo del Viejo Mundo) incluye virus autóctonos de África y al virus de la coriomeningitis linfocitaria (lymphocytic choriomeningitis virus, LCMV) que presenta una distribución mundial.
Los arenavirus tienen como hospedadores naturales a roedores de la familia Muridae. Al igual que los hantavirus, estos virus han coevolucionado con sus reservorios específicos y la distribución geográfica del virus, y de la enfermedad que producen, está circunscrita a la del roedor que actúa como reservorio. La adaptación a otras especies de roedores no es un hecho infrecuente. Así, el LCMV puede infectar a partir de su reservorio, Mus musculus (ratón casero), a los hámsteres y éstos, a su vez, al hombre. De hecho, la mayoría de los casos clínicos causados por el LCMV están relacionados con hámsteres 36. Los arenavirus, como robovirus que son, presentan aspectos epidemiológicos superponibles a los comentados para los hantavirus. Sin embargo en el caso de los arenavirus, la transmisión persona a persona ha sido bien documentada 37. Se han descrito casos de infecciones nosocomiales debidas a la inoculación accidental del virus durante la manipulación de fluidos y tejidos de los enfermos, siendo posible también la transmisión aérea para algunos virus (tabla 3). Además, al menos para el LCMV, se ha demostrado la transmisión vertical tanto en personas como en roedores 35.
Hasta el momento, se han relacionado de forma fehaciente a seis arenavirus con infección humana (tabla 3). Los arenavirus sudamericanos y el virus de la fiebre de Lassa causan fiebres hemorrágicas, mientras que el LCMV produce enfermedad neurológica. Con algunas diferencias, las fiebres hemorrágicas presentan unas manifestaciones clínicas similares. Tras un período de incubación, que puede prolongarse hasta 3 semanas, comienzan a aparecer gradualmente síntomas inespecíficos de tipo seudogripal que se continúan con el rápido desarrollo de fenómenos hemorrágicos de diversa consideración y alteraciones neurológicas como temblores o vértigos 38, habiéndose descrito encefalitis en enfermos con fiebre de Lassa 39. En líneas generales los enfermos se recuperan sin secuelas, aunque hasta un tercio de los pacientes de fiebre de Lassa pueden sufrir complicaciones como sordera 40. La mortalidad de estos cuadros oscila entre el 1 y el 2% para la fiebre de Lassa hasta el 15-30% para el resto de los virus, siendo especialmente importante en mujeres embarazadas.
La mayoría de las infecciones por el LCMV cursan como enfermedades subclínicas o cuadros seudogripales, pero en ocasiones se manifiesta como meningitis aséptica o meningoencefalitis 41 que tienen buen pronóstico y producen excepcionalmente la muerte del paciente. La infección en embarazadas puede ocasionar abortos y malformaciones congénitas 42.
El diagnóstico de laboratorio de estas infecciones puede realizarse mediante técnicas serológicas como la IFI y el ELISA indirecta. Ambos métodos detectan anticuerpos frente a la nucleoproteína a partir de los 10 días posteriores al inicio de los síntomas. La técnica de seroneutralización es el método de elección para diferenciar las distintas especies de arenavirus. La detección viral en muestras clínicas puede realizarse mediante cultivo celular o mediante RT-PCR. El aislamiento viral se puede realizar en células VERO a partir de suero y exudados faríngeos, obtenidos entre los 3-10 días posteriores al inicio de la sintomatología. Los arenavirus tardan en crecer de 1 a 10 días y lo hacen sin producir efecto citopático aparente. Los arenavirus patógenos, a excepción del LCMV que puede manejarse en un nivel de bioseguridad tipo 3, requieren un nivel 4. El ARN viral puede detectarse mediante RT-PCR de suero, plasma, orina, exudados faríngeos y varios tejidos. Esta técnica, además de permitir la identificación viral mediante secuenciación, se prefiere actualmente sobre el cultivo por su mayor seguridad y sensibilidad 43.
El tratamiento de las infecciones por arenavirus se fundamenta en la adopción de medidas de soporte dirigidas a corregir todas las alteraciones que se vayan produciendo. En el caso de las fiebres hemorrágicas se puede utilizar plasma inmune y ribavirina. La inmunoterapia parece reducir de forma importante el índice de mortalidad en la fiebre hemorrágica argentina, pero no ha sido tan eficaz en pacientes con fiebre de Lassa. El empleo de ribavirina ha demostrado ser eficaz tanto para el tratamiento como para la profilaxis postexposición en la fiebre de Lassa 44. Aunque no hay datos específicos para el caso de los arenavirus patógenos sudamericanos, podrían utilizarse los mismos regímenes terapéuticos.
Se está utilizando con éxito una vacuna atenuada frente al virus Junin (fiebre hemorrágica argentina), pero no existen vacunas específicas para otros arenavirus 45. Por lo tanto, las medidas preventivas van dirigidas a evitar el contacto con roedores. En el caso concreto del LCMV, y debido a su capacidad teratógena, debería evitarse la entrada de mascotas como hámsteres en hogares donde residan mujeres embarazadas. En las fiebres hemorrágicas, la prevención de infecciones nosocomiales puede requerir el aislamiento del enfermo en una habitación con presión negativa, siendo necesaria la cuidadosa manipulación de sus fluidos y excretas, y el empleo de los métodos de barrera habituales. Igualmente, deberían controlarse la aparición de fiebre y de otros síntomas agudos en los contactos durante un período de 21 días.
Observación final
Las infecciones por robovirus suponen un importante problema de salud en muchos países del mundo. En España contamos con muchos de los roedores descritos como reservorios de robovirus en Europa y, dada su amplia distribución mundial, es muy improbable que no circulen éstos u otros virus relacionados por nuestra geografía. Uno de los objetivos prioritarios de la Red Temática de Investigación EVITAR (enfermedades víricas transmitidas por artrópodos y roedores) es la identificación de robovirus autóctonos y de sus reservorios. Consideramos necesario que los médicos contemplen la posibilidad de este tipo de infecciones ante cuadros clínicamente compatibles, importados o no. El tratamiento de estos pacientes puede requerir, en ciertos casos, de cuidados especiales y sus muestras clínicas deben procesarse en laboratorios especializados. En España, cualquier resultado positivo debe ser confirmado por el laboratorio de arbovirosis y enfermedades virales importadas (AEVI) del Instituto de Salud Carlos III (Ver: http//www.isciii.es/aevi).
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Avances en el tratamiento de la infección por el virus VIH"
Disponible en: http://www.doyma.es/eimc/formacion
1 junio / 31 diciembre 2005