Introducción
Desde el descubrimiento de la penicilina en 1928 1 se han pautado millones de tratamientos con betalactámicos y salvado un número incalculable de vidas gracias a ellos. Sin embargo, las reacciones adversas de estos antibióticos son causa no desdeñable de morbilidad y mortalidad 2-4. El ejemplo más conocido por su gravedad son las reacciones anafilácticas por betalactámicos que se describieron en 1946, ya durante los primeros años de su utilización clínica 5. Ese mismo año se describió el primer caso de neutropenia por betalactámicos 6.
A pesar de que la neutropenia provocada por betalactámicos es un efecto secundario bien documentado en la literatura médica, en los últimos años se ha dado una escasez notable de artículos dedicados a este tema y no existen referencias recientes que revisen este tema. Así, en una búsqueda en el Medline sólo se han encontrado publicados desde el año 2000, cuatro artículos que se refieren a la neutropenia por betalactámicos 7-10, y uno que se refiere a la agranulocitosis por antibióticos en general 11. Sin embargo, la frecuencia elevada de neutropenia que señalan algunos de estos recientes artículos cuando se administran tratamientos prolongados 7,8, indica que éste puede ser un problema relevante en determinadas poblaciones.
Incidencia del problema
Son varias las razones que hacen difícil conocer la frecuencia de la neutropenia provocada por betalactámicos. En primer lugar, la mayoría de los artículos referentes a la neutropenia provocada por betalactámicos son descripciones de casos. En segundo lugar, los estudios utilizan diferentes criterios para definir la toxicidad sobre la serie blanca: algunos hablan de leucopenia en general 12,13, y los que se refieren a la neutropenia en concreto la definen con criterios variables: bien como cifras menores a 500 neutrófilos/μl 14, 1.000 neutrófilos/μl 15-17, 1.500 neutrófilos/μl 7,18 o 2.000 neutrófilos/μl 8,19. En tercer lugar, muchas de las referencias se centran en poblaciones concretas como por ejemplo niños 9,13,17,18,20,21, enfermos con fibrosis quística 17, pacientes con endocarditis 15,16, osteomielitis 7,8,10,19 o con hepatopatía avanzada 12. En cuarto lugar, muchos de estos estudios se refieren a un grupo de betalactámicos en concreto: algunos a penicilinas 22, otros a penicilinas resistentes a penicilinasas 18,21,23, a ureído y acilpenicilinas 19 o a cefalosporinas 3,24,25, e incluso a la neutropenia por un único antibiótico betalactámico 7,8,13,17,20,26-39 o más en concreto a la agranulocitosis por un betalactámico 6,29,40,41. En el otro extremo existen publicaciones que se refieren a la agranulocitosis o neutropenia medicamentosa en general 42-44 o globalmente a la neutropenia provocada por antibióticos 11,44, incluyendo en estas series algunos casos de neutropenia por betalactámicos.
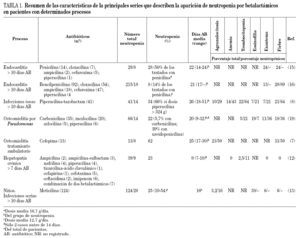
Contando con todas estas limitaciones, la literatura especializada indica una gran variabilidad en la incidencia de neutropenia por betalactámicos que llega incluso hasta el 60% en una serie reciente de pacientes con infecciones óseas tratados con cefepima en régimen ambulatorio 7. La mayor parte de los estudios que se centran en este problema, aceptan del 5 al 15% de incidencia de neutropenia con tratamientos de más de 10 días 19,21-23,47-49. En tratamientos más cortos su incidencia probablemente no supere el 0,1%, tal como refieren Neftel et al 47, que en la serie más larga publicada, aportan 50 casos de neutropenia por betalactámicos de 17 hospitales y revisan otros 140 publicados hasta el año 1985.
La importancia relativa de la neutropenia por betalactámicos ha cambiado en las últimas décadas. En los años 1970 los betalactámicos eran la primera causa de neutropenia medicamentosa por fármacos no quimioterápicos, interviniendo en casi el 50% de los casos 44,45. En una revisión más reciente de los casos de agranulocitosis recogidos por sistema de farmacovigilancia holandés desde 1974 a 1994, el grupo de las penicilinas se situaba en quinto lugar como agente causal de agranulocitosis originando el 3,3% del total de casos, por detrás del cotrimoxazol 43. En otra serie francesa, que recogió 102 casos de agranulocitosis por fármacos no quimioterápicos sucedidos desde 1985 al año 2000, los antimicrobianos causaron el 20% de los casos, y los betalactámicos el 7,8% del total, también sólo por detrás del cotrimoxazol dentro de los antimicrobianos 11. En cualquier caso la frecuencia de neutropenias que provocan los betalactámicos es mucho mayor que la que producen otros antibióticos, a excepción del cotrimoxazol 11,41,43,45.
Mecanismos de producción
Dos son los mecanismos principales propuestos para explicar la neutropenia provocada por betalactámicos: toxicidad medular directa y mecanismo inmunológico 46. Aunque también se ha postulado un posible papel de la marginación de leucocitos a expensas del pool circulante, este sería un mecanismo secundario 3.
El principal argumento que apoya la existencia de toxicidad medular es el efecto inhibidor de diversos betalactámicos in vitro, sobre cultivos de células de médula ósea en los que inhiben su proliferación 33,47,50,61. Se ha comprobado que los betalactámicos inhiben in vitro la replicación del ADN por inhibición de la ADN polimerasa 50, y que la inhibición de la formación de colonias mieloides en estos cultivos que provocan los betalactámicos, depende de la concentración de betalactámico 33,47,51. La relevancia de este mecanismo en la neutropenia se ve reforzada por el hecho de que la capacidad inhibitoria de los diferentes betalactámicos in vitro se correlaciona con las dosis diarias definidas causantes de neutropenia en pacientes 47. Otros argumentos utilizados a favor de la toxicidad directa medular como causa de la neutropenia por betalactámicos son: la habitual aparición progresiva de la neutropenia en estos pacientes y la rápida desaparición tras la retirada del antibiótico, la falta de un incremento de enzimas séricas en los pacientes con neutropenia que indiquen destrucción leucocitaria, la aparición en ocasiones de linfocitos plasmocitoides en sangre periférica, y el que se mantenga la dependencia de la dosis acumulativa cuando sucede un segundo episodio de neutropenia durante la reexposición a betalactámicos 22.
Se han esgrimido como argumentos a favor de la implicación de la respuesta inmunitaria en el desarrollo de la neutropenia por betalactámicos, la existencia de anticuerpos dirigidos contra los betalactámicos y anticuerpos antineutrófilo circulantes en los pacientes durante la aparición de neutropenia 22,24,44,52,53. Se piensa que estos anticuerpos la provocan la neutropenia por un mecanismo similar al de la trombocitopenia inmune por antibióticos 53,54. Los anticuerpos antineutrófilo tienen poder opsonizante, podrían actuar tanto a nivel periférico, induciendo una destrucción de los neutrófilos 44, como central provocando una inhibición medular, y explicarían la aparición de fiebre, exantema y eosinofilia en muchos de estos pacientes 22,52. Sin embargo, los anticuerpos contra los betalactámicos son frecuentes en todos los pacientes que reciben tratamientos prolongados con betalactámicos, sufran o no neutropenia por lo que algunos autores no los consideran implicados como agente causal 22,25,52.
Tanto la toxicidad directa de los betalactámicos, como el mecanismo inmunitario pueden inhibir la maduración medular y explicar el arresto madurativo detectado en los estudios histopatológicos de médula ósea de estos pacientes 22,31,33,38,47,55.
Efecto dependiente de la dosis
En general la neutropenia provocada por betalactámicos aparece tras varias semanas de tratamiento. Tiene relación con la dosis acumulativa administrada del betalactámico determinada a su vez tanto por la dosis diaria del betalactámico como por la duración del tratamiento 15,16,46. En nuestra serie, que ha estudiado la incidencia de neutropenia en pacientes con infecciones óseas tratados con piperacilina-tazobactam, la dosis acumulativa de piperacilina se relacionaba claramente con la frecuencia de neutropenia (incidencia del 0% de neutropenia en el primer cuartil de dosis acumulativa de piperacilina, del 33% en el segundo cuartil, del 40% en el tercer cuartil y del 67% en el cuarto cuartil), existiendo además correlación negativa entre la cifra de neutrófilos al final del tratamiento y la dosis total de piperacilina administrada 8.
Dosis diaria
La importancia de la dosis diaria ha quedado bien patente en las dos series prospectivas de pacientes con endocarditis publicadas por Olaison 15,16, que detectó el 50% de neutropenias en pacientes con endocarditis tratados con penicilina cuando la dosis media era de 27 mU por día y sólo del 14% cuando la dosis de penicilina era de 21 mU por día 15,16, sin que la duración de tratamiento difiriera entre ambos grupos.
Duración del tratamiento
La duración de tratamiento es un factor clave en la aparición de neutropenia inducida por betalactámicos. Así, la neutropenia es muy infrecuente en tratamientos menores de 10 días 16,47, y en varios estudios en adultos la neutropenia nunca apareció antes de los 17 días (tabla 1) 7,8,16. La importancia de la duración del tratamiento como factor precipitante de la neutropenia por betalactámicos explicaría la ausencia de casos de neutropenia en muchos ensayos clínicos, en los que normalmente no se superan las 2 semanas de tratamiento. Dos series recientes ilustran la contribución de la duración del tratamiento en la aparición de neutropenia por betalactámicos. La primera, la serie de infecciones óseas tratadas con piperacilina-tazobactam ya referida, con una incidencia de neutropenia del 34% 8, a pesar de que en numerosos ensayos clínicos, con tratamientos siempre inferiores a las 2 semanas de duración, no se habían detectado casos de neutropenia 56-58. La segunda, una serie de infecciones óseas tratadas con cefepima con una incidencia de neutropenia del 60% 7. Frente a ella, una revisión previa de más de 3.300 tratamientos con este antibiótico sólo detectaba una incidencia del 0,3% de agranulocitosis aunque de nuevo la duración del tratamiento fue en general corta, con una mediana de 7 días. Sin embargo, cuando se seleccionaron dentro de esta última revisión, los 112 pacientes que recibieron más de 8 semanas de tratamiento, ocho (7,1%) sufrieron agranulocitosis 14.
La historia no es nueva. Ya a principios de los años ochenta varios estudios hicieron hincapié en la incidencia de neutropenia en torno al 15% en pacientes tratados con meticilina 13,21,23, aunque la incidencia en pacientes tratados menos de 10 días rondaba el 0% 13. De manera similar la mezlocilina se había mostrado segura en ensayos clínicos con una incidencia de leucopenia del 0,2% 59. Sin embargo, un estudio en pacientes con osteomielitis mostró una incidencia de neutropenia del 50% entre 16 pacientes con osteomielitis por Pseudomonas tratados con este betalactámico 19.
A pesar de que la neutropenia por betalactámicos aparece generalmente tras un tratamiento prolongado con dosis altas de antibióticos por vía intravenosa, se han publicado casos aislados de neutropenia tras tratamientos prolongados con betalactámicos orales 28,55, intramusculares 31, o incluso tras los primeros días de tratamiento intravenoso 9,17,20,47,52.
Factores facilitadores
Diversos factores como una menor edad 8,16,17,60 o la existencia de hepatopatía grave concomitante 12 se asocian a una mayor incidencia de neutropenia durante tratamientos prolongados con betalactámicos.
La predisposición de la población pediátrica ha sido sugerida por varios autores 48,60. La apoya la aparición de la neutropenia más precozmente en la población pediátrica que en los adultos. Así en 9 de los 16 pacientes de la serie de Yow et al 13, y en los 3 pacientes que aportan Kumar y Kumar 20 la neutropenia apareció antes del día 15. Incluso en la serie de Nahata et al 18 que estudió de manera prospectiva a 68 niños tratados con meticilina, nafcilina u oxacilina, 2 de los 3 casos de neutropenia detectados sucedieron ya al cuarto día de tratamiento antibiótico 20. Por el contrario, en diversas series que estudian adultos sin hepatopatía, la neutropenia aparece casi siempre a partir de los 14 días de tratamiento (tabla 1). La predisposición de los niños puede deberse a una mayor dosis por kilogramo de antibiótico que reciben estos enfermos 48. Así por ejemplo la dosis de ceftriaxona en niños con meningitis es de 100 mg/kg/día y en adultos ronda los 40 mg/kg/día 60, y en estas series a menudo se han utilizado en niños dosis de penicilinas resistentes a penicilinasas de hasta 300 mg/kg/día, mucho mayores que las utilizadas en adultos 13,20,21. En algunos adultos con bajo peso corporal que han sufrido neutropenia por betalactámicos también podría contribuir la administración de una elevada dosis por kilogramo 38.
En cuanto a la mayor incidencia de neutropenia en los pacientes con hepatopatía se considera consecuencia de una acumulación de los betalactámicos o de sus metabolitos por el deterioro del metabolismo hepático 12. En la única serie de pacientes con hepatopatía crónica avanzada que ha estudiado la incidencia de leucopenia por betalactámicos, la frecuencia de hipoalbuminemia, hipocolesterolemia, hipoprotrombinemia y trombocitopenia era mayor entre los pacientes que desarrollaron leucopenia, aunque probablemente estos datos señalaban indirectamente la existencia de un mayor deterioro de la función hepática 12. De hecho, en pacientes sin hepatopatía, la frecuencia de neutropenia por piperacilina-tazobactam no se incrementa con la presencia de hipoalbuminemia 8.
Un aspecto poco conocido es el de la toxicidad sobre la serie blanca de la combinación de betalactámicos con otros antibióticos potencialmente mielotóxicos como cotrimoxazol o linezolid, o de dos betalactámicos, simultánea o secuencialmente. Dado que estas combinaciones son poco utilizadas, la experiencia con estos tratamientos es escasa. En una serie de 16 pacientes con endocarditis enterocócica tratados con un combinación de ampicilina y ceftriaxona (4 g/día) o cefotaxima (2 g/6 h) durante al menos un mes, sólo dos sufrieron neutropenia 61,62. En la serie comentada de neutropenia por piperacilina-tazobactam, un paciente había sido tratado en asociación con cotrimoxazol y no sufrió neutropenia, y dos de los tres tratados asociando aztreonam sí tuvieron neutropenia 8.
La alta incidencia de neutropenia en series con determinadas enfermedades como osteomielitis 8,19, endocarditis 15,16, o pacientes en tratamientos ambulatorios parenterales 7,63 probablemente se deba a que en esas situaciones los tratamientos son prolongados y con dosis altas, y no a que el proceso tratado en sí mismo predisponga a la neutropenia.
La insuficiencia renal no parece predisponer a la neutropenia por betalactámicos 8,12,15,16, quizá porque el ajuste de dosis de acuerdo a la función renal evita una mayor exposición al antibiótico.
Manifestaciones asociadas
La administración prolongada de betalactámicos puede provocar diversas manifestaciones como exantema o fiebre que pueden servir de señales de alarma, dado que a menudo anteceden en días a la aparición de neutropenia 8. Neftel et al 47 en su revisión de la literatura especializada refleja que la fiebre está presente en el 38% de los casos de neutropenia y el exantema en el 34%, aunque en las series la incidencia de ambos es muy variable (tabla). Otras manifestaciones asociadas son mialgias, artralgias, dolor abdominal, sensación de malestar durante la administración del antibiótico o diarrea 8,16,47.
La administración prolongada de betalactámicos también produce con frecuencia alteraciones analíticas que pueden asociarse o no a la neutropenia. Son frecuentes las alteraciones hematológicas como eosinofilia, anemia, trombocitopenia 7,8,12-17,19, en porcentajes muy variables según las series (tabla 1), y la alteración de pruebas de función hepática 18,19. Neftel et al 47 en su revisión encontraron el 13% de trombocitopenia entre los pacientes con neutropenia por betalactámicos. Se ha descrito un caso aislado de insuficiencia renal acompañada de fiebre y exantema por piperacilina-tazobactam en el que se sospechó nefritis intersticial 64. Además la meticilina puede provocar hematuria y proteinuria asociadas a la neutropenia 13.
¿Son todos los betalactámicos iguales?
Aunque probablemente cualquier betalactámico a dosis suficiente puede provocar neutropenia, diversos estudios sugieren que no todos los betalactámicos la producen en la misma medida. Se han realizado estudios in vitro que demuestran una relación entre las dosis diarias definidas causantes de neutropenia y la capacidad para inhibir in vitro cultivos de médula ósea 47. Además la incidencia de neutropenia, varía notablemente entre las series que estudian la incidencia con un solo antibiótico: 16% con meticilina en niños 13, 34% en infecciones óseas tratadas con piperacilina-tazobactam 8 y 62% en osteomielitis tratadas con cefepima 7, aunque el valor de estas comparaciones está limitado por las diferencias en la duración del tratamiento en los diferentes estudios (tabla 1). Otro dato que apoya las diferencias entre los distintos antibióticos proviene de las series centradas en un tipo de enfermedad. Así, por ejemplo, en la serie de neutropenia por betalactámicos en pacientes con endocarditis de Olaison 16 el porcentaje de neutropenias fue del 18% entre los tratados con penicilina, el 6% entre los tratados con ampicilina y el 4% entre los tratados con cloxacilina o con cefuroxima 16, sin que hubiera diferencias en la duración de los tratamientos. Incluso dentro de la misma familia de betalactámicos existen grandes diferencias de frecuencia de neutropenia como se demuestra en una serie de pacientes con osteomielitis por Pseudomonas tratados con ureído y acilpenicilinas; en ella la incidencia de neutropenia fue del 53% entre los tratados con mezlocilina, del 33% entre los tratados con piperacilina, del 5,7% entre los tratados con carbenicilina y del 0% entre los tratados con azlocilina 19.
Por otra parte, aunque se han descrito casos de neutropenia por todas las familias de betalactámicos: penicilinas, cefalosporinas, carbapenémicos y monobactámicos, la mayor parte de los casos publicados se deben a penicilinas 13,15,22,26, penicilinas resistentes a penicilinasas 13-15,20,23,27-29 y ureído y acilpenicilinas 19. Los casos de neutropenia por cefalosporinas son mucho menos frecuentes 24,25 a excepción del cefepima 8,37. En los tratamientos con carbapenémicos 11,34,35,65,66 o aztreonam 36 la aparición de neutropenia es excepcional. Se desconoce con exactitud si los inhibidores de las betalactamasas, que en realidad son también betalactámicos, pueden tener efectos aditivos en su asociación con los betalactámicos y pueden facilitar la aparición de neutropenia 55. Los datos actuales no lo apoyan: tanto la neutropenia provocada por amoxicilina-ácido clavulánico como por amoxicilina sola son una rareza 55; por otra parte, la incidencia de neutropenia durante tratamientos prolongados de infecciones óseas con piperacilina 19 es similar a la de la causada por la piperacilina-tazobactam (tabla 1) 8.
El hecho de que la mayor parte de las publicaciones centradas en la neutropenia por betalactámicos de los últimos años se refieran específicamente a determinados antibióticos como la piperacilina-tazobactam (20 casos de neutropenia en los últimos 10 años 8,17,38-40,64 o cefepima (19 casos de neutropenia publicados desde 1996) 7,14,37 podría tener relación con el desarrollo relativamente reciente de estas moléculas y su uso generalizado, incluido en tratamientos prolongados, más que con una elevada frecuencia real. Un betalactámico de reciente aparición es el ertapenem. Aunque la información que existe sobre su uso en tratamientos prolongados es muy escasa, en una revisión de 1.954 pacientes incluidos en ensayos fases II y III con este fármaco, tratados durante una media de 5 días (límites: 1-28 días) se detectaron 16 casos de neutropenia, con un descenso por debajo de 1.000 cél./μl en sólo 2 casos que ya tenían neutropenia pretratamiento. En ninguno de los casos fue necesario suspender el tratamiento 66.
Reexposición al betalactámico tras la neutropenia
La neutropenia por betalactámicos no debe considerarse una alergia que contraindique de manera absoluta la reexposición al antibiótico causante de neutropenia, o a otro betalactámico. La reexposición al mismo betalactámico o a otro puede provocar neutropenia pero sólo entre el 15 y el 30% de los casos 16,47,67. La aparición de la neutropenia en la reexposición depende de la dosis y de la duración del tratamiento, tal como sucede en el episodio inicial, sin que se acorte el período de tratamiento que precede a la neutropenia, y puede darse meses o incluso años tras la primera exposición 47. En su serie de endocarditis, Olaison et al 16 detectaron una frecuencia de neutropenia en la reexposición a un nuevo betalactámico similar a la del primer tratamiento.
Recuperación de la neutropenia por betalactámicos
La neutropenia que provocan los betalactámicos no suele ser grave, aunque en alguna serie sufren agranulocitosis hasta el 50% de los pacientes con neutropenia (tabla 1). La mayor parte de los casos se recuperan espontáneamente aunque en algunos casos de agranulocitosis se ha utilizado factor estimulante de colonias 7,8,11,65. La duración de la neutropenia no suele superar los 4 días tras la suspensión del antibiótico, y en los casos de agranulocitosis se suele prolongar hasta los 10 días 7,8,11,16,22,47,65. Muy raramente la neutropenia persiste meses después de la retirada del betalactámico 9,47.
Los casos de sobreinfección durante la neutropenia por betalactámicos son raros y afectan a menos del 5% de estos pacientes 10,11,47. Aunque se han descrito casos mortales de neutropenia por betalactámicos 11,47,49,68, son excepcionales. Esto difiere de la agranulocitosis causada por otros fármacos no quimioterápicos, que conlleva una mortalidad del 16% en las series más antiguas 44, y del 4-5% en las más recientes 42,65.
Una cuestión no resuelta se refiere al posible efecto negativo del tratamiento con betalactámicos sobre la recuperación de la agranulocitosis causada por quimioterapia. Los datos preliminares y retrospectivos de un autor en los años ochenta sugerían que los betalactámicos podían tener un efecto negativo aumentando la duración de la agranulocitosis 47. Sin embargo, las asociaciones de dos betalactámicos no parecen prolongar la neutropenia en pacientes con enfermedades hematológicas tratados con quimioterapia o en los trasplantes de médula ósea 69.
En definitiva, la neutropenia por betalactámicos sigue siendo un problema relevante en la actualidad, especialmente cuando estos antibióticos pueden administrarse por períodos prolongados como en régimen de hospital de día y unidades de hospitalización domiciliaria. La medida más importante para evitar su aparición es la monitorización analítica, teniendo presente que la aparición de fiebre o exantema pueden ser señales de alarma. Por otra parte, en el desarrollo de nuevos betalactámicos se debe tener presente que pueden provocar neutropenia, en particular a la hora de establecer determinadas indicaciones como, por ejemplo, su utilización en infecciones óseas.