La bacteriemia asociada a catéter se relaciona con una elevada morbimortalidad, fundamentalmente en pacientes críticos. La piel circundante, las conexiones, las bacteriemias de otro origen y la colonización de las sustancias infundidas constituyen los principales orígenes de la infección de los catéteres intravasculares. Los agentes causales habituales son estafilocococos goagulasa-negativos, Staphylococcus aureus, bacilos gramnegativos y Candida spp. Las técnicas diagnósticas conservadoras, como los hemocultivos cuantitativos pareados o los hemocultivos con tiempo diferencial de crecimiento han supuesto un gran avance en los últimos años. El tratamiento depende del tipo de catéter. En la mayoría de casos de bacteriemia o funguemia asociada a catéteres centrales no tunelizados es recomendable la retirada. En los catéteres tunelizados o reservorios subcutáneos la decisión de retirar el catéter se debe basar en la gravedad del paciente, la documentación de la infección, el tipo de agente y la presencia de complicaciones como endocarditis, tromboflebitis, signos inflamatorios locales o infecciones a distancia. Cuando un agente es documentado se recomienda adecuar la antibioticoterapia sistémica y valorar la posibilidad de utilizar técnicas de sellado endoluminal si el catéter no va a ser retirado. En los últimos años se han producido avances en la prevención de la infección de catéteres intravasculares como son la adecuación de los antisépticos cutáneos, la utilización de medidas amplias de barrera, el uso de catéteres impregnados con antimicrobianos y los sellados con antibióticos.
Catheter-related bloodstream infections are associated with recognized morbidity and mortality, especially in critically ill patients. Skin insertion site, the catheter ub,hematogenous seeding of the catheter tip from a distant site of infection, and infusate contamination are the sources of catheter colonization and infections. Coagulase-negative staphylococci, Staphylococcus aureus, aerobic gram-negative bacilli, and Candida spp most commonly cause catheter-related bloodstream infection. Catheter-sparing diagnostic methods, such as differential quantitative blood cultures and time to positivity have emerged as reliable diagnostic techniques. Management of catheter-related infection varies according to the type of catheter involved. In most cases of nontunneled catheter-related bacteremia and fungemia, the catheter should be removed. For management of bacteremia and fungemia from a tunneled catheter or implantable device, such as a port, the decision to remove the catheter or device should be based on the severity of the patient's illness, documentation that the vascular-access device is infected, assessment of the specific pathogen involved, and presence of complications, such as endocarditis, septic thrombosis, tunnel infection, or metastatic seeding. When a catheter-related infection is documented and a specific pathogen is identified, systemic antimicrobial therapy should be narrowed and consideration given for antibiotic lock therapy, if the catheter or implantable device is not removed. Novel preventive strategies include cutaneous antisepsis, maximum sterile barrier, use of antimicrobial catheters, and antimicrobial catheter lock solution.
La utilización de catéteres intravasculares es esencial en el tratamiento de enfermos críticos, oncológicos y en hemodiálisis. Su infección constituye la principal causa de bacteriemia nosocomial y, aunque la mortalidad suele ser inferior al 5%, se asocian a una elevada morbilidad y coste económico.
Los criterios diagnósticos clínicos de infección son poco sensibles y específicos, lo que supone una retirada innecesaria de gran número de catéteres y una demora en la retirada de los catéteres infectados.
En los últimos años se ha avanzado en la epidemiología y patogenia de estas infecciones y se han producido importantes aportaciones en el diagnóstico, manejo y prevención de las mismas.
Tipos de catéteres intravascularesAdemás de los catéteres arteriales pulmonares, catéteres tipo midline y catéteres periféricos (arteriales o venosos), existen diferentes tipos de catéteres venosos centrales.
- 1.
Catéteres venosos centrales no tunelizados
Son catéteres de poliuretano o silicona colocados para duraciones estimadas menores de dos semanas. Se colocan en la vena subclavia o yugular y, en menor medida, en la vena femoral, aunque en estos casos se recomienda no mantenerlos más de 48 o 72 h, dado su riesgo de infección.
- 2.
Catéteres venosos centrales tunelizados
Son catéteres de larga duración. Requieren una implantación quirúrgica o en salas de radiodiagnóstico y se caracterizan por que un segmento del mismo está tunelizado en el espacio subcutáneo, antes de introducirse en la vena, habitualmente subclavia. Para ello llevan un recubrimiento exterior de dacron, que les permite un mayor anclaje mecánico y dificulta la migración de los microorganismos desde la piel. Suelen estar hechos de silicona.
- 3.
Catéteres implantables
También diseñados para cateterizaciones prolongadas, son reservorios de titanio o plástico totalmente implantados en la zona subcutánea, de los que se origina el catéter para el acceso venoso. Suelen colocarse en el tórax o, más rara vez, de forma periférica en la fosa antecubital. La administración de sustancias requiere la utilización de agujas especiales que perforan la piel y la superficie superior del reservorio.
- 4.
Catéteres centrales con inserción periférica
Son catéteres de silicona o poliuretano que se insertan periféricamente en el fosa antecubital para acceder a través de la vena cefálica a la vena cava. En los últimos años ha crecido considerablemente su uso, dada la gran duración de los mismos y porque su colocación no supone grandes dificultades técnicas y puede ser realizada por personal de enfermería capacitado.
La tabla 1 muestra las principales fuentes de infección de los catéteres intravasculares. Las principales vías de infección tienen lugar desde la piel circundante o desde las conexiones. La colonización de la piel y la progresión por la superficie externa del catéter son el origen más frecuente de la infección en los catéteres de corta duración, con cateterizaciones inferiores a 2 semanas1. La colonización de la conexión constituye la vía de infección más importante en los catéteres tunelizados.
Algunos agentes, como los estafilococos coagulasa-negativo (SCN), producen complejos glucoproteicos denominados slime o limo que les confiere protección frente el sistema inmunitario y favorece su multiplicación. Otros microorganismos como Pseudomonas aeruginosa y Candida spp. pueden producir sustancias similares, sobre todo en medios ricos en glucosa1.
La implantación del catéter genera por parte del huésped la producción de una biocapa alrededor. Esta capa es rica en fibrina y fibronectina, dos sustancias muy adherentes para Staphylococcus aureus y Candida spp. Ambos son productores de coagulasa y se benefician del proceso de trombogénesis generado alrededor del catéter, adheriéndose firmemente a la monocapa. La utilización de sustancias anticoagulantes impregnadas en la superficie externa de los catéteres o administradas de forma profiláctica en la luz de los mismos tiene como objetivo reducir este riesgo2,3.
La composición de los catéteres es también un aspecto relevante en el riesgo de infección de los mismos. Los catéteres de cloruro de polivinilo y polietileno presentan mayor facilidad para la adhesión bacteriana que los de teflón, elastómero de silicona o poliuretano, mientras que los catéteres con menor adherencia bacteriana son los de silicona2.
El lugar de cateterización es importante según el tipo de microorganismo implicado en su infección. Staphylococcus spp. es el agente causal más frecuente, en todas las localizaciones, fundamentalmente SCN. La participación de bacilos gramnegativos o levaduras suele ser inferior al 10% en catéteres implantados en la vena subclavia o yugular. Sin embargo, la participación de estos agentes en infecciones de catéteres implantados en la zona femoral es significativamente superior y alcanza en algunas series el 39 y el 17%, respectivamente4.
Diagnóstico (tabla 2)Diagnóstico tras retirada del catéterEl diagnóstico de certeza de infección asociada a catéter pasa por la retirada de éste y la confirmación de la colonización del segmento distal del mismo. Éste queda establecido cuando se observan mediante cultivo semicuantitativo la presencia de más de 15 ufc tras rodamiento de dicho segmento en placa o más de 1.000 ufc/ml si se aplica una técnica cuantitativa2,5,6. No obstante, el diagnóstico de bacteriemia asociada conlleva la documentación del mismo agente en hemocultivos obtenidos por venopunción directa.
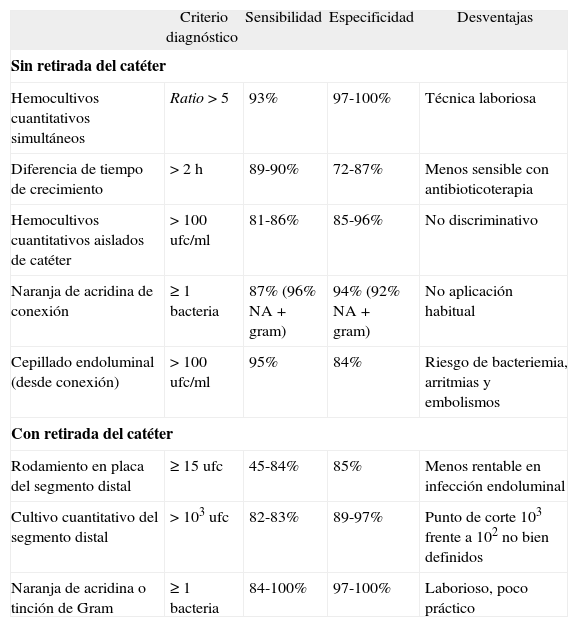
Rentabilidad de las técnicas diagnósticas
| Criterio diagnóstico | Sensibilidad | Especificidad | Desventajas | |
| Sin retirada del catéter | ||||
| Hemocultivos cuantitativos simultáneos | Ratio > 5 | 93% | 97-100% | Técnica laboriosa |
| Diferencia de tiempo de crecimiento | > 2 h | 89-90% | 72-87% | Menos sensible con antibioticoterapia |
| Hemocultivos cuantitativos aislados de catéter | > 100 ufc/ml | 81-86% | 85-96% | No discriminativo |
| Naranja de acridina de conexión | ≥ 1 bacteria | 87% (96% NA + gram) | 94% (92% NA + gram) | No aplicación habitual |
| Cepillado endoluminal (desde conexión) | > 100 ufc/ml | 95% | 84% | Riesgo de bacteriemia, arritmias y embolismos |
| Con retirada del catéter | ||||
| Rodamiento en placa del segmento distal | ≥ 15 ufc | 45-84% | 85% | Menos rentable en infección endoluminal |
| Cultivo cuantitativo del segmento distal | > 103 ufc | 82-83% | 89-97% | Punto de corte 103 frente a 102 no bien definidos |
| Naranja de acridina o tinción de Gram | ≥ 1 bacteria | 84-100% | 97-100% | Laborioso, poco práctico |
Tomada de Raad et al5.
La utilidad de la técnica del rodamiento en placa (técnica de Maki) fue validada inicialmente en catéteres de corta duración7, y estudios posteriores han confirmado una sensibilidad y especificidad del 84 y del 85%, respectivamente8. Su correlación con el diagnóstico de bacteriemia asociada en los catéteres de larga duración es inferior y se ha estimado entre el 45 y el 75%9,10, aunque algunos estudios han comunicado sensibilidad y especificidad superiores al 90%, tanto en los catéteres de corta como de larga duración11.
Diferentes métodos, como la centrifugación12, agitación13 y sonicación14 del segmento distal del catéter han confirmado su utilidad en la recuperación de bacterias de la superficie externa e interna del mismo. La recuperación de más de 1.000 ufc/ml en cultivo cuantitativo utilizando estas técnicas ha confirmado un elevado valor predictivo (aunque algunos autores consideran suficientes recuentos superiores a 100)5. Los métodos de sonicado y agitación han confirmado una similar sensibilidad y especificidad a la técnica de rodamiento en placa en los casos de bacteriemia asociada a catéteres de corta duración11, sin embargo en los catéteres de larga duración, la sensilibilidad de aquéllos es mayor10. La sensibilidad y especificidad de los cultivos cuantitativos del segmento distal en los catéteres de corta duración es del 82 y 89%, respectivamente y del 83 y el 97% para los de larga duración, respectivamente8.
Diagnóstico sin retirada del catéterEn muchos casos la sospecha de infección se confirma tras retirar el catéter. Por ello, son muy interesantes las técnicas que posibilitan el diagnóstico, fundamentalmente de la bacteriemia asociada, sin necesidad de retirada del mismo.
En los últimos años han aparecido diferentes trabajos que han confirmado que los hemocultivos que miden la diferencia de tiempo del crecimiento bacteriano (o fúngico) desde su obtención en los hemocultivos extraídos a través del catéter y los obtenidos mediante venopunción directa (DTP, differential time to positivity) constituyen un método muy sensible y específico para la confirmación de bacteriemia asociada, tanto en los catéteres de corta como de larga duración, estimando significativos tiempos de crecimiento superiores a 2 h entre ambos hemocultivos6,15,16. La sensibilidad y especificidad de esa técnica en la bacteriemia asociada en catéteres de corta duración es de 89 y el 87%, respectivamente, y para los catéteres de larga duración del 90 y el 72%, respectivamente8.
Los hemocultivos cuantitativos pareados, utilizando métodos de dilución en placa17 o técnicas de lisis-centrifugación18, también consiguen resultados similares, pero requieren de mejor tecnología, tiempo y manipulación. Se consideran significativos si el número de unidades formadoras de colonias por mililitro en los hemocultivos obtenidos a través del catéter supera en 2-10 veces el número de unidades formadoras de colonias por mililitro en los hemocultivos obtenidos por venopunción directa6,19. La Sociedad Americana de Enfermedades Infecciosas (IDSA) acepta una ratio de 5. La sensibilidad y especificidad de este procedimiento fue estimada en un reciente metaanálisis en el 75 y el 97% para los catéteres de corta duración y en el 93 y el 100% para los catéteres de larga duración, respectivamente8.
Otras técnicas dirigidas al diagnóstico de la infección sin la retirada, como son los cultivos superficiales (piel, conexión o trayecto subcutáneo)20, las tinciones rápidas (p. ej., naranja de acridina) en las muestras de la conexión21,22 y el cepillado intraluminal23, pueden ser útiles en algunas ocasiones, dado el elevado valor predictivo negativo de los primeros y la celeridad en el diagnóstico de los últimos6.
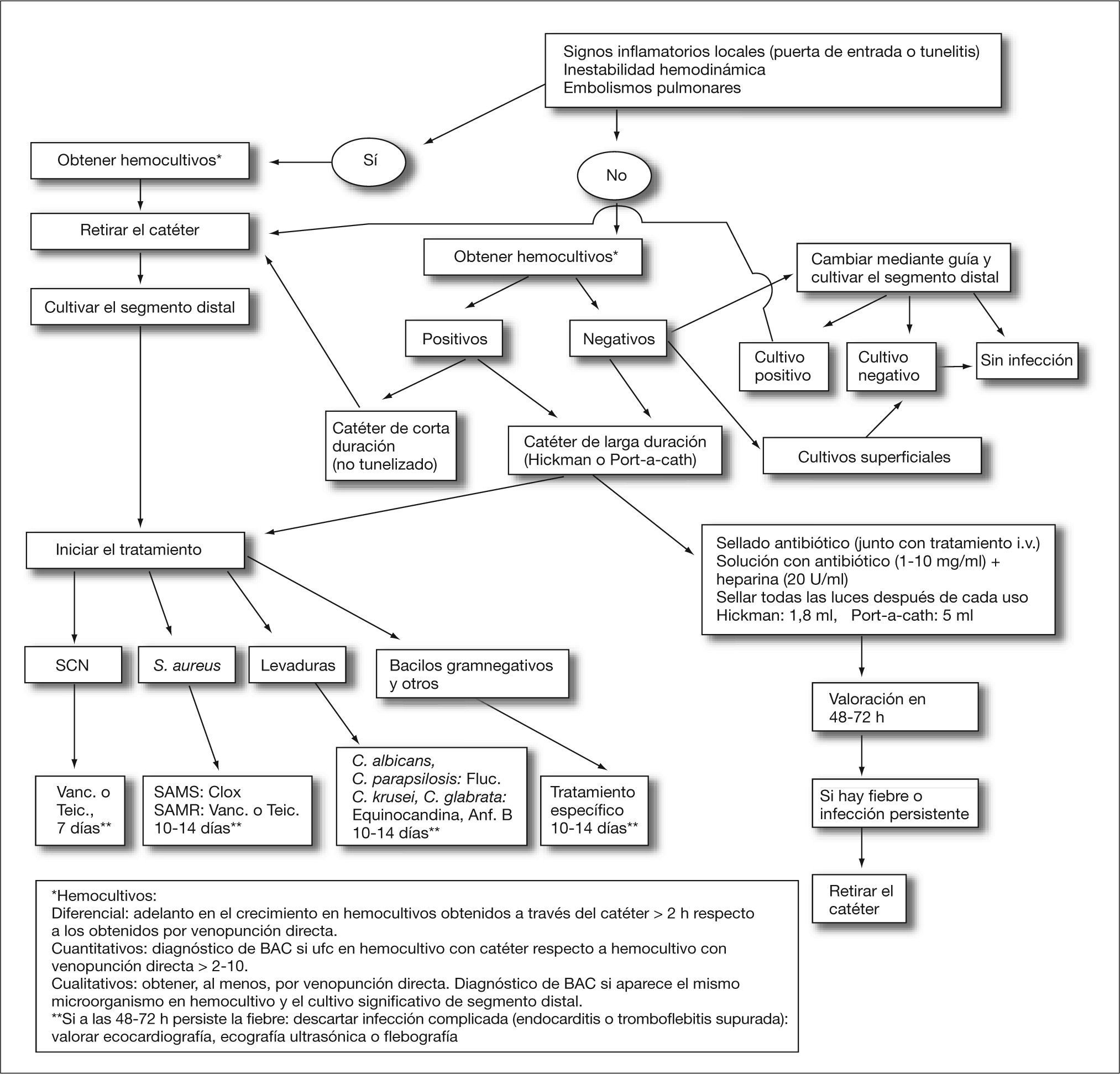
Tratamiento (fig. 1)Retirada del catéterSi es posible, se ha de llevar a cabo en todos los casos de infección probable o probada, y está fundamentalmente indicada en: a) catéteres fácilmente reemplazables, b) signos evidentes de infección local, c) presencia de embolismos pulmonares, d) implicación de agentes de conocida morbilidad y e) si se acompaña de shock séptico o el cuadro no está controlado en 48-72 h24,25.
Algoritmo de actuación en sospecha de infección asociada a catéter venoso central. Anf. B: anfotericina B; BAC: bacteriemia asociada a catéter; clox: cloxacilina; Fluc: fluconazol; SAMR: S. aureus resistente a meticilina; SAMS: S. aureus sensible a meticilina; SCN: Staphylococcus coagulasa-negativo; Teic: teicoplanina; Vanc: vancomicina.
No se recomienda si existe certeza de que dicho catéter está infectado; sin embargo, puede ser de utilidad si existen dudas de que la fuente de la infección sea el catéter. En ese caso, se retira el catéter nuevamente colocado mediante guía sólo si los cultivos del segmento distal del retirado muestran colonización del mismo.
Tratamiento conservador (sellado antibiótico)A pesar de que la retirada del catéter es el tratamiento recomendado, en algunos casos puede considerarse el tratamiento conservador. En estos casos es fundamental que las concentraciones endoluminales del antibiótico sean elevadas y mantenidas para así superar el fenómeno de tolerancia microbiológico asociado al crecimiento bacteriano en fase vegetativa que se produce en la biocapa o biofilm adherido al catéter. La evidencia de esta necesaria exposición prolongada de antibióticos en la zona endoluminal lo constituyen las técnicas que conllevan el sellado endoluminal con antibióticos (antibiotic-lock technique)26–33, y su aplicabilidad en el tratamiento de las infecciones asociadas a catéter ha sido recogida en las últimas recomendaciones de la IDSA, fundamentalmente si están producidas por SCN24. Este sellado consiste en la adición de antibióticos a la solución anticoagulante que se aplica tras el uso del catéter hasta su próxima utilización. Posibilita incluso evitar la necesidad de administración sistémica de antibióticos más allá de la prolongación del cuadro séptico asociado, aunque en espera de estudios controlados es recomendable la utilización del sellado como un tratamiento aditivo y no sustitutivo de la antibioticoterapia sistémica26.
Las dosis utilizadas oscilan entre 1 y 10 mg/ml. Se han utilizado con éxito en el sellado diferentes antimicrobianos, como vancomicina, teicoplanina, cefazolina, clindamicina, rifampicina, aminoglucósidos y quinolonas30–34. Recientemente, se han comunicado mejores resultados con la utilización de oxazolidinonas (linezolid y eperezolid) que con vancomicina y gentamicina en infecciones por SCN27. También se han utilizado con éxito sellados con minociclina, etanol35,36, ácido etilen-diamino-tetracético (EDTA) y etanol36 y con citrato de taurolidina37.
El tratamiento conservador debe llevar siempre implícita una especial vigilancia clínica del paciente, sobre todo en las primeras 48-72 h. Si pasado este tiempo el paciente sigue con fiebre o signos sugestivos de infección, la retirada del catéter es obligada.
La mayoría de los casos publicados con sellado endoluminal utilizan heparina como anticoagulante. En general, aunque incluso se puede tratar la antibioticoterapia en ausencia de anticoagulación, la práctica más habitual es la utilización de heparina en concentraciones bajas (20 U/ml de solución de sellado antibiótico o en solución simple). No se observa interacción con concentraciones de vancomicina de 100 a 4.000 μg/ml o ciprofloxacino entre 100 y 2.000 μg/ml y soluciones de heparina sódica al 5%. Se ha notificado un cierto sinergismo en la utilización conjunta de EDTA y minociclina en el tratamiento de bacteriemias asociadas catéter por Staphylococcus sp.36. No está claro el papel de la administración conjunta de antibióticos y agentes trombolíticos, como urokinasa. Algunos autores han mostrado una mayor tasa de embolismos sépticos; sin embargo, algunos estudios realizados en niños con patología oncológica han sido favorables.
Agente causalSi se va a probar un tratamiento conservador, las mejores circunstancias para ello son: ausencia de signos inflamatorios y estar producida la bacteriemia por SCN. La experiencia obtenida en los casos de infecciones producidas por S. aureus, levaduras y bacilos gramnegativos no es favorable, pues aparece un elevado índice de recidivas. En los casos excepcionales producidos por hongos filamentosos o micobacterias de rápido crecimiento la retirada es obligatoria. En el caso de bacteriemia por S. aureus es especialmente importante la retirada del catéter dado el riesgo de endocarditis. Si persiste la bacteriemia más allá de 72 h o se sospecha evolución desfavorable, se debe practicar una ecografía transesofágica para descartar endocarditis y prolongar la duración del tratamiento24,25. En los casos de candidemia existe también una recomendación clara sobre la retirada del catéter si existe sospecha de que éste es la fuente de la infección, pero existe controversia sobre el manejo de catéteres en los pacientes con candidemia de otro origen, dado el riesgo de anidación en el mismo y siembra metastásica38.
Antibioticoterapia sistémica y duración (fig. 1)Vancomicina es el tratamiento de elección en las infecciones y/o bacteriemias producidas por Staphylococcus spp. resistente a meticilina. La experiencia con teicoplanina es más reducida, aunque puede ser utilizada con éxito. La duración del tratamiento no está bien definida; sin embargo, 7 días de tratamiento pueden ser suficientes en bacteriemias por SCN24,25. En S. aureus, vancomicina es la elección en cepas resistentes a meticilina; para las cepas sensibles a meticilina el tratamiento lo debe constituir una isoxazolpenicilina o una cefalosporina de primera generación. La duración de la antibioticoterapia en bacteriemias por S. aureus no complicadas debe ser mínimo de 10 días, y posiblemente 14 días. Las infecciones producidas por bacilos gramnegativos deben ser tratadas durante 10-14 días con antibióticos adecuados al aislamiento, habitualmente betalactámicos o quinolonas, y más rara vez aminoglucósidos24,25. Las causadas por Candida sp. pueden ser tratadas con fluconazol si el agente es sensible. En cepas resistentes a azoles el tratamiento debe realizarse con una equinocandina o anfotericina B39,40.
Infecciones complicadasLa persistencia de fiebre o bacteriemia tras la retirada del catéter debe hacer sospechar la presencia de una infección profunda, fundamentalmente tromboflebitis supurada o endocarditis. Un examen físico que incluya la detección de nuevos soplos cardíacos, si es preciso mediante la realización de ecocardiografía, un examen funduscópico o en estudio de flujos venosos, mediante ecografía ultrasónica o flebografía, deben ser necesarios, especialmente en bacteriemias por S. aureus y Candida spp.24,25. La confirmación de una infección complicada asociada (endocarditis o tromboflebitis supurada) antes de la retirada del catéter es una indicación absoluta de retirada del mismo. Una vez retirado el catéter, la antibioticoterapia debe ser mantenida en estos casos durante, al menos, 4 semanas.
Curación sin antibioticoterapiaLa retirada del catéter conduce en muchos casos a la curación del cuadro clínico en ausencia de antibioticoterapia. Si el cultivo del segmento distal confirma un recuento bacteriano significativo y el paciente presenta la desaparición total de los síntomas, en general se recomienda la simple observación del paciente. La excepción a esto son los pacientes portadores de materiales protésicos en los que, ante el riesgo de anidación metastásica, la mayoría de autores recomiendan la administración de antibioticoterapia específica.
Estrategias de prevenciónExisten unas recomendaciones elaboradas por los Centers for Diseases Control and Prevention (CDC) americanos para el correcto manejo de los catéteres intravasculares basadas en evidencias contrastadas en la literatura médica2. En la tabla 3 se recoge un resumen de las mismas. A continuación se exponen los aspectos más destacables.
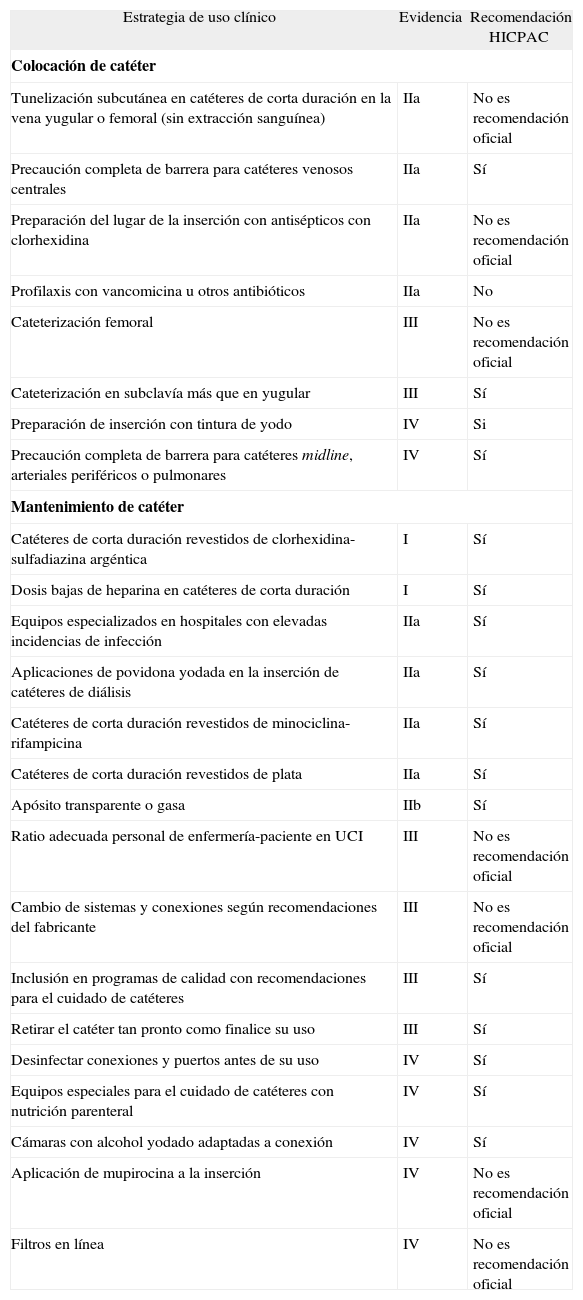
Recomendaciones para la prevención de la infección de catéter intravascular2
| Estrategia de uso clínico | Evidencia | Recomendación HICPAC |
| Colocación de catéter | ||
| Tunelización subcutánea en catéteres de corta duración en la vena yugular o femoral (sin extracción sanguínea) | IIa | No es recomendación oficial |
| Precaución completa de barrera para catéteres venosos centrales | IIa | Sí |
| Preparación del lugar de la inserción con antisépticos con clorhexidina | IIa | No es recomendación oficial |
| Profilaxis con vancomicina u otros antibióticos | IIa | No |
| Cateterización femoral | III | No es recomendación oficial |
| Cateterización en subclavía más que en yugular | III | Sí |
| Preparación de inserción con tintura de yodo | IV | Si |
| Precaución completa de barrera para catéteres midline, arteriales periféricos o pulmonares | IV | Sí |
| Mantenimiento de catéter | ||
| Catéteres de corta duración revestidos de clorhexidina-sulfadiazina argéntica | I | Sí |
| Dosis bajas de heparina en catéteres de corta duración | I | Sí |
| Equipos especializados en hospitales con elevadas incidencias de infección | IIa | Sí |
| Aplicaciones de povidona yodada en la inserción de catéteres de diálisis | IIa | Sí |
| Catéteres de corta duración revestidos de minociclina-rifampicina | IIa | Sí |
| Catéteres de corta duración revestidos de plata | IIa | Sí |
| Apósito transparente o gasa | IIb | Sí |
| Ratio adecuada personal de enfermería-paciente en UCI | III | No es recomendación oficial |
| Cambio de sistemas y conexiones según recomendaciones del fabricante | III | No es recomendación oficial |
| Inclusión en programas de calidad con recomendaciones para el cuidado de catéteres | III | Sí |
| Retirar el catéter tan pronto como finalice su uso | III | Sí |
| Desinfectar conexiones y puertos antes de su uso | IV | Sí |
| Equipos especiales para el cuidado de catéteres con nutrición parenteral | IV | Sí |
| Cámaras con alcohol yodado adaptadas a conexión | IV | Sí |
| Aplicación de mupirocina a la inserción | IV | No es recomendación oficial |
| Filtros en línea | IV | No es recomendación oficial |
Evidencia I: metaanálisis de ensayos clínicos aleatorizados. Evidencia IIa: por lo menos un ensayo clínico aleatorizado. Evidencia IIb: igual que IIa, pero en catéteres cambiados con guía. Evidencia III: por lo menos un ensayo clínico, no aleatorizado. Evidencia IV: Opinión de expertos o comités. HICPAC: Hospital Infection Control Practice Advisory Committee, de los Centers for Diseases Control and Prevention (CDC).
La utilización de medidas de asepsia más estrictas, como guantes, gorro, máscara y paño amplio, ha demostrado reducir la tasa de infección, y tiene un papel más determinante que el hecho de que la cateterización se lleve a cabo en el quirófano o en sala de hospitalización41. En este sentido, la utilización por parte del hospital de un equipo entrenado para la colocación de catéteres ha contribuido a la reducción de las tasas de infección y coste en dichos centros.
Antibióticos y desinfectantes tópicosUn metaanálisis que incluye siete estudios aletorizados demostró el beneficio del sellado de vancomicina en la reducción de la bacterimia asociada a catéteres de larga duración en pacientes con cáncer42; sin embargo, dada la pobre actividad de vancomicina en estafilococos incluidos en biofilms43, son necesarios más estudios para evaluar el posible impacto de desarrollo de resitencias derivadas de esta práctica.
Maki et al44 demostraron una superioridad de la clorhexidina del 2% sobre la povidona yodada y el alcohol al 70% en la reducción de la tasa de bacteriemia asociada y constituye el antiséptico recomendado.
Conexiones con cámara antisépticaLa utilización de cámaras con alcohol yodado adaptables a la conexión (sistemas tipo Segur Lock®) han demostrado una reducción en las bacteriemias asociadas a catéteres sujetos a manipulaciones numerosas o prolongadas45.
Revestimiento de plataAunque estudios con un número reducido de pacientes han mostrado una menor frecuencia de infección en pacientes graves con catéteres venosos centrales de corta duración (media: 5-9 días), su eficacia en catéteres de mayor duración (media: 20 días) o en pacientes con catéteres de tipo Hickman no ha sido probada46.
Revestimiento del catéter con antimicrobianosSe han utilizado con éxito los revestimientos de catéteres con benzalconio o cefazolina. Los catéteres revestidos de clorhexidina y sulfadiazina argéntica se han asociado a un menor grado de colonización, pero la mayoría de los estudios no han demostrado una reducción significativa de las bacteriemias47. Sin embargo, diferentes estudios experimentales48 y clínicos49,50 han mostrado la superioridad de los catéteres revestidos (externa e internamente) con minociclina-rifampicina, consiguiendo una clara reducción de las bacteriemias asociadas y son los únicos catéteres aprobados por la Food and Drug Administration (FDA) para este uso.
En conclusión, aunque se han producido avances considerables en los últimos años en el campo del diagnóstico, tratamiento y prevención de las infecciones relacionadas con los catéteres intravasculares, la frecuencia y repercusión clínica del problema hacen necesarios nuevos progresos en este campo. Técnicas más sensibles y específicas, fundamentalmente si el catéter no se retira, tratamientos con mayor capacidad bactericida en presencia de biofilms y medidas de prevención más eficaces y baratas constituyen algunas de estas necesidades.