La microbiota vaginal, dominada por Lactobacillus crispatus, L. jensenii y L. gasseri, protege a la mucosa frente al establecimiento de microorganismos patógenos mediante tres mecanismos complementarios: a) la adherencia específica al epitelio, que bloquea su asentamiento, b) la producción de compuestos antimicrobianos y c) la coagregación con los patógenos, que potencia su efecto microbiocida. A pesar de ello, en ocasiones se ve desplazada por microorganismos indeseables, lo que se asocia con la aparición de vaginosis bacteriana, vaginitis por Candida spp., tricomoniasis e infecciones del tracto urinario inferior. Muy raramente, los lactobacilos causan patología, invariablemente en pacientes inmunodeprimidos. Los cuadros dominantes son bacteriemias (alrededor del 50% de los casos) y endocarditis (30%). Sin embargo, no se ha descrito patología genital por lactobacilos. El efecto mutualista de los lactobacilos sugiere que su instilación podría regenerar el ecosistema vaginal, eliminando las recidivas asociadas al tratamiento de la infección.
Vaginal microbiota, mainly comprised of Lactobacillus crispatus, L. jensenii and L. gasseri, protect the mucosa against the establishment of pathogenic microorganisms through three complementary mechanisms: a) specific adherence to the epithelium, which blocks colonization of pathogens, b) production of antimicrobial compounds, and c) co-aggregation with pathogens, which enhances their microbiocidal effect. Despite these mechanisms, vaginal microbiota are sometimes displaced by undesirable microorganisms, which is associated with the development of bacterial vaginosis, vaginitis due to Candida spp., trichomoniasis, and lower urinary tract infections. On rare occasions, lactobacilli cause disease, but exclusively in immunocompromised patients. The main conditions are bacteremia (about 50% of the cases) and endocarditis (30%). However, no genital pathology caused by lactobacilli has been reported. The mutualistic effect of lactobacilli suggests that instillation of these microorganisms might regenerate the vaginal ecosystem, thus eliminating the relapses associated with treatment of the infection.
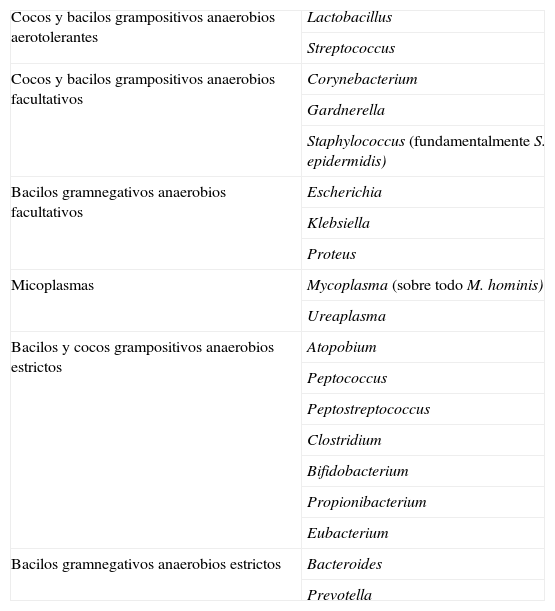
En la tabla 1 se presenta una relación de los microorganismos que se detectan con regularidad en la vagina de mujeres sanas. La mayoría son típicos del hábitat intestinal, lo que sugiere que el tracto entérico podría actuar como reservorio de dichos agentes infecciosos. Sin embargo, las frecuencias relativas son muy distintas a las encontradas en la porción final del tubo digestivo. Las diferencias más notables son las siguientes: los lactobacilos son dominantes en la vagina, hasta el punto de ser prácticamente exclusivos en muchos casos1; mientras que son minoritarios en el intestino, no siempre aparecen y cuando lo hacen su proporción nunca es mayor del 1%2. En general, el porcentaje de muestras de exudado vaginal que presentan predominancia de los lactobacilos es superior al 70%, tanto si el procesamiento de las mismas incluye el cultivo3,4 como si se hace por métodos genotípicos5-7. Por otro lado, las bacterias grampositivas o gramnegativas anaerobias estrictas de los grupos Clostridium-Eubacterium y Bacteroides-Prevotella, respectivamente, que dominan el hábitat intestinal, aparecen esporádicamente en la vagina, lo que sugiere que en esta mucosa son transeúntes más que colonizadoras.
Géneros de microorganismos que se encuentran en la vagina de mujeres sanas
| Cocos y bacilos grampositivos anaerobios aerotolerantes | Lactobacillus |
| Streptococcus | |
| Cocos y bacilos grampositivos anaerobios facultativos | Corynebacterium |
| Gardnerella | |
| Staphylococcus (fundamentalmente S. epidermidis) | |
| Bacilos gramnegativos anaerobios facultativos | Escherichia |
| Klebsiella | |
| Proteus | |
| Micoplasmas | Mycoplasma (sobre todo M. hominis) |
| Ureaplasma | |
| Bacilos y cocos grampositivos anaerobios estrictos | Atopobium |
| Peptococcus | |
| Peptostreptococcus | |
| Clostridium | |
| Bifidobacterium | |
| Propionibacterium | |
| Eubacterium | |
| Bacilos gramnegativos anaerobios estrictos | Bacteroides |
| Prevotella |
Desde el primer estudio microbiológico de la vagina humana, realizado por Doderlein8, los lactobacilos han sido descritos consistentemente como los microbios dominantes en dicho hábitat9-11. Por ello, se considera que tienen un papel crítico en el mantenimiento del ecosistema vaginal al prevenir la excesiva proliferación de microorganismos indígenas, como Gardnerella vaginalis, que cuando se convierten en dominantes pueden inducir alteraciones como la vaginosis. Igualmente, impedirían la colonización por patógenos y la aparición de vaginitis y cervicitis, que podrían complicarse con afectación de estructuras regionales como el útero y las glándulas de Bartolino o incluso convertirse en infección sistémica.
Características generalesLos lactobacilos varían desde formas muy alargadas a bastante cortas y desde rectas a curvadas e incluso espiriladas. Se les incluye habitualmente en el grupo amplio y heterogéneo de las bacterias del ácido láctico, caracterizadas por ser grampositivas, no esporuladas y con un catabolismo de los azúcares estrictamente fermentativo, cuyo producto final predominante es dicho ácido orgánico. En general, son bacterias anaerobias aerotolerantes. Presentan genomas pequeños, por lo que son muy exigentes nutricionalmente. Sin duda, su inocuidad como agentes infecciosos se debe también en parte a esta escasez de información genética; por ejemplo, no se han descrito en ninguna de las cuatro cepas secuenciadas hasta el momento genes codificantes de factores de virulencia.
TaxonomíaLa adscripción precisa de los lactobacilos aislados de vagina a especies concretas va a depender de los métodos de identificación empleados, observándose una disparidad en los datos obtenidos cuando se usan técnicas que ponen de manifiesto cualidades fenotípicas y las que determinan propiedades genotípicas.
En los métodos dependientes de cultivo se incluyen habitualmente dentro del género Lactobacillus los aislados bacilares, no esporulados, grampositivos y catalasa negativos. Adicionalmente, puede emplearse como criterio el desarrollo en medio MRS, aunque esta última exigencia puede dejar fuera a algunas especies como L. iners. En todo caso, en los aislamientos primarios los lactobacilos se comportan como organismos fastidiosos, y es aconsejable la incubación en medios enriquecidos con hemo (hemina, hemoglobina o sangre) y la atmósfera enriquecida en CO2 o incluso anaerobia.
Una vez purificados, los aislados se suelen someter a las pruebas de identificación que, tradicionalmente, consistían en la determinación de la capacidad de la cepa en estudio para fermentar diferentes fuentes de carbono y de crecer en medios con concentraciones crecientes de sal12. Más recientemente se popularizaron las galerías miniaturizadas. Tanto unas pruebas como las otras indican que la vagina está colonizada preferentemente por L. acidop- hilus4,12-14 y/o L. fermentum15.
Sin embargo, cuando se aplican métodos genotípicos de identificación a los mismos aislados, prácticamente ninguno puede adscribirse a cualquiera de esas dos especies, y las predominantes son L. crispatus, L. gasseri y L. jensenii, tanto si se analiza el grado de homología de los ADN cromosómicos16,17, se determina la huella genética (DNA fingerprinting)5 o las secuencias de los ARNr 16S18,19. Por estos métodos también se detectan con frecuencia en la vagina otras especies como L. iners6,7 y L. vaginalis14.
La disparidad entre los métodos fenotípicos y genotípicos parece deberse a la diversidad bioquímica intraespecífica de los lactobacilos vaginales y a la ausencia de algunas especies en las bases de datos de las galerías comerciales (Boyd et al14, encontraron sólo el 4% de coincidencia en un estudio con 97 cepas de origen vaginal).
Bases de la interacción bacilo de Doderlein-hospedadorComo hemos visto, los lactobacilos son predominantes en la vagina de las mujeres fértiles e impiden la colonización de la mucosa por microorganismos indeseados, generadores de patología urogenital. Es cierto que mujeres colonizadas por bacterias alternativas como Atopobium u otras7,19 parecen estar también protegidas, lo que indica que el requerimiento de una microbiota dominada por Lactobacillus no es absoluto. Ahora bien, estos otros organismos aparecen esporádicamente, por lo que sigue considerándose que los lactobacilos son fundamentales para el mantenimiento de la homeostasis vaginal, y son los principales candidatos para ser usados en terapias de reposición en procesos patológicos que la afecten20.
Las propiedades de la microbiota vaginal que le permiten colonizar la mucosa e impedir el establecimiento o la proliferación excesiva de microorganismos potencialmente patógenos son de dos tipos: a) la adherencia específica a las células epiteliales y a dichos patógenos, y b) la producción de compuestos antimicrobianos.
Adherencia al epitelio vaginal e inhibición de la colonización por organismos indeseadosLa protección de la mucosa vaginal depende del reconocimiento específico entre las estructuras superficiales de los lactobacilos (adhesinas) y del epitelio (receptores).
Las adhesinas forman parte del glucocaliz o de la pared celular y su composición parece ser variada. Así se han descrito los ácidos lipoteicoicos21, proteínas extracelulares22, carbohidratos y glucoproteínas23, aunque aún no se ha purificado ningún componente de las cubiertas bacterianas que se una específicamente a las células de la mucosa vaginal.
Respecto a los receptores localizados en la superficie del epitelio, aún se sabe menos. Se ha observado que la fibronectina, que es una glucoproteína que forma parte de la matriz extracelular, es reconocida específicamente por lactobacilos aislados de vagina, cuya unión se ve favorecida en condiciones de acidez; así, cepas que no se unen a pH neutro sí lo hacen a pH 424. Este hecho, unido a la baja capacidad de cepas de bacterias intestinales anaerobias para unirse a dicha macromolécula25, tiene implicaciones ecológicas evidentes. La unión de los lactobacilos también podría ser directa a glucolípidos de la membrana de las células vaginales, en un proceso mediado por cationes divalentes23.
El resultado de la asociación entre los lactobacilos y el epitelio vaginal es la formación de una biopelícula que lo protege frente a la colonización por microorganismos indeseados24-26. Este efecto se ve potenciado por la capacidad de los lactobacilos vaginales para coagregar con los patógenos potenciales. La mayoría de aislados vaginales autoagregan, propiedad que desaparece tras el tratamiento de las células con proteinasa K, por lo que se postula que dicho efecto sería dependiente de la producción de una proteína exocelular26. La capacidad de agregación se manifiesta también respecto a otros microorganismos como Escherichia coli, G. vaginalis y Candida albicans, lo cual induce un efecto antimicrobiano notable, probablemente como consecuencia de que el contacto estrecho que se establece aumenta la efectividad del ácido láctico, el peróxido de hidrógeno y otros productos microbiocidas generados por los lactobacilos26-29.
Producción de compuestos antimicrobianosÁcidos orgánicosEl pH fisiológico de la vagina es de aproximadamente 4. Este ambiente ácido inhibe parcial o totalmente el desarrollo de la mayor parte de las bacterias procedentes del tracto digestivo y de las de origen ambiental, siendo así un mecanismo de protección de la mucosa muy eficaz, hasta el punto de que un rasgo diferencial de la vaginosis es un exudado con un pH próximo a la neutralidad30,31.
El origen de la acidez vaginal es el ácido láctico que se genera como producto final del metabolismo fermentativo de los glúcidos, que llevan a cabo los lactobacilos residentes y las propias células epiteliales.
Las células vaginales tienden a acumular glucógeno, especialmente durante el período comprendido entre la menarquia y la menopausia, por lo que se considera que este glúcido es la fuente de la que deriva la acidez vaginal. Debido a ello, es creencia generalizada que los lactobacilos escinden el glucógeno a glucosa y ésta a ácido láctico. Sin embargo, no hay evidencia de que la degradación de glucógeno sea una característica general de estas bacterias. De hecho, en los artículos en los que se trata este tema, todos ellos muy antiguos, la evidencia es la contraria12,13,32. Así pues, es probable que el glucógeno vaginal sea degradado hasta glucosa por las propias células del epitelio, de modo que el papel de los lactobacilos sería la fermentación de dicho azúcar para generar el ácido láctico responsable del antagonismo frente a la colonización por microorganismos indeseados. En apoyo de esta hipótesis está el hecho de que en la vagina aparecen los isómeros L y D del ácido láctico en proporciones semejantes. La generación de ambas formas quirales es característica de Lactobacillus spp., mientras que nuestras células sólo generan el isómero L33,34.
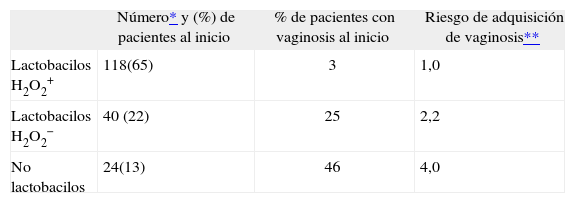
Peróxido de hidrógenoLa producción de agua oxigenada parece ser común entre ciertas especies de lactobacilos como L. crispatus y L. jensenii, mientras que es excepcional en otras como L. fermentum y los lactobacilos que habitan preferentemente en el intestino, como L. plantarum y L. casei, incluso aunque se aíslen de la vagina16,35. Las cepas productoras de H2O2 son más estables en el ambiente vaginal17 y protegen mejor la mucosa frente a las alteraciones causadas por microorganismos indeseados (tabla 2)1,4,36, incluyendo productores de infecciones de transmisión sexual (ITS) como Neisseria gonorrhoeae37. Ahora bien, el efecto antagonista es mayor cuando se asocia a especies determinadas; así, en un estudio con 174 pacientes se encontró que la frecuencia de vaginosis era del 9% en mujeres que albergaban cepas de L. crispatus o L. jensenii, mientras que subía hasta el 44% en las colonizadas por otros lactobacilos productores de H2O235.
Influencia de la presencia de Lactobacillus spp. en vagina y de la producción de peróxido de hidrógeno sobre la frecuencia de vaginosis bacteriana
| Número* y (%) de pacientes al inicio | % de pacientes con vaginosis al inicio | Riesgo de adquisición de vaginosis** | |
| Lactobacilos H2O2+ | 118(65) | 3 | 1,0 |
| Lactobacilos H2O2− | 40 (22) | 25 | 2,2 |
| No lactobacilos | 24(13) | 46 | 4,0 |
El efecto bactericida del agua oxigenada viene determinado por su capacidad oxidante y por la generación, a partir de ella, de metabolitos como el radical OH−, que dañan la integridad del ADN celular. Dicho efecto se potencia por la mieloperoxidasa y los radicales haluro, como el Cl−, que son abundantes en las secreciones biológicas y cuya elevada concentración en el mucus uterino es especialmente pertinente, sobre todo durante la ovulación38,39.
BacteriocinasSon polipéptidos con actividad antimicrobiana que, al contrario que los antibióticos peptídicos, se sintetizan en los ribosomas. Las bacterias lácticas producen multitud de bacteriocinas, alguna de las cuales, como la nisina, se emplea como conservante alimentario. Suelen ser moléculas anfipáticas que originan la apertura de poros en las membranas e incluso la lisis celular, ya que algunas se unen al lípido II de la pared (el mismo que es reconocido por la vancomicina)40,41. Aunque se han descrito múltiples actividades compatibles con la producción de bacteriocinas por lactobacilos de origen vaginal, sólo hay dos casos en los que existe evidencia; uno de ellos es un péptido de 3,8 kDa activo sobre cepas de G. vaginalis, mientras que el otro inhibe diversas cepas de Enterococcus42,43. Ahora bien, el papel antagonista real de las bacteriocinas no se conoce, ya que su efecto bactericida sólo se ha comprobado in vitro.
Agentes tensioactivosSon compuestos anfifílicos que originan una disminución de la tensión superficial, favoreciendo la solubilización de sustancias hidrofóbicas. Se han descrito dos agentes tensioactivos, producidos respectivamente por una cepa de L. acidophilus y otra de L. fermentum, que inhiben la adhesión de E. faecalis y de E. coli, pero no la de C. albicans, a la goma de silicona de los catéteres44,45. Desafortunadamente, no se ha probado si también inhiben la adherencia de bacterias indeseadas a las células del epitelio vaginal. Por otra parte, los agentes tensioactivos solubilizan lípidos, de manera que podrían ser letales para virus envueltos y para micoplasmas, los cuales serían especialmente susceptibles al carecer de pared celular46,47.
Los lactobacilos en retirada: patología asociadaEn ocasiones, la concentración de lactobacilos en la vagina disminuye por debajo de un nivel crítico, a pesar del enorme arsenal que acabamos de describir en el apartado anterior. Esta circunstancia es aprovechada por microorganismos que se encuentran habitualmente en la vagina sana y/o por otros de origen exógeno, que proliferarán hasta hacerse dominantes, comportándose así como patógenos oportunistas48.
Los cuadros que se han asociado a la disminución de lactobacilos sobre el epitelio vaginal son cuatro: la vaginosis bacteriana, cuyos agentes etiológicos más habituales son Gardnerella vaginalis, Mycoplasma hominis, Prevotella y Peptostreptococcus49,50; la candidiasis, producida por Candida albicans (en el 85% de los casos), C. glabrata y C. tropicalis51; la tricomoniasis, consecuencia de la proliferación de Trichomonas vaginalis52 y las infecciones del tracto urinario inferior, causadas sobre todo por enterobacterias de origen intestinal (Escherichia coli es responsable de al menos el 80% de los casos) aunque, en ocasiones, se aíslan cocos grampositivos como Enterococcus faecalis53.
Ahora bien, la desaparición de los lactobacilos vaginales ¿es la causa o el efecto de la proliferación excesiva de los patógenos? Para responder a esta cuestión hemos de tener en cuenta que el hábitat vaginal sufre frecuentes cambios originados por su propia fisiología. Así, el aumento cíclico de la concentración de hormonas esteroideas, que ayuda al desarrollo de los lactobacilos, también es beneficioso para algunos de los patógenos potenciales. Por ejemplo, los estrógenos parecen favorecer la adherencia de Candida al epitelio54 y la proliferación de T. vaginalis, hasta el punto de que este último organismo puede desarrollarse transitoriamente en la vagina de niñas recién nacidas debido a las hormonas recibidas por vía trasplacentaria, pero desaparece a las pocas semanas según se van metabolizando52,55.
Por otro lado, la descarga menstrual o el semen tienen un pH próximo a la neutralidad, circunstancia en la que los lactobacilos tienen dificultades para crecer, y en este último caso el grado de acidez protector tarda varias horas en recuperarse56,57. El uso de tampones coadyuvaría al mantenimiento de un pH excesivamente elevado durante períodos prolongados. Si unimos estos datos al hecho de que un pH vaginal superior a 4,7 es uno de los signos característicos de la vaginosis y de la tricomoniasis30,52, podríamos postular que la disminución de la acidez vaginal es un factor predisponente importante para la proliferación excesiva de los patógenos oportunistas.
Ahora bien, la alcalinización del ambiente vaginal puede no ser la causa, sino la consecuencia del desarrollo excesivo de algunos patógenos. Por ejemplo, G. vaginalis y T. vaginalis presentan una potente actividad aminoácido descarboxilasa, por lo que generan aminas biógenas, las cuales, aparte de su efecto anafiláctico, originan la elevación del pH, favoreciendo la expansión de dichos organismos y la inhibición de los lactobacilos. Adicionalmente, las aminas son responsables del olor pútrido, típico de la secreción, que aumenta con la adición de KOH al 10% y que constituye otro signo de diagnóstico relevante30,52. La descarboxilación de los aminoácidos genera, además, CO2, lo que podría favorecer la sobreinfección por bacterias anaerobias como Prevotella y Peptostreptococcus.
Complementariamente, tanto los dispositivos intrauterinos como los espermicidas inhiben el desarrollo de los lactobacilos, favoreciendo así la aparición subsiguiente de vaginosis y vaginitis58,59. Por último, los antibióticos usados en el tratamiento sistémico de infecciones y los agentes antineoplásicos (que suelen ser activos además frente a bacterias grampositivas) permean al exudado vaginal, provocando también, con frecuencia, una alteración sustancial de la microbiota de ocupación58,60,61.
Los cuadros derivados de la disminución de los lactobacilos vaginales parecen inducir complicaciones importantes. Así, se han asociado con infecciones posquirúrgicas62 y como predisponentes para la adquisición de ITS producidas por N. gonorrhoeae, Chlamydia spp. y VIH63,64. Ahora bien, estas últimas podrían no ser solamente consecuencia, sino también causa de la vaginosis y de la vaginitis; la inflamación, pus, mucosidad e incluso hemorragias cervicales que se asocian a las ITS podrían alterar el microambiente vaginal y causar la desaparición de los lactobacilos, lo que sería aprovechado por los patógenos oportunistas57.
Aunque las infecciones del tracto urinario inferior (ITU) no son propiamente genitales, la colonización vaginal por parte de las bacterias causales, cuyo reservorio es el intestino grueso, parece ser un paso intermedio esencial en su migración a la región periuretral y, posteriormente, a la vejiga65. Así, se ha encontrado que la frecuencia de ITU es inversamente proporcional a la presencia de una microbiota normal, dominada por lactobacilos, en la vagina de las mujeres sanas66. Complementariamente, se ha determinado que la ITU iba prácticamente siempre precedida de la colonización vaginal por parte de los patógenos urinarios67. Así podría explicarse también por qué dichos cuadros son predominantes en mujeres posmenopáusicas, que han perdido gran parte de los lactobacilos vaginales y son, por ello, más susceptibles a la colonización por E. coli y otras enterobacterias68. También explicaría la relación entre la reducción de ITU y el tratamiento estrogénico en este grupo de pacientes, que induce la recolonización de la mucosa por Lactobacillus spp.69.
Infecciones por LactobacillusEn general se asume que los lactobacilos son bacterias inocuas y, de hecho, se les considera microorganismos GRAS (Generally Regarded As Safe) por la Food and Drug Administration (FDA) debido a que se consumen de manera habitual como parte de los productos fermentados, sin que ello suponga ningún problema de Salud Pública.
Ahora bien, en algunas ocasiones se les ha asociado a procesos patológicos. Así, en una revisión reciente70 se computaron los 241 casos aparecidos en la literatura médica entre 1950 y 2003 (aunque en ella refieren a una revisión anterior71 cuyos datos abarcan desde 1938). De ellos, 129 eran bacteriemias (53,5%); 73, endocarditis (30,3%) y 39, infecciones localizadas (16,2%). Entre estas últimas, la localización pulmonar era prevalente (38,5% de los casos), seguida de los abscesos (20,5%). Curiosamente, la infección digestiva es extremadamente rara y no se han descrito casos de afectación ginecológica.
Los agentes etiológicos se identificaron en 140 casos, y los más frecuentes fueron los lactobacilos heterofermentadores facultativos de los grupos L. casei L. paracasei (42,8%), L. rhamnosus (22,9%) y L. plantarum (10%), cuyo hábitat preferencial es el ambiente externo. El conjunto de lactobacilos que aparecen habitualmente en la vagina (L. acidophilus, L. gasseri, L. jensenii, y L. fermentum) todos ellos homofermentadores estrictos, eran responsables del 15,7% de las infecciones (esto representa 22 casos en 53 años, lo que indica que la traslocación desde la vagina, si existe, es muy infrecuente).
En un estudio llevado a cabo en Finlandia, se encontró que la incidencia de bacteriemia por lactobacilos era de aproximadamente el 0,02% de todos los hemocultivos procesados entre 1995 y 2000, lo que supone una tasa de 0,3 casos/100.000 habitantes72. Por otra parte, diversos análisis de incidencia muestran bacilinemia en entre el 0,1 y el 0,4% de los hemocultivos positivos71-73.
En alrededor del 40% de bacteriemias y de infecciones localizadas la afección era polimicrobiana, y los organismos acompañantes más comunes eran Candida, Streptococcus y Enterococcus. Como era de esperar, las infecciones mixtas se asocian a un peor pronóstico.
Invariablemente, los pacientes presentaban enfermedades de base graves o condiciones que deprimían significativamente el sistema inmune, y las más frecuentes eran cáncer, diabetes, infección previa tratada con antibióticos de amplio espectro y trasplantes, especialmente hepático.
El factor predisponente más importante en casos de endocarditis es la cardiopatía previa seguida de la manipulación dental. Las infecciones mixtas son muy escasas en esta localización.
Así pues, podemos concluir que los lactobacilos son organismos oportunistas que únicamente producen infección en personas con enfermedades subyacentes graves, especialmente las que inducen inmunodepresión71,74. Esto hizo que se planteara la conveniencia o no de eliminar de la dieta de estos pacientes los productos fermentados, especialmente los que contienen organismos probióticos, ya que éstos suelen ser resistentes a la acidez estomacal y a la bilis. Sin embargo, son numerosos los estudios que no encuentran una relación entre el consumo de estos alimentos y un incremento en la incidencia de las infecciones por lactobacilos en inmunodeprimidos72,75, incluyendo a afectados de SIDA76. Apesar de ello, en un estudio reciente sobre bacteriemias se encontró que en casi el 50% de las infecciones causadas por L. rhamnosus el perfil genómico era indistinguible del de L. rhamnosus GG, una bacteria de origen intestinal que se usa como probiótica desde 199077.
Perspectivas terapéuticas: los lactobacilos vaginales como agentes probióticosEl término probiótico designa "microorganismos vivos que, administrados en cantidades adecuadas, ejercen un efecto beneficioso sobre la salud"78. El concepto deriva de la observación de Metchnikoff79 de que las poblaciones que consumían leche fermentada tenían una esperanza de vida superior a la del resto. Esto le llevó a postular que las bacterias responsables de la fermentación desplazarían a los "organismos putrefactivos" del intestino grueso, eliminándose así la generación de sustancias tóxicas como las aminas biógenas, el indol, la urea y el ácido sulfídrico.
Sin embargo, la asunción de que la administración de bacterias en grandes cantidades causaría su establecimiento sobre las mucosas resultó ser excesivamente optimista, ya que pasó por alto una de las principales características de los ecosistemas complejos: la homeostasis, por la que cada miembro de la comunidad tiene un papel complementario al de todos los demás, lo que impide en la práctica la sustitución de cualquier miembro autóctono por los organismos que se administran desde el exterior2,80.
Ahora bien, el ecosistema vaginal es mucho menos complejo que el intestinal y los lactobacilos son dominantes en él, por lo que, en principio, debería ser más sencillo promover la reposición de una microbiota normal después de su alteración por un proceso patológico o como consecuencia de un tratamiento quimioterápico.
El uso de lactobacilos para tratar infecciones del tracto genitourinario data de 1915, cuando Newman los inyectó en la vejiga urinaria para tratar la cistitis81. El advenimiento de la antibioticoterapia relegó estas prácticas hasta que, hacia 1970, empezó a evidenciarse que dichos tratamientos eran parcialmente ineficaces, con altos porcentajes de recidivas que obligaban, en ocasiones, al uso profiláctico continuado de los quimioterápicos, lo que, a su vez, inducía la aparición de efectos secundarios y la selección de mutantes resistentes.
Todas estas razones hicieron renacer el interés en la terapia de reposición microbiana. Sin embargo, no parece que la instilación de lactobacilos haya dado resultados satisfactorios hasta muy recientemente65,82. Esta falta de éxito podría estar motivada por una selección deficiente de las cepas (en algunos casos tenían origen ambiental, lácteo o animal) y el hecho de que casi siempre se administraban cepas únicas, lo que probablemente no proporcione el abanico de propiedades necesario para que se genere un ecosistema maduro, en el que sus componentes establezcan una relación a largo plazo entre sí y con la mujer hospedadora. Por último, los lactobacilos silvestres, tanto los indígenas de la propia vagina como los de origen rectal, parecen tener una gran capacidad de recolonización de la mucosa vaginal, por lo que competirán con las cepas presuntamente probióticas35,83.
La mayor parte de los trabajos realizados en los últimos años para seleccionar cepas con propiedades probióticas han partido de muestras de mucosa vaginal, en general procedentes de mujeres sanas. Lógicamente, este origen aumenta las posibilidades de que las células se adhieran bien a la mucosa, lo que facilitaría su implantación, y de que sean capaces de coagregar eficientemente con los patógenos más habituales, para maximizar el efecto del ácido láctico, el agua oxigenada y otros agentes antimicrobianos sobre ellos.
Ahora bien, ninguna de estas propiedades manifestadas in vitro garantiza una buena implantación y antagonismo frente a los microorganismos indeseados. Por ello, es necesario llevar a cabo ensayos clínicos bien diseñados, incluyendo la metodología a doble ciego, para evaluar adecuadamente el potencial de las cepas candidatas a convertirse en probióticos urogenitales.
En realidad, este segundo filtro ha sido superado tan sólo por la administración conjunta de L. rhamnosus GR1 y L. reuteri B-54 o L. reuteri RC-14. La primera de estas cepas se eligió por su capacidad de inhibir el desarrollo de algunas bacterias gramnegativas y por su resistencia a los espermicidas, mientras que las dos restantes son productoras de H2O284. Parece, además, que GR1 podría inhibir la respuesta inflamatoria de la mucosa y que RC14 estimularía la secreción de mucina, lo que podría actuar como una barrera frente al establecimiento de patógenos sobre el epitelio65.
Inicialmente, la administración se hacía por vía vaginal, en cápsulas de gelatina que se instilaban una o dos veces por semana y contenían alrededor de 109 bacterias viables liofilizadas. Se consiguió así hacer descender la frecuencia de recurrencias de ITU desde 6 a 1,6 episodios al año, un valor semejante al observado cuando se llevaba a cabo un tratamiento profiláctico continuado con nitrofurantoína u otros antimicrobianos85,86.
El hecho de que el recto actúe como un reservorio para los lactobacilos vaginales35 sugiere que la ingestión de cepas probióticas podría ser una ruta de administración alternativa a la vaginal. Basándose en este principio, se observó que la ingestión continuada de dosis elevadas de L. rhamnosus GR1 y de L. reuteri RC14 resultaba en su aislamiento de vagina a partir de una semana de tratamiento, aunque su persistencia variaba según las pacientes después de interrumpir la administración87. Complementariamente, un estudio semejante con 64 mujeres asintomáticas reveló que las que habían ingerido las cepas probióticas presentaban un incremento significativo del grado de colonización por lactobacilos (aunque no se determinó si era debido al establecimiento de dichas cepas o bien a la recuperación de cepas indígenas de las pacientes). Dicho incremento se acompañaba de la reducción de la colonización por Candida y uropatógenos84. Estos datos son esperanzadores, pero requieren de una evaluación de la capacidad de las cepas probióticas administradas oralmente para, por si solas, revertir la sintomatología asociada a la infección genitourinaria.
También presenta un especial interés determinar si la administración de cepas de lactobacilos inmediatamente después de un tratamiento antibiótico incide en las tasas de curación y en la prevención de recurrencias y de infecciones oportunistas. En un primer trabajo se sometió a mujeres tratadas con cotrimoxazol durante tres días, a una terapia de reposición, por vía vaginal, con la mezcla de L. rhamnosus GR1 y L. reuteri B54, como consecuencia de la cual se observó una disminución significativa de las recurrencias de ITU88. En un segundo estudio, se partió de una muestra de 360 mujeres afectadas de tricomoniasis (76%), candidiasis (17%), vaginosis (5,5%) o infección polimicrobiana (1,5%). A las que presentaban tricomoniasis y vaginosis se las trató con metronidazol, mientras que a las que sufrían candidiasis se les administró fluconazol (en ambos casos por vía sistémica). Dos días después de finalizado el tratamiento se inició la terapia de reposición con tabletas vaginales contenedoras de, al menos, 107 lactobacilos viables y 30 μg de estradiol, que se mantuvo durante al menos 6 días. Las muestras tomadas una y seis semanas después de la finalización de este tratamiento indicaron que la colonización por lactobacilos era mayoritaria en alrededor del 70% de las mujeres tratadas, mientras que no llegaba al 50% en las que recibieron placebo. Diferencias semejantes se observaban respecto a la resolución clínica del problema y al número de recaídas en los dos años siguientes. Es una pena que los datos aportados no nos permitan discriminar entre el papel desempeñado por la cepa probiótica y el debido al estrógeno que la acompañaba83.
Hasta el momento sólo existe un estudio en el que se hayan usado cepas probióticas por vía oral como terapia de reposición tras un tratamiento antibiótico. En él, 125 mujeres con vaginosis sintomática fueron tratadas con metronidazol y una mezcla de lactobacilos durante una semana. La preparación probiótica se les administró durante 23 días más y se determinó el grado de reversión vaginal a la normalidad. El 96% de las tratadas y el 53% de las control presentaban una microbiota dominada por Lactobacillus spp., lo que se correspondía con un porcentaje de curación del 88 y del 40%, respectivamente. Ninguna de las mujeres del grupo que recibió las cepas probióticas presentaba una vaginitis franca, situación que se observó en el 30% de las que recibieron placebo89.
Consideración finalComo hemos visto, la microbiota de ocupación es esencial para el mantenimiento de la salud vaginal. Habitualmente, cuando ésta se ve alterada como consecuencia de la infección por microorganismos indeseables, el tratamiento incluye el uso de inhibidores del desarrollo microbiano, lo que, en ocasiones, altera aún más el ecosistema, dificultando la recuperación y abriendo las puertas a procesos crónicos recidivantes. Por ello, hace ya algunos años se planteó que una alternativa de tratamiento más juiciosa sería tratar de devolver la homeostasis al ecosistema vaginal, dotándolo de nuevo de los mecanismos de refractividad frente a la infección que habían actuado hasta ese momento. Aunque el reto es importante, los datos que empiezan a acumularse indican que ésta puede ser una alternativa terapéutica fiable y efectiva, de fácil administración y sin efectos secundarios notables.
AgradecimientosQueremos agradecer el apoyo financiero a nuestra investigación que se realiza con cargo al proyecto SAF2004-00033 de CICYT y a los contratos CN-05-048 y CN-05-049 con la empresa Mercadona S.A. Rebeca Martín es becaria predoctoral de la FICYT (Principado de Asturias).